酱香大曲是以小麦为原料,粉碎后加水和曲母踩成曲坯,经发酵贮存制成,在酱香型白酒生产过程中起到微生物制剂、复合酶制剂和风味物质载体等作用[1]。受到曲房内位置、温度和水分等差异的影响,形成了3种颜色的高温大曲:黑曲、褐曲和黄曲,这3种大曲不仅仅是颜色不同,更重要的是微生物组成、功能特性也有差异。生产用曲是由这3种大曲按照一定的比例混合使用。
大曲微生物种群结构及功能对白酒品质有重要影响,因此受到广泛的关注。柳习月等[2]利用多组学解析酱香型大曲风味物质的形成,发现不同曲种间菌群结构及代谢物差异显著,微生物、酶和代谢产物之间存在相关性,其中糖化酶和蛋白酶为芽孢杆菌合成四甲基吡嗪的重要驱动因素。SHI等[3]通过比较不同类型大曲的酶活性、挥发性代谢物和菌群特征,结果发现不同类型大曲在菌系、酶系和物系上存在显著差异,酱香型大曲的4个细菌属(Kroppenstedtia、Virgibacillus、Scopulibacillus和Staphylococcus)和2个真菌属(Thermoascus和Aspergillus)与几乎所有挥发性风味物质呈正相关。不同颜色大曲质量存在差异,唐佳代等[4]对3种不同颜色酱香型大曲的微生物群落与理化指标进行比较,发现造成其真菌群落结构差异的主要是Saccharomyces、Thermoascus、Byssochlamys和若干丰度较低的菌属;DENG等[5]通过比较4种颜色的大曲理化性质及微生物组成,发现4种不同颜色的大曲样品在微生物组成、理化性质、酶学性质以及潜在功能方面存在差异,黑曲和红曲的群落结构较为相似。大量研究表明不同颜色的酱香型大曲在微生物区系、理化性质、酶学特征及代谢上都表现出不同的差异。因此,用不同的颜色来阐明酱香型大曲的潜在功能,将有利于酱香型大曲生产标准化。本研究通过比较不同颜色酱香型大曲微生物群落结构与功能、挥发性风味物质组成及主要酶活力的差异,多维度地评估不同颜色大曲质量与特点,为建立更加科学的酱香型大曲质量评价标准提供理论参考。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
3种颜色的高温大曲样品取自四川遂宁某酒厂拆仓曲。取曲房底层表面黑色大曲、中层表面褐色大曲和上层表面黄色大曲各3块,总计9个样品,分别单独粉碎制样。根据大曲外观颜色的不同,分别标记为黄曲(Y)、褐曲(BR)和黑曲(BL)。取样后,将大曲样品分为2份,一份立即进行酶活力和理化指标的测定,一份用液氮处理后于-80 ℃保藏用于微生物组成检验。
1.1.2 试剂
氢氧化钠、邻苯二甲酸氢钾、葡萄糖(均为分析纯),成都市科龙化工试剂厂;乙二胺四乙酸二钠、蜗牛酶、溶菌酶、十六烷基三甲基溴化铵、十二烷基硫酸钠,生工生物工程(上海)股份有限公司;Tris-平衡酚(pH>7.8),上海博威生物医药有限公司;三氯甲烷、硫酸、盐酸、冰醋酸(均为分析纯),成都市科隆化学品有限公司;乙酸正戊酯,Adamas试剂有限公司。
1.2 仪器与设备
ST2100 pH计,奥豪斯仪器有限公司;LYNX6000高速冷冻离心机,美国Thermo公司;7890A/5975B气相色谱-质谱联用仪,美国Agilent公司。
1.3 试验方法
1.3.1 大曲质量指标的检测
大曲理化指标及主要酶活力的检测参考QB/T 4257—2011《酿酒大曲通用分析方法》。
1.3.2 大曲总DNA的提取和测序
DNA的提取采用改良的CTAB法[6],使用引物338F/806R(5′-ACTCCTACGGGAGGCAGCA-3′/5′-GGACTACHVGGGTWTCTAAT-3′)对细菌16S rRNA基因的V3-V4高变区进行扩增,ITS5F/ITS1R(5′-GGAAGTAAAAGTCGTAACAAGG-3′/5′-GCTGCGTTC-TTCATCGATGC-3′)对真菌的内部转录间隔区(ITS1)进行扩增。由上海派森诺生物科技有限公司在Illumina MiSeq 2500平台上进行双端测序。
1.3.3 大曲挥发性风味物质的测定
挥发性化合物的测定使用了改良的MA等[7]的方法。具体操作如下:采用顶空固相微萃取法(headspace solid-phase microextraction method,HS-SPME)进行香气成分的富集。称取3 g大曲样品于15 mL顶空瓶中,加入3 mL生理盐水和20 μL的乙酸正戊酯(内标),70 ℃条件下平衡15 min,50/30 μm DVB/CAR/PDMS纤维萃取头顶空吸附50 min,进样,250 ℃下解析3.5 min;DB-WAX 毛细管色谱柱(60 m×0.25 mm×0.25 μm)。升温程序为:起始温度为40 ℃,保持1 min后以5 ℃/min的速度升温升至180 ℃保持5 min,再以8 ℃/min的速度升温至230 ℃,保持10 min,载气为He,流速为1 mL/min,分流方式为不分流;离子化方式为电子电离源,质谱电子能量为70 eV,离子源温度为200 ℃,灯丝流量为0.25 mA,检测器电压为350 V,扫描范围为33~450 AMU。
1.4 数据处理
利用IBM SPSS Statistics 26.0进行单因素方差分析(analysis of variance,ANOVA)和Duncan检验计算样品间的显著性(P<0.05);采用派森诺云平台(https://www.genescloud.cn/)对原始序列进行处理[8]及其在线工具进行物种组成分析、线性判别分析(linear discriminant analysis,LEfSe)、相关性分析、微生物功能预测;使用SIMCA-P 14软件建立偏最小二乘-判别分析(partial least squares-discriiminate analysis,PLS-DA)模型筛选差异挥发性风味化合物;Origin 2022b用于风味物质主成分分析分析。
2 结果与分析
2.1 不同颜色大曲微生物多样性和群落组成
为评价不同颜色大曲样品微生物群的差异,采用高通量测序技术对不同颜色大曲中的微生物进行分析,在3种酱香型大曲样品中,共发现细菌有效序列986 218个(平均每个样品有109 580个细菌序列),真菌有效序列930 818个(平均每个样品有103 424个真菌序列)。微生物的α-多样分析结果见图1-a,图1-d,以Chao 1指数表征丰富度,以Shannon指数表征多样性。结果表明,样品中细菌的物种丰富度和多样性均高于真菌,因此真菌对高温比细菌更敏感[9];细菌群落丰富度和多样性的大小顺序一致,为:黄曲>褐曲>黑曲;真菌群落与细菌群落丰富度和多样性的大小顺序相反,为:黑曲>褐曲>黄曲;且不同颜色大曲样品间细菌和真菌多样性差异均不显著(P>0.05)。
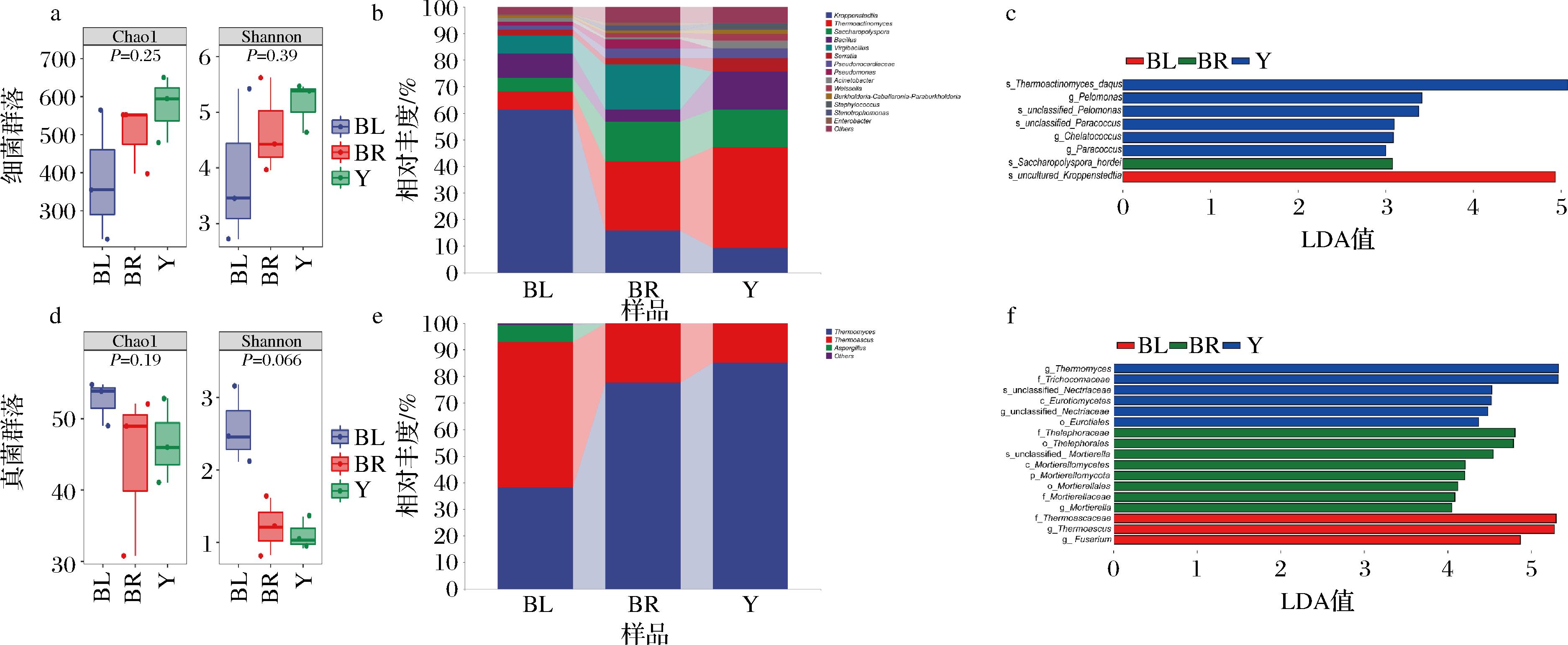
a-细菌α-多样性;b-细菌属水平群落结构;c-细菌LDA判别柱形图;d-真菌α-多样性;e-真菌属水平群落结构;f-真菌LDA判别柱形图
图1 不同颜色大曲微生物多样性和群落组成
Fig.1 Microbial diversity and community composition of Daqu with different colors
所有大曲样品中共检测到396个细菌属和61个真菌属,真菌物种种类少于细菌。根据平均相对丰度,将样品中丰度<1%的物种归为一类(others)。由图1-b可知,不同颜色大曲的细菌群落主要由克罗彭斯特菌属(Kroppenstedtia)、高温放线菌属(Thermoactinomyces)、糖多孢菌属(Saccharopolyspora)和芽孢杆菌属(Bacillus)组成。黑曲的细菌群落以克罗彭斯特菌属占绝对优势,占比为61.28%,远高于其他2种颜色大曲。高温放线菌属和糖多孢菌属在褐曲和黄曲中的相对丰度远高于黑曲,且高温放线菌属是褐曲和黄曲中的第一优势菌属。芽孢杆菌属在黄曲中的占比最高为14.24%,而在褐曲中的占比最低为4.57%;芽孢杆菌属被证实是酱香型白酒生产中主要的功能性细菌,可产生多种风味化合物[10-11]。枝芽孢杆菌属(Virgibacillus)在黑曲和褐曲中的占比分别为6.94%和16.84%,而在黄曲中的占比不到1%,范培文等[12]发现其与正丙醇的产量呈正相关。由图1-e可知,不同大曲真菌群落主要由嗜热真菌属(Thermomyces)、嗜热子囊菌属(Thermoascus)和曲霉属(Aspergillus)组成。嗜热子囊菌属和嗜热真菌属在不同颜色大曲中的相对丰度较高,分别为黑曲的第一优势真菌属和第二优势真菌属,而在褐曲和黄曲中恰与黑曲相反,分别为黄曲和褐曲的第二优势真菌属和第一优势真菌属;曲霉属在黑曲中的相对丰度为6.40%,而在褐曲和黄曲中的相对丰度不到1%,曲霉属在酱香型白酒发酵过程有利于提高酒曲的液化力、发酵力和酯化力[4]。
为进一步分析不同颜色大曲微生物的差异,采用LEfSe分析方法以鉴定3种颜色大曲的潜在生物标志物,如图1-c、图1-f所示。从不同颜色大曲中共检出3个细菌属和5个真菌属,黄曲的生物标志物为嗜糖假单胞菌属、副球菌属和螯台球菌属、unclassified_Nectriaceae和嗜热真菌属,且副球菌属仅存在于黄曲中,ZHANG等[13]研究证明副球菌属是酱香型大曲成熟6个月的生物标志物;褐曲的生物标志物为被孢霉属;黑曲的生物标志物为嗜热子囊菌属和镰刀菌属,且嗜热子囊菌属为黑曲的第一优势微生物。造成不同颜色大曲的微生物群落结构差异的主要是高丰度的嗜热真菌属和嗜热子囊菌属与丰度较低的螯台球菌属、unclassified_Nectriaceae、被孢霉属和镰刀菌属。
2.2 不同颜色大曲微生物功能预测
为了对比不同颜色大曲微生物的功能,利用PICRUSt2对不同颜色微生物群落的基因及其丰度进行预测,并且基于负二项分布模型进行检验,如图2所示。以|lg 2FC|>1且P<0.05为筛选标准,褐曲与黑曲对比,有950个基因丰度显著增加,195个基因丰度显著降低;黄曲与黑曲对比,有1 057个基因丰度显著增加,318个基因丰度显著降低;黄曲与褐曲对比,有57个基因丰度显著增加,247个基因丰度显著降低。
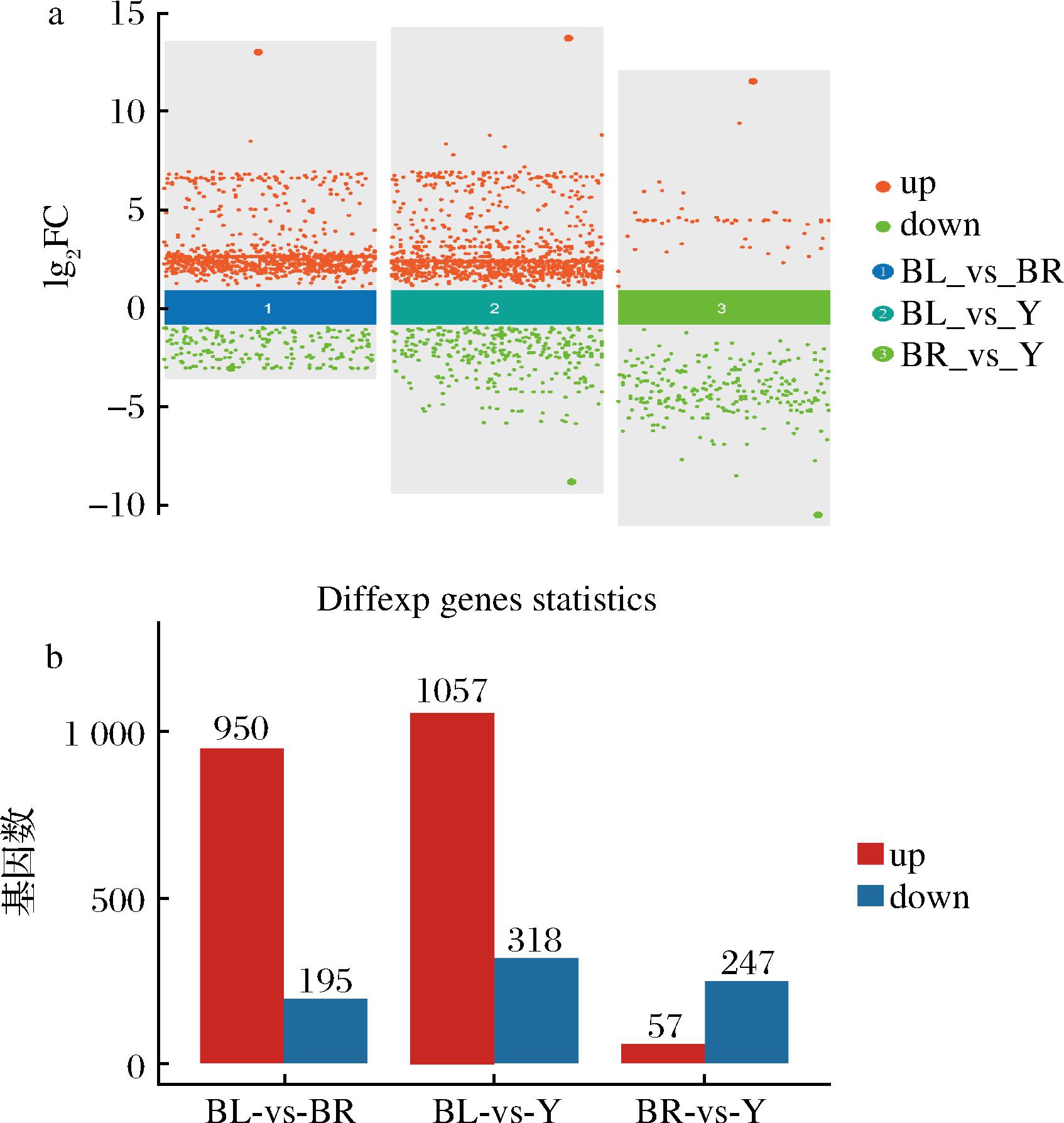
a-火山图;b-柱状图
图2 不同颜色大曲差异基因
Fig.2 Different genes of Daqu with different colors
基于京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)对差异基因进行功能富集,如图3所示。褐曲和黑曲对比,显著增加的基因的富集通路共有21种,主要为果糖和甘露糖代谢、代谢途径、不同环境中的微生物代谢、精氨酸生物合成、半胱氨酸和甲硫氨酸代谢、脂肪酸降解、芳香族化合物的降解和苯丙氨酸代谢等新陈代谢途径;显著下降的基因主要富集在碳水化合物代谢(氨基糖和核苷酸糖代谢、戊糖和葡萄糖醛酸的相互转化和淀粉和蔗糖代谢)、氨基酸代谢(膦酸盐和亚膦酸盐代谢和赖氨酸降解)及核苷酸代谢(嘌呤代谢)。氨基酸代谢和碳水化合物代谢在白酒酿造体系中极为重要,氨基酸不仅本身就是酱香型白酒中风味物质的直接来源且也是酱香型白酒中风味前体物的重要来源[14-15];大曲中含有丰富的淀粉、蔗糖等物质,微生物通过碳水化合物代谢为自身生长提供能量和营养物质,同时为大曲酿造提供重要的风味物质。黄曲与黑曲对比,显著增加的基因的富集的通路共有21种,主要为芳香族化合物的降解、代谢途径、不同环境中的微生物代谢等新陈代谢途径及群体感应,ABISADO等[16]研究称群体感应是导致传统固态发酵具有不同稳态形成的内在因素;显著下降的基因富集通路共有10种,主要为环境信息处理(ABC转运蛋白和双组分系统)。黄曲与褐曲对比,显著增加的基因富集通路共有5种,为肽聚糖生物合成、双组分系统、二甲苯降解、类胡萝卜素生物合成和非核糖体肽结构;显著下降的基因的富集通路共有7种,主要为双组分系统,其基因数为30条。3种颜色的大曲微生物的功能差异主要体现在新陈代谢、细胞过程与环境信息处理,这些大曲微生物群落功能的差异最终影响到大曲微生群落的代谢物的产生。
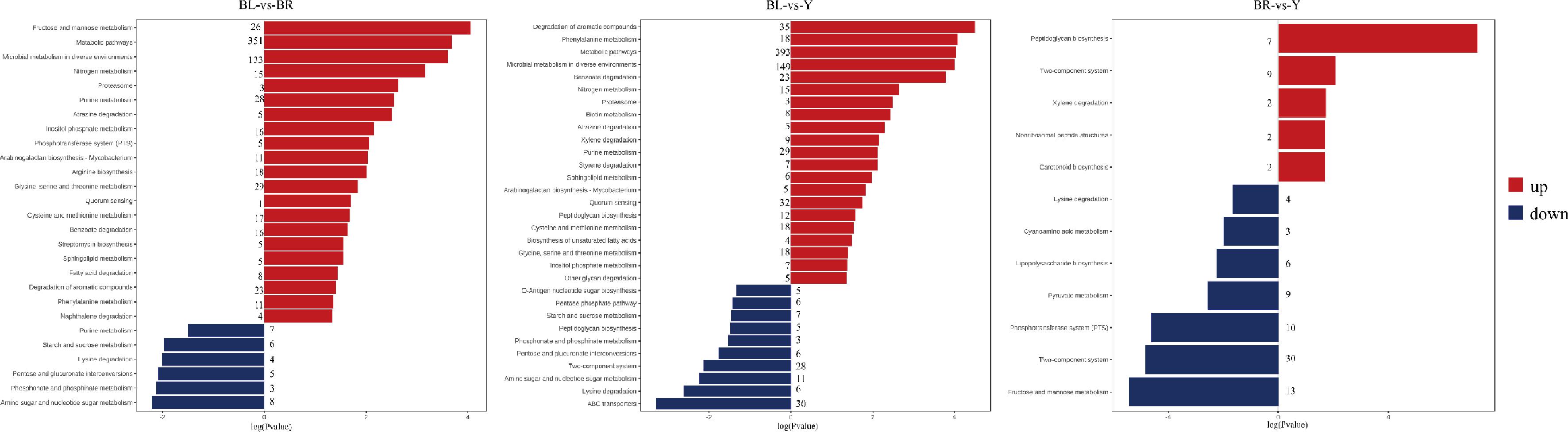
图3 不同颜色大曲显著差异基因KEGG功能富集图
Fig.3 KEGG functional enrichment map of significantly different genes of Daqu with different colors
2.3 不同颜色大曲理化指标及主要酶活力的差异分析
大曲的水分、酸度、还原糖和淀粉等指标在一定程度上能够反映大曲的品质,也是目前大曲质量评价的重要指标[17],而糖化力、液化力和酯化力则反映大曲中的酶系功能[18]。通过单因素方差分析,比较不同颜色大曲的理化指标差异,分析结果如表1所示。
表1 不同颜色大曲质量指标
Table 1 Quality index table of Daqu with different colors
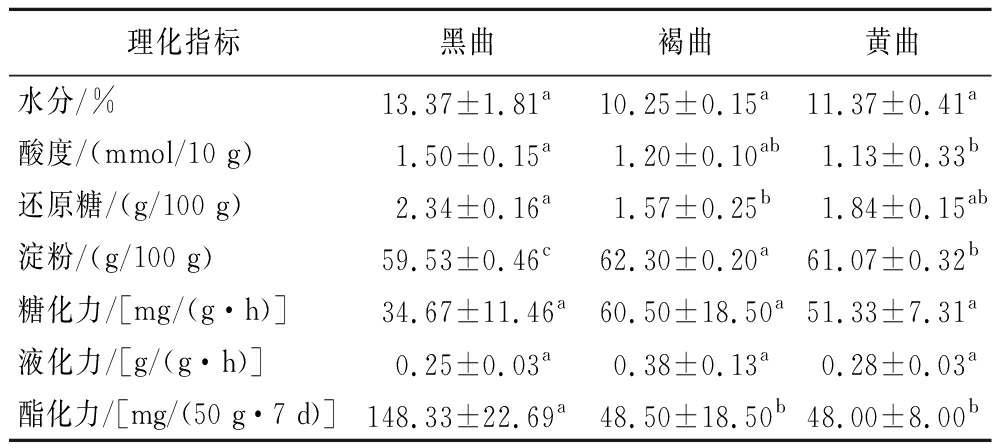
理化指标黑曲褐曲黄曲水分/%13.37±1.81a10.25±0.15a11.37±0.41a酸度/(mmol/10 g)1.50±0.15a1.20±0.10ab1.13±0.33b还原糖/(g/100 g)2.34±0.16a1.57±0.25b1.84±0.15ab淀粉/(g/100 g)59.53±0.46c62.30±0.20a61.07±0.32b糖化力/[mg/(g·h)]34.67±11.46a60.50±18.50a51.33±7.31a液化力/[g/(g·h)]0.25±0.03a0.38±0.13a0.28±0.03a酯化力/[mg/(50 g·7 d)]148.33±22.69a48.50±18.50b48.00±8.00b
注:同行字母不同表示差异显著(P<0.05)。
如表1可知,大曲的水分、糖化力和液化力的含量值在3种颜色大曲之间没有显著性差异,差异主要体现在酸度、还原糖、淀粉和酯化力。黑曲的淀粉含量显著低于其他组,总酸含量却显著高于其他组,可见黑曲样品中的微生物可能将更多的多糖类物质通过糖酵解等途径进一步转化成了酸类物质,从而表现为酸的累积[19]。大曲的重要功能之一是在酿造过程中提供酶。褐曲的糖化酶和液化酶最高,分别是黄曲/黑曲的1.18/1.75和1.36/1.52;有研究表明优质曲的糖化力和液化力突出[20]。黑曲的酯化酶活性显著高于褐曲和黄曲,分别是褐曲/黄曲的3.06/3.09倍。
2.4 不同颜色大曲挥发性风味物质组成及差异分析
为评估不同颜色大曲挥发性风味物质差异,进行了主成分分析研究(图4-a)。发现不同颜色大曲挥发性风味物质共有37种,其中醇类、酯类和吡嗪类物质种类较多,分别为8、5、6种。为进一步探究不同颜色大曲挥发性风味物质的差异,基于3组大曲挥发性风味物质的定量结果建立了PLS-DA 分类模型进行可视化分析,如图4-b所示。以VIP值大于1为标准,确定了3组大曲间有显著差异的挥发性风味物质14种,十六酸乙酯和三甲胺与褐曲落点距离相对较近,在褐曲中相对含量较高,可视为褐曲区别于其他两种颜色大曲代谢组成的特征风味物质;苯酚、邻苯二甲醚、苯乙醇和苯甲醇与黄曲分布在PC1的负轴和PC2的正轴,这些风味物质在黄曲中含量相对较高;可视为黄曲的特征风味物质;苯乙醇和苯甲醇在黄曲中的含量高于褐曲和黑曲,这与王颖等[21]的研究结果一致;乙酸乙酯、2-甲基吡嗪、糠醛、异戊醇、3-辛醇、2,3,5-三甲基吡嗪和乙醇与黑曲分布在PC1的负轴和PC2的负轴,这些风味物质在黑曲中相对含量较高,可视为黑曲的特征风味物质。
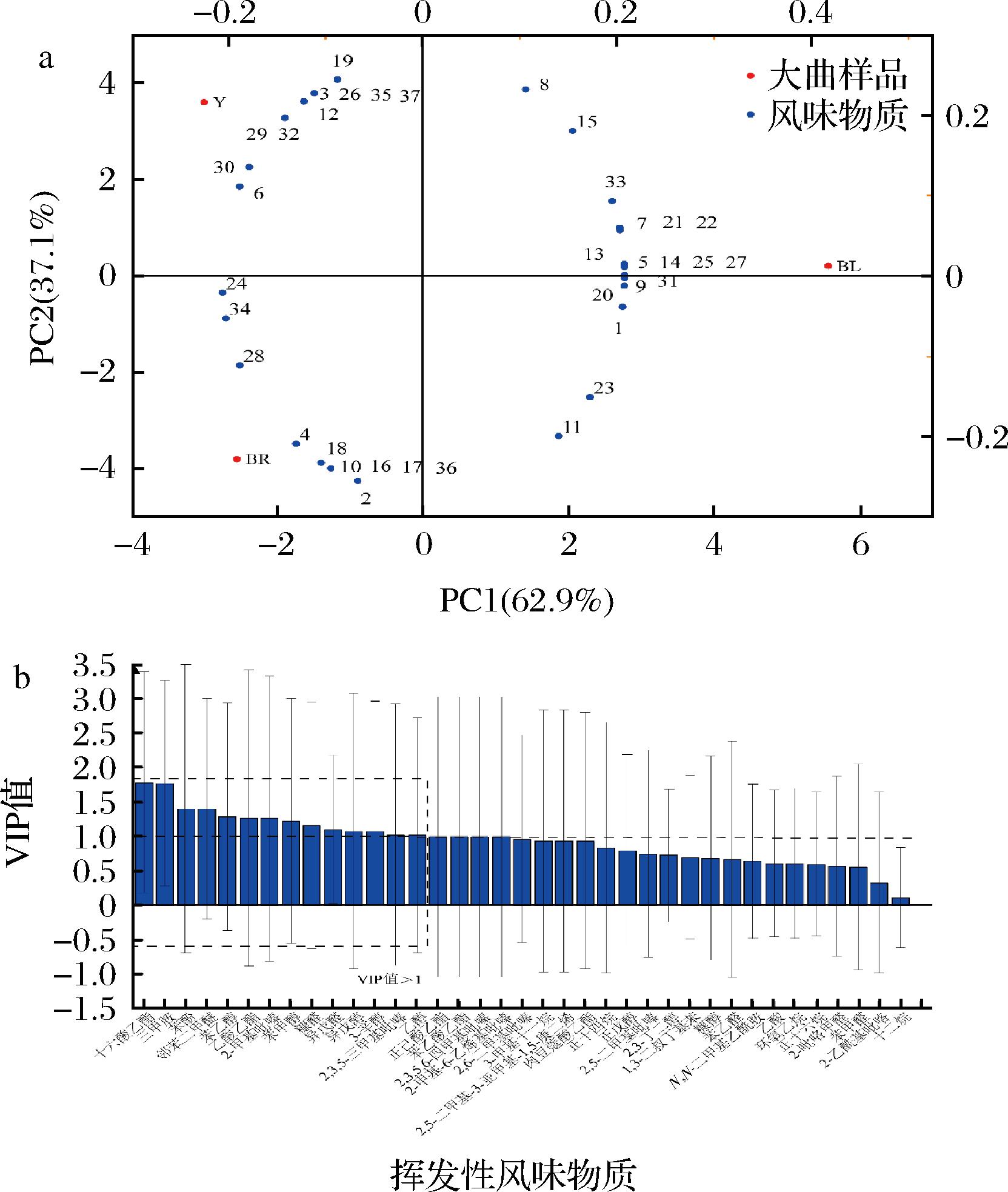
1-乙醇;2-十六酸乙酯;3-肉豆蔻酸乙酯;4-乙酸;5-乙酸乙酯;6-苯乙醇;7-苯甲醛;8-2,3-丁二醇;9-正戊醇;10-正己酸乙酯;11-异戊醛;12-苯甲醇;13-异戊醇;14-2,3,5-三甲基吡嗪;15-2,5-二甲基吡嗪;16-苯乙酸乙酯;17-2,3,5,6-四甲基吡嗪;18-三甲胺;19-糠醇;20-糠醛;21-2,6-二甲基吡嗪;22-苯乙醛;23-2-吡咯甲醛;24-2-乙酰基吡咯;25-2-甲基吡嗪;26-苯酚;27-正十四烷;28-环氧乙烷;29-正十六烷;30-邻苯二甲醚;31-3-辛醇;32-1,3-二叔丁基苯;33-十二烷;34-N,N-二甲基
乙酰胺;35-3-甲基十一烷;36-2-甲基-6-乙烯基吡嗪;37-2,5-二甲基-3-亚甲基-1,5-庚二烯a-主成分分析;b-PLS-DA VIP值
图4 不同颜色大曲挥发性风味物质组成和差异分析
Fig.4 Volatile flavor substances composition and difference analysis of Daqu with different colors
2.5 不同颜色大曲微生物群落与理化性质、主要酶活力及风味物质的关联分析
为了解不同颜色大曲之间的差异,利用冗余分析(redundancy analysis,RDA)解析差异微生物与大曲理化指标之间的相关性,结果如图5-a所示。由图5-a可知,被孢霉属与酯化力呈正相关;嗜热真菌属与淀粉含量、糖化力和液化力成正相关;镰刀菌属、嗜热子囊菌属与水分、总酸、还原糖和酯化力呈正相关,且镰刀菌属和嗜热子囊菌属为黑曲的生物标志物,可知镰刀菌属和嗜热子囊菌属是引起黑曲高酯化力的关键菌群。
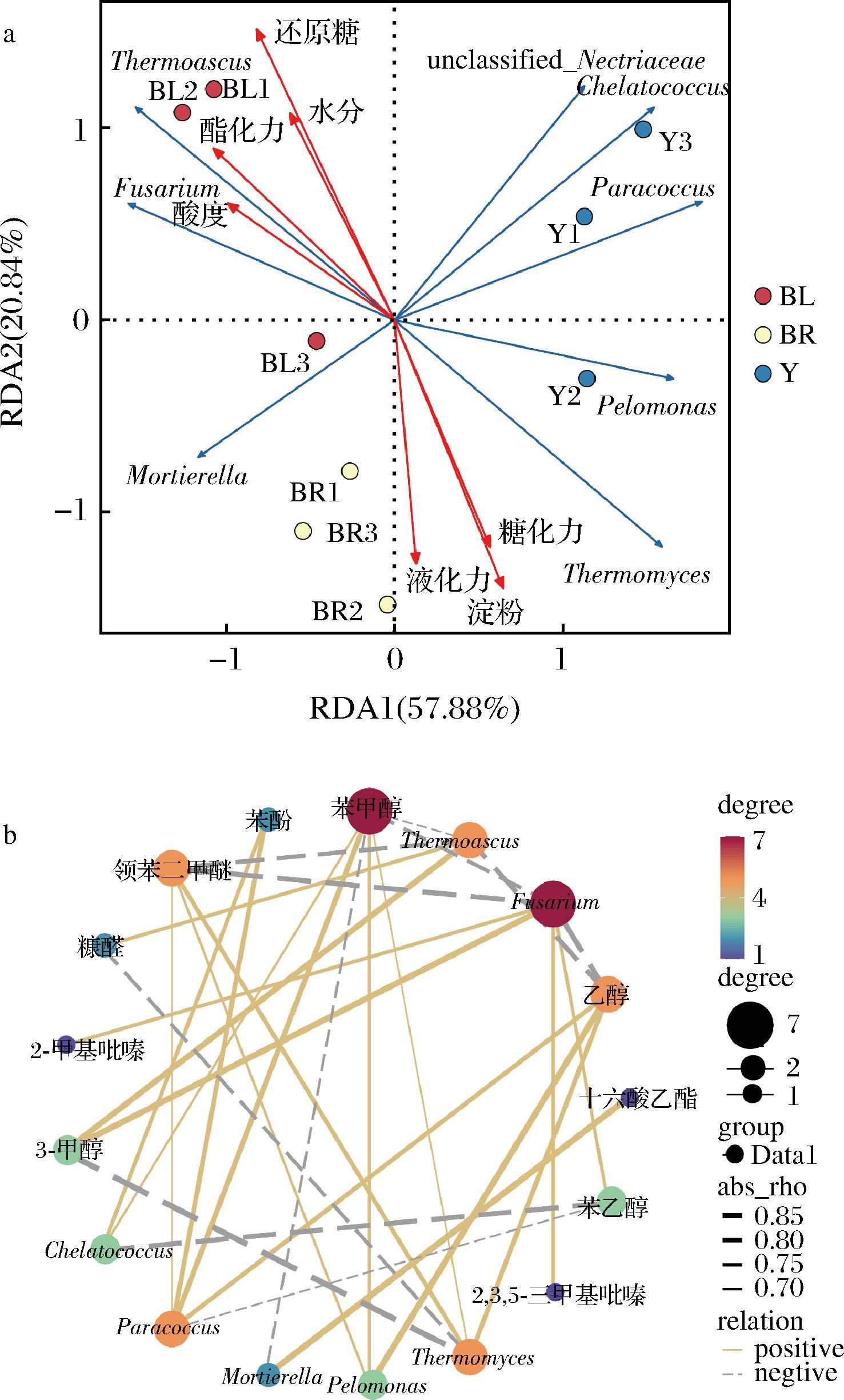
a-RDA图;b-共现网络图
图5 差异微生物与理化指标、主要酶活力及差异挥发性风味物质之间相关性分析
Fig.5 Correlation analysis between differential microorganisms and physicochemical indexes, main enzyme activities and differential volatile flavor substances
利用Cytoscape软件基于Spearman等级相关性(|ρ|>0.5和P<0.05)绘制相关性网络图以评估差异微生物与差异挥发性风味物质的关系。如图5-b所示,嗜糖假单胞菌属与邻苯二甲醚和苯甲醇呈正相关;副球菌属与苯甲醇、苯酚和邻苯二甲醚呈正相关;螯台球菌属与苯甲醇和苯酚呈正相关;可见嗜糖假单胞菌属、副球菌属和螯台球菌属主要影响苯甲醇、苯乙醇、苯酚、邻苯二甲醚的合成。被孢霉属与十六酸乙酯呈正相关,与苯甲醇呈负相关。嗜热子囊菌属与3-辛醇呈正相关,这与柳习月等[2]的研究结果一致;此外,镰刀菌属与3-辛醇、2-甲基吡嗪和2,3,5-三甲基吡嗪呈正相关,而与苯甲醇和邻苯二甲醚呈负相关。
将大曲样品中鉴定出的差异挥发性风味物质进行KEGG富集分析,如图6所示。发现富集途径与功能预测相同的途径有淀粉和蔗糖代谢、苯丙氨酸代谢、果糖和甘露糖代谢、丙酮酸代谢和氨基糖和核苷酸糖代谢。此外,不同颜色大曲代谢产物也存在一定差异,说明代谢途径也存在一定差异。这些基于功能预测和差异风味物质通路富集分析进一步阐明了3种颜色大曲在微生物功能方面的差异,尤其是在碳水化合物代谢和氨基酸代谢。
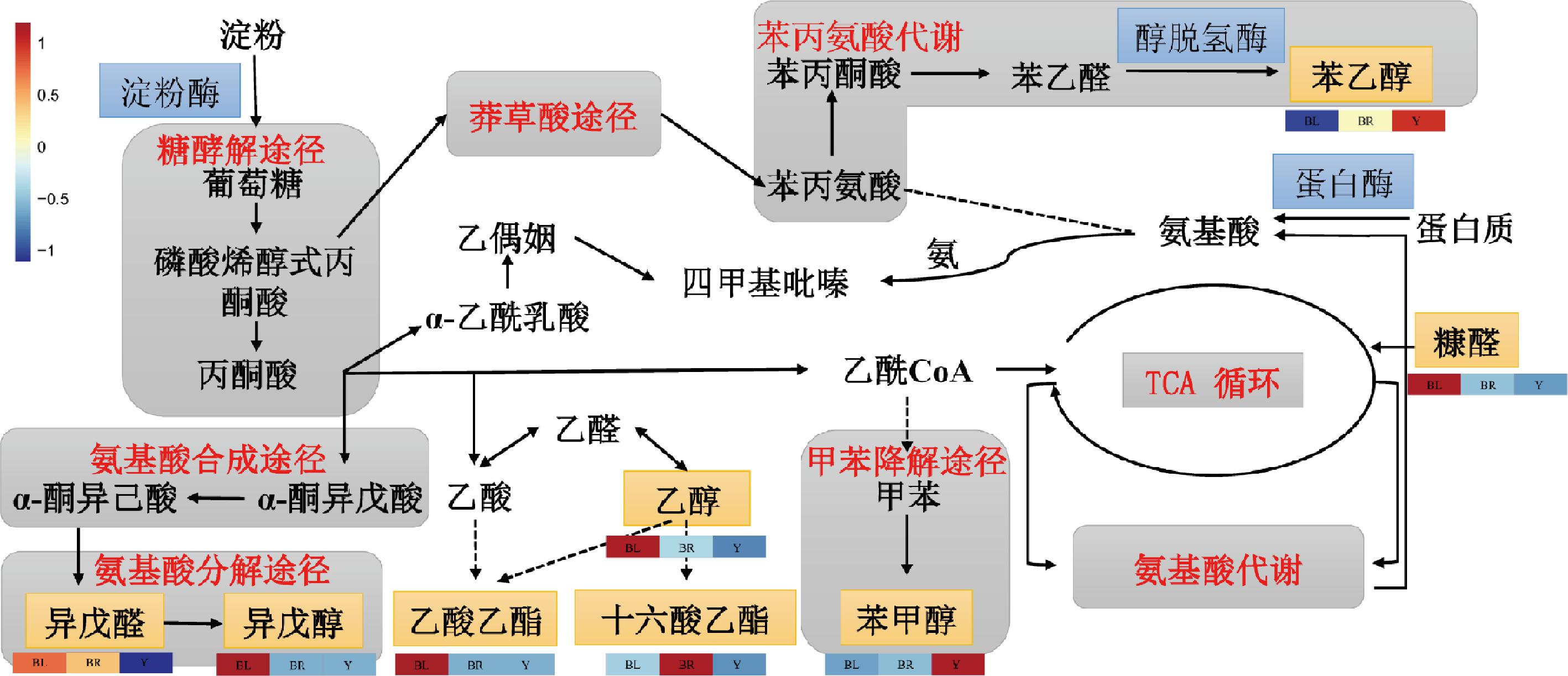
图6 不同颜色大曲微生物通路热图
Fig.6 Microbial pathway heat map of Daqu with different colors
3 结论
通过比较不同颜色的大曲微生物菌群结构与功能、理化指标以及挥发性风味物质,3种不同颜色大曲共有优势细菌属为克罗彭斯特菌属、高温放线菌属、糖多孢菌属、芽孢杆菌属、Pseudonocardiaceae、枝芽孢杆菌属和沙雷菌属,共有优势真菌属为嗜热真菌属和嗜热子囊菌属;黄曲的生物标志物为嗜糖假单胞菌属、副球菌属、螯台球菌属、嗜热真菌属和unclassified_Nectriaceae,褐曲的生物标志物为被孢霉属,黑曲的生物标志物为嗜热子囊菌属和镰刀菌属;发现3种不同颜色酱香型大曲微生物群落功能出现显著差异,褐曲与黑曲对比,共有1 145个差异基因;黄曲与黑曲对比,共有1 372个差异基因;黄曲与褐曲对比,共有304个差异基因。基于功能富集,发现3种颜色的大曲微生物的功能差异主要体现在新陈代谢、细胞过程与环境信息处理,尤其体现在新陈代谢中的碳水化合物代谢和氨基酸代谢。嗜热真菌属与淀粉含量、液化力和酯化力呈正相关,被孢霉属与十六酸乙酯和酯化力呈正相关,嗜热子囊菌属和镰刀菌属与水分、总酸、还原糖、酯化力和3-辛醇呈正相关,且嗜热子囊菌属和镰刀菌属为黑曲的潜在生物标志物,可知镰刀菌属、嗜热子囊菌属是引起黑曲高酯化力的关键菌群;研究结果表明了不同颜色酱香型大曲微生物群落结构与功能、挥发性风味物质组成及主要酶活力的差异,阐明了3种大曲微生物菌群与理化、风味物质的关系,为进一步完善大曲评价指标,建立酱香型大曲质量评价标准提供了理论参考。
[1] 张清玫, 赵鑫锐, 李江华, 等.不同香型白酒大曲微生物群落及其与风味的相关性[J].食品与发酵工业, 2022, 48(10):1-8.
ZHANG Q M, ZHAO X R, LI J H, et al.The relationship between microbial community and flavors of three types of Daqu[J].Food and Fermentation Industries, 2022, 48(10):1-8.
[2] 柳习月, 朱琪, 杨帆, 等.多组学解析酱香型大曲风味物质的形成[J].食品与发酵工业, 2021, 47(22):35-41.
LIU X Y, ZHU Q, YANG F, et al.Multi-omics reveal the formation of flavor compounds in sauce-flavor Daqu[J].Food and Fermentation Industries, 2021, 47(22):35-41.
[3] SHI W, CHAI L J, FANG G Y, et al.Spatial heterogeneity of the microbiome and metabolome profiles of high-temperature Daqu in the same workshop[J].Food Research International, 2022, 156:111298.
[4] 唐佳代, 刘力萍, 龙亚飞, 等.不同感官特性酱香大曲真菌群落结构与理化特性[J].食品科学, 2022, 43(14):193-198.
TANG J D, LIU L P, LONG Y F, et al.Physicochemical characteristics and fungal community structure of different colored Jiang-flavor Daqu[J].Food Science, 2022, 43(14):193-198.
[5] DENG L, MAO X, LIU D, et al.Comparative analysis of physicochemical properties and microbial composition in high-temperature Daqu with different colors[J].Frontiers in Microbiology, 2020, 11:588117.
[6] 夏玙, 罗惠波, 周平, 等.不同处理方式的大曲真菌群落差异分析[J].食品科学, 2018, 39(22):166-172.
XIA Y, LUO H B, ZHOU P, et al.Comparison of fungal communities in Daqu with different treatments[J].Food Science, 2018, 39(22):166-172.
[7] MA S Y, SHANG Z C, CHEN J, et al.Differences in structure, volatile metabolites, and functions of microbial communities in Nongxiangxing Daqu from different production areas[J].LWT, 2022, 166(17):113784.
[8] CALLAHAN B J, MCMURDIE P J, ROSEN M J, et al.DADA2:High-resolution sample inference from Illumina amplicon data[J].Nature Methods, 2016, 13(7):581-583.
[9] CAI W C, WANG Y R, NI H, et al.Diversity of microbiota, microbial functions, and flavor in different types of low-temperature Daqu[J].Food Research International, 2021, 15(9):110734.
[10] WANG Y R, CAI W C, WANG W P, et al.Analysis of microbial diversity and functional differences in different types of high-temperature Daqu[J].Food Science &Nutrition, 2021, 9(2):1003-1016.
[11] GAN S H, YANG F, SAHU S K, et al.Deciphering the composition and functional profile of the microbial communities in Chinese moutai liquor starters[J].Frontiers in Microbiology, 2019, 10:1540.
[12] 范培文, 刘蒲临, 张明春, 等.浓酱兼香型白酒发酵酒醅微生物群落及理化指标对正丙醇产出的影响[J].中国酿造, 2022, 41(7):32-37.
FAN P W, LIU P L, ZHANG M C, et al.Effects of microbial community and physicochemical indexes of fermented grains of strong-sauce-flavor Baijiu on n-propanol production[J].China Brewing, 2022, 41(7):32-37.
[13] ZHANG Y D, XU J G, JIANG Y L, et al.Microbial characteristics and metabolite profiles of high-temperature Daqu in different maturation stages[J].World Journal of Microbiology and Biotechnology, 2022, 38(12):234.
[14] YANG L A, FAN W L, XU Y.GC×GC-TOF/MS and UPLC-Q-TOF/MS based untargeted metabolomics coupled with physicochemical properties to reveal the characteristics of different type Daqu for making soy sauce aroma and flavor type Baijiu[J].LWT-Food Science and Technology, 2021, 146:111416.
[15] YI Z L, JIN Y L, XIAO Y, et al.Unraveling the contribution of high temperature stage to Jiang-flavor Daqu, a liquor starter for production of Chinese Jiang-flavor Baijiu, with special reference to metatranscriptomics[J].Frontiers in Microbiology, 2019, 10:472.
[16] ABISADO R G, BENOMAR S, KLAUS J R, et al.Bacterial quorum sensing and microbial community interactions[J].mBio, 2018, 9(3):e02331-e02317.
[17] 向港兴, 陈莹琪, 沈毅, 等.不同等级浓香型大曲微生物群落结构与理化性质的比较分析[J].食品科学, 2022, 43(18):184-191.
XIANG G X, CHEN Y Q, SHEN Y, et al.Comparative analysis of microbial community structure and physicochemical properties of different grades of Nongxiangxing Daqu[J].Food Science, 2022, 43(18):184-191.
[18] 唐慧芳, 黄钧, 周荣清, 等.场地异质性对中高温大曲微生物群落及品质影响的研究[J].食品与发酵工业, 2023, 49(8):237-244.
TANG H F, HUANG J, ZHOU R Q, et al.Effect of site heterogeneity on microbial community and quality of medium-high temperature Daqu[J].Food and Fermentation Industries, 2023, 49(8):237-244.
[19] 杨阳, 禄凌飞, 刘光钱, 等.不同发酵顶温大曲中细菌群落结构的差异性分析[J].食品与发酵工业, 2023,49(13):70-77.
YANG Y, LU L F, LIU G Q, et al.Difference analysis of bacterial community structure in Daqu with different peak temperatures achieved during fermentation[J/OL].Food and Fermentation Industries, 2023,49(13):70-77.
[20] 何猛超, 任义平, 熊林, 等.茅台地区不同高温大曲微生物群落结构解析[J].中国酿造, 2022, 41(6):51-57.
HE M C, REN Y P, XIONG L, et al.Microbial community structure of different high-temperature Daqu in Maotai area[J].China Brewing, 2022, 41(6):51-57.
[21] 王颖, 邱勇, 王隆, 等.不同产区酱香型高温大曲黑、白、黄曲的理化、挥发性成分差异性分析[J].中国调味品, 2022, 47(6):155-159.
WANG Y, QIU Y, WANG L, et al.Analysis on the differences of physicochemical indexes and volatile components of black, white and yellow koji at high temperature with Maotai flavor in different production areas[J].China Condiment, 2022, 47(6):155-159.