黑果枸杞(Lycium ruthenicum Murr.)系茄科(Solanceae)枸杞属(Lycium L.)植物[1],是西北干旱地区一种特有的多年生灌木野生植物,在我国宁夏贺兰山、青海东西部、新疆北部等地皆有分布,其中尤其以柴达木和塔里木盆地分布最广。黑果枸杞耐干旱,多喜生于盐渍化生境土壤中,可作为水土保持的灌木植物[2]。黑果枸杞富含花青素,被人们称为“花青素之王”。花青素是一类广泛存在于植物中的水溶性天然色素,属于黄酮类化合物,多以糖苷的形式存在而成为花色苷[3]。花青素作为一种天然食用色素,安全、无毒、资源丰富,是迄今为止所发现的最强效的自由基清除剂,近年来越来越备受人们的关注[4-5]。
目前,有研究者进行黑果枸杞花青素的提取条件优化[6-7],但考察优化条件中未涉及到提取溶剂中溶剂种类和体系、溶剂中盐酸体积占比,另pH示差法检测显色过程中缓冲溶液稀释倍数的考察也未见文献报道。通常采用液质联用法、高效液相色谱法和pH示差法检测黑果枸杞中花青素含量[8-9],其中采用pH示差法检测花青素时,有研究者用矢车菊素-3-O-葡萄糖苷、飞燕草素、儿茶素、平均花青素等计算,然而黑果枸杞中不含有矢车菊素-3-O-葡萄糖苷,飞燕草素也仅占1.34%,儿茶素多用于原花青素测定,以平均花青素计只能得到大概含量,实际上黑果枸杞中主要含矮牵牛素类花青素[10]。此外,有研究采用pH示差法检测野生黑果枸杞饮料中花青素的含量[11],但以矮牵牛素-3-O-葡萄糖苷作为标准物质通过外标法定量,而该成分并非是矮牵牛素类花青素的主要组成成分。针对以上问题,本文以青海特有的植物源性食品黑果枸杞及其制品为研究对象,对《AOAC官方方法 2005.02果汁、饮料、天然着色剂及酒中总花色苷含量的测定 pH示差法》(AOAC:Association of Official Analytical Chemists,美国官方分析化学师协会)中提取溶剂、提取过程、检测显色过程和数据处理分别进行了改进,通过液质联用法鉴别出黑果枸杞中花青素的具体化学结构,并计算出混合花青素的平均摩尔质量。通过分光光度法测得混合花青素的平均摩尔消光系数,并对改进后的pH示差法进行方法学验证和青海境内不同产地黑果枸杞及其制品中花青素的含量测定,该法能真实地反映黑果枸杞及其制品中花青素的含量,从而为青海特色植物源性食品黑果枸杞的质量控制提供数据支撑。
1 材料与方法
1.1 材料与试剂
黑果枸杞采自青海省境内6个产区21个不同地点,每个地点均采集3批,共63批,详见表1。样品预处理:将采集的黑果枸杞鲜果样品阴干,用四分法取适量或取全部,除去果、柄以外肉眼可见的黑果枸杞枝、叶、碎果、小石子、土颗粒等杂质后,取有代表性试样50 g,临用前用食物粉碎机粉碎后,过40目筛,装入黑色密封袋中密封,混匀后立即用于检测。若暂存时间不超过1 h,并置于干燥器中避光保存备用。
表1 采自青海省境内6个产区21个不同地点的黑果枸杞样品(n=3)
Table 1 The samples of Lycium ruthenicum Murr.collected from twenty-one different locations of six different producing areas in Qinghai (n=3)

样品编号样品来源样品编号样品来源样品编号样品来源样品编号样品来源HG-1天峻县江河镇莫合拉HG-7都兰县巴隆乡布洛格村铁丝盖HG-13格尔木市河东农场十一连HG-19德令哈市克鲁克基地HG-2天峻县龙门乡HG-8都兰县宗加镇诺木洪乡HG-14格尔木市乌图美人乡小灶火幸福村HG-20德令哈市怀头塔拉镇东滩二队HG-3乌兰县柯柯镇纳木哈村HG-9都兰县香日德镇香乐村HG-15格尔木市园艺场HG-21德令哈市怀头塔拉镇五队HG-4乌兰县希里沟镇西庄村HG-10格尔木市大格勒镇龙羊村HG-16大柴旦大柴旦镇HG-5乌兰县柯柯镇东村HG-11格尔木市大格勒镇菊花村HG-17大柴旦鱼卡乡HG-6都兰县香日德镇小夏滩村HG-12格尔木市河东农场八连HG-18德令哈市柯鲁柯镇平原村塔湾克里
黑果枸杞制品:黑果枸杞片、提取物、冻干粉、胶囊、饮料、酒等6种黑果枸杞制品均为西宁市售产品,各购买3批,共18批,详见表2。黑果枸杞片、提取物、冻干粉、胶囊均在室温避光条件下置于干燥器中保存,其中,黑果枸杞片用四分法取适量或取全部,取有代表性试样25 g,临用前用玻璃研钵粉碎研磨混匀后,装入黑色密封袋中密封立即用于检测;黑果枸杞饮料、酒在室温避光条件下保存,临用前再开封。
表2 西宁市售的6种黑果枸杞制品(n=3)
Table 2 Six types of Lycium ruthenicum Murr.products sold in Xining (n=3)
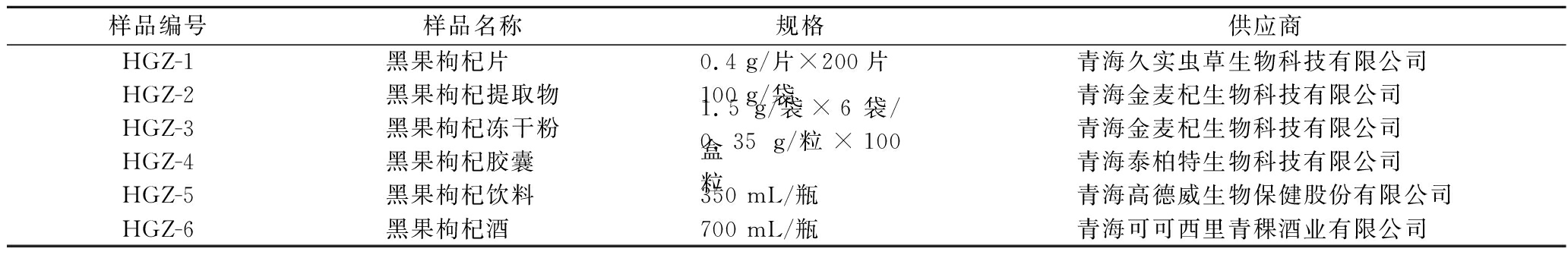
样品编号样品名称规格供应商HGZ-1黑果枸杞片 0.4 g/片×200片青海久实虫草生物科技有限公司 HGZ-2黑果枸杞提取物100 g/袋青海金麦杞生物科技有限公司 HGZ-3黑果枸杞冻干粉1.5 g/袋×6袋/盒青海金麦杞生物科技有限公司 HGZ-4黑果枸杞胶囊 0.35 g/粒×100粒青海泰柏特生物科技有限公司 HGZ-5黑果枸杞饮料 350 mL/瓶青海高德威生物保健股份有限公司HGZ-6黑果枸杞酒 700 mL/瓶青海可可西里青稞酒业有限公司
氯化矮牵牛素-3-O-芸香糖苷(反-对香豆酰)-5-O-葡萄糖苷(纯度≥98%),武汉科斯坦生物科技有限公司;氯化矮牵牛素-3,5-二氧葡萄糖苷(纯度≥95%),成都瑞芬思德丹生物科技有限公司;氯化钾、结晶乙酸钠、无水乙醇(均为分析纯),天津百世化工有限公司;浓盐酸(分析纯),甘肃白银瑞斯物资贸易有限公司;甲酸、乙腈、无水乙醇、甲醇(均为色谱纯),山东禹王实业有限公司化工分公司;实验用水为去离子水。
1.2 仪器与设备
Agilent 1260 Infinity Ⅱ- 6470 液相色谱-三重四级杆串联质谱仪,美国安捷伦科技公司;UV-1780紫外-可见分光光度仪,日本岛津公司;KQ5200B超声波清洗器,昆山市超声仪器有限公司;pHS-3E pH计,上海仪电科学仪器股份有限公司;PL203、MS205DU电子天平,瑞士Mettler Toledo公司;TGL-16C高速台式离心机,上海安亭科学仪器厂;TYSP-100高速多功能粉碎机,浙江永康市红太阳机电有限公司。
1.3 实验方法
1.3.1 pH示差法最佳提取和检测条件的考察
在《AOAC 官方方法2005.02果汁、饮料、天然着色剂及酒中总花色苷含量的测定 pH示差法》基础上做了改进,考察了提取溶剂(溶剂种类和体系、溶剂体积分数、溶剂中盐酸体积占比)、料液比、超声提取温度、超声提取时间、缓冲溶液的稀释倍数、静置平衡时间几个因素。以都兰县宗加镇诺木洪乡产黑果枸杞为例,称取已处理黑果枸杞干果粉末0.5 g,置于150 mL具塞磨口锥形瓶中,按料液比(g∶mL)为1∶25、1∶50、1∶100、1∶150、1∶200准确加入提取溶剂[a)盐酸-水(3∶97, 体积比,下同)、盐酸-体积分数分别为100%、75%、50%、25%的甲醇溶液(3∶97)、盐酸-体积分数分别为100%、75%、50%、25%的乙醇溶液(3∶97);b)盐酸-体积分数分别为100%、95%、90%、85%、80%、75%、70%、60%的乙醇溶液(3∶97);c)盐酸-80%乙醇溶液(0.05∶99.95, 0.1∶99.9, 0.5∶99.5, 1∶99, 2∶98, 3∶97, 4∶96, 5∶95)],于30、40、50、60、70、80 ℃超声提取5、10、20、30、40 min。离心取上层花青素提取母液继续加入原提取溶剂稀释4倍后,再用缓冲溶液稀释2、3、4、5、6倍,制备2份供试品检测溶液,其中1份用氯化钾缓冲溶液(0.025 mol/L, pH 1.0)稀释,另1份用乙酸钠缓冲溶液(0.4 mol/L, pH 4.5)稀释。静置平衡5、7、10、15、20、25、30、40、50、60、70、80 min后,用1 cm厚比色皿在528 nm处分别测定用pH 1.0缓冲溶液稀释的供试品检测溶液和用pH 4.5缓冲溶液稀释的供试品检测溶液的吸光度值各一次,同理在700 nm处各测定一次,按公式(1)计算花青素的含量:
(1)
式中:w,黑果枸杞及其制品中花青素的含量,g/100 g;A,分别在pH 1.0与pH 4.5条件下测定供试品检测溶液在2个波长下的吸光度差值,按A=(Amax-A700nm)pH 1.0条件下-(Amax-A700nm)pH 4.5条件下计算;M混,混合花青素的平均摩尔质量,g/mol;DF,稀释因子;V,提取液总体积,![]() 混合花青素的平均摩尔消光系数,L/(mol·cm);l,比色皿厚度,cm;m,称取试样的质量,g;10,由g/kg换算为g/100 g的转换因子。
混合花青素的平均摩尔消光系数,L/(mol·cm);l,比色皿厚度,cm;m,称取试样的质量,g;10,由g/kg换算为g/100 g的转换因子。
在初步单因素实验的基础上,进行单因素循环时试样以料液比(g∶mL)1∶100加入提取溶剂盐酸-80%乙醇溶液(3∶97),在50 ℃条件下提取30 min后制得提取母液。用原提取溶剂将提物母液稀释4倍后,再用缓冲溶液稀释5倍,静置平衡20 min作为最初拟定的最佳实验操作步骤,即在考察其中一个实验条件时,严格遵照该拟定的其他最佳实验操作步骤。在实际操作中,各单因素相互之间并非无关联,而是相互交叉影响的。为全面考察影响因素,选取对花青素含量影响大的关键因素,在单因素试验的基础上设计了正交试验,以确定最佳的黑果枸杞中花青素提取、检测条件。
1.3.2 黑果枸杞中花青素化学结构鉴别
采用液相色谱-三重四级杆串联质谱法,根据紫外-可见最大吸收波长、水解前后母离子峰(M-/M+)和子离子峰碎片(MS/MS)的质荷比值(m/z),鉴别出黑果枸杞中各花青素的具体化学结构。
1.3.2.1 液相色谱条件
Agilent Eclipse Plus C18 Rapid Resolution HD柱(1.8 μm, 50 × 2.1 mm),流动相:A:1%甲酸-乙腈溶液,B:1%甲酸-水溶液(0~15 min,5% A~20% A;15~20 min,维持20% A不变;20~30 min,20% A~60% A;30~35 min,维持60% A不变;35~40 min,60% A~5% A;40~58 min,维持5% A不变),流速:0.20 mL/min,检测波长:530 nm,柱温:35 ℃,进样量:1 μL。
1.3.2.2 质谱条件
电喷雾电离源,正、负离子方式检测;离子源温度:450 ℃,碰撞气:氮气,流量:0.2 mL/min;雾化气:氮气,喷雾压力:20 p.s.i;干燥气:氮气,温度:325 ℃,流量:10.0 L/min;鞘气:氮气,温度:400 ℃,流量:11.0 L/min;质荷比扫描范围:100 ~ 1 500 m/z;毛细管电压:4 000 V(正离子)、2 500 V(负离子);扫描方式:MS2。
1.3.3 黑果枸杞混合花青素平均摩尔质量的确定
采用液相色谱-三重四级杆串联质谱法,根据试样中各花青素在总花青素中物质的量占比(Nx%)和各自摩尔质量(Mx),按照公式(2)求得黑果枸杞中混合花青素的平均摩尔质量(M混):
M混/(g/mol)=Ma×Na%+Mb×Nb%+Mc×Nc%+…+Mn×Nn%
(2)
1.3.4 黑果枸杞混合花青素平均摩尔消光系数的确定
按黑果枸杞中主要含有的花青素标准物质在总花青素中的物质的量占比配制成浓度为1 mol/L的混合花青素标准储备溶液。各取2份3 mL该标准储备溶液用盐酸-80%乙醇溶液(3∶97)稀释定容至50 mL后分别加氯化钾缓冲溶液(0.025 mol/L, pH 1.0)和乙酸钠缓冲溶液(0.4 mol/L, pH 4.5)再次稀释5倍后分别配制成pH 1.0和pH 4.5的花青素检测溶液,用1 cm厚比色皿分别在λmax (nm)和700 nm处均测定2个不同pH值的花青素检测溶液,测得4个吸光度值依据公式(3)求得黑果枸杞中混合花青素的平均摩尔消光系数:
(3)
式中:![]() 混合花青素的平均摩尔消光系数,L/(mol·cm);A,分别在pH 1.0与pH 4.5条件下测定供试品检测溶液在2个波长下的吸光度差值,按A=(Amax-A700nm)pH 1.0条件下-(Amax-A700nm)pH 4.5条件下计算;c,花青素检测溶液的摩尔浓度,mol/L;l,比色皿厚度,cm。
混合花青素的平均摩尔消光系数,L/(mol·cm);A,分别在pH 1.0与pH 4.5条件下测定供试品检测溶液在2个波长下的吸光度差值,按A=(Amax-A700nm)pH 1.0条件下-(Amax-A700nm)pH 4.5条件下计算;c,花青素检测溶液的摩尔浓度,mol/L;l,比色皿厚度,cm。
1.3.5 方法学验证实验
为保证方法改进后检测结果准确、可靠,对该法的准确性、科学性和可行性进行验证,以证明分析方法符合花青素检测的目的和要求。考察了改进pH示差法的专属性、线性关系、精密度、稳定性、重复性、加样回收率、定量限、检出限并选取黑果枸杞干果及其制品黑果枸杞片、黑果枸杞冻干粉、黑果枸杞酒共4种样品,同时送检至其他3家实验室进行实验室间比对验证实验,以验证方法再现性。将不同实验室之间的检测结果进行比较,以证明改进后pH示差法测定黑果枸杞及其制品中花青素的准确性。
1.3.6 黑果枸杞及其制品中花青素的含量测定
称取一定量已处理试样(干果、冻干粉、片剂、胶囊内容物粉末0.5 g,鲜果匀浆5.0 g,准确至±0.001 g;提取物粉末0.1 g,准确至±0.000 1 g),置于150 mL具塞磨口锥形瓶中,准确加入50 mL盐酸-80%乙醇溶液(3∶97)于50 ℃超声提取30 min,每隔10 min振摇1次,保持固相完全分散。冷却至室温后用提取溶剂补足减失的质量,以8 000 r/min离心3 min,取上清液即得花青素提取母液。将花青素提取母液继续加入原提取溶剂稀释4倍,再用缓冲溶液稀释5倍,制备2份供试品检测溶液,其中一份用氯化钾缓冲溶液(0.025 mol/L, pH 1.0)稀释(1 mL供试品溶液+4 mL氯化钾缓冲溶液),另一份用乙酸钠缓冲溶液(0.4 mol/L, pH 4.5)稀释(1 mL供试品溶液+4 mL醋酸钠缓冲溶液)。静置平衡20 min后,用1 cm厚比色皿在(530±2) nm[不同样品的花青素最大检测波长参考值如下:黑果枸杞干果、饮料(528 nm)、黑果枸杞鲜果(529 nm)、黑果枸杞提取物、胶囊、酒(530 nm)、黑果枸杞冻干粉(531 nm)、黑果枸杞片(532 nm)]波长处分别测定用pH 1.0缓冲溶液稀释的供试品检测溶液和用pH 4.5缓冲溶液稀释的供试品检测溶液的吸光度值各一次,同理在700 nm处各测定一次,按1.3.1节公式(1)计算花青素的含量。
2 结果与分析
2.1 最佳提取和检测条件的考察结果
2.1.1 单因素循环实验
2.1.1.1 提取溶剂研究
花青素的化学结构中含有多个羟基,用常用大极性试剂水、甲醇、乙醇进行提取。从图1-a可以看出花青素提取能力:乙醇>甲醇>水。从图1-b可知,在不同体积分数的乙醇溶液中,80%乙醇提取花青素效果更佳。从图1-c可知,盐酸-80%乙醇体积比为4∶96时花青素含量最高、其次体积比为5∶95,但在这2个体积比时比色溶液均不澄清,呈微混浊状态,还需进一步离心除去悬浮物使溶液澄清,增加了实验操作步骤,费时费力,而盐酸-80%乙醇体积比为3∶97时比色溶液澄清无混浊现象,花青素含量虽然并非最高,但与体积比为4∶96和5∶95结果之间无显著性差异(P>0.05),故选择提取溶剂为盐酸-80%乙醇体积比为3∶97。
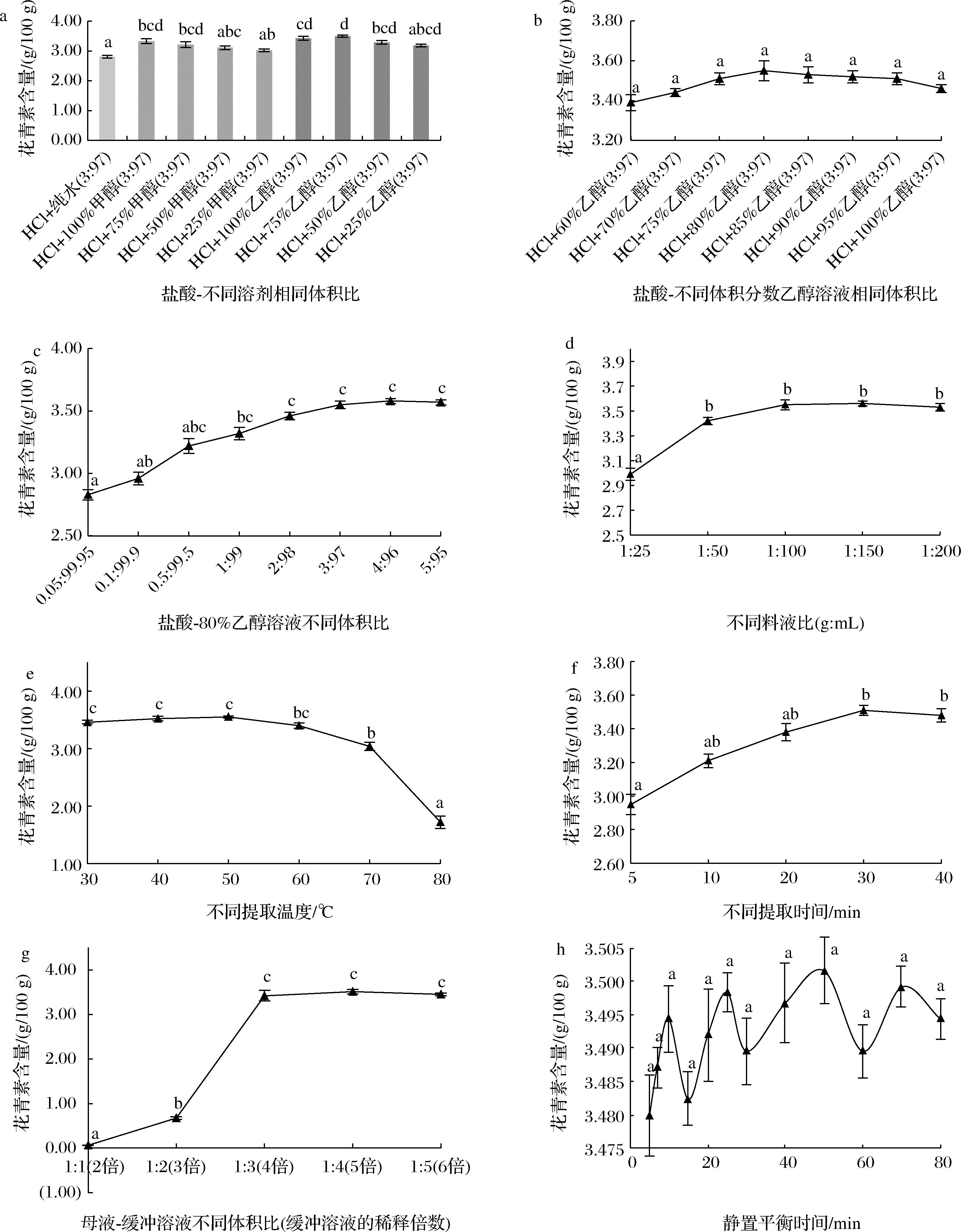
a-盐酸-不同溶剂相同体积比;b-盐酸-不同体积分数乙醇溶液相同体积比;c-盐酸-80%乙醇溶液不同体积比;d-料液比;e-提取温度;f-提取时间;g-缓冲溶液稀释倍数;h-静置平衡时间
图1 不同因素对黑果枸杞花青素含量的影响
Fig.1 Effect of different factors on the anthocyanidins contents of Lycium ruthenicum Murr.
注:不同小写字母表示不同条件下同一样品之间差异显著(P<0.05)。
2.1.1.2 提取过程研究
从图1-d可知,花青素含量随着料液比的增加先逐渐增加后趋于平稳但略有下降,在料液比(g∶mL)为1∶150时花青素含量高。料液比(g∶mL)为1∶100时花青素含量虽然并非最高,但与料液比(g∶mL)1∶150和1∶200结果之间无显著性差异(P>0.05),同时从经济效益考虑,为节省更多的化学溶剂故选择料液比(g∶mL)为1∶100。从图1-e可知,花青素含量随着提取温度的增加先逐渐增加,在提取温度为50 ℃时花青素含量高;至60 ℃时花青素含量趋于相对平稳但开始下降,超过60 ℃时花青素含量下降明显,至80 ℃时花青素含量急剧下降,与50 ℃时相比存在显著性差异(P<0.05),可见黑果枸杞花青素在提取温度超过60 ℃时由于受到较高温度的影响而降解,故选择提取温度为50 ℃。从图1-f可知,花青素含量随着提取时间的延长逐渐增加,至提取时间为30 min时达到最高,此后随着提取时间的进一步延长,黑果枸杞中花青素逐渐减少,传质阻力逐渐下降,提取率增长缓慢不明显,故选择提取时间为30 min。
2.1.1.3 检测显色过程研究
从图1-g可知,花青素含量随着缓冲溶液稀释倍数的增加急剧增加,在稀释2~3倍时由于缓冲溶液体积占比不够,不足以起到稳定提取溶液pH的作用,花青素在不稳定的pH条件下容易从稳定的红色(花烊正离子)转变为无色(甲醇假碱和查尔酮)。至稀释倍数为4~5倍时缓冲溶液体积占比足以使提取溶液pH稳定在pH 1.0,而在pH 1.0时花青素花烊正离子最稳定,在稀释倍数为5倍时,花青素含量达到最高,故选择缓冲溶液稀释倍数为5倍。从图1-h可知,花青素含量随着缓冲溶液的静置平衡时间的延长有一定的波动,静置平衡时间在20 min以内时花青素含量在3.48~3.49 g/100 g内波动,随着静置平衡时间的进一步延长,20 min以后至80 min时花青素含量在3.49~3.50 g/100 g内波动,花青素含量有一定增加,但波动稳定无明显增长。溶液pH不同,花青素的4种化学结构形式便会在某一个pH下处于动态平衡,当加入不同pH缓冲溶液改变pH值时,动态平衡被打破发生转移,结果表明静置平衡20 min后达到一个新的动态平衡,这时可稳定测定吸光度,故选择静置平衡时间为20 min。
2.1.2 正交实验
为全面考察影响因素,选取单因素循环实验中对花青素含量影响大的关键因素,以V(盐酸)∶V(80%乙醇溶液)(A)、料液比(B)、提取温度(C)、提取时间(D)和静置平衡时间(E)作为考察对象,在单因素试验的基础上设计了5因素3水平正交试验,以确定黑果枸杞中花青素含量最高的最佳提取和检测条件。考察的各因素及具体水平见表3,选用L27(35)正交表,正交实验结果见表4。
表3 正交实验因素水平表
Table 3 Factors and levels of orthogonal design

水平因素A V(盐酸)∶V(80%乙醇溶液)(mL∶mL)B料液比(g∶mL)C提取温度/℃D提取时间/minE静置平衡时间/min11∶991∶504020522∶981∶10050301033∶971∶150604020
表4 正交实验结果表
Table 4 Results of orthogonal test
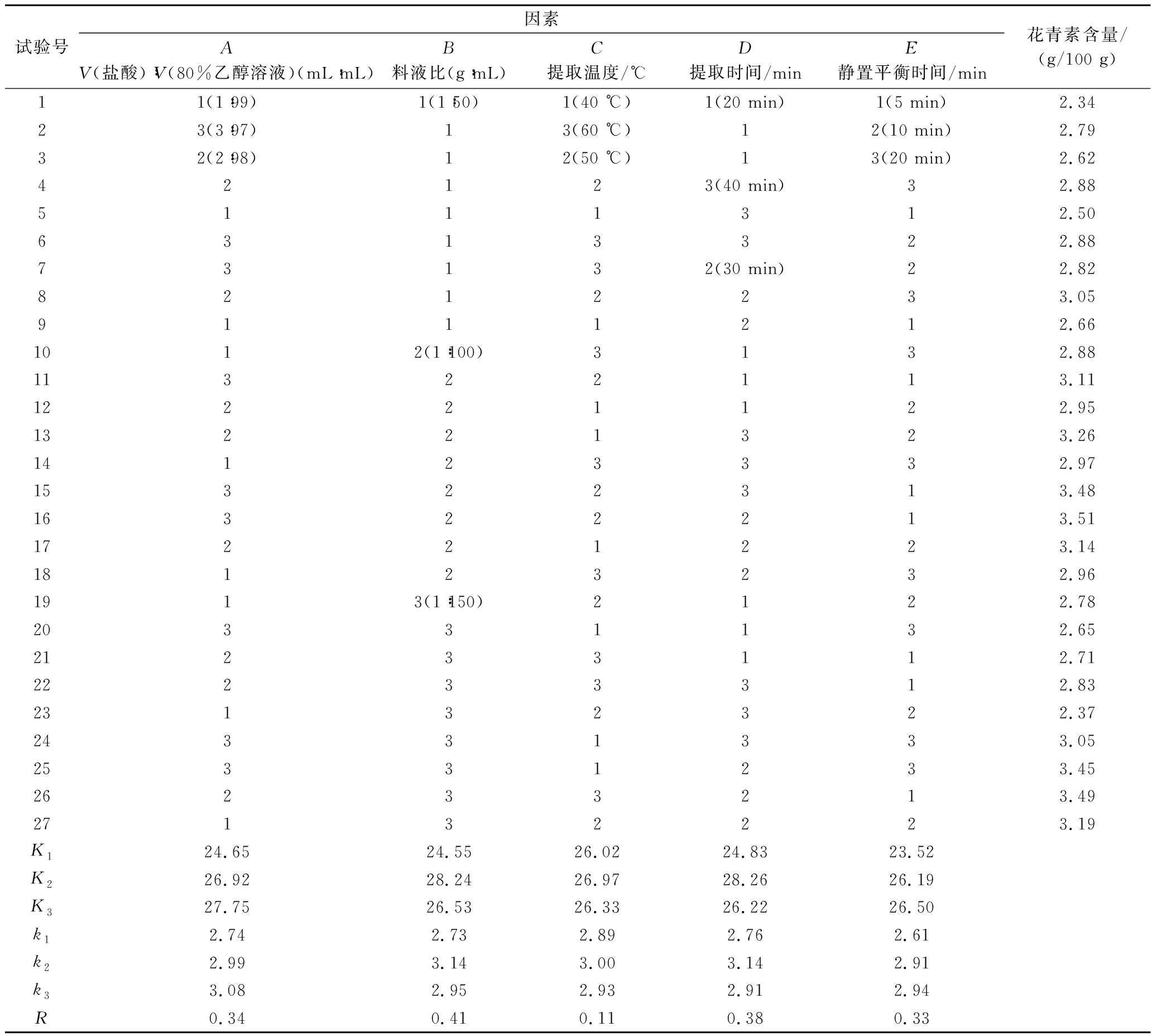
试验号因素AV(盐酸)∶V(80%乙醇溶液)(mL∶mL)B料液比(g∶mL)C提取温度/℃D提取时间/minE静置平衡时间/min花青素含量/(g/100 g)11(1∶99)1(1∶50)1(40 ℃)1(20 min)1(5 min)2.3423(3∶97)13(60 ℃)12(10 min)2.7932(2∶98)12(50 ℃)13(20 min)2.6242123(40 min)32.885111312.506313322.8873132(30 min)22.828212233.059111212.661012(1∶100)3132.8811322113.1112221122.9513221323.2614123332.9715322313.4816322213.5117221223.1418123232.961913(1∶150)2122.7820331132.6521233112.7122233312.8323132322.3724331333.0525331233.4526233213.4927132223.19K124.6524.5526.0224.8323.52K226.9228.2426.9728.2626.19K327.7526.5326.3326.2226.50k12.742.732.892.762.61k22.993.143.003.142.91k33.082.952.932.912.94R0.340.410.110.380.33
由表4可知,影响黑果枸杞中花青素含量的各因素主次顺序为:料液比(B)>提取时间(D)>V(盐酸)∶V(80%乙醇溶液)(A)>静置平衡时间(E)>提取温度(C)。从k值分析,使花青素含量最高的最佳提取和检测条件为A3B2C2D2E3,而正交实验所得结果是A3B2C2D2E1。该正交设计无重复实验,采用SPSS 19.0软件进行方差分析,分析可知ss(提取温度C)= 0.072最小,它对整个实验结果影响最小,因而将它作为误差估计,用以检验其他因素作用的显著性。结果表明,将提取温度(C)作为误差时,V(盐酸)∶V(80%乙醇溶液)(A)、料液比(B)、提取时间(D)对花青素含量有显著性影响(P<0.05),静置平衡时间(E)对花青素含量无显著性影响(P=0.858>0.05)。由此可知,直观分析与方差分析结果一致。综合各种因素,确定黑果枸杞花青素最佳提取和检测条件为A3B2C2D2E3,即提取溶剂为盐酸-80%乙醇溶液(3∶97),料液比(g∶mL)为1∶100,提取温度为50 ℃,提取时间为30 min,缓冲溶液稀释5倍后静置平衡20 min。
同理对于黑果枸杞制品同样按1.3.1节下内容进行条件考察,结果表明,a)黑果枸杞冻干粉、片剂、胶囊料液比(g∶mL)为1∶100,黑果枸杞提取物料液比(g∶mL)为1∶500,其余实验条件同上述黑果枸杞。b)黑果枸杞饮料和酒按实际含有的花青素含量其料液比(g∶mL)为1∶5~1∶50不等,提取时间为10 min,其余实验条件同上述黑果枸杞。
2.2 液相色谱-三重四级杆串联质谱法鉴别黑果枸杞中花青素的具体化学结构
液质联用分析黑果枸杞花青素检测溶液的高效液相色谱图见图2,其保留时间(tR)、紫外-可见最大吸收波长(λmax)、母离子峰(M+)和子离子峰碎片(MS/MS)等化学结构鉴别信息见表5。结果鉴别出黑果枸杞中含有三类(矮牵牛素类、飞燕草素类、锦葵色素类)共9种花青素,其中有6种为矮牵牛素类花青素,分别是矮牵牛素-3-O-半乳糖苷-5-O-葡萄糖苷(峰1)、矮牵牛素-3,5-二氧葡萄糖苷(峰3)、矮牵牛素-3-O-(6-O-咖啡酰)芸香糖苷-5-O-葡萄糖苷(峰5)、矮牵牛素-3-O-(6-O-对香豆酰)芸香糖苷-5-O-葡萄糖苷(峰6)、矮牵牛素-3-O-(6-O-丙二酰)芸香糖苷-5-O-葡萄糖苷(峰7)、矮牵牛素-3-O-(6-O-阿魏酰)芸香糖苷-5-O-葡萄糖苷(峰8)。另外3种分别为飞燕草素-3-O-(6-O-顺式对香豆酰)芸香糖苷-5-O-葡萄糖苷(峰2)、飞燕草素-3-O-(6-O-反式对香豆酰)芸香糖苷-5-O-葡萄糖苷(峰4)、锦葵色素-3-O-(6-O-对香豆酰)芸香糖苷-5-O-葡萄糖苷(峰9)。其中矮牵牛素类、飞燕草素类、锦葵色素类花青素的物质的量占比分别为97.96%、1.34%、0.62%,可见黑果枸杞中的花青素主要为矮牵牛素类花青素,并且以矮牵牛素-3-O-(6-O-对香豆酰)芸香糖苷-5-O-葡萄糖苷为主,其在总花青素中的物质的量占比为89.98%,在矮牵牛素类花青素中的物质的量占比为91.86%。
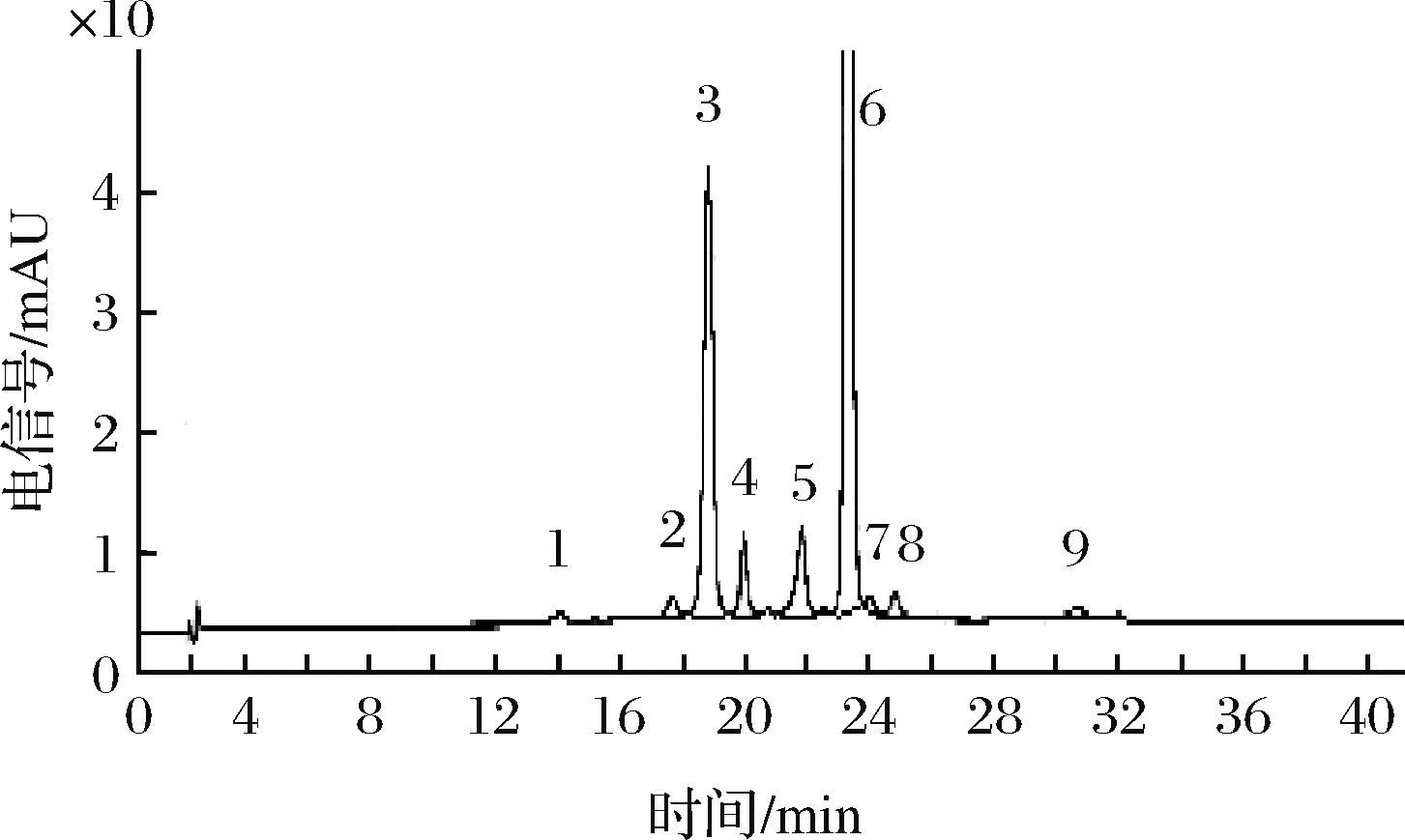
图2 黑果枸杞花青素的高效液相色谱图
Fig.2 HPLC chromatogram of anthocyanins in Lycium ruthenicum Murr.
表5 黑果枸杞花青素的化学结构鉴别信息
Table 5 Identification information of anthocyanins chemical structure in Lycium ruthenicum Murr.
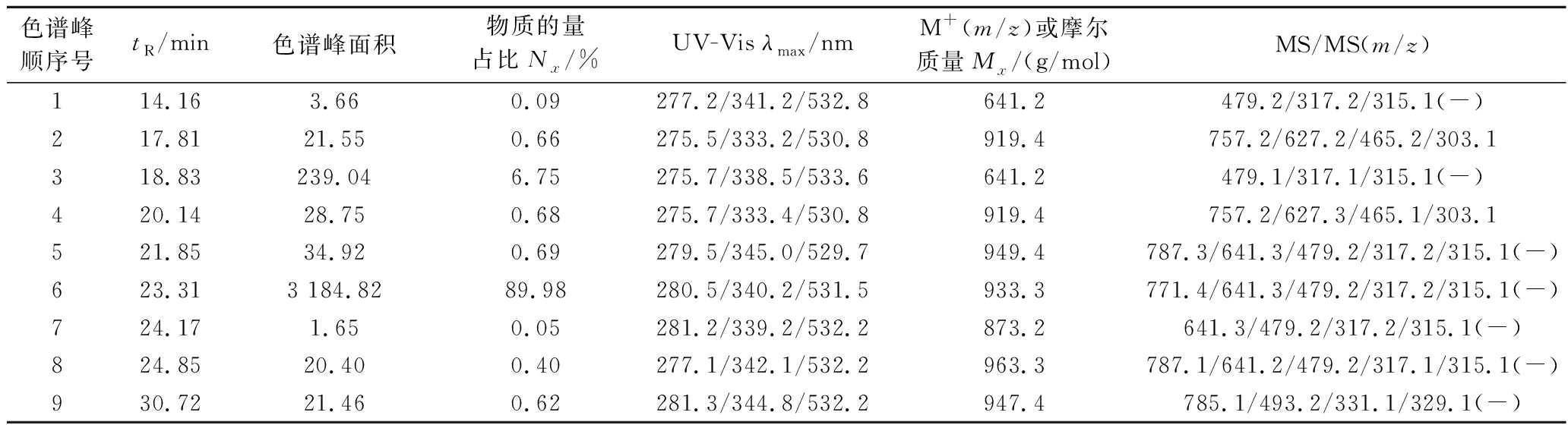
色谱峰顺序号tR/min色谱峰面积物质的量占比Nx/%UV-Vis λmax/nmM+(m/z)或摩尔质量Mx/(g/mol)MS/MS(m/z)114.163.660.09277.2/341.2/532.8641.2479.2/317.2/315.1(-)217.8121.550.66275.5/333.2/530.8919.4757.2/627.2/465.2/303.1318.83239.046.75275.7/338.5/533.6641.2479.1/317.1/315.1(-)420.1428.750.68275.7/333.4/530.8919.4757.2/627.3/465.1/303.1521.8534.920.69279.5/345.0/529.7949.4787.3/641.3/479.2/317.2/315.1(-)623.313 184.82 89.98280.5/340.2/531.5933.3771.4/641.3/479.2/317.2/315.1(-)724.171.650.05281.2/339.2/532.2873.2641.3/479.2/317.2/315.1(-)824.8520.400.40277.1/342.1/532.2963.3787.1/641.2/479.2/317.1/315.1(-)930.7221.460.62281.3/344.8/532.2947.4785.1/493.2/331.1/329.1(-)
注:(-)表示在负离子模式下花青素的子离子峰碎片的质荷比。
2.3 黑果枸杞混合花青素平均摩尔质量的确定
根据试样中各花青素在总花青素中物质的量占比(Nx%)和各自摩尔质量(Mx),计算得![]() M1×N1%+M2×N2%+M3×N3%+M4×N4%+M5×N5%+M6×N6%+M7×N7%+M8×N8%+M9×N9%=0.09%×641.2+0.66%×919.4+6.75%×641.2+0.68%×919.4+0.69%×949.4+89.98%×933.3+0.05%×873.2+0.40%×963.3+0.62%×947.4=912.7 g/mol,数据处理见表5。
M1×N1%+M2×N2%+M3×N3%+M4×N4%+M5×N5%+M6×N6%+M7×N7%+M8×N8%+M9×N9%=0.09%×641.2+0.66%×919.4+6.75%×641.2+0.68%×919.4+0.69%×949.4+89.98%×933.3+0.05%×873.2+0.40%×963.3+0.62%×947.4=912.7 g/mol,数据处理见表5。
2.4 黑果枸杞混合花青素平均摩尔消光系数的确定
2.4.1 标准物质的使用
黑果枸杞中的花青素有97.96%为矮牵牛素类花青素,其中矮牵牛素-3-O-半乳糖苷-5-O-葡萄糖苷、矮牵牛素-3-O-(6-O-咖啡酰)芸香糖苷-5-O-葡萄糖苷、矮牵牛素-3-O-(6-O-丙二酰)葡萄糖苷-5-O-葡萄糖苷和矮牵牛素-3-O-(6-O-阿魏酰)葡萄糖苷-5-O-葡萄糖苷这4种矮牵牛素类花青素均没有可购买的标准物质,其物质的量总和仅占总花青素的1.22%,对整个实验影响不大,因此用市售可以购买到的氯化矮牵牛素-3,5-二氧葡萄糖苷和氯化矮牵牛素-3-O-(6-O-对香豆酰)芸香糖苷-5-O-葡萄糖苷2种标准物质(占总花青素物质的量的96.73%)进行实验。
2.4.2 平均摩尔消光系数的测定
按氯化矮牵牛素-3,5-二氧葡萄糖苷和氯化矮牵牛素-3-O-(6-O-对香豆酰)芸香糖苷-5-O-葡萄糖苷在总花青素物质的量占比的比例7∶93配制成浓度为0.912 mg/mL的标准储备溶液,准确移取3 mL并用盐酸-80%乙醇溶液(3∶97)稀释定容至50 mL后,加pH 1.0和pH 4.5缓冲溶液再稀释5倍分别配制成pH 1.0和pH 4.5的供试品检测溶液(浓度为0.011 mg/mL),用上述2种矮牵牛素类花青素标准物质的平均摩尔质量换算为平均摩尔浓度为1.211 5×10-5 mol/L。用1 cm厚比色皿分别在528、700 nm处均测定2个不同pH值的花青素检测溶液,测得4个吸光度值,计算A=(A528nm-A700nm)pH 1.0条件下-(A528nm-A700nm)pH 4.5条件下=0.346 8(n=3),按照1.3.4节下公式(3),并按2种矮牵牛素类花青素物质的量在总花青素所占比例96.73%折算后,求得ε=29 591 L/(mol·cm)。
2.5 改进后方法学验证结果
以都兰县宗加镇诺木洪乡产黑果枸杞为例,考察改进pH示差法的专属性、线性关系、精密度、稳定性、重复性、加样回收率、定量限和检出限。
2.5.1 专属性实验
精密移取1份提取溶剂1.0 mL和1份花青素提取母液1.0 mL,先分别用原提取溶剂稀释4倍后,再分别用氯化钾缓冲溶液(0.025 mol/L, pH=1.0)稀释5倍,分别得到对照溶液和氯化钾-花青素检测溶液。室温静置20 min后,用1 cm厚比色皿在400~700 nm可见波段进行扫描,以确定最大检测波长。结果表明,黑果枸杞及其制品的氯化钾-花青素检测溶液在(530±2) nm处有最大吸收峰:黑果枸杞干果、饮料(528 nm)、黑果枸杞鲜果(529 nm)、黑果枸杞提取物、胶囊、酒(530 nm)、黑果枸杞冻干粉(531 nm)、黑果枸杞片(532 nm),而显色后对照溶液在(530±2) nm处无吸收,说明不存在空白干扰,实验方法专属性良好,故选择(530±2) nm作为最大检测波长。
2.5.2 线性关系
准确移取0.011 mg/mL氯化矮牵牛素-3,5-二氧葡萄糖苷和氯化矮牵牛素-3-O-(6-O-对香豆酰)芸香糖苷-5-O-葡萄糖苷混合标准溶液0.10、0.25、0.50、0.75、1.0、1.25 mL,依次补加80%乙醇溶液0.40、0.25、0.00、0.25、0.00、0.25 mL,然后分别用氯化钾缓冲溶液(0.025 mol/L, pH=1.0)和乙酸钠缓冲溶液(0.4 mol/L, pH=4.5)稀释10倍(依次加入缓冲溶液4.5、4.5、4.5、9.0、9.0、13.5 mL),分别得到氯化钾-花青素检测溶液和乙酸钠-花青素检测溶液。静置20 min后,用1 cm厚比色皿分别在528 nm和700 nm 2个波长处均测定氯化钾-花青素检测溶液和乙酸钠-花青素检测溶液共4个吸光度值(总体积超过5 mL的检测溶液最终均统一换算为浓缩至5 mL时的吸光度值),绘制混合矮牵牛素类花青素的标准曲线。以吸光度值为纵坐标,混合矮牵牛素类花青素质量为横坐标,绘制标准曲线。结果混合矮牵牛素类花青素质量在0.011~0.138 mg内呈良好的线性关系,回归方程为y=6.166 1 x+0.011 2,R2=0.999 1。
2.5.3 精密度实验
将已制备好的花青素供试品检测溶液,室温静置20 min后,用1 cm厚比色皿分别在528 nm和700 nm波长处均测定用pH 1.0缓冲溶液稀释的供试品检测溶液和用pH 4.5缓冲溶液稀释的供试品检测溶液共4个吸光度值,早、中、晚各测定2次,一共测定6次,计算花青素含量的相对标准偏差(relative standard deviation,RSD)以考察日内精密度;连续测定3 d,每天均早、中、晚各测定2次,3 d一共测定18次,计算花青素含量的RSD值以考察日间精密度。结果计算得黑果枸杞中花青素含量的日内精密度RSD值为0.53%,日间精密度RSD值为0.94%,表明精密度良好。
2.5.4 稳定性实验
将已制备好的花青素供试品检测溶液,室温避光条件下放置,在第1、2、6、8、10、12、15、20、24 h时分别于528 nm和700 nm波长处均测定用pH 1.0缓冲溶液稀释的供试品检测溶液和用pH 4.5缓冲溶液稀释的供试品检测溶液共4个吸光度值,计算花青素含量的RSD值。结果计算得黑果枸杞中花青素含量的RSD值为1.11%,表明黑果枸杞花青素检测溶液在24 h内稳定性良好。
2.5.5 重复性实验
准确称取5份黑果枸杞粉末,每份0.5 g,分别制备5份花青素供试品检测溶液,每一份均在室温静置20 min后,用1 cm厚比色皿分别在528 nm和700 nm波长处均测定用pH 1.0缓冲溶液稀释的供试品检测溶液和用pH 4.5缓冲溶液稀释的供试品检测溶液共4个吸光度值,计算花青素含量的RSD值。结果计算得黑果枸杞中花青素含量的RSD值为1.68%,表明重复性良好。
2.5.6 回收率实验
采用加样回收法,准确称取9份已知花青素含量的黑果枸杞粉末,每份0.25 g,分别按低、中、高3个水平精密加入2.10 mg/mL 2种混合矮牵牛素类花青素标准溶液2.5、5.0、7.5 mL,每一水平3份,并按2种矮牵牛素类花青素物质的量在总花青素所占比例96.73%折算后,计算花青素含量的平均回收率和RSD值。结果计算得黑果枸杞中花青素含量低、中、高3个水平的平均回收率分别为95.37%(RSD=1.12%)、96.57%(RSD=0.49%)、94.87%(RSD=0.70%),表明方法准确性良好。
2.5.7 定量限和检出限实验
依据ICH 指导原则中 Q2(R1)分析方法的验证,准确移取11份1.0 mL盐酸-80%乙醇溶液(3∶97)提取溶剂作为空白对照溶液,分别用氯化钾缓冲溶液(0.025 mol/L, pH=1.0)和乙酸钠缓冲溶液(0.4 mol/L, pH=4.5)稀释一定倍数后,静置20 min后,分别在(530±2) nm和700 nm两个波长处均测定氯化钾-花青素检测溶液和乙酸钠-花青素检测溶液共4个吸光度值,求出这11份空白对照溶液响应值的标准偏差σ。然后再根据绘制的标准曲线斜率S,分别求出前处理之后的定量限(QL=10×σ/S)和检出限(DL=3.3×σ/S),最终将称样量、稀释倍数和定容体积一并用于计算黑果枸杞及其制品处理之前的定量限和检出限(表6)。结果固体样品和液体样品最低检出限分别为28.2 mg/100 g、0.282 mg/100 mL。
表6 黑果枸杞及其制品中花青素含量测定的检出限和定量限
Table 6 The detection limits and quantitative limits for the determination of anthocyanidins content in Lycium ruthenicum Murr.and products
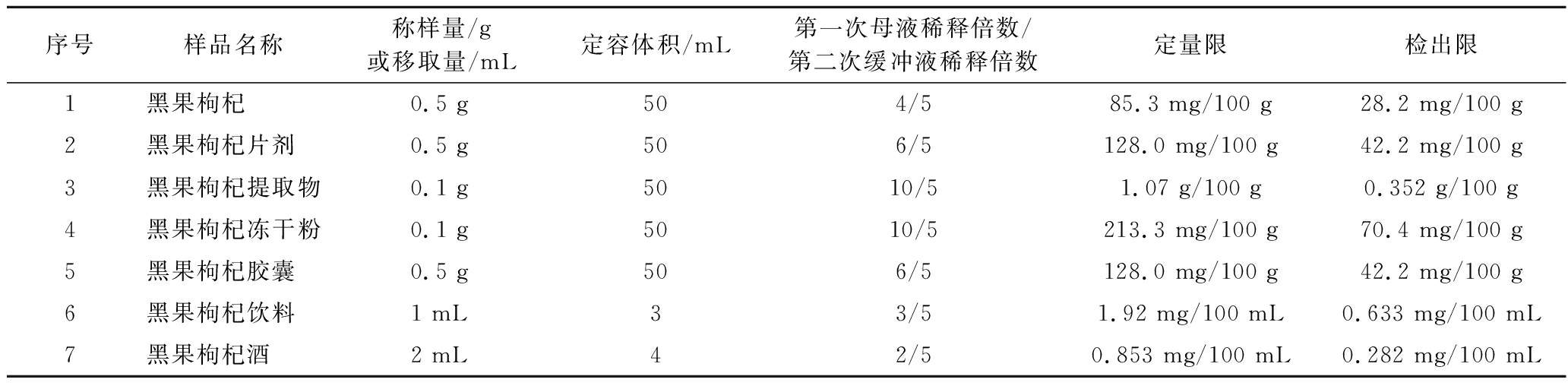
序号样品名称称样量/g或移取量/mL定容体积/mL第一次母液稀释倍数/第二次缓冲液稀释倍数定量限检出限1黑果枸杞 0.5 g504/585.3 mg/100 g28.2 mg/100 g2黑果枸杞片剂 0.5 g506/5128.0 mg/100 g42.2 mg/100 g3黑果枸杞提取物0.1 g5010/51.07 g/100 g0.352 g/100 g4黑果枸杞冻干粉0.1 g5010/5213.3 mg/100 g70.4 mg/100 g5黑果枸杞胶囊 0.5 g506/5128.0 mg/100 g42.2 mg/100 g6黑果枸杞饮料 1 mL33/51.92 mg/100 mL0.633 mg/100 mL7黑果枸杞酒 2 mL42/50.853 mg/100 mL0.282 mg/100 mL
2.5.8 实验室间比对实验
每个实验室内部数据的精密度(以相对相差%计)和其他3家实验室之间的精密度结果表明,实验室内最大精密度为4.81%,室间最大精密度为8.97%,均满足一般国家标准对食品中各种成分检测的精密度要求(相对相差<10%),表明改进后的pH示差法再现性良好,可以准确测定黑果枸杞及其制品中花青素含量。
2.6 黑果枸杞及其制品中花青素的含量测定结果
结果表明,青海境内不同产区黑果枸杞中花青素含量为2.81~3.77 g/100 g,平均含量为3.38 g/100 g。其中,来自天峻县龙门乡的黑果枸杞中花青素含量最高为3.77 g/100 g,来自乌兰县希里沟镇西庄村的黑果枸杞中花青素含量最低为2.81 g/100 g。各产区之间比较,大柴旦和天峻县的黑果枸杞中花青素含量较高为3.61 g/100 g,其次是都兰县、德令哈市和格尔木市,黑果枸杞中花青素含量依次为3.51、3.36、3.34 g/100 g,乌兰县的黑果枸杞中花青素含量较低为3.00 g/100 g,但各产区之间黑果枸杞中花青素含量差异不显著(P>0.05)。黑果枸杞制品中,黑果枸杞提取物中花青素含量可高达67.5 g/100 g,片剂、冻干粉和胶囊中花青素含量依次为1.32、2.55、1.40 g/100 g,黑果枸杞饮料和酒中花青素含量相当,分别为32.5、31.6 mg/100 mL(表7)。
表7 青海境内不同产地黑果枸杞及其制品中花青素的含量![]()
Table 7 The anthocyanidins content in Lycium ruthenicum Murr. samples collected from Qinghai different producing areas and its products ![]() n=3)
n=3)
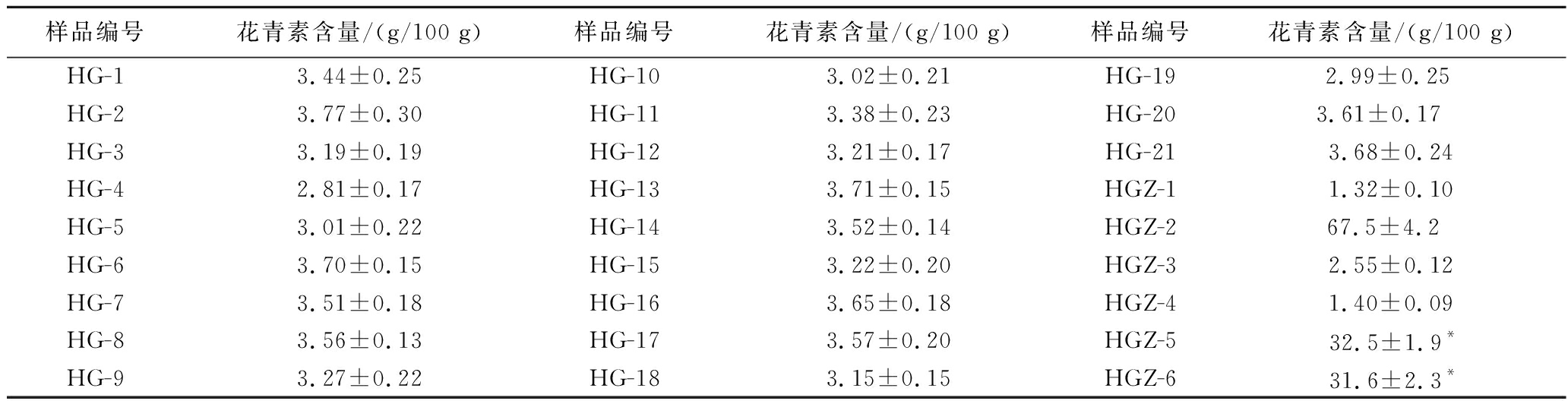
样品编号花青素含量/(g/100 g)样品编号花青素含量/(g/100 g)样品编号花青素含量/(g/100 g)HG-13.44±0.25HG-103.02±0.21HG-192.99±0.25 HG-23.77±0.30HG-113.38±0.23HG-203.61±0.17 HG-33.19±0.19HG-123.21±0.17HG-213.68±0.24HG-42.81±0.17HG-133.71±0.15HGZ-11.32±0.10HG-53.01±0.22HG-143.52±0.14HGZ-267.5±4.2 HG-63.70±0.15HG-153.22±0.20HGZ-32.55±0.12HG-73.51±0.18HG-163.65±0.18HGZ-41.40±0.09HG-83.56±0.13HG-173.57±0.20HGZ-5 32.5±1.9*HG-93.27±0.22HG-183.15±0.15HGZ-6 31.6±2.3*
注:*表示花青素含量单位为mg/100 mL。
3 讨论
3.1 pH示差法改进前后花青素检测结果的比较
改进前后黑果枸杞及其制品中花青素的含量结果见表8。结果表明,在最佳提取和检测条件下,黑果枸杞及其制品的花青素提取增长率均大于20%,其中,黑果枸杞的花青素提取增长率可高达50.0%,其余黑果枸杞制品的花青素提取增长率在22.1%~33.3%范围内不等,优化提取和检测条件能够极大地提高花青素提取率。采用液相色谱-三重四级杆串联质谱法鉴别出黑果枸杞中花青素主要为矮牵牛素类花青素,计算出混合花青素的平均摩尔质量为912.7 g/mol,平均摩尔消光系数为29 591 L/(mol·cm),分别以矢车菊素-3-O-葡萄糖苷计和以矮牵牛素类花青素计算黑果枸杞及其制品中花青素含量,结果以后者计算比以前者计算花青素含量增加了2.26~2.77倍不等,平均增加了2.41倍,说明对于完全不含有矢车菊素-3-O-葡萄糖苷的黑果枸杞及其制品,若以矢车菊素-3-O-葡萄糖苷计算花青素含量必然造成很大误差,检测结果偏低,以矮牵牛素类花青素计算能够真实地反映黑果枸杞及其制品中花青素的含量。
表8 pH示差法改进前后花青素含量检测结果的比较![]()
Table 8 Comparison of detection results of anthocyanidins content between before and after improvement of pH differential method ![]() n=3)
n=3)
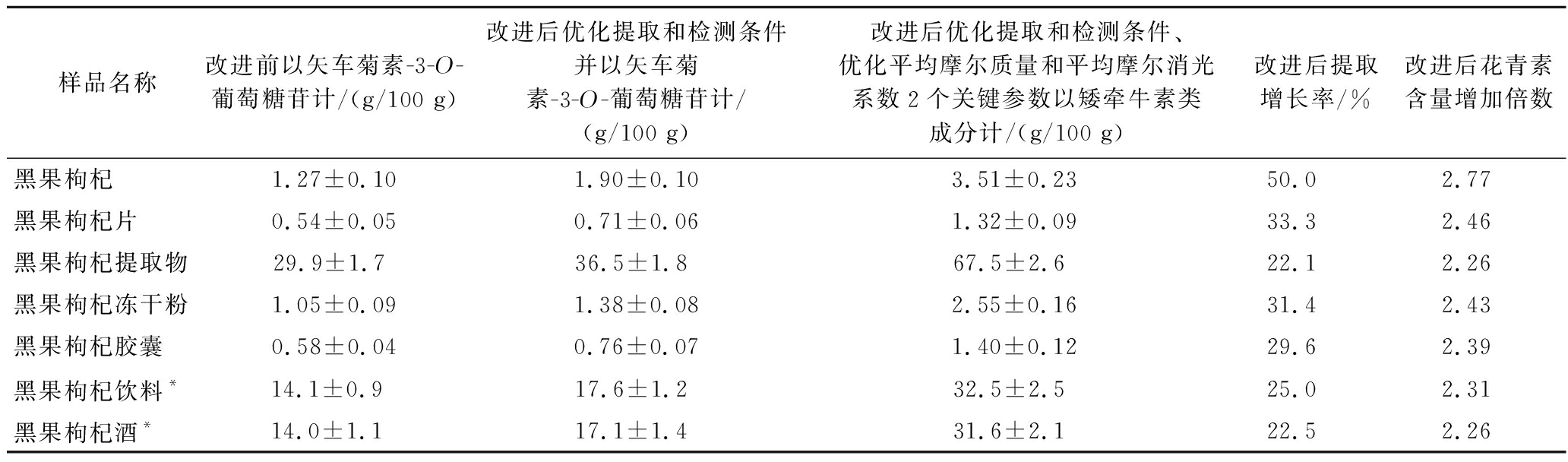
样品名称改进前以矢车菊素-3-O-葡萄糖苷计/(g/100 g)改进后优化提取和检测条件并以矢车菊素-3-O-葡萄糖苷计/(g/100 g)改进后优化提取和检测条件、优化平均摩尔质量和平均摩尔消光系数2个关键参数以矮牵牛素类成分计/(g/100 g)改进后提取增长率/%改进后花青素含量增加倍数黑果枸杞1.27±0.101.90±0.103.51±0.2350.02.77黑果枸杞片0.54±0.050.71±0.061.32±0.0933.32.46黑果枸杞提取物 29.9±1.7 36.5±1.8 67.5±2.6 22.12.26黑果枸杞冻干粉1.05±0.091.38±0.082.55±0.1631.42.43黑果枸杞胶囊0.58±0.040.76±0.071.40±0.1229.62.39黑果枸杞饮料*14.1±0.9 17.6±1.2 32.5±2.5 25.02.31黑果枸杞酒*14.0±1.1 17.1±1.4 31.6±2.1 22.52.26
注:*表示花青素含量单位为mg/100 mL。
3.2 pH示差法改进后花青素单次检测结果的精密度分析
缓冲溶液稀释5倍时可以使提取溶液pH稳定在pH 1.0,此时花青素花烊正离子最稳定,并且花青素含量达到最高。以都兰县宗加镇诺木洪乡产黑果枸杞为例,在最佳提取和检测条件下其花青素含量为3.50 g/100 g。花青素检测缓冲溶液静置平衡时间在20 min以内时花青素含量在3.48~3.49 g/100 g内波动,在20 min以后至80 min时花青素含量在3.49~3.50 g/100 g内波动,20 min以后与20 min内相比略有增加,20 min内单次检测结果精密度为0.57%(以最大相对相差%计),20 min以后单次检测结果精密度为0.29%,可见在最佳检测条件下花青素含量单次检测结果精密度可稳定在0.3%以内,检测结果更准确。
3.3 不同方法检测花青素的结果分析
花青素常用的检测方法主要有高效液相色谱法和pH示差法。高效液相色谱法前处理过程中在沸水浴条件下将花色苷水解成花青素时,由于加入了盐酸,并且又在沸水浴的高温条件下水解,剧烈的水解条件使部分花青素的化学结构被不可逆破坏,结果造成花青素大量损失。其次在多次使用同一根色谱柱后发现存在柱平衡时间长、色谱柱易污染、保留时间不稳定、变化大等问题。另处理好的试样溶液即使存放在4 ℃冷藏条件下,其超过2 d后检测结果也会比在24 h内检测偏低,分析其原因可能是由于水解后单一花青素受甲基化程度的内在因素和温度、pH值、光、金属离子、氧、酶、抗坏血酸、糖及降解产物等外在因素的影响而发生不同程度的降解[12],与连接具有空间保护作用糖苷键的花色苷相比其稳定性更差。pH示差法检测花青素采用超声波提取法,实验时间短、耗能少、提取率高、能有效保护花青素活性、操作简单、检测过程污染少,不涉及高效液相色谱法上述缺点以及还需要购买多种价格昂贵的进口花青素标准物质。以来自乌兰县希里沟镇西庄村的黑果枸杞为例,采用上述2种方法分别检测黑果枸杞中花青素的含量,高效液相色谱法检测结果为1 101.6 mg/100 g,pH示差法检测结果为2 810.4 mg/100 g,2个结果之间相差2.55倍。高效液相色谱法检测花青素含量是以不含有糖苷键的飞燕草素、矢车菊素、矮牵牛素、天竺葵素、芍药色素和锦葵色素6种花青素含量之和计算,而pH示差法检测花青素含量是以连有糖苷键的矮牵牛素类花色苷计算,二者用于计算的花青素化学结构完全不同,所以不能说pH示差法检测花青素含量高于高效液相色谱法,二者之间完全没有可比性,这里需要注意的是在采用不同的检测方法时,务必标示清楚用于计算的具体花青素名称,以防误用产生错误的结论。
4 结论
pH示差法不涉及高效液相色谱法存在的柱平衡时间长、色谱柱易污染、保留时间不稳定、试样溶液易变质发生降解、需要购买多种昂贵的花青素标准物质等缺点,其方法简单、快速、易操作。改进后的pH示差法在最佳提取条件下能够最大限度地提取出黑果枸杞及其制品中的花青素,在最佳检测条件下能够提高单次检测结果的精密度。以黑果枸杞中特有的矮牵牛素类花青素的平均摩尔质量和平均摩尔消光系数代替其不含有的矢车菊素-3-O-葡萄糖苷进行计算,能真实地反映黑果枸杞及其制品中花青素的含量。该法的广泛应用能够不断带动青海省境内黑果枸杞花青素品质的提高,加强野生黑果枸杞资源的保护利用,有效地减少野生黑果枸杞的盲目破坏性采摘,防止对当地生态环境的严重破坏,大力发展人工种植技术,有效保护环境、恢复脆弱生态、维持黑果枸杞种质的多样性,对于青海省黑果枸杞产业的健康可持续发展,食品的合理加工和利用等均具有重要意义。
[1] 赵秀玲. 黑果枸杞生理活性成分研究进展[J].食品与生物技术学报, 2016, 35(6):561-568.
ZHAO X L.A review on bioactives from Lycium rethenicum Murr[J].Journal of Food Science and Biotechnology, 2016, 35(6):561-568.
[2] 中国科学院中国植物志编辑委员会. 中国植物志[M].北京:科学出版社, 1999.
Flora of China Editorial Committee of Chinese Academy of Sciences.Flora of China [M].Beijing:Science Press, 1999.
[3] 孙建霞, 张燕, 孙志健, 等.花色苷的资源分布以及定性定量分析方法研究进展[J].食品科学, 2009, 30(5):263-268.
SUN J X, ZHANG Y, SUN Z J, et al.Summary of resource distribution and qualitative and quantitative analysis methods of anthocyanin[J].Food Science, 2009, 30(5):263-268.
[4] TAMURA H, YAMAGAMI A.Antioxidative activity of monoacylated anthocyanins isolated from Muscat Bailey A grape[J].Journal of Agricultural and Food Chemistry, 1994, 42(8):1 612-1 615.
[5] PRIOR R L, CAO G H, MARTIN A, et al.Antioxidant capacity as influenced by total phenolic and anthocyanin content, maturity, and variety of Vaccinium species[J].Journal of Agricultural and Food Chemistry, 1998, 46(7):2 686-2 693.
[6] 贺盼, 孔东升, 王立, 等.正交试验优化黑果枸杞果实中花青素的提取工艺[J].中国野生植物资源, 2020, 39(2):33-37.
HE P, KONG D S, WANG L, et al.Optimizing the extraction technology of anthocyanin from fruit of Lycium ruthenicum by orthogonal design[J].Chinese Wild Plant Resources, 2020, 39(2):33-37.
[7] 巩芳芳, 廖碧芳, 董佳佳, 等.黑枸杞花青素提取工艺优化和含量测定[J].郑州大学学报(医学版), 2019, 54(4):531-534.
GONG F F, LIAO B F, DONG J J, et al.Extraction process optimization and content determination of anthocyanin from black Wolfberry[J].Journal of Zhengzhou University (Medical Sciences), 2019, 54(4):531-534.
[8] HU N, ZHENG J E, LI W C, et al.Isolation, stability, and antioxidant activity of anthocyanins from Lycium ruthenicum Murray and Nitraria Tangutorum Bobr of Qinghai-Tibetan Plateau[J].Separation Science and Technology, 2014, 49(18):2 897-2 906.
[9] 杨萍, 李哲.pH示差法与HPLC测定黑枸杞花青素方法比较[J].中国农机化学报, 2017, 38(7):74-78.
YANG P, LI Z.Comparison between pH differential method and HPLC method for measuring anthocyanin content of black wolfberry[J].Journal of Chinese Agricultural Mechanization, 2017, 38(7):74-78.
[10] 谭亮, 李玉林, 杲秀珍, 等.改进pH示差法检测不同植物源性食品中花青素的方法[J].食品与发酵工业, 2022, 48(21):276-285.
TAN L, LI Y L, GAO X Z, et al.Determination of anthocyanidins in different plant origin foods by improved pH differential method[J].Food and Fermentation Industries, 2022, 48(21):276-285.
[11] 白佳兴. 野生黑果枸杞饮料工艺及特性研究[D].天津:天津科技大学, 2018.
BAI J X.Studies on processing technology and characteristics of wild Lycium ruthenicum Murray beverage[D].Tianjin:Tianjin University of Science &Technology, 2018.
[12] 汪慧华, 赵晨霞.花青素结构性质及稳定性影响因素研究进展[J].农业工程技术(农产品加工业), 2009(9):32-35.
WANG H H, ZHAO C X.Research progress on structural properties and stability influencing factors of anthocyanins[J].Agriculture Engineering Technology (Agricultural Product Processing Industry), 2009(9):32-35.