黄酒采用的是双边发酵工艺,即边糖化边发酵。该发酵过程复杂,不仅产生了乙醇和风味物质,还生成了许多有益的功能性成分,如低聚糖、氨基酸、酚类、活性肽等,具有较好的降胆固醇、降血压、抗氧化等功效[1]。但是发酵过程难免也会产生其他非喜好代谢物质,例如杂醇、生物胺、嘌呤、氨基甲酸乙酯(ethyl carbamate,EC)等。黄酒中杂醇主要来自发酵过程中氨基酸降解代谢和糖代谢2种合成途径,适量的杂醇赋予了黄酒独特的醇香和圆润的酒体[2]。但杂醇的含量过高,致醉性越强[3]。黄酒中的生物胺主要来自于浸米和发酵工序,它是一类低分子含氮有机碱。过量的生物胺在人体内代谢较慢,饮后会有头痛、恶心等症状,影响人体健康[4]。而嘌呤是一种杂环芳香有机化合物,是核酸的重要组成成分。在酒类中普遍存在。含量过高易使体内血尿酸升高[5]。氨基甲酸乙酯主要是由乙醇与氨甲酰化合物的反应产生,巫景铭等[6]研究发现,70%的氨基甲酸乙酯来源于煎酒与陈酿,微量存在于许多发酵食品和酒精饮料当中。
活性炭是一种采用优质煤、木材、椰壳等为原料,经一系列工序精制而成的吸附材料,其内部具有晶体结构和孔隙结构,外部拥有巨大的比表面积。具有物理和化学吸附的作用[7]。而酒类活性炭对酒体可以起到去浊、新酒催陈、去除异味及苦味、提高酒质等功能作用。研究表明,活性炭可吸附白酒中的杂醇[2]和啤酒中的嘌呤[5],以及黄酒中的氨基甲酸乙酯[8],对酒类的后期修饰具有较为显著的作用。而利用活性炭对生物胺的吸附研究较少,主要采用生物酶法降解[9]。总体上活性炭应用于白酒的工艺较为广泛,而应用于处理黄酒的工艺研究报道较少。
本研究以提升黄酒品质为目的,通过椰壳制成的粉状酒类活性炭为吸附介质静态处理黄酒。虽然对黄酒的色泽和风味有所损失,但是吸附了黄酒中异杂味、总酸以及杂醇、生物胺、嘌呤、氨基甲酸乙酯等非喜好代谢物质,整体提高了黄酒饮用舒适性和健康性。实验中对活性炭添加量、吸附温度及吸附时间进行探究,旨在获得最佳的处理工艺,对黄酒工业化生产过程中品质的控制提供技术和参考。
1 材料与方法
1.1 材料与仪器
绍兴古越龙山半干型黄酒;酒类活性炭,平顶山市绿之原活性炭有限公司。
ZXGP-B2080电热恒温水浴锅,上海智城分析仪器制造有限公司;自动电位滴定仪,上海仪电科学仪器股份有限公司;TRACE 1300气相色谱仪,配有质谱检测器,赛默飞世尔科技公司;固相微萃取PA萃取头,美国Sigma-Aldrich公司;高效液相色谱仪A1100,安捷伦科技有限公司;EL3002分析天平,梅特勒-托利多仪器(上海)有限公司;高精度分光测色仪,美国HunterLab公司;ZGDCY-12S氮吹仪,上海梓桂仪器有限公司。
1.2 实验方法
1.2.1 活性炭吸附工艺
各量取黄酒1 L,加入粉末活性炭配制成0、5、10、15、20、25、50 g/L溶液。在室温下进行静态吸附24 h。之后使用布氏漏斗进行3次滤膜抽滤。处理后的酒样立刻进行相关指标检测,之后放于4 ℃冰箱冷藏。综合感官评价,得出活性炭的最适添加量,再进行下一步实验。
1.2.2 色度测定
将黄酒样品装入石英比色皿后,使用色度仪进行色度测定,测试模式为透射,读数以色度空间值L*、a*和b*表示,其中L*为明度(色泽的明亮度),a*为红绿度(正数为红色,负数为绿色),b*为黄蓝度(正数为黄色,负数为蓝色),重复3次[10]。
1.2.3 感官评价
综合文献[11],制定如表1所示评分表。邀请9位具有多年黄酒品鉴资格人员组成感官小组,对样品进行随机编号,去掉最高分和最低分,取平均分,满分为100分。
表1 感官评价表
Table 1 Sensory evaluation

指标评分标准分值颜色(30分)琥珀色,澄清21~30金黄色,澄清,轻度脱色11~20浅黄色近无色,澄清,重度脱色0~10香气(30分)香气浓郁宜人,或无异味21~30香气简单纯正,或轻微异杂味11~20香气平淡微弱,或有异味0~10口感(30分)酒体饱满,口感均衡21~30酒体中等,口感轻微失调11~25酒体寡淡,口感重度失调0~10饮用舒适性0~10
1.2.4 酒精度、总酸、氨基酸态氮检测
酒精度、总酸、氨基酸态氮检测均依据:GB/T 13662—2018《黄酒》。
1.2.5 关键酯类物质检测
采用顶空固相微萃取-气相色谱-质谱联用(headspace-solid phase micro extraction- gas chromatography- mass spectrometry,HS-SPME-GC/MS)技术,以10 μL 2-辛醇(10 mg/L)作为内标,同时测定内标物和代表性酯类物质成分的峰面积和相对响应值得出含量。具体参见王培璇等[12]的方法。
1.2.6 相关物质检测
杂醇含量的的检测参考参见黄桂东等[13]的方法;生物胺检测参见国标GB/T5009.208—2016《食品中生物胺含量的测定》;嘌呤的检测,采用离子交换固相萃取-反相高效液相色谱法,参见刘镇等[14];氨基甲酸乙酯的检测,采用HS-SPME/GC-MS法,参见刘俊等[15]。
1.2.7 工艺优化试验
根据1.2.3节的结果,筛选出最适的活性炭添加量进行下一步工艺优化。分别置于不同温度:4、15、25、35、45、55、65 ℃,不同时间:3、6、9、12、15、18、21、24 h进行吸附。
1.2.8 数据统计分析
每个样品进行3次平行检验,将统计结果提交进行SPSS 25.0方差分析(ANOVA),然后对概率低于0.05的平均值进行比较(Tukey)。使用Origin 2021和Microsoft Excel软件生成统计分析和图表。
2 结果与分析
2.1 色度评价
由表2可知,与未添加活性炭的原酒样相比,随着活性炭添加量的增加,酒样的明亮度逐渐增加,绿色和黄色逐渐减少,说明黄酒逐渐变浅色透明化。可见活性炭的添加对原酒的色度影响较大,其中对于黄色影响最大。当添加量达到50 g/L时,黄酒呈现近乎无色透明状态。当活性炭添加量为5 g/L和10 g/L时,其明度无明显差异,a*和b*值出现显著差异(P<0.05)。
表2 色度评价结果
Table 2 Chromaticity evaluation results
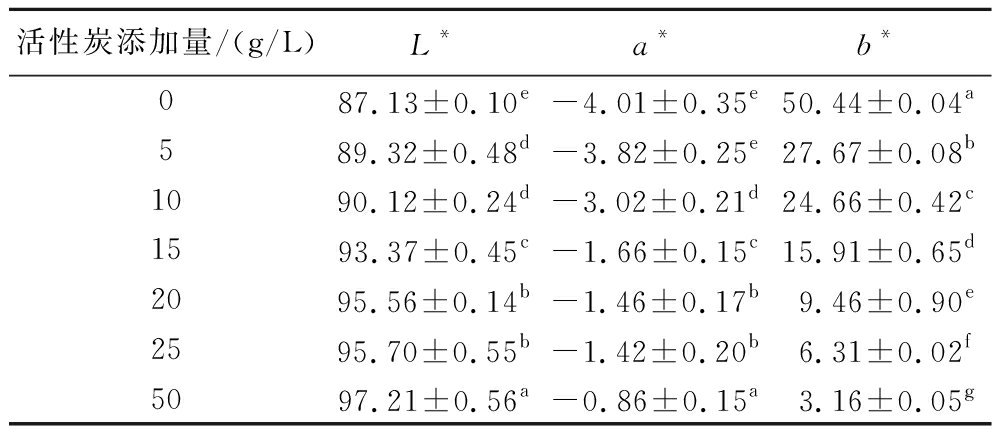
活性炭添加量/(g/L)L*a*b*087.13±0.10e-4.01±0.35e50.44±0.04a589.32±0.48d-3.82±0.25e27.67±0.08b1090.12±0.24d-3.02±0.21d24.66±0.42c1593.37±0.45c-1.66±0.15c15.91±0.65d2095.56±0.14b-1.46±0.17b9.46±0.90e2595.70±0.55b-1.42±0.20b6.31±0.02f5097.21±0.56a-0.86±0.15a3.16±0.05g
注:不同小写字母表示差异显著(P<0.05)。
2.2 感官评价
表3感官评价结果表明,10 g/L活性炭添加量的酒样得分比5 g/L活性炭量的酒样得分略高,吸附了该黄酒轻微的异杂味,例如塑料味、酸嗖味、烂曲味等;酒样彼此间色度差异不大。因此选择10 g/L活性炭添加量作为后续研究对象进行探究。经10 g/L活性炭处理后酒样颜色呈禾秆黄色,香气浓郁度虽比原酒略有降低,但是削减了黄酒中不愉悦的异杂味,使得原酒中的米香、曲香、醇香与酯香表现得更加纯粹,整体评价较高。
表3 感官评价结果
Table 3 Sensory evaluation results
活性炭添加量/(g/L)051015202550得分/分82848575706452
注:感官评价标准见表1。
2.3 关键酯类物质检测
对原酒样、10 g/L与50 g/L活性炭添加量的酒样进行关键酯类定量的对比分析,结果如图1所示,10 g/L活性炭添加后黄酒的酯类物质稍有损失,但是能整体保留80%左右的风味物质骨架。王国安[16]使用酒类专用活性炭对白酒的酒尾进行异杂味去除,也发现还有很多呈味呈香物质被保留。而50 g/L活性炭添加量对黄酒中酯类物质吸附过多,其中乳酸乙酯、乙酸乙酯的含量损失最多,且处理后的黄酒风味寡淡。
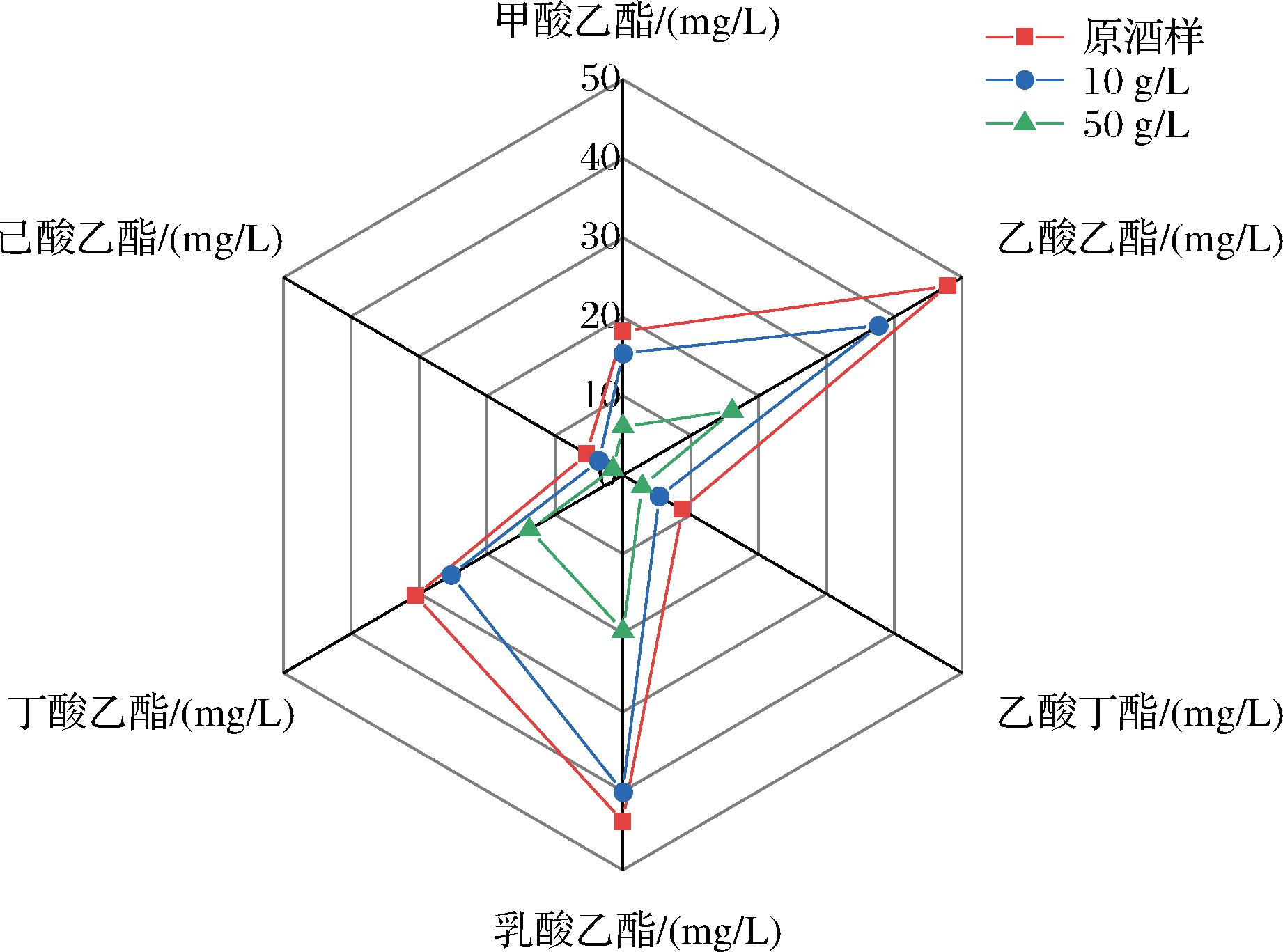
图1 关键酯类风味物质雷达图
Fig.1 Radar of key ester flavor substances
2.4 总酸与氨基酸态氮检测结果
图2-a总酸含量以10 g/L的活性炭添加量为临界点,添加量<10 g/L时,总酸含量迅速降低;减少了黄酒酸度过高引起的刺激感。活性炭添加量>10 g/L时,总酸过低使得酒体失衡。当活性炭添加量为10 g/L时,氨基酸态氮损失不大,意味着对黄酒的质量等级影响较小[17]。
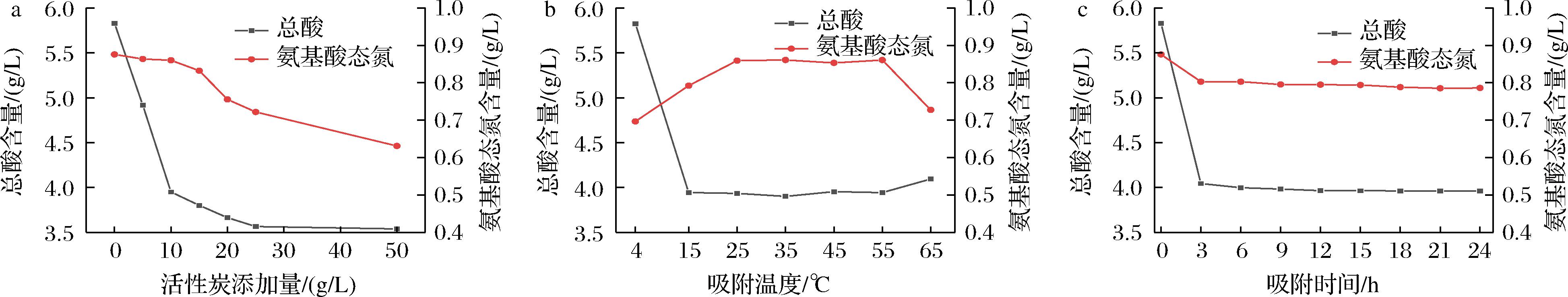
a-不同活性炭添加量,室温下吸附24 h;b-10 g/L活性炭添加量,不同温度吸附24 h;c-10 g/L活性炭添加量,室温下吸附不同时间
图2 单因素试验对总酸与氨基酸态氮含量的影响
Fig.2 Effect of single factor test on total acid and amino acid nitrogen conten
图2-b在不同吸附温度条件下,活性炭吸附温度在25~45 ℃总酸与氨基酸态氮维持在平稳水平,为合理温度区间。但最低温和高温吸附处理对酒样中总酸吸附无明显效果,且氨基酸态氮的损失较大。图2-c不同吸附时间显示,活性炭添加3 h后总酸与氨基酸态氮的含量几乎不变。
2.5 杂醇检测结果
图3-a表明,随着活性炭用量增加,黄酒中杂醇逐渐下降。添加10 g/L活性炭的黄酒杂醇相对于原酒样约降低了75 mg/L;添加50 g/L活性炭的黄酒杂醇含量约降低了266 mg/L,降低幅度巨大。其中对苯乙醇的吸附量最多,对正丙醇的吸附量最少。
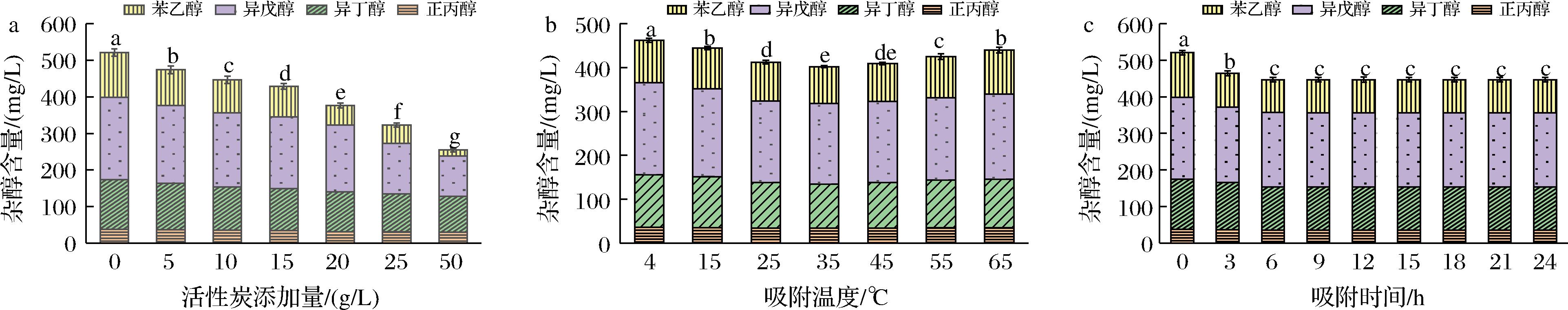
a-不同活性炭添加量,室温下吸附24 h;b-10 g/L活性炭添加量,不同温度吸附24 h;c-10 g/L活性炭添加量,室温下吸附不同时间
图3 单因素试验对杂醇含量的影响
Fig.3 Effect of single factor test on fusel alcohols content
注:Tukey检验,不同小写字母表示显著差异(P<0.05)(下同)。

a-不同活性炭添加量,室温下吸附24 h;b-10 g/L活性炭添加量,不同温度吸附24 h;c-10 g/L活性炭添加量,室温下吸附不同时间
图4 单因素试验对生物胺含量的影响
Fig.4 Effect of single factor test on biogenic amines content
图3-b表明,当吸附温度升高,黄酒中杂醇含量变化为先降低后升高。以35 ℃为界,4~35 ℃时活性炭对于杂醇吸附量逐渐递增;当温度达到35 ℃以上时,温度增加了分子间的热运动,活性炭吸附加快的同时解吸附也变快,杂醇含量略有上升。图3-c表明,3~6 h后活性炭对杂醇的吸附即可达到饱和量。
2.6 生物胺检测结果
如图4-a所示,随着活性炭添加量逐渐增大,黄酒中的生物胺几乎呈线性下降的趋势,说明活性炭对生物胺具有明显吸附作用。当活性炭的添加量达到50 g/L时,总生物胺含量从原来95.59 mg/L降低至51.02 mg/L。该酒样中酪胺含量较多,活性炭对其吸附量也最大。对其他几种生物胺均为少量吸附。生物胺吸附是由其芳香环的π系统与碳表面六边形相互作用引起的[18]。
图4-b所示,当温度较低时,活性炭对生物胺的吸附力较小。逐渐升高温度,活性炭吸附力越强,温度在25 ℃和35 ℃时吸附最佳,两者之间无显著性差异。超过35 ℃之后,可能部分生物胺被解吸附,总生物胺含量反而上升。图4-c所示,9 h以后10 g/L活性炭添加量达到吸附最大值,黄酒中的生物胺不再被吸附。
2.7 嘌呤检测结果
图5-a表明,随着活性炭添加量逐渐增大,黄酒中总嘌呤含量逐渐降低,整体呈线性下降。当活性炭的添加量>15 g/L时,总嘌呤含量急剧下降。达到50 g/L活性炭添加量时,嘌呤的含量仅为35.31 mg/L。其中该活性炭对于黄酒中黄嘌呤的吸附量最大。

a-不同活性炭添加量,室温下吸附24 h;b-10 g/L活性炭添加量,不同温度吸附24 h;c-10 g/L活性炭添加量,室温下吸附不同时间
图5 不同活性炭添加量对嘌呤含量的影响
Fig.5 Effect of single factor test on purine content
图5-b表明,可以看出当温度较低时,活性炭对嘌呤的吸附量同样较低。逐渐升高温度,活性炭吸附力越强。25 ℃和35 ℃,活性炭吸附效果最佳,说明该温度区间比较合适。与王海容等[19]研究活性炭吸附啤酒中嘌呤的研究结果一致。此时总嘌呤含量维持在80 mg/L左右,含量比原酒低16 mg/L左右。图5-c表明,吸附时间>3 h后对于嘌呤含量的变化几乎没有影响,说明活性炭对嘌呤的吸附速度较快。
嘌呤是一类带碱性有2个相邻碳氮环的含氮有机大分子物质,含有极性基团,可被一些吸附剂作用[20]。对于有机物而言,其相对分子质量越大、沸点越高,不饱和性越大,则越易被吸附[7]。可见活性炭对大分子嘌呤类物质的吸附较快,效果较好。
2.8 氨基甲酸乙酯检测结果
图6-a显示,由于EC的含量相对较低,5 g/L活性炭添加量对EC的吸附作用甚微,当添加量在10 g/L~20 g/L时对EC的吸附效果最为明显,随后到达饱和状态。
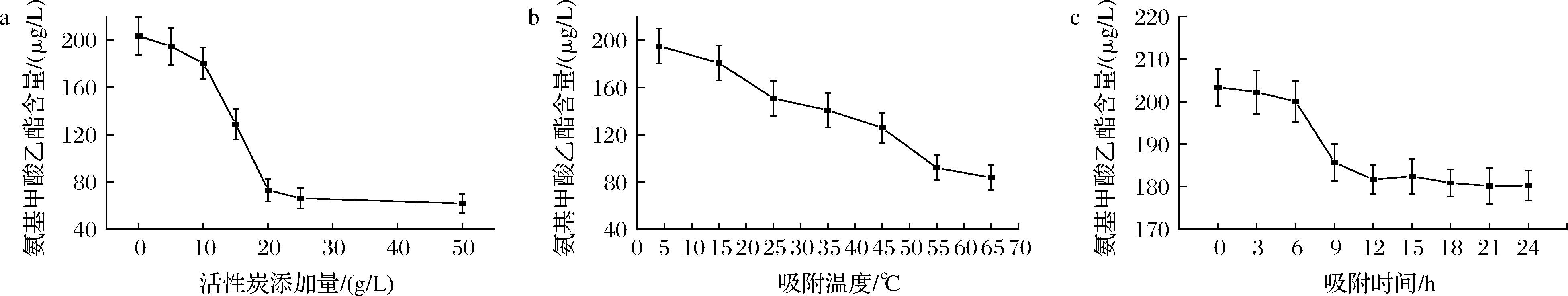
a-不同活性炭添加量,室温下吸附24 h;b-10 g/L活性炭添加量,不同温度吸附24 h;c-10 g/L活性炭添加量,室温下吸附不同时间
图6 单因素试验对氨基甲酸乙酯含量的影响
Fig.6 Effect of single factor test on ethyl carbamate content
图6-b显示,随着温度升高,活性炭对EC的吸附作用越来越大,黄酒中EC含量几乎呈线性下降。因此推测此吸附过程为化学吸附,为吸热反应。有别于活性炭对于其他物质的物理吸附,为放热反应。温度升高反而更有利于EC的吸附[15]。PARK等[21]也通过使用活性炭简单过滤降低饮料酒中的EC含量。图6-c显示,当吸附时间>9 h,EC的含量几乎不变。
2.9 活性炭过滤最佳处理工艺
根据表3感官评价结果得出活性炭的最佳添加量为10 g/L;以上不同物质的最适吸附温度不同,综合考虑选择吸附温度为35 ℃;关系到时间成本,确定吸附时间为9 h。表4为原酒样与最佳工艺处理的前后综合指标对比情况。
表4 酒样处理前后综合指标对比
Table 4 Comprehensive comparison parameters of Huangjiu before and after treatment

指标原酒样处理后吸附率/%总酸/(g/L)5.834.2027.96氨基酸态氮/(g/L)0.8760.8582.05酒精度/%vol14.814.24.05杂醇/(mg/L)520.99446.8814.22生物胺/(mg/L)95.5965.8631.10嘌呤/(mg/L)103.4774.8327.78氨基甲酸乙酯/(μg/L)203.38140.8030.77感官得分/分8285
3 结论
实验研究表明,黄酒经过该活性炭过滤吸附后,其中的总酸、杂醇、生物胺、嘌呤、氨基甲酸乙酯均有不同程度的降低。确定了最佳活性炭使用工艺条件为:10 g/L活性炭添加量,35 ℃吸附温度,9 h吸附时间。在此优化条件下,各项指标检测结果显示,总酸从原来的5.83 g/L降低至4.20 g/L,氨基酸态氮损失较少。总杂醇从原来的520.99 mg/L降低至446.88 mg/L,吸附率为14.22%。总生物胺从原来的95.59 mg/L降低至65.86 mg/L,吸附率为31.10%。总嘌呤从原来的103.47 mg/L降低至74.73 mg/L,吸附率为27.78%。氨基甲酸乙酯的含量从原来的203.38 μg/L降低至140.80 μg/L,吸附率为30.77%。活性炭添加量为10 g/L时,吸附率排序为生物胺>氨基甲酸乙酯>嘌呤>杂醇。吸附时间上得出,吸附速率排行为嘌呤>杂醇>生物胺>氨基甲酸乙酯,有可能各物质之间存在竞争吸附的作用。
本试验开发了黄酒后期处理过程中添加活性炭的工艺技术。在尽量保持黄酒色度及原风味骨架的前提条件下,简单高效地去除了不愉悦的异杂味,降低了黄酒生产过程中不可避免产生的非喜好代谢物质,提高了黄酒饮用健康性和舒适性。另外亦可以增大活性炭的添加量,把处理后的黄酒作为一种后期调配基酒使用。
[1] 刘月, 祁国栋, 张炳文.黄酒功能成分的研究进展[J].中国酿造,2015,34(11):27-30.
LIU Y, QI G D, ZHANG B W.Research progress of functional components of Chinese rice wine[J].China Brewing, 2015, 34(11):27-30.
[2] 刘红微, 王耀, 杨玉珍, 等.活性炭在处理酒样过程中的危害分析[J].酿酒,2021,48(5):73-75.
LIU H W, WANG Y, YANG Y Z, et al.Hazard analysis of activated carbon in the treatment of wine samples[J].Liquor Making, 2021,48 (5):73-75.
[3] 周建弟, 蒋予箭, 邹慧君, 等.新旧工艺黄酒发酵过程中主要高级醇的变化研究[J].中国酿造,2012,31(8):29-32.
ZHOU J D, JIANG Y J, ZOU H J, et al.Changes of primary higher alcohols during the traditional and new rice wine fermentation process[J] China Brewing, 2012,31(8):29-32.
[4] 许禄.黄酒酿造过程中生物胺变化规律的研究[D].上海:上海海洋大学,2016.
XU L.Study on the change law of biogenic amines during the brewing process of rice wine[D].Shanghai:Shanghai Ocean University, 2016.
[5] 刘建林, 孙学颖, 辛晓琦, 等.食品中嘌呤的降低方法及低嘌呤产品研究进展[J].食品研究与开发,2020,41(2):179-184.
LIU J L, SUN X Y, XIN X Q, et al.Research progress of methods of purine reduction and low purine products in food[J].Food Research and Development, 2020,41(2):179-184.
[6] 巫景铭, 洪瑞泽, 马丽辉, 等.黄酒生产中氨基甲酸乙酯的监测与控制[J].酿酒,2011,38(3):64-67.
WU J M, HONG R Z, MA L H, et al.Determination and control of ethyl carbamate in the production of rice wine[J].Liquor Making, 2011,38(3):64-67.
[7] 解炜, 肖乃友, 段超, 等.活性炭处理挥发性有机物的研究现状及应用展望[J].煤质技术,2020,35(5):9-15.
XIE W, XIAO N Y, DUAN C, et al.Research status and application prospect of activated carbon treatment of volatile organic compounds[J].Coal Quality Technology, 2020, 35(5):9-15.
[8] 白卫东. 广东客家黄酒中氨基甲酸乙酯及其控制技术研究[D].广州:华南农业大学,2017.
BAI W D.Ethyl carbamate in Guangdong Huangjiu and its control technology[D].Guangzhou:South China Agricultural University, 2017.
[9] 杨佳, 李新生, 耿敬章, 等.黄酒中氨基甲酸乙酯的研究进展[J].中国酿造,2020,39(3):7-11.
YANG J, LI X S, GENG J Z, et al.Research progress on ethyl carbamate of Huangjiu[J].China Brewing, 2020, 39(3):7-11.
[10] 赵慧君, 潘婷, 王想, 等.不同澄清剂对黄酒澄清效果及产品品质影响的研究[J].保鲜与加工,2018,18(5):101-106.
ZHAO H J, PAN T, WANG X, et al.Influences of different clarifying agents on clarification effect and quality of Chinese rice wine[J].Storage and Process, 2018,18(5):101-106.
[11] 王栋, 经斌, 徐岩, 等.中国黄酒风味感官特征及其风味轮的构建[J].食品科学,2013,34(5):90-95.
WANG D, JING B, XU Y, et al.Sensory flavor characteristics of Chinese yellow rice wine and construction of flavor wheel[J].Food Science, 2013, 34(5):90-95.
[12] 王培璇, 毛健, 李晓钟, 等.不同地区黄酒挥发性物质差异性分析[J].食品科学,2014,35(6):83-89.
WANG P X, MAO J, LI X Z, et al.Comparative analysis of volatile components of Chinese rice wines from different areas[J].Food Science, 2014, 35(6):83-89.
[13] 黄桂东, 彭家伟, 钟先锋, 等.半干型绍兴黄酒中主要高级醇含量检测及其香气贡献分析[J].中国酿造,2017,36(10):159-162.
HUANG G D, PENG J W, ZHONG X F, et al.Main higher alcohol contents determination and aroma contribution analysis of semi-dry Shaoxing rice wine[J].China Brewing, 2017, 36(10):159-162.
[14] 刘镇, 张瑛, 郑云峰, 等.离子交换固相萃取-反相高效液相色谱法测定黄酒中游离嘌呤[J].食品与发酵工业,2021,47(11):236-240.
LIU Z, ZHANG Y, ZHENG Y F, et al.Determination of free purines in Huangjiu by ion-exchange solid phase extraction combined with reverse phase high performance liquid chromatography[J].Food and Fermentation Industries, 2021,47(11):236-240.
[15] 刘俊, 赵光鳌, 徐岩.黄酒中氨基甲酸乙酯直接减除技术的研究[J] 食品与生物技术学报.2012, 31(2): 171-176.
LIU J, ZHAO G G, XU Y.Directly removal of ethyl carbamate in Chinese rice wine[J].Journal of Food Science and Biotechnology, 2012, 31(2): 171-176.
[16] 王国安.基于酒用活性炭的酒尾异杂味去除方法研究[J].现代食品,2019(11):81-83.
WANG G A.Study on removal method of odour from liquor tail based on activated carbon for liquor[J].Modern Food, 2019(11):81-83.
[17] 潘慧青.黄酒中氨基酸态氮的来源及酿造工艺的影响[D].无锡:江南大学,2015.
PAN H Q.Source of amino acid nitrogen in yellow rice wine and the influence of brewing technology[D].Wuxi:Jiangnan University, 2015.
[18] SIDORENKO I G, MARKITAN O V, VLASOVA N N, et al.The adsorption of biogenic amines on carbon nanotubes[J].Russian Journal of Physical Chemistry A, 2009, 83(6):1002-1005.
[19] 王海容, 付大友, 王蓉.吸附剂对啤酒中嘌呤类物质吸附的研究[J].酿酒科技,2009(9):50-54.
WANG H R, FU D Y, WANG R.Research on the absorption of purine compounds in beer by absorbents[J].Liquor-Making Science &Technology, 2009(9):50-54.
[20] 毛玉涛, 王明力, 张洪, 等.吸附剂对豆浆中嘌呤物质的吸附[J].食品与机械,2012,28(6):47-49;54.
MAO Y T, WANG M L, ZHANG H, et al.Research on adsorption of purine compounds in soybean milk by sorbents[J].Food and Machinery, 2012,28(6):47-49;54.
[21] PARK S R,HA S D,YOON J H,et al.Exposure to ethyl carbamate in alcohol drinking and nondrinking adults and its reduction by simple charcoal filtration[J].Food Control, 2009, 20(10):946-952.