微生物细胞表面不仅是胞内物质与胞外环境之间的边界,也是胞内与胞外通信、分子识别及交换场所[1]。因此,细胞表面工程是微生物学研究与应用中最具吸引力的领域之一。1985年,SMITH最先报道将外源DNA片段插入到丝状噬菌体基因Ⅲ中,表达的融合蛋白被展示在病毒颗粒表面,而不影响噬菌体的感染能力,由此开启了表面展示技术的发展[2]。表面展示技术可以将靶蛋白直接或间接地定向表达于微生物表面,展示的靶蛋白仍具备相对独立的生物活性和空间构型,被广泛用于疫苗和抗体开发、蛋白定向进化、生物传感器、生物吸附、生物转化、全细胞催化剂制备等方面[3]。
目前,病毒、细菌、酵母菌以及丝状真菌等微生物表面展示系统相继建立和发展。由于病毒和原核细胞展示系统缺乏蛋白质翻译后的加工机制,部分细菌和丝状真菌会产生内毒素等[4],限制了以上种类的表面展示技术在其食品和药品等领域中的应用。酵母菌作为单细胞真核宿主,易于进行遗传学操作,能够实现重组蛋白正确折叠和糖基化等翻译后修饰,可以利用廉价底物进行生物转化和高密度培养。通过酵母表面展示技术能将功能酶锚定表达在酵母细胞表面制备全细胞催化剂,无需额外的纯化和固定化操作,且与游离酶相比具有更好的温度、pH值和有机溶剂稳定性,可以重复循环利用[5]。因此,与其他微生物表面展示系统相比,酵母展示系统更适合在食品领域应用。
本文对酵母表面展示技术的原理及其应用进展进行了概述,包括改善传统发酵食品品质、改进发酵生产过程、发酵生产功能食品等方面;并展望了酵母表面展示技术的未来发展方向,以期为食品发酵技术革新和工业化应用提供参考。
1 酵母表面展示技术原理
酵母菌的细胞壁主要由甘露糖蛋白和β-葡聚糖组成,还含有少量几丁质。以酿酒酵母(Saccharomyces cerevisiae)为例,细胞壁分为内外2层(图1)。内层是由β-1,3-葡聚糖和几丁质构成的骨架,提供细胞壁的强度,骨架的侧链成分为β-1,6-葡聚糖。外层是刷状的甘露糖蛋白层,甘露糖蛋白与大多数的细胞表面特性相关联。甘露糖蛋白被高度糖基化,直接或间接与β-1,3-葡聚糖骨架相连[6](图1)。
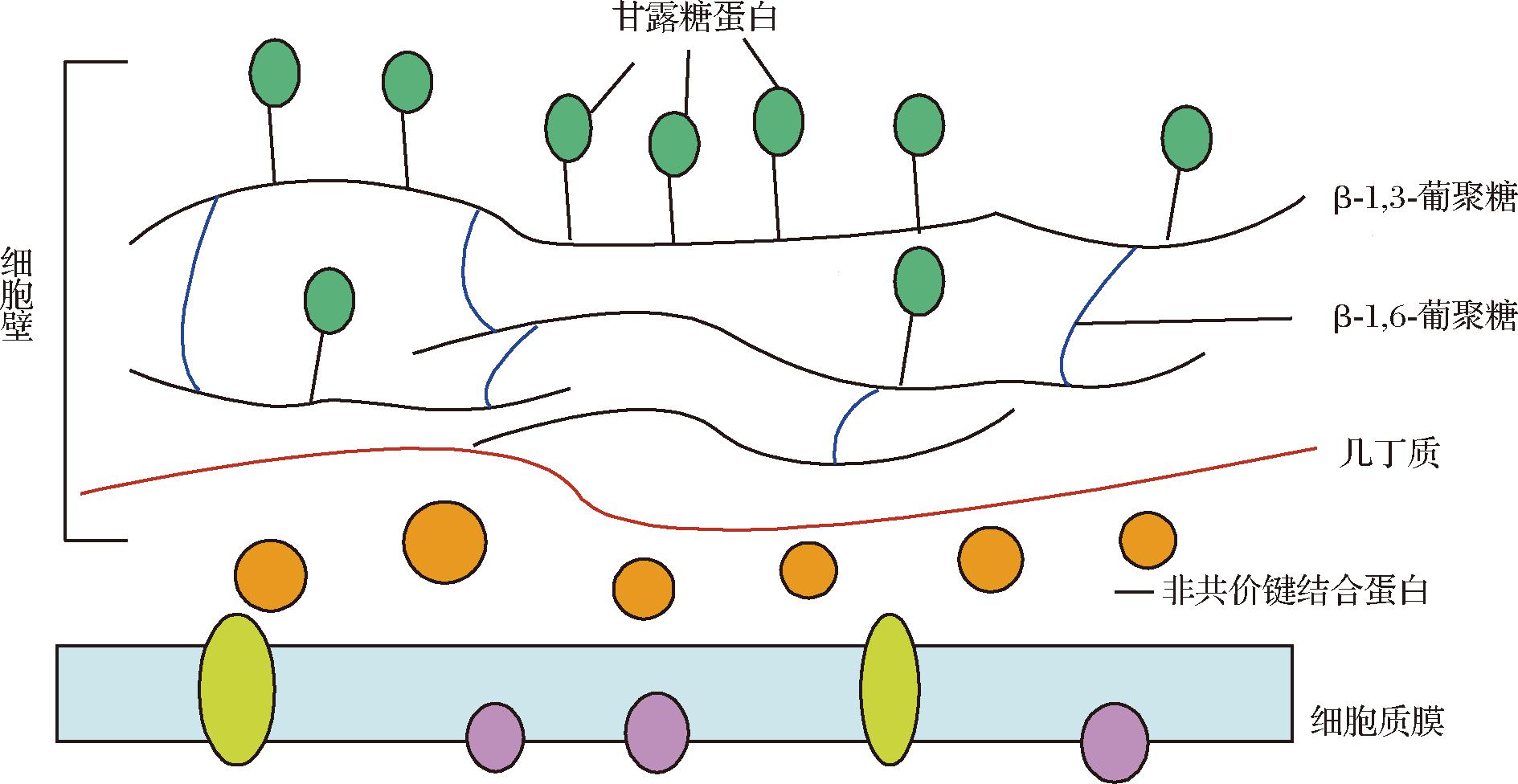
图1 酵母细胞壁结构示意图
Fig.1 Cell wall structure of yeast
酵母表面展示系统的三要素是宿主、锚定蛋白和靶蛋白。位于酵母细胞表面的细胞壁蛋白或细胞膜蛋白是酵母表面展示系统的备选锚定蛋白。锚定蛋白通常含有信号肽和锚定结构域,靶蛋白与锚定蛋白“融合”表达后,信号肽将引导融合蛋白向细胞表面运输,锚定结构域使融合蛋白固定在宿主细胞表面[7]。锚定蛋白的选择对靶蛋白展示的成功率和效率起到关键作用。目前已被广泛应用的酵母表面展示锚定蛋白主要是三类细胞壁蛋白(图2)。第一类锚定蛋白以非共价键与细胞壁结合,通过简单的SDS抽提即可获得,如具有絮凝功能的Flo1p等。由于Flo1p的锚定结构域位于N端,靶蛋白的融合方式为C端融合。第二类锚定蛋白是通过糖基磷脂酰肌醇(glycosylphosphatidylinositol,GPI)锚与细胞壁结合的GPI型蛋白,如Cwp1p、Cwp2p、Tip1p、Sed1p、α-凝集素等[8]。GPI型蛋白与β-1,6-葡聚糖侧链连接,间接连接到β-1,3-葡聚糖骨架上,需经过β-葡聚糖酶的消化才可获得。GPI型蛋白的锚定结构域在C端,靶蛋白的融合方式为N端融合。其中,由Aga1p和Aga2p组成的a-凝集素锚定系统比较特殊,Aga1p的C端具有GPI锚定结构与细胞壁共价结合,Aga2p与Aga1p通过二硫键连接,靶蛋白与Aga2p的C端或N端融合展示在酵母细胞表面。第三类锚定蛋白为内部重复蛋白(protein with internal repeats,PIR型蛋白),如Pir1p~Pir4p等。该类型蛋白与前2种锚定模式不同,其通过N端重复序列可以与细胞壁中的β-1,3-葡萄糖形成酯键连接,也可以利用C端半胱氨酸残基通过二硫键附着在细胞壁的特定组分上,还可以同时利用2种锚定结构域进行插入型融合[9]。
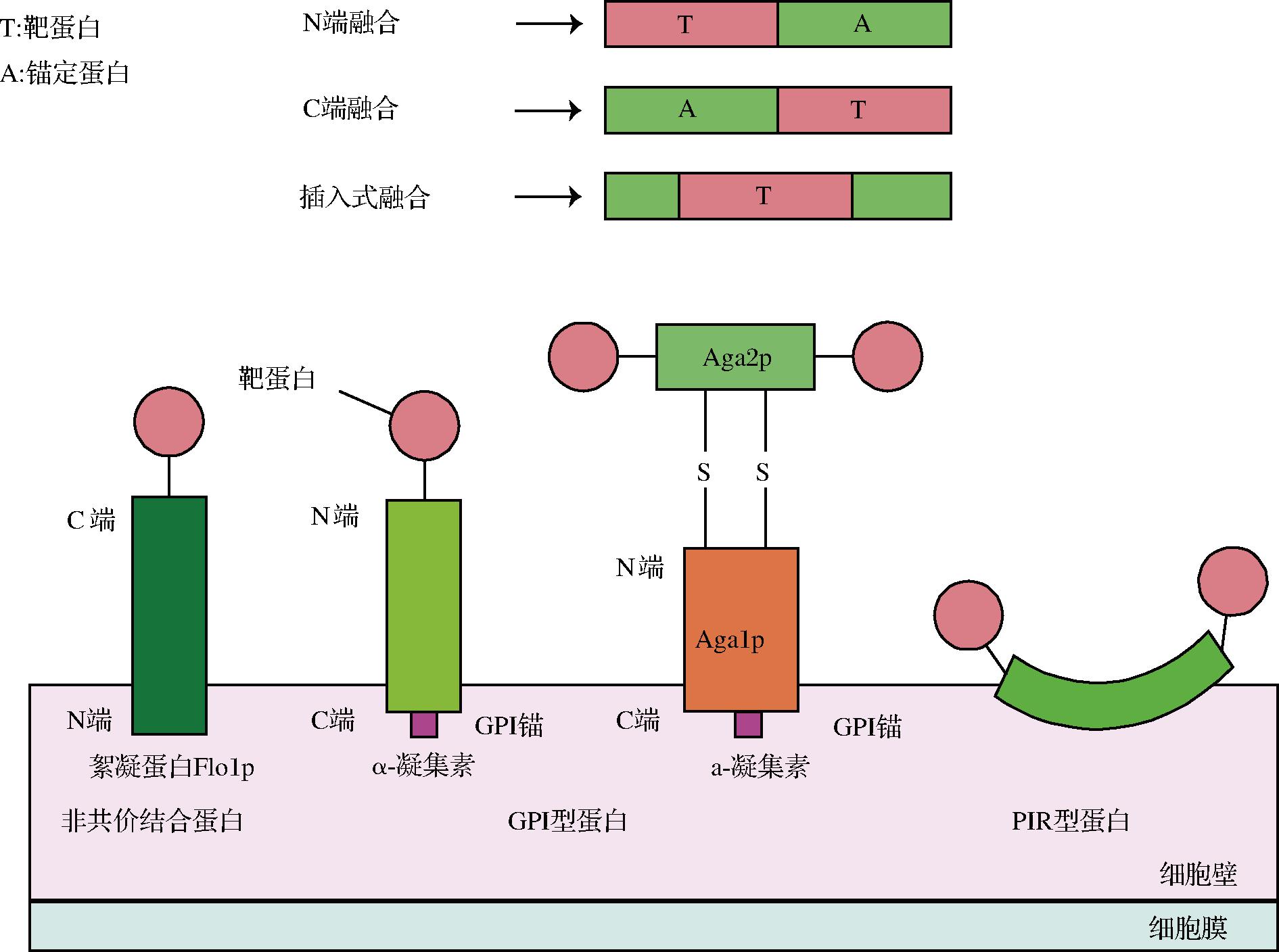
图2 常用锚定蛋白和锚定方式
Fig.2 Commonly used anchoring proteins and anchoring methods
2 酵母表面展示技术的应用研究进展
2.1 改善传统发酵食品品质
2.1.1 在葡萄酒酿造领域的应用
葡萄酒的风味前体物质大多数以无气味的糖苷形式存在,可被β-D-葡萄糖苷酶(EC 3.2.1.21)等糖苷酶水解后释放香气。在葡萄酒酿造过程中添加以上商业酶制剂或固定化酶可以对增进葡萄酒的风味,但成本较高,且稳定性较差[10]。ZHANG等[11]将来源于黑曲霉(Aspergillus niger)的β-D-葡萄糖苷酶展示在酿酒酵母细胞表面,通过优化载体、启动子、锚定蛋白以及转录融合伴侣等策略实现了β-D-葡萄糖苷酶的高效稳定展示。采用了3种锚定蛋白(Sag1p、Sed1p、Cwp2p)。其中Sag1p的锚定能力最强,全细胞酶活力最高达到(74.58±5.88) U/g。重组全细胞酶对香气糖苷的水解能力是商业酶制剂AR2000的2.1倍。同时探索了葡萄酒发酵环境因素对全细胞酶活力的影响。
葡萄酒中的有机酸会显著影响口感,苹果酸和酒石酸占葡萄酒总酸的70%~90%,降低苹果酸的含量十分必要[12]。酿酒酵母缺乏转化苹果酸的酶系,需由乳酸菌主导进行苹果酸-乳酸发酵过程,将苹果酸转化为乳酸和二氧化碳[13]。ZHANG等[14]将来源于酒酒球菌(Oenococcus oeni)的苹果酸乳酸酶(malolactic enzyme,MLE)在酿酒酵母细胞表面展示。锚定蛋白为α-凝集素的C端结构域。所构建的全细胞酶与苹果酸反应12 h后,可将21.11%的苹果酸转化为乳酸,可用于在葡萄酒发酵过程中同时进行乙醇发酵和苹果酸转化过程。
过量的铜离子会导致葡萄酒氧化褐变,也会影响酿酒酵母的活性。目前主要解决铜过量的方法是添加“下胶剂”去除。黄蓉等[15]将内源金属硫蛋白在酿酒酵母细胞表面展示,锚定蛋白选用C末端结合的絮凝蛋白Flo1p。构建的二倍体展示菌株重金属耐受性得到提高,可以作为吸附葡萄酒中铜离子的全细胞催化剂。
白葡萄酒中的非稳定蛋白质会发生沉淀现象,会影响其风味和感官特性。黄蓉等[16]将来源于宇佐美曲霉(Aspergillus usamii)的酸性蛋白酶展示在酿酒酵母细胞表面,选用Sed1p为锚定蛋白。分别构建了单倍体和二倍体的重组菌株,最高酶活力达到495.24 U/mL。可作为改善白葡萄酒介质低pH值条件下蛋白稳定性的全细胞催化剂。
2.1.2 在啤酒发酵领域的应用
在啤酒酿造过程中,异亮氨酸-缬氨酸途径的中间体α-乙酰乳酸会被转化成双乙酰,当双乙酰含量超过0.15 mg/L时,就会有类似馊饭的气味,影响啤酒的风味。所以,双乙酰含量高低成为衡量啤酒质量的重要标志之一。研究发现,在啤酒生产中添加α-乙酰乳酸脱羧酶(α-acetolactate decarboxylase,ALDC)可以将α-乙酰乳酸分解成3-羟基-2-丁酮和二氧化碳,有效地降低双乙酰含量,缩短酿造周期进而大幅降低生产成本[17]。然而,使用商业ALDC制剂将使该过程成本更高,且异源酶将留在啤酒中。CEJNAR等[18]选用α-凝集素的C末端结构域作为锚定蛋白,将有纹膜醋酸菌(Acetobeαcer αceti)的ALDC展示到酿酒酵母表面,构建了全细胞催化剂,能够消除发酵麦芽汁中双乙酰的积累,发酵7 d后,麦芽汁中几乎不存在双乙酰。
β-葡聚糖是啤酒发酵原料大麦和燕麦等的细胞壁主要成分之一。在酿造过程中,高浓度的β-葡聚糖会导致啤酒粘度高,形成凝胶状沉淀,降低麦芽汁产量,影响啤酒的品质。啤酒中与β-葡聚糖相关的问题可以通过在麦芽生产、发酵中添加商用β-1,3-1,4-葡聚糖酶来缓解[19]。GUO等[20]构建了具有双向启动子的食品级表面展示系统,将枯草芽孢杆菌(Bacillus subtilis)β-1,3-1,4-葡聚糖酶基因与α-凝集素锚定基因融合,在半乳糖激酶1(GAL1)启动子的调控下表达融合基因。磷酸甘油酸激酶1(PGK1)启动子诱导α-半乳糖苷酶表达作为食品级选择标记。在含有蜜二糖作为唯一碳源的培养基中,诱导32 h后重组菌株YGMPNA-PM的全细胞酶酶活力达到45.1 U/mL。与游离酶相比,重组全细胞酶的热稳定性增强。这些结果表明,利用构建的食品级β-1,3-1,4-葡聚糖酶表面展示酵母重组菌株进行啤酒发酵具有改善啤酒酿造过程的潜力。
综上,在葡萄酒和啤酒酿造领域,酵母表面展示系统的宿主细胞大多是酿造菌株酿酒酵母,展示载体选用食品级的筛选标记,靶蛋白是能够提升酒品品质的关键功能酶,如增进风味的糖苷酶、提高酒品澄清度的沉淀分解酶等。单一功能的全细胞酶应用较为广泛,应用时需要确定在酿造胁迫因子(高浓度糖、乙醇以及低pH值)存在下的全细胞酶稳定性。
2.2 简化发酵生产过程
低聚果糖(fructooligosaccharides,FOS)一种优良的水溶性膳食纤维。已被用于治疗人类遗传性肥胖和单纯性肥胖[21]。FOS的大规模生产涉及利用游离或固定化的果糖基转移酶转化蔗糖,副产物为葡萄糖、果糖和残余蔗糖,方法昂贵且耗时。ZHANG等[22]将来源于米曲霉(Aspergillus oryzae)的果糖基转移酶展示在可产赤藓糖醇的解脂亚罗维亚酵母(Yarrowia lipolytica)细胞表面,以PIR型细胞壁蛋白Pir1p作为锚定蛋白。全细胞酶转化蔗糖制造低聚果糖的生产强度为160 g/(L·h),可重复使用10次以上。高浓度、低附加值的FOS副产物(葡萄糖和果糖)可同时被全细胞酶利用生产赤藓糖醇,这种大规模生产FOS的高效方法极具应用价值。
低聚半乳糖(galactooligosaccharides,GOS)与人乳中的乳寡糖(human milk oligosaccharides,HMOs)在结构和功能上具备一定的相似性[23],可以促进肠道有益细菌增殖、预防感染和提高免疫力等[24]。目前,工业上使用具有半乳糖基转移酶活性的β-半乳糖苷酶以乳糖为原料生产GOS。通常是四阶段的过程,即酶的生产、纯化、固定化和转化,既耗时又昂贵。因此,有必要开发易于操作的GOS生产工艺。在赤藓糖醇发酵行业中,副产物废弃酵母泥由于处理不当而引发严重的环境问题。AN等[25]将来源于米曲霉的β-半乳糖苷酶展示到生产赤藓糖醇的解脂亚罗维亚酵母细胞表面,锚定蛋白为Pir1p。将表面展示β-半乳糖苷酶的废酵母泥作为全细胞催化剂以乳糖为原料二次发酵生产低聚半乳糖。在pH值为5.5和60 ℃条件下,以起始细胞浓度为5 g/L CDW时,6 h内将500 g/L乳糖转化为160 g/L GOS,转化率为51%,酵母泥可以循环使用10次以上。全细胞酶的最佳反应温度比游离酶高约20 ℃,转化效率远高于游离酶,与其他方式的固定化酶效率相近。
低聚异麦芽糖(isomalto-oligosaccharides,IMOs)是聚合度为2~10的多聚葡萄糖混合物,是一种性质优良的益生元。由酶转化的IMOs聚合度通常为2~4,包括异麦芽糖、潘糖、异麦芽三糖和异麦芽四糖等[26]。目前工业上采用多酶协同法由淀粉经过液化(耐热α-淀粉酶)→糖化(真菌α-淀粉酶或β-淀粉酶)→转苷(α-葡萄糖苷酶)三步法合成低聚异麦芽糖,步骤繁琐、成本较高。因此开发更加经济简便的方法生产IMOs具有重要的应用价值[27]。刘大文等[28]将来源于热硫嗜热厌氧杆菌(Thermoanaerobacterium thermosulfurigenes)的耐热β-淀粉酶和来源于黑曲酶的耐热α-葡萄糖转苷酶进行顺序连接,共同展示在解脂亚罗维亚酵母细胞表面,锚定蛋白选用Pir1p。50 ℃条件下,全细胞酶利用液化的淀粉可一步法转化合成纯度为75.3%的IMOs。钱玲等[29]将来源于褐色嗜热裂孢菌(Thermobifida fusca)的麦芽三糖生成酶展示到毕赤酵母GS115细胞表面,锚定蛋白选用GPI型细胞壁蛋白Gcw61p。全细胞酶活力可达到260 U/g,且热稳定性较好,重复利用3次后仍有80%的活性,可将30%麦芽糊精酶解为麦芽三糖,转化率为60.13%。将展示麦芽三糖生成酶的全细胞酶加入到利用淀粉制备IMOs的糖化反应中,可为黑曲霉α-葡萄糖苷酶提供更多的麦芽三糖底物,有利于IMOs总产量的提高,且低聚异麦芽糖组分更加丰富。
异麦芽酮糖是蔗糖的一种结构异构体。作为替代蔗糖的替代品,异麦芽酮糖无毒性,是公认安全的甜味剂,具有较低的升糖指数,且不能被口腔中的致龋细菌利用,适合用于各种食品和饮料的添加。由于其化学合成的复杂性,酶生物转化法是生产异麦芽酮糖的首选方法[30]。蔗糖异构酶(sucrose isomerase,EC 5.4.99.11)可将蔗糖生物转化为异麦芽酮糖。LEE等[31]将来源于肠杆菌属(Enterobacter sp.)FMB-1菌株的蔗糖异构酶展示在酿酒酵母EBY100菌株的细胞表面,使用Aga2p作为锚定蛋白。与在大肠杆菌中表达的重组游离酶相比,展示的全细胞酶热稳定性显著增强。在不同底物浓度范围(50~250 mmol/L)下,蔗糖转化为异麦芽酮糖的转化率为6.4%~7.4%。
海藻糖可以防止蛋白质或氨基酸产生美拉德反应,是最为常用的食品添加剂[32]。海藻糖合成酶可以通过从低成本底物麦芽糖一步转化合成海藻糖[33]。LI等[34]将嗜热古菌(Pictrophilus torridus)的海藻糖合酶基因展示到解脂亚罗维亚酵母细胞表面,锚定蛋白选用Pir1p。在最佳的发酵条件下,海藻糖的产率达到73%,与从重组大肠杆菌中纯化的游离酶相比,展示的全细胞酶的热稳定性和pH稳定性得到了改善。YANG等[35]将来源于恶臭假单胞菌(Pseudomonas putida)的海藻糖合成酶基因与锚定蛋白Pir1p融合展示在巴斯德毕赤酵母GS115细胞表面。在5 L发酵罐中发酵150 h,重组全细胞酶活力达到1 109 U/g,展示细胞以麦芽糖浆作为底物生产海藻糖转化率超过60%,在循环使用3次后仍具有较高的催化活性。研究结果表明,采用全细胞催化剂一步法发酵麦芽糖生产海藻糖是经济、有效的途径,适合大规模的工业化生产。
综上,利用微生物发酵和酶法工艺进行低聚糖的生产是该领域的发展趋势。表面展示功能酶的全细胞催化剂在活性和稳定性方面显著高于游离酶和固定化酶,可多次重复利用,在大规模的工业生产中具有较大的应用潜力。
2.3 生产高值和增值食品
长链多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)对大脑和神经系统发育至关重要。二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)是功能脂肪酸中的主要活性成分。从鱼油、海藻油和渔业副产品等含有PUFA的原料中富集DHA或EPA成为一个重要的研究领域。采用化学方法提取和浓缩PUFA对脂肪酸没有选择性,并且消耗大量能量[36]。利用脂肪酶(三酰甘油酰基水解酶,EC 3.1.1.3)催化的选择性水解是生产PUFA浓缩物的一种简单高效的方法。PAN等[37]将来源于地霉属(Geotrichum sp.)的脂肪酶在巴斯德毕赤酵母细胞表面展示,锚定蛋白选用酿酒酵母的a-凝集素的N端结构域。在30 ℃下培养96 h后,全细胞酶水解橄榄油的活性达到(273±2.4) U/g。在选择性水解的基础上进行生物转化富集,EPA和DHA从原始鱼油中的1.53%和24.1%增加到1.85%和30.86%,分别增加了1.21和1.29倍。EPA和DHA的总收率达到46.62%。XU等[38]使用源自酿酒酵母的a-凝集素作为锚定蛋白,将皱纹假丝酵母脂肪酶展示在巴斯德毕赤酵母细胞表面。展示的全细胞酶与游离酶相比,热稳定性更高,对橄榄油的水解活性最高达到(380±2.8) U/g。从海藻油中富集DHA,在最佳条件下发酵96 h后,DHA的含量从原始藻油中的40.61%提高到50.44%,产量增加了1.24倍。该研究是从海藻油中提取DHA的首次报道。
磷脂酰丝氨酸(phosphatidylserine,PS)是一种具有改善记忆、预防阿尔茨海默症、缓解抑郁和减少压力的功能性食品添加剂。PS可以从动物器官、大豆、蛋黄、植物油等生物质中提取,但其获得效率较低,限制了工业规模生产[39]。磷脂酶D(phospholipase D,EC.3.1.4.4)可以催化磷脂酰胆碱与L-丝氨酸的转磷酰化反应制备PS,其催化具有反应条件温和、环境友好、易于工业化生产等优点。LIU等[40]将来源于褐色链霉菌(Streptomyces chromofuscus)磷脂酶D基因pldsh进行密码子优化后在巴斯德毕赤酵母GS115细胞表面进行过表达展示,锚定蛋白选用细胞壁蛋白Flo1p。与游离酶比,展示的全细胞酶的热稳定性、酸稳定性和有机溶剂耐受性显著增强。在最佳条件下使用水相体系,全细胞酶可将67.5%的磷脂酰胆碱转化为PS,经过7次分批循环后,PS的转化率仍保持在50%以上。LIU等[41]将来源于色粘链霉菌(Streptomyces halstedii)的磷脂酶D与锚定蛋白Flo1p絮凝功能结构域融合表达,展示在巴斯德毕赤酵母GS115细胞表面,制备利用磷脂酰胆碱和L-丝氨酸合成PS的全细胞生物催化剂。全细胞酶在较宽的温度(20~60 ℃)和pH值(4.0~8.0)范围内稳定。在最佳工艺条件下,PS的转化率为53%,全细胞酶在水相体系中催化4次后产率仍保持在40%以上。
表1 酵母表面展示技术在食品发酵领域的应用
Table 1 Application of yeast surface display technology in food fermentation
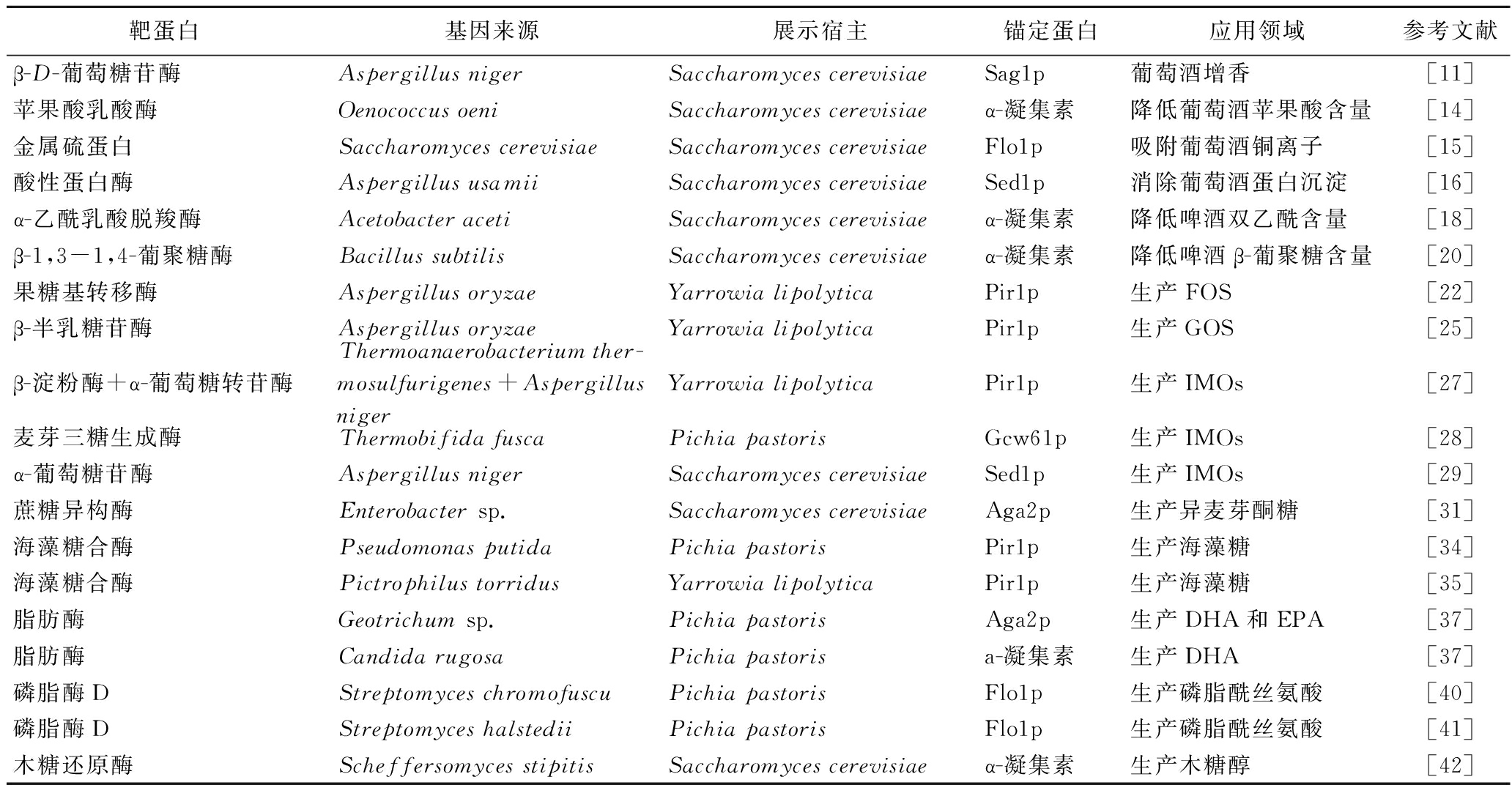
靶蛋白基因来源展示宿主锚定蛋白应用领域参考文献β-D-葡萄糖苷酶Aspergillus nigerSaccharomyces cerevisiaeSag1p葡萄酒增香[11]苹果酸乳酸酶Oenococcus oeniSaccharomyces cerevisiaeα-凝集素降低葡萄酒苹果酸含量[14]金属硫蛋白Saccharomyces cerevisiaeSaccharomyces cerevisiaeFlo1p吸附葡萄酒铜离子[15]酸性蛋白酶Aspergillus usamiiSaccharomyces cerevisiaeSed1p消除葡萄酒蛋白沉淀[16]α-乙酰乳酸脱羧酶Acetobacter acetiSaccharomyces cerevisiaeα-凝集素降低啤酒双乙酰含量[18]β-1,3-1,4-葡聚糖酶Bacillus subtilisSaccharomyces cerevisiaeα-凝集素降低啤酒β-葡聚糖含量[20]果糖基转移酶Aspergillus oryzaeYarrowia lipolyticaPir1p生产FOS[22]β-半乳糖苷酶Aspergillus oryzaeYarrowia lipolyticaPir1p生产GOS[25]β-淀粉酶+α-葡萄糖转苷酶Thermoanaerobacterium ther-mosulfurigenes+Aspergillus nigerYarrowia lipolyticaPir1p生产IMOs[27]麦芽三糖生成酶Thermobifida fuscaPichia pastorisGcw61p生产IMOs[28]α-葡萄糖苷酶Aspergillus nigerSaccharomyces cerevisiaeSed1p生产IMOs[29]蔗糖异构酶Enterobacter sp.Saccharomyces cerevisiaeAga2p生产异麦芽酮糖[31]海藻糖合酶Pseudomonas putidaPichia pastorisPir1p生产海藻糖[34]海藻糖合酶Pictrophilus torridusYarrowia lipolyticaPir1p生产海藻糖[35]脂肪酶Geotrichum sp.Pichia pastorisAga2p生产DHA和EPA[37]脂肪酶Candida rugosaPichia pastorisa-凝集素生产DHA[37]磷脂酶DStreptomyces chromofuscuPichia pastorisFlo1p生产磷脂酰丝氨酸[40]磷脂酶DStreptomyces halstediiPichia pastorisFlo1p生产磷脂酰丝氨酸[41]木糖还原酶Scheffersomyces stipitisSaccharomyces cerevisiaeα-凝集素生产木糖醇[42]
木糖醇是一种由D-木糖衍生的甜味剂,广泛应用于食品行业。以木质纤维素废料生产木糖醇是一种可以显著降低其生产成本的方法。GUIRIMAND等[42]将木糖还原酶(XR)、β-葡萄糖苷酶(BGL)、木糖苷酶(XYL)和木聚糖酶(XYN)等展示在酿酒酵母YPH499菌株表面。使用全细胞酶以稻草水解液直接生产木糖醇,发酵过程不需要添加任何商业酶。稻草水解液中所含的木糖中以79.5%的理论产率转化为5.8 g/L的木糖醇。此外,稻草水解物发酵过程中同时进行纳滤分离以去除其中的发酵抑制剂,促进了高浓度木糖醇的生产(37.9 g/L)。此项研究是酵母细胞表面技术和膜分离技术相结合生产木糖醇的首次报道,可进一步的扩展到工业应用中去。
综上,酵母菌的底物利用范围大、环境适应能力强。酵母全细胞催化剂能将可以利用的天然廉价底物转化为高值产品。单独催化元件的表面展示可能具有一定局限性,对全细胞催化剂进行多基因、多组分的网络重构分析具有很好的工业应用前景。
3 结论与展望
酵母表面展示技术对于食品发酵工业产生了多方面的影响。在发酵产物方面,酵母表面展示技术可以通过重新设计传统的发酵食品生产过程,从而生产新颖的产品或避免合成副产品提高产品品质。在发酵过程方面,酵母表面展示技术可以传统的发酵食品生产方式,集成多步催化过程,构建“细胞工厂”提高资源转化效率。在发酵原料方面,酵母表面展示技术可以扩大食品发酵的反应底物范围,将廉价的原料转化为更有价值的目标产品,可以实现可再生原料或低值原料的高值利用[43]。
然而,酵母表面展示技术在食品发酵领域的应用仍有许多问题需要解决。在宿主选择方面,目前已广泛应用的展示宿主仅为酿酒酵母、巴斯德毕赤酵母、解脂亚罗维亚酵母等有限的种类。作为公认安全的乳酸克鲁维酵母、马克斯克鲁维酵母、布拉氏酵母等其他酵母表面展示系统的建立已见报道,但仍未被进一步开发及利用,食品级宿主资源还需进一步挖掘。在靶蛋白选择方面,选用展示单酶进行简单催化反应的实际应用场景较多,从单酶到多酶共展示协同发酵技术是今后的研究和开发方向。在锚定蛋白选择方面,选用单一锚定蛋白进行直接展示是一种比较简洁方便的方法,有利于工业的生产。然而对于分子质量较大结构复杂难以直接展示的蛋白,可能需要通过间接展示的方式来实现[44]。深入研究酵母细胞结构,开发新的锚定方式将有利于酵母表面展示技术的发展。尽管存在问题,但是随着酵母展示技术的不断完善和改进,能科学地指导传统发酵产业的升级,在食品领域发挥越来越重要的作用。
[1] RAEESZADEH-SARMAZDEH M, BODER E T.Yeast surface display:New opportunities for a time-tested protein engineering system[J].Methods in Molecular Biology, 2022, 2491:3-25.
[2] SMITH G P.Filamentous fusion phage:Novel expression vectors that display cloned antigens on the virion surface[J].Science, 1985, 228(4705):1315-1317.
[3] SHIBASAKI S, UEDA M.Progress of molecular display technology using Saccharomyces cerevisiae to achieve sustainable development goals[J].Microorganisms, 2023, 11(1):125.
[4] URBAR-ULLOA J, MONTA O-SILVA P, RAM
O-SILVA P, RAM REZ-PELAYO A S, et al.Cell surface display of proteins on filamentous fungi[J].Applied Microbiology and Biotechnology, 2019, 103(17):6949-6972.
REZ-PELAYO A S, et al.Cell surface display of proteins on filamentous fungi[J].Applied Microbiology and Biotechnology, 2019, 103(17):6949-6972.
[5] ZHANG C M, CHEN H Y, ZHU Y P, et al.Saccharomyces cerevisiae cell surface display technology:Strategies for improvement and applications[J].Frontiers in Bioengineering and Biotechnology, 2022, 10:1056804.
[6] INOKUMA K, KITADA Y, BAMBA T, et al.Improving the functionality of surface-engineered yeast cells by altering the cell wall morphology of the host strain[J].Applied Microbiology and Biotechnology, 2021, 105(14-15):5895-5904.
[7] YE M Q, YE Y Q, DU Z J, et al.Cell-surface engineering of yeasts for whole-cell biocatalysts[J].Bioprocess And Biosystems Engineering, 2021, 44(6):1003-1019.
[8] REKSTINA V V, BYKOVA A A, ZIGANSHIN R H, et al.GPI-modified proteins non-covalently attached to Saccharomyces cerevisiae yeast cell wall[J].Biochemistry (Moscow), 2019, 84(12):1513-1520.
[9] TEYMENNET-RAM REZ K V, MART
REZ K V, MART NEZ-MORALES F, TREJO-HERN
NEZ-MORALES F, TREJO-HERN NDEZ M R.Yeast surface display system:strategies for improvement and biotechnological applications[J].Frontiers in Bioengineering and Biotechnology, 2022, 9:794742.
NDEZ M R.Yeast surface display system:strategies for improvement and biotechnological applications[J].Frontiers in Bioengineering and Biotechnology, 2022, 9:794742.
[10] 张阳. 酿酒酵母高效表面展示β-葡萄糖苷酶提高葡萄酒香气的研究[D].杨凌:西北农林科技大学, 2019.
ZHANG Y.Efficient display of β-glucosidase on Saccharomyces cerevisiae cell wall for aroma enhancement in wine[D].Yangling:Northwest A&F University, 2019.
[11] ZHANG Y, MIN Z, QIN Y, et al.Efficient display of Aspergillus niger β-glucosidase on Saccharomyces cerevisiae cell wall for aroma enhancement in wine[J].Journal of Agricultural and Food Chemistry, 2019, 67(18):5169-5176.
[12] SUMBY K M, BARTLE L, GRBIN P R, et al.Measures to improve wine malolactic fermentation[J].Applied Microbiology and Biotechnology, 2019, 103(5):2033-2051.
[13] NETO R, MOTA M J, LOPES R P, et al.Growth and metabolism of Oenococcus oeni for malolactic fermentation under pressure[J].Letters In Applied Microbiology, 2016, 63(6):426-433.
[14] ZHANG X, HOU X, LIANG F, et al.Surface display of malolactic enzyme from Oenococcus oeni on Saccharomyces cerevisiae[J].Applied Biochemistry and Biotechnology, 2013, 169(8):2350-2361.
[15] 黄蓉, 吕林灿, 李莹, 等.酿酒酵母表面展示金属硫蛋白吸附葡萄酒中的铜离子[J].中国食品学报, 2022, 22(7):31-39.
HUANG R, LYU L C, LI Y, et al.The adsorption of copper ions in wine by displaying metallothionein on the surface of Saccharomyces cerevisiae[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(7):31-39.
[16] 黄蓉, 董超, 余鸿飞, 等.酿酒酵母表面展示技术表达酸性蛋白酶[J].中国食品学报, 2022, 22(2):114-122.
HUANG R, DONG C, YU H F, et al.Expression of acid protease using surface display technology of Saccharomyces cerevisiae[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(2):114-122.
[17] COSTA G P, SPOLIDORO L S, MANFROI V, et al.α-Acetolactate decarboxylase immobilized in chitosan:A highly stable biocatalyst to prevent off-flavor in beer[J].Biotechnology Progress, 2022, 38(6):e3295.
[18] CEJNAR R, HLOŽKOV K, KOTRBA P, et al.Surface-engineered Saccharomyces cerevisiae displaying alpha-acetolactate decarboxylase from Acetobacter aceti ssp xylinum[J].Biotechnology Letters, 2016, 38(12):2145-2151.
K, KOTRBA P, et al.Surface-engineered Saccharomyces cerevisiae displaying alpha-acetolactate decarboxylase from Acetobacter aceti ssp xylinum[J].Biotechnology Letters, 2016, 38(12):2145-2151.
[19] 郭钦, 阮晖, 张伟, 等.酿酒酵母表面展示表达的β-1,3-1,4-葡聚糖酶酶学性质研究[J].中国食品学报, 2014, 14(5):26-31.
GUO Q, RUAN H, ZHANG W, et al.Studies on the properties of displayed β-1,3-1,4-glucanase on the yeast cell[J].Journal of Chinese Institute of Food Science and Technology, 2014, 14(5):26-31.
[20] GUO Q, ZHANG W, MA L L, et al.A food-grade industrial arming yeast expressing beta-1,3-1,4-glucanase with enhanced thermal stability[J].Journal of Zhejiang University SCIENCE B, 2010, 11(1):41-51.
[21] DOU Y Q, YU X, LUO Y L, et al.Effect of fructooligosaccharides supplementation on the gut microbiota in human:A systematic review and meta-analysis[J].Nutrients, 2022, 14(16):3298.
[22] ZHANG L B, AN J, LI L J, et al.Highly efficient fructooligosaccharides production by an erythritol-producing yeast Yarrowia lipolytica displaying fructosyltransferase[J].Journal of Agricultural and Food Chemistry, 2016, 64(19):3828-3837.
[23] 安瑾. 解脂耶氏酵母表面展示β-半乳糖苷酶合成低聚半乳糖[D].上海:上海交通大学, 2016.
AN J.Cell surface-displaying the β-galactosidase on Yarrowia lipolytica:A new approach to synthesizing galactooligosaccharides[D].Shanghai: Shanghai Jiao Tong University, 2016.
[24] QIU S T, CHEN J J, BAI Y, et al.GOS ameliorates nonalcoholic fatty liver disease induced by high fat and high sugar diet through lipid metabolism and intestinal microbes[J].Nutrients, 2022, 14(13):2749.
[25] AN J, ZHANG L B, LI L J, et al.An alternative approach to synthesizing galactooligosaccharides by cell-surface display of β-galactosidase on Yarrowia lipolytica[J].Journal of Agricultural and Food Chemistry, 2016, 64(19):3819-3827.
[26] 王框. 表面展示α-葡萄糖苷酶毕赤酵母的固定及其在低聚异麦芽寡糖合成中的应用[D].广州:华南理工大学, 2018.
WANG K.Immobilization of Pichia Pastoris surface displayed with α-glucosidase and its application in the synthesis of isomaltooligosaccharides[D].Guangzhou: South China University of Technology, 2018.
[27] CASA-VILLEGAS M, MARíN-NAVARRO J, POLAINA J.Synthesis of isomaltooligosaccharides by Saccharomyces cerevisiae cells expressing Aspergillus niger α-glucosidase[J].ACS Omega, 2017, 2(11):8062-8068.
[28] 刘大文, 程海荣, 邓子新.解脂耶氏酵母表面展示β-淀粉酶与α-葡萄糖转苷酶及一步法由淀粉合成低聚异麦芽糖[J].生物工程学报, 2019, 35(1):121-132.
LIU D W, CHENG H R, DENG Z X.One step production of isomalto-oligosaccharides by engineered Yarrowia lipolytica yeast co-displayed β-amylase and α-transglucosidase[J].Chinese Journal of Biotechnology, 2019, 35(1):121-132.
[29] 钱玲, 郑一文, 林影, 等.毕赤酵母表面展示麦芽三糖生成酶全细胞催化制备麦芽三糖[J].食品科技, 2020, 45(5):1-7.
QIAN L, ZHENG Y W, LIN Y, et al.Cell-Surface display of maltotriose-producing α-amylase in Pichia pastoris and preparation of maltotriose from whole-cell catalyst[J].Food Science and Technology, 2020, 45(5):1-7.
[30] ZHENG Y, WANG Z P, JI X F, et al.Display of a sucrose isomerase on the cell surface of Yarrowia lipolytica for synthesis of isomaltulose from sugar cane by-products[J].3 Biotech, 2019, 9(5):179.
[31] LEE G Y, JUNG J H, SEO D H, et al.Isomaltulose production via yeast surface display of sucrose isomerase from Enterobacter sp.FMB-1 on Saccharomyces cerevisiae[J].Bioresource Technology, 2011, 102(19):9179-9184.
[32] 李宁. 解脂耶氏酵母表面展示海藻糖合成酶一步转化麦芽糖得到高纯海藻糖的研究[D].上海:上海交通大学, 2016.
LI N.Producing high-purity trehalose from maltose by Yarrowia lipolytica displaying trehalose synthase on the cell surface[D].Shanghai:Shanghai Jiao Tong University, 2016.
[33] 李梦悦. 毕赤酵母表面展示海藻糖合酶技术的研究[D].济南:齐鲁工业大学, 2016.
LI M Y.Study on the technology of trehalose synthase on the surface of Pichia pastoris[D].Jinan: Qilu University of Technology, 2016.
[34] LI N, WANG H W, LI L J, et al.Integrated approach to producing high-purity trehalose from maltose by the yeast Yarrowia lipolytica displaying trehalose synthase (tres) on the cell surface[J].Journal of Agricultural and Food Chemistry, 2016, 64(31):6179-6187.
[35] YANG S J, LV X, WANG X H, et al.Cell-Surface displayed expression of trehalose synthase from Pseudomonas putida ATCC 47054 in Pichia pastoris using Pir1p as an anchor protein[J].Frontiers in Microbiology, 2017, 8:2583.
[36] 潘小幸. 白地霉脂肪酶在酿酒酵母和毕赤酵母细胞表面的展示研究[D].武汉:华中科技大学, 2012.
PAN X X.Surface display of Geotrichum candidum lipase in Saccharomyces cerevisiae and Pichia pastoris[D].Wuhan: Huazhong University of Science and Technology, 2012.
[37] PAN X X, XU L, ZHANG Y, et al.Efficient display of active Geotrichum sp.lipase on Pichia pastoris cell wall and its application as a whole-cell biocatalyst to enrich EPA and DHA in fish oil[J].Journal of Agricultural and Food Chemistry, 2012, 60(38):9673-9682.
[38] XU L, XIAO X, WANG F, et al.Surface-Displayed thermostable Candida rugosa lipase 1 for docosahexaenoic acid enrichment[J].Applied Biochemistry and Biotechnology, 2020, 190(1):218-231.
[39] 程青. 磷脂酶D在大肠杆菌中的异源表达及其催化合成磷脂酰丝氨酸的研究[D].杭州:浙江大学, 2021.
CHENG Q.The heterogeneous expression of phospholipase D in Escherichia coli and its synthesis of phosphatidylserine[D].Hangzhou: Zhejiang University, 2021.
[40] LIU Y H, ZHANG T, QIAO J, et al.High-yield phosphatidylserine production via yeast surface display of phospholipase D from Streptomyces chromofuscus on Pichia pastoris[J].Journal of Agricultural and Food Chemistry, 2014, 62(23):5354-5360.
[41] LIU Y H, HUANG L, FU Y, et al.A novel process for phosphatidylserine production using a Pichia pastoris whole-cell biocatalyst with overexpression of phospholipase D from Streptomyces halstedii in a purely aqueous system[J].Food Chemistry, 2019, 274:535-542.
[42] GUIRIMAND G, SASAKI K, INOKUMA K, et al.Cell surface engineering of Saccharomyces cerevisiae combined with membrane separation technology for xylitol production from rice straw hydrolysate[J].Applied Microbiology and Biotechnology, 2016, 100(8):3477-3487.
[43] MADZAK C.Engineering Yarrowia lipolytica for use in biotechnological applications:A review of major achievements and recent innovations[J].Molecular Biotechnology, 2018, 60(8):621-635.
[44] 艾莹莹. 脂肪酶在毕赤酵母细胞表面的间接展示研究[D].武汉:湖北大学, 2021.
AI Y Y.Indirect surface display of lipase on Pichia pastoris cells[D].Wuhan: Hubei University, 2021.