4-羟基-2,5-二甲基-3(2H)-呋喃酮(4-hydroxy-2,5-dimethyl-3(2H)-furanone,HDMF),又名菠萝酮,稀溶液呈草莓味,浓溶液则是焦糖香味[1]。HDMF及其甲氧基衍生物、乙氧基衍生物、β-吡喃葡萄糖苷及其丙二酰化衍生物均已在水果中鉴定[2]。在加热、非加热、发酵的食品中均可以检测出HDMF[3]。HDMF在水中的阈值是0.03 mg/L、空气中阈值是0.1 mg/L、在pH值为3.2的10%水醇溶液中阈值是5 μg/L[4],较低的阈值及宜人的风味特征,被用作调味剂[5]。环状二羰基衍生物的平面烯醇氧基的结构特征,使得HDMF与其类似物具有焦糖风味[6](图1)。
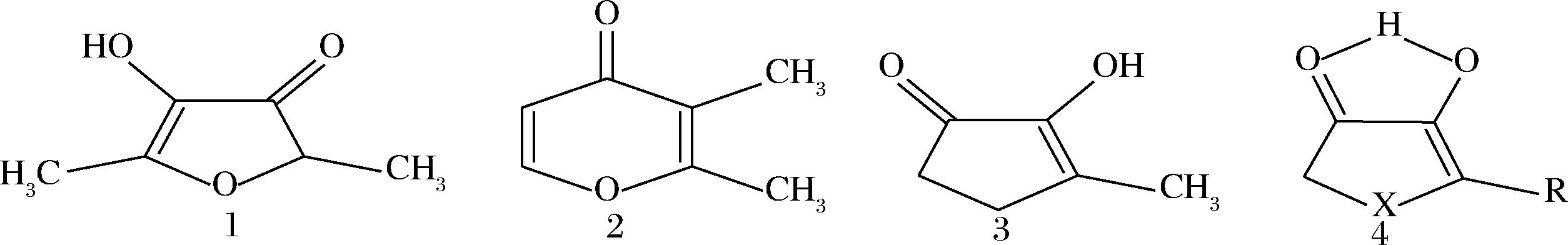
1-呋喃酮;2-麦芽酚;3-甲基环戊烯稀酮;4-五元环氢键环状化合物
图1 含有α-二酮体稀醇结构的物质[6]
Fig.1 Substances containing α-diketone dilute alcohol structure[6]
呋喃酮类化合物以其官能团分为3(2H)-呋喃酮和2-(5H)-呋喃酮两大类,其中3(2H)-呋喃酮中包括:5-甲基-4-羟基-3(2H)-呋喃酮[5-methy-4-hydroxy-3(2H)-furanone,HMF]、2,5-二甲基-4-羟基-3(2H)-呋喃酮(HDMF)、2,5-二甲基-4-甲氧基-3(2H)-呋喃酮[2,5-dimethyl-4-methoxy-3(2H)-furanone,DMMF]、5-(或2)-乙基-2-(或5)-甲基-4-羟基-3(2H)-呋喃酮[5-(or 2)ethyl-2-(or 5)-methy-4-hudroxy,3(2H)-furanone,EMHF]、2,5-二甲基-2,4-二羟基-3(2H)-呋喃酮,2-(5H)-呋喃酮包括芦巴内酯、乙氧基呋喃酮、抗坏血酸、红细胞抗坏血酸等[7]。HDMF依据氧存在的形式,表现出氧化或促氧化特性[8],是食品中已知的促氧化剂,通过铜离子还原为亚铜离子产生超氧自由基转化为过氧化氢和羟基自由基,是DNA链断裂和8-羟基-2′-脱氧鸟苷形成的原因[8],具有与抗坏血酸相当的抗氧化活性[7]。HDMF可保护人类红细胞膜和低密度脂蛋白免受铁诱导的氧化修饰,抑制色素沉着,具有抗感染活性[8];抑制人血浆脂质氧化,对眼睛晶状体组织中超氧化物有抗氧化作用,抑制白内障[9];对革兰氏菌、真菌具有抗菌活性,诱导细胞内海藻糖积累,破坏血清诱导的菌丝形态[10]。HMF、HDMF、DMMF是良好的抗致癌剂,HDMF可降低由苯并[α]芘诱导的大鼠前胃肿瘤发生率和数量[11]。据最新研究,大鼠吸入HDMF可降低收缩压、心率及血浆氧化应激标志物水平[12]。人体吸入HDMF可以降低愤怒-敌意、紧张-焦虑、疲劳-惯性情绪;降低额叶皮层闪烁频率和氧合血红蛋白,具有镇静、生理放松作用[13]。
综上,HDMF为广泛存在于自然界的天然活性功能物质,重要的工业香料。通过对其生物与非生物合成途径的国内外研究报道进行综述,为HDMF健康、绿色的工业生产、食品加工中的风味调控等提供综合性知识。
1 化学法合成HDMF
HDMF化学合成底物有糖,羧酸和羧酸酯、呋喃、不饱和醇类、醛酮的衍生物等(表1),其中常见的有鼠李糖、酒石酸、乳酸乙酯和丙酮醛等。
表1 呋喃酮化学合成主要原料[6]
Table 1 Main raw materials for the chemical synthesis of furanone[6]
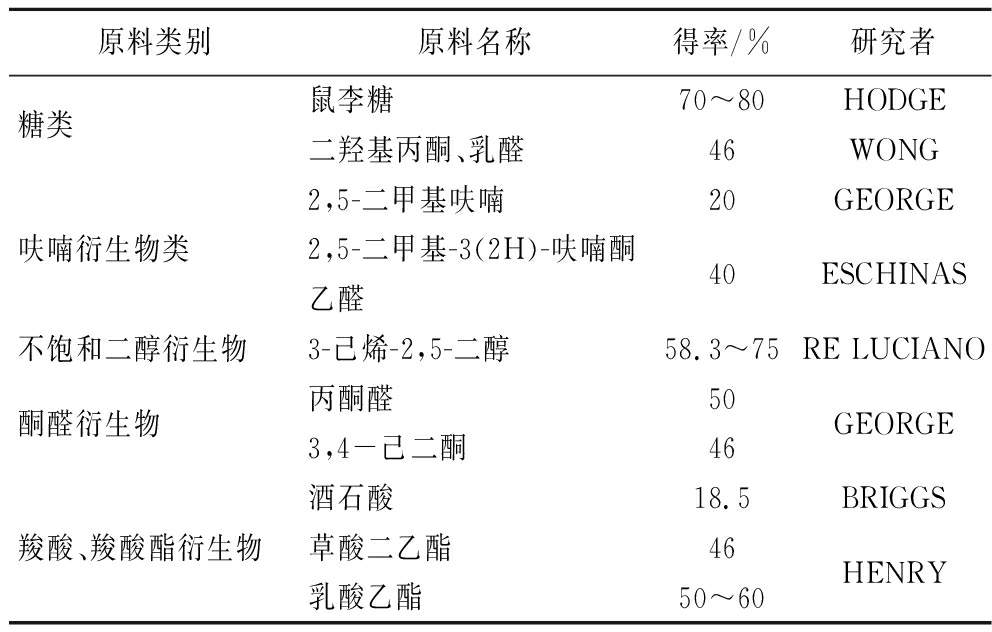
原料类别原料名称得率/%研究者糖类鼠李糖70~80HODGE二羟基丙酮、乳醛46WONG2,5-二甲基呋喃20GEORGE呋喃衍生物类2,5-二甲基-3(2H)-呋喃酮40ESCHINAS乙醛不饱和二醇衍生物3-己烯-2,5-二醇58.3~75RE LUCIANO酮醛衍生物丙酮醛50GEORGE3,4-己二酮46酒石酸18.5BRIGGS羧酸、羧酸酯衍生物草酸二乙酯46HENRY乳酸乙酯50~60
表2 合成HDMF的微生物
Table 2 Microorganisms that synthesise HDMF
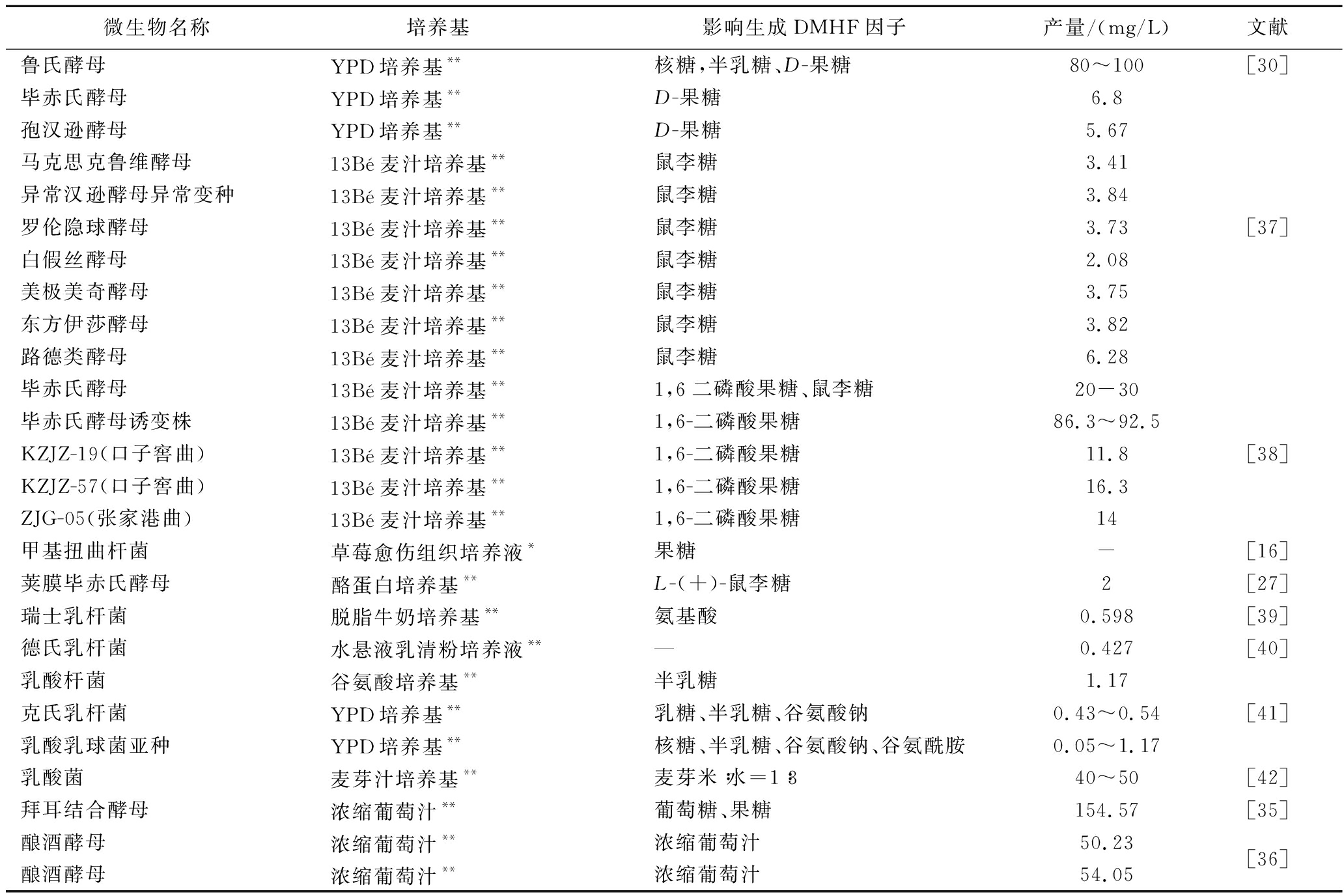
微生物名称培养基 影响生成DMHF因子 产量/(mg/L)文献鲁氏酵母YPD培养基**核糖,半乳糖、D-果糖80~100[30]毕赤氏酵母YPD培养基**D-果糖6.8孢汉逊酵母YPD培养基**D-果糖5.67马克思克鲁维酵母13Bé麦汁培养基**鼠李糖3.41异常汉逊酵母异常变种13Bé麦汁培养基**鼠李糖3.84罗伦隐球酵母13Bé麦汁培养基**鼠李糖3.73[37]白假丝酵母13Bé麦汁培养基**鼠李糖2.08美极美奇酵母13Bé麦汁培养基**鼠李糖3.75东方伊莎酵母13Bé麦汁培养基**鼠李糖3.82路德类酵母13Bé麦汁培养基**鼠李糖6.28毕赤氏酵母13Bé麦汁培养基**1,6二磷酸果糖、鼠李糖20-30毕赤氏酵母诱变株13Bé麦汁培养基**1,6-二磷酸果糖86.3~92.5KZJZ-19(口子窖曲)13Bé麦汁培养基**1,6-二磷酸果糖11.8[38]KZJZ-57(口子窖曲)13Bé麦汁培养基**1,6-二磷酸果糖16.3ZJG-05(张家港曲)13Bé麦汁培养基**1,6-二磷酸果糖14甲基扭曲杆菌草莓愈伤组织培养液*果糖-[16]荚膜毕赤氏酵母酪蛋白培养基**L-(+)-鼠李糖2[27]瑞士乳杆菌脱脂牛奶培养基**氨基酸0.598[39]德氏乳杆菌水悬液乳清粉培养液**—0.427[40]乳酸杆菌谷氨酸培养基**半乳糖1.17克氏乳杆菌YPD培养基**乳糖、半乳糖、谷氨酸钠0.43~0.54[41]乳酸乳球菌亚种YPD培养基**核糖、半乳糖、谷氨酸钠、谷氨酰胺0.05~1.17乳酸菌麦芽汁培养基**麦芽米∶水=1∶340~50[42]拜耳结合酵母浓缩葡萄汁**葡萄糖、果糖154.57[35]酿酒酵母浓缩葡萄汁**浓缩葡萄汁50.23[36]酿酒酵母浓缩葡萄汁**浓缩葡萄汁54.05
注:*表示过滤除菌;**表示加热除菌。
化学合成在工业中应用还需克服原料成本高、不同合成工艺差异较大等技术难题。在国内,化学合成HDMF的方法为:乳酸乙酯与α-溴代丙酸乙酯在强碱性溶液中发生烷氧基化反应,中间产物在含有金属钠的甲苯溶剂发生偶联反应,再催化氧化得到HDMF,具有原料廉价、易得的优点,但烷基化以及缩合反应,反应条件严苛[14]。在国外合成HDMF主要是由瑞士芬美意公司(FIRMENICH)提供,丙酮醛在乙酸水溶液中,由锌粉提供还原电子,经过Pinacol偶联反应得到3,4-二羟基-2,5-己二酮,再用Na2HPO4调节反应体系pH进行环化反应得到HDMF,反应体系中含有多羰基,很难控制Witting反应制备相应的烯烃[15]。
2 美拉德反应形成呋喃酮
美拉德反应可以形成HDMF(图2)。在含有糖的溶液中,己糖、6-脱氧糖和戊糖通过2,3-烯醇化、β-消去反应、形成3-脱氧酮糖、再进行分子内环化和脱水反应降解为HDMF[16](蓝色标注)。在含有己糖和氨基酸的食品中,HDMF通过美拉德反应形成,葡萄糖经过阿姆德分子重排、2,3-烯醇化形成脱氧酮,裂解为羟基丙酮和乳醛,再通过羟醛缩合反应、环化形成乙酰福尔马林,再被还原成HDMF,其中乙酰福尔马林、双乙酰福尔马林和二氢二乙酰福尔马林为重要中间体[17](红色标注)。3-脱氧酮糖裂解形成甲基乙二醛,再经过Cannrizzaro反应形成羟基丙酮,异构为端羟基醇,通过与2-氧代丙醇反应生成2,5-二氧代-3,4-二羟基己烷,继而环化、β-消除水形成HDMF[17]。在面包中,HDMF前驱物质是酵母细胞内水溶性的1,6-二磷酸-D-果糖(D-fructose-1,6-diphosphate,FDP)在烘培中生成,其推测是C6的磷酸根离子移除之后,2,3-烯醇化形成乙酰福尔马林,继而形成HDMF,磷酸根离子、维生素C可以促进其转化[18]。环境温度为30 ℃时合成HDMF的效率最高,缓冲液的pH、化学性质对酶活性影响较小。在含有FDP和NADPH的溶液中,NADPH向碳水化合物非酶氢化转移,可化学转化形成HDMF,重要的中间体为乙酰福尔马林[19](绿色标注)。

图2 美拉德反应形成呋喃酮物质转化路线图
Fig.2 Roadmap for the conversion of furanones from the Melard reaction
注:蓝色为己糖加热直接形成呋喃酮途径[17];红色己糖在氨基酸溶液中加热形成呋喃酮途径[17]:绿色为常温条件下己糖形成呋喃酮途径[19]。
3 酶催化形成呋喃酮
在工业中以FDP为底物,利用三步酶法生产HDMF(图3)[20]。醛缩酶和磷酸三酯异构酶处理含有D- 1,6-二磷酸果糖和D-乳醛的溶液时,形成6-脱氧果糖-1-磷酸(图5),D-1,6-二磷酸果糖在1,6-二磷果糖-酸醛缩酶(兔肌肉醛缩酶)的作用下裂解为磷酸二羟丙酮和D-磷酸甘油醛,而磷酸丙糖异构酶可以促进D-磷酸甘油醛与磷酸二羟丙酮相互转化,磷酸二羟丙酮在含有乳醛的碱性溶液中经醛缩酶作用发生羟醛缩合反应形成6-脱氧-D-果糖(D-乳醛)或6-脱氧-L-山梨糖(L-乳酸醛)与哌啶在80 ℃条件下加热20 h形成HDMF[21]。
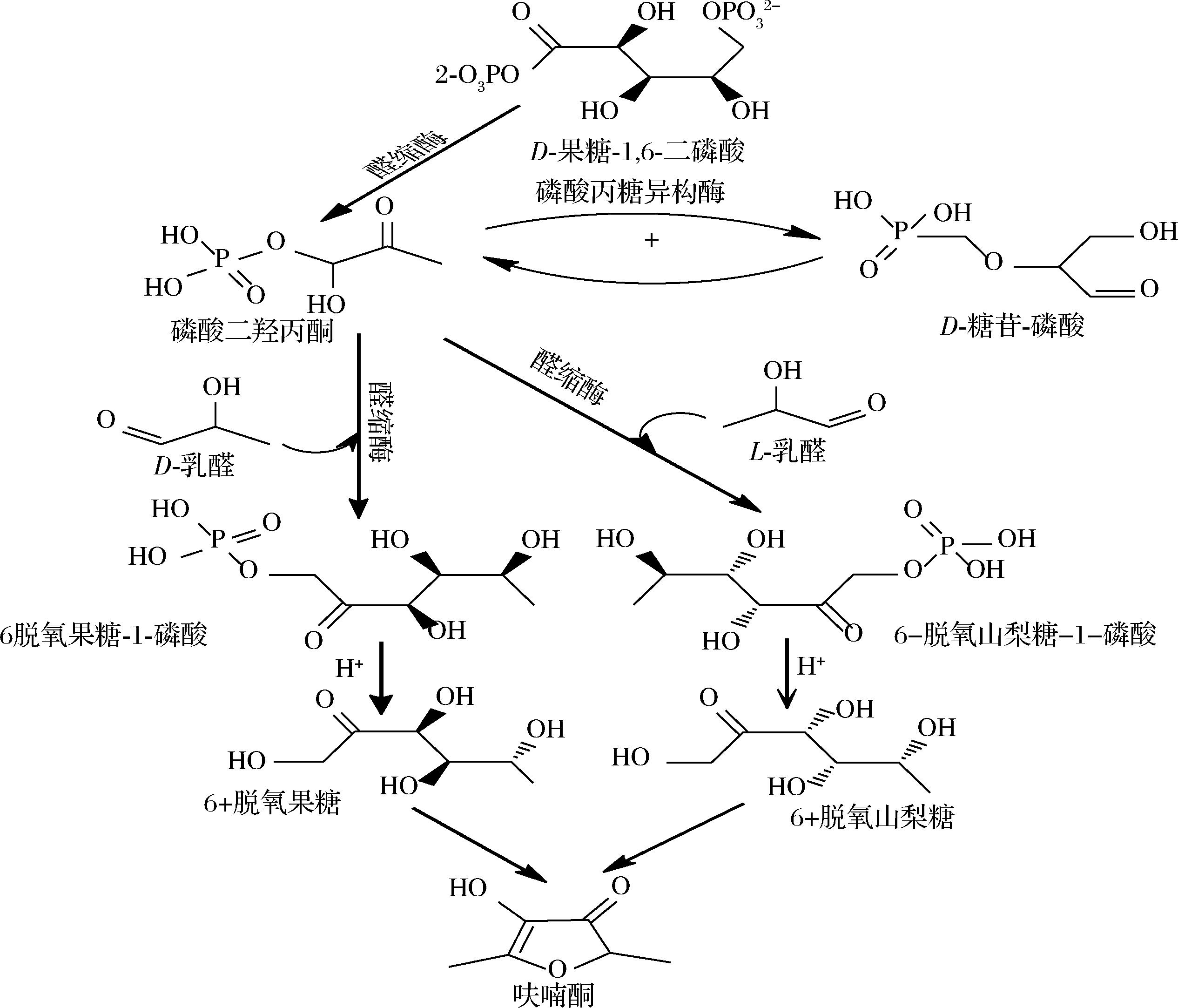
图3 酶法合成呋喃酮物质转化路线图[20]
Fig.3 Roadmap for the enzymatic synthesis of furanone substance conversion[20]
4 植物中酶促反应生成游离与结合态的呋喃酮
最早发现HDMF是草莓的特征香气物质之一。尚未发现HDMF在草莓果实中较为完整的植物代谢合成途径[22],但已取得了实质性进展(图4):草莓果实中HDMF及其糖苷衍生物是由D-果糖和6-磷酸-D-果糖形成HDMF的甲氧化合物,醌氧化还原酶(FaQR)和烯酮氧化还原酶(FaEO)将其转化为HDMF,通过葡萄糖基转移酶和丙二酰转移酶生成HDMF葡萄糖苷衍生物[23]。其中,HDMF的碳架直接来源于D-果糖、FDP通过生物美拉德反应生成的1-脱氧果糖或6-脱氧果糖,而非醛缩酶切割成2个C3单元[24]。草莓果实基因和菠萝、番茄中发现的是同源基因,与高等植物生长素诱导型蛋白编码基因高度相似[23]。在草莓中合成HDMF的基因只在果实细胞中表达,在后熟期大量积累[24]。草莓中存有呋喃酮葡萄糖醛酸和呋喃酮丙二酸葡糖苷,两者未在葡萄中鉴定,但葡萄中含有HDMF苷元,Muscat Bailey A、V.labrusca (Bailey) x V.vinifera (Muscat Hamburg)的杂交葡萄,HDMF前驱物质与草莓中呋喃酮前驱物质相似,主要为mesifuran及其吡喃葡萄糖苷,在基因水平上UGT85K14葡萄糖基转移酶基因调控呋喃酮的糖基化[25]。
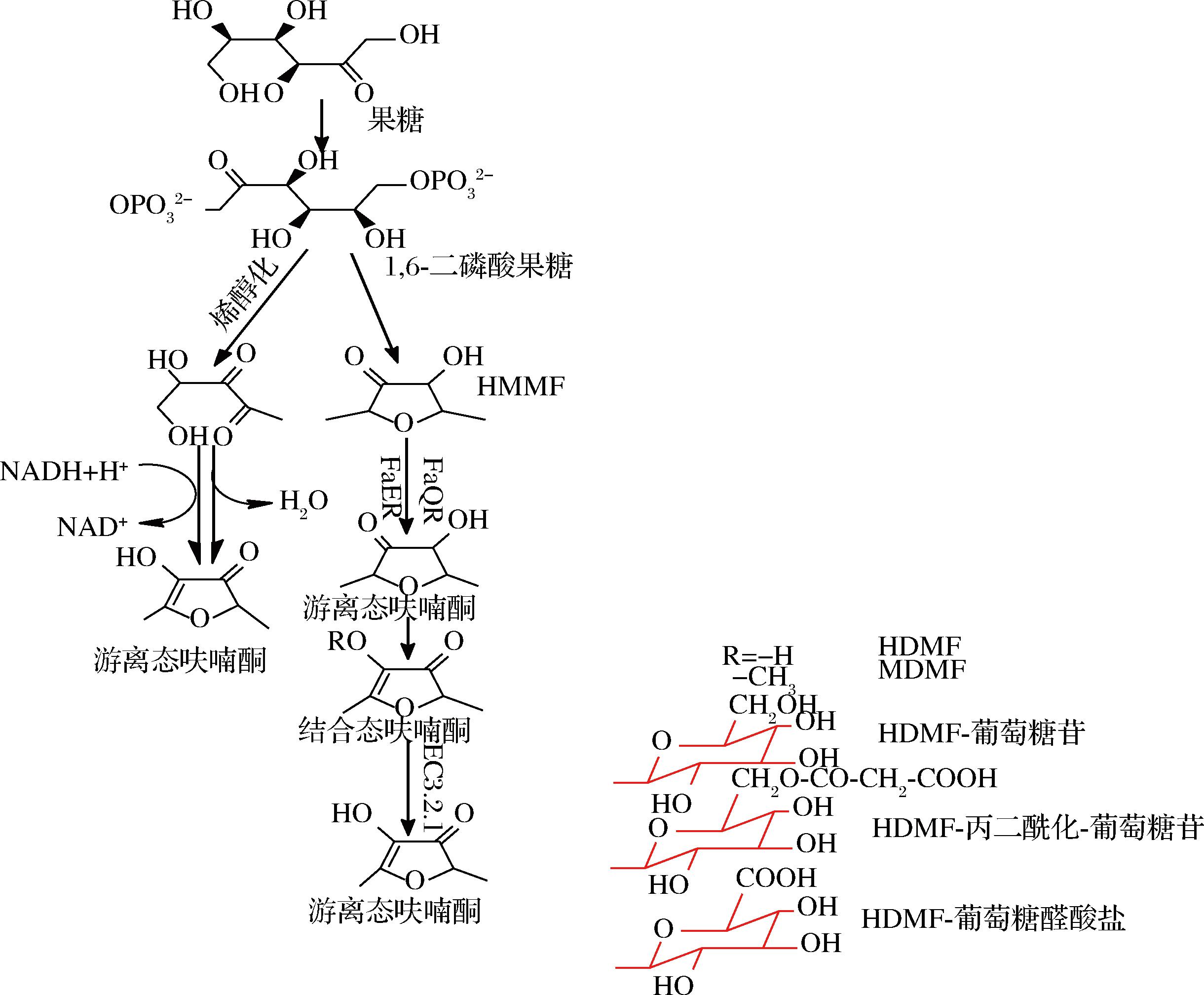
图4 植物合成呋喃酮的路线图[22]
Fig.4 Roadmap for the synthesis of furanone in plants[22]
注:红色标记为结合态呋喃酮取代基部分结构示意图。
5 微生物合成呋喃酮的可能途径
5.1 微生物发酵释放结合态HDMF
在发酵果汁中,微生物可释放结合态HDMF(图4)。不同葡萄品种的葡萄酒中HDMF从微量到3.5 mg/L不等,结合态香气的释放是其重要来源之一,葡萄酒中通过β-葡萄糖苷的果胶水解酶提高HDMF浓度。结合态HDMF有葡萄糖苷、呋喃酮-丙二酰化-葡萄糖苷等[26],研究表明磷酸己糖异构酶参与D-果糖转化释放结合态HDMF,参与的微生物有酿酒酵母(Saccharomyces cerevisiae)、贝氏丝孢酵母(Trichosporon baileyi)[22];HDMF-葡萄糖醛酸存在于草莓果实中,β-葡萄糖苷酶可能是参与反应的生物酶[27]。
5.2 微生物以美拉德反应中间产物为底物合成HDMF
20世纪90年代已经证明美拉德反应的产物可以促进微生物生成HDMF。在单独加热后的L-鼠李糖溶液、湿热灭菌的D-葡萄糖、酵母膏、蛋白胨培养基(YPG)中接种荚膜毕赤酵母(Pichia capsulata)生长4 d,均没HDMF;而将单独加热的L-鼠李糖加入湿热灭菌的YPG中,接种荚膜毕赤酵母(P.capsulata)生长4 d后,检测出HDMF,L-鼠李糖浓度增加HDMF生成量也增加,推测添加L-鼠李糖的YPG加热后可以形成酵母菌合成HDMF的底物[28]。深色麦芽汁中检测到HDMF,而淡色麦芽汁中未检出,酿酒酵母(S.cerevisiae)发酵浅色和深色麦芽汁均生成HDMF[29]。shoyu-koji糖化汁(mugi-miso)中添加还原糖后加热均产生HDMF,再接入鲁氏接合酵母(Zygosaccharomyces rouxii)发酵,HDMF含量均有不同程度增加,其中D-鼠李糖可促进美拉德反应产生HDMF(125.5 mg/L)和酵母菌(T.dermatis)发酵生成HDMF(131.2 mg/L),高于其他糖类诱导生成HDMF(美拉德反应≤6 mg/L,酵母菌发酵≤8 mg/L);通过监测发酵过程中各还原糖浓度、HDMF浓度、褐变度,作者推测酵母菌可将美拉德反应的产物(C6-1-脱氧核糖)转化为HDMF(图5),到目前仅是推测,缺乏直接证据。将单一氨基酸和单一糖(核糖和半乳糖)混合液加热(121 ℃,15 min)后,再添加至高压蒸汽灭菌后的YPG中,鲁氏酵母(Z.rouxii)发酵生成HDMF约1 mg/L[30]。在YPG中添加5%的D-果糖生成HDMF含量为1.8 mg/L,6-脱氧-L-甘露糖和6-脱氧核糖,经湿热灭菌后,接入鲁氏接合酵母进行发酵,分别生成5 mg/L和18 mg/L[31]。在慕萨莱思发酵过程中,通过果实的酶解和酸解释放结合态呋喃酮,HDMF含量不断增加。模拟葡萄汁灭菌后接入本土酿酒酵母(S.cerevisiae)发酵,均可产生HDMF,证明在慕萨莱思发酵过程中,微生物既降解葡萄汁中结合态呋喃酮,同时又代谢葡萄汁浓缩过程中美拉德反应的产物生产HDMF[32]。
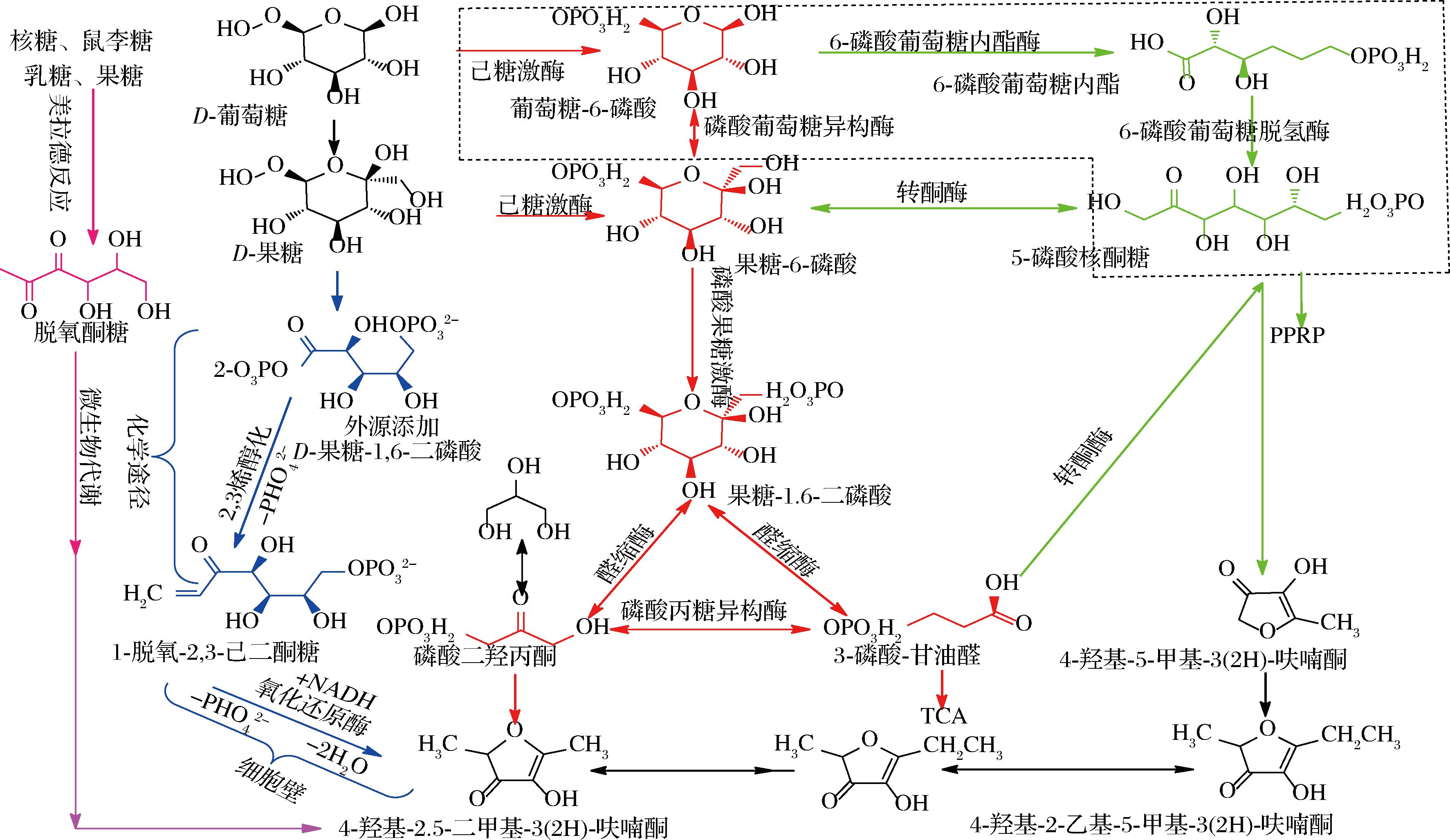
图5 微生物合成呋喃酮的可能代谢途径
Fig.5 Possible metabolic pathways for microbial synthesis of furanone
注:紫色为微生物利用美拉德产物生成呋喃酮代谢途径[32];蓝色为微生物利用外源添加己糖合成呋喃酮代谢途径[44];红色为微生物通过EMP途径生成呋喃酮代谢途径[9];绿色为微生物通过PP途径生成呋喃酮代谢途径[45]。
乳酸菌可以利用美拉德产物而生成HDMF,但无明确的代谢途径报道。在含酵母膏和蛋白胨的培养基中,添加半乳糖和谷氨酸钠、核糖和谷氨酸,培养基经过湿热灭菌和0.22 μm膜过滤除菌,再乳酸乳球菌亚种(Lactococcus lactis subsp.Cremoris)发酵,均生成HDMF,湿热灭菌培养基中HDMF的生成量分别是膜过滤除菌的9倍与3.3倍,说明乳酸菌可以将美拉德反应的产物转化为HDMF[33]。瑞士乳杆菌(L.helveficu)和德氏乳杆菌(L.delbrueckii)在乳清粉水悬浮液上培养7 d后,HDMF浓度分别为0.60 mg/L和0.45 mg/L,佛氏丙酸杆菌(Propionibacterium freudenreichii)产生量为0.08 mg/L[34]。利用植物乳杆菌(L.amylolyticus)发酵麦芽汁饮品,HDMF为其关键风味化合物之一。在浓缩葡萄汁中接入拜耳结合酵母(Z.bailii)、毕赤克鲁维酵母(P.kluyveri)和酿酒酵母(S.cerevisiae)混菌发酵,30 d后检测到发酵液中HDMF含量为172.30 mg/L[35]。在浓缩葡萄汁中接入野生型酿酒酵母发酵,14 d后HDMF含量为54.055 mg/L[36]。
5.3 微生物利用FDP代谢合成HDMF途径
微生物在添加不同糖类的培养基中生成HDMF的含量存在差异。在YPG中添加单磷酸糖(6-磷酸-D-葡萄糖、1-磷酸-D-果糖和6-磷酸-D-果糖),鲁氏接合酵母生成少量HDMF(1.9~3.8 mg/L),而添加FDP,生成HDMF含量为52 mg/L[31]。在13°Bé麦汁中添加不同糖类均可生成HDMF,其中添加FDP生成HDMF含量为45.6 mg/L,其他含量为14~17 mg/L[39],当添加FDP浓度为100 g/L时,HDMF的产量最高达到98 mg/L[43]。FDP作为唯一碳源并不能直接生成HDMF,而是酵母菌以FDP为底物的次级代谢产物产生,其完整代谢途径不清楚,但已明确FDP先经化学途径转化为1-脱氧-2,3-己二酮糖-6-磷酸,再由鲁氏接合酵母细胞壁中生物酶合成HDMF[44]。
鲁氏接合酵母在高浓度NaCl的YPG中加入D-果糖进行发酵,发现D-果糖可提高鲁氏接合酵母在糖酵解途径(EMP)和磷酸戊糖(PPP)途径中初级代谢产物及相关基因表达,包括调节磷酸二羟丙酮的FBA基因,对应酶活性与HDMF浓度相关[45]。作者没有将可能的关键底物进行验证实验,关键底物可能是D-果糖的加热(包括湿热灭菌)非酶褐变或生物非酶褐变反。目前报道D-果糖转化为HDMF的生物途径主要有2种:一种是D-果糖在培养基中一起加热,再微生物发酵形成HDMF,底物可能是D-果糖加热过程中形成的美拉德反应产物,但尚无清晰的代谢途径[31];另一种是在草莓成熟过程中作为HDMF的碳骨架来源,D-果糖通过生物美拉德反应生成1-脱氧果糖或6-脱氧果糖[24]。
综上表明,荚膜毕赤酵母,鲁氏接合酵母,酿酒酵母,乳酸菌可以在不同糖类培养基中发酵产生HDMF,其生成量依据微生物、糖、氮源、美拉德反应程度(色度)、厌氧与好氧、渗透压等产生差异。目前微生物生成HDMF,初步明确微生物可释放植物中结合态呋喃酮,或通过代谢美拉德中间产物生成途径,转化生产HDMF,或可能有其他代谢途径(细菌代谢未加热处理的培养物)可生成HDMF。不论哪种代谢途径,均无完整而清晰的代谢途径,极大限制了微生物合成HDMF的深入研究。
6 结论与展望
本文对HDMF的生物与非生物合成途径进行了全面综述。目前,化学合成已成为工业合成主要途径;植物合成代谢和美拉德反应生成途径较为清晰,揭示农产品和食品加工形成HDMF的途径,但目前没有开发应用的报道;微生物合成HDMF具有绿色、低成本等优势,但微生物合成HDMF的研究滞后,初步表现为释放结合态HDMF较为清晰,酵母菌、乳酸菌等多种菌株发现可以利用FDP、美拉德反应中间产物等为其可能的代谢底物,但代谢途径不清晰。
随着食品风味科学的兴起,关键香气鉴定技术广泛应用,对食品风味的形成实施精准控制。对于传统加热后再发酵生成HDMF的食品,可以通过热加工赋予该食品焦糖类风味,但由于美拉德反应的复杂性,难以实现食品风味的精细化控制。随着我国绿色经济的发展,HDMF市场需求的不断增加,化学合成的HDMF难以满足价廉、低污染、安全、高效的需求,也无法满足人们对天然食材消费增长的需求。在植物中可以通过代谢途径及关键酶调控生成HDMF,草莓植株进行分子育种与栽培控制,可将HDMF的代谢通路进行基因编辑等技术手段进行改良,提高产量[];在富含HDMF植物中运用现代分离提纯技术提取HDMF;通过生物转化法生产高效价的HDMF,但合成周期长、成本高、操作难度大,应用范围窄。微生物发酵法生产的HDMF香韵较好、品质较高,具有不受环境限制等优点,是合成HDMF的新趋势,但需要对微生物合成HDMF的底物、代谢途径、关键酶系、调控基因及优良菌株等基础性工作做深入研究。
[1] VANDAMME E J. Bioflavours and fragrances via fungi and their enzymes[J]. Fungal Diversity, 2003, 13:153-166.
[2] EFFENBERGER I, HOFFMANN T, JONCZYK R, et al. Novel biotechnological glucosylation of high-impact aroma chemicals, 3(2H)-and 2(5H)-furanones[J]. Scientific Reports, 2019, 9(1):10943.
[3] ROSCHER R, KOCH H, HERDERICH M, et al. Identification of 2, 5-dimethyl-4-hydroxy-3[2H]-furanone beta-D-glucuronide as the major metabolite of a strawberry flavour constituent in humans[J]. Food and Chemical Toxicology: an International Journal Published for the British Industrial Biological Research Association, 1997, 35(8):777-782.
[4] FERREIRA V, ORT N N, ESCUDERO A, et al. Chemical characterization of the aroma of Grenache rosé wines: Aroma extract dilution analysis, quantitative determination, and sensory reconstitution studies[J]. Journal of Agricultural and Food Chemistry, 2002, 50(14):4048-4054.
N N, ESCUDERO A, et al. Chemical characterization of the aroma of Grenache rosé wines: Aroma extract dilution analysis, quantitative determination, and sensory reconstitution studies[J]. Journal of Agricultural and Food Chemistry, 2002, 50(14):4048-4054.
[5] LARSEN M, POLL L. Odour thresholds of some important aroma compounds in strawberries[J]. Zeitschrift Für Lebensmittel-Untersuchung Und Forschung, 1992, 195(2):120-123.
[6] 易玲敏. 呋喃酮的制备及其绿色工艺设计[D]. 杭州: 浙江大学, 2002.
YI L M. Preparation of 2, 5-dimethyl-4-hydroxy-3 (2H)-furanone and its green design[D].Hangzhou: Zhejiang University, 2002.
[7] COLIN S J. The naturally occurring furanones: Formation and function from pheromone to food[J]. Biological Reviews of the Cambridge Philosophical Society, 1999, 74(3):259-276.
[8] XIAO Q, HUANG Q R, HO C T. Occurrence, formation, stability, and interaction of 4-hydroxy-2, 5-dimethyl-3(2H)-furanone[J]. ACS Food Science &Technology, 2021, 1(3):292-303.
[9] SASAKI T, YAMAKOSHI J, SAITO M, et al. Antioxidative activities of 4-hydroxy-3(2H)-furanones and their anti-cataract effect on spontaneous cataract rat (ICR/f)[J]. Bioscience, Biotechnology, and Biochemistry, 1998, 62(10):1865-1869.
[10] SUNG W S, JUNG H J, LEE I S, et al. Antimicrobial effect of furaneol against human pathogenic bacteria and fungi[J]. Journal of Microbiology and Biotechnology, 2006, 16:349-354.
[11] KATAOKA S, LIU W, ALBRIGHT K, et al. Inhibition of benzo[a]pyrene-induced mouse forestomach neoplasia and reduction of H2O2 concentration in human polymorphonuclear leucocytes by flavour components of Japanese-style fermented soy sauce[J]. Food and Chemical Toxicology, 1997, 35(5):449-457.
[12] YOKOYAMA I, OHATA M, KOMIYA Y, et al. Inhalation of odors containing DMHF generated by the Maillard reaction affects physiological parameters in rats[J]. Scientific Reports, 2020, 10(1):13931.
[13] OHATA M, ZHOU L X, YADA Y, et al. 2, 3-Dimethylpyrazine (3DP) and 2, 5-dimethyl-4-hydroxy-3(2 H)-furanone (DMHF) generated by the Maillard reaction in foods affect autonomic nervous activity and central nervous activity in human[J]. Bioscience, Biotechnology, and Biochemistry, 2020, 84(9):1894-1902.
[14] RE L, MAURER B, OHLOFF G. Ein einfacher Zugang zu 4-hydroxy-2, 5-dimethyl-3(2H)-furanon (furaneol), einem aromabestandteil von Ananas und erdbeere[J]. Helvetica Chimica Acta, 1973, 56(6):1882-1894.
[15] BUECHI G, DEMOLE E, THOMAS A F. Syntheses of 2, 5-dimethyl-4-hydroxy-2, 3-dihydrofuran-3-one (furaneol), a flavor principle of pineapple and strawberry[J]. The Journal of Organic Chemistry, 1973, 38(1):123-125.
[16] ZABETAKIS I, GRAMSHAW J W, ROBINSON D S. 2, 5-Dimethyl-4-hydroxy-2H-furan-3-one and its derivatives: Analysis, synthesis and biosynthesis—A review[J]. Food Chemistry, 1999, 65(2):139-151.
[17] WANG Y, HO C T. Formation of 2, 5-dimethyl-4-hydroxy-3(2H)-furanone through methylglyoxal: A Maillard reaction intermediate[J]. Journal of Agricultural and Food Chemistry, 2008, 56(16):7405-7409.
[18] SCHIEBERLE P. ACS Symposium Series[M]. Washington: American Chemical Society, 1992:164-174.
[19] HAUCK T, LANDMANN C, RAAB T, et al. Chemical formation of 4-hydroxy-2, 5-dimethyl-3[2H]-furanone from D-fructose 1, 6-diphosphate[J]. Carbohydrate Research, 2002, 337(13):1185-1191.
[20] DUBAL S A, TIKARI P, MOMIN S A, et al. Biotechnological routes in flavour industries[J]. Advanced Biotech, 2008(14): 20-31.
[21] WONG C H, MAZENOD F P, WHITESIDES G M. Chemical and enzymatic syntheses of 6-deoxyhexoses. conversion to 2, 5-dimethyl-4-hydroxy-2, 3-dihydrofuran-3-one (furaneol) and analogs[J]. The Journal of Organic Chemistry, 1983, 48(20):3493-3497.
[22] RAAB T, L PEZ-R
PEZ-R EZ J A, KLEIN D, et al. FaQR, required for the biosynthesis of the strawberry flavor compound 4-hydroxy-2, 5-dimethyl-3(2H)-furanone, encodes an enone oxidoreductase[J]. The Plant Cell, 2006, 18(4):1023-1037.
EZ J A, KLEIN D, et al. FaQR, required for the biosynthesis of the strawberry flavor compound 4-hydroxy-2, 5-dimethyl-3(2H)-furanone, encodes an enone oxidoreductase[J]. The Plant Cell, 2006, 18(4):1023-1037.
[23] KLEIN D, FINK B, AROLD B, et al. Functional characterization of enone oxidoreductases from strawberry and tomato fruit[J]. Journal of Agricultural and Food Chemistry, 2007, 55(16):6705-6711.
[24] 隋静. 草莓果实发育过程和采后处理对其芳香物质和醇酰基转移酶活性影响研究[D]. 泰安: 山东农业大学, 2007.
SUI J. Effects of fruit development period and post-harvest treatment on aromatic substances and AAT activity in strawberry[D].Taian: Shandong Agricultural University, 2007.
[25] KOBAYASHI, SASAKI, TANZAWA, et al. Impact of harvest timing on 4-hydroxy-2, 5-dimethyl-3(2H)-furanone concentration in ‘Muscat Bailey a’ grape berries[J]. Vitis: Journal of Grapevine Research, 2013, 52(1):9-11.
[26] UBEDA C, SAN-JUAN F, CONCEJERO B, et al. Glycosidically bound aroma compounds and impact odorants of four strawberry varieties[J]. Journal of Agricultural and Food Chemistry, 2012, 60(24):6095-6102.
[27] ROSCHER R, HILKERT A, GESSNER M, et al. L-Rhamnose: Progenitor of 2, 5-dimethyl-4-hydroxy-3[2H]-furanone formation by Pichia capsulata?[J]. Zeitschrift Für Lebensmitteluntersuchung Und -Forschung A, 1997, 204(3):198-201.
[28] HAYASHIDA Y, SLAUGHTER J C. Biosynthesis of flavour-active furanones by Saccharomyces cerevisiae during fermentation depends on the malt type used in medium preparation[J]. Biotechnology Letters, 1997, 19(5):429-431.
[29] HAYASHIDA Y, NISHIMURA K, SLAUGHTER C J. Formation mechanisms of flavour-active furanones, 4-hydroxy-2, 5-dimethyl-3 (2 H)-furanone (HDMF) and 4-hydorxy-2 (or 5)-ethyl-5 (or 2)-methyl-3 (2 H)-furanone (HEMF), in mugi-miso, fermented soy-beans paste with barley-koji[J]. JOURNAL OF THE BREWING SOCIETY OF JAPAN, 1998, 93(9):730-738.
[30] HECQUET L, SANCELME M, BOLTE J, et al. Biosynthesis of 4-hydroxy-2, 5-dimethyl-3(2h)-furanone by Zygosaccharomyces rouxii[J]. Journal of Agricultural and Food Chemistry, 1996, 44(5):1357-1360.
[31] HAYASHIDA Y, HATANO M, TAMURA Y, et al. 4-Hydroxy-2, 5-dimethyl-3(2H)-furanone (HDMF) production in simple media by lactic acid bacterium, Lactococcus lactis subsp. cremoris IFO 3427[J]. Journal of Bioscience and Bioengineering, 2001, 91(1):97-99.
[32] ZHU L X, ZHANG M M, LIU Z, et al. Levels of furaneol in msalais wines: A comprehensive overview of multiple stages and pathways of its formation during msalais winemaking[J]. Molecules, 2019, 24(17):3104.
[33] PREININGER M, GROSCH W. Determination of 4-hydroxy-2, 5-dimethyl-3 (2H)-furanone (HDMF) in cultures of bacteria[J]. Zeitschrift Für Lebensmittel-Untersuchung Und Forschung, 1995, 201(1):97-98.
[34] NSOGNING DONGMO S, SACHER B, KOLLMANNSBERGER H, et al. Key volatile aroma compounds of lactic acid fermented malt based beverages-impact of lactic acid bacteria strains[J]. Food Chemistry, 2017, 229:565-573.
[35] 刘真. 降解5-羟甲基糠醛、高产焦糖香酵母菌筛选及其混菌发酵慕萨莱思的研究[D]. 阿拉尔: 塔里木大学, 2021.
LIU Z. Screening yeast strains with degradation of 5-hydroxymethylfurfural and high production of caramel compounds and fermentation musalais by the co-inoculation of the screened strains[D].Ala’er: Tarim University, 2021.
[36] 乔通通. 慕萨莱思产关键香优良菌株的筛选与工艺优化[D]. 阿拉尔: 塔里木大学, 2022.
QIAO T T. Screening and process optimization of key fragrant and excellent strains in msalais[D].Ala’er: Tarim University, 2022.
[37] 王鹏霄. 4-羟基-2, 5-二甲基-3(2H)-呋喃酮高产菌株的选育及发酵条件优化[D]. 北京: 北京工商大学, 2010.
WANG P X. Screening of strains with high yield of HDMF and optimization of the fermentation conditions[D].Beijing: Beijing Technology and Business University, 2010.
[38] 张海林. 高产2,5-二甲基-4-羟基-3(2H)-呋喃酮酵母菌株的选育及培养环境的研究[D]. 无锡: 江南大学, 2009.
ZHANG H L. Breeding and culture environment of yeast strains with high production of 2, 5-dimethyl-4-hydroxyl-3(2H)-furanone[D].Wuxi: Jiangnan University, 2009.
[39] KOWALEWSKA J, ZELAZOWSKA H, BABUCHOWSKI A, et al. Isolation of aroma-bearing material from Lactobacillus helveticus culture and Cheese1[J]. Journal of Dairy Science, 1985, 68(9):2165-2171.
[40] PREININGER M, GROSCH W. Determination of 4-hydroxy-2, 5-dimethyl-3 (2H)-furanone (HDMF) in cultures of bacteria[J]. Zeitschrift Für Lebensmittel-Untersuchung Und Forschung, 1995, 201(1):97-98.
[41] HAYASHIDA Y, NISHIMURA K, SLAUGHTER J C. The importance of the furanones HDMF and HEMF in the flavour profile of Japanese barley miso and their production during fermentation[J]. Journal of the Science of Food and Agriculture, 1998, 78(1):88-94.
[42] KURIYAMA K, YOSHIHAMA Y. Lactic acid baterium for highly producing HDMF and its use: Japanese, 280256A [P]. 2006-10-19.
[43] 李昕. 外源D-果糖促进鲁氏酵母合成呋喃酮碳代谢的分子机制研究[D]. 大庆: 黑龙江八一农垦大学, 2020.
LI X. Carbon metabolism molecular mechanisms of D-fructose promotion on the furanone production in Zygosaccharomyces rouxii[D].Daqing: Heilongjiang Bayi Agricultural University, 2020.
[44] HAUCK T, BRÜHLMANN F, SCHWAB W. Formation of 4-hydroxy-2, 5-dimethyl-3[2H]-furanone by Zygosaccharomyces rouxii: Identification of an intermediate[J]. Applied and Environmental Microbiology, 2003, 69(7):3911-3918.
[45] ZHANG Y Y, YIN X R, XIAO Y W, et al. An ethylene response factor-myb transcription complex regulates furaneol biosynthesis by activating quinone oxidoreductase expression in strawberry[J]. Plant Physiology, 2018, 178(1):189-201.