球虫病是指艾美尔球虫属的传染性单细胞原虫寄生于动物肠道上皮细胞所引起的一种寄生虫病,在家禽养殖中最为常见,其次是兔、牛和羊等[1-2]。抗球虫药按照来源方式的不同可分为两类:一类是聚醚类离子载体抗球虫药,如莫能菌素、拉沙洛西等;另一类是化学合成类抗球虫药,如常山酮、尼卡巴嗪类等。聚醚类抗球虫药的作用机理是破坏球虫的细胞膜,使其失去调节渗透压的能力,球虫细胞膜吸收过量的钠、钾离子后细胞破裂而死亡[3]。由于化学合成类抗球虫药的结构不同,其抗球虫作用机理也不尽相同。例如三嗪类抗球虫药是通过抑制球虫体内呼吸链酶的活性来抑制球虫的生长繁殖[4]。抗球虫药因具有低毒、价格低廉、防治球虫效果好等特点被广泛应用于畜牧业,但常有过量使用或不规范使用导致动物性食品中药物残留超标的情况。长期食用药物残留超标的食品,会引起人体慢性毒性作用,表现症状为多发性神经病、横纹肌溶解、高钙血症、呼吸衰竭等,甚至会威胁生命安全[5-8]。
近年来,抗球虫药在食品安全监督抽检中屡被检出,向俊等[9]统计发现2020年湖南多地区的肉类样品中检出了磺胺类药物,其中鸡肉类样品检出率高达52.4%。我国《食品安全国家标准食品中兽药最大残留限量》(GB 31650—2019)中明确规定了抗球虫类兽药在食品中的最大残留限量(表1)。因此,实现抗球虫药残留的快速高效检测对保障食品安全,助力我国食品进出口贸易都具有重大意义。目前,抗球虫药残留的检测主要以高效液相色谱[10]、液相色谱串联质谱[11](liquid chromatography-massspectrometry,LC-MS)和超高效液相色谱串联质谱[12](ultraperformance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)等仪器分析方法为主。虽然仪器方法精密度、准确度高,但仪器设备体积大,价格昂贵,样品前处理复杂,仅适用于对准确度和灵敏度要求较高的检测和验证。免疫分析是一种利用标记物(如酶、胶体金、荧光物质等)标记抗体或抗原并对目标检测物进行特异性识别,从而达到定性和定量分析的分析方法,具有灵敏、特异、快速的优势,是快速检测方法的主要技术支撑[13]。应用免疫分析方法可以弥补传统分析方法的不足,实现低成本、高通量的现场快速检测。本文综述了抗球虫药人工抗原的合成方法和免疫分析方法研究进展,以期为食品中抗球虫药残留的快速检测提供参考。
表1 我国国家标准对食品中常见抗球虫药最大残留限量的规定
Table 1 The maximum residue limits of common coccidiostats in foods by China national standards
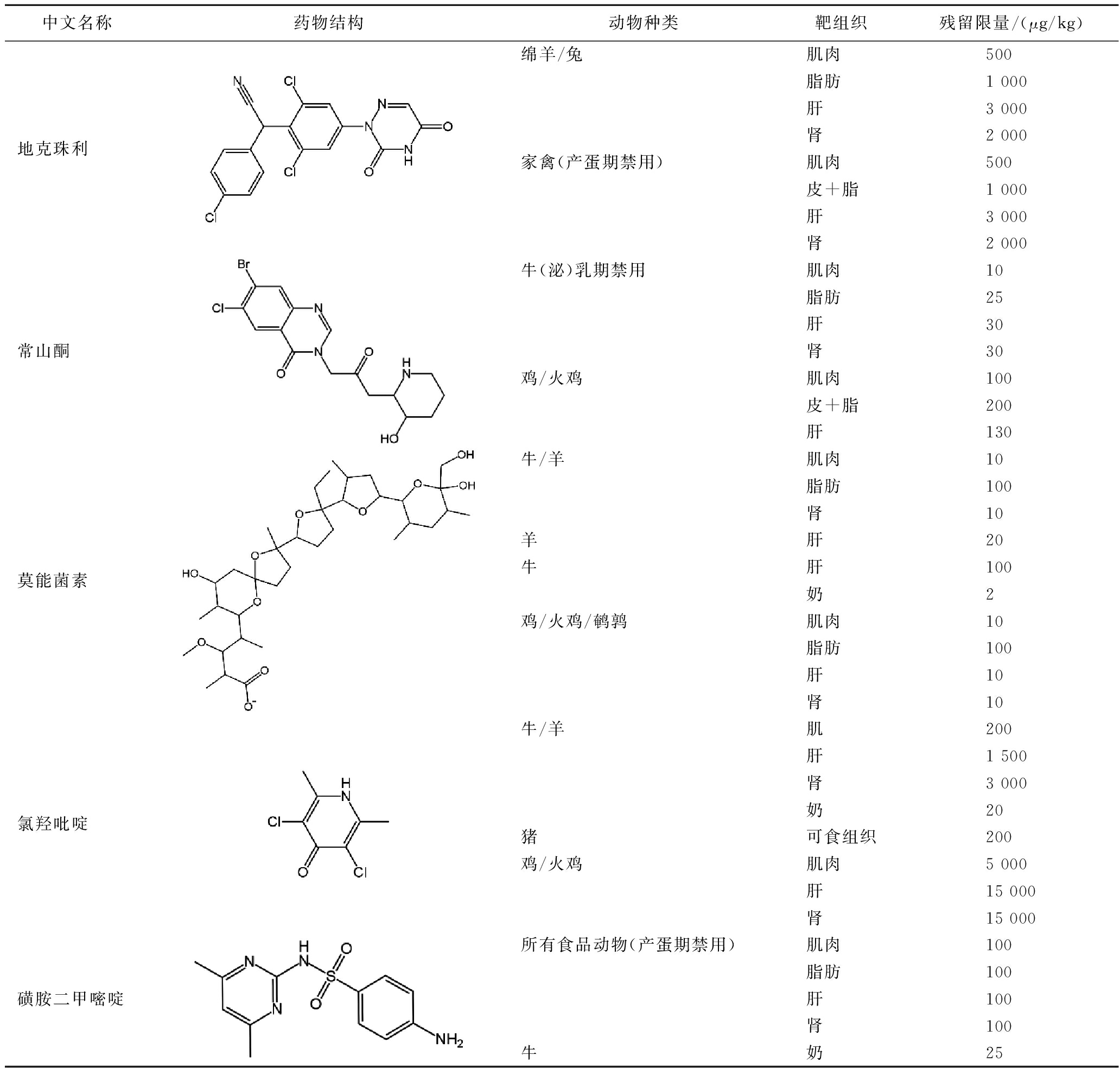
中文名称药物结构动物种类靶组织残留限量/(μg/kg)地克珠利绵羊/兔肌肉500脂肪1 000肝3 000肾2 000家禽(产蛋期禁用)肌肉500皮+脂1 000肝3 000肾2 000常山酮牛(泌)乳期禁用肌肉10脂肪25肝30肾30鸡/火鸡肌肉100皮+脂200肝130莫能菌素牛/羊肌肉10脂肪100肾10羊肝20牛肝100奶2鸡/火鸡/鹌鹑肌肉10脂肪100肝10肾10氯羟吡啶牛/羊肌200肝1 500肾3 000奶20猪可食组织200鸡/火鸡肌肉5 000肝15 000肾15 000磺胺二甲嘧啶所有食品动物(产蛋期禁用)肌肉100脂肪100肝100肾100牛奶25
1 抗球虫药的人工抗原合成
相对分子质量小于1 000的小分子化合物具有反应原性而无免疫原性,不能诱导机体产生相应的特异性抗体,只能被称为半抗原(不完全抗原)[14]。只有小分子化合物与载体偶联形成完全抗原后,才能诱导机体B细胞增殖分化,进而产生特异性抗体用于免疫分析[15]。通过适当的化学改造方法,在半抗原分子结构的特定位置进行基团转化,进而引入连接臂,之后再与大分子载体共价结合,生成半抗原与载体的偶联物,此偶联物即为人工抗原[16]。因此半抗原的设计、改造和人工抗原的制备是制备抗球虫药抗体,建立相应的免疫分析方法的重要环节[17]。
1.1 半抗原的设计与改造
在合成抗球虫药人工抗原的过程中,半抗原自身的分子结构十分重要,应具有一定的复杂性,否则难以产生抗体或产生的抗体效价较低[18]。少数小分子结构基本满足抗体制备需要,且具有活性基团,如氨基、羧基、羟基等,可直接作为半抗原与载体偶联[19]。一些抗球虫药如盐霉素、莫能菌素等,它们的分子结构中均含活性基团羧基,药物分子便可直接作为半抗原与载体偶联,用于检测相应的抗球虫药残留。
大多数抗球虫药的分子结构中没有能够与载体直接共价结合的活性基团,或是与载体偶联后半抗原的特征结构被载体干扰屏蔽,或是活性基团即为具有维持半抗原免疫功能的特征基团,一旦被破坏会导致药物失效[20-21]。这些情况下必须对药物分子进行设计改造为新的半抗原。半抗原改造时需在保持原有分子结构的前提上,使特征基团暴露在人工抗原的表面,以便被动物的免疫细胞所识别,刺激机体产生免疫学特性良好的抗体。最常使用的改造半抗原的方法是在药物分子上引入连接臂。杨小康等[22]用氨基丁酸与拉沙洛西反应制备半抗原,氨基丁酸作为连接臂可使拉沙洛西的活性基团羧基暴露于分子表面,便于与载体偶联(表2)。在改造常山酮的半抗原时,BAI等[25]发现分子含有仲胺基、羟基2种活性基团,由于羟基是常山酮具有抗球虫活性的特征结构,在改造常山酮结构的同时应保护羟基不受破坏,因此,加入三甲基碘硅烷保护羟基,同时采用琥珀酸酐与常山酮反应,构建末端含有羧基的间隔臂,制备常山酮半抗原。这样设计出的半抗原具有较强的诱导免疫应答的作用。
表2 常见半抗原改造方法
Table 2 Common haptens modification methods

改造方法半抗原改造路线优缺点参考文献引入连接臂拉沙洛西优点:可突出抗原决定簇,增强抗体特异性缺点:易产生副反应产物、非特异性抗体[22]引入活性基团氯羟吡啶优点:操作简单、便于与载体蛋白偶联缺点:改变待测物分子的电子分布,影响抗原-抗体识别[23]改造靶标的代谢物、结构类似物4,4'-二硝基羰酰替苯胺优点:代替不易改造的待测物,简化半抗原改造流程,提高改造成功率缺点:导致抗体灵敏度不高、特异性较差[24]
注:LAS为拉沙洛西(lasalocid);EDC为碳二亚胺[N-(3-dimethylaminopropyl)-N′-ethylcarbodiimide];NHS为N-羟基琥珀酰亚胺(N-hydroxysuccinimide)。
针对没有活性基团的抗球虫药,可以通过引入活性基团的方式改造半抗原。CHAO等[23]使氯羟吡啶在碱性条件下与溴乙酸乙酯反应,得到了含酯键的氯羟吡啶衍生物,酯键水解后形成羧基,调pH形成酸性环境,得到含有羧基的氯羟吡啶半抗原(表2)。SHEN等[26]通过计算机模拟设计地克珠利半抗原,在酸性条件下以地克珠利、羧甲基羟胺和吡咯烷为原料合成了含有羧基的地克珠利半抗原。WANG等[27]通过引入羧基的方式制备托曲珠利半抗原。先将托曲珠利(toltrazuril,TOL)和6-溴己酸苄酯反应24 h,再将所得物质干燥减压浓缩,得到一种中间产物TOL-1,将TOL-1和钯碳(钯的含量为10%)在氢气环境中混合反应,经过纯化得到和托曲珠利结构相似且含有羧基的半抗原。
改造靶标分子的代谢物、结构类似物也是一种常见的制备半抗原的方法。SHEN[24]等利用尼卡巴嗪的代谢物4,4′-二硝基羰酰替苯胺[1,3-bis(4-nitrophenyl)urea,4,6-dimethyl-1H-pyrimidin-2-one, DNC]设计半抗原,将DNC与5-氨基-2-硝基苯甲酸反应,在特定反应条件下制得含有羧基的尼卡巴嗪的半抗原(表2)。LIU等[28]发现二硝托胺虽含有可直接与载体蛋白偶联的活性基团(酰胺基团),但实验中以二硝托胺为半抗原时直接制备的抗体灵敏度不高,不能满足实验需求。因此选择二硝托胺的结构类似物3,5-二硝基-2-甲基苯甲酸作为半抗原,该物质含有羧基,可直接与蛋白偶联。
1.2 完全抗原的合成
在制备人工完全抗原时,蛋白质、多聚肽等大分子化合物都可以作为与小分子偶联的载体,其中蛋白质结构复杂,免疫原性好,故一般采用蛋白质作为载体。蛋白质结构中可供连接的基团主要为氨基、羧基等。蛋白质类载体中最为常用的是牛血清蛋白(bovine albumin,BSA)、鸡卵清蛋白和钥孔血蓝蛋白(keyhole limpet hemocyanin,KLH)。
偶联反应通过化学反应完成,可以根据半抗原修饰物中的活性基团的不同而选用不同的偶联方法。对于含有羧基的半抗原,可用碳二亚胺法、活性酯法、混合酸酐法等方法将其与载体蛋白偶联;含有氨基的半抗原,可用戊二醛法或重氮化法将其与载体蛋白偶联;含羟基的半抗原,则可通过琥珀酸酐法、高碘酸钠反应法与载体蛋白偶联。胡梅等[29]采用活泼酯法将含有羧基的莫能霉素、马度米星铵分别与载体蛋白偶联,成功合成完全抗原。TIAN等[30]选择通过活泼酯法将盐霉素的羧基与BSA的氨基共价结合,制备完全抗原。BURKIN等[31]采用活泼酯法分别将含有羧基的盐霉素、甲基盐霉素与BSA成功偶联,制备出2种完全抗原,用于抗体制备。ZHANG等[32]将4-溴丁酸乙酯与地克珠利杂环上的仲铵反应,再加入氢氧化钠使酯键水解,调节pH值,使酯键水解为羧基,形成新的半抗原。再通过活泼酯法半抗原连接到KLH合成完全抗原。LI等[33]用2种方式制备了乙氧酰胺苯甲酯的完全抗原。采取重氮化法使乙氧酰胺苯甲酯的氨基在酸性条件下与亚硝酸钠反应,经重氮化后,与BSA反应生成完全抗原。采用戊二醛法使半抗原和BSA偶联,引入间隔臂并使二者连接在一起,合成完全抗原。人工抗原制备后,经过鉴定,即可作为免疫原免疫实验动物以获取免疫学特性良好的抗体。
2 抗球虫药残留免疫分析方法
2.1 酶联免疫分析法
酶联免疫分析法(enzyme-linked immunosorbent assay,ELISA)将酶的高效催化作用和抗原-抗体特异性识别相结合,用特定的酶标记抗原或抗体,根据酶催化底物的显色程度,对待测物进行定性或定量测定[34]。抗球虫药的ELISA方法已经较为成熟,目前所报道的方法主要为直接竞争法(direct competitive ELISA,dc-ELISA)和间接竞争法(indirect competitive ELISA,ic-ELISA)。抗球虫药抗体多为单克隆抗体(monoclonal antibody,mAb)和多克隆抗体(polyclonal antibody,pAb)也有所报道。
CHEN等[35]在单链抗体片段(single chain fragment variable, scFv)的基础上首次构建了抗拉沙洛西和盐霉素的完整双特异性单链抗体(bispecific single-chain diabody, scDb)。利用scDb建立的ic-ELISA法,可以同时检测鸡肉中的拉沙洛西和盐霉素,IC50分别为3.5 ng/mL和4.1 ng/mL,该方法的灵敏度和特异性均优于scFv亲本抗体。HUANG等[36]制备了一种特性免疫磁珠,在其表面固定单链抗体,建立了一种简单、高效的免疫磁珠ic-ELISA法测定马度米星铵残留,检出限为6.31 μg/kg。LIN等[37]首次制备出氯苯胍的单克隆抗体,以此开发了基于单克隆抗体的ic-ELISA快速筛选样品中氯苯胍的方法。该方法的IC50为0.927 ng/mL。检测结果与LC-MS/MS分析一致。SHEN等[24]基于针对尼卡巴嗪代谢产物DNC的特异性抗体,建立了一种ic-ELISA方法,可检测尼卡巴嗪残留,IC50为0.825 ng/mL,相比WU等[38]建立的检测DNC的ic-ELISA方法(IC50为3.46 ng/mL),IC50有所降低,灵敏度更强。值得一提的是,BAI等[25]建立一种非竞争性ELISA法用于鸡肉中常山酮残留检测,发现在使用抗体相同的情况下,非竞争免疫分析比竞争形式灵敏度提高了3.5倍,检出限为0.13 ng/mL,分析范围提高5倍,该研究可为传统的小分子竞争分析提供新思路。
2.2 化学发光免疫分析法
化学发光免疫分析(chemiluminescence immunoassay,CLIA)是在放射免疫分析方法和酶联免疫分析方法的基础上建立起来的一种超高灵敏度的非放射性标记的免疫分析方法[39]。目前常用的荧光标记物有鲁米诺、异鲁米诺及其衍生物及吖啶酯类。与抗体或抗原结合后,这些标志物性质稳定,并保持较高的反应能力和量子产率,对被标记抗体或抗原的理化特性几乎没有影响[40]。近年来此方法已应用于多个检测领域,在抗球虫药残留检测中也有所进展。LI等[41]建立了一种基于生物素-链霉亲和素体系的检测鸡肉中地克珠利的化学发光免疫分析法,通过制备生物素化的抗地克珠利抗体,结合辣根过氧化物酶标记的链霉亲和素的专一性、多位点结合和信号放大作用,以及催化鲁米诺-过氧化氢体系化学发光,最终实现特异性化学发光信号的读出。用该方法检测鸡肉样品中的地克珠利,灵敏度是ELISA法的4倍,IC50为0.48 μg/kg,检出限为0.02 μg/kg,与HPLC-MS/MS相关性良好。ZHAO等[42]也采用了鲁米诺-过氧化氢发光体系,利用广谱的磺胺单克隆抗体建立了一种快速竞争化学发光法,用于检测鸡肉中32种磺胺类药物。此方法的IC50为0.038~11.2 ng/g,检测限为0.03~26 ng/g,可作为肉类中磺胺类药物残留的常规筛查工具。
2.3 免疫层析试纸法
免疫层析试纸法(immunochromatography assay,ICA)的原理是采用条状纤维膜作为载体,利用吸水垫的毛细管虹吸作用,使待测样抗原或抗体与层析膜上相应的受体(抗体或抗原)结合,所形成的免疫复合物被截留在检测带,通过标记物显色,快速得到可视化结果[43]。常见的标记物有磁性纳米颗粒、彩色纳米颗粒和荧光纳米颗粒等,其中胶体金具有制备简易、性质稳定、显色明显的特点,在抗球虫药检测中应用最为广泛。CHAO等[23]基于氯羟哌啶单克隆抗体,建立了胶体金免疫层析法,用于生鸡样品中氯羟哌啶的快速筛查。该方法检出限为0.14 μg/kg,可以满足现场快速检测的需求。LIU等[28]基于制备的单抗,开发了检测鸡肉中二硝托胺残留的免疫层析检测方法,检出限为2.5 μg/kg。XU等[44]制备针对尼卡巴嗪的高灵敏度单克隆抗体与胶体金的复合物,组装成间接竞争型免疫层析试纸条,用于鸡肉样品中尼卡巴嗪的快速检测,检出限为10 μg/kg(图1)。与同一单克隆抗体建立的ic-ELISA法测定结果非常接近。LIN等[37]基于制备的氯苯胍单克隆抗体开发了一种胶体金免疫层析试纸,该试纸能快速检测虾、鸡胸肉和鸡肝样品中的氯苯胍残留,检出限分别为10、5、10 ng/g。经验证,此免疫层析试纸检测结果与LC-MS/MS的结果一致,仅需10 min便得出定性结果,体现了免疫层析试纸法快速简便的分析优势。此外,FITZGERALD等[45]利用被动吸附法使抗体与绿色羧化微球形成络合物,并组装免疫层析试纸,建立了一种基于图像像素分析的可同时检测多组分残留的免疫层析方法,通过测量像素强度实现了由一次定性到定量化的过程。该方法检测常山酮的检测限为10 ng/mL,对托曲珠利和地克珠利的检测限为100 ng/mL。
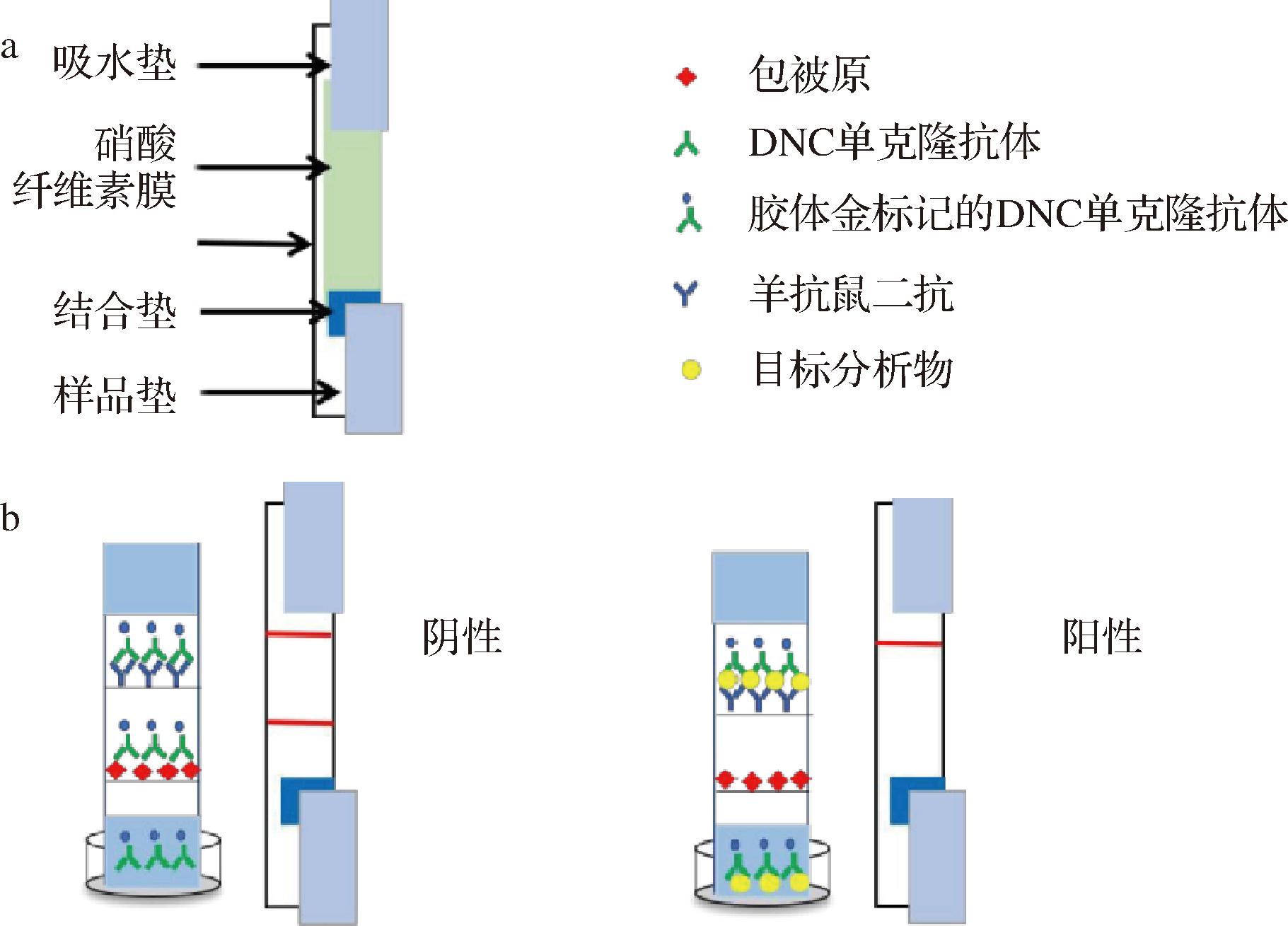
a-试纸的组成;b-检测结果示意图
图1 尼卡巴嗪免疫层析试纸原理图
Fig.1 Principle diagram of nicarbazine immunochromatography assay
2.4 荧光偏振免疫分析法
荧光偏振免疫分析法(fluoresce polarization immunoassay,FPIA)以竞争性免疫分析为基础,反应体系内除待测抗原外,同时加入一定量荧光素-抗原偶联物(示踪物,Tracer),使两者与有限量的特异性抗体竞争结合。荧光素-抗原偶联物在结合抗体后荧光偏振值的变化能反映待测物浓度,荧光偏振值大小与待测抗原浓度呈反比关系[46]。小分子检测中常用的传统荧光素有异硫氰酸荧光素异构体、羧基荧光素、氨基荧光素、镧系元素等、新型荧光素有量子点、荧光链霉亲和素偶联物等。在FPIA过程中,多采用化学反应合成Tracer,制备性能良好的Tracer是FPIA方法的关键[47]。传统荧光素具有性质稳定、荧光寿命长、成本低等优势,在抗球虫药的检测中应用较广。CHEN等[48]合成磺胺甲氧基嘧啶-异硫氰酸酯为Tracer,依靠广特异性的单链抗体,建立了可以用于检测牛奶样品中13种磺胺类药物的荧光偏振免疫分析方法,该方法结合了荧光偏振免疫分析的优点和单链抗体的广谱敏感性,适合应用于现场快速筛查。ZHANG等[49]合成了25种长波长荧光素标记的DNC半抗原作为Tracer,并对其进行了表征,建立了一种基于单克隆抗体的快速检测鸡体内DNC的荧光偏振免疫分析方法。该方法的检出限为24.21 μg/kg,重复性较好,可用于鸡肉中尼卡巴嗪的快速检测。传统荧光素价格低廉,使用广泛,但存在受背景荧光干扰较大和灵敏度较低等缺陷。新型荧光素如量子点、荧光链霉亲和素偶联物等的光稳定性和亮度更强,且发射光谱窄,可显著降低杂信号,提高灵敏度,已广泛应用到兽药残留的检测当中,是未来抗球虫药荧光偏振免疫分析研究的趋势。
2.5 电化学免疫传感器法
电化学免疫传感器(electrochemical immunosensor,ECIA)的原理是将电化学和免疫分析相结合,通过检测探针与抗原结合前后电信号的相对变化来定量靶标的量(图2)[50]。在电化学免疫分析中,碳纳米颗粒、纳米金刚石-石墨、氧化石墨烯等碳纳米材料经常被用来修饰玻碳电极的表面,增强电极的导电能力[51-52]。电化学免疫传感器可在复杂基质中实现抗球虫药残留的快速检测。HU等[53]合成了AuNPs/Zn/Ni-ZIF-8-800@graphene复合材料修饰玻碳电极,构建了间接竞争型电化学免疫传感器,用于检测牛奶中莫能菌素的残留量。该传感器具有优异的电子传导能力,极大地提高了传感器的检测灵敏度,检出限为0.11 ng/mL。基于同一原理,该团队[54]还合成了hemin@Fe-MIL-88 NH2/AuPt作为信号探针,制备了电化学免疫传感器,通过多重信号放大作用实现对马度米星铵的定量检测,检出限为0.045 ng/mL。WANG等[55]合成了一种AuNPs/Ag-GO-NF纳米复合材料作为有效底物固定抗体和放大电化学信号,Ag-GO-NF结构可以为金纳米粒子提供更多暴露的活性中心。所研制的电化学免疫传感器检测磺胺二甲氧嘧啶的检出限为4 pg/mL。该免疫传感器制备简单,兼具高灵敏性和稳定性。该团队[56]还开发了一种以银纳米粒子为氧化还原探针的电化学免疫传感器,用于磺胺二甲嘧啶的特异性检测。葡萄球菌蛋白A具有靶向功能,滴到电极上可以吸收磺胺二甲嘧啶单克隆抗体,可提高免疫反应效率。在最佳条件下,此传感器的检出限为3 pg/mL。
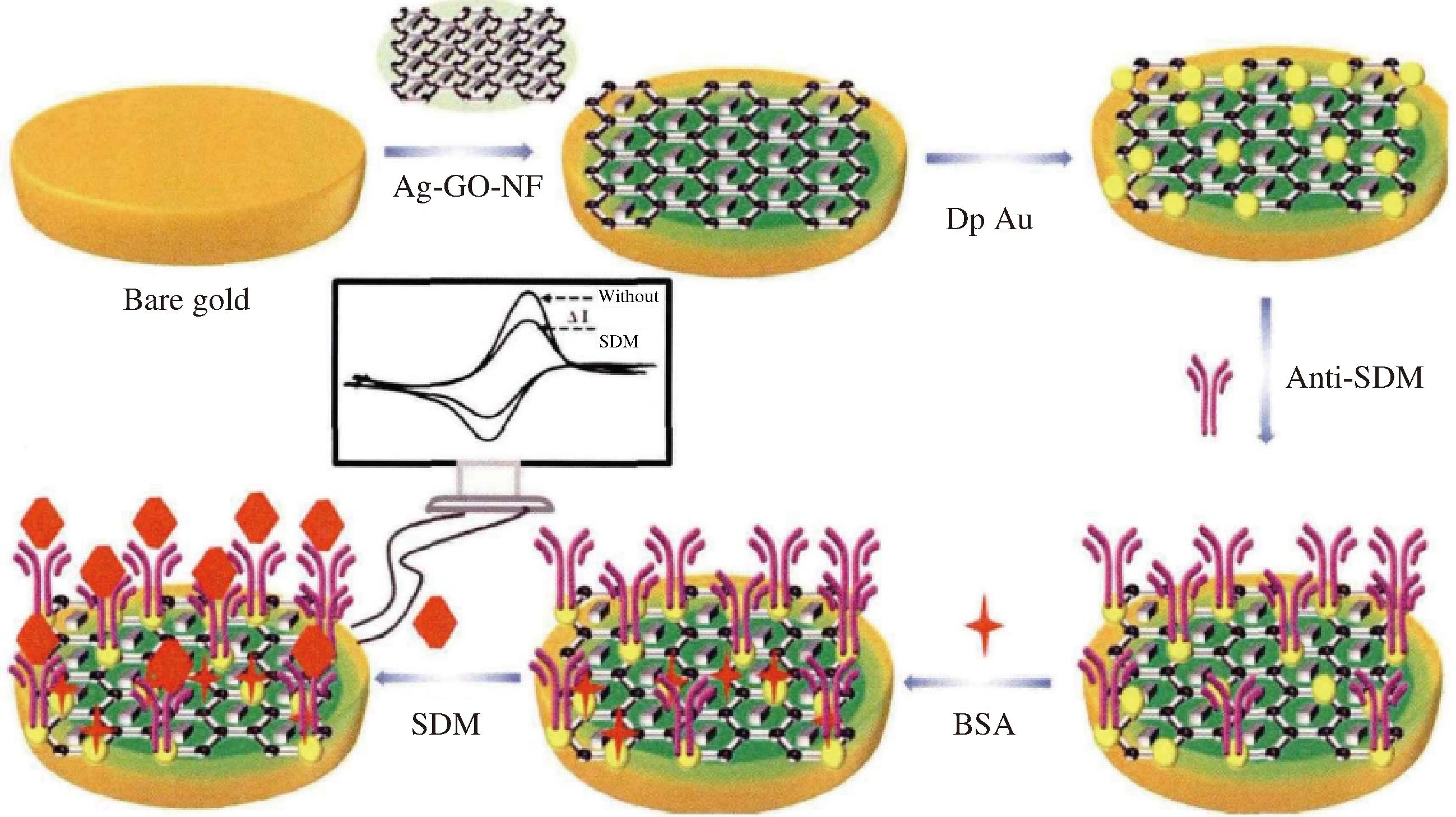
图2 磺胺二甲氧嘧啶电化学免疫传感器原理图
Fig.2 Principles of sulfadimethoxine electrochemical immunosensor
注:Bare gold为裸露的金电极;GO为氧化石墨烯(graphene oxide);NF为Nafion膜;Dp为电沉积(electrodeposition);SDM为磺胺二甲氧嘧啶(sulfadimethoxine);Anti为抗体(antibody)。
3 总结与展望
抗球虫药作为兽药或者动物饲料中的添加剂,在禽畜养殖中有着广泛的应用。随着社会的不断发展,世界各国对抗球虫药允许的最大残留限量正逐步下调。目前动物性食品中抗球虫药残留超标的情况仍有发生,人们对抗球虫药的检测要求将越来越高。免疫分析方法以其灵敏、快速、低成本等独特优势在众多检测方法中脱颖而出,在抗球虫药检测中得到了广泛的应用。本文综述了免疫分析方法在抗球虫药残留检测中的应用(表3)。酶联免疫分析方法是现阶段抗球虫药免疫分析方法中最常见的一类,具有操作简单、灵敏快速、应用广泛的优势,但有大量手动加样步骤,易出现人为误差。化学发光免疫分析方法无辐射、标记物有效期长、自动化程度高,但抗原或抗体被标记过发光物质后会改变免疫反应性能,且发光剂标记率重现性较差。免疫层析试纸法体积小而便携、结果判定简单直观,可实现大批量快速筛查,但灵敏度和精确度普遍偏低,多用于定性及半定量检测。荧光偏振免疫分析法无需洗涤,适用于快速筛选,不受样品颜色以及仪器条件影响,但该方法灵敏度低于ELISA法,需要荧光偏振检测设备,仪器成本较高。电化学免疫传感器检测灵敏,但稳定性差,用特殊材料修饰的电极只能满足单个样品的测试。
表3 免疫分析方法检测食品中抗球虫药残留的应用
Table 3 Application of immunoassay for detection of coccidiostats residues in food

待测物抗体类型检测方法检测样品IC50检测限回收率参考文献常山酮mAbELISA鸡肉-0.13 ng/mL83.00%~115.00%[25]托曲珠利mAbAuNP-ICA鸡肉-2.37 μg/kg80.40%~111.50%[27]氯羟哌啶mAbELISA鸡肉0.275 ng/mL0.018 ng/mL95.70%~98.40%[23]mAbAuNP-ICA鸡肉-0.14 μg/kg95.70%~98.40%[23]mAbELISA猪肉、鸡肉0.952 μg/kg10 μg/kg73.10%~115.50%[32]地克珠利mAbELISA鸡肉、鸭肉0.05 ng/mL0.10 ng/mL85.00%~102.50%[26]mAbCLIA鸡肉0.48 μg/kg0.02 μg/kg90.30%~120.4%[41]二硝托胺mAbAuNP-ICA鸡肉-2.5 μg/kg98.00%~109.00%[28]盐霉素pAbELISA鸡肉、鸡蛋0.55 ng/mL0.03 ng/mL67.00%~110.00%[31]甲基盐霉素pAbELISA鸡肉、鸡蛋0.57 ng/mL0.03 ng/mL67.00%~110.00%[31]mAbELISA鸡肉、鸭肉 0.825 ng/mL-74.40%~111.70%[24]尼卡巴嗪mAbAuNP-ICA牛奶-10 ng/mL99.00%~100.00%[38]mAbAuNP-ICA鸡胸、鸡肝0.14 ng/mL5 ng/kg93.50%~115.60%[44]mAbFPIA鸡肉28.39 ng/mL24.21 μg/ kg74.20%~85.80%[49]乙氧酰胺苯甲酯mAbELISA鸡肉、鸡肝0.66 μg/L0.21 ug/kg85.40%~98.40%[33]氯苯胍mAbELISA虾、鸡胸、鸡肝0.927 ng/mL0.18 ng/g87.80%~102.00%[37]mAbAuNP-ICA虾、鸡胸、鸡肝-5 ng/g87.80%~109.30%[37]mAbECIA鸡蛋-0.045 ng/mL96.40%~106.00%[54]马杜米星铵scFvELISA鸡肉15.43 ng/mL6.31 ng/mL72.93%~89.51%[36]scDbELISA鸡肝4.1 ng/mL6.8 μg/kg88.60%~90.20%[35]拉沙洛西scDbELISA鸡肝3.5 ng/mL5.4 μg/kg89.20%~92.70%[35]莫能菌素mAbECIA牛奶-0.11 ng/mL94.40%~112.00%[53]磺胺二甲氧嘧啶mAbECIA猪肉、猪肝-4 pg/mL90.69%~111.10%[55]磺胺二甲嘧啶mAbECIA猪肉、猪肝-3 pg/mL92.60%~106.70%[56]
注:mAb表示单克隆抗体,pAb表示多克隆抗体,scFv表示单链抗体片段,scDb表示双特异性单链抗体,“-”表示未报道。
抗球虫药残留免疫分析方法应在以下几方面不断完善。一是个别抗球虫药的结构复杂,无法合成完全抗原,缺乏特异性抗体,从而无法建立免疫检测方法。如癸氧喹酯、氨丙啉等还没有半抗原合成及免疫分析方法的报道。针对未有免疫检测方法或抗体的抗球虫药,应探究其结构特点、基团活性等,设计合成人工抗原,扩大抗球虫药抗体库,提高抗体的灵敏度和特异性。二是检测方法库还有待完善和均衡发展。仍有部分抗球虫药的免疫检测方法研究较少、检测模式单一、灵敏度较低,如拉沙洛西、乙氧酰胺苯甲酯、氯苯胍等。针对该点,今后的研究方向可以结合质谱分析、量子点、生物传感器、免疫芯片等新技术来开发更为灵敏、便捷的高通量免疫检测方法,提高检测灵敏度,缩短检测时间。三是单克隆抗体的制备周期较长,批间差别较大,缺乏大批量生产的条件。可以探索开发性能更稳定、能大批量制备、批次间差异小的新型优质抗体,如单链抗体、基因工程抗体,或核酸适配体、受体蛋白等抗体代替物。四是人工抗原的制备均是一种载体蛋白偶联一种半抗原,其制备出的抗体特异性高,但也存在一定局限性,所建立的免疫分析方法只能检测某一种或结构极其相似的抗球虫药,无法像仪器方法一样能够同时对多种抗球虫药残留进行多残留检测。因此,开发能够同时快速检测多种抗球虫药残留的免疫分析方法也将是免疫分析方法的发展趋势。可将免疫分析与人工智能、云计算、大数据等技术结合,实现动物性食品生产加工全过程中抗球虫药残留的智能化和动态化监测。
[1] CONLOGUE G, FOREYT W J, WESCOTT R B.Bovine coccidiosis:Protective effects of low-level infection and coccidiostat treatments in calves[J].American Journal of Veterinary Research, 1984, 45(5):863-866.
[2] MARTINS R R, SILVA L J G, PEREIRA A M P T, et al.Coccidiostats and poultry:A comprehensive review and current legislation[J].Foods, 2022, 11(18):2738.
[3] HUET A C, BIENENMANN-PLOUM M, VINCENT U, et al.Screening methods and recent developments in the detection of anticoccidials[J].Analytical and Bioanalytical Chemistry, 2013, 405(24):7733-7751.
[4] ZHANG M, LI X Y, ZHAO Q P, et al.Anticoccidial activity of novel triazine compounds in broiler chickens[J].Veterinary Parasitology, 2019, 267:4-8.
[5] ZHANG D H, LU H S, WANG E, et al.Toxic myopathy following monensin exposure:A case report with 12 year follow-up[J].Int.J.Clin.Exp.Med, 2018, 11:5 390-5 393.
[6] ROILA R, BRANCIARI R, PECORELLI I, et al.Occurrence and residue concentration of coccidiostats in feed and food of animal origin;human exposure assessment[J].Foods, 2019, 8(10):477.
[7] RYBICKI M J, BECUE I, DAESELEIRE E, et al.Solvent Front Position Extraction and some conventional sample preparation techniques for the determination of coccidiostats in poultry feed by LC-MS/MS[J].Scientific Reports, 2022, 12:3786.
[8] LI L H, PAN Y H, TAO Y F, et al.Development of a sensitive monoclonal antibody-based indirect competitive enzyme-linked immunosorbent assay for the determination of monensin in edible chicken tissues[J].Food Analytical Methods, 2019, 12(6):1479-1486.
[9] 向俊, 唐万里, 刘慧, 等.湖南省各地区畜禽肉中磺胺类药物残留情况分析[J].食品与机械, 2020, 36(9):82-86;107.
XIANG J, TANG W L, LIU H, et al.Detection and analysis of sulfonamides residues in meat poultry in Hunan province[J].Food&Machinery, 2020, 36(9):82-86;107.
[10] SILVA J M, AZC RATE F J, KNOBEL G, et al.Multiple response optimization of a QuEChERS extraction and HPLC analysis of diclazuril, nicarbazin and lasalocid in chicken liver[J].Food Chemistry, 2020, 311:126014.
RATE F J, KNOBEL G, et al.Multiple response optimization of a QuEChERS extraction and HPLC analysis of diclazuril, nicarbazin and lasalocid in chicken liver[J].Food Chemistry, 2020, 311:126014.
[11] WANG B, LIU J Y, ZHAO X, et al.Determination of eight coccidiostats in eggs by liquid-liquid extraction-solid-phase extraction and liquid chromatography-tandem mass spectrometry[J].Molecules, 2020, 25(4):987.
[12] ZHAO X, WANG B, XIE K Z, et al.Development and comparison of HPLC-MS/MS and UPLC-MS/MS methods for determining eight coccidiostats in beef[J].Journal of Chromatography B, 2018, 1087-1088:98-107.
[13] XIAO X Y, HU S, LAI X C, et al.Developmental trend of immunoassays for monitoring hazards in food samples:A review[J].Trends in Food Science &Technology, 2021, 111:68-88.
[14] 许梓红, 罗林, 陈子键, 等.拟除虫菊酯类农药及其代谢物免疫检测技术研究进展[J].食品与发酵工业, 2022, 48(8):320-328.
XU Z H, LUO L, CHEN Z J, et al.Progress on the development of immunoassays for pyrethroids insecticides and their metabolites[J].Food and Fermentation Industries, 2022, 48(8):320-328.
[15] GUO L L, XU L G, SONG S S, et al.Development of an immunochromatographic strip for the rapid detection of maduramicin in chicken and egg samples[J].Food and Agricultural Immunology, 2018, 29(1):458-469.
[16] 宋娟, 王榕妹, 王悦秋, 等.半抗原的设计、修饰及人工抗原的制备[J].分析化学, 2010, 38(8):1211-1218.
SONG J, WANG R M, WANG Y Q, et al.Hapten design, modification and preparation of artificial antigens[J].Chinese Journal of Analytical Chemistry, 2010, 38(8):1211-1218.
[17] 王晶, 王耀, 王方雨, 等.草甘膦人工抗原的制备及兔源多抗的ELISA鉴定[J].食品科学, 2017, 38(4):65-69.
WANG J, WANG Y, WANG F Y, et al.Preparation of artificial antigen and ELISA identification of rabbit polyclonal antiserum for the detection of glyphosate[J].Food Science, 2017, 38(4):65-69.
[18] 张煜超, 王芳芳, 李周敏, 等.小分子药物人工抗原的合成与鉴定研究进展[J].药物分析杂志, 2014, 34(6):947-951.
ZHANG Y C, WANG F F, LI Z M, et al.Research progress of artificial antigen synthesis and identification for micromolecule drug[J].Chinese Journal of Pharmaceutical Analysis, 2014, 34(6):947-951.
[19] 赵静, 赵其阳, 张耀海, 等.螺虫乙酯单克隆抗体的制备及酶联免疫分析方法的建立[J].食品与发酵工业, 2022, 48(10):247-254.
ZHAO J, ZHAO Q Y, ZHANG Y H, et al.Preparation of monoclonal antibody-based immunoassay for the detection of spirotetramat[J].Food and Fermentation Industries, 2022, 48(10):247-254.
[20] 李容庆, 权春善, 张丽影, 等.人工抗原合成研究进展[J].中国生物工程杂志, 2018, 38(12):65-75.
LI R Q, QUAN C S, ZHANG L Y, et al.Progress in the synthesis of artificial antigen[J].China Biotechnology, 2018, 38(12):65-75.
[21] 曹啸天, 陈秀金,李兆周, 等.杀菌剂半抗原的合成及其免疫分析技术的研究进展[J].中国免疫学杂志, 2020, 36(24):3039-3044;3054.
CAO X T, CHEN X J, LI Z Z, et al.Research progress of immunoassay technology and synthesis of hapten for fungicides[J].Chinese Journal of Immunology,2020, 36(24):3039-3044;3054.
[22] 杨小康, 张绘艳, 顾建红, 等.拉沙里菌素单克隆抗体的研制及间接竞争ELISA检测方法的建立[J].中国畜牧兽医, 2017, 44(10):3049-3056.
YANG X K, ZHANG H Y, GU J H, et al.Preparation of monoclonal antibody against lasalocid and deveopment of indirect competitive ELISA detection method[J].China Animal Husbandry &Veterinary Medicine.2017, 44(10):3049-3056.
[23] CHAO M J, LIU L Q, SONG S S, et al.Development of a gold nanoparticle-based strip assay for detection of clopidol in the chicken[J].Food and Agricultural Immunology, 2020, 31(1):489-500.
[24] SHEN H, ZHAO Q Q, CHEN B L, et al.Preparation and identification of an anti-nicarbazin monoclonal antibody and its application in the agriculture and food industries[J].Annals of Translational Medicine, 2022, 10(10):557.
[25] BAI Y C, WANG Y H, LI Q, et al.Binding affinity-guided design of a highly sensitive noncompetitive immunoassay for small molecule detection[J].Food Chemistry, 2021, 351:129270.
[26] SHEN H, LI C, SUN H, et al.Generation and characterization of an anti-diclazuril monoclonal antibody and development of a diagnostic enzyme-linked immunosorbent assay for poultry[J].Frontiers in Nutrition, 2022, 9:910876.
[27] WANG Z X, ZHANG J, LIU L Q, et al.A colorimetric paper-based sensor for toltrazuril and its metabolites in feed, chicken, and egg samples[J].Food Chemistry, 2019, 276:707-713.
[28] LIU J, SONG S S, WU A H, et al.Development of a gold nanoparticle-based lateral-flow strip for the detection of dinitolmide in chicken tissue[J].Analytical Methods: Advancing Methods and Applications, 2020, 12(25):3210-3217.
[29] 胡梅. 抗球虫药单克隆抗体的制备及其在电化学免疫传感器中的应用[D].无锡:江南大学, 2019.
HU M.Preparation of the anti-coccidiostat mAb and its application in electrochemical immunosensor[D].Wuxi:Jiang University, 2019.
[30] TIAN W H, ZHANG X X, SONG M R, et al.An enzyme-linked immunosorbent assay to detect salinomycin residues based on immunomagnetic bead clean-up[J].Food Analytical Methods, 2017, 10(9):3042-3051.
[31] BURKIN M A, GALVIDIS I A.Simultaneous immunodetection of ionophore antibiotics, salinomycin and narasin, in poultry products and milk[J].Analytical Methods: Advancing Methods and Applications, 2021, 13(13):1550-1558.
[32] ZHANG Y F, LI S F, PENG T, et al.One-step icELISA developed with novel antibody for rapid and specific detection of diclazuril residue in animal-origin foods[J].Food Additives &Contaminants. Part A, Chemistry, Analysis, Control, Exposure &Risk Assessment, 2020, 37(10):1633-1639.
[33] LI Z Z, WANG Y, LI D M, et al.Development of an indirect competitive enzyme-linked immunosorbent assay for screening ethopabate residue in chicken muscle and liver[J].RSC Advances, 2017, 7(57):36 072-36 080.
[34] 王佳, 陶晓奇.动物源食品中磺胺类药物残留的免疫分析方法研究进展[J].食品与发酵工业, 2018, 44(10):260-267.
WANG J, TAO X Q.Development of immunoassays for sulfonamides residues detection in edible animal foods[J].Food and Fermentation Industries, 2018, 44(10):260-267.
[35] CHEN Y X, ZHAO K X, HUANG J J, et al.Detection of salinomycin and lasalocid in chicken liver by icELISA based on functional bispecific single-chain antibody (scDb) and interpretation of molecular recognition mechanism[J].Analytical and Bioanalytical Chemistry, 2021, 413(28):7031-7041.
[36] HUANG J J, ZHAO K, LI M X, et al.Development of an immunomagnetic bead clean-up ELISA method for detection of Maduramicin using single-chain antibody in chicken muscle[J].Food and Agricultural Immunology, 2021, 32(1):820-836.
[37] LIN L, SONG S S, WU X L, et al.Determination of robenidine in shrimp and chicken samples using the indirect competitive enzyme-linked immunosorbent assay and immunochromatographic strip assay[J].The Analyst, 2021, 146(2):721-729.
[38] WU A H, WU X L, ZHENG Q K, et al.Preparation of an anti-4,4’-dinitrocarbanilide monoclonal antibody and its application in an immunochromatographic assay for anticoccidial drugs[J].Food and Agricultural Immunology, 2018, 29(1):1 162-1 172.
[39] 李静雯, 刘清珺, 杜美红, 等.化学发光免疫分析技术在微生物检测中的应用[J].分析测试学报, 2017, 36(11):1409-1416.
LI J W, LIU Q J, DU M H, et al.Application of chemiluminescence immunoassay in microbiological detection[J].Journal of Instrumental Analysis, 2017, 36(11):1409-1416.
[40] 蒋艳, 余姓鸿, 谢礼, 等.化学发光免疫方法在食品安全检测中的应用及展望[J].食品安全质量检测学报, 2020, 11(20):7603-7609.
JIANG Y, YU X H, XIE L, et al.Application and prospect of chemiluminescence immunoassay in food safety detection[J].Journal of Food Safety &Quality, 2020, 11(20):7603-7609.
[41] LI Y, WANG Y H, LI P P, et al.High efficient chemiluminescent immunoassays for the detection of diclazuril in chicken muscle based on biotin-streptavidin system[J].Food and Agricultural Immunology, 2020, 31(1):255-267.
[42] ZHAO B L, CUI P L, LIU J, et al.Production of generic monoclonal antibody and development of chemiluminescence immunoassay for determination of 32 sulfonamides in chicken muscle[J].Food Chemistry, 2020, 311:125966.
[43] DI NARDO F, CHIARELLO M, CAVALERA S, et al.Ten years of lateral flow immunoassay technique applications:Trends, challenges and future perspectives[J].Sensors, 2021, 21(15):5185.
[44] XU X X, LIU L Q, WU X L, et al.Ultrasensitive immunochromatographic strips for fast screening of the nicarbazin marker in chicken breast and liver samples based on monoclonal antibodies[J].Analytical Methods, 2020, 12(16):2143-2151.
[45] FITZGERALD J, LEONARD P, DANAHER M, et al.Rapid simultaneous detection of anti-protozoan drugs using a lateral-flow immunoassay format[J].Applied Biochemistry and Biotechnology, 2015, 176(2):387-398.
[46] ZHANG H Y, YANG S P, DE RUYCK K, et al.Fluorescence polarization assays for chemical contaminants in food and environmental analyses[J].TrAC Trends in Analytical Chemistry, 2019, 114:293-313.
[47] 王战辉, 米铁军, 沈建忠.荧光偏振免疫分析检测粮食及其制品中的真菌毒素研究进展[J].中国农业科学, 2012, 45(23):4862-4872.
WANG Z H, MI T J, SHEN J Z.Advance in fluorescence polarization immunoassay for the determination of mycotoxins in cereals and related products[J].Scientia Agricultura Sinica, 2012, 45(23):4862-4872.
[48] CHEN M, WEN K, TAO X Q, et al.A novel multiplexed fluorescence polarisation immunoassay based on a recombinant bi-specific single-chain diabody for simultaneous detection of fluoroquinolones and sulfonamides in milk[J].Food Additives &Contaminants. Part A, Chemistry, Analysis, Control, Exposure &Risk Assessment, 2014, 31(12):1959-1967.
[49] ZHANG Q D, ZOU M, WANG W Y, et al.Design, synthesis, and characterization of tracers and development of a fluorescence polarization immunoassay for rapid screening of 4,4′-dinitrocarbanilide in chicken muscle[J].Foods, 2021, 10(8):1822.
[50] JIA J Z, ZHANG H X, QU J T, et al.Immunosensor of nitrofuran antibiotics and their metabolites in animal-derived foods:A review[J].Frontiers in Chemistry, 2022,10:813666.
[51] 仇彩霞, 陈秀金, 付祖耀, 等.基于石墨烯-壳聚糖复合膜修饰电极的麻保沙星电化学免疫传感器的构建[J].食品与发酵工业, 2022, 48(16):50-55.
QIU C X, CHEN X J, FU Z Y, et al.Establishment of an electrochemical immunosensor for marbofloxacin analysis based on graphene oxide-chitosan nanocomposite film modified glass carbon electrode[J].Food and Fermentation Industries, 2022, 48(16):50-55.
[52] 朱小钿, 张燕, 彭宏威, 等.免疫传感器在食品安全检测中的应用[J].食品安全质量检测学报, 2019, 10(3):626-632.
ZHU X T, ZHANG Y, PENG H W, et al.Application of immunosensors in food safety testing[J].Journal of Food Safety and Quality, 2019, 10(3):626-632.
[53] HU M, HU X F, ZHANG Y P, et al. Label-free electrochemical immunosensor based on AuNPs/Zn/Ni-ZIF-8-800@graphene composites for sensitive detection of monensin in milk[J].Sensors and Actuators B:Chemical, 2019, 288:571-578.
[54] HU M, WANG Y, YANG J F, et al. Competitive electrochemical immunosensor for maduramicin detection by multiple signal amplification strategy via hemin@Fe-MIL-88 NH2/AuPt[J].Biosensors and Bioelectronics, 2019, 142:111554.
[55] WANG A P, MA K K, YOU X J, et al.A sensitive analysis of sulfadimethoxine using an AuNPs/Ag-GO-Nf-based electrochemical immunosensor[J].Journal of Solid State Electrochemistry, 2022, 26(2):515-525.
[56] WANG A P, ZHANG C Y, YOU X J, et al.A novel electrochemical immunosensor for sulfadimidine detection based on staphylococcal protein A-AuNPs/Ag-GO-Nf modified electrode[J].Chemistry Select, 2021, 6(32):8262-8269.