菊芋在中国种植面积广阔,自然资源丰富,且作为非粮作物,具有易栽培、高产量、抗逆性较强、可以广泛适应土壤和气候条件等优点[1-2],是一种发展潜力巨大的生物质资源。菊芋全株包括地上叶片和秸秆以及地下块茎3部分,可以用于抗氧化剂、生物燃料、菊糖、低聚果糖等多种生物产品的开发。
菊芋叶片富含绿原酸、黄酮、多酚等重要的生物活性成分,已被证实具有多种功效以及药用价值,例如抗肿瘤、抗氧化、降血脂、降血糖等功能[3]。菊芋秸秆是一种重要的木质纤维素资源,秸秆中的结构性碳水化合物(纤维素和半纤维素)可以用于生物乙醇等燃料生产,是生物炼制的宝贵原料。菊芋块茎富含菊粉、蛋白质和淀粉等成分,菊粉作为一种可溶性膳食纤维,对人类饮食、营养和医药产品等方面具有特殊价值[4]。
本文总结了菊芋全株生物制品的来源以及适用的生产技术,回顾了目前国内外菊芋资源开发的研究进展,并讨论了它们对菊芋未来生物精制的可行性。全面介绍了基于菊芋的可再生生物质资源和生物基产品转化的最新进展,旨在促进菊芋产业更高附加值生产的新前景。
1 菊芋简介
菊芋又名洋姜、鬼子姜,属菊科,葵花属,是一种多年生的双子叶草本植物[5]。由于其具有良好的抗寒、抗旱性和抵御病虫害的能力,使得菊芋相较于大多数经济作物更具生长竞争优势,能够在环境恶劣的边际土地生长,在欧洲、加拿大、北美等地区种植广泛,我国的山东、青海、山西、黑龙江、江苏、四川、宁夏和新疆等地区均有种植[6]。菊芋主要由叶片、茎秆以及地下部分的块茎和根系组成。秋季开黄色小花,叶片为椭圆形,多毛,在茎的顶端附近互生,茎秆高约1~3 m,直立状,有分枝,初期的幼茎粗壮多汁,有毛刺,随着生长周期变长,茎秆会木质化。菊芋根系为纤维状,可以有效从土壤中获取养分,块茎生长在地下根部,由于品种、栽培条件、生长周期等的不同,造成块茎形状差异很大,从节状到圆形的簇状不等,颜色主要有淡褐色、白色、红色和紫色等[7]。
2 菊芋叶片高值化利用研究进展
2.1 菊芋叶片的主要活性成分
菊芋叶片中富含多种生物活性物质,例如酚酸类、黄酮类、倍半萜类、多糖和氨基酸等[8],其中绿原酸类化合物、黄酮类化合物和倍半萜内酯类化合物为主要活性物质,已被广泛证实具有抗菌、抗炎、抗肿瘤和抗氧化的功能。菊芋叶中绿原酸含量为0.040%~2.139%[9],总类黄酮含量为49.4 mg/g DM~86.4 mg/g DM,差异较大,这与菊芋生长阶段和生态区域以及收获时间有很大关系。通过分析菊芋全年生长周期内的绿原酸动态含量,发现当年11月份的菊芋叶片中绿原酸的含量最高,为1.52%[10]。因此,选择适宜的区域和品种以及收获周期有利于进一步开发利用菊芋叶片资源。菊芋叶片提取物中富含倍半萜内酯,倍半萜内酯类化合物是目前最普遍的次级代谢物类别之一,YUAN等[11]在菊芋叶分离出一种新的倍半萜内酯3-Hydroxy-8b-tigloyloxy-1,10-dehydroariglovin,同时评估了10种已知倍半萜内酯的细胞毒性,对MCF-7、A549和HeLa癌细胞系进行了测试。结果表明,所有倍半萜内酯对测试的癌细胞系都表现出有效的细胞毒活性。
2.2 菊芋叶片主要活性成分的提取
菊芋叶中主要生物活性物质的含量与提取的工艺方法,如提取条件、提取溶剂、温度和时间以及固液比有关。选择适合的提取技术是获得具有较高生物活性的化合物的必要条件。表1总结了菊芋叶片主要活性成分提取方法、最佳条件和提取效果。
表1 菊芋叶片主要活性成分提取方法及条件
Table 1 Extraction methods and conditions of major bioactive substances of Jerusalem artichoke leaves
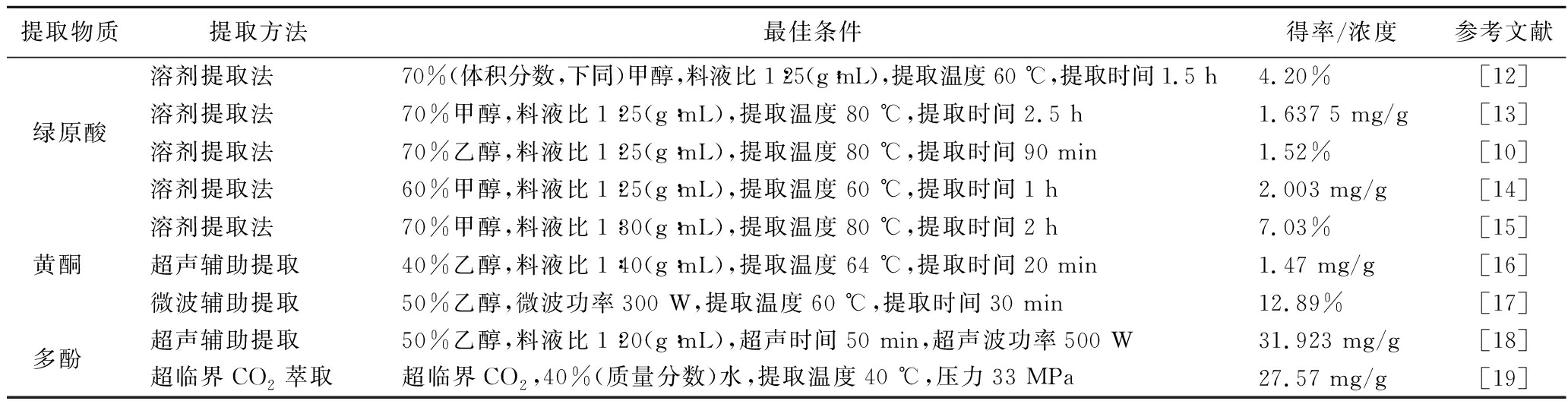
提取物质提取方法最佳条件得率/浓度参考文献绿原酸溶剂提取法70%(体积分数,下同)甲醇,料液比1∶25(g∶mL),提取温度60 ℃,提取时间1.5 h4.20%[12]溶剂提取法70%甲醇,料液比1∶25(g∶mL),提取温度80 ℃,提取时间2.5 h1.637 5 mg/g[13]溶剂提取法70%乙醇,料液比1∶25(g∶mL),提取温度80 ℃,提取时间90 min1.52%[10]溶剂提取法60%甲醇,料液比1∶25(g∶mL),提取温度60 ℃,提取时间1 h2.003 mg/g[14]黄酮 溶剂提取法70%甲醇,料液比1∶30(g∶mL),提取温度80 ℃,提取时间2 h7.03%[15]超声辅助提取40%乙醇,料液比1∶40(g∶mL),提取温度64 ℃,提取时间20 min1.47 mg/g[16]微波辅助提取50%乙醇,微波功率300 W,提取温度60 ℃,提取时间30 min12.89%[17]多酚 超声辅助提取50%乙醇,料液比1∶20(g∶mL),超声时间50 min,超声波功率500 W31.923 mg/g[18]超临界CO2萃取超临界CO2,40%(质量分数)水,提取温度40 ℃,压力33 MPa27.57 mg/g[19]
传统的菊芋叶片活性成分的提取方法有水提取法、溶剂提取法。菊芋叶中的有机酚酸类化合物易溶于水,随着温度的升高化合物的溶解度增大。水提取法操作简单且成本较低,污染更小,但缺点在于提取效率低,后续处理困难。有机溶剂提取法相对于水提取法应用较多,通过利用菊芋叶中的有效成分在不同溶剂中溶解度不同的原理,从而将目标成分析出[20]。高明哲等[21]对比了3种不同溶剂对提取绿原酸的影响,认为水醇混合溶剂是提取菊芋叶中绿原酸的最佳溶剂,通过正交试验,得出最佳工艺条件为以pH值为3的60%乙醇,回流提取2 h。孙鹏程[14]采用甲醇加热回流法提取,最佳条件为60%甲醇为溶剂,料液比1∶25(g∶mL),60 ℃下回流2次,每次0.5 h。使用乙醇、甲醇等有机溶剂提取的产品得率更高,纯度更好,易于分离纯化,但有机溶剂相对来说成本较高,实际生产中应优化提取条件。
随着提取技术的迅速发展,一些诸如微波辅助提取、超声波辅助提取等提取技术也逐步应用到菊芋叶片活性成分的提取中。微波辅助提取原理是利用微波均匀加热含有目标样品的混合物,导致细胞中含有的极性物质能够吸收微波能从而释放出热量,活性成分释放到细胞外溶剂中。由于加热效率高,可以广泛应用于天然产物中活性成分的快速提取[22]。叶礼卉[17]采用微波辅助法从菊芋叶片中提取总黄酮,最佳工艺条件为提取温度60 ℃,微波功率300 W,提取时间0.5 h,乙醇体积分数50%,总黄酮得率为12.89%。超声波辅助提取通过超声波中的机械效应可以加速内部扩散,使更多溶剂渗透到样品基质中,此外,超声诱导的空化过程能够有效破坏生物细胞壁,以促进内容物的释放[23]。马剑等[18]应用超声波辅助从菊芋叶中提取多酚,通过响应面优化设计,在超声波功率为500 W、处理时间50 min、料液比1∶20(g∶mL),乙醇体积分数50%条件下,多酚得率为31.923 mg/g。与热水提取的传统提取方法相比,超声辅助提取可以在更短的提取时间内得到更高的多酚产量,克服了以往的传统提取工艺耗时长、溶剂用量大的主要限制。而且由于提取温度较低,所提取的产品能够保留更高的生物活性。
除上述提取方法外,近年来新兴了一种技术——超临界流体萃取,通过使用超临界流体,通常是CO2气体,从固体甚至液体材料中提取活性成分。由于超临界流体相对于液体的扩散速度更为快速,且黏度更低,因此对于相同的提取过程,超临界流体萃取的时间更短。具有降低能耗、低温操作、溶剂相无溶质、产品质量高等优点,在菊芋叶片提取活性物质方面有着广泛的应用前景。OSTOLSKI等[19]采用超临界流体萃取技术从菊芋叶片中提取多酚化合物,通过对比超临界CO2萃取和以水为辅助溶剂的超临界CO2萃取的提取效果,发现在40%(质量分数)水为辅助溶剂,萃取温度40 ℃,压力33 MPa的工艺条件下,总多酚得率最高达27.57 mg/g。水作为助溶剂可以改变混合物的极性,从而提高极性多酚化合物的提取效率。该研究为进一步开发用于从菊芋等生物质中提取多酚的超临界CO2萃取技术提供了可能性。
3 菊芋秸秆高值化利用研究进展
3.1 菊芋秸秆的生物组成
菊芋秸秆是菊芋生物质资源的重要组成部分,同时也是一种重要的木质纤维素资源。菊芋秸秆的细胞壁主要由纤维素、半纤维素、木质素和果胶构成[24]。纤维素是由β-1,4-D-吡喃葡萄糖单元组成的线性链状多聚物[25],不溶于水、乙醇等。葡萄糖单元形成的分子内和分子间的氢键作用,促进了纤维素的聚集,导致纤维素聚合度不同,并导致其具有结晶和无定形结构域的超分子结构。半纤维素是由戊糖和己糖(主要是木糖和甘露糖)组成的多聚糖,这些杂聚糖相互连接,经常具有分支和取代基。由于半纤维素无定形结构,导致其热稳定较差。木质素是一种由苯基丙烷类单体经不同程度甲氧基化作用而合成的非规则多酚类生物聚合物。一般认为,植物细胞壁的微结构是木质素和多糖紧密结合的基质[26]。从生物精炼的角度来看,纤维素、半纤维素和木质素的选择性分离是生产增值生物分子的必要条件。
3.2 菊芋秸秆的生物转化路线
3.2.1 菊芋秸秆的预处理
菊芋秸秆的生物转化主要是基于利用纤维素和半纤维素,为了将其转化为可发酵糖,首先需要进行预处理操作。预处理的目的是打破半纤维和木质素的屏障作用,提高降解酶和底物之间的可及性以及水解步骤中游离糖的总收率,增加生物产量。菊芋秸秆木质纤维素预处理方法主要包括物理法、化学法、生物法。表2总结了近年来菊芋秸秆的预处理方法及酶解效果。
表2 菊芋秸秆的不同预处理方法对比
Table 2 Comparison of different pretreatment methods of Jerusalem artichoke stalks

预处理方法预处理条件酶解条件葡萄糖产量纤维素转化率参考文献酸性预处理0.05 g/mL硝酸,121 ℃,1 h10 FPU/g纤维素38.5 g/L72 h转化89%[27]稀硫酸30 U/g纤维素酶和30 U/g木聚糖酶55.49 g/L-[28]碱性预处理2%(质量分数)氢氧化钠,4%(体积分数)过氧化氢20 FPU/g基质93.8 g/L72 h转化96.42% [29]0.02 g/mL氢氧化钠20 FPU/g干物质115.8 g/L-[30]0.02 g/mL氢氧化钠,0.05 g/mL过氧化氢0.2%(质量分数)--[31]酸碱结合预处理0.5%(体积分数)硫酸,1 mol/L氢氧化钠80 FPU/g干物质(57.3±1.4) g/L68.3%[32]0.05 g/mL硝酸和氢氧化钠10 FPU/g纤维素(44.81±2.25) g/L97.6%[33]生物预处理黑曲霉---[17]
注:-表示参考文献中未提及。
物理预处理是最基础的预处理方法,通过采用超声波、磨碎、挤压和超声波等机械的方法,使菊芋秸秆粒径减小,结晶度和聚合度降低,从而增大木质纤维素的可及面积。
化学预处理方法广泛应用于多种生物质,也是目前最常见的菊芋秸秆预处理方法,它是利用化学试剂或溶剂来降低菊芋秸秆的聚合度和结晶度,常用的包括酸预处理法、碱预处理法和酸碱结合预处理法。酸预处理常采用硫酸、硝酸、盐酸等酸进行预处理,酸能够打破秸秆原料本身的结构,有效地降解半纤维素,将其解聚成单体糖,降低纤维素结晶度,提高酶解效率。由于高浓度酸具有强腐蚀性与强氧化性,对设备抗腐蚀性要求高且难以进行回收,因此低浓度酸更常用于在实际生产中。相瑞娟等[28]探究了稀硫酸对菊芋秸秆进行预处理的最优条件,优化结果表明,用质量分数为1.5%的稀硫酸处理菊芋秸秆,在料液比为1∶8(g∶mL)的条件下于121 ℃下反应1 h,获得最高还原糖得率为53.7%。预处理后的水解液同步糖化发酵与分步糖化发酵乙醇产量分别为25.91 g/L和![]() 等[27]研究了硝酸预处理对菊芋茎杆水解及后续发酵的影响,结果显示经0.05 g/mL硝酸处理的菊芋秸秆经水解和发酵后,葡萄糖和乙醇浓度较高,与更常用的酸(硫酸和盐酸)和碱(氢氧化钠和氢氧化钾)相比,硝酸的葡萄糖产率大约高出47%~74%,表明硝酸也是一种很有潜力的木质纤维生物质预处理催化剂。碱性预处理过程中由于添加碱性溶液产生的酯化反应和糖苷键的断裂,会造成木质纤维生物质结构的降解,有效去除半纤维素和木质素,增大反应结合位点的暴露表面积以便于酶水解。氢氧化钠和碳酸钠是已经使用的主要碱性溶液。KHATUN等[30]分别用不同浓度的H2SO4和NaOH对菊芋秸秆进行预处理,对比了酸预处理和碱预处理对菊芋秸秆生物成分的变化。结果表明,0.02 g/mL NaOH最适合菊芋秸秆预处理,原因是NaOH预处理比H2SO4预处理更加能够有效去除木质素,对纤维素和半纤维素的富集效果更好,菊粉损失更少。LI等[29]用响应面方法优化了碱性过氧化氢对菊芋秸秆的预处理,最佳条件为2%(质量分数)NaOH和4%(体积分数)H2O2,预处理后的纤维素含量最高能够达到51.18%,纤维素结晶度增加了21.87%。高含量的纤维素以及与纤维素酶良好的接触有利于菊芋秸秆的酶解。由于单一的预处理只能部分去除木质素或半纤维素组分,导致糖产量相对较低,因此,上述方法常被结合起来,通过两阶段连续的酸碱结合预处理去除生物质原料中的木质素和半纤维素组分,从而改善连续脱木质素的效果。根据处理顺序不同又可分为先酸后碱预处理和先碱后酸预处理[34]。通过研究不同酸碱浓度、酸碱顺序对菊芋秸秆预处理后剩余固体组成和酶解效率的影响,联合预处理后,由于半纤维素和木质素的去除,生物质中的纤维素含量大幅度增加,在0.05 g/mL NaOH和HNO3的碱-酸预处理下达到了最高葡萄糖得率,菊芋秸秆预处理效率为97.6%[33]。表明酸碱结合预处理可以有效打破木质纤维素生物质的顽固结构,释放出更多的单糖,明显提高了酶解转化率。
等[27]研究了硝酸预处理对菊芋茎杆水解及后续发酵的影响,结果显示经0.05 g/mL硝酸处理的菊芋秸秆经水解和发酵后,葡萄糖和乙醇浓度较高,与更常用的酸(硫酸和盐酸)和碱(氢氧化钠和氢氧化钾)相比,硝酸的葡萄糖产率大约高出47%~74%,表明硝酸也是一种很有潜力的木质纤维生物质预处理催化剂。碱性预处理过程中由于添加碱性溶液产生的酯化反应和糖苷键的断裂,会造成木质纤维生物质结构的降解,有效去除半纤维素和木质素,增大反应结合位点的暴露表面积以便于酶水解。氢氧化钠和碳酸钠是已经使用的主要碱性溶液。KHATUN等[30]分别用不同浓度的H2SO4和NaOH对菊芋秸秆进行预处理,对比了酸预处理和碱预处理对菊芋秸秆生物成分的变化。结果表明,0.02 g/mL NaOH最适合菊芋秸秆预处理,原因是NaOH预处理比H2SO4预处理更加能够有效去除木质素,对纤维素和半纤维素的富集效果更好,菊粉损失更少。LI等[29]用响应面方法优化了碱性过氧化氢对菊芋秸秆的预处理,最佳条件为2%(质量分数)NaOH和4%(体积分数)H2O2,预处理后的纤维素含量最高能够达到51.18%,纤维素结晶度增加了21.87%。高含量的纤维素以及与纤维素酶良好的接触有利于菊芋秸秆的酶解。由于单一的预处理只能部分去除木质素或半纤维素组分,导致糖产量相对较低,因此,上述方法常被结合起来,通过两阶段连续的酸碱结合预处理去除生物质原料中的木质素和半纤维素组分,从而改善连续脱木质素的效果。根据处理顺序不同又可分为先酸后碱预处理和先碱后酸预处理[34]。通过研究不同酸碱浓度、酸碱顺序对菊芋秸秆预处理后剩余固体组成和酶解效率的影响,联合预处理后,由于半纤维素和木质素的去除,生物质中的纤维素含量大幅度增加,在0.05 g/mL NaOH和HNO3的碱-酸预处理下达到了最高葡萄糖得率,菊芋秸秆预处理效率为97.6%[33]。表明酸碱结合预处理可以有效打破木质纤维素生物质的顽固结构,释放出更多的单糖,明显提高了酶解转化率。
生物预处理是利用微生物对秸秆原料中木质素的降解能力,破坏纤维素和半纤维素之间的连接键,从而去除木质素,提高水解效果。微生物预处理方法相较于物理和化学预处理具有低能耗和不需要添加化学试剂的优势。常用于木质纤维素生物预处理的微生物包括真菌、细菌、放线菌,其中以真菌预处理应用最为广泛。叶礼卉[17]利用黑曲霉对菊芋秸秆进行微生物预处理,利用热重分析、热重-傅里叶红外光谱联用分析、裂解气相色谱-质谱联用分析等分析结果表明,黑曲霉预处理改变了菊芋秸秆木质纤维素的成分和热解行为,提高了处理后的纤维素热解效率。然而,能有效降解木质素并同时回收纤维素的真菌菌株较少,并且尚未在其商业化应用方面取得突破。
3.2.2 基于菊芋秸秆的产品研究进展
国际能源安全和气候变化的双重压力正在鼓励生物燃料的发展。全球能源需求主要通过煤炭、天然气和石油等不可再生能源来满足。菊芋秸秆生物转化为还原糖生产乙醇、丁醇和甲烷等燃料在生物能源领域具有巨大的应用潜力。
3.2.2.1 生物乙醇
生物乙醇相较于传统的化石燃料,在环境和安全方面具有更大的潜力,是一种具有可持续性的生物能源。一般来说,纤维素和半纤维素部分可以通过不同途径发酵转化为乙醇,对于生物乙醇的生产过程,纤维素的酶水解,也称为糖化,它可以通过不同的工艺路线进行,包括分步糖化发酵、同步糖化发酵、联合生物加工等[35],其中以前2种技术应用最广。分步糖化发酵是将水解和发酵分开进行的两阶段过程,预处理的生物质首先通过酶降解为葡萄糖和木糖,然后将这些糖发酵成乙醇[36],该工艺的主要优点是酶水解和发酵都在各自的最适条件下发挥作用,缺点在于水解过程中糖的积累会有反馈抑制作用,最终影响乙醇产量。同步糖化发酵是在同一反应器中同时进行生物质的糖化与发酵的过程,由于能够将酶水解产生的葡萄糖迅速转化为乙醇,减少了反应过程中糖的积累,使反馈抑制作用降低,提高了水解效率。相较于分步糖化发酵,该工艺操作更加简便,设备要求更低,而且反应体系中乙醇的生成能够降低染菌的可能性。然而,由于水解和发酵的最佳条件不同,难以同时达到酶和微生物的最佳工艺参数。国内外学者对利用菊芋秸秆发酵生产乙醇的技术路线进行了大量研究。LI等[29]用2%(质量分数)NaOH和4%(体积分数)H2O2碱-过氧化氢方法对菊芋秸秆进行预处理,进而酶解发酵,结果表明葡萄糖产量在生物质浓度为30%的情况下达到最大值93.8 g/L,通过同步糖化发酵工艺产生55.6 g/L的乙醇,比通过分步糖化发酵工艺产生的乙醇高出36.5%。KIM等[32]以预处理后的菊芋秸秆和块茎为底物,用马克斯克鲁维酵母(Kluyveromyces marxianus CBS 1555)进行了有效的分批和补料分批同步糖化和发酵,分别获得了29.1 g/L和70.2 g/L的乙醇。可发酵糖转换率分别为83.6%和70.8%。这些结果表明,结合块茎和茎部水解物是有效利用菊芋生物质发酵的有效策略。
3.2.2.2 生物丁醇
生物丁醇是一种重要的平台化学品和生物燃料,其具有低挥发性、低腐蚀性、高能量密度、高热值等优异的燃料特性,在取代不可再生燃料方面越来越受到关注,此外,丁醇作为各种工业的化学替代品也有需求。因此,许多研究人员考虑合适的原料和生物工艺技术,以低成本生产生物丁醇。近年来,从木质纤维素生物质到丙酮-丁醇-乙醇(acetone-butanol-ethanol,ABE)发酵的生物丁醇生产,由于其可持续供应以及作为植物的非食用部分,不和食品供应产生竞争,而在全球范围内引起了人们的广泛兴趣,这一过程主要由细菌乙酰丁酸梭状芽胞杆菌进行。XUE等[37]首先将菊芋秸秆用于生物丁醇生产,研究了碱-过氧化氢预处理与水洗中和相结合的策略,可以有效提高酶的效率和丁醇产量,在最佳条件下可生产11.8 g/L丁醇。此外,在水洗过程中可以节省超过64%的水,丁醇产量增加了31.1%。汽化渗透工艺的丁醇产量高于传统的渗透汽化工艺,更适用于ABE发酵的产品回收,在冷凝液中产生323.4~348.7 g/L丁醇(542.7~594.0 g/L ABE)。为利用菊芋秸秆生物质高效生产生物丁醇提供了重要的支持和策略。
3.2.2.3 生物甲烷
由微生物厌氧消化产生的沼气是一种重要的可燃性混合气体,主要由甲烷(CH4)和二氧化碳(CO2)组成。沼气可以替代天然气或将其用作运输燃料,将秸秆等农业废弃物用于沼气生产既可以处理有机废物,改善环境问题,又能产生可再生能源,是一种可持续进程。预处理技术和厌氧发酵模式是限制秸秆高效厌氧发酵的主要原因,国内外学者为此做了大量研究。孟艳等[38]研究了不同浓度的HCl和NaOH预处理对菊芋秸秆厌氧消化产甲烷特性的影响。结果表明用HCl降解半纤维素效果最好,为17.26%~31.75%,NaOH降解木质素的效果最好,为6.86%~16.87%。0.4 mol/L HCl处理菊芋秸秆获得了最大的累积甲烷产量,为(229.57±13.77) mL/g,这高于大多数木质纤维素类废弃物的产甲烷潜力值,且有效缩短了菊芋秸秆的厌氧消化周期,为提高菊芋秸秆资源的综合利用率提供了理论依据。
3.2.2.4 2,3-丁二醇
2,3-丁二醇是一种重要的液体燃料和生物基化学品,可用作溶剂和许多合成聚合物和树脂的前体。在化学品、药品、食品以及化妆品等领域表现出广泛的潜在用途。半纤维素和纤维素水解物中常见的所有糖都可以转化为丁二醇,包括葡萄糖、木糖、阿拉伯糖、甘露糖、半乳糖和纤维素。在生物精炼方面,从可再生资源中生产2,3-丁二醇的微生物正在引起更多的关注。LI等[39]研究了由肺炎克雷伯菌(Klebsiella pneumoniae CICC 10011)发酵菊芋秸秆与块茎转化成高价值的2,3-丁二醇。采用分段通气策略进行补料分批糖化发酵,68 h得到901.2 mmol/L(80.5 g/L)目标产物(2,3-丁二醇和乙酰酮)。目标产物的浓度、产量和生产率分别为16.9%、16.8%和23.4%,结果表明将糖原料与木质纤维素水解物结合,可以使还原糖的浓度大大提高,是一种增加菊芋发酵生产2,3-丁二醇的有效策略。
4 菊芋块茎高值化利用研究进展
菊芋块茎是菊芋全株的主要生物质部分,与其他以淀粉为主要碳水化合物的植物不同,菊芋块茎中富含菊粉、蛋白质和其他生物活性成分,被誉为膳食纤维的良好来源。传统上,菊芋块茎主要用于食用,烹饪、腌制酱菜、加工菊芋脯等,附加价值低。近二十年来,随着科学技术的进步,国内外广泛探索了菊芋块茎在食品行业、生物燃料、医学制药等领域的应用前景。
4.1 食品行业
菊芋块茎中的菊粉占块茎总糖含量的80%,菊粉作为益生元可以调节肠道微生物菌群,改善肠道环境,这些生物活性已被广泛研究证明[40-41]。研究发现菊粉的聚合度和贮存条件对其益生元作用有影响,聚合度较低的菊粉具有更高的活性[42]。菊粉可以作为甜味剂、脂肪替代品等用于食品中,用来替代乳制品、肉制品和烘焙食品中的脂肪、糖和面粉,增加膳食纤维含量的同时提高了产品的感官品质。RADOVANOVIC等[43]开发了富含菊芋粉的小麦面包,结果显示添加25%菊芋粉制成的面包具有最佳的营养价值和热值以及低血糖指数。胡雅婕等[44]人从菊芋中提取菊粉,将其应用于馒头食品中,结果表明适量的菊粉添加能够使馒头的质构和感官品质得到改善,菊粉最佳添加量为8%。
4.2 生物制品
菊芋是目前公认的一种新兴能源作物,用富含菊粉的菊芋块茎可生产不同的微生物产品,如生物乙醇、生物柴油、乳酸、2,3-丁二醇等,详见表3。菊粉提取物首先通过酸或酶水解为可发酵糖,然后利用酵母及其他真菌和细菌等进行发酵。菊芋块茎的乙醇产量相当于从甘蔗中获得的乙醇产量,是玉米产量的2倍。WANG等[45]构建了一种用于菊粉乙醇发酵的天然酵母菌株,在最终的二倍体菌株JZD-InuMKCP实现了菊粉和菊芋块茎的高效乙醇发酵,用200 g/L菊粉和250 g/L的菊芋块茎粉进行乙醇发酵,生产率分别为2.44 g/(L·h)和3.13 g/(L·h)。ZHAO等[46]研究了使用圆红冬孢酵母菌(Rhodosporidium toruloides Y4)从菊芋块茎中生产脂质的情况,以菊芋水解物为底物发酵时,获得了39.6 g/L的脂质滴度和56.5%(质量分数)的细胞脂质含量。结果表明,菊芋块茎作为大规模微生物脂质生产的原料是可行的。CHOI等[47]开发了一种利用菊芋块茎发酵生产乳酸的高效生物工艺,研究发现副干酪乳杆菌(Lactobacillus paracasei KCTC 13169)对菊芋块茎的发酵效率高于其他乳杆菌,无需在发酵前进行酸性或酶水解。以菊芋提取液为原料,在含糖量为111.6 g/L的条件下直接发酵生产92.5 g/L的乳酸,菊粉转化为乳酸的效率达到理论产率的98%。上述研究表明,菊芋具有作为生物能源原料的巨大潜力。
表3 菊芋块茎生物精制产品
Table 3 Biological refinery products from Jerusalem artichoke tubers

生物产品发酵菌株发酵条件产量参考文献生物乙醇Saccharomyces cerevisiae KCCM 5054930 ℃,36 h36.2 g/L[48]Saccharomyces sp.W028 ℃,96 h95.5 g/L[49]Engineering S.cerevisiae strain JZH30 ℃,96 h95.19 g/L[45]生物柴油Rhodosporidium toruloides Y430 ℃,36 h39.6 g/L[46]Rhodotorula mucilaginosa TJY15a30 ℃,108 h10.2 g/L[50]乳酸Aspergillus niger SL-09 and Lactobacillus sp. G-0230 ℃,36 h120.5 g/L[51]Lactococcus lactis30 ℃,90 h142 g/L[52]Lactobacillus paracasei KCTC 1316937 ℃,72 h92.5 g/L[47]Bacillus coagulans XZL450 ℃,50 h134 g/L[53]2,3-丁二醇Bacillus licheniformis ATCC 1458050 ℃,30 h103.0 g/L[54]Bacillus polymyxa ATCC 1232130 ℃,55 h44 g/L[55]Paenibacillus polymyxa ZJ-930 ℃,24 h36.92 g/L[56]Klebsiella pneumoniae37 ℃,40 h91.63 g/L[57]
4.3 医学与制药
菊芋块茎中含有丰富的抗真菌、抗癌和抗氧化的成分,主要包括菊粉、蛋白质、粗纤维和矿物质等[58]。块茎中的蛋白质含量一般为1%~2%,并富含所有必需氨基酸,从块茎中分离出的蛋白质具有抗癌特性[59]。矿物质含量约为菊芋块茎干重的1.2%,铁、钙和钾的含量尤为丰富,具有补血、保护心血管、增强人体免疫力等功能[60]。菊芋也是天然抗氧化剂的良好来源。据报道,菊芋块茎提取物富含酚类和黄酮类化合物,具有良好的自由基清除能力,可以减缓多糖分解速度,降低血糖水平,有体外抗氧化、促进伤口愈合和抗糖尿病等重要作用[61]。菊芋块茎的高值化利用主要基于块茎中提取的菊粉,菊粉在调节肠道特性、血液代谢物和肝酶方面发挥着巨大作用[59],使得菊芋在医学和制药业具有多种用途。YU等[62]研究了菊芋菊粉对高脂饮食(high-fat diet,HFD)喂养小鼠高脂血症和肠道菌群的影响。菊粉降低了肝脏甘油三酯和总胆固醇水平,高脂血症小鼠的肝脏超氧化物歧化酶活性增加,肝脏丙二醛水平降低。同时改善了肠道菌群,显著增加了HFD喂养的小鼠肠道中双歧杆菌的数量。因此,菊粉是预防和治疗高脂血症的潜在有效成分。SHAO等[63]研究了硫酸盐修饰的菊芋菊粉的生物活性,通过细胞活力检测法测定评估菊芋多糖的硫酸化衍生物(sulfated derivative,S-JAP)对人肝细胞癌(HepG2)细胞增殖的抑制作用,结果显示染色后不同浓度的S-JAP对HepG2细胞的抑制率均显著高于纯化的菊芋多糖。此外,S-JAP成功地促进了细胞凋亡。因此,从菊芋块茎中提取的硫酸盐修饰多糖被证明具有有效的抗肿瘤活性,具有进一步应用的潜力。此外,KANG等[64]发现通过局部给药菊芋块茎菊粉可以减轻局部小鼠模型中的特应性皮炎症状。因此,菊芋产品可被视为皮肤过敏性炎症性疾病的潜在治疗剂或补充剂。抗糖尿病作用也是菊芋块茎菊粉常被描述的另一个有益特性。WANG等[65]报道了用菊芋块茎菊粉通过修复由链脲佐菌素引起的肝损伤治疗糖尿病大鼠,在缓解糖尿病症状方面具有积极作用,此外,作者观察到菊芋块茎菊粉通过植物乳杆菌发酵对α-葡萄糖苷酶活性的抑制作用增加。因此,菊芋块茎菊粉可以作为调节血糖药物的添加剂。
5 总结与展望
菊芋作为一种非粮能源作物,具有栽培投入低、作物产量高和广泛适应气候和土壤条件的优势,适合在我国的滩涂、盐碱地等地区种植,起到保护生态环境的作用。同时,菊芋是生物经济发展的一个有前途的生物质,既能作为生物活性成分来源,也是生物燃料生产的可持续原料。本文对菊芋全株包括叶片、茎秆、块茎已经进行的大量研究进行了总结,认为研发探索适用于菊芋全株的加工方法,提高菊芋资源的利用率,生产种类丰富且附加值高的菊芋相关产品,是未来实现菊芋高值化综合利用的发展趋势。
为使菊芋的综合利用在经济和技术上更具有可行性,进一步的研究工作可以集中在以下5个方面:a)优选菊芋品种,优化种植技术,以提高作物产量,降低生产成本;b)深入研究菊芋叶片酚酸类、黄酮类、萜类等生物活性物质的作用机理,分析鉴定各成分结构与其功能的关系,在保留生物活性的基础上选用最适提取分离方法,以及多种提取技术相结合应用提高得率;c)高效的预处理技术是菊芋茎秆转化为生物燃料的关键,探索不同预处理方法之间的协同作用,减少反应抑制物,利用半纤维素酶、果胶酶等混合酶进行组合优化开发更有效的预处理方法;d)加强菊芋相关产品发酵工艺的优化,筛选开发高效发酵菌株和具有高活性和稳定性的酶,改进生物反应器设计,促进大规模生产过程中菊芋精炼产品的生产效率;e)完善菊芋相关产品的行业标准,改进菊芋块茎贮存问题,规范菊芋加工流程,重视副产物的再次利用,提高菊芋全株利用的经济价值。
[1] 刘丹梅, 姜吉禹, 杨君. 菊芋的生态功能研究[J]. 北方园艺, 2009(10):140-142.
LIU D M, JIANG J Y, YANG J. Ecological functions of Jerusalem artichoke[J]. Northern Horticulture, 2009(10):140-142.
[2] 鹿天阁, 周景玉, 马义, 等. 优良的防沙治沙植物: 菊芋[J]. 辽宁林业科技, 2007(2):58-60.
LU T G, ZHOU J Y, MA Y, et al. Jerusalem artichoke-an excellent sand control plant[J]. Liaoning Forestry Science and Technology, 2007(2):58-60.
[3] 杨明俊, 王亮, 吴婧, 等. 菊芋叶黄酮类化合物的体外抗氧化活性研究[J]. 贵州农业科学, 2011, 39(4):52-54.
YANG M J, WANG L, WU J, et al. Study on antioxidant activity of flavonoids from Helianthus tuberosus leaves in vitro[J]. Guizhou Agricultural Sciences, 2011, 39(4):52-54.
[4] 魏凌云, 王建华, 郑晓冬, 等. 菊粉研究的回顾与展望[J]. 食品与发酵工业, 2005, 31(7):81-85.
WEI L Y, WANG J H, ZHENG X D, et al. Review and prospects of the inulin research[J]. Food and Fermentation Industries, 2005, 31(7):81-85.
[5] 孙纪录, 贾英民, 桑亚新. 菊芋资源的开发利用[J]. 食品科技, 2003, 28(1):27-29.
SUN J L, JIA Y M, SANG Y X. The development and utilization of Jerusalem artichoke resource[J]. Food Science and Technology, 2003, 28(1):27-29.
[6] LI L L, LI L, WANG Y P, et al. Biorefinery products from the inulin-containing crop Jerusalem artichoke[J]. Biotechnology Letters, 2013, 35(4):471-477.
[7] LIAVA V, KARKANIS A, DANALATOS N, et al. Cultivation practices, adaptability and phytochemical composition of Jerusalem artichoke (Helianthus tuberosus L.): A weed with economic value[J]. Agronomy, 2021, 11(5):914.
[8] 汪悦, 薛夫光, 蒋林树, 等. 菊芋饲料的营养价值、生物活性及其对动物生理功能的调控作用[J]. 动物营养学报, 2020, 32(2):497-507.
WANG Y, XUE F G, JIANG L S, et al. Nutritional value and biological activity of Jerusalem artichoke feed and its regulation effects on animal physiological function[J]. Chinese Journal of Animal Nutrition, 2020, 32(2):497-507.
[9] 张海娟. 不同产地菊芋叶片中绿原酸含量变化及其提取、分离技术研究[D]. 南京: 南京农业大学, 2010.
ZHANG H J. Study on extraction and separation technology of chlorogenic acid content variation in Jerusalem artichoke(Helianthus tuberosus L.)leaves from different producing areas[D]. Nanjing: Nanjing Agricultural University, 2010.
[10] 赵俊宏, 王红星, 曹长青, 等. 菊芋叶片中绿原酸的提取工艺优化及动态含量研究[J]. 河南科学, 2021, 39(12):1935-1940.
ZHAO J H, WANG H X, CAO C Q, et al. Extraction process optimization and dynamic content of chlorogenic acid from Helianthus tuberosus leaves[J]. Henan Science, 2021, 39(12):1935-1940.
[11] YUAN X Y, CHENG M C, GAO M Z, et al. Cytotoxic constituents from the leaves of Jerusalem artichoke (Helianthus tuberosus L.) and their structure-activity relationships[J]. Phytochemistry Letters, 2013, 6(1):21-25.
[12] 苗芹, 叶明国, 刘苏静, 等. 高效液相色谱法测定菊芋叶和向日葵叶中绿原酸[J]. 化学与生物工程, 2017, 34(2):63-67.
MIAO Q, YE M G, LIU S J, et al. Determination of contents of chlorogenic acid in Helianthus tuberosus L. leaves and Helianthus annuus L. leaves by HPLC[J]. Chemistry &Bioengineering, 2017, 34(2):63-67.
[13] 张海娟, 刘玲, 郑晓涛, 等. 菊芋叶片绿原酸的提取工艺条件优化研究[J]. 食品工业科技, 2011, 32(5):261-262; 265.
ZHANG H J, LIU L, ZHENG X T, et al. Study on optimization of extraction technology of chlorogenic acid in Helianthus tuberosus leaves[J]. Science and Technology of Food Industry, 2011, 32(5):261-262, 265.
[14] 孙鹏程. 菊芋叶片中高纯度绿原酸的规模化制备工艺研究[D]. 沈阳: 辽宁大学, 2014.
SUN P C. Study on large-scale preparation of high purity chlorogenic acid from Helianthus tuberosus L. leaves[D]. Shenyang: Liaoning University, 2014.
[15] 郑晓涛, 隆小华, 刘玲, 等. 菊芋叶总黄酮提取工艺优化及含量动态变化[J]. 天然产物研究与开发, 2012, 24(11):1642-1645, 1689.
ZHENG X T, LONG X H, LIU L, et al. Extraction and dynamic content of total flavonoids in leaves of Helianthus tuberosus[J]. Natural Product Research and Development, 2012, 24(11):1642-1645; 1689.
[16] 何舒澜, 朱扶蓉, 朱宏阳, 等. 响应面法优化组培菊芋叶总黄酮提取工艺及其抑菌活性研究[J]. 福建农业学报, 2017, 32(8):897-904.
HE S L, ZHU F R, ZHU H Y, et al. Optimization of flavonoids extraction from leaves of Helianthus tuberosus L. by response surface methodology and determination of antimicrobial activity of resulting extract[J]. Fujian Journal of Agricultural Sciences, 2017, 32(8):897-904.
[17] 叶礼卉. 微波和微生物预处理对菊芋秸秆生物质成分利用的影响研究[D]. 合肥: 合肥工业大学, 2021.
YE L H. Effect of microwave and microbial pretreatment on utilization of biomass components of Jerusalem artichoke straw[D]. Hefei: Hefei University of Technology, 2021.
[18] 马剑, 张宏志, 王愈, 等. 菊芋叶多酚的超声辅助提取及抗氧化活性研究[J]. 保鲜与加工, 2021, 21(11):50-57.
MA J, ZHANG H Z, WANG Y, et al. Study on ultrasonic-assisted extraction and antioxidant activity of polyphenols from Jerusalem artichoke leaves[J]. Storage and Process, 2021, 21(11):50-57.
[19] OSTOLSKI M, ADAMCZAK M, BRZOZOWSKI B, et al. Screening of functional compounds in supercritical carbon dioxide extracts from perennial herbaceous crops[J]. Agriculture, 2021, 11(6):488.
[20] 庄英斌, 刘军海, 郭景学. 天然活性多酚提取、纯化及功能性研究进展[J]. 粮食与油脂, 2012, 25(8):44-48.
ZHUANG Y B, LIU J H, GUO J X. Research progress for natural active polyphenol extraction, purification and its functionality[J]. Cereals &Oils, 2012, 25(8):44-48.
[21] 高明哲, 肖红斌, 谭成玉, 等. 菊芋叶中绿原酸提取工艺研究[C].全国第七届中医药继承创新与发展研讨会文集. 北京:中华中医药杂志社, 2008.
GAO M Z, XIAO H B, TAN C Y, et al. Study on extraction process of chlorogenic acid in Helianthus tuberosus Linn leaves[C]. Proceedings of the 7th National Symposium on Inheritance, Innovation and Development of Chinese Medicine. Beijing: China Journal of Traditional Chinese Medicine and Pharmacy. 2008.
[22] 黎海彬, 王邕, 李俊芳, 等. 微波辅助提取技术在天然产物提取中的应用[J]. 现代食品科技, 2005, 21(3):148-150.
LI H B, WANG Y, LI J F, et al. Application of microwave assisted extraction technology to extraction of natural products[J]. Guangzhou Food Science and Technology, 2005, 21(3):148-150.
[23] WEN C T, ZHANG J X, ZHANG H H, et al. Advances in ultrasound assisted extraction of bioactive compounds from cash crops-A review[J]. Ultrasonics Sonochemistry, 2018, 48:538-549.
[24] GUNNARSSON I B, SVENSSON S E, JOHANSSON E, et al. Potential of Jerusalem artichoke (Helianthus tuberosus L.) as a biorefinery crop[J]. Industrial Crops and Products, 2014, 56:231-240.
[25] 叶代勇, 黄洪, 傅和青, 等. 纤维素化学研究进展[J]. 化工学报, 2006, 57(8):1782-1791.
YE D Y, HUANG H, FU H Q, et al. Advances in cellulose chemistry[J]. Journal of Chemical Industry and Engineering (China), 2006, 57(8):1782-1791.
[26] TERRETT O M, DUPREE P. Covalent interactions between lignin and hemicelluloses in plant secondary cell walls[J]. Current Opinion in Biotechnology, 2019, 56:97-104.
[27]![]() U, BER
U, BER OWSKA J, DZIUGAN P, et al. Nitric acid pretreatment of Jerusalem artichoke stalks for enzymatic saccharification and bioethanol production[J]. Energies, 2018, 11(8):2153.
OWSKA J, DZIUGAN P, et al. Nitric acid pretreatment of Jerusalem artichoke stalks for enzymatic saccharification and bioethanol production[J]. Energies, 2018, 11(8):2153.
[28] 相瑞娟, 尹思静, 侯胜博, 等. 菊芋秸秆的稀酸水解及乙醇发酵[J]. 现代化工, 2015, 35(5):81-84.
XIANG R J, YIN S J, HOU S B, et al. Ethanol production using stalk of Jerusalem artichoke by Kluyveromyces marxianus[J]. Modern Chemical Industry, 2015, 35(5):81-84.
[29] LI K, QIN J C, LIU C G, et al. Optimization of pretreatment, enzymatic hydrolysis and fermentation for more efficient ethanol production by Jerusalem artichoke stalk[J]. Bioresource Technology, 2016, 221:188-194.
[30] KHATUN M M, LI Y H, LIU C G, et al. Fed-batch saccharification and ethanol fermentation of Jerusalem artichoke stalks by an inulinase producing Saccharomyces cerevisiae MK01[J]. RSC Advances, 2015, 5(129):107112-107118.
[31] LI M, WANG J, YANG Y Z, et al. Alkali-based pretreatments distinctively extract lignin and pectin for enhancing biomass saccharification by altering cellulose features in sugar-rich Jerusalem artichoke stem[J]. Bioresource Technology, 2016, 208:31-41.
[32] KIM S, PARK J M, KIM C H. Ethanol production using whole plant biomass of Jerusalem artichoke by Kluyveromyces marxianus CBS1555[J]. Applied Biochemistry and Biotechnology, 2013, 169(5):1531-1545.
[33]![]() U, BER
U, BER OWSKA J, DZIUGAN P, et al. Two-stage pretreatment to improve saccharification of oat straw and Jerusalem artichoke biomass[J]. Energies, 2019, 12(9):1715.
OWSKA J, DZIUGAN P, et al. Two-stage pretreatment to improve saccharification of oat straw and Jerusalem artichoke biomass[J]. Energies, 2019, 12(9):1715.
[34] LI P, CAI D, ZHANG C W, et al. Comparison of two-stage acid-alkali and alkali-acid pretreatments on enzymatic saccharification ability of the sweet sorghum fiber and their physicochemical characterizations[J]. Bioresource Technology, 2016, 221:636-644.
[35] 郭振强, 张勇, 曹运齐, 等. 燃料乙醇发酵技术研究进展[J]. 生物技术通报, 2020, 36(1):238-244.
GUO Z Q, ZHANG Y, CAO Y Q, et al. Research progress of fuel ethanol fermentation technology[J]. Biotechnology Bulletin, 2020, 36(1):238-244.
[36] VOHRA M, MANWAR J, MANMODE R, et al. Bioethanol production: Feedstock and current technologies[J]. Journal of Environmental Chemical Engineering, 2014, 2(1):573-584.
[37] XUE C, ZHANG X T, WANG J F, et al. The advanced strategy for enhancing biobutanol production and high-efficient product recovery with reduced wastewater generation[J]. Biotechnology for Biofuels, 2017, 10:148.
[38] 孟艳, 李屹, 陈来生, 等. HCl和NaOH预处理对菊芋秸秆产甲烷潜力的影响[J]. 可再生能源, 2023, 41(2):174-179.
MENG Y, LI Y, CHEN L S, et al. Assessment of biomethane production from Jerusalem artichoke straw using NaOH and HCl pretreatment[J]. Renewable Energy Resources, 2023, 41(2):174-179.
[39] LI D, DAI J Y, XIU Z L. A novel strategy for integrated utilization of Jerusalem artichoke stalk and tuber for production of 2, 3-butanediol by Klebsiella pneumoniae[J]. Bioresource Technology, 2010, 101(21):8342-8347.
[40] AKRAM W, GARUD N, JOSHI R. Role of inulin as prebiotics on inflammatory bowel disease[J]. Drug Discoveries &Therapeutics, 2019, 13(1):1-8.
[41] SHOAIB M, SHEHZAD A, OMAR M, et al. Inulin: Properties, health benefits and food applications[J]. Carbohydrate Polymers, 2016, 147:444-454.
[42] LI W C, ZHANG J, YU C W, et al. Extraction, degree of polymerization determination and prebiotic effect evaluation of inulin from Jerusalem artichoke[J]. Carbohydrate Polymers, 2015, 121:315-319.
[43] RADOVANOVIC A M, MILOVANOVIC O Z, KIPIC M Z, et al. Characterization of bread enriched with Jerusalem artichoke powder content[J]. Journal of Food and Nutrition Research, 2014, 2(12):895-898.
[44] 胡雅婕, 高海燕, 孙俊良, 等. 菊粉特性及其对馒头品质的影响研究[J]. 食品工业科技, 2016, 37(15):60-65.
HU Y J, GAO H Y, SUN J L, et al. Charactoristics of inulin and its effects on the quality of steamed bread[J]. Science and Technology of Food Industry, 2016, 37(15):60-65.
[45] WANG D, LI F L, WANG S A. Engineering a natural Saccharomyces cerevisiae strain for ethanol production from inulin by consolidated bioprocessing[J]. Biotechnology for Biofuels, 2016, 9:96.
[46] ZHAO X, WU S G, HU C M, et al. Lipid production from Jerusalem artichoke by Rhodosporidium toruloides Y4[J]. Journal of Industrial Microbiology &Biotechnology, 2010, 37(6):581-585.
[47] CHOI H Y, RYU H K, PARK K M, et al. Direct lactic acid fermentation of Jerusalem artichoke tuber extract using Lactobacillus paracasei without acidic or enzymatic inulin hydrolysis[J]. Bioresource Technology, 2012, 114:745-747.
[48] LIM S H, RYU J M, LEE H, et al. Ethanol fermentation from Jerusalem artichoke powder using Saccharomyces cerevisiae KCCM50549 without pretreatment for inulin hydrolysis[J]. Bioresource Technology, 2011, 102(2):2109-2111.
[49] ZHANG T, CHI Z, CHI Z M, et al. Expression of the inulinase gene from the marine-derived Pichia guilliermondii in Saccharomyces sp. W0 and ethanol production from inulin[J]. Microbial Biotechnology, 2010, 3(5):576-582.
[50] ZHAO C H, ZHANG T, LI M, et al. Single cell oil production from hydrolysates of inulin and extract of tubers of Jerusalem artichoke by Rhodotorula mucilaginosa TJY15a[J]. Process Biochemistry, 2010, 45(7):1121-1126.
[51] GE X Y, QIAN H, ZHANG W G. Improvement of L-lactic acid production from Jerusalem artichoke tubers by mixed culture of Aspergillus niger and Lactobacillus sp[J]. Bioresource Technology, 2009, 100(5):1872-1874.
[52] SHI Z M, WEI P L, ZHU X C, et al. Efficient production of l-lactic acid from hydrolysate of Jerusalem artichoke with immobilized cells of Lactococcus lactis in fibrous bed bioreactors[J]. Enzyme and Microbial Technology, 2012, 51(5):263-268.
[53] WANG L M, XUE Z W, ZHAO B, et al. Jerusalem artichoke powder: A useful material in producing high-optical-purity l-lactate using an efficient sugar-utilizing thermophilic Bacillus coagulans strain[J]. Bioresource Technology, 2013, 130:174-180.
[54] LI L X, CHEN C, LI K, et al. Efficient simultaneous saccharification and fermentation of inulin to 2, 3-butanediol by thermophilic Bacillus licheniformis ATCC 14580[J]. Applied and Environmental Microbiology, 2014, 80(20):6458-6464.
[55] FAGES J, MULARD D, ROUQUET J J, et al. 2, 3-Butanediol production from Jerusalem artichoke, Helianthus tuberosus, by Bacillus polymyxa ATCC 12321. Optimization of kLa profile[J]. Applied Microbiology and Biotechnology, 1986, 25(3):197-202.
[56] GAO J, XU H, LI Q J, et al. Optimization of medium for one-step fermentation of inulin extract from Jerusalem artichoke tubers using Paenibacillus polymyxa ZJ-9 to produce R, R-2, 3-butanediol[J]. Bioresource Technology, 2010, 101(18):7076-7082.
[57] SUN L H, WANG X D, DAI J Y, et al. Microbial production of 2, 3-butanediol from Jerusalem artichoke tubers by Klebsiella pneumoniae[J]. Applied Microbiology and Biotechnology, 2009, 82(5):847-852.
[58] SAWICKA B, ![]() H, JARIENE E, et al. Nutritional value of Jerusalem artichoke tubers (Helianthus tuberosus L.) grown in organic system under Lithuanian and Polish conditions[J]. Agriculture, 2021, 11(5):440.
H, JARIENE E, et al. Nutritional value of Jerusalem artichoke tubers (Helianthus tuberosus L.) grown in organic system under Lithuanian and Polish conditions[J]. Agriculture, 2021, 11(5):440.
[59] SAWICKA B, SKIBA D, PSZCZ Å
Å KOWSKI P, et al. Jerusalem artichoke (Helianthus tuberosus L.) as a medicinal plant and its natural products[J]. Cellular and Molecular Biology, 2020, 66(4):160-177.
KOWSKI P, et al. Jerusalem artichoke (Helianthus tuberosus L.) as a medicinal plant and its natural products[J]. Cellular and Molecular Biology, 2020, 66(4):160-177.
[60] 赵孟良, 刘明池, 钟启文, 等. 菊芋种质资源主要矿质营养元素含量特征与分析评价[J]. 河北农业大学学报, 2017, 40(4):31-36.
ZHAO M L, LIU M C, ZHONG Q W, et al. Content characteristics and analysis evaluation of main mineral nutrient elements in 29 Helianthus tuberosus[J]. Journal of Agricultural University of Hebei, 2017, 40(4):31-36.
[61] MARIADOSS A V A, PARK S, SARAVANAKUMAR K, et al. Ethyl acetate fraction of Helianthus tuberosus L. induces anti-diabetic, and wound-healing activities in insulin-resistant human liver cancer and mouse fibroblast cells[J]. Antioxidants, 2021, 10(1):99.
[62] YU Q H, ZHAO J J, XU Z K, et al. Inulin from Jerusalem artichoke tubers alleviates hyperlipidemia and increases abundance of bifidobacteria in the intestines of hyperlipidemic mice[J]. Journal of Functional Foods, 2018, 40:187-196.
[63] SHAO T L, YUAN P C, ZHANG W Z, et al. Preparation and characterization of sulfated inulin-type fructans from Jerusalem artichoke tubers and their antitumor activity[J]. Carbohydrate Research, 2021, 509:108422.
[64] KANG Y M, LEE K Y, AN H J. Inhibitory effects of Helianthus tuberosus ethanol extract on Dermatophagoides farina body-induced atopic dermatitis mouse model and human keratinocytes[J]. Nutrients, 2018, 10(11):1657.
[65] WANG Z Q, HWANG S H, LEE S Y, et al. Fermentation of purple Jerusalem artichoke extract to improve the α-glucosidase inhibitory effect in vitro and ameliorate blood glucose in db/db mice[J]. Nutrition Research and Practice, 2016, 10(3):282-287.