糙米与白米相比,糙米富含蛋白质、脂质、维生素、矿物质以及抗氧化活性成分[1]等,多食用糙米及其制品可以增加人们对营养物质的吸收,同时可以降低慢性病的患病风险。糙米中的脂肪含量约为白米的3倍,糙米在贮藏期间脂质氧化是导致其品质下降的主要因素,这是糙米消费流通主要障碍。糙米约含有43%的多不饱和脂肪酸,在贮藏期间极易发生氧化哈败,造成糙米贮藏困难,货架期短。糙米中有脂肪酶、脂肪氧合酶、过氧化物酶等,脂肪酶是其中耐热性最好的酶,被认为是小麦[2]贮藏期间品质劣变的重要因素。因此,通过热处理去灭活脂肪酶有利于糙米的贮藏稳定性,但同时也会产生自由基,从而促进不饱和脂肪酸的自动氧化进程,且自由基的强度越高,氧化的速率越快[3]。因此,控制自由基强度并适度灭酶对糙米的贮藏稳定性具有重要意义。
射频是基于交变电磁波的加热技术,射频加热工艺是传统食品热处理和化学加工的一种高效且环保的替代方法。介电能通过偶极旋转和离子迁移在食品和农产品内部产生摩擦热,迅速提高材料整体温度,从而最大限度地减少传统热传导因加工时间过长而导致的质量劣化[4]。在农产品干燥中,射频被广泛用于坚果、新鲜水果和蔬菜[5-6],射频还可以选择性加热,可以有效地用于采后害虫防治和微生物灭活[7]。而射频用于谷物的品质稳定性的研究很少,目前大多数文献只针对米糠等谷物加工副产品的脂肪酶、脂肪氧合酶、过氧化物酶的灭活[8]。张晶晶[9]与李永富等[10]的研究表明射频加热对薏米仁与青稞脂肪酶有良好的灭活效果,但她们均发现自由基强度增加对贮藏稳定性的不利影响。目前,关于射频技术处理糙米自由基与脂肪酶的作用效果及贮藏稳定性影响的研究还鲜有报道。
本研究以最低自由基强度、脂肪酶活性、脂肪酸值、过氧化值、脂肪酸组成、己醛含量等指标对射频处理后糙米的贮藏品质进行评价,研究结果可以为延长糙米保质期提供创新有效的技术手段,为射频加热处理延长谷物贮藏稳定性的研究提供参考。
1 材料与方法
1.1 材料与试剂
南粳46,江苏艾津稻园农业科技服务有限公司于2021年3月生产,水分含量为(12.80±0.02)%(质量分数),于-18 ℃贮藏备用。无水乙醇、无水乙醚、三油酸甘油酯、三氯甲烷、冰醋酸、氢氧化钾、己醛标准品、硫代硫酸钠滴定液等试剂为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
GJ-3-27-JY高频真空介质加热射频装置(27.12 MHz),河北华氏纪元高频设备有限公司;EMX plus-10/12电子自旋共振波谱仪,德国布鲁克科技有限公司;AX224ZH/E电子天平,常州市奥豪斯仪器有限公司;LXJ-ⅡB低速离心机,上海安亭科学仪器厂;PB-10型PH计,德国Sartorius公司;DZ-280/2SE多功能真空封口机,上海三联包装机械有限公司;GC-2010气相色谱仪,日本岛津公司;LRH-150恒温生化培养箱,上海一恒科学仪器有限公司;MSH-20A磁力搅拌器,德国明智公司。
1.3 实验方法
1.3.1 糙米脂肪酶的射频灭活处理
称取550 g米置于聚丙烯盒(14.0 cm×10.5 cm×4.5 cm)中,放入泡沫盒(外径21.0 cm×17.0 cm×8 cm,内径16 cm×12 cm×7 cm)组合使用,盒内糙米高约4.0 cm,泡沫盒可减少散热,用于保温,然后将置于射频下极板中心位置,分别设置相应的极板间距、物料中心的目标温度和射频处理结束后的保温时间。射频处理结束后立即将糙米取出,平衡温度后装入8.5号自封袋中,贮备用于进行分析。
1.3.2 脂肪酶活性的测定
脂肪酶活性测定方法参照GB/T 5523—2008《粮油检验粮油脂肪酶活性测定》。
1.3.3 自由基强度的测定
电子自旋共振波谱法(electron spin resonance spectrometer, ESR)是一种快速且普遍应用于农产品中自由基的检测工具[11],糙米原料的烷基自由基强度的ESR光谱图在3 355 G处出现一个明显的信号峰,信号峰的最高点和最低点之间的差值反应了自由基的强度。将糙米样品粉碎过60目筛,精确称取糙米粉样品(60.0±0.5) mg于核磁管中,称量过程中避免样品粉末粘壁,称量好后在桌面轻敲,使糙米粉末均匀分布在底部。ESR测定条件:磁场宽度100 G,磁场中心为3 350 G,扫描3次,每次1 min,功率20 mW。自由基强度用3 350 附近峰高与1 g糙米粉(干基)质量的比值来表示。本研究中ESR所测自由基为以碳为中心的稳定型自由基。
1.3.4 射频处理糙米最佳实验参数单因素实验
1.3.4.1 极板间距对糙米度、自由基强度的影响
550 g糙米,不补水,在射频温度100 ℃,设置极板间距分别为110、120、130、140、150 mm进行射频处理,射频处理时间分别为9.9、10.3、13.9、17.8、21.9 min处理结束后不保温立即取出备用。
1.3.4.2 温度对糙米脂肪酶活性、自由基强度的影响
550 g糙米,不补水,在极板间距140 mm条件下,设置射频温度分别为80、90、100、110、120 ℃进行射频处理,射频处理时间分别为12.7、15.4、17.8、22.2、29.3 min。
1.3.4.3 补水量对糙米脂肪酶活性、自由基强度的影响
使用微量喷壶对550 g原料糙米进行补水处理,在自封袋中边喷边用玻璃棒搅拌,使样品均匀补水,获得补水量质量分数为1%、2%、3%、4%和5%的糙米样品,分别混匀后于25 ℃恒温摇床中平衡14 h。射频条件为极板间距140 mm,物料中心温度100 ℃,射频处理时间分别为15.8、14.8、14.3、12.3、10.4 min。
1.3.4.4 保温时间对糙米脂肪酶活性、自由基强度的影响
将550 g糙米样品在极板间距140 mm、物料中心温度为100 ℃、补水率为4%的条件下进行射频处理,射频处理时间约11.50 min,射频处理结束后,将糙米分别保温0、10、20、30、40、50 min后取出备用。
1.3.5 正交试验
选择影响糙米脂肪酶活性和自由基强度的因素:极板间距、温度、补水率。根据单因素试验的结果,进行三因素三水平正交试验,设计方案如表1所示,共进行9组射频处理,每组射频处理用量为550 g,不保温。
表1 正交实验设计
Table 1 Orthogonal experimental design
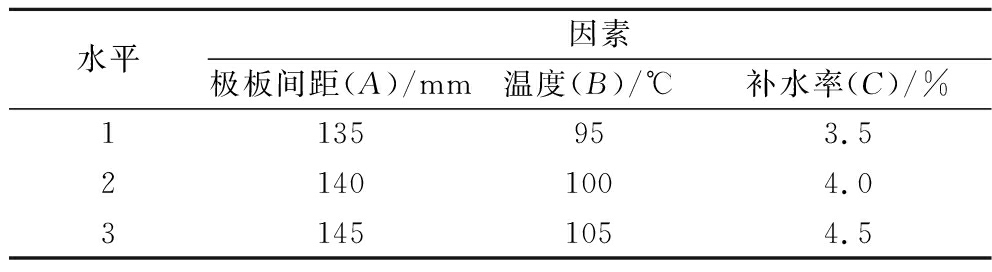
水平因素极板间距(A)/mm温度(B)/℃补水率(C)/%1135953.521401004.031451054.5
1.3.6 贮藏实验
选取正交试验结果得到的两组最佳实验条件进行射频处理,将射频处理好的糙米用自封袋包装,和原料糙米一起在37 ℃恒温培养箱中贮藏28 d,贮藏湿度11%,每7 d取样1次,取样后放入-20 ℃冰柜贮备用于分析。
1.3.6.1 含水量的测定
参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》进行测定。
1.3.6.2 过氧化值的测定
参照GB 5009.227—2016《食品安全国家标准 食品中过氧化值的测定》进行测定。
1.3.6.3 脂肪酸值的测定
参照 GB/T 5684—2015《谷物碾磨制品脂肪酸值的测定》进行测定。
1.3.6.4 己醛含量的测定
采用顶空气相色谱法测定己醛的含量。以癸烷标准品为内标,用甲醇配制1 mg/mL内标液。用95%乙醇配制己醛标准品至100 μg/mL贮备液,4 ℃冰箱避光冷藏。称取约1 g糙米粉加入气相瓶中,加入1 mL质量浓度为20 μg/mL的正癸烷内标液和5 mL去离子水,振荡混匀待测,另外用去离子水将己醛储备液稀释至2 μg/mL,再向气相瓶中加入5 mL稀释的标准溶液和20 μL的癸烷内标液,用振荡器混匀,待测。测试参数按照MEXIS等[12]方法。
1.3.6.5 脂肪酸组成的测定
将提取出来的脂肪酸,先甲酯化前处理,再通过气相色谱法测定[13]。取脂肪50~80 mg,加2 mL NaOH甲醇溶液,振荡,60 ℃水浴30 min,冷却后加入2 mL 25%(体积分数)的三氟化硼甲醇溶液,60 ℃水浴20 min。冷却后加入2 mL正己烷、2 mL饱和氯化钠溶液,振荡萃取分层,取1 mL上清液进行气相分析。
1.4 数据处理
每个实验都有3个平行实验,数据均采用均值±标准差表示,数据采用Excel 2019进行处理。用SPSS Statistics 20 进行显著性分析,选择LSD检验和Duncan检验,显著性水平为P<0.05。采用 Origin 2018绘图。
2 结果与分析
2.1 单因素试验结果
2.1.1 极板间距对糙米脂肪酶活性、自由基强度的影响
由图1可知,射频的升温速率随着板间距的增大而减小;在极板间距为130 mm 时,脂肪酶活性最低,灭酶率达60.46%。分析原因为若极板间距增大,极板之间的电场强度减弱,带电离子前后移动幅度减小,故发生碰撞产热也减少,升温速率也逐渐减慢[14];若极板间距变小,则射频加热电路的频率与射频产生电路固有频率的耦合程度越大,样品吸收的功率越大,升温速率越高,但升温速率过高会有边角效应,导致加热不均匀,灭酶效果不佳。140 mm的极板间距下升温速率为4.2 ℃/min,与WANG等[15]用于射频加热处理豆类等适宜升温速率约为5 ℃/min相接近。根据选取最低自由基强度并适度灭酶的原则,因极板间距为130 mm时的自由基强度显著高于极板间距为140 mm时的自由基强度(P<0.05),且此两种条件下的脂肪酶活度并无显著性差异。故最终选择 140 mm 的极板间距作为最佳极板间距。

图1 极板间距对升温速率、脂肪酶活度和自由基强度的影响
Fig.1 Effect of electrode gap on heating rate, lipase activity, and free radical intensity
注:字母不同表示差异显著(P<0.05)(下同)。
2.1.2 温度对糙米脂肪酶活性、自由基强度的影响
由图2可知,随着射频处理的温度升高,脂肪酶活性均显著下降(P<0.05)。当物料中心达到120 ℃时,射频的灭酶效果最好,脂肪酶活性为2.95 mg/g,灭酶率达到66.7%。射频温度越高,糙米脂肪酶活性越低,灭酶率越高,VEARASILP等[16]随着射频加热温度升高和保温时间的延长能使得脂肪酶的活性显著降低的研究也有类似发现。随着射频处理的温度越高,自由基强度增长速率越大,BOLUMAR等[17]也有类似报道。在物料中心温度达到100 ℃时的自由基强度显著低于其他温度下的自由基强度,且脂肪酶活性较低,为5.17 mg/g,灭酶率能够达到42.7%。故最终选取100 ℃为最佳温度。
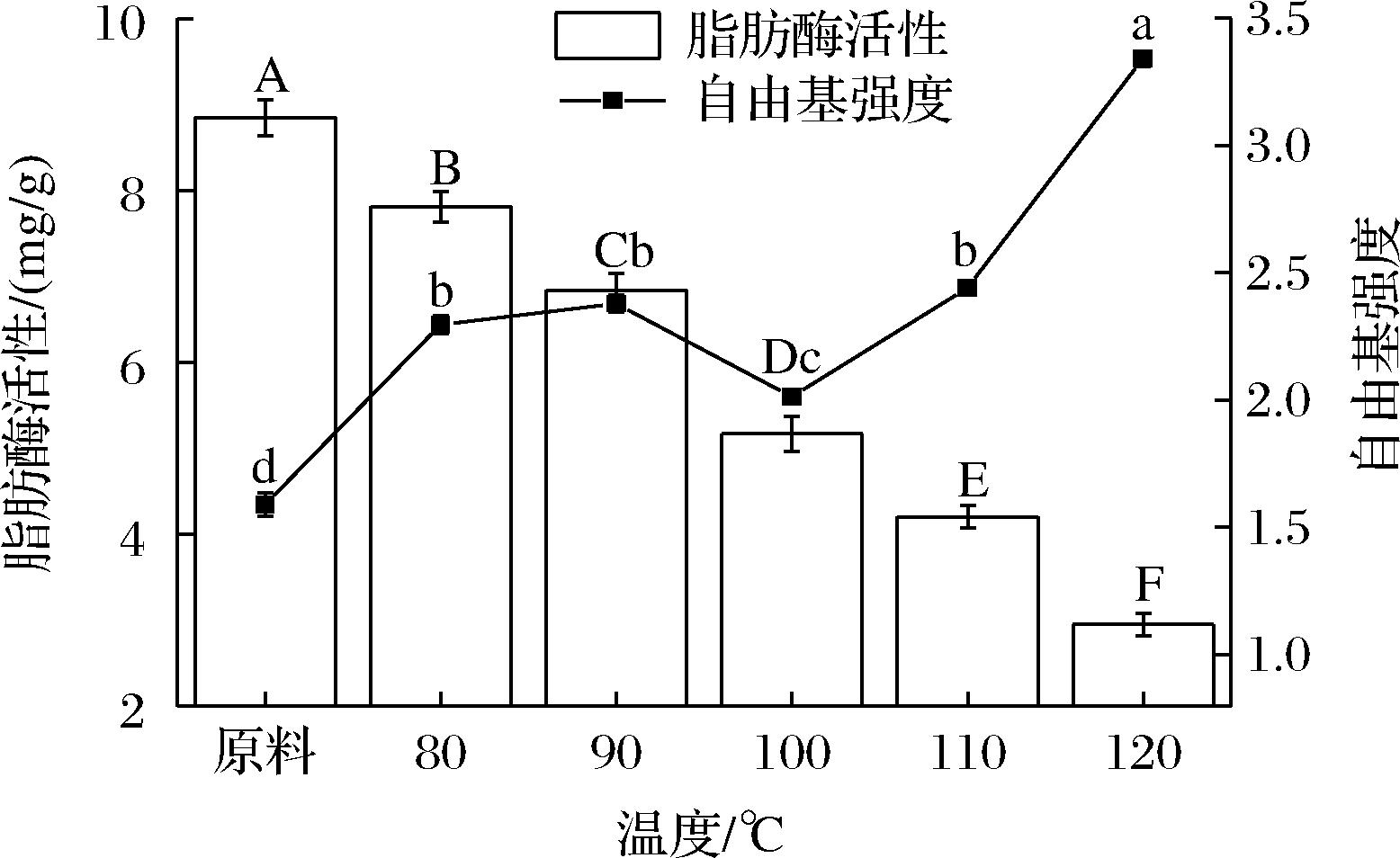
图2 温度对脂肪酶活性和自由基强度的影响
Fig.2 Effect of temperature on lipase activity and radical intensity
2.1.3 补水量对糙米脂肪酶活性、自由基强度的影响
补水一方面可以降低酶的耐热性,使脂肪酶活性下降[18],另一方面可以提高升温速率,缩短射频时间[19],而且可以淬灭因高温产生的自由基[20],由图3可看出,灭酶率最佳时补水率为3%,这说明对糙米进行适当的补水可提升灭酶率。但当补充的水分过多时,伴随着糙米水分的蒸发消耗射频能量,故用于糙米灭酶的能量减少;若补充水分较少时,糙米水分活度增大,这有利于提高脂肪酶在低介电介质环境中的柔韧性,酶活性增强,灭酶率下降[21],故只有适度对糙米补水才能达到最佳灭酶率。由图3可看出,补水2%、3%和4%的糙米脂肪酶活性显著低于其他补水率下的脂肪酶活性(P<0.05),且4%补水率下的糙米自由基强度显著低于这3组中的另2组(P<0.05)。故最终选取最佳补水率为4%。
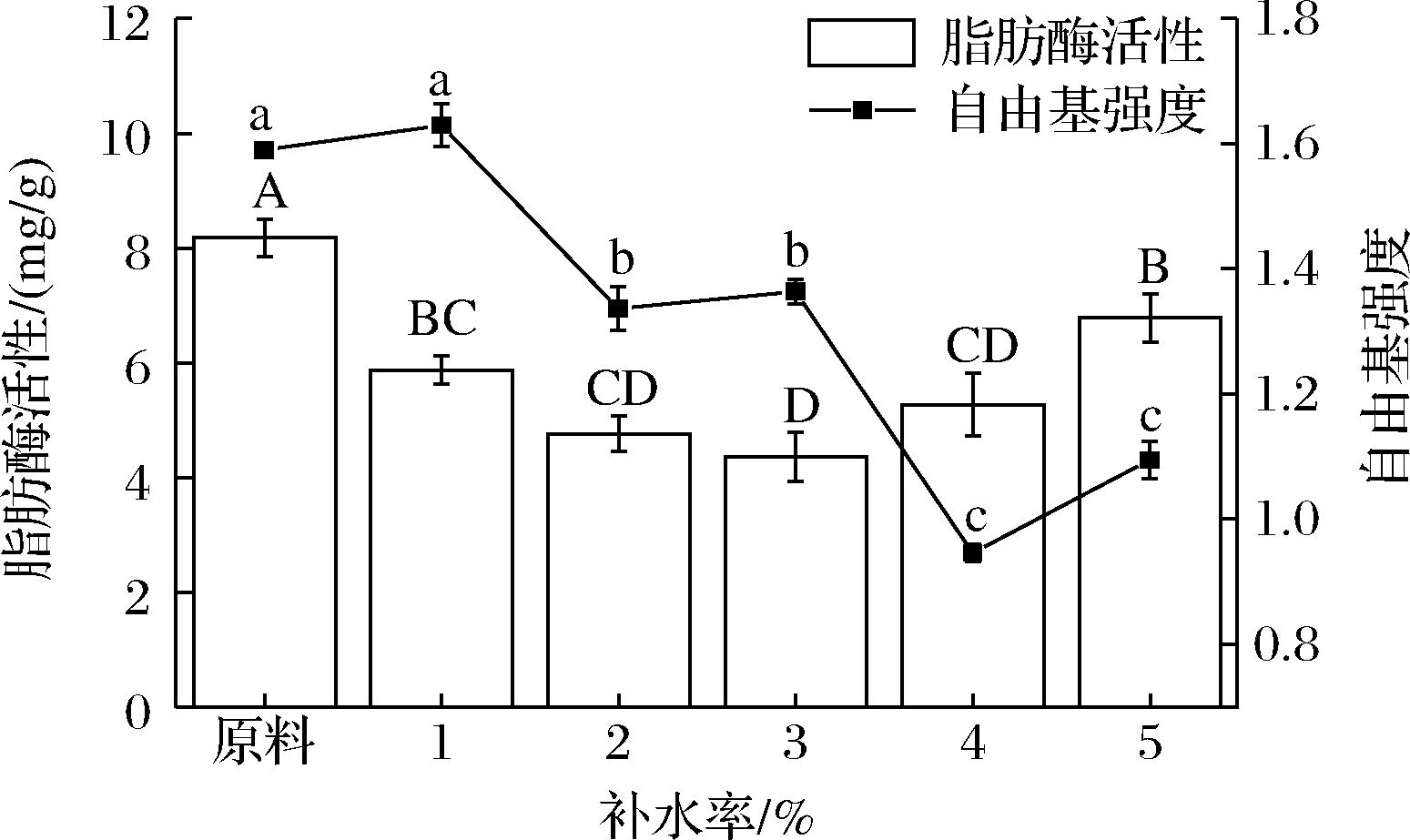
图3 补水率对脂肪酶活性和自由基强度的影响
Fig.3 Effects of hydration rate on lipase activity and free radical intensity
2.1.4 保温时间对糙米脂肪酶活性、自由基强度的影响
由图4可知,脂肪酶活度随着保温时间不断延长出现了先上升下降的趋势。在保温时间20 min时脂肪酶活度最性,为5.75 mg/g,灭酶率最低,为29.71%,保温时间50 min时脂肪酶活度最低,此时灭酶率为55.68%。在保温10 min以后,脂肪酶活度短暂增大的可能的原因是电场的作用:射频通过静电相互作用改变了脂肪酶电荷的分布,改变了蛋白质的二级结构,增加了底物与活性中心接触的机会,导致了酶活性变大,灭酶率下降[22]。与保温0 min相比,随着保温时间增加,自由基强度逐渐增大,从保温0 min的1.141增加到保温50 min的1.730,射频后的糙米保持高温的环境有利于自由基的不断生成。综合灭酶率和自由基强度指标,选择不保温作为单因素最优实验条件。
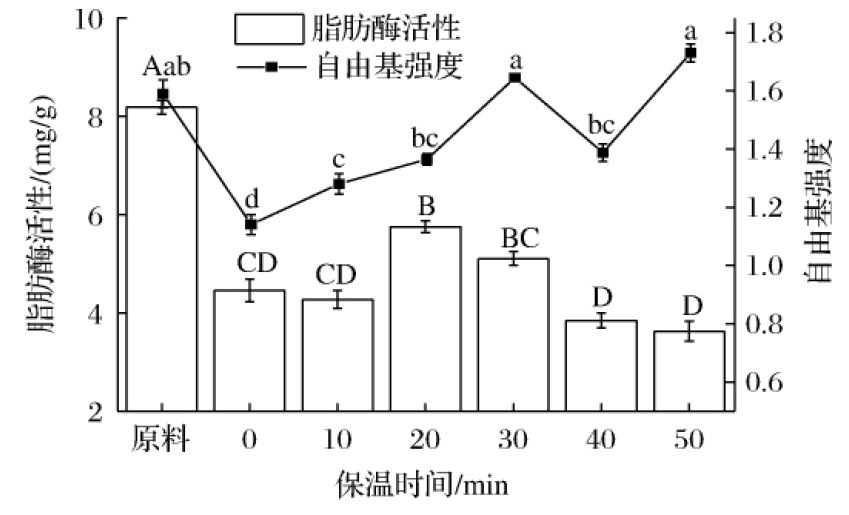
图4 保温时间对脂肪酶活性和自由基强度的影响
Fig.2 Effect of temperature on lipase activity and radical intensity
2.2 正交试验
根据单因素试验的结果,进行正交试验。选择自由基强度、脂肪酶活性并计算灭酶率作为评价指标。正交试验结果见表2。
表2 正交试验结果
Table 2 Orthogonal experimental result

编号极板间距(A)/mm温度(B)/℃补水率(C)/%自由基强度脂肪酶活度/(mg/g)灭酶率/%1135 95 3.501.002±0.0508.03±0.109.272135 100 4.001.040±0.0146.97±0.3621.283135 105 4.500.914±0.0166.11±0.3630.954140 100 4.500.927±0.0075.37±0.1039.335140 105 3.501.004±0.0966.13±0.2930.756140 95 4.000.960±0.0166.44±0.1827.227145 105 4.000.891±0.0333.52±0.2960.258145 95 4.500.699±0.0015.13±0.1642.039145 100 3.500.829±0.0134.65±0.1747.45
由表3和表4可知,极差R的大小顺序为A>B>C,说明极板间距对灭酶率的影响最大,补水率影响灭酶率程度最小。仅因素A对实验结果有显著影响(P<0.05)。由此,以灭酶率为评价指标,得到的最佳加工工艺为A3B3C3,即极板间距145 mm、温度105 ℃、补水率4.5%。
表3 灭酶率极差分析
Table 3 Range analysis of enzyme inhibition rate
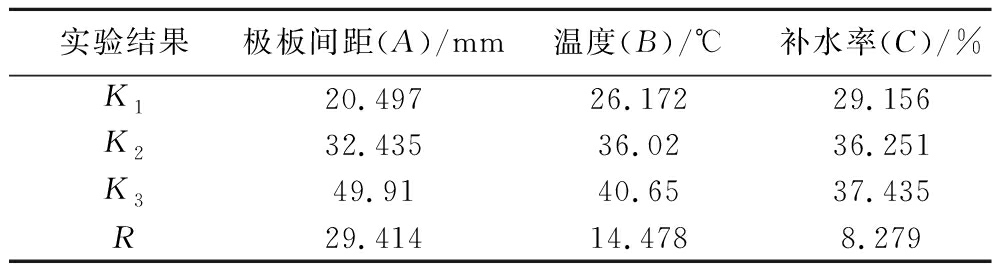
实验结果极板间距(A)/mm温度(B)/℃补水率(C)/%K120.49726.17229.156K232.43536.0236.251K349.9140.6537.435R29.41414.4788.279
表4 灭酶率方差分析
Table 4 Variance analysis of enzyme inhibition rate

方差来源自由度F值P值A220.0350.048B20.9510.513C27.5540.117
由表5和表6可知,极差R的大小顺序为A>C>B,说明极板间距对灭酶率的影响最大,而温度影响灭酶率程度最小。仅因素A对实验结果有显著影响(P<0.05)。由此,以自由基强度为评价指标,得到的最佳加工工艺为A3B1C3即极板间距145 mm、温度95 ℃、补水率4.5%。
表5 自由基强度极差分析
Table 5 Range analysis of radical intensity
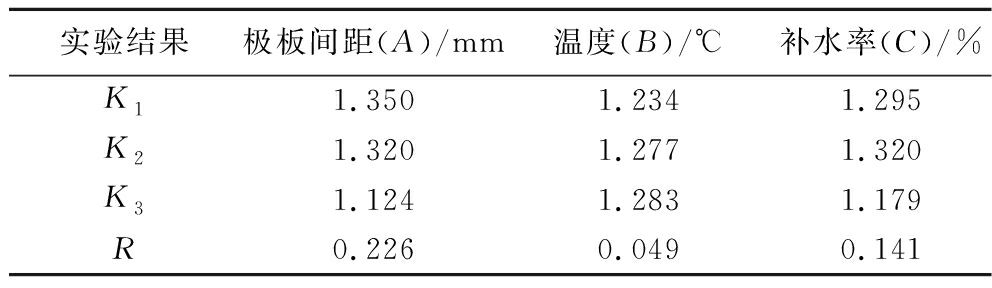
实验结果极板间距(A)/mm温度(B)/℃补水率(C)/%K11.3501.2341.295K21.3201.2771.320K31.1241.2831.179R0.2260.0490.141
表6 自由基强度方差分析
Table 6 Variance analysis of radical intensity
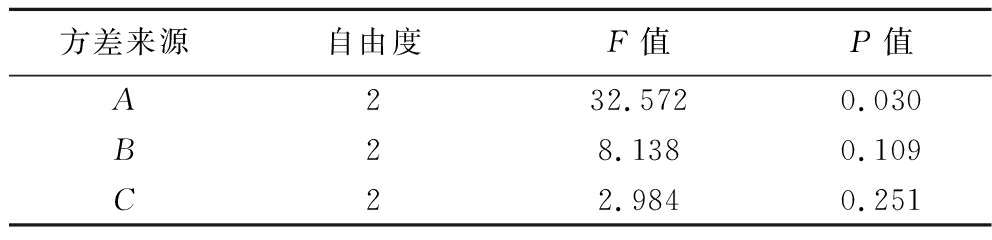
方差来源自由度F值P值A232.5720.030B28.1380.109C22.9840.251
2.3 最佳加工工艺的选取
根据正交实验灭酶率的极差分析结果可以得到最佳实验条件为A3B3C3,但因轮空未测,补测结果如表7所示。
表7 正交实验最佳工艺验证
Table 7 Optimal process verification for orthogonal experiments
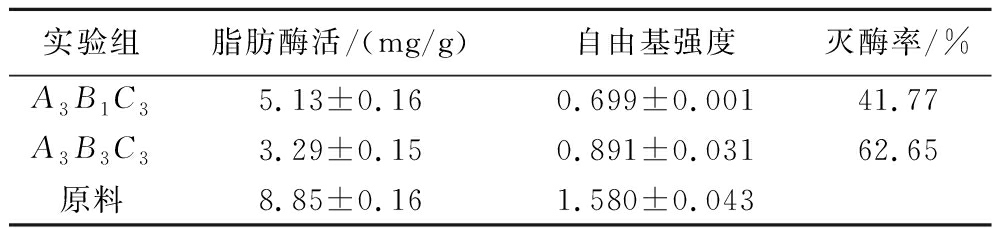
实验组脂肪酶活/(mg/g)自由基强度灭酶率/%A3B1C35.13±0.160.699±0.00141.77A3B3C33.29±0.150.891±0.03162.65原料8.85±0.161.580±0.043
2.4 射频处理对糙米贮藏稳定性的影响
2.4.1 贮藏期间糙米脂肪酸值的变化
由图5可知,射频处理对糙米的初始脂肪酸值有显著影响(P<0.05),相较糙米原料的脂肪酸值,射频处理后的脂肪酸值降低了约30.29%,这说明射频处理能够降低糙米脂肪酸值,其原因可能部分脂肪酸与淀粉形成了复合物或发生了进一步降解。由于射频处理脂肪酶活度下降,所以脂肪酶水解反应受到抑制,脂肪酸值显著降低[23]。在贮藏过程中,各样品的脂肪酸值先升高后下降,在21 d时达到峰值,射频组脂肪酸值约23.70 mg/100 g,而原料则已达到33.17 mg/100 g。在21~28 d期间脂肪酸值有所下降,可能是游离脂肪酸氧化速度大于生成速度,也可能是积累过多的游离脂肪酸会对水解有抑制作用,故此时脂肪氧化速率高于水解速率[24]。脂肪酸的积累会导致脂肪加速降解,这是由于游离脂肪酸中带有极性基团,它能够催化氢过氧化物发生分解,不断生成自由基,进入链式反应,导致脂肪降解的速率加快[25]。一般认为稻谷的宜存品质的脂肪酸值≤25 mg/100 g,射频处理后的糙米在加速贮藏实验中脂肪酸值峰值在安全范围内,而原料糙米的品质已不宜继续贮藏。综上,射频可显著降低糙米在贮藏期间的脂肪酸值,有利于提高其贮藏稳定性。

图5 贮藏期间糙米脂肪酸值的变化
Fig.6 Change of peroxide value of brown rice during storage
2.4.2 贮藏期间糙米过氧化值的变化
过氧化值是反映谷物贮藏期间品质的指标之一。图6显示贮藏期间原料与射频处理后的糙米的过氧化值均呈现不断上升的趋势,过氧化值的增加表明样品中脂质氧化形成的中间体的积累,过氧化值小于0.25 g/100 g被认为是一般植物油的可接受阈值,当过氧化值超过0.35 g/100 g时,则认为完全不能被消费者认可,货架期结束。射频样品A3B3C3和原料的过氧化值在28 d时已超过0.35 g/100 g,不适宜继续贮藏。而此前基于最低自由基强度选取A3B1C3为射频处理条件的糙米样品,得到的过氧化值在3组糙米样品中最低,且在安全范围以内,故需要选取合适的射频条件进行处理。综上,基于最低自由基强度原则进行射频处理可使在贮藏期间糙米的过氧化值明较低,脂肪酸值在适宜范围内,有利于提高其贮藏稳定。
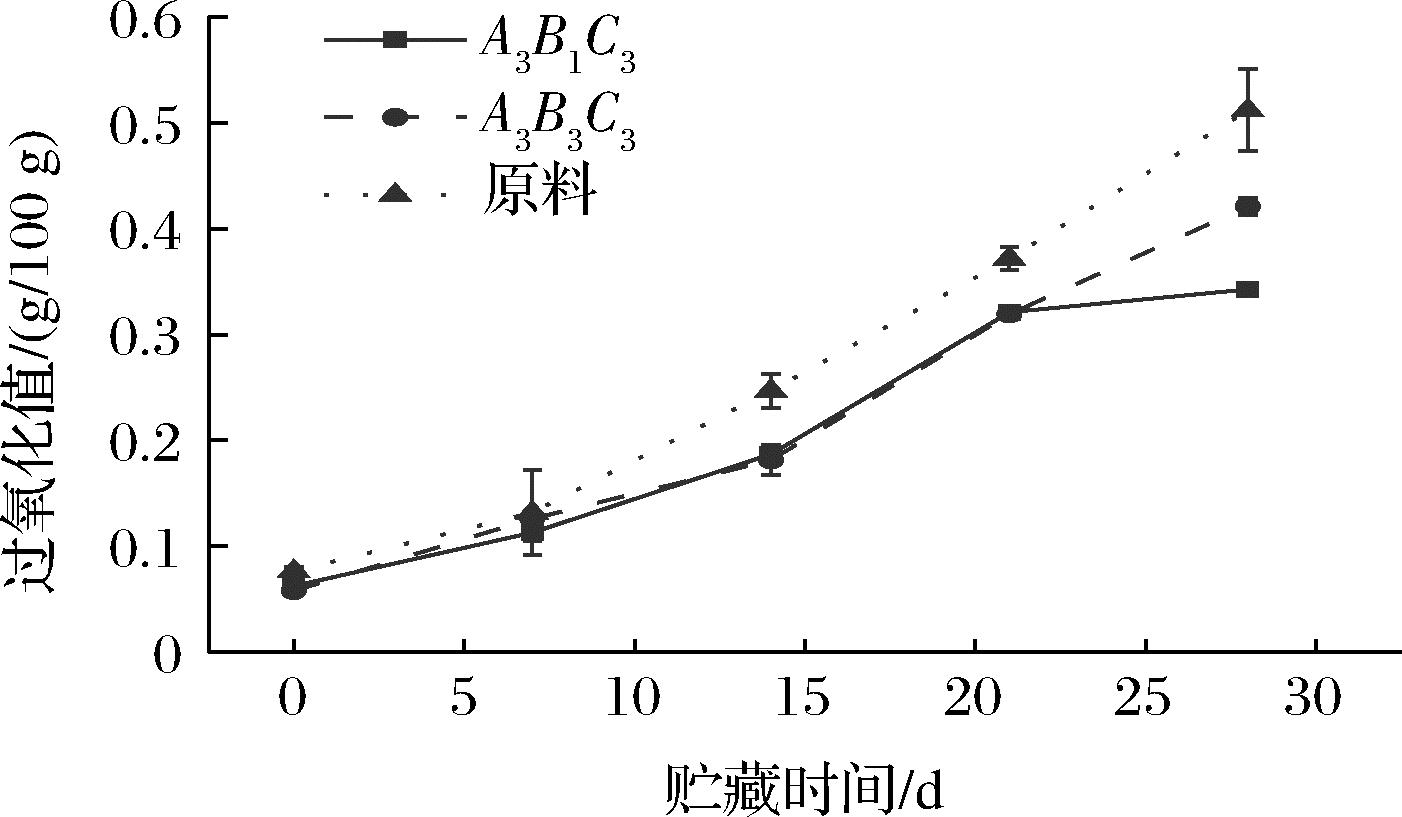
图6 贮藏期间糙米过氧化值的变化
Fig.6 Change of peroxide value of brown rice during storage
2.4.3 贮藏期间糙米自由基强度的变化
图7显示,在0 d 2组射频处理后的糙米自由基强度均显著低于原料糙米(P<0.05)。原因可能是射频处理时对糙米进行了补水处理,水分对自由基有猝灭作用;并发现在2组射频糙米中,射频加热温度越高,自由基强度越高。在贮藏28 d时,射频处理后的糙米自由基强度均显著高于原料组(P<0.05),与0 d相比射频处理后的糙米自由基强度增加了约47.5%;这与林露芬等[26]微波处理糙米贮藏过程中自由基的变化相似,且自由基的信号强度随着贮藏时间的延长而增加。观察到贮藏0 d时射频处理能显著降低糙米自由基强度(P<0.05),但在贮藏28 d后射频处理后的糙米自由基强度却显著高于原料,这与李永富等[10]结论不一致。糙米处理前后自由强度在贮藏期间的变化趋势发生了逆转,这一变化的原因需要进一步研究,这种变化与脂肪氧化的关系也需要深入研究。较低自由基强度的射频处理糙米,其自由基强度峰值也较低,其脂肪酸值与过氧化值也较低,这证明较低的自由基强度对改善糙米贮藏稳定性有益。
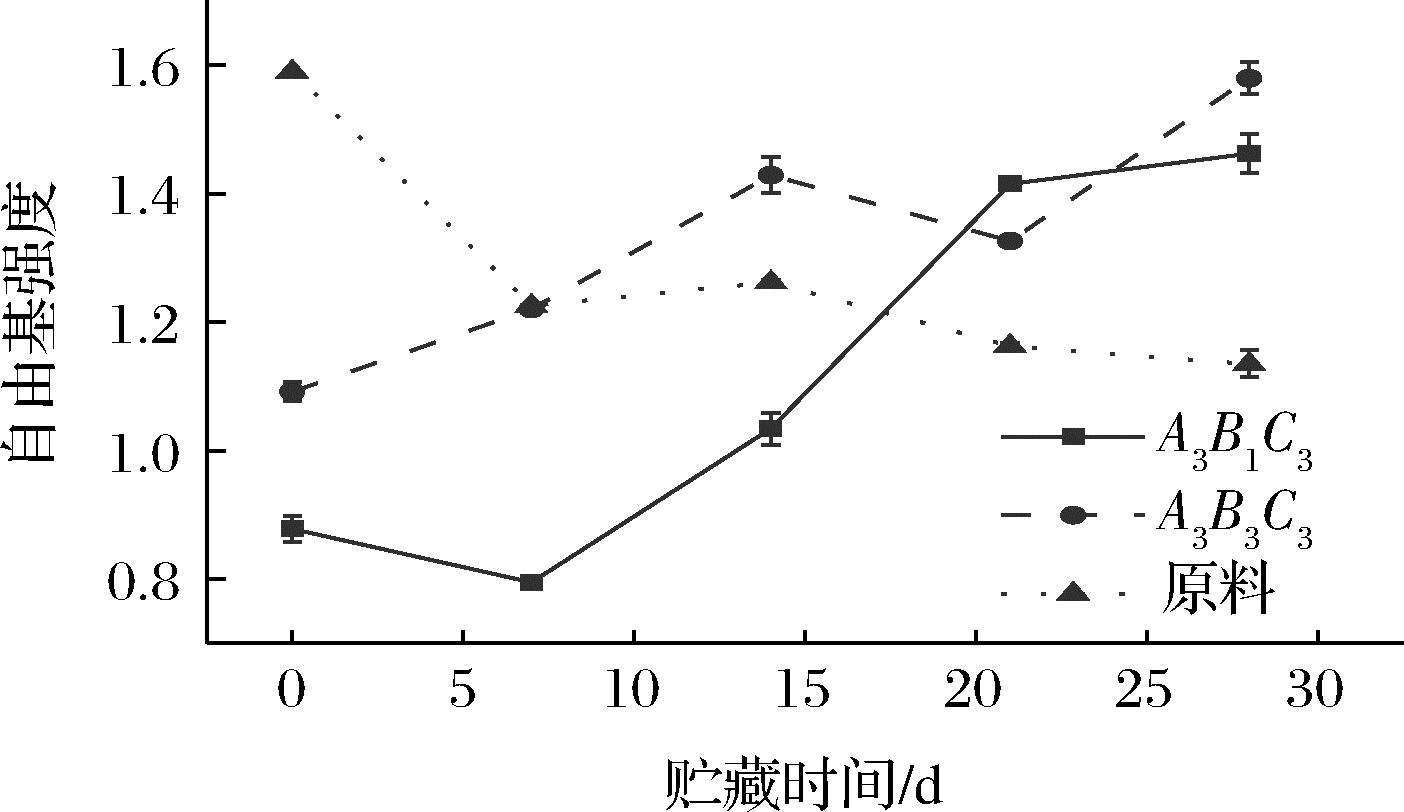
图7 贮藏期间糙米自由基强度的变化
Fig.7 Changes in radical intensity of brown rice during storage
2.4.4 贮藏期间糙米己醛含量的变化
糙米贮藏过程中主要的异味成分是醛类化合物,其中己醛占最大比例。由图8可知,在贮藏期间,贮藏28 d时,用射频条件A3B1C3、A3B3C3处理后的糙米的己醛含量与0 d相比分别升高了109.6%、145.5%,而原料仅升高了27%。射频处理后己醛的升幅更高,且射频处理的温度越高,脂肪酶活性越低,己醛含量升高的幅度越大,加速氧化的程度越重。这与PEKKA等[27]研究一致,他们发现在长期贮藏过程中,脂肪酶活性越低,己醛的含量越高,如果将燕麦麸皮热处理至脂肪酶活性为0,则贮藏12个月后检测到的顶空己醛含量是未经热处理的麸皮的5~7倍。在37 ℃贮藏28 d后,射频A3B1C3处理的糙米样品的己醛含量显著低于射频A3B3C3处理的糙米,说明控制自由基强度能一定程度上改善射频处理糙米的贮藏稳定性。
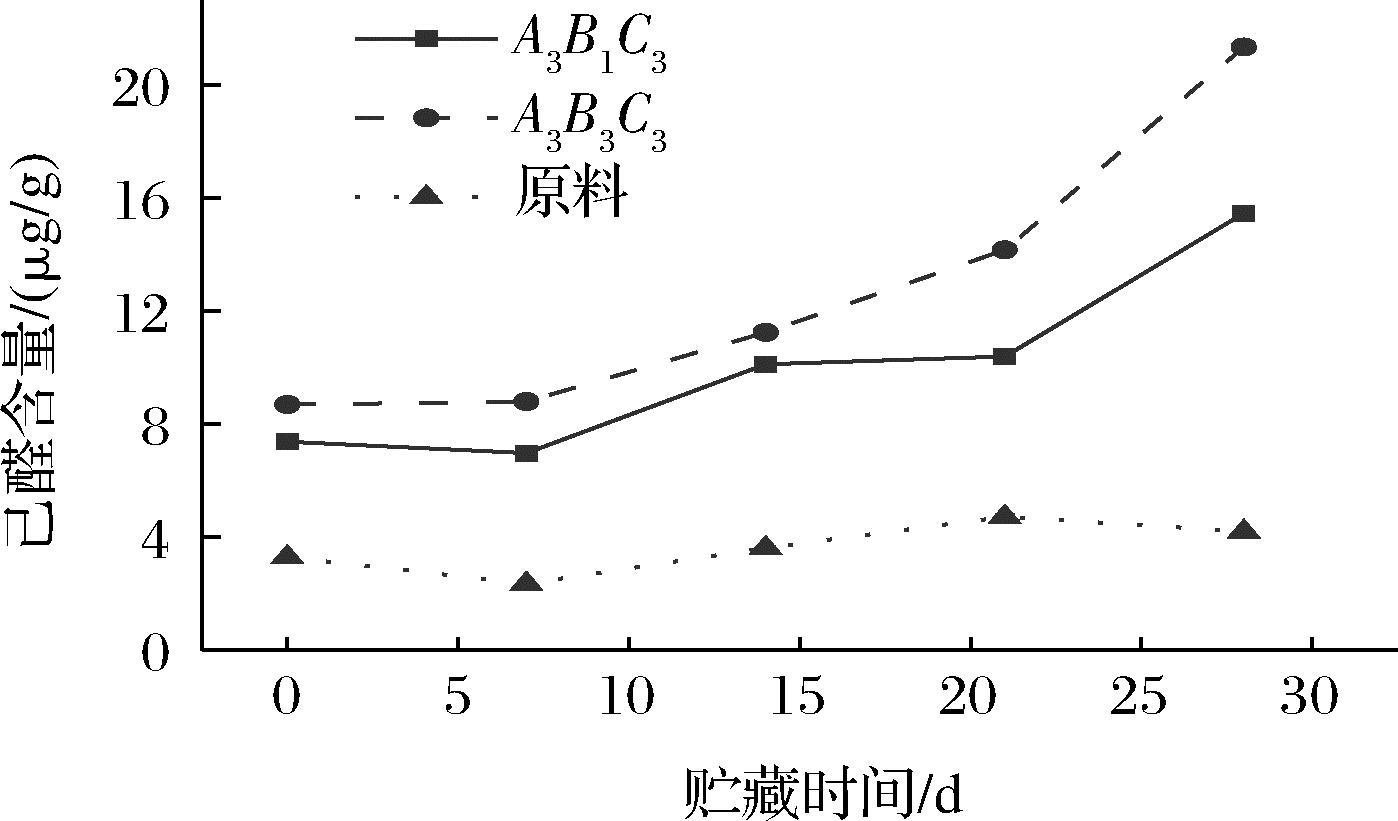
图8 贮藏期间糙米己醛含量的变化
Fig.8 Changes of hexanal content in brown rice during storage
2.4.5 贮藏期间糙米脂肪酸组成的变化
不饱和脂肪酸(unsaturated fatty acids, UFA)比饱和脂肪酸(saturated fatty acids, SFA)更容易被氧化,故探究糙米中游离脂肪酸的组成是探究糙米贮藏过程中脂肪氧化的重要指标之一。由表8结果可看出,糙米中含量最多的脂肪酸为油酸和亚油酸,含量为34.56%和41.63%。糙米中的不饱和脂肪酸的含量达到78.56%,而其中的多不饱和脂肪酸(polyunsaturated fatty acid, PUFA)比例较单不饱和脂肪酸(monounsaturated fatty acids, MUFA)的更大。在贮藏期间,3组样品的UFA的含量都显著下降(P<0.05),SFA的含量都显著上升(P<0.05),说明参与油脂氧化反应的主要是UFA,而3组样品的MUFA含量都显著升高(P<0.05),PUFA都含量显著下降(P<0.05),可说明在糙米的UFA中,PUFA较MUFA更容易被氧化。这与WANG等[28]研究一致。A3B1C3、A3B3C3和原料的PUFA含量分别下降了1.34%、2.08%、2.39%,射频处理后的样品的PUFA含量下降速率:A3B1C3<A3B3C3<原料,由于PUFA 含量下降较少,其氧化酸败产生的下一级氧化产物含量应该更低,这与图6中过氧化值的数据相符合,即在贮藏结束后,自由基最低的样品A3B1C3的过氧化值最低,这说明控制自由基强度能一定程度上改善射频处理糙米的贮藏稳定性。
表8 贮藏期间糙米的脂肪酸组成变化
Table 8 Changes in fatty acid composition of brown rice during storage
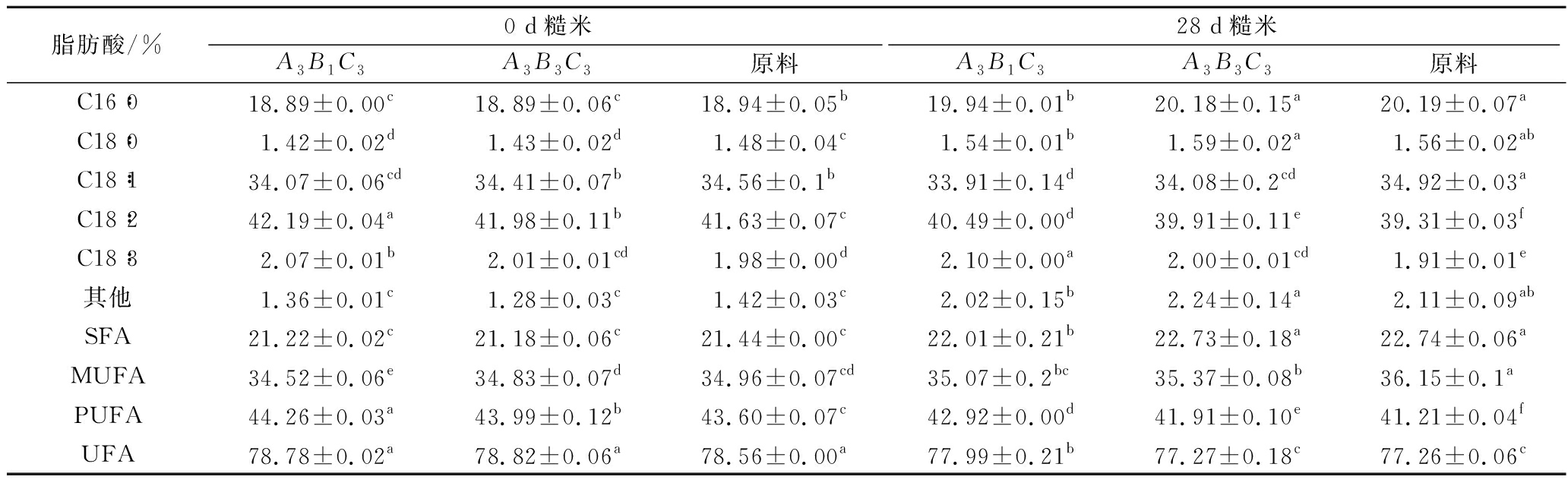
脂肪酸/%0 d糙米28 d糙米A3B1C3A3B3C3原料A3B1C3A3B3C3原料C16∶018.89±0.00c18.89±0.06c18.94±0.05b19.94±0.01b20.18±0.15a20.19±0.07aC18∶01.42±0.02d1.43±0.02d1.48±0.04c1.54±0.01b1.59±0.02a1.56±0.02abC18∶134.07±0.06cd34.41±0.07b34.56±0.1b33.91±0.14d34.08±0.2cd34.92±0.03aC18∶242.19±0.04a41.98±0.11b41.63±0.07c40.49±0.00d39.91±0.11e39.31±0.03fC18∶32.07±0.01b2.01±0.01cd1.98±0.00d2.10±0.00a2.00±0.01cd1.91±0.01e其他1.36±0.01c1.28±0.03c1.42±0.03c2.02±0.15b2.24±0.14a2.11±0.09abSFA21.22±0.02c21.18±0.06c21.44±0.00c22.01±0.21b22.73±0.18a22.74±0.06aMUFA34.52±0.06e34.83±0.07d34.96±0.07cd35.07±0.2bc35.37±0.08b36.15±0.1aPUFA44.26±0.03a43.99±0.12b43.60±0.07c42.92±0.00d41.91±0.10e41.21±0.04fUFA78.78±0.02a78.82±0.06a78.56±0.00a77.99±0.21b77.27±0.18c77.26±0.06c
注:同列不同小写字母,表示差异显著(P<0.05)。
3 结论
基于自由基强度控制的糙米脂肪酶射频灭活可改善其贮藏稳定性。最佳加工工艺为A3B1C3,即极板间距145 mm、温度95 ℃、补水率4.5%,极板间距对脂肪酶活性、自由基强度均有显著影响(P<0.05)。在37 ℃下贮藏28 d后,射频处理糙米的脂肪酸值和过氧化值与原料相比均显著降低(P<0.05);射频处理后的糙米的PUFA含量下降速率与原料相比均显著降低(P<0.05),其中以最低自由基强度的射频处理糙米综合品质最好。结果表明,在控制自由基强度的前提下,适度灭活糙米脂肪酶能够有效改善其贮藏稳定性。关于糙米处理前后自由强度在贮藏期间的变化趋势发生了逆转,这一变化的原因及其与脂肪氧化的关系也需要后续深入研究。本研究中只采用了江苏艾津稻园农业科技服务有限公司提供的南粳46糙米,所得到的射频最佳加工工艺在更多糙米品种中的适用性还可以进行对比研究;本研究中射频系统只局限于实验室规模,尚未开展射频工业规模的研究,这给评估能源消耗和经济效益带来了一定的困难。此外,射频灭酶处理与其他传统灭酶方式处理后糙米的品质比较还需更多的试验研究。
[1] 吕呈蔚, 岳玉兰, 王政, 等.糙米营养价值及加工技术研究进展[J].粮油食品科技, 2020, 28(6):140-144.
LYU C Y, YUE Y L, WANG Z, et al.Research progress on the nutritional value and processing technology of brown rice[J].Science and Technology of Cereals, Oils and Foods, 2020, 28(6):140-144.
[2] 王新伟, 李蕊, 陈聪聪, 等.储藏过程中小麦粉酸败的研究进展[J].食品工业, 2019, 40(10):253-257.
WANG X W, LI R, CHEN C C, et al.A reuiew of rancidity of wheat flour during storage[J].The Food Industry, 2019, 40(10):253-257.
[3] 胡博, 范大明, 乌斯嘎勒, 等.微波致米蛋白的自由基生成及氧化特性研究[J].现代食品科技, 2015, 31(4):151-156.
HU B, FAN D M, WU S G L, et al.The radical production and oxidative properties of rice protein under microwave radiatio[J].Modern Food Science &Technology, 2015, 31(4):151-156.
[4] LI Y L, LI F, TANG J M, et al.Radio frequency tempering uniformity investigation of frozen beef with various shapes and sizes[J].Innovative food science &emerging technologies, 2018, 48:42-55.
[5] CHEN L, SUBBIAH J, JONES D, et al.Development of effective drying strategy with a combination of radio frequency (RF) and convective hot-air drying for inshell hazelnuts and enhancement of nut quality[J].Innovative Food Science &Emerging Technologies, 2021, 67:102555.
[6] ZHOU X, WANG S J.Recent developments in radio frequency drying of food and agricultural products:A review[J].Drying Technology, 2019, 37(3):271-286.
[7] MAO Y X, WANG P H, WU Y, et al.Effects of various radio frequencies on combined drying and disinfestation treatments for in-shell walnuts[J].LWT, 2021, 144:111246.
[8] LING B, LYNG J G, WANG S J.Effects of hot air-assisted radio frequency heating on enzyme inactivation, lipid stability and product quality of rice bran[J].LWT, 2018, 91:453-459.
[9] 张晶晶. 薏仁米脂肪酶射频灭活效果及贮藏稳定性研究[D].无锡:江南大学, 2021.
ZHANG J J.Radio frequency inactivation effect and storage stability of coix rice lipase[D].Wuxi:Jiangnan University, 2021.
[10] 李永富, 王雪真, 黄金荣, 等.基于自由基控制的青稞脂肪酶射频灭活技术研究[J].中国粮油学报, 2022, 37(7):46-54.
LI Y F, WANG X Z,HUANG J R,et al.Radio frequency for lipase inactivation of highland barely based on free radicals control[J].Journal of the Chinese Cereals and Oils Association, 2022, 37(7):46-54.
[11] BARBA F J, ROOHINEJAD S, ISHIKAWA K, et al.Electron spin resonance as a tool to monitor the influence of novel processing technologies on food properties[J].Trends in Food Science &Technology, 2020, 100:77-87.
[12] MEXIS S F, KONTOMINAS M G.Effect of oxygen absorber, nitrogen flushing, packaging material oxygen transmission rate and storage conditions on quality retention of raw whole unpeeled almond kernels (Prunus dulcis)[J].LWT-Food Science and Technology, 2010, 43(1):1-11.
[13] 李诗炜. 熟化谷物粉在储藏过程中的氧化及其评价指标分析[D].无锡:江南大学, 2017.
LI S W.Analysis of oxidation and evaluation indexes of instant cereal flours during storage[D].Wuxi:Jiangnam University, 2017.
[14] 周良付, 雷玉洁, 李宇坤, 等.多酚氧化酶的射频加热灭活效果及动力学分析[J].现代食品科技, 2016, 32(9):161-166.
ZHOU L F, LEI Y J, LI Y K, et al.Inactivation effect of radio frequency heating on polyphenol oxidase and the analysis of kinetics[J].Modern Food Science and Technology, 2016, 32(9):161-166.
[15] WANG S, TIWARI G, JIAO S, et al.Developing postharvest disinfestation treatments for legumes using radio frequency energy[J].Biosystems Engineering, 2010, 105(3):341-349.
[16] VEARASILP S, THOBUNLUEPOP P, THANAPORNPOONPONG S-N, et al.Radio frequency heating on lipid peroxidation, decreasing oxidative stress and aflatoxin B1 reduction in Perilla frutescens L.highland oil seed[J].Agriculture and Agricultural Science Procedia, 2015, 5:177-183.
[17] BOLUMAR T, SKIBSTED L H, ORLIEN V.Kinetics of the formation of radicals in meat during high pressure processing[J].Food Chemistry, 2012, 134(4):2114-2120.
[18] 杨晓清, 赵丽贞, 高爱武, 等.水分调节对原料米糠微波稳定化的增效作用[J].食品工业科技, 2018, 39(23):169-174;181.
YANG X Q, ZHAO L Z,GAO A W, et al.Synergistic effect of moisture regulation on rice bran stabilization by microwave heating[J].Science and Technology of Food Industry, 2018, 39(23):169-174;181.
[19] CHAMPAGNE E T, HRON R J, ABRAHAM G.Utilizing ethanol to produce stabilized brown rice products[J].Journal of the American Oil Chemists Society, 1992, 69(3):205-208.
[20] LING B, LYNG J G, WANG S J.Radio-frequency treatment for stabilization of wheat germ:Dielectric properties and heating uniformity[J].Innovative Food Science and Emerging Technologies, 2018, 48:66-74.
[21] DUTTA BANIK S, NORDBLAD M, WOODLEY J M, et al.Effect of water clustering on the activity of Candida antarctica lipase B in organic medium[J].Catalysts, 2017, 7(8):227.
[22] 敖敦格日乐, 杨体强, 包斯琴高娃, 等.电场对脂肪酶二级结构及其活性的影响[J].食品与生物技术学报, 2015, 34(12):1256-1261.
AO D G R L, YANG T Q, BAO S Q G W, et al.Study on the effect of electric field on the secondary structure and activity of lipase[J].Journal of Food Science and Biotechnology, 2015, 34(12):1256-1261.
[23] 周颖, 杨震, 郭晓娜, 等.过热蒸汽对燕麦挂面储藏稳定性及风味的影响[J].中国粮油学报, 2022, 37(2):54-61.
ZHOU Y, YANG Z, GUO X N, et al.Effects of superheated steam treatment on storage stability and flavor of dried oat noodles[J].Journal of the Chinese Cereals and Oils Association, 2022, 37(2):54-61.
[24] 黄倩, 郭晓娜, 朱科学, 等.小麦粉加工精度对挂面储藏期间脂质稳定性的影响[J].中国粮油学报,2020, 35(11):111-118.
HUANG Q, GUO X N, ZHU K X, et al. Effects of wheat flour processing degree on lipid stability of dried noodles during storage[J].Journal of the Chinese Cereals and Oils Association, 2020, 35(11):111-118.
[25] 龚东平, 胡耀池, 张红漫, 等.游离脂肪酸对DHA油脂氧化稳定性的影响[J].食品与发酵工业, 2010, 36(11):30-33.
GONG D P, HU Y C, ZHANG H M, et al.Effect of free fatty acid on the oxidative stability of DHA oil[J].Food and Fermentation Industries, 2010, 36(11):30-33.
[26] 林露芬, 胡博, 高艺书, 等.微波处理对糙米制粉多样产物的自由基水平及贮藏稳定性的影响[J].食品与发酵工业, 2016, 42(8):81-86.
LIN L F, HU B, GAO Y S, et al.The influence of microwave irradiation on the thermal radical generation and storage behavior of the product of brown rice powder process[J].Food and Fermentation Industries, 2016, 42(8):81-86.
[27] LEHTINEN P, KIILI INEN K, LEHTOM
INEN K, LEHTOM KI I, et al.Effect of heat treatment on lipid stability in processed oats[J].Journal of Cereal Science, 2003, 37(2):215-221.
KI I, et al.Effect of heat treatment on lipid stability in processed oats[J].Journal of Cereal Science, 2003, 37(2):215-221.
[28] WANG X Z, LI Y F, SHI F, et al.Optimization of radio frequency heating protocols based on free radical control to improve the storage stability of highland barley[J].Journal of Cereal Science, 2022, 108:103558.