控制冰晶尺寸对冷冻食品品质至关重要。添加抗冻剂是有效控制冰晶形成、生长和重结晶的重要方法,如渗透型小分子(二甲基亚砜、甲醇、甘油等)、非渗透型小分子(单、双糖)、非渗透型聚合物、合成聚合物、纳米材料和水凝胶等作为抑冰剂已经得到了广泛研究和应用[1]。然而,这些抗冻剂潜在的安全风险及可能引入的感官变化往往不适合食品添加和应用。近年来,天然来源的大分子抗冻剂提供了活性可调、生物相容的选择。如生物来源的抗冻(糖)蛋白可以通过“吸附抑制”机制产生热滞效应、抑制冰重结晶和修饰冰晶形态[2],已被证实对冷冻食品具有优良的保护能力[3-5]。然而,天然抗冻(糖)蛋白来源少、不利于规模化生产以及潜在的健康隐患使其食品工业化应用面临挑战。除此之外,持续研究发现一些天然多糖,如卡拉胶[6-7]、纳米纤维素[8-9]以及冷适应性生物来源的多糖[10-11]具有抗冻活性,其中一些作为稳定剂已在冷冻食品中得到了广泛应用。天然多糖具有广泛的可及性、再生性、无毒性和健康益处[12],是开发理想食品冷冻保护剂的潜在候选者。
目前,天然多糖抑制冰晶生长的确切机制尚未明晰,只有少数多糖具有可观的冰重结晶抑制活性,其活性差异取决于多糖的结构类型[6]。近期针对卡拉胶、纳米纤维素、瓜尔豆胶等多糖稳定剂的研究表明,多糖溶液的黏度或凝胶化并不能解释其冰晶生长抑制活性,而是可能与抗冻蛋白冰结合作用类似的机制发挥作用[6-8]。CARILLO等[10]通过分子模拟技术发现一种从嗜冷海洋细菌Colwellia psychrerythraea 34H中提取的多糖可以形成特殊的“胶囊”结构,与冰晶表面通过特定的氢键作用结合而抑制冰晶生长;而GUERREIRO等[11]发现胞外多糖FucoPol表现出非依数性、浓度依赖性的冰点增加效应,认为多糖链水合参与界面冰-水相互作用可能解释其冷冻保护作用。
罗望子多糖(tamarind seed polysaccharide,TSP)是从罗望子(Tamarindus indica L.)种仁中提取纯化的一种半乳糖木葡聚糖,由β-D-(1→4)-葡聚糖的纤维素骨架以及半乳糖和木糖的分支组成的九糖重复单元[13]。木葡聚糖的特殊结构赋予TSP良好的水合性和热震稳定性,可以改善冷冻面团[14]、肉[15]等制品的冻融和贮藏稳定性。据日本Dsp Gokyo公司2014年的技术通报(https://www.fc.sumitomo-pharma.co.jp/en/)显示,TSP可以稳定冰淇淋中的冰晶尺寸,推荐其用于冷冻甜品冰晶稳定剂。作为一种极具开发潜力的天然大分子冷冻保护剂,尚缺乏系统的研究来理解TSP对冰晶生长的抑制效应。为此,本文通过研究TSP的冰重结晶抑制活性、重结晶动力学、冰晶生长习性以及对水溶液相变的热力学影响,系统理解该多糖对冰晶生长的抑制效应,为其食品应用提供一定的理论依据。
1 材料与方法
1.1 试验材料
罗望子多糖(TSP,纯度90.1%;蛋白含量1.1%,水分8.8%,灰分0.3%,均为质量分数),云南猫哆哩集团食品有限公司,进一步纯化(80 ℃加热溶解、离心、4倍体积95%乙醇沉淀、冻干),达到98.95%纯度;聚乙二醇(polyethylene glycol,PEG,黏均分子质量Mv约为100 000 g/mol)、聚乙烯醇(polyvinyl alcohol,PVA,纯度95%,重均分子质量Mw为89 000~98 000 g/mol),上海麦克林生化有限公司;其他化学品均为分析级。
1.2 仪器与设备
多角度激光散射凝胶色谱系统,美国Wyatt技术公司;Olympus BX51显微镜配置Canon EOS 500D SLR相机,日本Olympus公司;BCS196生物低温控制台,英国Linkam科学仪器公司;差示扫描量热(differential scanning calorimetry,DSC)仪2500,美国TA仪器公司。
1.3 试验方法
1.3.1 尺寸排阻色谱和多角度激光散射(size exclusion chromatography-multi-angle laser light scattering,SEC-MALLS)分析
采用高效尺寸排阻色谱初步分析TSP的溶液分子特征。配制不同质量浓度(1、2、5 mg/mL)的多糖溶液,80 ℃下持续搅拌至完全溶解,4 ℃下过夜,离心(10 000×g,10 min)去除不溶物后上样分析。该色谱系统包括多角度激光散射(multi-angle laser light scattering,MALLS)检测器、示差折光检测器和紫外检测器,采用SB-G 6B保护柱串联SB-805 HQ和SB-803 HQ分析柱,流动相为0.1 mol/L NaNO3,流速0.5 mL/min,柱温35 ℃,上样量100 μL。其中,TSP水溶液(25 ℃)的示差折光指数增量(dn/dc)为0.145 mg/mL。采用ASTRA 7.1.3软件分析样品的重均分子质量(Mw)、数均分子质量(Mn)、多分散指数(PDI=Mw/Mn)和z-均回转半径(rz)等分子特征参数。
1.3.2 “蔗糖三明治”冰重结晶试验
以49%(质量分数,下同)的蔗糖溶液为空白体系,研究添加TSP对冰重结晶过程的影响。通过不同蔗糖、纯水、TSP质量比配制含0.01%~0.5%(质量分数,下同)多糖的样品溶液,含1%(质量分数,下同)PEG和1%(质量分数,下同)PVA分别作为阴性对照和阳性对照[16]。吸取约1.5 μL样品溶液滴加于2块玻片(直径12 mm)间,浸油密封,置于冷台。将样品以30 ℃/min迅速降温至-40 ℃诱导形成多冰晶,保持2 min,以10 ℃/min升温至-8 ℃,维持30 min。等温(-8 ℃)退火期间,观察并记录冰晶的生长过程,样品台内外均缓慢流通N2防止环境水凝结雾化影响观察视野。独立重复3次试验,采用ImageJ软件测量每张图片中至少50个冰晶的尺寸,取3次测量的平均值。
1.3.3 冰重结晶动力学
基于Lifshitz-Slyozov-Wagner(LSW)理论描述的Ostwald熟化过程[17],研究冰重结晶过程中的生长动力学。如果冰重结晶过程是由水分子通过中间液相从小冰晶向大冰晶的扩散主导,那么LSW理论认为晶体的平均半径r随时间演变应遵循公式(1):
(1)
其中,r0,重结晶t=0 min时的初始平均半径;kd,重结晶的速率常数。试验采用49%蔗糖溶液体系可以确保Ostwald熟化(或迁移重结晶)占主导地位的较大的非冻结液相比例。因此,在半径r随时间t的演变过程中,重结晶的速率常数kd可以通过公式(1)线性回归之间的斜率确定。
1.3.4 动态冰晶修饰试验
在含0.25%(质量分数)TSP的蔗糖模型溶液(含质量分数49%的蔗糖水溶液)中观察单冰晶生长的动态变化,含0.25%(质量分数)的PEG和0.25%(质量分数)PVA分别作为阴性和阳性对照,研究样品添加对冰晶生长形貌的影响。如1.3.2节所述,将样品溶液降低至-40 ℃后升温至-8 ℃,等温退火30 min,随后以0.5 ℃/min升温直到视野中的冰晶仅剩无几,再以0.1 ℃/min缓慢冷却,期间观察单冰晶生长的形貌变化。
1.3.5 差示扫描量热法分析
采用差示扫描量热法研究样品溶液的量热行为,数据采集从25 ℃开始(平衡1 min),以3 ℃/min降温至-70 ℃(等温1 min),再以相同速率升温至25 ℃(等温1 min)。测试样品为0.01%~1.5% TSP、1%PEG和1%PVA的水溶液,空密封铝皿作为参照,至少进行3次独立的DSC测试。使用仪器配置的TRIOS软件进行数据分析,确定溶液平均冻结/非均相成核温度(Tf)、平均融化温度(Tm)以及相应的平均焓值(结晶焓ΔHc,融化焓ΔHm)。
2 结果与分析
2.1 罗望子多糖分子特征的初步分析
采用SEC-MALLS初步研究TSP在不同浓度下的分子特征。基于色谱峰(图1)计算的相关分子特征参数结果如表1所示,TSP的Mw和Mn浓度依赖性降低,1、2和5 mg/mL质量浓度下检测的Mw分别为1.97×106、1.18×106和0.98×106 Da,而rz分别为67.9、58.7和55.5 nm。此外,通过主要分子质量分布区间和rz的函数关系可以研究TSP溶液中主要的分子构象差异(图1-b~图1-d)。理想情况下,斜率为0.33代表球形构象,斜率为0.5~0.6代表随机线圈,而斜率1代表刚性棒状构象[18]。因此,TSP在质量浓度为2 mg/mL时斜率为0.565,表明该浓度下TSP呈柔性线圈构象;TSP在质量浓度5 mg/mL时斜率为0.477,说明构象趋于紧凑,介于球形和柔性随机线圈结构之间;而低质量浓度(1 mg/mL)TSP显示独特的U-型分布,这是高支化聚合物的典型特征。这种现象可以用伴随发生的相反分离机制来解释,即在小的洗脱体积下,正常的尺寸排阻分离机制占优势,此时小的洗脱片段的多分散性可以忽略;而在较大的洗脱体积下,洗脱的小分子质量多糖与延迟的高分子质量聚合物共流出,增加了洗脱“片段”的多分散性。因为均方根半径随多分散性的增加比Mw更加显著,所以曲线随着多分散系数的增加而向上位移,形成独特的U型曲线[19]。上述结果表明,TSP的溶液分子构象具有复杂的浓度依赖性。

a-不同浓度TSP的HPSEC-MALLS色谱图;b-1 mg/mL TSP的均方回转半径分布图;c-2 mg/mL TSP的均方回转半径分布图; d-5 mg/mL TSP的均方回转半径分布图
图1 不同浓度TSP的HPSEC-MALLS色谱图和均方回转半径分布图
Fig.1 HPSEC-MALLS-RI chromatograms and distribution of z-average radius of gyration (rz) for TSP at different concentrations
表1 SEC-MALLS分析的TSP分子特征
Table 1 Molecular characteristic of TSP from SEC-MALLS analysis

质量浓度/(mg/mL)Mw(×106Da)Mn(×106Da)PDI(Mw/Mn)z-均回转半径(rz)/nm11.97±0.151.59±0.301.46±0.3767.9±5.5221.18±0.170.93±0.121.24±0.0658.7±2.1950.98±0.060.69±0.101.42±0.1355.5±2.33
2.2 罗望子多糖的冰重结晶抑制活性
如图2所示,“蔗糖三明治”冰重结晶试验退火过程(Ostwald熟化)中,冰晶尺寸逐渐增大,而总冰晶数量减少。空白对照(质量分数49%蔗糖溶液)和阴性对照(空白对照49%蔗糖溶液中含1%PEG)退火30 min后的冰晶尺寸比含TSP溶液中的冰晶更大(图3),而含PVA溶液中的冰晶最小,表明TSP具有显著的冰重结晶抑制活性,但活性远低于PVA。不同质量分数(0.01%~0.5%)TSP溶液中冰晶在退火30 min后的尺寸分布如图4-a所示,与未添加TSP的溶液相比,添加TSP后形成的冰晶尺寸分布更窄,当TSP质量分数从0.01%增加到0.25%时,冰晶分布趋向更小的尺寸。然而,当质量分数增大到0.5%时,尺寸分布反而变宽,粒径变大。尺寸分布的统计结果如表2所示,空白组和阴性对照形成的冰晶平均半径分别为6.08和5.46 μm,添加0.25%TSP形成的冰晶半径为3.05 μm,而添加0.5%TSP的冰晶半径为3.71 μm,这与肉眼观察到的结果一致。值得注意的是,这里没有显示PVA溶液的冰晶尺寸分布,因为1%(质量分数)PVA在30 min内几乎完全抑制冰重结晶,冰晶尺寸几乎没有变化,因此很难进行单独测量。总的来说,TSP从0.01%到0.25%范围内显示剂量依赖性活性增加,而当质量分数增加到0.5%时活性略有降低。

图2 等温退火过程中的冰晶生长过程(Ostwald熟化)
Fig.2 Growth process of ice grains during annealing (Ostwald ripening)

a-49%蔗糖;b-49%蔗糖+1%PEG;c-49%蔗糖+1%PVA; d-49%蔗糖+0.1%TSP;e-49%蔗糖+0.25%TSP; f-49%蔗糖+0.5%TSP
图3 冰重结晶过程中等温(-8 ℃)退火30 min后的 冰晶显微图片
Fig.3 Micrographs of ice crystals grown after annealing 30 min at -8 ℃
如图4-b所示,重结晶过程中冰晶平均半径的三次方随时间的变化可以采用线性生长函数拟合(R2>0.9),表明测试溶液中的冰重结晶动力学由LSW理论提出的水分子扩散主导[17]。如表2所示,与空白蔗糖溶液的冰重结晶速率相比(kd=9.93 μm3/min),含TSP溶液的冰重结晶速率常数显著降低,其中0.25%(质量分数)TSP溶液中的冰晶生长速率最慢,kd为0.98 μm3/min,而0.5%(质量分数)TSP中冰晶的生长速率略有增加,kd为2.20 μm3/min。

a-冰晶尺寸分布;b-冰晶生长动力学(t=2~30 min)
图4 冰晶尺寸分布和重结晶动力学
Fig.4 Ice size distribution and recrystallization kinetics
表2 冰晶的尺寸分布统计和生长速率常数
Table 2 Ice crystals size distribution and growth rate constants (kd)

样品质量分数/%最小半径/μm最大半径/μm平均半径/μmkd(μm3/min)R2空白-1.49±0.18a11.19±1.96a6.08±0.55a9.93±1.06a0.99PEG11.48±0.30a9.56±2.29a5.46±0.29a7.02±1.09b0.95TSP0.011.22±0.12ab9.63±0.51a5.59±0.20ab7.77±0.62b0.990.051.40±0.09ab10.02±0.64a5.10±0.52b6.39±1.14b0.980.11.11±0.15b6.74±0.60b3.54±0.34bcd1.88±0.09c0.960.251.05±0.23b4.61±0.38b3.05±0.15d0.98±0.14d0.940.51.34±0.19ab5.90±0.17b3.71±0.26c2.20±0.25c0.98
注:同列上标不同字母的数据差异显著(P<0.05)。
2.3 冰晶生长习性
动态冰晶修饰试验中不同溶液中的冰晶生长形貌如图5所示,空白溶液(49%蔗糖)中的冰晶呈圆形,少数呈拉长状。添加PEG对冰晶的生长形貌没有显著影响,表明其与冰晶界面没有明显的相互作用,而PVA可以与特定冰晶表面结合[20],因此显示较强的冰晶形貌修饰能力,含PVA的蔗糖溶液中冰晶均呈针状和拉长状。与上述对照组相比,TSP溶液中形成少量的针状和不规则冰晶,暗示TSP与冰晶表面可能存在弱的相互作用。

a-49%蔗糖;b-49%蔗糖+PEG;c-49%蔗糖+TSP; d-49%蔗糖+PVA
图5 不同溶液中的冰晶生长形貌
Fig.5 Growth morphology of ice crystals of different solutions
2.4 量热行为分析
采用差示扫描量热法(differential scanning calorimetry,DSC)研究TSP对溶液相变的热力学影响。如图6所示(数据统计结果见表3),纯水在-15.18 ℃附近的过冷温度范围冻结,随后的升温过程中冻结相在-0.81 ℃附近融化。TSP溶液的冻结温度(Tf)降低,表明在溶液缓慢冷却过程中TSP抑制了(非均相)成核,其中0.01%、0.1%、0.25%和0.5%TSP的冰点抑制温度(ΔTf,TSP溶液初始冻结温度与空白对照初始冻结温度的差值)分别为-1.74、-4.36、-6.43、-6.15 ℃。而当TSP质量分数增加到1.5%时,ΔTf为-2.96 ℃。在当前测试条件和浓度范围内,TSP溶液没有表现出玻璃化转变和冷结晶事件。在随后的加热过程中,TSP溶液的融点温度没有显著变化。作为对照,1%PEG和1%PVA的ΔTf分别为-2.78和-8.52 ℃,而Tm比空白组略低。
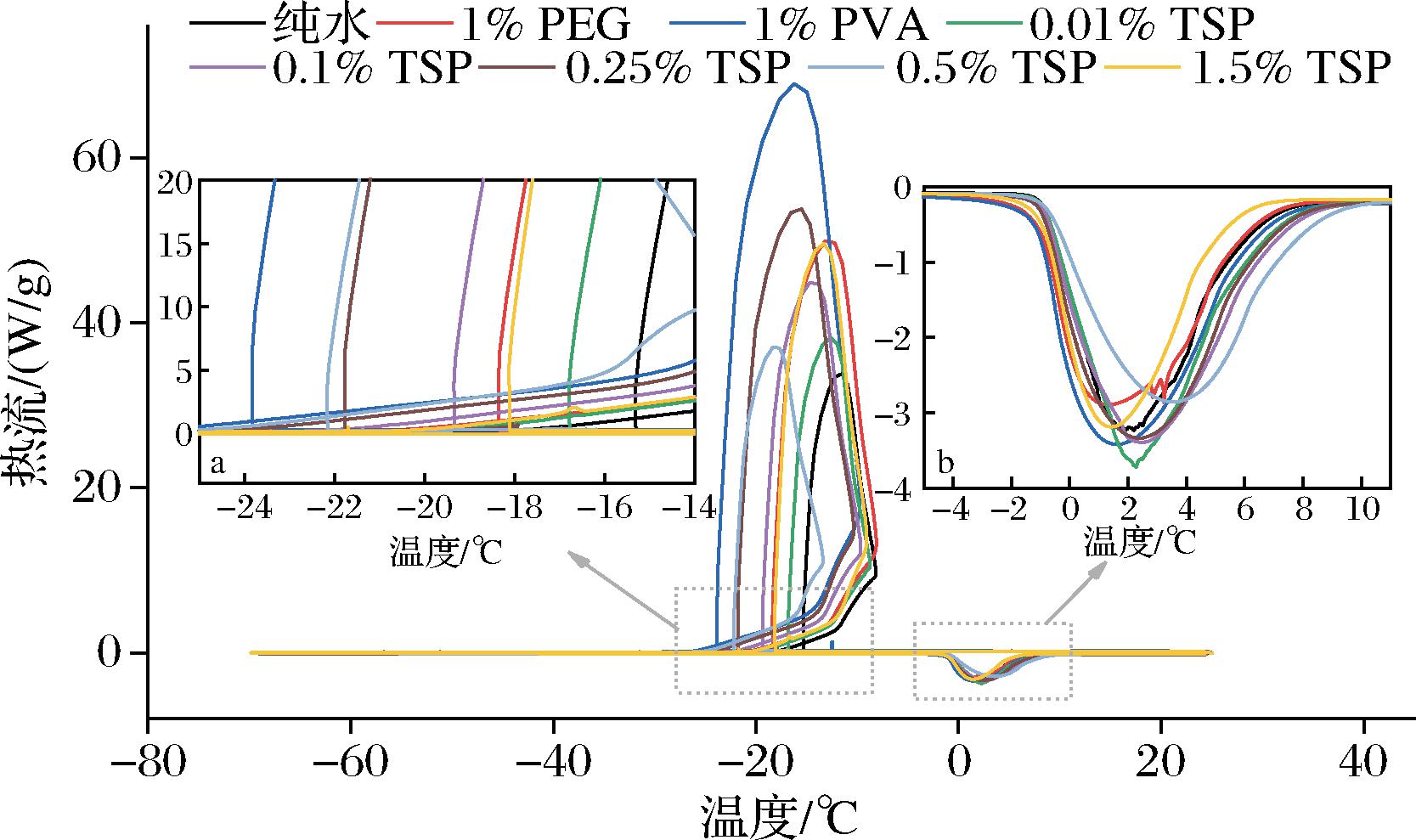
a-冻结行为;b-融化行为
图6 TSP水溶液的DSC分析
Fig.6 DSC analysis of TSP aqueous samples
表3 样品溶液的热力学数据统计
Table 3 Summary of thermodynamic data of samples
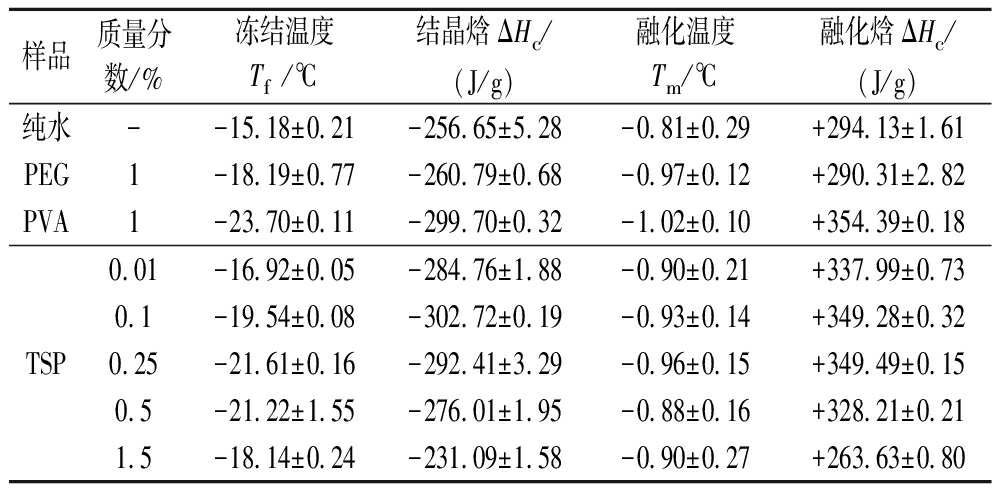
样品质量分数/%冻结温度Tf/℃结晶焓ΔHc/(J/g)融化温度Tm/℃融化焓ΔHc/(J/g)纯水--15.18±0.21-256.65±5.28-0.81±0.29+294.13±1.61PEG1-18.19±0.77-260.79±0.68-0.97±0.12+290.31±2.82PVA1-23.70±0.11-299.70±0.32-1.02±0.10+354.39±0.18TSP0.01-16.92±0.05-284.76±1.88-0.90±0.21+337.99±0.730.1-19.54±0.08-302.72±0.19-0.93±0.14+349.28±0.320.25-21.61±0.16-292.41±3.29-0.96±0.15+349.49±0.150.5-21.22±1.55-276.01±1.95-0.88±0.16+328.21±0.211.5-18.14±0.24-231.09±1.58-0.90±0.27+263.63±0.80
3 讨论
为发展高品质冷冻食品,长期以来,科学界一直关注于合成的小分子抗冻剂,但天然来源的多糖大分子提供了生物相容的替代性选择。利用天然多糖抑制冰晶生长(重结晶)的研究一直在持续,但很少具有可观的抗冻活性[12],仍需持续发掘自然界中具有显著抗冻能力的食品多糖资源,并进一步理解其发挥抗冻活性的潜在机理。
在本研究中,SEC-MALLS结果初步显示TSP在溶液中具有浓度依赖性构象变化,可能是因为分子自聚集行为所致[21],这种复杂的溶液行为可能会影响其冷冻保护活性。冰重结晶抑制试验采用高质量分数(49%)蔗糖体系可以避免假阳性[16],其产生低冰相分离的冰晶可以进一步定量冰晶生长的动力学数据,为TSP应用于冷冻甜品提供了更为精确的研究模型。结果显示,TSP具有优良的冰晶生长抑制能力,且活性受浓度变化影响。值得注意的是,TSP和合成聚合物PVA相比,活性较低,但和其他已报道的具有抗冻活性的天然多糖如卡拉胶[6]、瓜尔胶和纳米纤维素[8]等相比,TSP表现出较高的竞争潜力。和生物低温保存不同,一些食品应用如冰淇淋等需要小冰晶赋予产品理想的口感,因此可以认为TSP用于冰淇淋等冷冻甜品的新型抑冰剂具有较大潜力。
冰重结晶动力学数据显示在实际应用中多糖浓度筛选的重要性,如在当前条件下,0.25%TSP(而非0.5%)显示最高的冰重结晶抑制活性。这种浓度依赖性但非持续性增加的活性变化也提示我们进一步探索TSP抑制冰晶生长的潜在作用机制。LI等[8, 22]研究发现,多糖类稳定剂的冰重结晶抑制活性与未冻结相中稳定剂浓度和冰晶总表面积的比值相关,且显示时间依赖性冰晶表面覆盖,为多糖类大分子的冰结合机制提供了有力证据。显然,当前研究结果也表明TSP的溶液黏度与冰重结晶抑制活性并不相关,且TSP显示一定(较弱)的冰晶形貌修饰活性,这些结果支持了多糖与冰晶相互作用的推测。因此,当多糖质量分数增加到0.5%时,TSP进入不同的链纠缠状态或自聚集趋于更加紧密的结构,可能改变了与冰晶表面的结合行为(相互作用可及性降低),导致活性略有降低。然而,当前结果并未排除由于未冻结相冷冻浓缩而凝胶化的影响。
此外,重结晶过程中的冰晶大小也受到初始成核行为的影响。尽管采用DSC测定溶液冻结温度存在一些预期的随机变化,但总体趋势非常明显。TSP对非均相成核温度具有一定的抑制效应,但不呈线性浓度依赖性增大。基于Gibbs-Thomson效应,冻结温度降低可以解释为聚合物与冰晶相互作用诱导形成曲率的结果[23]。PVA可以与冰晶表面特定的氢键结合,具有较强的冻结温度抑制能力,但TSP与冰晶表面的弱相互作用似乎不足以解释其有效的冻结温度抑制能力。因此,TSP抑制冰晶生长(重结晶)可能存在更加复杂的作用机制。此外,TSP在测试浓度范围内未显示任何玻璃化转变或冷结晶事件,表明在当前测试质量分数<1.5%时不会通过玻璃化食品系统发挥冷冻保护作用。
水化动力学对碳水化合物基抗冻剂具有非常重要的意义[24],大多数亲水性多糖与水分子的相互作用会扰动水的氢键网络,从而影响水的热力学和动力学性质。CHEN等[25]通过分子动力学模拟研究表明,吸附在TSP周围的水分子扩散系数远小于体相水(仅相当于体相水的15%)。因此,不难推测TSP水合会影响体相水分子到冰/水界面(准液层)扩散的热力学和动力学性质[24-25],从而影响冰的生长和重结晶。从这点来说,浓度增大导致活性降低可能与分子聚集增加了局部的脱水合作用有关。然而,目前尚缺乏多糖类大分子与冰晶表面相互作用以及通过水氢键网络扰动抑制冰晶生长的直接证据,需要进一步的工作来确证并阐明其分子和原子细节。
4 结论
本研究系统评估了TSP的冰晶生长抑制效率。 结果表明,TSP具有优良的冰重结晶抑制活性,其中0.25%TSP对冰重结晶的抑制效果最好。单冰晶形貌变化暗示TSP与冰晶表面可能存在较弱的相互作用,量热分析显示TSP具有一定的冰点抑制效应而对融点没有显著影响。推测TSP的抑冰机理可能和其与冰晶表面的弱相互作用和水化动力学有关,但仍需进一步证据确证并阐明其作用的分子和原子细节。总的来说,利用天然TSP作为新型食品抑冰剂具有巨大潜力,但目前针对大分子抗冻剂的活性和实际应用效果的联系仍未得到充分理解,需在实际食品体系中进一步研究。
[1] CHANG T, ZHAO G.Ice inhibition for cryopreservation:Materials, strategies, and challenges[J].Advanced Science, 2021, 8(6):2002425.
[2] RAMLOV H, FRIIS D S.Antifreeze Proteins Volume 2[M].Cham, Switzerland:Springer International Publishing, 2020.
[3] KALEDA A, TSANEV R, KLESMENT T, et al.Ice cream structure modification by ice-binding proteins[J].Food Chemistry, 2018, 246:164-171.
[4] KASHYAP P, KUMAR S, SINGH D.Performance of antifreeze protein HrCHI4 from Hippophae rhamnoides in improving the structure and freshness of green beans upon cryopreservation[J].Food Chemistry, 2020, 320:126599.
[5] 张艳杰, 王金慧, 艾志录, 等.植物源抗冻蛋白对面筋蛋白性质影响研究进展[J].食品与发酵工业, 2022, 48(9):267-273;279.
ZHANG Y J, WANG J H, AI Z L, et al.Effects of plant-derived antifreeze proteins on properties of gluten:A review[J].Food and Fermentation Industries, 2022, 48(9):267-273;279.
[6] KIRAN-YILDIRIM B, HALE J L, WEFERS D, et al.Ice recrystallization inhibition of commercial κ-, ι-, and λ-carrageenans[J].Journal of Food Engineering, 2021, 290:110269.
[7] LEITER A, EMMER P, GAUKEL V.Influence of gelation on ice recrystallization inhibition activity of κ-carrageenan in sucrose solution[J].Food Hydrocolloids, 2018, 76:194-203.
[8] LI M, DIA V P, WU T.Ice recrystallization inhibition effect of cellulose nanocrystals:Influence of sucrose concentration[J].Food Hydrocolloids, 2021, 121:107011.
[9] LI T, ZHAO Y, ZHONG Q X, et al.Inhibiting ice recrystallization by nanocelluloses[J].Biomacromolecules, 2019, 20(4):1667-1674.
[10] CARILLO S, CASILLO A, PIERETTI G, et al.A unique capsular polysaccharide structure from the psychrophilic marine bacterium Colwellia psychrerythraea 34H that mimics antifreeze (glyco)proteins[J].Journal of the American Chemical Society, 2015, 137(1):179-189.
[11] GUERREIRO B M, FREITAS F, LIMA J C, et al.Demonstration of the cryoprotective properties of the fucose-containing polysaccharide FucoPol[J].Carbohydrate Polymers, 2020, 245:116500.
[12] SUN X B, WU Y, SONG Z B, et al.A review of natural polysaccharides for food cryoprotection:Ice crystals inhibition and cryo-stabilization[J].Bioactive Carbohydrates and Dietary Fibre, 2022, 27:100291.
[13] GIDLEY M J, LILLFORD P J, ROWLANDS D W, et al.Structure and solution properties of tamarind-seed polysaccharide[J].Carbohydrate Research, 1991, 214(2):299-314.
[14] 王文豪, 张光玲, 杨天奎, 等.多糖涂膜对冷冻面团的保鲜研究[J].农产品加工, 2018(1):9-12;17.
WANG W H, ZHANG G L, YANG T K, et al.Study of the preservation effect of polysaccharide coating on frozen dough[J].Farm Products Processing, 2018(1):9-12;17.
[15] 王盼盼. 肉制品加工中使用的辅料:增稠剂[J].肉类研究, 2011, 25(2):29-35.
WANG P P.Ingredients in meat products:Thickeners[J].Meat Research, 2011, 25(2):29-35.
[16] BIGGS C I, STUBBS C, GRAHAM B, et al.Mimicking the ice recrystallization activity of biological antifreezes.when is a new polymer active?[J].Macromolecular Bioscience, 2019, 19(7):e1900082.
[17] BUDKE C, HEGGEMANN C, KOCH M, et al.Ice recrystallization kinetics in the presence of synthetic antifreeze glycoprotein analogues using the framework of LSW theory[J].The Journal of Physical Chemistry B, 2009, 113(9):2865-2873.
[18] HIEMENZ P C, LODGE T.Polymer Chemistry[M].2nd ed.Boca Raton, FL:CRC Press, 2007.
[19] ZHAO W, CHAI D D, LI H M, et al.Significance of metal ion supplementation in the fermentation medium on the structure and anti-tumor activity of Tuber polysaccharides produced by submerged culture of Tuber melanosporum[J].Process Biochemistry, 2014, 49(12):2030-2038.
[20] BUDKE C, KOOP T.Ice recrystallization inhibition and molecular recognition of ice faces by poly (vinyl alcohol)[J].ChemPhysChem, 2006, 7(12):2601-2606.
[21] KISHANI S, VILAPLANA F, RUDA M, et al.Influence of solubility on the adsorption of different xyloglucan fractions at cellulose-water interfaces[J].Biomacromolecules, 2020, 21(2):772-782.
[22] LI M, LUCKETT C R, WU T.Potent time-dependent ice recrystallization inhibition activity of cellulose nanocrystals in sucrose solutions[J].Biomacromolecules, 2022, 23(2):497-504.
[23] ZHANG Z S, LIU X Y.Control of ice nucleation:Freezing and antifreeze strategies[J].Chemical Society Reviews, 2018, 47(18):7116-7139.
[24] TAM R Y, FERREIRA S S, CZECHURA P, et al.Hydration Index-A better parameter for explaining small molecule hydration in inhibition of ice recrystallization[J].Journal of the American Chemical Society, 2008, 130(51):17494-17501.
[25] CHEN P, TERENZI C, FUR I, et al.Hydration-dependent dynamical modes in xyloglucan from molecular dynamics simulation of 13 NMR relaxation times and their distributions[J].Biomacromolecules, 2018, 19(7):2567-2579.
I, et al.Hydration-dependent dynamical modes in xyloglucan from molecular dynamics simulation of 13 NMR relaxation times and their distributions[J].Biomacromolecules, 2018, 19(7):2567-2579.