小白链霉菌(Streptomyces albulus)是日本学者SHIMA和SAKAI于1977年从土壤中分离得到的[1]。目前,它主要作为ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)的工业生产菌被广泛研究。ε-PL是由25~35个L-赖氨酸单体,在非核糖体肽合成酶催化作用下以α—COOH和ε—NH2缩合方式形成的一种天然抗菌肽,对革兰氏阳性(G+)和革兰氏阴性(G-)细菌、酵母、霉菌和病毒均具有很好的抑制作用[2-3]。目前,它作为一种天然食品防腐剂在日本、韩国、美国和中国等国家的食品工业中获得应用[4]。由于ε-PL能够与乳酸链球菌素和纳他霉素等天然食品防腐剂在抑菌谱、应用范围和产品特性上形成有效互补,故被认为是推动天然食品防腐剂替代化学食品防腐剂的关键品种。
维持发酵环境pH值处于4.0左右是实现S.albulus大量积累ε-PL的重要前提。主要有两方面原因:一是低pH条件能够限制S.albulus的菌体生长而大量积累ATP,从而满足ε-PL合成酶催化起始对ATP浓度的要求,以实现ε-PL合成顺利启动[5];二是低pH条件能够抑制ε-PL降解酶活性,防止已积累的ε-PL被分解[6]。因此,对S.albulus发酵过程pH值进行精准调控成为提高ε-PL产量的有效途径。例如,KAHAR等[7]建立了分阶段pH调控策略(pH 6.5→4.0),实现S.albulus S410的ε-PL发酵产量达到48.3 g/L;CHEN等[8]开发了两阶段pH发酵工艺(pH 3.5→3.8),实现S.albulus M-Z18的ε-PL发酵产量达到30.11 g/L;REN等[9]创建了pH冲击策略(pH 6.0→3.0→3.8)使得S.albulus M-Z18的ε-PL发酵产量提升至54.7 g/L。邓玥等[10]提出了动态pH值调控策略(pH 5.5→3.0→3.8~4.2),实现S.albulus GS114的ε-PL发酵产量达到60.2 g/L。然而,S.albulus的菌体生长最适pH值为6.0左右,由此形成ε-PL合成阶段的酸性环境对小白链霉菌生长产生了低pH胁迫。王开方等[11]的研究发现,S.albulus M-Z18在pH 2.5条件下,24 h内菌体存活率降低80%以上;吴梦萍[12]也发现S.albulus WG-608在pH 3.6条件下,菌体干重和平均比生长速率较pH 4.3均有显著下降。已有的研究表明,微生物处于酸胁迫条件下,往往会引起胞内微环境变化,造成关键酶活力的降低、细胞膜和胞内大分子的结构变化,最终引起细胞凋亡[13]。因此,提高S.albulus的低pH耐受能力以减少低pH对S.albulus造成的损伤可能是提高其ε-PL合成能力的一种有效方法。
适应性实验室进化(adaptive laboratory evolution,ALE)是在特定条件下对微生物进行培养,促使菌株完成适应性自进化,最后通过筛选获得有益突变的方法[14]。该方法在改善微生物耐酸性能方面具有强大功效与广泛应用。例如,NARAYANAN等[15]利用ALE技术对S.cerevisiae TMB3500菌株在低pH的培养环境下进行培养,显著提高了酿酒酵母菌株在pH 5.0和pH 4.5时的生长性能。SHUI等[16]在适应性进化过程中通过逐渐增加乙酸的浓度,成功在7 g/L乙酸条件下使适应性进化菌株的细胞密度比出发菌株提高0.35~2.64。任喜东等[17]对淀粉产色链霉菌进行了70 d的酸适应性进化,使得适应性进化菌株的菌体干重较出发菌株增加了60%。本文以1株ε-PL生产菌Streptomyces albulus GS114为出发菌株,采用适应性进化策略,通过逐渐降低驯化pH值,实现S.albulus GS114低pH耐受性增强;再结合菌株筛选,获得低pH耐受性能增强和ε-PL产量提高的突变菌株。最后,考察了不同pH值对最优适应性进化菌株分批发酵影响,并评估了最优适应性进化菌株补料-分批发酵生产ε-PL的能力。
1 材料与方法
1.1 材料
1.1.1 菌株
Streptomyces albulus GS114,由本实验室选育和保藏。
1.1.2 培养基
固体培养基(贝特纳)(g/L):葡萄糖 10,酵母粉 1,鱼粉蛋白胨 2,pH 7.5。
种子培养基(g/L):葡萄糖 50,酵母粉 5,(NH4)2SO4 5,KH2PO4 1.36,K2HPO4 0.8,MgSO4·7H2O 0.5,ZnSO4·7H2O 0.04,FeSO4·7H2O 0.03,pH 6.8。
发酵培养基(g/L):葡萄糖 60,酵母粉 10,(NH4)2SO4 10,KH2PO4 4,MgSO4·7H2O 0.5,ZnSO4·7H2O 0.04,FeSO4·7H2O 0.03,pH 6.8。
1.1.3 试剂和仪器
葡萄糖(优级纯),山东西王药业有限公司;酵母粉,Oxoid公司;其他试剂(分析纯),国药化学试剂有限公司。
UV-2100分光光度计,优尼科仪器有限公司;AB204-N分析天平,瑞士梅特勒公司;GNP-9160恒温培养箱,上海光都仪器设备有限公司;高速冷冻离心机3K15,德国西格玛公司;HYL-C组合式摇床,太仓市强乐设备有限公司;SBA-40C生物传感分析仪,山东省科学院生物研究所;5 L发酵罐,上海保兴生物设备有限公司。
1.2 实验方法
1.2.1 培养方法
种子培养:挑取2~3环孢子接种至种子培养基,30 ℃、200 r/min培养24 h。
摇瓶水平的ε-PL发酵:将培养好的种子液以体积分数8%接种量接入装有40 mL发酵培养基的250 mL锥形瓶中,30 ℃、200 r/min,培养72 h。
1.2.2 适应性进化
取生长24 h种子液,以8%的接种量分别转接pH 2.5、3.0、3.5、4.0、4.5、5.0的M3G摇瓶,30 ℃,200 r/min,培养24 h。培养前后取样稀释涂布,然后平板菌落计数。
将孢子接种至含有40 mL M3G培养基(pH 6.8)的250 mL摇瓶中,30 ℃,200 r/min培养24~26 h,将培养后的菌液按8%的接种量接种至pH 4.0的M3G培养基中,30 ℃,200 r/min培养72 h,每隔12 h取样,测定其菌体干重。
将以8%的接种量将培养24 h的S.albulus GS114种子液接种至初始pH 4.0的M3G培养基中,30 ℃、200 r/min振荡培养36 h,再以8%的接种量转接至新鲜的相同培养基中。在转接过程中待其菌体量稳定后,降低适应性进化pH,每次降低0.2,增加选择压力。在适应性进化的不同pH时期,挑选在pH 4.0的M3G固体平板上生长快速、产孢子能力强的菌株,即为耐酸能力提高的进化菌株。
1.2.3 不同pH适应性进化菌株孢子耐酸能力评估
将不同pH适应性进化菌株的孢子,经梯度稀释(10-1、10-2、10-3)后,点涂于不同pH值(6.0、4.0、3.8、3.6)的贝特纳平板上,30 ℃静置培养,观测菌落生长情况。
1.2.4 不同pH适应性进化菌株发酵能力评价
取3 mL培养24 h的种子液接种到装有40 mL YP培养基(初始pH 6.8)的250 mL锥形瓶中,置于摇床中30 ℃、200 r/min培养72 h,测定菌体干重,ε-PL产量。
1.2.5 不同pH对适应性进化菌株生产ε-PL的影响
将培养好的种子液以体积分数8%接种量接入5 L发酵罐中,装液量为3.5 L,温度设置为30 ℃,初始转速为200 r/min,溶氧设置为30%,转速溶氧联动控制。待pH分别自然下降至4.0、3.8、3.6时,用体积分数12.5%的NH3·H2O分别维持pH恒定直至葡萄糖消耗完毕。
1.2.6 适应性进化菌株与出发菌株补料分批发酵过程分析
培养24 h的种子液以体积分数8%接种量接入5 L宝兴发酵罐中,装液量为3.5 L,温度设置为30 ℃,初始转速为200 r/min,溶氧设置为30%,转速溶氧联动控制。待pH值自然下降至4.0时,用体积分数12.5%的NH3·H2O分别维持pH恒定直至192 h发酵结束。当发酵液中葡萄糖质量浓度低于10 g/L时,根据葡萄糖的消耗速率设定补料速率,补加质量浓度为750 g/L葡萄糖溶液,维持发酵液中葡萄糖质量浓度在10 g/L左右直至发酵结束。与此同时,当NH4+-N质量浓度低于0.2 g/L时补加375 g/L (NH4)2SO4溶液,使NH4+-N质量浓度维持在0.2~0.5 g/L,如此重复直至发酵结束。
1.2.7 发酵参数测定
葡萄糖浓度使用生物传感分析仪进行测定,样品稀释100倍,25 μL进样量进行测定;NH4+-N浓度采用奈斯勒试剂比色法测定[18];ε-PL浓度采用甲基橙比色法[19];菌体干重(dry cell weight,DCW)测定参考汪泽等[20]的方法。ε-PL平均比合成速率按公式(1)计算:
(1)
式中:x,DCW,g/L;t,发酵时间,h;p,ε-PL产量,g/L。
2 结果与分析
2.1 S.albulus GS114的低pH适应性进化
初始适应性进化pH值和转接时间的选择对适应性进化的成败起着关键作用。为此,首先考察了不同起始pH值对S.albulus GS114存活率的影响,结果如图1-a所示。S.albulus GS114在初始pH值为2.5和3.0的体系中活菌数随着培养时间延长而明显下降,在初始pH值为3.5和4.0的体系中存活率有少许增加并保持稳定,而在初始pH值为4.5和5.0的体系中活菌数有显著增加。由此可以看出,选择初始pH值为3.5和4.0为适应性进化初始pH值较合适。然而,预实验选择pH 3.5作为初始适应性进化pH值的实验周期太长(结果未给出),故选择初始pH值4.0为最佳适应性进化初始pH值。其次,考察了S.albulus GS114在初始pH 4.0适应性进化体系中的生长曲线,结果如图1-b所示。S.albulus GS114随着培养时间延长,菌体干重一直处于下降趋势,说明该pH并不适合菌体正常生长。另外,由于在24~36 h菌体干重降低幅度最大,具有适应性进化潜力,故选择36 h为最佳转接时间。在确定适应性进化条件后,开始采用逐级降低pH的策略对S.albulus GS114进行低pH适应性进化,过程如图1-c所示。整个适应性进化过程共进行了连续62次转接,历时2 232 h(93 d),适应性进化pH值从4.0降低到3.6。当适应性进化pH值,下降至3.4时,菌体生长延滞期严重延长甚至停止生长(结果未给出),导致适应性进化所付出的时间成本与收益极大的不平衡,因此适应性进化停止在pH 3.6。从图1-c可以看出,pH 4.0适应性进化阶段,出发菌株初始菌体干重为1.4 g/L,经过14次转接(504 h)后,菌体干重达到2.4 g/L;pH 3.8适应性进化阶段,初始菌体干重为2.3 g/L,经过18次转接(648 h)后,菌体干重达到2.6 g/L;在pH 3.6适应性进化阶段,由于pH值更低造成环境压力增大,从pH 3.8中转接的菌体干重逐渐降低,经过5次转接(180 h)后,菌体干重才逐渐增加,最终经过31次转接(1 116 h),菌体干重达到2.46 g/L。总体上来说,经过逐级降低pH的适应性进化,实现了出发菌株的适应性进化pH值由4.0降低至3.6。

a-不同pH条件培养下菌落数;b-菌体干重随培养时间变化;c-菌体干重随转接次数变化
图1 适应性进化策略的设计与实施
Fig.1 Design and implementation of adaptive evolution strategy
2.2 耐受低pH的ε-PL高产菌株筛选
本研究一方面要实现S.albulus GS114的低pH耐受性增加,另一方面要确保S.albulus GS114的ε-PL合成能力不下降甚至提高。因此,需要对各适应性进化阶段的菌株进行ε-PL合成能力的筛选,结果如图2所示。
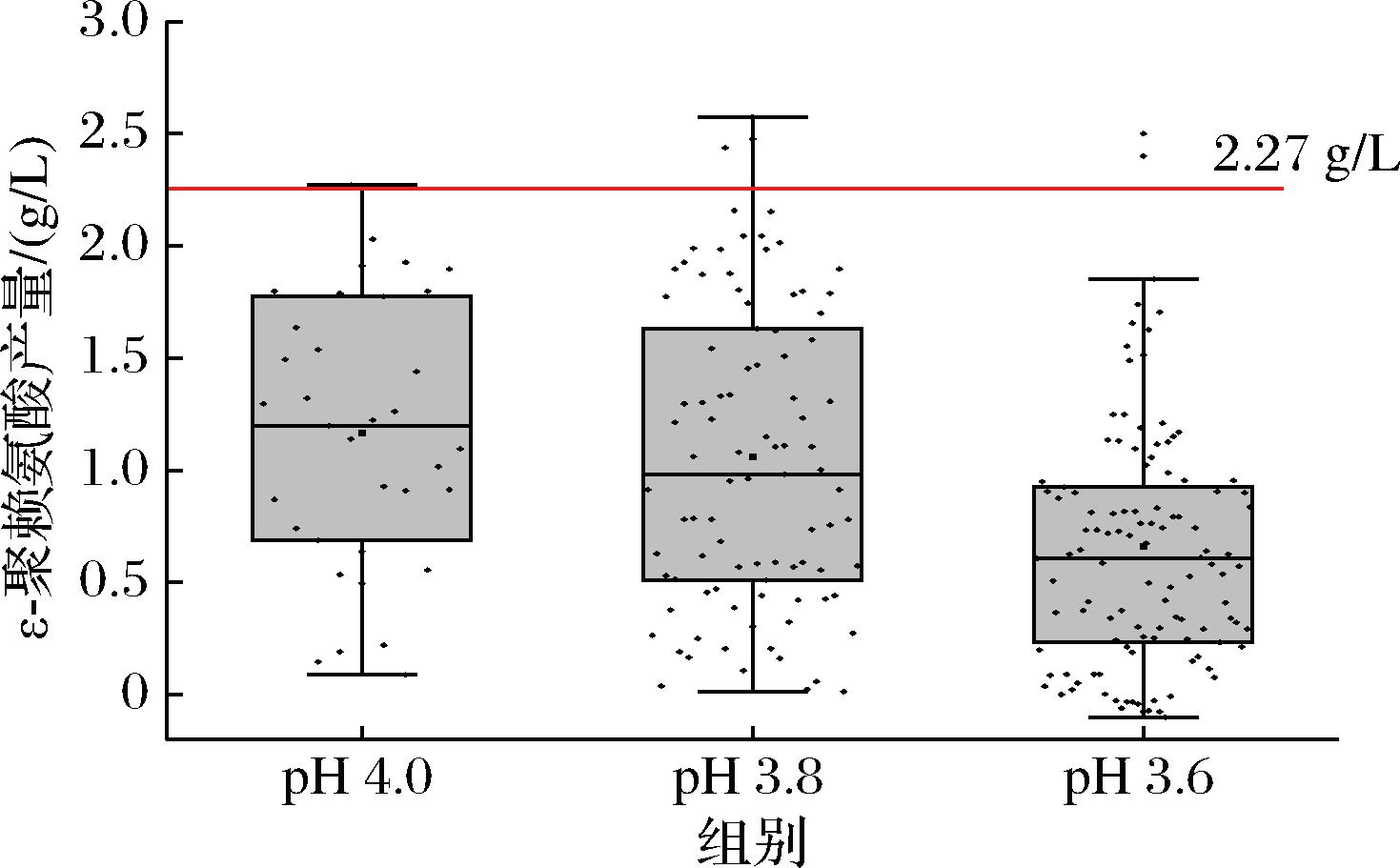
图2 不同适应性进化条件下ε-PL产量筛选结果
Fig.2 Screening results of ε-PL yield under different adaptive evolution conditions
出发菌株ε-PL产量为2.27 g/L,在不同批次的适应性进化中均筛选到产ε-PL能力提高的菌株。pH 4.0,pH 3.8阶段适应性进化筛选到的菌株ε-PL产量离散程度较大,pH 3.6阶段适应性进化得到的菌株ε-PL产量较为集中。同时,随着适应性进化pH值降低,低pH耐受菌株ε-PL产量的平均数和中位数均在下降,说明适应性进化一方面提高了菌株的低pH耐受性,另一方面却造成了ε-PL合成能力的普遍下降。这可能是经过低pH环境适应性进化后的菌株在基本生理代谢与次级代谢产物之间权衡的结果。经过大量筛选,最终确定pH 4.0适应性进化阶段最优菌株为S.albulus ALE4.0,pH 3.8适应性进化阶段最优菌株为S.albulus ALE3.8,pH 3.6适应性进化阶段最优菌株为S.albulus ALE3.6。
2.3 适应性进化菌株的低pH耐受性能和ε-PL合成能力评价
为了评价适应性进化对S.albulus低pH耐受性的影响,将S.albulus ALE4.0、S.albulus ALE3.8、S.albulus ALE3.6和出发菌株S.albulus GS114的孢子点接于不同pH的固体平板上(pH 6.0、4.0、3.8、3.6),以观察它们的菌落生长情况,结果如图3所示。在pH 6.0和pH 4.0的平板上,4个菌株的生长情况基本相同,菌落大小也基本一致;在pH 3.8和pH 3.6平板上,出发菌株与ALE4.0、ALE3.8菌株均只能在10-1稀释倍数下生长,但ALE4.0和ALE3.8菌株的菌落较出发菌株的菌落大;而ALE3.6菌株可以在10-1、10-2稀释倍数下生长,显示出ALE3.6菌株的突出低pH耐受性。由此可以看出,经过低pH适应性进化,ALE4.0和ALE3.8菌株的低pH耐受能力有一定提升,而ALE3.6菌株的低pH耐受能力得到显著增强。
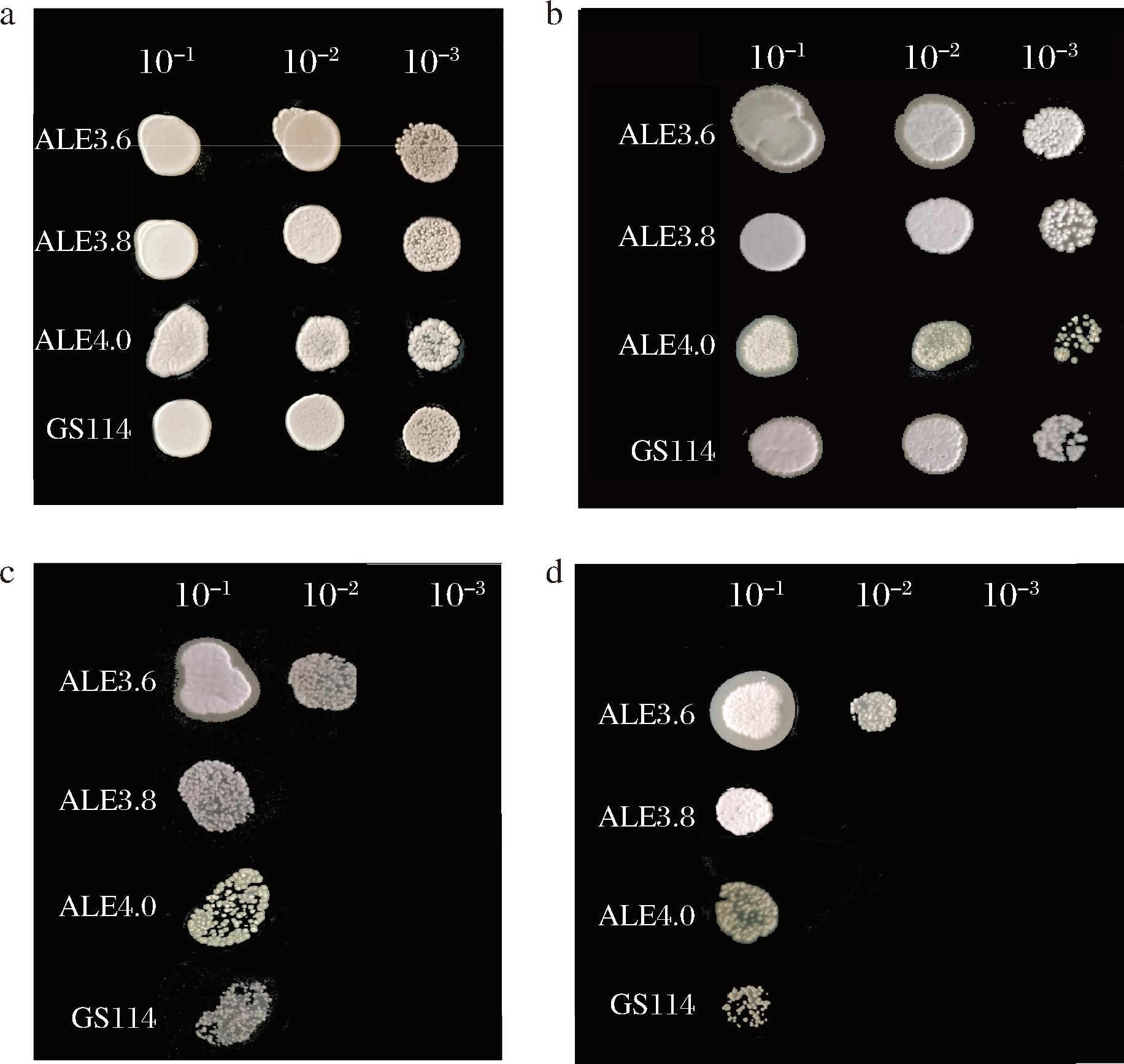
a-pH 6.0;b-pH 4.0;c-pH 3.8;d-pH 3.6
图3 出发菌株与适应性进化菌株不同pH固体平板生长情况
Fig.3 Growth performance of solid plates with different pH of starting strains and adaptive evolutionary strains
为了评价适应性进化菌株的ε-PL合成能力,4个菌株的摇瓶发酵结果如图4所示。ALE3.6 菌株的ε-PL产量最高为(2.17±0.12) g/L,相较于出发菌株(1.84±0.11) g/L,ε-PL产量提升了17.9%。ALE4.0和ALE3.8菌株的ε-PL产量分别为(1.89±0.04)、(1.92±0.04) g/L,与出发菌株无显著差异。在菌体量方面,ALE3.6的菌体干重最小,为(7.5±0.21) g/L,较出发菌株(9.0±0.42) g/L,菌体干重降低了16.7%;ALE4.0和ALE3.8菌体量分别为(8.74±0.02)、(9.45±0.07) g/L,与出发菌株(9.0±0.42) g/L无显著差异。单位菌体ε-PL合成能力方面,ALE3.6菌株的单位菌体合成能力为0.289 g/g,较出发菌株GS114(0.204 g/g)提高了41.7%。ALE4.0和ALE3.8菌株的单位菌体合成能力分别为0.216 g/g、0.203 g/g,与出发菌株无显著差异。综上,选择S.albulus ALE3.6作为后续研究对象。
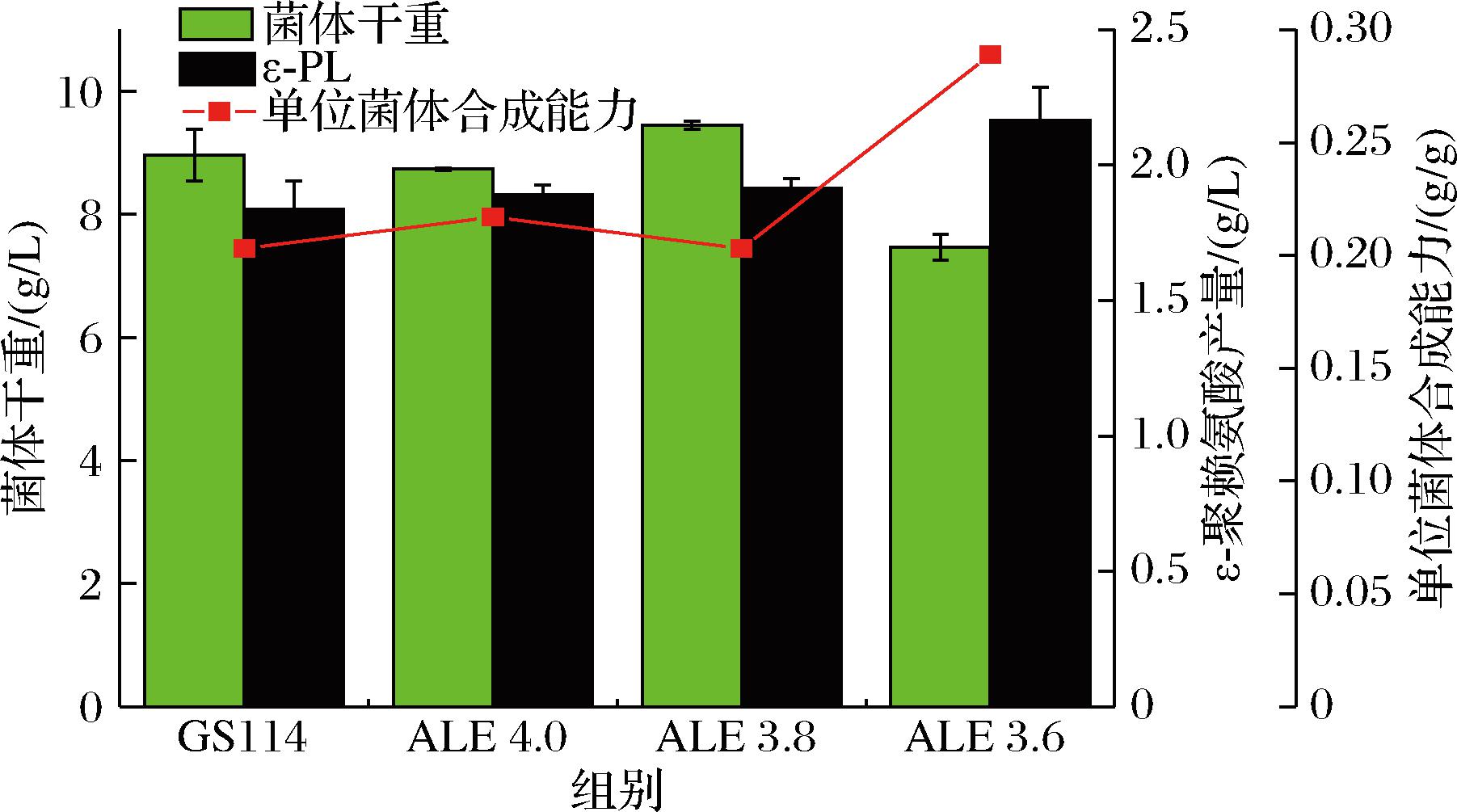
图4 出发菌株与适应性进化菌株的摇瓶发酵产ε-PL结果
Fig.4 Fermentation results of starting strains and adaptive evolutionary strains for ε-PL production
2.4 不同发酵pH值对S.albulus ALE3.6分批发酵生产ε-PL的影响
pH值是影响S.albulus合成ε-PL的最重要因素。因此,在5 L发酵罐水平考察了不同pH值对S.albulus ALE3.6分批发酵生产ε-PL的影响,结果如图5所示。在恒定pH 4.0条件下,ALE3.6菌株的ε-PL产量为4.63 g/L、菌体干重为16.8 g/L,较出发菌株(ε-PL产量4.08 g/L、菌体干重19.5 g/L),分别提升了13.5%和降低了13.8%;在恒定pH 3.8条件下,ALE3.6菌株的ε-PL产量为6.14 g/L、菌体干重为11.8 g/L,较出发菌株(ε-PL产量5.64 g/L、菌体干重17.4 g/L),分别提升了8.9%和降低了32.2%;在恒定pH 3.6条件下,ALE3.6菌株ε-PL产量为7.2 g/L、菌体干重为14.7 g/L,较出发菌株(ε-PL产量7.8 g/L、菌体干重14.6 g/L)的产量降低了7.7%,而菌体干重并无差异。值得注意的是,在pH 4.0和pH 3.8条件下,ALE3.6菌株的显著特点是单位菌体合成能力得到显著提升,分别达到0.28、0.52 g/g,较出发菌株(0.21、0.32 g/g),分别提高了33.3%和62.5%;在恒定pH 3.6条件下,ALE3.6菌株的显著特点是产率实现了提升,达到0.12 g/(L·h),较出发菌株的0.11 g/(L·h)提高了10%。同时,在恒定pH 3.6条件下,ALE3.6的葡萄糖消耗速率为0.92 g/(L·h),出发菌株的葡萄糖消耗速率为0.76 g/(L·h),提高了21%。由此可见,适应性进化菌株S.albulus ALE3.6在不同pH条件下均较出发菌株表现出明显优势。如图5-d所示,就产物合成而言,pH越高ε-PL合成速率越高,ε-PL平均比合成速率在pH 4.0、3.8、3.6条件下分别为0.021、0.015、0.014 h-1。为了达到低菌体量高ε-PL产量的目的,选择pH 4.0作为S.albulus ALE3.6最优发酵pH值。
2.5 S.albulus ALE3.6补料-分批发酵生产ε-PL
补料-分批发酵是生产ε-PL的主要方式。为此,考察了适应性进化菌株S.albulus ALE3.6和出发菌株S.albulus GS114在恒定pH 4.0条件下的补料-分批发酵过程,结果如图6所示。
图6-a显示,出发菌株GS114在恒定pH 4.0条件下连续发酵192 h,菌体干重达到56.5 g/L、ε-PL产量为26.8 g/L;图6-b显示,适应性进化菌株S.albulus ALE3.6在相同的发酵工艺条件下,实现菌体干重为39.8 g/L、ε-PL产量达到43.7 g/L。与出发菌株相比,S.albulus ALE3.6的菌体干重降低了30%,但ε-PL产量提高了63%。另外,适应性进化菌株S.albulus ALE3.6的单位菌体合成能力为1.1 g/g,较出发菌株(单位菌体合成能力为0.47 g/g)提升了134%。进一步分析发酵过程参数发现,ALE3.6在发酵过程中保持菌体干重缓慢增加,并在114 h达到稳定,后续菌体干重基本不再增加;而出发菌株在72 h菌体干重达到稳定,在120~140 h菌体干重又发生了明显增长。菌体干重的增加会带来发酵过程氧气需求和碳源消耗的增加,这也是发酵过程中出发菌株GS114需要保持较高转速和葡萄糖转化率低的重要原因。对ε-PL变化的分析发现在72~120 h出发菌株GS114的ε-PL增长基本较为缓慢甚至停滞,在120~192 h开始大量合成,在整个发酵过程中,ε-PL平均比合成速率为0.004 h-1;适应性进化菌株S.albulus ALE3.6在整个发酵周期内基本保持相同的ε-PL增长速度,整个发酵过程ε-PL平均比合成速率为0.009 h-1,表明适应性进化菌株S.albulus ALE3.6主要通过中期ε-PL的大量积累来达到增产的目的。因此,在恒定pH 4.0补料-分批条件下,适应性进化菌株S.albulus ALE3.6菌株较出发菌株具有更高的ε-PL的合成能力和生产效率。
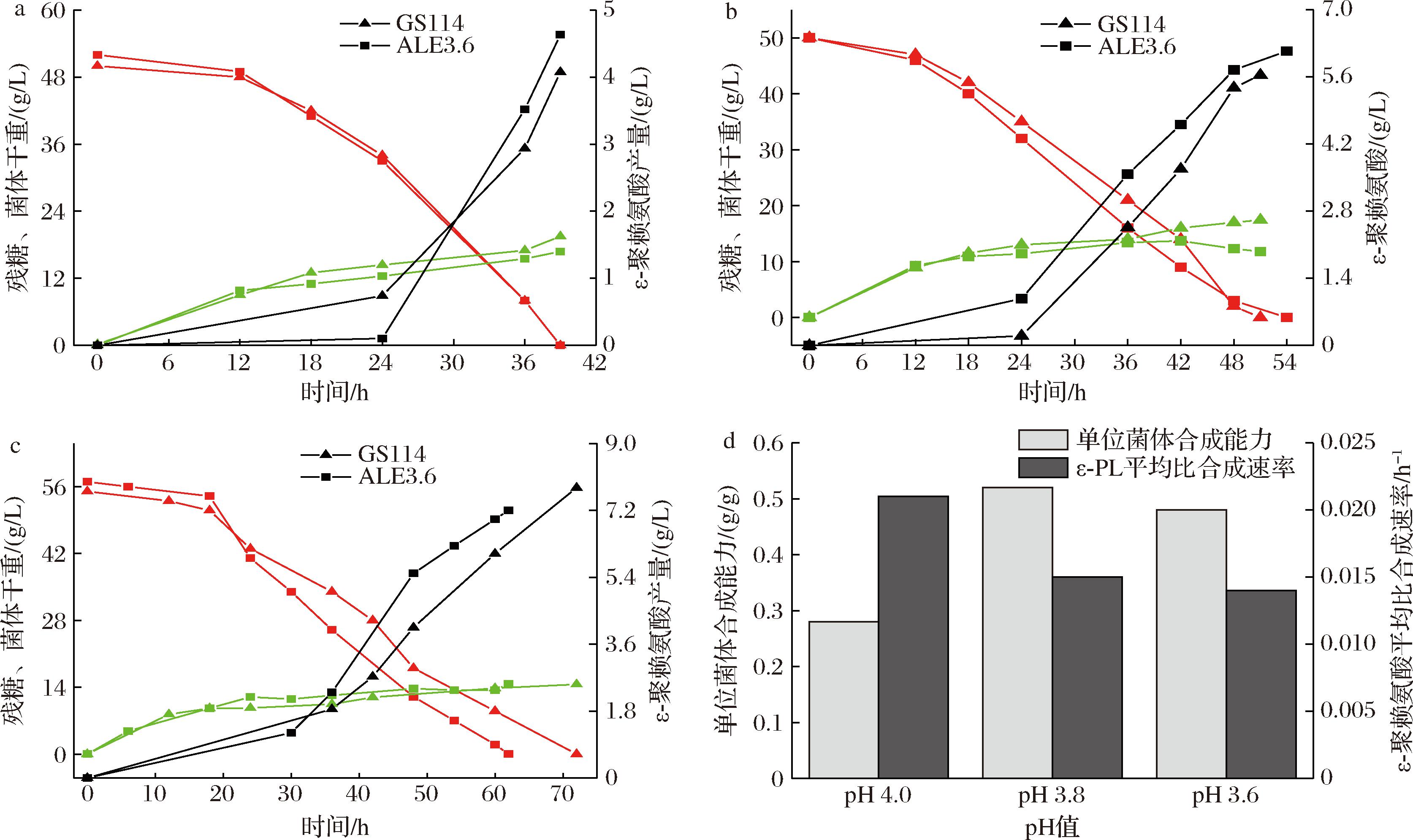
a-恒定pH 4.0分批发酵;b-恒定pH 3.8分批发酵;c-恒定pH 3.6分批发酵;d-ALE3.6菌株不同pH发酵比较
图5 不同发酵pH值对S.albulus ALE3.6分批发酵生产ε-PL的影响
Fig.5 Effect of pH on ε-PL production in batch fermentation by S.albulus ALE3.6
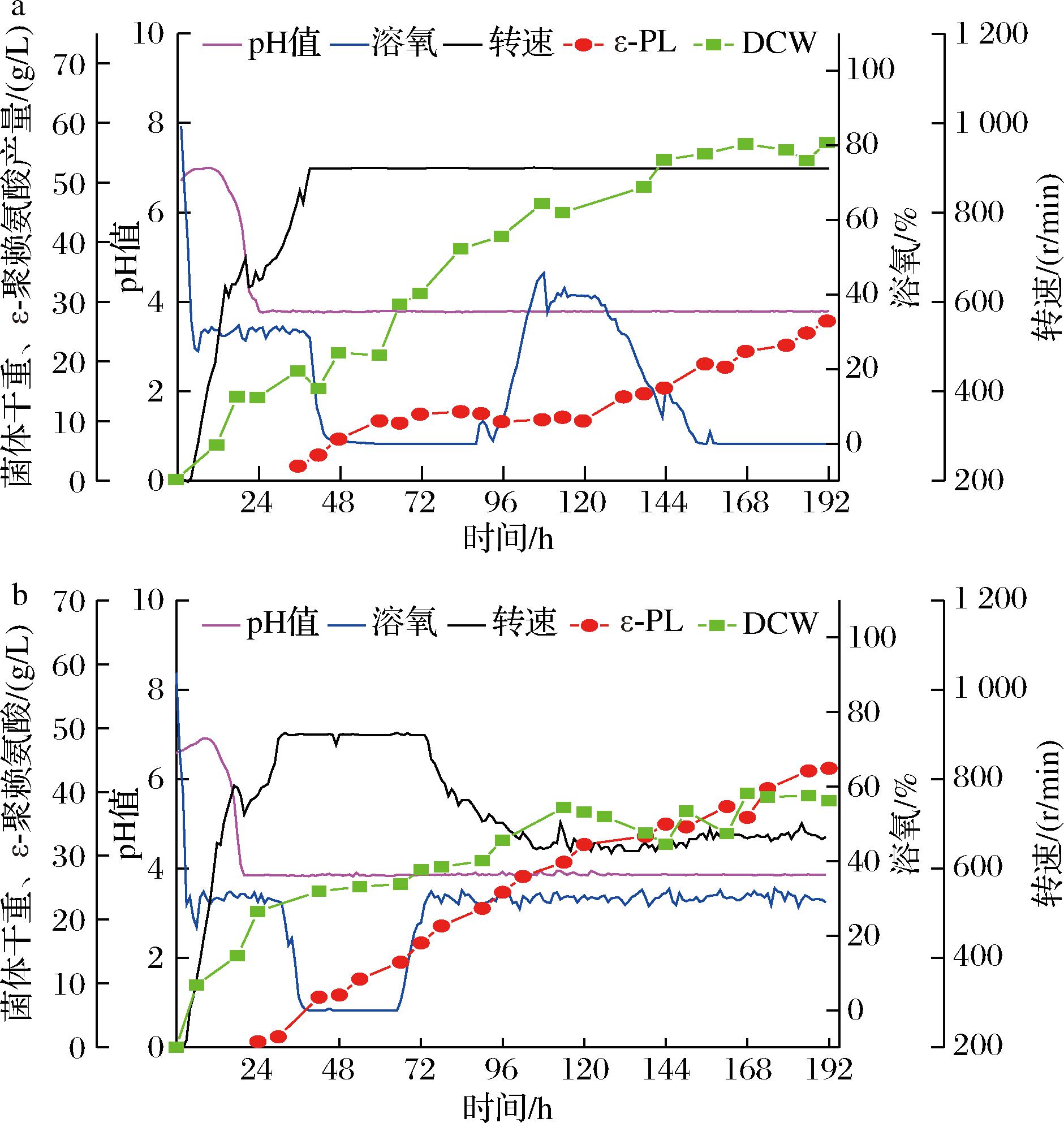
a-GS114恒定pH 4.0补料分批发酵; b-ALE3.6恒定pH 4.0补料分批发酵
图6 不同菌株恒定pH 4.0补料分批发酵生产ε-PL
Fig.6 Production of ε-PL in fed-batch fermentation using constant pH 4.0 strategy by S.albulus GS114 and S.albulus ALE3.6
3 结论
ε-PL作为一种天然食品防腐剂,以其安全性高、抗菌谱广、耐热性能好的的优势正逐渐在食品工业得以应用。然而,在ε-PL发酵生产过程中,S.albulus长时间遭受低pH胁迫,严重影响了其ε-PL生产效率,制约了ε-PL生产成本下降。本研究通过逐步降低驯化pH值的适应性进化策略,获得了一株低pH耐受能力增强的ε-PL生产菌株S.albulus ALE3.6,其最低耐受pH值为3.6,较出发菌株降低了0.4;同时,在摇瓶发酵条件下ε-PL产量达到(2.17±0.12)g/L,较出发菌株提高了17.9%。通过考察pH值对S.albulus ALE3.6合成ε-PL的影响,发现pH 4.0是S.albulus ALE3.6最优发酵pH值。采用恒定pH 4.0补料分批发酵方式,实现S.albulus ALE3.6发酵192 h的ε-PL产量达到43.7 g/L,较出发菌株提高了63%。本研究证实了适应性进化策略能够有效提升S.albulus低pH耐受能力,并且增强S.albulus低pH耐受能力能够提高其ε-PL合成能力。同时,适应性进化筛选到的低pH耐受型ε-PL生产菌株为S.albulus耐酸机制和增产机制的解析提供了优良研究对象。下一步将通过组学方法将改良的表型与潜在的基因型和基因表达水平联系起来,进而揭示S.albulus ALE3.6对酸胁迫反应的潜在驱动因素。
[1] SHIMA S, SAKAI H.Polylysine produced by Streptomyces[J].Agricultural and Biological Chemistry, 2014, 41(9):1807-1809.
[2] XU Z X, XU Z, FENG X H, et al.Recent advances in the biotechnological production of microbial poly(ɛ-L-lysine) and understanding of its biosynthetic mechanism[J].Applied Microbiology and Biotechnology, 2016, 100(15):6619-6630.
[3] HIRAKI J, ICHIKAWA T, NINOMIYA S I, et al.Use of ADME studies to confirm the safety of ε-polylysine as a preservative in food[J].Regulatory Toxicology and Pharmacology, 2003, 37(2):328-340.
[4] YOSHIDA T, NAGASAWA T.ε-Poly-L-lysine:Microbial production, biodegradation and application potential[J].Applied Microbiology and Biotechnology, 2003, 62(1):21-26.
[5] YAMANAKA K, KITO N, IMOKAWA Y, et al.Mechanism of ɛ-poly-L-lysine production and accumulation revealed by identification and analysis of an ɛ-poly-L-lysine-degrading enzyme[J].Applied and Environmental Microbiology, 2010, 76(17):5669-5675.
[6] MITSUAKI K, RIKA T, TOYOKAZU Y, et al.Purification and characterization of an ɛ-poly-L-lysine-degrading enzyme from an ɛ-poly-L-lysine-producing strain of Streptomyces albulus[J].Archives of Microbiology, 2002, 178(5):325-330.
[7] KAHAR P, IWATA T, HIRAKI J, et al.Enhancement of ε-polylysine production by Streptomyces albulus strain 410 using pH control[J].Journal of Bioscience and Bioengineering, 2001, 91(2):190-194.
[8] CHEN X S, LI S, LIAO L, et al.Production of ε-poly-L-lysine using a novel two-stage pH control strategy by Streptomyces sp.M-Z18 from glycerol[J].Bioprocess and Biosystems Engineering, 2011, 34:561-567.
[9] REN X D, CHEN X S, ZENG X, et al.Acidic pH shock induced overproduction of ε-poly-L-lysine in fed-batch fermentation by Streptomyces sp.M-Z18 from agro-industrial by-products[J].Bioprocess and Biosystems Engineering, 2015, 38:1113-1125.
[10] 邓玥, 柳天一, 陈旭升.动态pH值调控策略提高ε-聚赖氨酸发酵产量及其原因解析[J].食品与发酵工业, 2021, 47(23):24-29.
DENG Y, LIU T Y, CHEN X S.Improvement of ε-poly-L-lysine production based on dynamic pH regulation and its mechanism analysis[J].Food and Fermentation Industries, 2021, 47(23):24-29.
[11] 王开方, 潘龙, 刁文娇, 等.pH值和比生长速率协同调控Streptomyces albulus合成ε-聚赖氨酸[J].食品与发酵工业, 2019, 45(23):8-14.
WANG K F,PAN L,DIAO W J, et al.Effects of pH and specific growth rates on ε-poly-L-lysine biosynthesis in Streptomyces albulus[J].Food and Fermentation Industries, 2019, 45(23):8-14.
[12] 吴梦萍. Streptomyces albulus WG-608高产ε-聚赖氨酸机制解析及其发酵工艺的优化[D].无锡:江南大学, 2022.
WU M P.High-yield ε-poly-L-lysine mechanism analysis of Streptomyces albulus WG-608 and its fermentation process optimization[D].Wuxi:Jiangnan University, 2022.
[13] COTTER P D, HILL C.Surviving the acid test:Responses of gram-positive bacteria to low pH[J].Microbiology and Molecular Biology Reviews:MMBR, 2003, 67(3):429-453.
[14] SANDBERG T E, SALAZAR M J, WENG L L, et al.The emergence of adaptive laboratory evolution as an efficient tool for biological discovery and industrial biotechnology[J].Metabolic Engineering, 2019, 56:1-16.
[15] NARAYANAN V, S NCHEZ I NOGUÉ V, NIEL E W J, et al.Adaptation to low pH and lignocellulosic inhibitors resulting in ethanolic fermentation and growth of Saccharomyces cerevisiae[J].AMB Express, 2016, 6(1):1-13.
NCHEZ I NOGUÉ V, NIEL E W J, et al.Adaptation to low pH and lignocellulosic inhibitors resulting in ethanolic fermentation and growth of Saccharomyces cerevisiae[J].AMB Express, 2016, 6(1):1-13.
[16] SHUI Z X, QIN H, WU B, et al.Adaptive laboratory evolution of ethanologenic Zymomonas mobilis strain tolerant to furfural and acetic acid inhibitors[J].Applied Microbiology and Biotechnology, 2015, 99(13):5739-5748.
[17] 任喜东, 于超, 王晨莹, 等.适应性进化提高淀粉酶产色链霉菌T17自发酸胁迫抗性的生理机制[J].食品科学, 2020, 41(12):106-112.
REN X D, YU C, WANG C Y, et al.Physiological mechanism by which adaptive evolution improves the resistance of Streptomyces diastatochromogenes T17 to spontaneous acid stress[J].Food Science, 2020, 41(12):106-112.
[18] 谢志鹏, 徐志南, 郑建明, 等.靛酚蓝反应测定发酵液中的氨态氮[J].浙江大学学报(工学版), 2005, 39(3):437-439;444.
XIE Z P, XU Z N, ZHENG J M, et al.Determination of ammonium nitrogen in fermentationbroth through indophenol blue reaction[J].Journal of Zhejiang University (Engineering Science), 2005, 39(3):437-439;444.
[19] ITZHAKI R F.Colorimetric method for estimating polylysine and polyarginine[J].Analytical Biochemistry, 1972, 50(2):569-574.
[20] 汪泽, 王开方, 胡扬帆, 等.过表达pls基因结合前体流加提高小白链霉菌ε-聚赖氨酸产量[J].食品与发酵工业, 2020, 46(14):1-6.
WANG Z, WANG K F, HU Y F, et al.Enhanced ε-poly-L-lysine production through overexpression of pls gene combined with precursor feeding in Streptomyces albulus[J].Food and Fermentation Industries, 2020, 46(14):1-6.