西藏凹乳芹(Vicatia thibetica de Boiss),为伞形科凹乳芹属植物凹乳芹的根,在我国主要分布于西藏、四川、云南等地区[1],其在西藏、云南地区常被作为滋补菜肴食用,也是藏药基础五大根药的重要组成[2]。据记载,西藏凹乳芹具有祛风除湿、散寒止痛的作用[3]。目前西藏凹乳芹中分离出多种生物活性成分,包括多糖、黄酮、香豆素、酚酸等[4]。目前对西藏凹乳芹的研究主要集中在药理方面,对其化学成分和结构特征的报道较少。
多糖是一种天然的大分子碳水化合物,广泛存在于动物、植物和细菌中[5]。多糖已被证明具有抗病毒、抗癌、抗氧化、降血糖、抗炎、免疫和调节肠道微生物活性的作用,由于其生物降解性、无毒性质、生物相容性和低加工成本等特点,被应用于许多领域[6]。西藏凹乳芹多糖(Vicatia thibetica de Boiss polysaccharide,VTP)是西藏凹乳芹的主要成分之一,因其具有抗疲劳[7]、抗氧化应激[8]、免疫调节[9]等作用成为研究热点。多糖的提取是其开发或应用的最关键步骤,然而关于VTP提取和纯化的进一步研究尚未见报道。
西藏凹乳芹资源丰富,是食品和医药行业应用的重要原料,目前主要被用于藏区人民食用和藏药原料成分,且大部分只流通于西藏、云南等地区,还未覆盖全国,对其的开发还处于基础阶段,未来具有广阔的市场前景。因此本研究以拉萨市西藏凹乳芹为原料,通过对VTP的提取、分离纯化、结构表征和体外抗氧化活性进行研究,旨在为充分利用西藏凹乳芹打下基础,为VTP的进一步开发和应用提供理论依据。
1 材料与方法
1.1 材料与试剂
实验材料:西藏凹乳芹,购于西藏昌都市蓝宝石药材有限公司拉萨分公司,经西藏藏医药大学南木加老师鉴定为西藏凹乳芹的根。
实验试剂:木瓜蛋白酶、纤维素酶、苯酚、硫酸、无水乙醇、NaCl、NaOH,国药集团化学有限公司;DEAE-cellulose 52、Sephadex G-100,北京索莱宝科技有限公司;系列葡聚糖标准品,美国聚合物标准品公司;单糖标准品,美国Sigma-Aldrich公司。
1.2 仪器与设备
R-1020旋转蒸发器,杭州庚雨仪器有限公司;MAX-190型酶标仪,美国分子仪器公司;ME204号立式大容量多管离心机、Trace 1300 ISQ气相色谱-质谱联用仪、DIONEX ICS-5000+SP-5型高压离子色谱系统,美国赛默飞世尔科技有限公司;Beta 1-8实验室型冻干机,北京博劢行仪器有限公司;Waters 1525EF 型高效液相色谱仪,美国沃特世公司;NEXUS型傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FT-IR)仪,美国尼高力仪器公司。
1.3 实验方法
1.3.1 西藏凹乳芹粗多糖(VTP-0)提取工艺优化
1.3.1.1 单因素优化
西藏凹乳芹经50 ℃干燥后粉碎,过60目筛,备用。之后分别考察料液比(1∶10、1∶20、1∶30、1∶40、1∶50, g∶mL)、复合酶(纤维素酶和木瓜蛋白酶,4∶6,质量比)添加量(0%、1%、2%、3%、4%,质量分数)、超声温度(35、45、55、65、75 ℃)、超声时间(35、45、55、65、75 min)、超声功率(250、300、350、400、450 W)对VTP-0得率的影响。在每个实验中,在一定条件下,使用超声辅助酶法提取5 g西藏凹乳芹粉,超声结束后,95 ℃下水浴灭酶10 min,冷却,4 500 r/min 离心15 min,得到VTP-0提取液,采用苯酚-硫酸法[10]测定VTP-0含量。
1.3.1.2 正交试验优化VTP-0提取工艺
在单因素试验基础上,从5个单因素中选出4个比较重要的因素和因素的3个水平,以VTP-0得率为指标,采用L9(34)正交试验设计,见表1,确定料液比(A)、超声温度(B)、超声时间(C)、和超声功率(D)的最佳组合,从而对VTP-0的提取条件进行优化。
表1 VTP-0提取的正交试验因素水平
Table 1 Factors and levels of orthogonal experiment for VTP-0

试验水平因素A料液比(g∶mL)B超声温度/℃C超声时间/minD超声功率/W11∶20554525021∶30655530031∶407565350
1.3.2 VTP-0的分离纯化
取上述VTP-0提取液上清液中加入无水乙醇至终体积分数为80%,4 ℃放置24 h后,4 500 r/min离心15 min,收集沉淀,冷冻干燥即得VTP-0。
取100 mg VTP-0溶于10 mL超纯水,0.45 μm的水系滤膜过滤,用装好的离子交换柱进行梯度洗脱,洗脱液为0、0.1、0.3、0.5 mol/L的NaCl溶液,洗脱速率为1 mL/min,洗脱时间为10 min/管。采用苯酚-硫酸法[10]测定每管洗脱液的总糖含量,根据洗脱管数和OD值绘制洗脱曲线。收集不同组分浓缩、透析、冷冻干燥。根据筛选结果使用超纯水溶液进行SephadexG-100柱洗脱,流速为0.5 mL/min,收集单一组分,浓缩冷冻干燥得VTP-1。
1.3.3 VTP-1相对分子质量测定
参照DING等[11]的方法采用高效凝胶渗透色谱法测定。
1.3.4 VTP-1的单糖组成分析
参照GU等[12]的方法采用离子色谱法对VTP-1的单糖组成进行测定。
1.3.5 VTP-1紫外光谱和FT-IR分析
利用紫外分光光度计在200~400 nm扫描,扫描间距为1 nm,检测在260、280 nm处是否含有核酸和蛋白质。
参照HE等[13]的方法,称取VTP-1 5 mg置于FT-IR仪样平台上,固定样品后,用FT-IR仪在4 000~500 cm-1扫描。
1.3.6 VTP-1的三螺旋结构分析
参照XU等[14]的方法,将100 μL VTP-1样品(2 mg/mL)与100 μL刚果红溶液(80 μmol/L)与系列浓度梯度的NaOH溶液(0~0.5 mol/L)混合均匀,室温静置5 min,使用酶标仪在200~700 nm测定其最大吸收波长的变化。
1.3.7 VTP-1的体外抗氧化活性测定
1.3.7.1 清除DPPH自由基能力测定
参考XIE等[15]的方法,并加以改动,将2 mL VTP-1溶液(1~10 mg/mL)与2 mL DPPH溶液,剧烈振摇混匀,在室温下于黑暗处静置30 min,测定混合物于517 nm处的吸光值,以无水乙醇作为空白对照。DPPH自由基清除能力计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:A1,样品溶液的吸光度;A2,无水乙醇代替DPPH-无水乙醇溶液的吸光度;A0,去离子水代替样品溶液的吸光度。
1.3.7.2 ABTS阳离子自由基清除能力测定
参考ZHAO等[16]的方法,将14 mmol/L ABTS溶液与4.9 mmol/L K2S2O8溶液1∶1(体积比)混合,于室温下黑暗中放置16 h,用去离子水将混合液的734 nm处吸光度值调至0.700±0.020。取20 μL VTP-1溶液(1~10 mg/mL)和180 μL ABTS稀释液,剧烈振摇混匀,静置10 min后于734 nm处测定吸光值,以维生素C为阳性对照,去离子水为空白对照。ABTS阳离子自由基清除能力计算如公式(2)所示:
ABTS阳离子自由基清除率![]()
(2)
式中:A1,样品溶液的吸光度;A2,去离子水代替ABTS溶液的吸光度;A0,去离子水代替样品溶液的吸光度。
1.3.7.3 ·OH清除能力测定
参考CHEN等[17]的方法,在试管中依次加入VTP-1溶液(1~14 mg/mL)、9 mmol/L FeSO4溶液、9 mmol/L水杨酸乙醇溶液、9 mmol/L H2O2溶液各1 mL混匀。将混合溶液于 37 ℃下温育30 min,冷却至室温后测定510 nm处的吸光值,以维生素C为阳性对照,去离子水为空白对照,·OH清除能力计算如公式(3)所示:
·OH清除率![]()
(3)
式中:A1,样品溶液的吸光度值;A2,去离子水替代H2O2溶液的吸光度值;A0,去离子水替代样品的吸光度值。
1.4 数据分析
本研究各实验设置3组平行,使用 Origin 2018进行统计分析,所有数据均表示为平均值±标准差。多重比较之间的差异采用单因素方差分析和 Fisher’s LSD 检验进行分析,P<0.05被认为是显著的。
2 结果与分析
2.1 VTP-0提取工艺优化
2.1.1 VTP-0提取单因素优化结果
采用超声辅助酶解法提取VTP-0,在控制其他条件不变的条件下,分别对料液比、酶添加量、超声温度、超声时间、超声功率进行了单因素试验。结果表明(图1),VTP-0在料液比为1∶30,酶添加量2%,超声时间55 min,超声功率300 W,超声温度65 ℃条件下得率最高,为(40.33±0.40)%。

a-料液比;b-酶添加量;c-超声温度;d-超声时间;e-超声功率
图1 VTP-0提取单因素实验结果
Fig.1 Single factor experiment results of VTP-0 extraction
2.1.2 正交试验优化VTP-0的提取工艺
正交试验优化VTP-0的提取工艺如表2所示,提取工艺优化过程中,以L9(34)正交试验设计,并对结果进行直观分析。R值与该因素对提取率影响呈正相关。提取率受各因素的影响程度由大到小依次为:A>D>C>B。最佳工艺组合为A2B1C2D3,即料液比1∶30(g∶mL),提取温度55 ℃,提取时间55 min,超声功率350 W,在该提取条件下VTP-0得率为(41.37±1.40)%,相对标准偏差为3.38%,表明精密度良好。对正交试验结果进行方差分析,结果如表3所示,其中料液比对VTP-0得率的影响极显著,其余3个因素均对VTP-0得率影响不显著。
2.2 VTP-0分离纯化
经提取、醇沉、冷冻干燥后得到的VTP-0,提取得率为(28.51±0.94)%。VTP-0经DEAE-cellulose 52离子交换柱分离,分别在水洗脱和梯度盐洗脱部分得到4个峰,如图2所示,命名为VTP-1、VTP-2、VTP-3、VTP-4。各组分所得多糖比率分别为(79.80±1.68)%、(10.82±0.53)%、(5.85±0.66)%、(3.53±0.26)%。考虑到收集时间与脱盐成本,本实验选择VTP-1进行后续分离纯化。经SephadexG-100凝胶柱纯化后,得到单一对称的单峰组分,证明VTP-1为较均一多糖,收集组分液,透析、干燥,其含量为(86.91±1.83)%。
表2 正交试验结果及直观分析
Table 2 Orthogonal experiment results and range analysis of extraction of total flavonoids

试验编号因素A料液比(g∶mL)B超声温度/℃C超声时间/minD超声功率/W重复VTP-0得率/%1111132.5532.9231.0832.182122234.6633.9436.6035.073133334.7132.4332.7133.284212340.1442.3241.4441.305223138.5237.4439.9838.656231236.4636.6738.9037.347313237.1535.8037.2636.748321337.2034.9536.5236.229332135.2034.0434.7234.65K1100.533110.220105.750105.483K2117.290109.937111.020109.147K3107.613105.280108.667110.807k133.51136.74035.25035.161k239.09736.64637.00736.382k335.87135.09336.22236.936R5.5861.6471.7571.774主次因素A>D>C>B最优方案A2B1C2D3
表3 正交试验结果方差分析
Table 3 Variance analysis of orthogonal experiment results
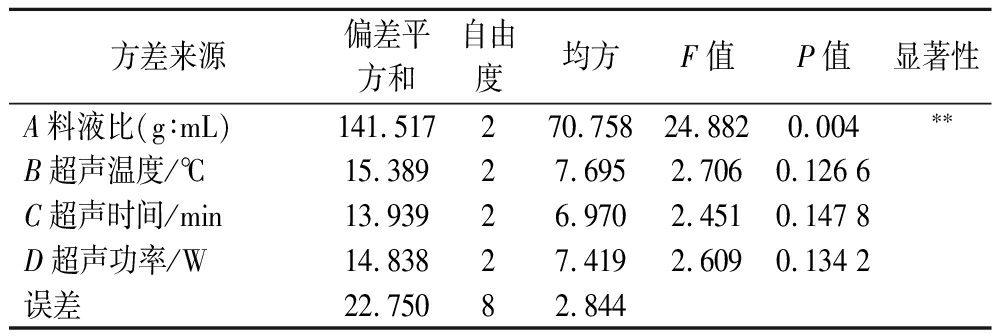
方差来源偏差平方和自由度均方F值P值显著性A料液比(g∶mL)141.517270.75824.8820.004∗∗B超声温度/℃15.38927.6952.7060.126 6C超声时间/min13.93926.9702.4510.147 8D超声功率/W14.83827.4192.6090.134 2误差22.75082.844
注:“**”表示对VTP-0含量的影响极其显著(P<0.01)。
2.3 VTP-1相对分子质量测定及单糖组成
重均分子质量(weight-average molecular weight,Mw)和数均分子质量(number-average molecular weight,Mn)是用于评价多糖理化性质的关键参数[18]。因此,使用高效凝胶渗透色谱测定VTP-1的分子质量,结果如表4所示。
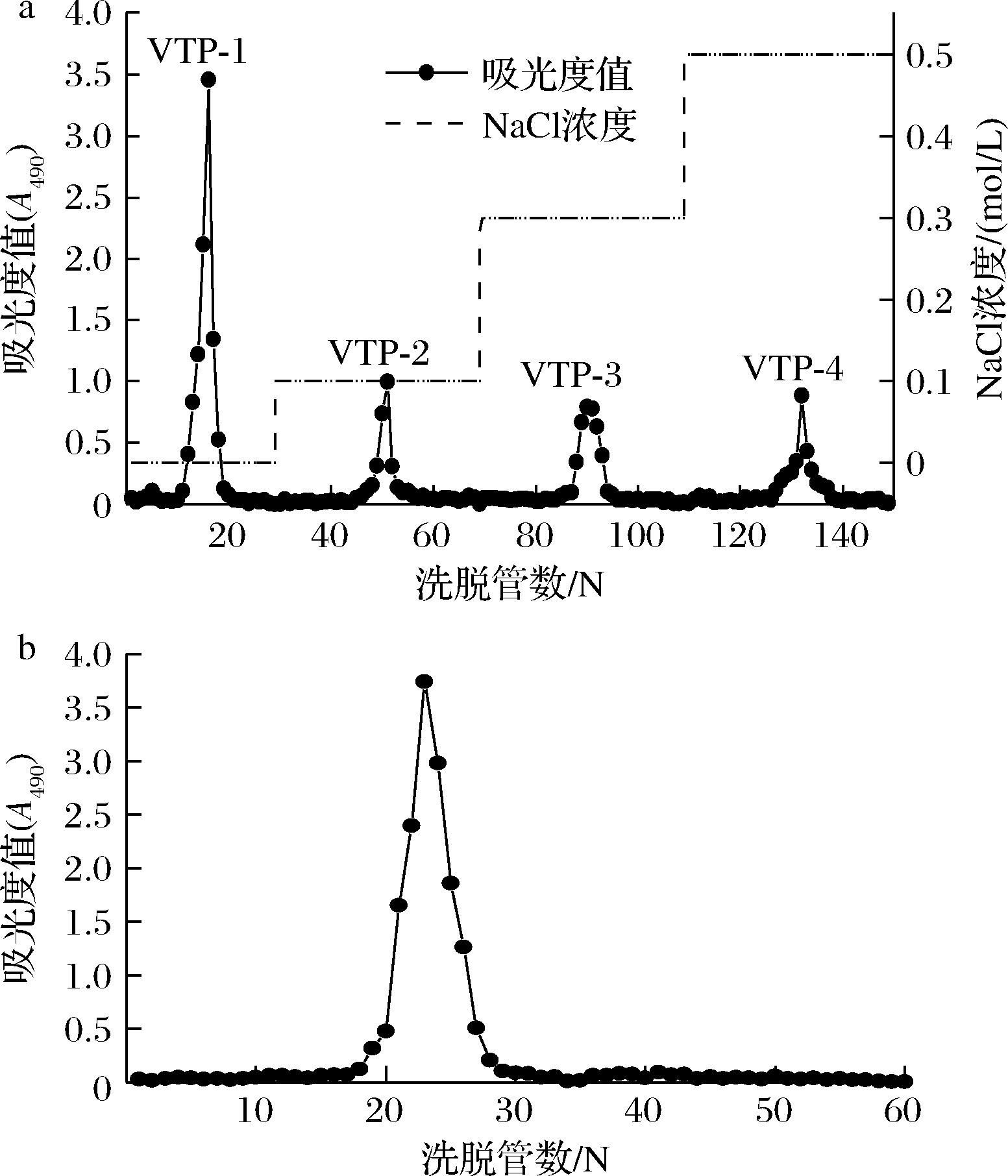
a-DEAE-52洗脱曲线;b-SephadexG-100洗脱曲线
图2 DEAE-52纤维素柱色谱法洗脱曲线和 SephadexG-100洗脱曲线
Fig.2 Elution curve of polysaccharides by DEAE-52 cellulose column chromatography elution curve and Sephadex G-100
VTP-1的Mw和Mn分别为96.81 kDa和56.28 kDa。多分散系数(Mw/Mn)为1.72,表明VTP-1是一种相对均质的多糖。
本研究采用高效液相色谱法分析VTP-1的单糖组成。如表4所示,VTP-1由阿拉伯糖、半乳糖、葡萄糖、木糖和甘露糖等组成,摩尔比为5.63∶2.79∶86.36∶3.02∶1.59。由于VTP-1未有报道,与西藏凹乳芹同属的伞形科当归的研究表明[19],当归多糖由葡萄糖、半乳糖、阿拉伯糖和木糖组成,摩尔比为8.4∶2.7∶1.8∶1.0,与本文分离纯化得到的单糖种类及占比类似,葡萄糖占比最高。
表4 VTP-1的分子质量及单糖组成
Table 4 Molecular weight and monosaccharide composition of VTP-1

指标VTP-1重均分子质量(Mw,kDa)96.81数均分子质量(Mn,kDa)56.28多分散系数(Mw/Mn)1.72单糖组成摩尔比阿拉伯糖5.63半乳糖2.79葡萄糖86.36木糖3.02甘露糖1.59
2.4 紫外光谱和FT-IR分析
紫外可见光谱结果如图3-a所示,VTP-1在紫外扫描范围内均无吸收峰,表明VTP-1中不含有蛋白质和核酸。

a-紫外光谱;b-FT-IR
图3 VTP-1的紫外-可见光光谱和FT-IR分析
Fig.3 Ultraviolet and visible spectra and FT-IR of VTP-1
为了进一步分析VTP-1的结构,使用FT-IR进行分析,结果如图3-b所示,VTP-1在3 259 cm-1处具有宽广强烈的吸收峰,表明其分子间及分子内结构中有—OH的存在;在2 928 cm-1处的吸收峰是C—H的伸缩振动,表明VTP-1具有典型的多糖结构特征[20];在1 605 cm-1处出现了吸收峰,其可能是由于糖醛酸中的羧酸基团或蛋白质中的酰胺Ⅰ带上的C![]() O的非对称伸缩振动引起的[16];在1 540 cm-1附近未出现明显的吸收峰,表明VTP-1不含N—H基团,这与紫外光谱分析的蛋白含量结果一致[20]。1 407 cm-1处的吸收峰是糖链上的C
O的非对称伸缩振动引起的[16];在1 540 cm-1附近未出现明显的吸收峰,表明VTP-1不含N—H基团,这与紫外光谱分析的蛋白含量结果一致[20]。1 407 cm-1处的吸收峰是糖链上的C![]() C伸缩振动引起的。在1 232 cm-1处的吸收峰是C—H伸缩振动引起的;在1 033 cm-1处的吸收峰为吡喃环中C—O和C—O—C的伸缩振动引起的[21];在920 cm-1的弱吸收峰为β-吡喃葡萄糖苷的拉伸振动引起的,在845 cm-1处为α型糖苷键的特征吸收峰[22]。这些结果表明,VTP-1同时包含α性糖苷键和β型糖苷键。
C伸缩振动引起的。在1 232 cm-1处的吸收峰是C—H伸缩振动引起的;在1 033 cm-1处的吸收峰为吡喃环中C—O和C—O—C的伸缩振动引起的[21];在920 cm-1的弱吸收峰为β-吡喃葡萄糖苷的拉伸振动引起的,在845 cm-1处为α型糖苷键的特征吸收峰[22]。这些结果表明,VTP-1同时包含α性糖苷键和β型糖苷键。
2.5 VTP-1三维螺旋结构分析
具有三螺旋结构的多糖与刚果红溶液结合时,会导致多糖与刚果红复合物的最大吸收波长发生红移[23]。因此,采用刚果红测定法测定VTP-1的三螺旋结构。如图4所示,VTP-1的最大吸收波长随NaOH浓度的增加而减小,表明VTP-1不具备三螺旋结构。
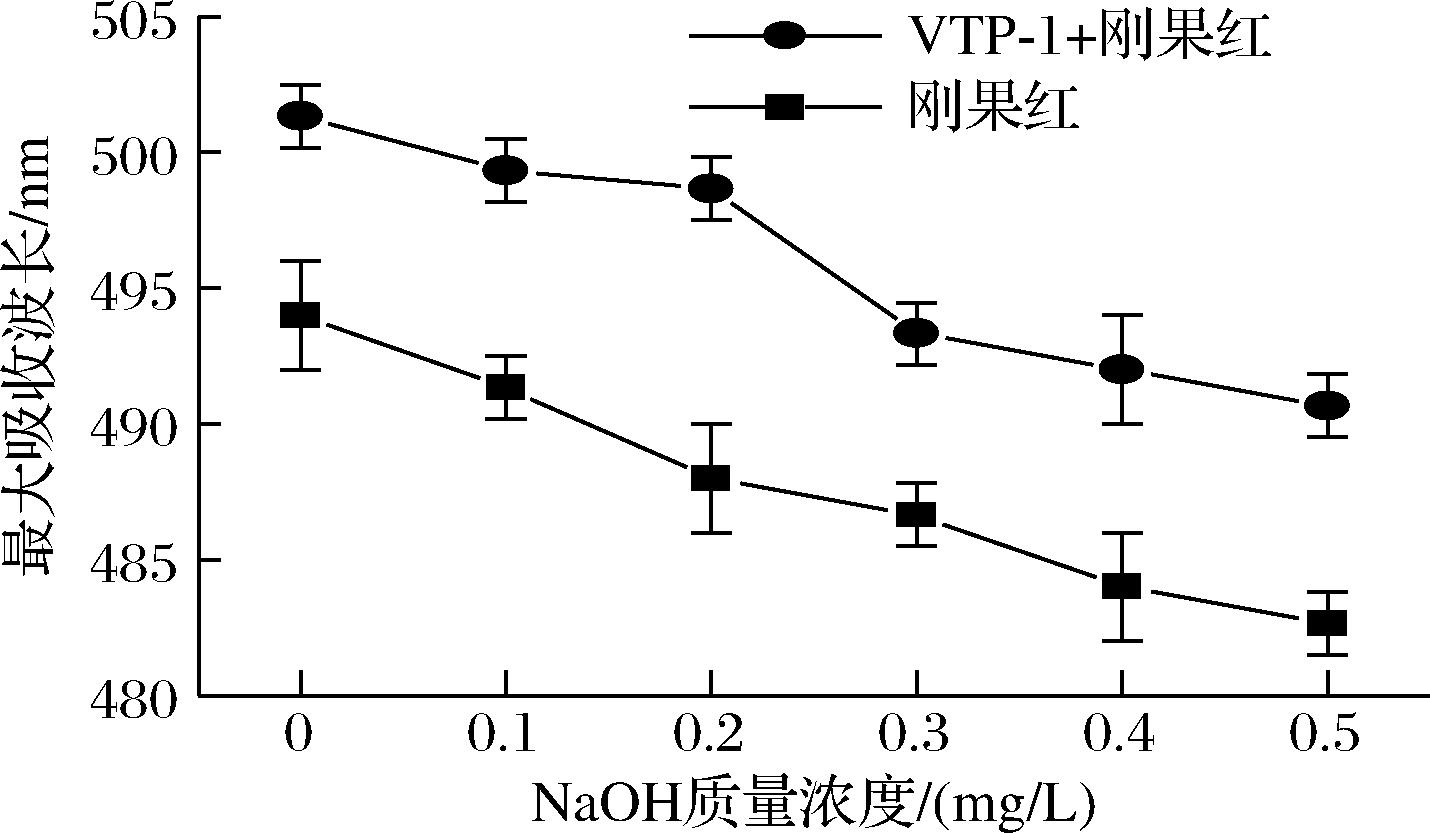
图4 VTP-1刚果红实验结果
Fig.4 Results of Congo red with VTP-1
2.6 VTP-1的体外抗氧化活性
如图5所示,VTP-1的抗氧化能力对DPPH自由基、ABTS阳离子自由基、·OH的清除能力呈剂量依赖性,但仍不及阳性对照(维生素C)的抗氧化能力。在10 mg/mL时,VTP-1对DPPH自由基、ABTS阳离子自由基清除率分别可达到(92.45±0.62)%、(84.87±0.59)%;在14 mg/mL时,VTP-1对·OH清除率达到(93.82±2.34)%。VTP-1对DPPH自由基、ABTS阳离子自由基、·OH清除率的IC50值分别为1.808、1.845、4.634 mg/mL。综上所述,VTP-1的抗氧化活性按DPPH自由基>ABTS阳离子自由基>·OH的顺序排列。
研究表明,多糖的抗氧化活性与其结构特性(分子质量、单糖组成、糖苷键类型和链构象等)有很大关系[24]。VTP-1的抗氧化活性受多种因素影响,而非单一因素的影响。本文提取得到的VTP-1分子质量较高(Mw=96.81 kDa),表现出了较强的抗氧化性。研究表明,低分子质量的灰喇叭菌酸性多糖具有较低的抗氧化性[25],而分子质量较高的罗汉果多糖不具有更强的抗氧化性[26]。因此,基于上述研究之间发现的不一致,表明多糖分子质量不是影响其抗氧化活性的主要因素。单糖中的鼠李糖、阿拉伯糖、木糖、甘露糖、葡萄糖、半乳糖等的存在可能与抗氧化活性有关[27-28]。因此,VTP-1其单糖组成种类丰富可能是决定其有良好抗氧化性的原因。此外,多糖中的α-和β-型糖苷键也会影响多糖的抗氧化活性[29-30]。VTP-1同时含有α-和β-型糖苷键,这可能也是其抗氧化性良好的原因。总之,由于多糖的抗氧化机制复杂,因此多糖的抗氧化能力与结构特征之间的特异性相关性有待进一步研究。

a-DPPH自由基清除率;b-ABTS阳离子自由基清除率;c-·OH清除率
图5 VTP-1的体外抗氧化活性
Fig.5 Antioxidant activities of VTP-1 in vitro
3 结论
采用超声辅助酶法提取得到VTP-0,最佳提取工艺为料液比1∶30(g∶mL),提取温度55 ℃,提取时间55 min,超声功率 350 W,VTP-0得率为(41.37±1.40)%。后续经DEAE-cellulose 52和Sephadex G-100柱分离纯化得到VTP-1。 结果表明,VTP-1的分子质量为96.81 kDa。VTP-1是由阿拉伯糖、半乳糖、葡萄糖、木糖和甘露糖组成,摩尔比为5.63∶2.79∶86.36∶3.02∶1.59;VTP-1为单一多糖,不含核酸和蛋白质。VTP-1具有多糖的特征吸收基团,同时含有α-和β-型糖苷键,且无三螺旋结构。VTP-1对DPPH自由基、ABTS阳离子自由基、·OH清除率的IC50值分别为1.808、1.845、4.634 mg/mL,具有良好的体外抗氧化活性,证明了VTP的潜在药用价值。本文对VTP的组分进行了初步研究,为进一步探讨VTP抗氧化活性与结构的关系提供了一定的数据支持,但后续还需进一步探究VTP-1的结构与体内功能活性的关系。
[1] 欧珠, 白玛玉珍, 杨斌, 等.基于UPLC-Q-TOF-MS技术分析西藏凹乳芹的化学成分及定量分析研究[J].中国食物与营养, 2023, 29(9):22-26.
OU Z, BAIMAYUZHEN, YANG B, et al.Analysis of chemical constituents and quantitative analysis of Vicatia thibeticu by UPLC-Q-TOF-MS[J].Food and Nutrition in China, 2023, 29(9):22-26.
[2] 才让南加, 多杰仁青, 文成当智, 等.西藏凹乳芹在藏医药中的应用[J].中华中医药杂志, 2021, 36(1):535-537.
CAIRANG N J,DUOJIE R Q,WENCHENG D Z, et al.Application of Tibetan celery in Tibetan medicine[J].China Journal of Traditional Chinese Medicine and Pharmacy, 2021, 36(1):535-537.
[3] 张梦如, 赵健黎, 孙芳云.西藏凹乳芹化学成分及药理作用研究进展[J].中国药理学与毒理学杂志, 2021, 35(10):804.
ZHANG M R, ZHAO J L, SUN F Y.Research progress on chemical constituents and pharmacological effects of Tibetan Cremastra crassipes[J].Chinese Journal of Pharmacology and Toxicology, 2021, 35(10):804.
[4] 李阳, 余晓晖, 郭玫, 等.超声辅助提取西藏凹乳芹总黄酮工艺的优化[J].中成药, 2022, 44(2):362-366.
LI Y, YU X H, GUO M, et al.Optimization of ultrasound-assisted extraction process for total flavonoids from Vicatia thibetica[J].Chinese Traditional Patent Medicine, 2022, 44(2):362-366.
[5] 梁天, 李静, 王奕斐, 等.莲不同部位多糖提取纯化、结构特征与生物活性研究进展[J].食品科学, 2023, 44 (11):317-328.
LIANG T, LI J, WANG Y F, et al.Extraction and purification, structural feature and biological activity of polysaccharides in different parts of lotus (Nelumbo nucifera Gaertn.):A review[J].Food Science, 2023, 44 (11):317-328.
[6] YU S S, MA R J, DONG X D, et al.A novel polysaccharide from Boletus edulis:Extraction, purification, characterization and immunologic activity[J].Industrial Crops and Products, 2022, 186:115206.
[7] 段金成, 罗顺迪, 曹祖高, 等.西归粗多糖对游泳力竭小鼠的抗运动性疲劳作用[J].中成药, 2018, 40(3):681-684.
DUAN J C, LUO S D, CAO Z G, et al.Anti-exercise fatigue effect of crude polysaccharide from Xigui on mice exhausted by swimming[J].Chinese Traditional Patent Medicine, 2018, 40(3):681-684.
[8] 何舒婷, 张雨源, 黄会, 等.西归粗多糖对缺氧小鼠抗氧化应激作用的研究[J].大理大学学报, 2022, 7(2):10-15.
HE S T, ZHANG Y Y, HUANG H, et al.Study on anti-oxidative stress effect of Xigui crude polysaccharide for hypoxic mice[J].Journal of Dali University, 2022, 7(2):10-15.
[9] 刘兴琴, 丁济超, 李继兴, 等.西归粗多糖对运动疲劳小鼠的免疫调节作用[J].食品工业科技, 2021, 42(5):317-321;327.
LIU X Q, DING J C, LI J X, et al.Immunomodulation of polysaccharides from Xigui in exercise-induced fatigue mice[J].Science and Technology of Food Industry, 2021, 42(5):317-321;327.
[10] HADIDI M, AMOLI P I, JELYANI A Z, et al.Polysaccharides from pineapple core as a canning by-product:Extraction optimization, chemical structure, antioxidant and functional properties[J].International Journal of Biological Macromolecules, 2020, 163:2357-2364.
[11] DING H H, CUI S W, GOFF H D, et al.Soluble polysaccharides from flaxseed kernel as a new source of dietary fibres:Extraction and physicochemical characterization[J].Food Research International, 2014, 56:166-173.
[12] GU J Y, ZHANG H H, ZHANG J X, et al.Preparation, characterization and bioactivity of polysaccharide fractions from Sagittaria sagittifolia L[J].Carbohydrate Polymers, 2020, 229:115355.
[13] HE N W, ZHAI X C, ZHANG X B, et al.Extraction, purification and characterization of water-soluble polysaccharides from green walnut husk with anti-oxidant and anti-proliferative capacities[J].Process Biochemistry, 2020, 88:170-179.
[14] XU Z, WANG H D, WANG B L, et al.Characterization and antioxidant activities of polysaccharides from the leaves of Lilium lancifolium Thunb[J].International Journal of Biological Macromolecules, 2016, 92:148-155.
[15] XIE J H, SHEN M Y, XIE M Y, et al.Ultrasonic-assisted extraction, antimicrobial and antioxidant activities of Cyclocarya paliurus (Batal.) Iljinskaja polysaccharides[J].Carbohydrate Polymers, 2012, 89(1):177-184.
[16] ZHAO W J, ZHANG W Y, LIU L, et al.Fractionation, characterization and anti-fatigue activity of polysaccharides from Brassica rapa L.[J].Process Biochemistry, 2021, 106:163-175.
[17] CHEN F, HUANG G L.Extraction, derivatization and antioxidant activity of bitter gourd polysaccharide[J].International Journal of Biological Macromolecules, 2019, 141:14-20.
[18] LIU X Y, LIU D, CHEN Y H, et al.Physicochemical characterization of a polysaccharide from Agrocybe aegirita and its anti-ageing activity[J].Carbohydrate Polymers, 2020, 236:116056.
[19] 陈曦, 曹蔚, 孙阳, 等.当归多糖APS-bⅡ的结构特征及体外抗肿瘤作用[J].科学技术与工程, 2010, 10(8):1839-1843.
CHEN X, CAO W, SUN Y, et al.Physicochemical properties and anti-tumor activities in vitro of Angelica sinensis polysaccharide APS-bII[J].Science Technology and Engineering, 2010, 10(8):1839-1843.
[20] 羡荣华, 蒲铎文, 樊梓鸾, 等.老山芹多糖的分离纯化、结构表征及体外降糖活性研究[J].食品与发酵工业, 2023, 49(18):113-118; 124.
XIAN R H, PU D W, FAN Z L, et al.Isolation, purification, structure characterization, and hypoglycemic activity analysis of polysaccharides from Heraclenm dissectum[J].Food and Fermentation Industries, 2023, 49(18):113-118; 124.
[21] 冯欣静. 半干型绍兴黄酒缓解便秘的关键物质解析及机制研究[D].无锡:江南大学, 2022.
FENG X J.The analysis of the crucial components in semi-dry Shaoxing Huangjiu on the alleviation of constipation[D].Wuxi:Jiangnan University, 2022.
[22] GUO L N, KONG N, ZHANG X Y, et al.Multimode ultrasonic extraction of polysaccharides from maca (Lepidium meyenii):Optimization, purification, and in vitro immunoregulatory activity[J].Ultrasonics Sonochemistry, 2022, 88:106062.
[23] MUTAILIFU P, NUERXIATI R, LU C F, et al.Extraction, purification, and characterization of polysaccharides from Alhagi pseudoalhagi with antioxidant and hypoglycemic activities[J].Process Biochemistry, 2022, 121:339-348.
[24] CUI Y L, CHEN Y J, WANG S, et al.Purification, structural characterization and antioxidant activities of two neutral polysaccharides from persimmon peel[J].International Journal of Biological Macromolecules, 2023, 225:241-254.
[25] LIU Y T, DUAN X Y, ZHANG M Y, et al.Extraction, structure characterization, carboxymethylation and antioxidant activity of acidic polysaccharides from Craterellus cornucopioides[J].Industrial Crops and Products, 2021, 159:113079.
[26] ZHU Y M, PAN L C, ZHANG L J, et al.Chemical structure and antioxidant activity of a polysaccharide from Siraitia grosvenorii[J].International Journal of Biological Macromolecules, 2020, 165(Pt B):1900-1910.
[27] SHANG X L, LIU C Y, DONG H Y, et al.Extraction, purification, structural characterization, and antioxidant activity of polysaccharides from wheat bran[J].Journal of Molecular Structure, 2021, 1233:130096.
[28] WANG F F, YE S H, DING Y, et al.Research on structure and antioxidant activity of polysaccharides from Ginkgo biloba leaves[J].Journal of Molecular Structure, 2022, 1252:132185.
[29] CAI L L, ZOU S S, LIANG D P, et al.Structural characterization, antioxidant and hepatoprotective activities of polysaccharides from Sophorae tonkinensis Radix[J].Carbohydrate Polymers, 2018, 184:354-365.
[30] MATEOS-APARICIO I, MATEOS-PEINADO C, JIMÉNEZ-ESCRIG A, et al.Multifunctional antioxidant activity of polysaccharide fractions from the soybean byproduct okara[J].Carbohydrate Polymers, 2010, 82(2):245-250.