橄榄油是一种由成熟的油橄榄果实低温压榨得到的食用油[1],营养价值丰富[2],得到了越来越多人的青睐。由于制作工艺不同,橄榄油可分为许多种类,其中品质最高的是特级初榨橄榄油(extra virgin olive oil,EVOO)[3]。该类橄榄油国内产量较少,主要依赖进口,价格十分昂贵[4],因此对EVOO的掺假行为变得有利可图。常见的掺假方式是在EVOO中直接掺入价格较低且色清味浅的植物油[5]。大豆油在我国是一种很常见的植物油,价格便宜[6],颜色气味都不突出,是一种理想的掺假原料,且大豆油掺伪EVOO的消息也时常出现[7]。
橄榄油的掺假检测方法主要有3类,分别是物理检测法、化学检测法和生物检测法[8]。其中物理检测法具有方便、无损、高效等特点,应用较为广泛,常见物理检测方法包括1)红外光谱法:利用不同油脂接收红外光照射产生红外光谱的不同来进行掺假判定[9];2)电子鼻技术:应用气敏器件对不同成分气体响应各不相同的特性来鉴定掺假[10];3)同位素技术:通过检测不同油样的某种同位素差异来判定掺假[11];4)同步荧光法:同时扫描并发射两单色器波长得到荧光强度信号及发射波长,构成光谱图来分析是否掺假[12]。以上物理检测方法或多或少存在检测时间较长、成本较高、操作复杂等问题,不利于橄榄油掺假方法的进一步推广。
差示扫描量热法(differential scanning calorimetry, DSC)是一种重要的检测食用油掺假的物理方法[13]。它主要侧重于油脂物理特性[14]与氧化稳定性[15] 2个方面来对掺假油进行判定。物理特性主要是考虑不同油样加热熔融与冷却结晶过程中油样吸热量与放热量的差异,这种差异体现在DSC加热冷却曲线的不同[16]。赵瑾等[17]利用EVOO与葵花籽油在DSC加热冷却曲线上的差异,利用结晶峰起始温度和峰值温度与掺假比例建立了相关性良好的回归方程,从而实现精确快速鉴定掺假的EVOO。而氧化稳定性主要是考虑油样中不饱和脂肪酸与抗氧化物质种类与含量不同[18],通过DSC测量诱导氧化时间体现。邵薇等[19]利用伪劣大豆油与精炼大豆油氧化稳定性的差异,通过DSC测得不同油样的诱导氧化时间来快速判断出大豆油是否掺假。由于诱导氧化时间的测量所需温度低于EVOO或大豆油烟点[20-21],用于鉴别特级橄榄油中大豆油的掺假更为便捷。目前基于氧化稳定性的橄榄油DSC掺假研究较少,值得尝试研究。
本文采用DSC对市面上常见的EVOO掺假问题进行研究,选取的掺假油为大豆油。从物理特性与氧化稳定性两个方面采用DSC对EVOO、大豆油以及不同比例掺假质量比的混合油进行评测,得到DSC加热冷却曲线上相关热力参数与诱导氧化时间并建立对掺假质量分数的一元回归方程,建立以诱导氧化时间为指标的EVOO掺假鉴别模型,并与以往常用的基于DSC加热冷却曲线建立的橄榄油掺假鉴别模型做对比,分析基于不同特性所建立掺假模型的特点,为DSC鉴定EVOO掺假研究提供更多思路与数据支持。
1 材料与方法
1.1 材料
EVOO,西班牙原装进口,品渥食品有限公司。大豆油,益海嘉里食品有限公司。
1.2 仪器与设备
DSC 200 F3差示扫描量热仪,德国NETZSCH耐驰公司;恒平FA1604电子天平,上海舜宇恒平科学仪器有限公司。
1.3 油样制备
按大豆油/EVOO为5%、10%、20%、30%、40%的不同掺假质量分数混合,在振荡器上充分摇晃和混合后转移到储存容器中,密封并在常温下避光贮存以供实验。
1.4 实验方法
1.4.1 DSC加热冷却曲线
准确称取15~25 mg样品,放入氧化铝坩埚中。设定程序扫描温度范围为-80~30 ℃,升降温速率为10 ℃/min。检测过程采用N2保护,气体流速50 mL/min。每个样品重复测量3次。
1.4.2 DSC诱导氧化时间
准确称重(10±0.5) mg样品,并放在氧化铝坩埚中并开孔。设定不同氧化温度140、160、180 ℃保持恒定,选取合适的氧化温度进行实验。升温至氧化温度这一过程采用N2保护,达到氧化温度时先保持3 min再切换空气气氛保持一段时间。气体流量为50 mL/min,每个样品重复测量3次。
1.5 实验数据获取与处理
1.5.1 DSC加热冷却曲线
应用DSC热分析软件Proteus 5.0.x(NETZSCH Proteus thermal analysis)对DSC图像上的冷却结晶峰或加热熔融峰进行峰的综合分析并从中获得的焓值ΔH、峰值温度TP、起始温度TO和终止温度TE等热力参数。用Excel 2016拟合出各热力参数对掺假质量比的一元回归方程,并求得决定系数R2[22]。
1.5.2 DSC诱导氧化时间
诱导氧化时间为放热峰起始端引出的最大斜率切线与外推基线的交点时间[23],该值可在DSC加热氧化曲线图上直接取得。用Excel 2016拟合出诱导氧化时间对掺假质量比的一元回归方程,并求得R2。
2 结果与分析
2.1 DSC加热冷却曲线
2.1.1 EVOO与纯大豆油DSC加热冷却曲线对比
3组实验重复性较好,选取一组EVOO与纯大豆油的DSC加热冷却实验将数据导出并用Origin 2018整合,得到EVOO与纯大豆油DSC曲线对比图,如图1所示。
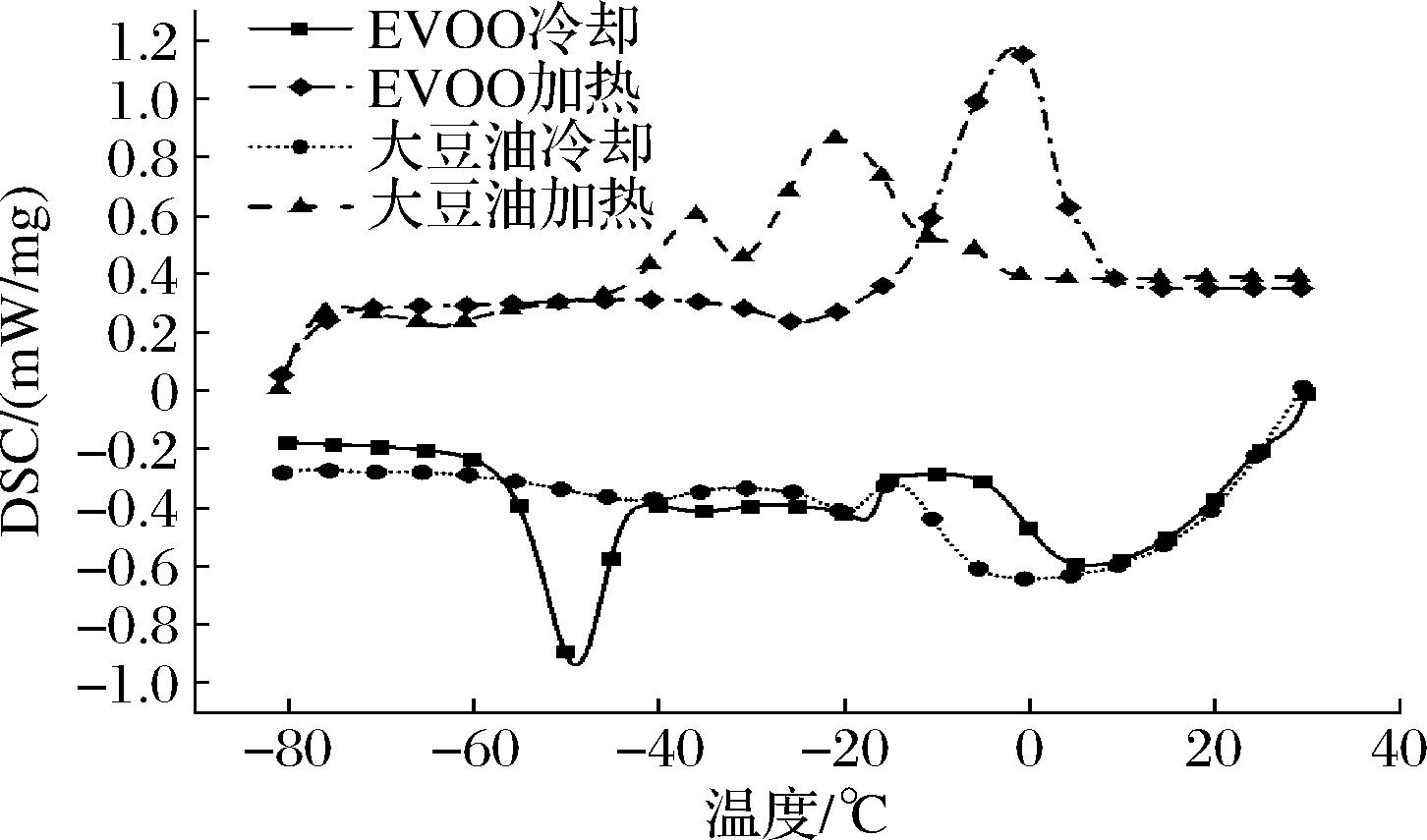
图1 大豆油与EVOO加热冷却DSC对比图
Fig.1 DSC contrast between soybean oil and EVOO heated and coo
由于DSC加热冷却实验是先在30 ℃条件下保持2 min再冷却,冷却开始时保护气体温度与坩埚内样品温度不一致,导致DSC值在实验初始阶段并不稳定。待传热逐渐稳定后,DSC值变得平坦。可以明显看出,EVOO在DSC值稳定一段时间后在-40~-60 ℃出现一个窄而尖的结晶峰,而纯大豆油并未呈现明显的结晶峰。虽然大豆油内同样含有许多脂肪酸,但种类、含量、形态都与EVOO存在差异,这导致在DSC冷却曲线中与EVOO呈现明显不同的结晶特性。因此该结晶峰是EVOO独有的特征,可以用结晶峰的起始温度TP、峰值温度TO、终止温度TE、焓值ΔH这些热力参数来表征该结晶峰形态,作为鉴定掺假的依据。而DSC加热曲线上EVOO与纯大豆油都有明显熔融峰的存在,位置存在交叉且差异不如DSC冷却曲线明显。因此后续实验以冷却结晶曲线分析EVOO掺假。
2.1.2 DSC冷却曲线结果与分析
在3组实验重复性较好的情况下,将各掺假比例混合油DSC冷却数据导出并用Origin 2018整合,如图2所示。随着大豆油掺假比例的升高,冷却结晶峰整体左移,峰型逐渐变得平坦。结晶起始温度、峰值温度、终止温度整体变低,结晶峰面积变小,整体与掺假比例线性相关。使用DSC专用分析软件对各掺假比例混合油的结晶峰进行分析,得到相关热力参数如表1所示。随着大豆油掺假比例升高,各热力参数均减小。与EVOO相比,40%掺假油焓值ΔH从29.78 J/g下降至6.133 J/g,峰值温度TP从-49.2 ℃下降至-62.7 ℃,起始温度TO从-43.8 ℃下降至-53.7 ℃,终止温度TE从-55.7 ℃下降至-71.3 ℃。
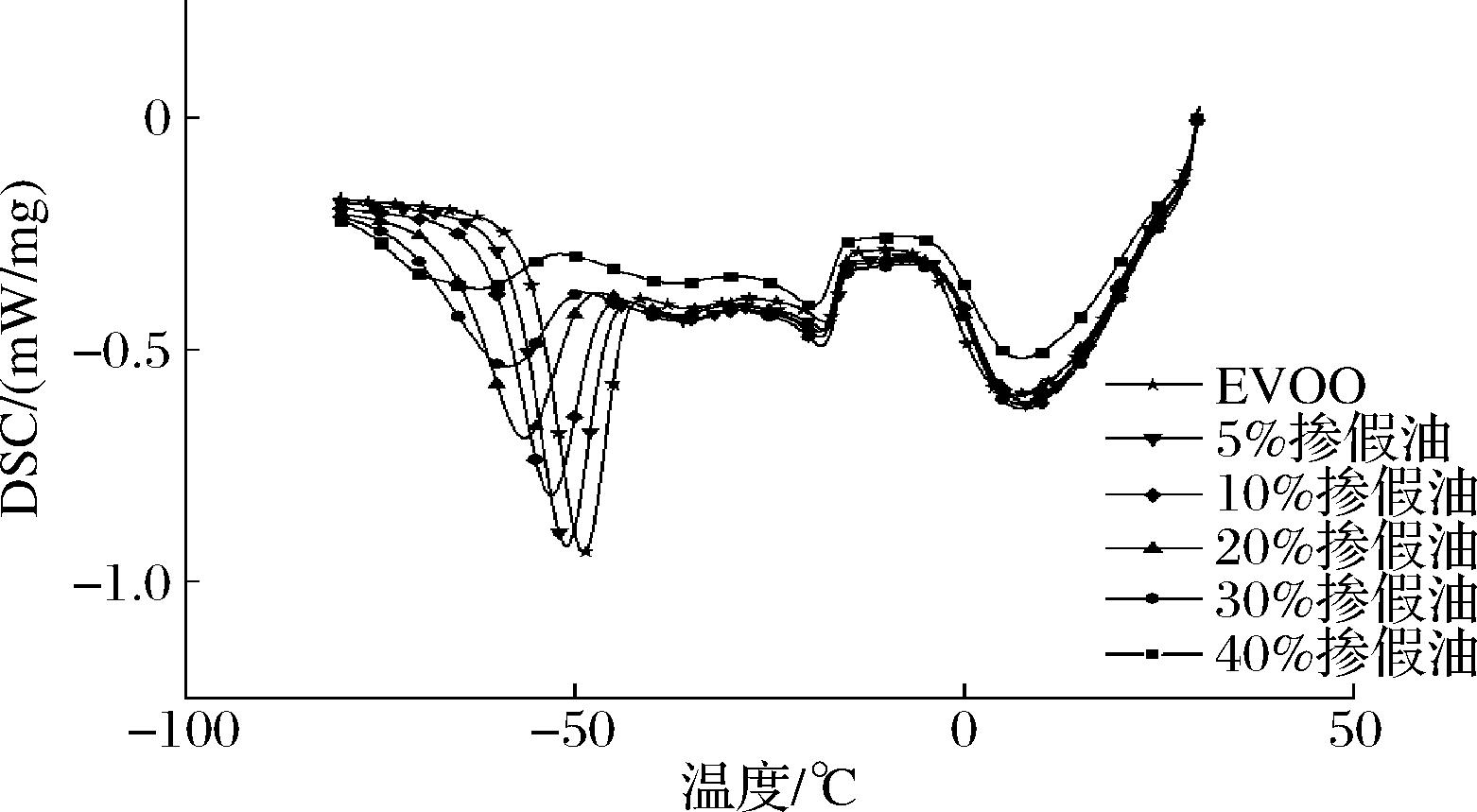
图2 各掺假比例混合油冷却DSC曲线对比图
Fig.2 Comparison chart of DSC curves of mixed oil cooled by each adulteration ratio
表1 DSC冷却曲线热力参数
Table 1 Thermodynamic parameters of DSC cooling curves
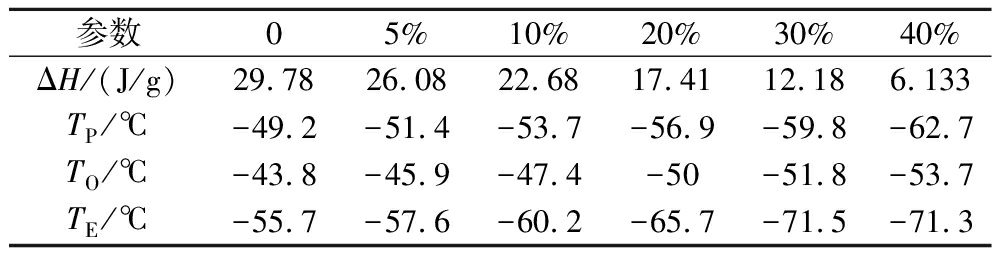
参数05%10%20%30%40%ΔH/(J/g)29.7826.0822.6817.4112.186.133TP/℃-49.2-51.4-53.7-56.9-59.8-62.7TO/℃-43.8-45.9-47.4-50-51.8-53.7TE/℃-55.7-57.6-60.2-65.7-71.5-71.3
表2 DSC冷却曲线相关热力参数的回归方程与决定系数
Table 2 Regression equations and determination coefficients of thermodynamic parameters related to DSC cooling curves

参数回归方程决定系数R2ΔH/(J/g)Y=57.556X-28.440.997TP/℃Y=33.2X-83.0070.992TO/℃Y=24X-28.5670.980TE/℃Y=43.453X-99.5150.950
以表1中各热力参数为横坐标,EVOO所占质量比为纵坐标建立一元回归方程并求出决定系数R2,结果如表2所示。ΔH所得到的一元回归方程决定系数R2为0.997,而TP、TO、TE得到的一元回归方程的决定系数R2分别为0.992、0.980和0.950,对比来看前者精度更高,所建立掺假模型相关性更好,因此以ΔH所建立的掺假模型作为掺假鉴定的依据更为合理。
同时,对于结晶焓值ΔH所建立掺假模型可以从掺假检测极限角度验证其精确性。由结晶焓值ΔH所建立的一元回归方程Y=57.556X-28.44可知,当EVOO质量分数为49.4%即对应掺假质量分数为51.6%时焓值为0,因此定量掺假分析的检测极限也在51.6%附近。50%掺假百分比混合油的DSC冷却曲线如图3所示,图上并未出现明显结晶峰,结晶焓值为0,两者基本接近,但存在一定误差。且热分析软件Proteus对峰进行综合分析时需要取点,当掺假比例靠近检测极限时结晶峰过小,取点存在困难,无法得到有效结果,因此需要缩小定量掺假检测的范围。综上所述,基于DSC冷却曲线上结晶峰焓值ΔH所建立的掺假模型在定性分析EVOO掺假方面有着明显效果,也可以进行一定范围内的定量掺假分析并通过重复实验取平均值的方法减小误差。

图3 50%掺假比例混合油冷却DSC曲线图
Fig.3 50% adulteration ratio mixed oil cooling DSC plot
2.2 DSC诱导氧化时间
2.2.1 DSC诱导氧化时间实验氧化温度
在DSC诱导氧化时间实验中需要实验样品在空气气氛下保持恒定温度一段时间,该恒定温度即为氧化温度,而氧化温度的选择对DSC加热氧化曲线图有着显著影响。氧化温度过大则氧化时间过短影响数据记录,过小则实验耗时很长,不利于掺假油的快速鉴定,因此选取140、160、180 ℃为氧化温度分别对EVOO进行实验,结果如图4所示。
以图4-a为例,DSC曲线为一个完整实验过程,实线为DSC随时间的变化曲线,虚线为温度随时间的变化曲线。由虚线可知整个氧化过程,首先在初始温度下以20 ℃/min的加热速率升温,到140 ℃时保持3 min随后切换空气气氛并继续维持140 ℃,在140 ℃的空气气氛下持续30 min后降温结束实验。

a-140 ℃ DSC氧化曲线图;b-160 ℃ DSC氧化曲线图;c-180 ℃ DSC氧化曲线图
图4 不同氧化温度下的氧化曲线图
Fig.4 Oxidation curves at different oxidation temperatures
由图4-a可知,在空气气氛下EVOO氧化曲线几乎保持一条直线,说明EVOO在140 ℃空气中恒温30 min的条件下并未发生氧化,诱导氧化时间无法测得,因此需要采用更高的氧化温度与更长的恒温时间。图4-b中氧化温度变为160 ℃,切换空气气氛后恒温时间变为40 min,在25.8 min左右EVOO发生氧化,诱导氧化时间可以测得且相对合理。图4-c中氧化温度变为180 ℃,在刚切换空气气氛后EVOO立刻发生氧化,氧化温度过高导致诱导氧化时间过短无法测量。因此160 ℃的氧化温度较为合适。同时对大豆油在氧化温度160 ℃,恒温时间40 min的条件下进行诱导氧化时间实验,由图5可知,大豆油在15.2 min左右发生氧化,诱导氧化时间也可以得到且比较合理,因此后续各掺假比例混合油的诱导氧化时间实验以氧化温度160 ℃,恒温时间40 min条件进行。

图5 大豆油在160 ℃下氧化曲线图
Fig.5 Oxidation curve of soybean oil at 160 ℃
2.2.2 DSC氧化稳定性实验结果与分析
以160 ℃的氧化温度维持40 min的条件,对各个不同掺假比例混合油进行实验,实验结果如图6所示,随着大豆油掺假比例增加,通入空气气氛后DSC曲线发生弯折时间变快,弯折后的DSC曲线也越来越靠下。具体数据如表3所示,随着大豆油掺假比例增加,诱导氧化时间逐渐变短,由EVOO的25.8 min减小到40%掺假比例混合油的17.8 min。而诱导氧化时间主要与油脂内的不饱和脂肪酸种类与含量有关,不饱和脂肪酸越多则诱导氧化时间越短,虽然EVOO内不饱和脂肪酸含量丰富,但同时也有酚类物质、角鲨烯、维生素E[24]等抗氧化物质的存在,因此所得结果较为合理,EVOO氧化稳定性比大豆油好。同时以表3数据拟合出诱导氧化时间对掺假百分比的一元回归方程并求出决定系数R2,所得回归方程为Y=-19.4X+25.64(R2=0.996)。利用大豆油的诱导氧化时间为15.2 min代入回归方程可大致得出掺假检测极限为53.8%。综上所述,基于诱导氧化时间所建立的掺假检验模型可较为准确地对掺假橄榄油进行定性分析,也可在一定范围内对掺假橄榄油进行定量分析。
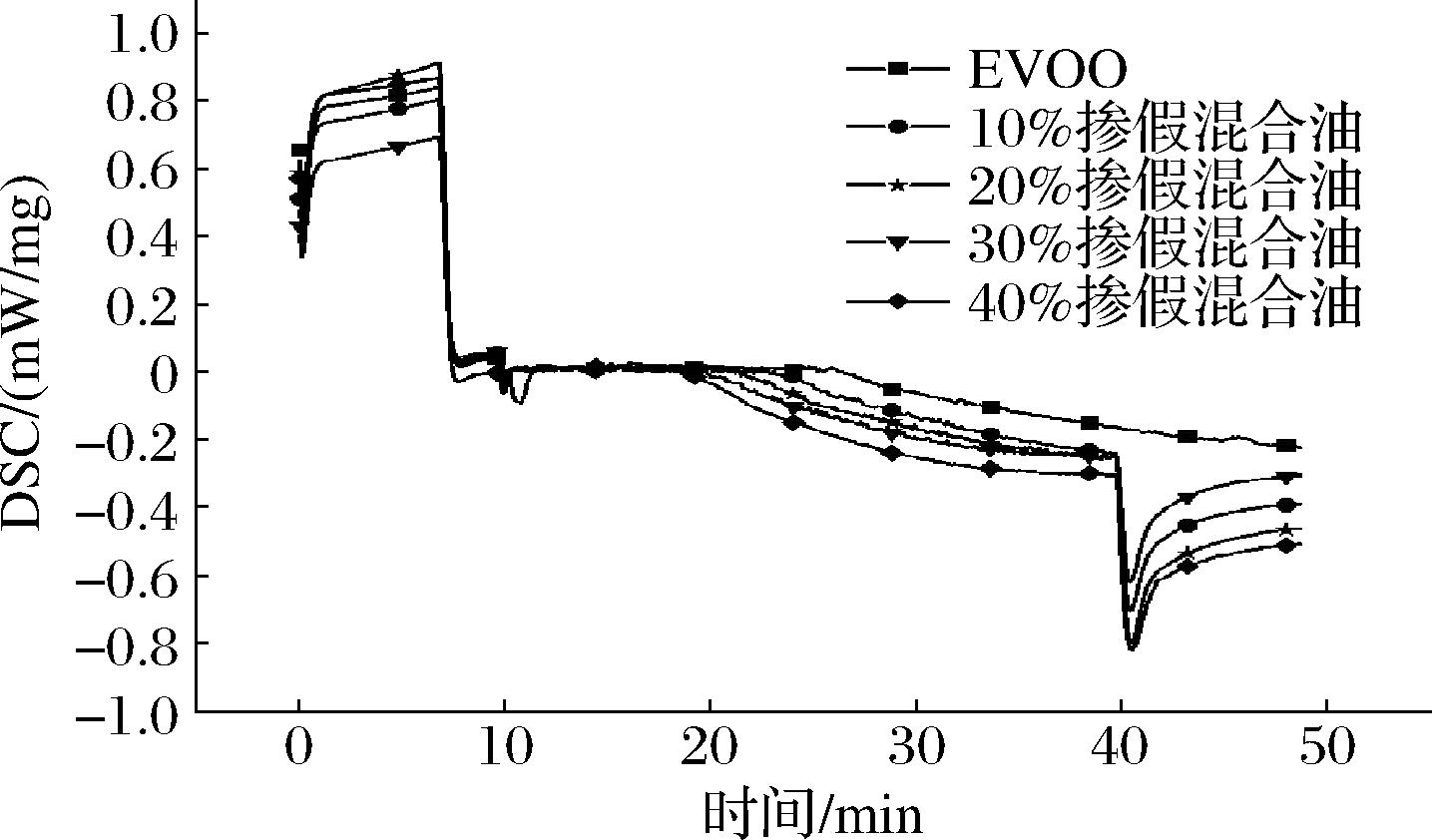
图6 不同掺假比例混合油的诱导氧化时间
Fig.6 Induced oxidation time of mixed oil with different adulteration ratio
2.3 DSC冷却结晶实验与诱导氧化时间实验对比分析
基于诱导氧化时间所建立的回归方程与基于DSC冷却曲线所建立的回归方程相关性R2都很高且很接近,都可在一定程度上作为分析EVOO中大豆油掺假的依据,但二者原理不同且各有优缺点。DSC冷却曲线差异主要取决于脂肪酸种类、含量、形态的不同,在曲线上能得到多个热力参数建立回归方程,可选取最优的热力参数来检验掺假,检验速度相对较快。但在掺假比例接近检测极限的情况下,结晶峰过小导致热分析软件Proteus取点进行峰的综合分析存在困难,无法得到准确数据。而诱导氧化时间的差异主要考虑不饱和脂肪酸与抗氧化物质种类与含量的不同,在DSC氧化曲线上可较为直接、清楚获得,且定量掺假分析时在各个掺假比例都能获得有效的结果。但DSC实验需要选取合适的氧化温度才能得到有效的结果,耗时相对较长,且也有着掺假检测极限的存在。因此可以根据实际情况选取相应的DSC检测方法鉴定EVOO是否掺假。
表3 不同掺假比例混合油的诱导氧化时间
Table 3 Induced oxidation time of mixed oils with different adulteration ratios

掺假比例诱导氧化时间/min40%掺假油17.830%掺假油2020%掺假油21.810%掺假油23.4EVOO25.8
3 结论
EVOO与大豆油冷却结晶DSC曲线有明显区别,随着掺假油中大豆油比例升高结晶峰逐渐变小左移,结晶开始温度TO、峰值温度TP、终止温度TE、结晶焓值ΔH均变小。由结晶峰焓值ΔH对EVOO质量百分比所建立回归方程Y=57.556X-28.44(R2=0.997),但由于模型掺假极限与热分析软件Proteus的限制,仅能在一定范围内对EVOO中大豆油的掺假做定量分析。
EVOO与大豆油诱导氧化时间也存在一定差异,在选取合适的实验条件后,随着大豆油掺假比例升高,油样诱导氧化时间变短。由诱导氧化时间对掺假质量比建立的回归方程Y=-19.4X+25.64相关性较好(R2=0.996),能够有效鉴定EVOO中大豆油的掺假,但定量掺假分析在掺假比例53.8%附近存在检测极限。
两种基于油脂不同特性的DSC掺假鉴别方法都能较好地鉴别EVOO中大豆油的掺假,且各有优劣,可对比分析选取更符合实际情况的方法。其中利用诱导氧化时间鉴别EVOO掺假也为DSC鉴定橄榄油掺假提供了更多思路,今后的研究中也可尝试利用DSC测量不同的体现氧化稳定性的参数如起始氧化时间[25]来完成对掺假橄榄油的鉴定,以进一步扩展EVOO的掺假检测方法。
[1] MARZOCCHI S, CABONI M F, PASINI F.Co-milling process of olives and oleaginous matrices with high nutritional value:A preliminary characterisation of the obtained oils[J].International Journal of Food Sciences and Nutrition, 2022, 73(8):1057-1066.
[2] 杨雯懿, 陈林, 周学忠.基于主成分分析和聚类分析的橄榄油中微量元素的统计比较[J].食品与发酵工业, 2020, 46(14):222-227.
YANG W Y, CHEN L, ZHOU X Z.Statistical comparison of trace elements in olive oil based on principal component analysis and cluster analysis[J].Food and Fermentation Industries, 2020, 46(14):222-227.
[3] YAN J, VAN STUIJVENBERG L, RUTH S.Handheld near-infrared spectroscopy for distinction of extra virgin olive oil from other olive oil grades substantiated by compositional data[J].European Journal of Lipid Science and Technology, 2019, 121(12):1900031.
[4] 宋聚国. 世界及中国橄榄油产业发展分析[J].世界农业, 2015(10):114-117.
SONG J G.Analysis on the development of olive oil industry in the world and China[J].World Agriculture, 2015(10):114-117.
[5] SIANO F, VASCA E.GC-FID analysis to evaluate the possible adulteration of extra virgin olive oil with different vegetable oils[J].Journal of Chemical Education, 2020, 97(11):4108-4116.
[6] 邱玲. 中国食用植物油贸易竞争力研究[D].哈尔滨:东北农业大学, 2017.
QIU L.Study on trade competitiveness of edible vegetable oil in China[D].Harbin:Northeast Agricultural University, 2017.
[7] 孔令琦, 宋佳琪, 陈林林, 等.食用油掺伪鉴别技术及模型建立的研究进展[J].食品安全质量检测学报, 2022, 13(19):6132-6139.
KONG L Q, SONG J Q, CHEN L L, et al.Research progress on identification technology and model establishment of edible oil adulteration[J].Journal of Food Safety &Quality, 2022, 13(19):6132-6139.
[8] 周盛敏, 姜元荣.橄榄油掺伪检测研究进展[J].粮食科技与经济, 2020, 45(4):93-96.
ZHOU S M, JIANG Y R.Research progress on adulteration detection of olive oil[J].Food Science and Technology and Economy, 2020, 45(4):93-96.
[9] 刘美艳, 宋会歌, 陈海桂, 等.红外光谱技术在地理标志食品检验中的应用[J].食品与发酵工业, 2011, 37(2):134-138.
LIU M Y, SONG H G, CHEN H G, et al.Application of the infrared spectroscopy technique in geographical indication food inspection[J].Food and Fermentation Industries, 2011, 37(2):134-138.
[10] ZAREZADEH M R, ABOONAJMI M, VARNAMKHASTI M G, et al.Olive oil classification and fraud detection using E-nose and ultrasonic system[J].Food Analytical Methods, 2021, 14(10):2199-2210.
[11] HUANG J Y, NORGBEY E, NKRUMAH P N, et al.Detection of corn oil in adulterated olive and soybean oil by carbon stable isotope analysis[J].Journal of Consumer Protection and Food Safety, 2017, 12(3):201-208.
[12] DANKOWSKA A, MA ECKA M.Application of synchronous fluorescence spectroscopy for determination of extra virgin olive oil adulteration[J].European Journal of Lipid Science and Technology, 2009, 111(12):1233-1239.
ECKA M.Application of synchronous fluorescence spectroscopy for determination of extra virgin olive oil adulteration[J].European Journal of Lipid Science and Technology, 2009, 111(12):1233-1239.
[13] VAN WETTEN I A, VAN HERWAARDEN A W, SPLINTER R, et al.Oil analysis by fast DSC[J].Procedia Engineering, 2014, 87:280-283.
[14] TOMASZEWSKA-GRAS J.DSC coupled with PCA as a tool for butter authenticity assessment[J].Journal of Thermal Analysis and Calorimetry, 2016, 126(1):61-68.
[15] 张春华, 惠菊, 王翔宇, 等.差示扫描量热法和热重法评估植物油氧化稳定性的研究进展[J].粮食与油脂, 2021, 34(10):8-11.
ZHANG C H, HUI J, WANG X Y, et al.Research development of oxidative stability evaluation of vegetable oil by DSC &TG methods[J].Cereals &Oils, 2021, 34(10):8-11.
[16] LI R F, HUANG J L, HUANG L, et al.Comparison of GC and DSC monitoring the adulteration of camellia oil with selected vegetable oils[J].Journal of Thermal Analysis and Calorimetry, 2016, 126:1735-1746.
[17] 赵瑾, 邹涛, 陈宇迪, 等.DSC方法在特级初榨橄榄油掺假鉴别中的应用[J].分析测试学报, 2017, 36(5):655-659.
ZHAO J, ZOU T, CHEN Y D, et al.Application of differential scanning calorimetry (DSC) in identification of the adulterated extra virgin olive oils[J].Journal of Instrumental Analysis, 2017, 36(5):655-659.
[18] 刘娟, 宋亚蕊, 唐维龙, 等.富硒茶油的抗氧化活性成分分析及氧化稳定性探究[J].食品与发酵工业, 2014, 40(4):82-86.
LIU J, SONG Y R, TANG W L, et al.Antioxidant activity components analysis and oxidation stability of Se-enriched camellia oil[J].Food and Fermentation Industries, 2014, 40(4):82-86.
[19] 邵薇, 张婷婷, 邹涛, 等.基于差示扫描量热法的大豆原油掺伪鉴别方法的建立[J].食品安全质量检测学报, 2015, 6(7):2746-2750.
SHAO W, ZHANG T T, ZOU T, et al.Detection of adulteration in crude soybean oil by using differential scanning calorimetry[J].Journal of Food Safety &Quality, 2015, 6(7):2746-2750.
[20] MARBELLO O D, VALBUENA S, RACEDO F J.Study of the nonlinear optical response and thermal stability of edible oils using the Z-scan technique[J].Talanta, 2020, 206:120226.
[21] 方冰, 朱宁科, 王瑛瑶, 等.大豆油和菜籽油中游离脂肪酸与烟点的数学关系研究[J].中国粮油学报, 2016, 31(10):56-59;65.
FANG B, ZHU N K, WANG Y Y, et al.Establishment of the mathematical model between free fatty acid and smoke point in soybean oil and rapeseed oil[J].Journal of the Chinese Cereals and Oils Association, 2016, 31(10):56-59;65.
[22] MANSOR T S T, CHE MAN Y B, SHUHAIMI M.Employment of differential scanning calorimetry in detecting lard adulteration in virgin coconut oil[J].Journal of the American Oil Chemists’ Society, 2012, 89(3):485-496.
[23] 纪佳璐, 吴莹, 徐斐然, 等.马泡瓜籽油理化特性、组成分析及氧化稳定性[J].食品科学, 2020, 41(21):15-21.
JI J L, WU Y, XU F R, et al.Physicochemical characteristics, composition and oxidative stability of Cucumis bisexualis seed oil[J].Food Science, 2020, 41(21):15-21.
[24] ALONSO-SALCES R M, GALLO B, COLLADO M I, et al.1H-NMR fingerprinting and supervised pattern recognition to evaluate the stability of virgin olive oil during storage[J].Food Control, 2021, 123:107831.
[25] 杨国燕. DSC和Rancimat法测定亚麻籽油氧化稳定性研究[J].粮食与油脂, 2014, 27(8):29-32.
YANG G Y.Study on oxidation stability of flax seed oil by DSC and Rancimat method[J].Cereals &Oils, 2014, 27(8):29-32.