青稞是我国青藏高原地区特有的传统经济作物,因其有高β-葡聚糖、高纤维、高蛋白、低血糖生成指数和低热量等特点,符合现代消费者所需的膳食结构,引起了国内外研究者广泛的关注[1]。淀粉是人体主要的能源物质,青稞中含有60%~80%的淀粉。根据淀粉消化性能和生物可利用性,将其分为易消化淀粉(rapidly digestible starch,RDS)、慢消化淀粉(lowly digestible starch,SDS)和抗性淀粉(resistant starch,RS)[2]。研究表明,抗性淀粉在对人体控制血糖、降低血脂、促进矿物质吸收等方面具有明显功效。
抗性淀粉又称抗酶解淀粉,具有类似于膳食纤维的生理功能,对糖尿病、心脑血管疾病等具有较好的预防作用。大量文献资料显示,常见的抗性淀粉多由小麦淀粉、玉米淀粉等制备。青稞中淀粉含量较高,是制备抗性淀粉的理想原料。然而,应用青稞淀粉(highland barley starch,HBS)制备抗性淀粉方面的研究相对较少。压热冷却法(hydrothermal cooling cycle method,HC)和酶解脱支法(enzymatic branching method,EB)是常用的抗性淀粉制备方法。其中HC处理的HBS经高温高压处理后颗粒结构塌陷,冷却过程中淀粉分子重结晶,呈现不规则的块状,形成抗酶解耐热结构[3],而EB处理则用酶降解淀粉分子,使淀粉分子的聚合度和直链A支链淀粉的比例达到适合形成RS的程度,进而促进RS的形成[4]。但这2种方法所得抗性淀粉含量不高(HC处理的RS含量在8%左右[3],EB处理的RS含量在10%左右)。研究表明,多种制备方法联合处理淀粉是一种有效提高抗性淀粉含量的方法。湿热法(damp heat method,DH)是一种在低湿度条件下对淀粉进行热处理的方法,具有提高直链和支链淀粉相互作用和提高抗性淀粉含量的优点。因此,以青稞淀粉为原料,采用HC-DH或EB-DH联合处理方法以期望得到高抗性、高热稳定性和低消化性的青稞抗性淀粉(highland barley resistant starch,HBRS)。
1 材料和方法
1.1 材料与试剂
昆仑14号黄青稞粉(100目),青海华实科技投资管理有限公司;D-葡萄糖(GOPOD法)检测试剂盒,无锡浩正生物科技有限公司;淀粉葡萄糖苷酶(黑曲霉),上海泰坦科技股份有限公司;无水乙醇、NaOH、HCl溶液、Na2CO3(均为分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
BSC-250型恒温恒湿箱、HHS型数显恒温水浴锅,上海博讯实业有限公司医疗设备厂;GZX-9246 MBE型数显鼓风干燥箱,上海一恒科学仪器有限公司;UV-3200型紫外分光光度计,上海美谱达仪器有限公司;D2 PHASER型X射线衍射仪,德国布鲁克AXS公司;BCD-258 WDPM型冰箱,青岛海尔股份有限公司;Thermo1510酶标仪,赛默飞世尔科技(中国)有限公司;SU8100 冷场发射扫描电子显微镜,日本株式会社日立高新技术;AX224ZH/E 型电子天平,奥豪斯仪器(常州)有限公司。
1.3 实验方法
1.3.1 青稞淀粉提取
参考张慧娟等[5]的方法略有修改:称取青稞粉300 g,加入1 500 mL 4 g/L的NaOH溶液浸泡2 h。然后用浓盐酸调节pH至中性,离心(4 800×g,10 min)。舍弃上清液、上层黄色黏稠液体和暗黄色固体,用去离子水多次洗涤下层沉淀物,离心(4 800×g,10 min),舍弃上清液及上层黄色黏稠液体,保留下层白色固体沉淀。用无水乙醇洗涤沉淀2次,抽滤,置于平皿中自然干燥,即得HBS。
1.3.2 HBRS的制备
1.3.2.1 压热冷却循环法和酶解脱支法制备HBRS
采用韩丽瑶等[6]的方法略有修改:称取HBS 10 g,加入去离子水100 mL,搅拌均匀,在125 ℃条件下处理45 min,取出,冷却至室温,随后于4 ℃冰箱中放置12 h,以上操作重复3次。将淀粉糊冷冻干燥,粉碎,过筛(100目),即得HC制备的HBRS。
称取HBS 10 g,加入去离子水100 mL,搅拌均匀,在125 ℃条件下预糊化45 min,取出冷却至55 ℃,用浓盐酸调节pH值至4.5,并在淀粉糊出现明显凝胶时,加入6 U/g普鲁兰酶,于50 ℃环境中孵育6 h。将酶解后的淀粉糊在125 ℃压热处理45 min,随后于4 ℃冰箱中放置24 h。将淀粉糊冷冻干燥,粉碎,过筛,即得EB制备的HBRS。
1.3.2.2 HC-DH和EB-DH联合制备HBRS
称取HC和DH制备的HBS各1 g,控制水分含量为30%,室温放置过夜。在105 ℃烘箱密封放置2 h,取出,于50 ℃条件下干燥24 h。之后加水保持水分30%,重复2次之前操作。淀粉糊冷冻干燥,粉碎,过筛,即得HC-DH和EB-DH制备的HBRS。
1.3.3 淀粉的结构性质
1.3.3.1 X-射线衍射及相对结晶度测定[7]
利用X-射线衍射仪(X-ray diffraction,XRD)对淀粉的结晶特性进行表征。测试条件:衍射角范围5°~35°,扫描速率2°/min,在40 kV和40 mA条件下进行扫描。相对结晶度(relative crystallinity,RC)使用MDI-Jade 6.5软件(Material Date,Inc.Livermore,California,USA)进行分析。计算如公式(1)所示:
(1)
式中:RC,相对结晶度;Ac,淀粉结晶区面积;Aa,淀粉无定形区的面积。
1.3.3.2 傅立叶变换红外光谱测定[8]
将HBS(HBRS)与适量KBr充分混合(1∶100),研磨后进行压片,然后置于傅立叶变换红外光谱仪中检测。扫描波数范围及仪器分辨率分别为 400~4 000 cm-1和4 cm-1。
1.3.4 糊化特性
称取HBS(HBRS)3 g,加入到装有25 mL蒸馏水的样品盒中并充分搅拌,将样品盒置于快速黏度分析仪样品槽内,开始15 s以150 r/min搅拌,将淀粉溶液混匀。淀粉的糊化特性用黏度参数表示[9]。
1.3.5 HBS(HBRS)的颗粒形态观察
HBS(HBRS)颗粒形态特征使用扫描电子显微镜进行观察。将HBS(HBRS)样品平铺于带有导电胶带的铝制坩埚上并进行真空喷金处理,样品的颗粒形态特征在3.0 kV,5.00 μm条件下进行观察,图像放大倍数为500×[10]。
1.3.6 淀粉消化特性
用改良后的Englyst方法[11]测试HBS(HBRS)的体外消化率。称取100 mg HBS(HBRS),置于离心管中,糊化后加入玻璃珠,密封,将离心管于37 ℃恒温振荡,振荡速率为120 r/min;加入4 mL新鲜配制的消化液并开始计时;分别在20和120 min吸取100 μL水解液,加入900 μL无水乙醇灭活消化酶;离心(8 000×g,2 min),收集上清液,利用3 mL葡萄糖氧化酶试剂盒(GOPOD)测定上清液中的葡萄糖含量。20 min内消化的淀粉部分为RDS, 20~120 min内消化的淀粉部分为SDS,120 min内未消化的淀粉部分为RS。
1.3.7 淀粉功能特性
称取HBS(HBRS)0.5 g,置于预先称重的离心管中,加入去离子水6 mL,混匀,在30 ℃水浴中保持30 min,每10 min涡旋5 s。离心(3 000×g,15 min),上清液转移到恒重的培养皿中,在105 ℃干燥4 h[12]。称取沉淀物质量,并根据公式(2)和公式(3)计算淀粉的持水性和水溶性。
(2)
(3)
式中:sp,持水性,%;m1,沉淀质量,g;m2,样品质量,g;m3,被溶解样品质量,g;sw,水溶性,%。
1.3.8 数据统计分析
每个样品至少平行测定3次,所有实验结果用平均值±标准差表示。运用SPSS 18.0软件(SPSS Incorporatd,Chicago)进行方差分析,并利用Tukey方法分析数据的显著性。
2 结果与讨论
2.1 淀粉的结构性质
2.1.1 X-射线衍射及相对结晶度
由图1可知,HBS在15.15°、17.15°、18.19°、23.23°均具有衍射峰,为A型结晶结构。与HBS相比,EB制备的HBS在17°处衍射峰的强度有所上升,在18°处的衍射峰强度下降,有类似B型结晶结构。HC、HC-DH和EB-DH制备的HBS衍射峰基本消失,淀粉无定形区增加,整条曲线接近馒头峰,说明HC、HC-DH和EB-DH处理能破坏HBS的结晶结构和双螺旋结构。HC处理对HBS结构改变的原因主要是在高温高压的环境中HBS原有的晶体结构被破坏。淀粉颗粒由有序的结晶区和无序的无定形区组成,其中结晶区主要由支链淀粉起到骨架作用,其直链分支和长短不同的游离直链分子平行排列,通过氢键作用形成大致有规则的束状体即为微晶束[13]。EB制备过程中,HBS微晶区的支链分支被普鲁兰酶酶解切断,支链淀粉的支撑作用减弱,大量短直链呈游离状态分布于淀粉颗粒中,从而降低了RC。结晶度是表征淀粉颗粒结晶结构的一个重要指标,其指标会影响淀粉的理化性质和应用[14]。HBS经HC和EB处理后,其RC从29.05%分别降低至12.85%(HC)和10.11%(EB)。经过HC-DH和EB-DH处理后,RC进一步显著降低,分别为4.75%(HC-DH)和3.59%(EB-DH)。表明HBS经过不同方式处理后,其晶体结构转变为无定型结构,从多晶状态转变为非晶态。

图1 不同制备方法对HBS X-射线衍射图谱及 相对结晶度的影响
Fig.1 Effect of different preparation methods on the HBS X-ray diffraction spectrum and its relative crystallinity
2.1.2 傅立叶变换红外光谱
由图2可知,与HBS相比,HC-DH和EB-DH制备的HBRS在3 400~3 100 cm-1处的吸收峰向低波数方向迁移,并形成了更宽和更深的吸收峰,表明HBRS中短直链淀粉链由于分子间和分子内相关的复杂振动拉伸而产生更多氢键,使分子间的结构变得更加紧密,影响了淀粉颗粒对淀粉酶作用的敏感性,阻碍了淀粉酶水解,降低了HBS的回生值[15]。淀粉分子的短程有序性可由红外光谱中1 047/1 022 cm-1吸收峰的吸光度比值来表征[16]。其中1 047/1 022比值越大,表明颗粒内短程有序度越高。由图3可知,HC和EB处理后的青稞淀粉样品的1 047/1 022吸光度比值显著降低(P<0.05),而再经过DH处理后1 047/1 022比值又有所减小,说明青稞淀粉经过
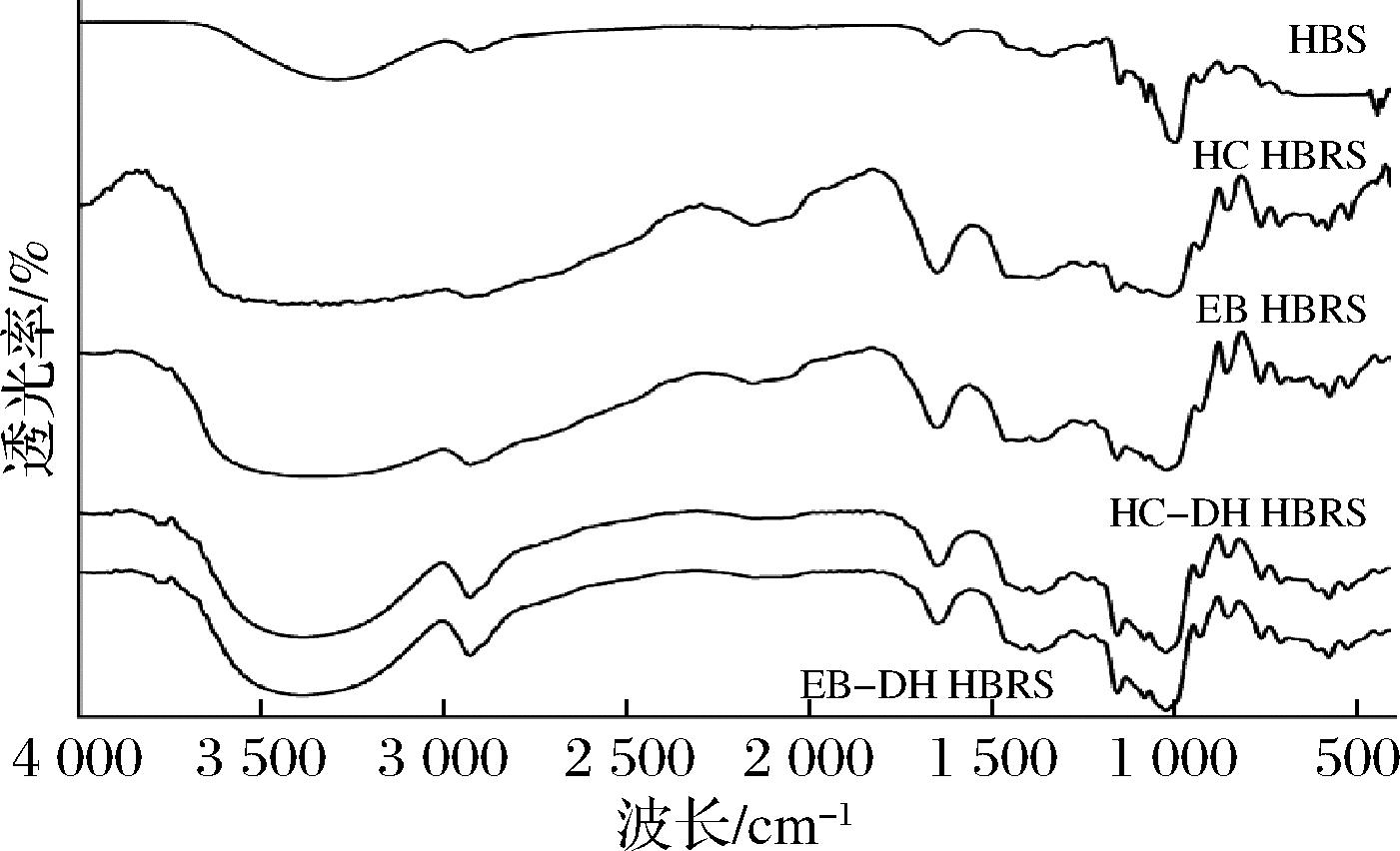
图2 不同制备方法对HBS红外图谱的影响
Fig.2 Effect of different preparation methods on the infrared mapping of HBS

图3 不同制备方法对HBS红外光谱中1 047/1 022 cm-1 吸光度的比值的影响
Fig.3 Effect of different preparation methods on the ratio of the absorbance of 1 047/1 022 cm-1 in the infrared spectrum of HBS
HC-DH和EB-DH处理后,样品的双螺旋结构解旋,结晶度降低,该结论与XRD所得结论一致。
2.2 RVA
峰值黏度与谷值黏度之差即衰减值则反映了HBS(HBRS)的热糊稳定性,衰减值越大,则其热糊稳定性就越差[17]。由表1可知,HBS衰减值为1 766 cP。经HC和EB处理的HBRS的峰值黏度显著降低(P<0.05)。再经过HC-DH和EB-DH处理后HBRS的衰减值有极显著减小(P<0.05)。表明HC-DH和EB-DH可显著提高HBS的热糊稳定性。
表1 不同制备方法对HBS糊化特性的影响
Table 1 Effect of different preparation methods on the gelatinization characteristics of HBS

样品峰值黏度/cP谷值黏度/cP衰减值/cP最终黏度值/cP回生值/cP糊化温度/℃HBS3 813.67±15.11a2 047.67±19.26a1 766.00±24.10a4 435.00±28.58a2 387.33±9.53a94.70±0.57aHC HBRS1 281.00±20.83b1 206.33±26.08b74.67±5.25b1 727.33±75.90b521.00±50.48b51.00±0.82cEB HBRS1 086.00±24.10c1 033.33±17.00c52.67±7.93bc1 513.00±55.55c479.67±50.02b50.03±0.45cHC-DH HBRS98.00±2.62d69.50±0.47d28.00±2.83c118.50±3.30d49.00±2.94c55.00±0.47bEB-DH HBRS68.50±3.50e61.50±4.50e7.00±1.00d73.00±1.00e11.50±3.50d50.5±0.50c
注:同列数据不同字母表示具有显著差异性(P<0.05)(下同)。
糊化温度反映了淀粉糊化的难易程度,糊化温度越高,淀粉糊化越困难[18]。HBS经过不同方式处理后,糊化温度显著降低(P<0.05),表明HC、EB、HC-DH和EB-DH处理均能明显改善HBS的糊化性能。
图4反映了不同处理方法对HBS糊化特性的影响,结合表1可以较为细致地得出HBS经过HC或EB处理后其糊化性能得到较大改善,而HC-DH和EB-DH处理对HBS糊化性能改善效果更为突出。
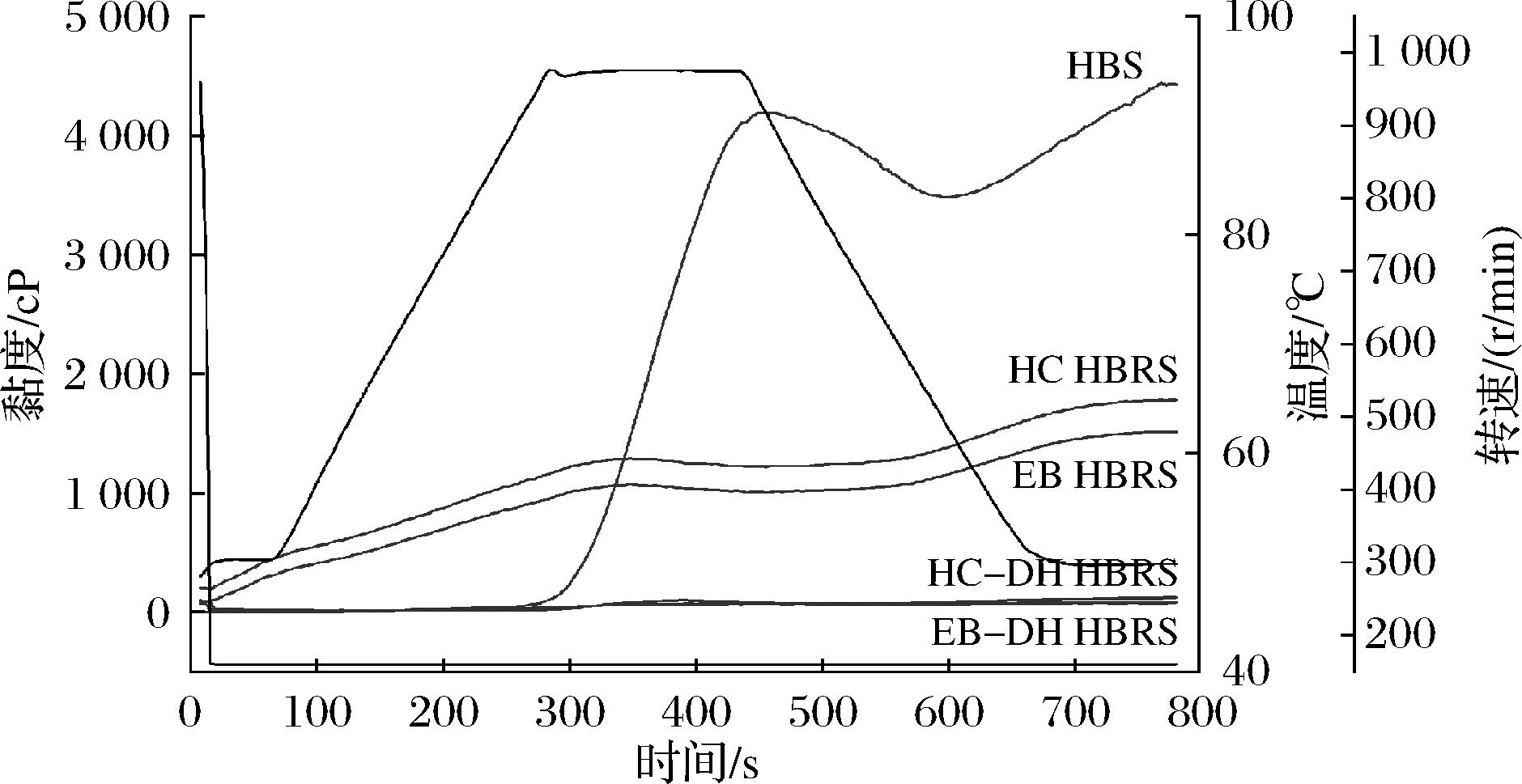
图4 不同制备方法对HBS糊化特性的影响
Fig.4 Effect of different preparation methods on the gelatinization characteristics of HBS
2.3 淀粉的颗粒形态观察
如图5所示,HBS颗粒形态呈现球形或椭圆形且表面光滑,无明显裂痕。HC处理后,青稞淀粉颗粒之间发生聚集且表面比较粗糙,呈现不规则的鱗片状,几乎没有完整的淀粉颗粒形状。其原因可能是在HC过程中,HBS大部分发生糊化,颗粒吸水膨胀,导致体积增大而后破裂,失去原有晶体结构[19]。DH处理后的淀粉,其原本颗粒结构和性质消失,淀粉颗粒相互连结,且体积明显增大,表面凹凸不规则,淀粉颗粒也出现了粘结现象。HC-DH和EB-DH处理时,可能由于DH处理的高温环境使其水分蒸发至颗粒表面,促使HBS颗粒相互黏连,颗粒变大。当结束DH过程后,温度的降低使颗粒表面形成塌陷,出现凹坑,表现出不同强度的固态连接,表观结构发生明显变化,形成不规则堆积结构,出现大量块状物[20]。这些结构的产生与上文中XRD和红外得出的处理前后晶体结构和结晶度产生变化相对应。在一定程度上揭示了HBS(HBRS)样品颗粒形态的变化与其消化性之间的关联。

a-HBS;b-HC HBRS;c-EB HBRS;d-HC-DH HBRS; e-EB-DH HBRS
图5 不同制备方法对HBS微观结构的影响
Fig.5 Effect of different preparation method on the microstructure of HBS
2.4 淀粉体外消化率
由表2可知,糊化HBS中RDS、SDS和RS含量分别为85.45%、9.73%和4.81%。经过HC处理后,RDS含量显著减少(P<0.05),SDS与RS含量均显著增加(P<0.05)[21]。这是由于HC处理的本质是高温高压产生的直链分子在回生过程中进行了重结晶,形成致密的抗酶解结构,而EB处理则是普鲁兰酶作用于α-1,6糖苷键而产生更多的直链淀粉[22]。HC和EB处理后HBS的消化率变弱。HC和EB与DH联合处理可以降解淀粉分子,部分破坏原存在于天然淀粉中的螺旋、结晶和层状结构。DH处理后的HBS具有更高的抗酶水解性(RS增加)[23]。HC-DH和EB-DH处理可以在多个尺度上改变结构来有效调节HBRS的消化率[24],并最终将部分RDS/SDS转化为RS,HC-DH和EB-DH后,RDS和SDS质量分数显著减少,而与此同时RS的质量分数大幅提高。根据以上结果,可以得出HC-DH和EB-DH处理过程中的水热效应/酶作用会导致淀粉层次结构被破坏,从而改变HBS(HBRS)消化和糊化特性,进而在消化过程中表现出较高的抗酶水解能力和在糊化过程中显示出较高的耐水热效应能力。
表2 糊化HBS(HBRS)体外消化率 单位:%
Table 2 In vitro digestibility of gelatinized HBS (HBRS)

样品RDSSDSRSHBS85.45±2.38a9.73±2.03b4.81±0.35cHC HBRS70.33±0.95b21.36±0.89a8.31±0.10dEB HBRS68.04±0.46b21.25±1.16a10.72±0.85cHC-DH HBRS31.65±0.43c6.71±0.37c61.64±0.07bEB-DH HBRS14.75±2.31d14.47±2.08b70.78±0.32a
2.5 淀粉功能特性
如表3所示,HBS经过HC、EB、HC-DH或EB-DH处理后,持水性显著增加(P<0.05),可能是由于HC或EB处理使HBS结晶结构被破坏,并促进淀粉和水之间的氢键相互作用,从而增加吸水指数[25]。HC-DH制备的HBRS的持水性略微增加,EB-DH处理的HBRS持水性有所减小,但均显著高于HBS(P<0.05)。HBS的水溶性指数最低(0.42%),HC制备的HBRS水溶性指数最高(11.86%)。水溶性指数通常用作确定淀粉成分破坏程度的指标。经改性后HBS水溶性指标明显提高,表明HBS结构在水热效应下进一步被破坏。
表3 HBS(HBRS)持水性和水溶性 单位:%
Table 3 Water retention and water solubility of HBS (HBRS)
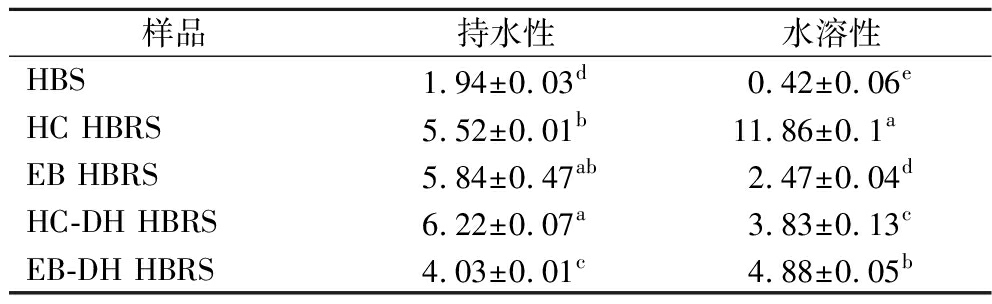
样品持水性水溶性HBS1.94±0.03d0.42±0.06eHC HBRS5.52±0.01b11.86±0.1aEB HBRS5.84±0.47ab2.47±0.04dHC-DH HBRS6.22±0.07a3.83±0.13cEB-DH HBRS4.03±0.01c4.88±0.05b
3 结论
抗性淀粉在小肠中不被吸收和酶解,但能在大肠中被肠道菌群发酵,生成短链脂肪酸,因此具有调节血糖水平和改善肠道环境作用。本文从结构和消化性等角度出发对HC或EB制备的抗性淀粉及HC-DH或EB-DH联合制备的抗性淀粉改善机制进行分析得出:HC-DH和EB-DH处理使HBS的相对结晶度减小,淀粉颗粒破裂,短程有序性、消化率和糊化温度降低,糊化特性得到调节。此外,与HC和EB相比,联合处理成功地提高了HBS的抗性淀粉含量。XRD与红外结果表明了不同处理方法对HBS(HBRS)结构方面的改变,其中HC-DH和EB-DH对HBS产生的结构破坏尤其明显。可以得出HBS经过联合处理后,其晶体结构转变为无定型结构,从多晶状态转变为非晶态。可能正是由于原本较稳定的晶体结构被破坏和新结构的产生,从而使HC-DH和EB-DH处理后得到的HBRS对淀粉酶敏感性降低和更高的抗性淀粉含量。糊化特性和功能特性研究结果也佐证了HC-DH和EB-DH处理比单一的HC和EB处理能得到更优质的HBRS。本文的研究结果有助于我们从结构的角度,通过与HC和EB对比更好地理解HC-DH和EB-DH处理的方法对HBS消化率、糊化特性和功能特性的影响,为后续更深入研究制备方法对HBRS构效关系的影响、制备更优质的HBRS奠定基础。
[1] 高汪磊, 龚凌霄, 张英.青稞作为我国高原特色谷物资源在功能食品领域的开发潜力[J].粮食与油脂, 2015, 28(2):1-4.
GAO W L, GONG L X, ZHANG Y.The development potential of Tibetan hull-less barley as China plateau characteristic grain resources in the field of functional food[J].Cereals &Oils, 2015, 28(2):1-4.
[2] 张倩倩. 青稞慢性消化淀粉制备条件的优化及应用[D].上海:上海海洋大学, 2015.
ZHANG Q Q.Optimum preparation conditions and application of highland barley slowly digestible starch[D].Shanghai:Shanghai Ocean University, 2015.
[3] 曹承嘉, 缪书婷, 张晓晨, 等.压热冷却循环处理制备青稞抗性淀粉的工艺优化及其特性研究[J].食品科技, 2020, 45(3):253-258.
CAO C J, MIAO S T, ZHANG X C, et al.Optimization of the preparation and physicochemical properties of hulless barley resistance starch by autoclaving-retrograding cycle method[J].Food Science and Technology, 2020, 45(3):253-258.
[4] 翟一潭, 柏玉香, 李晓晓, 等.酶法改性淀粉颗粒的研究进展[J].食品科学, 2021, 42(7):319-328.
ZHAI Y T, BAI Y X, LI X X, et al.Preparation, characterization, physicochemical property and potential application of enzyme-modified starch:A review[J].Food Science, 2021, 42(7):319-328.
[5] 张慧娟, 王静, 刘英丽, 等.碱法提取青稞淀粉的理化性质研究[J].中国食品学报, 2016, 16(3):75-80.
ZHANG H J, WANG J, LIU Y L, et al.Studies on physicochemical properties of hull-less barley starch obtained by the alkali extraction method[J].Journal of Chinese Institute of Food Science and Technology, 2016, 16(3):75-80.
[6] 韩丽瑶, 李梁, 张博辉, 等.压热法制备黑青稞抗性淀粉工艺及性质研究[J].食品研究与开发, 2020, 41(10):115-121.
HAN L Y, LI L, ZHANG B H, et al.Study on autoclaving preparation technology of black highland barley resistance starch and its properties[J].Food Research and Development, 2020, 41(10):115-121.
[7] 林静, 苑会功, 周英, 等.小麦抗性淀粉理化特性的研究[J].新疆农业科学, 2017, 54(3):417-422.
LIN J, YUAN H G, ZHOU Y, et al.Studies on the physicochemical properties of wheat flour resistant starch[J].Xinjiang Agricultural Sciences, 2017, 54(3):417-422.
[8] UZIZERIMANA F.湿热处理改性苦荞淀粉的理化性质及体外消化率[D].杨凌:西北农林科技大学, 2021.
UZIZERIMANA F.Physicochemical properties and in vitro digestibility of tartary buckwheat starch modified by heat moisture treatment[D].Yangling:Northwest A&F University, 2021.
[9] 李蒙娜. 小麦抗性淀粉的制备及结构性质研究[D].合肥:合肥工业大学, 2019.
LI M N.Preparation, structure and properties of resistant starch from wheat starch[D].Hefei:Hefei University of Technology, 2019.
[10] CHANG F D, HE X W, HUANG Q.Effect of lauric acid on the V-amylose complex distribution and properties of swelled normal cornstarch granules[J].Journal of Cereal Science, 2013, 58(1):89-95.
[11] ENGLYST H N, KINGMAN S M, CUMMINGS J H.Classification and measurement of nutritionally important starch fractions[J].European Journal of Clinical Nutrition, 1992, 46(2):S33-S50.
[12] 肖新龙. 青稞淀粉理化特性及其抗性淀粉制备研究[D].杨凌:西北农林科技大学, 2013.
XIAO X L.Physicochemical properties of barley starch and preparation of resistant starch[D].Yangling:Northwest A&F University, 2013.
[13] 李红梅, 陈文文, 黄璐, 等.复合湿热处理对苦荞全粉理化特性及体外消化性的影响[J].食品科学技术学报, 2021, 39(5):39-48.
LI H M, CHEN W W, HUANG L, et al.Effect of combined heat-moisture treatments on physicochemical properties and in vitro digestibility of whole tartary buckwheat flour[J].Journal of Food Science and Technology, 2021, 39(5):39-48.
[14] 王成祥, 饶欢, 张美娜, 等.压热-酶解法制备黑豆抗性淀粉及其理化性质[J].食品工业, 2021, 42(8):69-72.
WANG C X, RAO H, ZHANG M N, et al.Preparation and structural characteristics of black bean resistant starch by physical and enzyme methods[J].The Food Industry, 2021, 42(8):69-72.
[15] 秦维. 不同制备方法对慈姑抗性淀粉结构及相关功能的影响[D].镇江:江苏大学, 2020.
QIN W.Influence on the structure and related functional characteristics of arrowhead (Sagittaria sagittifolia L.) resistant starch prepared by different methods[D].Zhenjiang:Jiangsu University, 2020.
[16] VAN SOEST J J G, TOURNOIS H, DE WIT D, et al.Short-range structure in (partially) crystalline potato starch determined with attenuated total reflectance Fourier-transform IR spectroscopy[J].Carbohydrate Research, 1995, 279:201-214.
[17] 莫琰, 杨尚威, 赵灿, 等.普鲁兰酶酶解对葛根淀粉理化特性的影响[J].食品工业科技, 2022, 43(13):79-85.
MO Y, YANG S W, ZHAO C, et al.Effect of enzymatic hydrolysis by pullulanase on the physicochemical properties of Kudzu starch[J].Science and Technology of Food Industry, 2022, 43(13):79-85.
[18] 肖兵. 抗性淀粉对糖尿病小鼠血糖和短链脂肪酸的影响及代餐产品开发[D].南昌:南昌大学, 2018.
XIAO B.Resistant starch to diabetic mice the regulation of blood sugar and the effect of short chain fatty acid[D].Nanchang:Nanchang University, 2018.
[19] LESMES U, BEARDS E J, GIBSON G R, et al.Effects of resistant starch type III polymorphs on human colon microbiota and short chain fatty acids in human gut models[J].Journal of Agricultural and Food Chemistry, 2008, 56(13):5415-5421.
[20] 杨光, 丁霄霖.抗性淀粉定量测定方法的研究[J].中国粮油学报, 2002, 17(3):59-62.
YANG G, DING X L.Study on determination of resistant starch[J] Chinese Cereals and Oils Association, 2002, 17(3):59-62.
[21] LIU K, ZHANG B J, CHEN L, et al.Hierarchical structure and physicochemical properties of highland barley starch following heat moisture treatment[J].Food Chemistry, 2019, 271:102-108.
[22] 张语涵, 徐同成, 刘丽娜, 等.抗性淀粉与肠道微生物的研究进展[J].中国食物与营养, 2019, 25(11):60-63.
ZHANG Y H, XU T C, LIU L N, et al.Research progress on resistant starch and intestinal microorganism[J].Food and Nutrition in China, 2019, 25(11):60-63.
[23] 卞华伟, 郑波, 陈玲, 等.干热处理对青稞淀粉多尺度结构和理化性质的影响[J].食品科学, 2020, 41(7):93-101.
BIAN H W, ZHENG B, CHEN L, et al.Multi-scale structure and physicochemical properties of highland barley starch following dry heat treatment[J].Food Science, 2020, 41(7):93-101.
[24] LIU C, WANG S J, CHANG X D, et al.Structural and functional properties of starches from Chinese chestnuts[J].Food Hydrocolloids, 2015, 43:568-576.
[25] DEMIRKESEN-BICAK H, TACER-CABA Z, NILUFER-ERDIL D.Pullulanase treatments to increase resistant starch content of black chickpea (Cicer arietinum L.) starch and the effects on starch properties[J].International Journal of Biological Macromolecules, 2018, 111:505-513.