大黄鱼(Pseudosciaena crocea)肉嫩味鲜、富含蛋白质与维生素等营养物质,受到国内外消费者的青睐。大黄鱼在国内以养殖为主,北起黄海南部,经东海、台湾海峡,南至南海雷州半岛以东均有分布[1],是我国近海主要经济鱼类。《2022中国渔业统计年鉴》显示[2],2021年我国养殖大黄鱼总产量为25.42万t,占全国海水养殖鱼类总产量的13.79%。
新鲜大黄鱼含有较高的蛋白质和水分,在运输和贮藏过程中极易受到微生物和内源酶的作用而发生鲜度下降、品质劣化与腐败变质现象,造成营养损失和商业价值下降。水产品在流通中要保持渔获后的鲜度和品质,就需要在运输过程中使用冷链运输体系,然而由于运输条件与成本的限制,在整个冷链流通过程中要保持稳定的温度十分不易。频繁的温度波动常常会影响水产品的鲜度。王一帆等[3]研究发现±2 ℃温度波动导致4 ℃冷藏的三文鱼片色差产生明显变化,对pH值、挥发性盐基氮(total volatile basic nitrogen, TVB-N)含量也有不良影响。LORENTZEN等[4]发现储存温度升高2 ℃,鳕鱼鱼片的货架期会因此显著缩短。傅丽丽等[5]的研究结果表明,温度波动的冻藏大黄鱼其理化指标和微生物数量与温度稳定组有明显差别,且贮藏货架期比温度稳定组缩短了约6 d。王倩等[6]研究发现,温度波动加速大黄鱼的品质劣变,流通时间与其感官分值、TVB-N值、微生物数正相关,冷链组与断链组样品分别在347与275 h时超出货架期终点。
水分是水产品中非常重要的组分,其存在形式和各区域分布状况对水产品品质和贮藏期间的稳定性等有着显著的影响[7]。低场核磁共振(low-field nuclear magnetic resonance, LF-NMR)技术是一种快速、无损的分析检测技术[8],能直观反映鱼肉中各状态水分含量和变化,结合部分品质指标的检测能为研究水分变化与贮藏品质之间的关系提供理论基础[9]。如王硕等[10]研究发现三文鱼冷藏期间水的横向弛豫参数T2与感官、质构、pH、TVB-N和K值等鲜度指标显著相关,可用于评价冷链物流过程中鱼肉品质的变化。汪春玲等[11]研究发现气调罗非鱼在低温贮藏下水分迁移与TVB-N含量、pH值有较高相关性,可利用LF-NMR技术检测水分来快速判定微冻气调鱼片的品质变化。S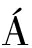 NCHEZ-ALONSO等[12]通过比较不同冻藏条件下鳕鱼肌肉的横向弛豫参数(T2)来评估鱼肉的品质,发现T2对不同冷冻温度敏感,能反映水分子的结晶情况,可用于鳕鱼货架期的预测。然而目前关于低场核磁共振技术结合理化指标监测养殖大黄鱼贮藏流通过程中因温度波动造成的水分迁移及品质变化的研究较少。
NCHEZ-ALONSO等[12]通过比较不同冻藏条件下鳕鱼肌肉的横向弛豫参数(T2)来评估鱼肉的品质,发现T2对不同冷冻温度敏感,能反映水分子的结晶情况,可用于鳕鱼货架期的预测。然而目前关于低场核磁共振技术结合理化指标监测养殖大黄鱼贮藏流通过程中因温度波动造成的水分迁移及品质变化的研究较少。
为了系统研究冷链流通过程中温度波动对养殖大黄鱼鲜度品质和水分迁移的影响,本试验模拟了大黄鱼冷链流通过程中常见的温度波动方式,通过流通过程中大黄鱼感官、色差、质构、色泽及菌落总数等理化指标的分析,并结合低场核磁共振技术综合评价温度波动对冷链流通过程中养殖大黄鱼品质及水分迁移的影响,以期为大黄鱼的冷链物流与品质保持技术开发提供理论参考。
1 材料与方法
1.1 材料与试剂
冰鲜大黄鱼(Pseudosciaena crocea),2022年3月采购于广东湛江市霞山水产品批发市场,产地福建宁德,质量为(500±50) g,体长为28~31 cm,鱼鳞完整且有光泽、眼球饱满凸出、鱼鳃鲜红无异味,层冰层鱼条件下运至实验室。
平板计数琼脂培养基,北京陆桥技术股份有限公司;ATP关联物标准品,美国Sigma公司;NaCl、MgO、H3BO3(均为分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
SN800分光测色仪,深圳市三恩驰科技有限公司;TA.XT Plus C质构仪,英国SMS公司;Varioskan Flash全自动酶标仪,美国Thermo Fisher Scientific公司;VAPODEST 450全自动凯氏定氮仪,德国Gerhardt公司;E2695高效液相色谱仪,美国Waters公司;NMI20-060HH核磁共振成像分析仪,苏州纽迈分析仪器股份有限公司。
1.3 实验方法
1.3.1 分组及处理
大黄鱼模拟冷链流通各阶段温度设定如图1所示。
贮藏初期阶段(L组):新鲜大黄鱼层冰层鱼运至实验室后置于2 ℃环境中至贮藏待运阶段结束。

图1 大黄鱼模拟流通过程中温度设定示意图
Fig.1 Schematic diagram of temperature setting in simulated circulation of P. crocea
注:CL组-冷链流通;BC组-断链流通(下同)。
CL组:从贮藏待运阶段结束至市场销售环节结束,大黄鱼样品均处在2 ℃环境中;从市场销售环节结束至家庭暂存阶段,大黄鱼样品均处在2 ℃环境中。
BC组:从贮藏待运阶段结束至市场销售环节结束,大黄鱼样品搬运环节温度为10 ℃,运输环节温度为4 ℃,销售环节温度为2 ℃;从市场销售环节结束至家庭暂存阶段,大黄鱼样品家庭运输环节处在20 ℃,其他环节均处在2 ℃环境中。
整个流通过程共设有14个采样点,L组:L-0、L-24;CL组:CL-48、CL-96、CL-120、CL-192、CL-240、CL-288;BC组:BC-48、BC-96、BC-120、BC-192、BC-240、BC-288。
新鲜大黄鱼运至实验室后用无菌纱布擦干水分后装入封口袋,分别置于不同的流通条件下贮藏。在各采样点取样进行感官评定、色差、质构、TVB-N、K值、菌落总数和低场核磁共振的测定。
1.3.2 感官评定
参考SC/T 3101—2010《鲜大黄鱼、冻大黄鱼、鲜小黄鱼、冻小黄鱼》的感官要求与胡申才等[13]的大黄鱼感官评定方法,由5名有经验的本专业感官人员从大黄鱼的色泽、气味和质地3个方面进行评价。采用5分制:5分代表最佳品质,1分代表最差品质,其感官评定分值为3项分数之和(11~15分为品质较好;6~10分为感官接受;0~5分为不可接受),详细评分标准如表1所示。
表1 大黄鱼感官评定评分标准
Table 1 Criteria for sensory evaluation of Pseudosciaena crocea

好(5分)较好(4分)一般(3分)较差(2分)差(1分)色泽色泽鲜亮色泽鲜亮色泽暗淡色泽暗淡色泽晦暗气味具鲜鱼味,无异味基本无异味稍有异味有明显异味有恶臭味质地肌肉紧实,弹性好纹理清晰肌肉紧实,有弹性纹理清晰肌肉稍软,弹性稍差指压后缓慢复原肌肉软化指压后较难复原肌肉松散指压后不复原
1.3.3 色差测定
取大黄鱼背部肌肉(长×宽×高约为2 cm×2 cm×1 cm),用分光测色仪测定鱼肉的L*值和b*值。每组试验3次重复,取平均值。
1.3.4 质构测定
取大黄鱼背部肌肉(长×宽×高约为2 cm×2 cm×1 cm),使用平底柱形探头P/10进行测定。测试前将样品放置4 ℃下平衡30 min。测定参数设置为:测试前速率1 mm/s,测试速率1 mm/s,测试后速率1 mm/s,测试距离5 mm,形变量50%。每个样品测1次,每组测3个样品。
1.3.5 TVB-N值测定
参照 GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》。具体操作如下:准确称取10.00 g鱼肉,绞碎后加入75 mL蒸馏水,摇匀浸渍30 min。在浸泡好的样品瓶中加入1 g MgO于消化管中,用全自动凯氏定氮仪进行测定,单位以mg/100 g表示。
1.3.6 K值测定
参考郭红霞等[14]的方法,使用高效液相色谱仪测定样品中的ATP关联物,K值的计算如公式(1)所示:
K/%=(HxR+Hx)/(ATP+ADP+AMP+IMP+HxR+Hx)×100
(1)
式中:ATP、ADP、AMP、IMP、HxR、Hx分别代表腺苷三磷酸、腺苷二磷酸、腺苷酸、肌苷酸、次黄嘌呤核苷、次黄嘌呤的含量,μmol/g。
1.3.7 菌落总数测定
参照GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》。称取10 g样品装入盛有90 mL生理盐水的无菌均质袋中,用均质器拍打均匀后进行10倍系列稀释。选择2~3个适宜稀释度接种且在相应条件下培养。30 ℃培养72 h后菌落总数计数,结果以lg CFU/g表示。
1.3.8 低场核磁共振
取大黄鱼背部肌肉(长×宽×高约为2.5 cm×2.5 cm×1 cm),保证每块鱼肉质量相近,使用Q-FID及标准品对机器进行校正,然后使用CPMG脉冲序列采集样品T2(自旋-自旋弛豫时间)信号,每组样品3个平行,每个平行样测3次。
仪器主要参数设置为:共振频率21 MHz,磁体强度0.55 T,磁体-探头:NMI21-60H-I-60 mm,RF Coi3线圈直径60 mm、RF Coil线圈直径60 mm,磁体温度32 ℃,90°射频脉宽13.00 μs,180°射频脉宽26.00 μs,采样频率200 kHz,重复采样间隔时间4 500.00 ms,回波个数8 000,回波时间0.20 ms。
1.3.9 数据处理
试验均进行3次平行,使用Origin 2021软件进行图像绘制,采用SPSS 26.0软件对数据进行显著性分析和相关性分析(P<0.05表示差异显著),结果采用平均值±标准偏差表示。
2 结果与分析
2.1 感官评价
模拟流通过程中大黄鱼的感官评定结果如图2所示。
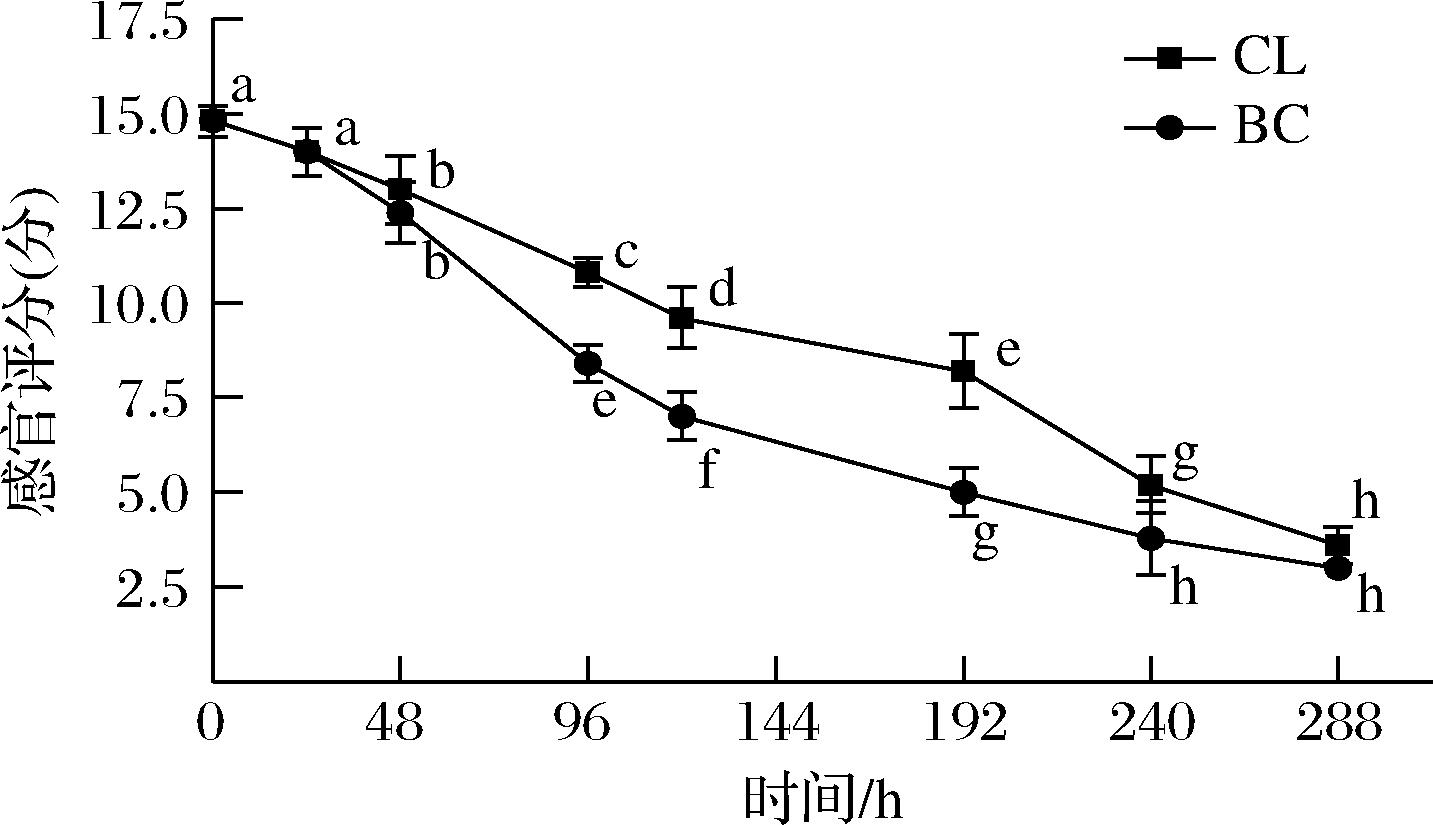
图2 大黄鱼流通过程中感官分值的变化
Fig.2 Changes in sensory scores of P. crocea in the circulation
注:不同小写字母表示组间差异显著(P<0.05)(下同)。
大黄鱼初始感官分值为14.80±0.40,随着贮藏时间的延长逐渐下降。CL组在贮藏96 h内感官品质较好,贮藏240 h之后才变为不可接受。与CL组相比,BC组在48~240 h各采样时间节点的样品感官评分下降幅度均显著增大(P<0.05),在贮藏72 h后由品质良好变为感官接受,失去鱼体原有光泽和弹性并逐渐散发出腥臭味,192 h后已变为不可接受。在流通过程中由于自身酶的分解和微生物的作用改变了鱼肉蛋白质和脂质等特性,从而影响气味、色泽和鱼肉质地;BC组比CL组感官评分降幅更大说明频繁的温度波动更加加速了微生物生长,促使鱼肉中的蛋白质快速分解产生了异味,极大地降低了大黄鱼在流通后期的感官品质。王倩等[6]的研究中也得出温度波动加速大黄鱼样品腐败进程的结论。
2.2 色差分析
色泽是评价鱼肉品质优劣的重要指标之一,根据鱼肉的色泽可判断其新鲜程度[15]。如图3所示,随着流通时间的延长,CL组和BC组样品的亮度值(L*值)呈下降趋势,与新鲜样品(0 h)相比差异显著(P<0.05)。L*值的下降说明大黄鱼鱼肉肉质的光泽度随着流通时间的增加逐渐降低,这可能是由于肌肉组织中高铁肌红蛋白和高铁血红蛋白在流通期间发生氧化,在大黄鱼鱼肉的表面积累导致鱼肉发生褐变反应[16]。当样品流通至48和98 h时,BC组样品的L*值均比上个采样点显著下降(P<0.05),且在经历频繁温度波动后的BC组样品L*值与CL组相比差异显著(P<0.05),说明频繁的温度波动对大黄鱼鱼肉L*值影响显著。在流通后期,CL组L*值下降幅度减小,而BC组下降幅度不变且略有增大。流通过程中大黄鱼样品的黄度值(b*值)如图4所示,大黄鱼为白肉鱼,贮藏初始b*值为-3.60±0.17,随着流通过程的延长,2组样品的b*值呈现上升趋势,在贮藏后期上升趋势渐缓。BC组样品b*值在配送运输过程(48~120 h)表现出明显上升趋势,而CL组变化不显著(P<0.05),可能是由于温度波动加速了鱼肉中脂肪氧化使肉色发黄,而稳定低温贮藏能减缓鱼肉的氧化变色[17]。

图3 大黄鱼流通过程中L*值的变化
Fig.3 Changes in L* value of P. crocea in the circulation
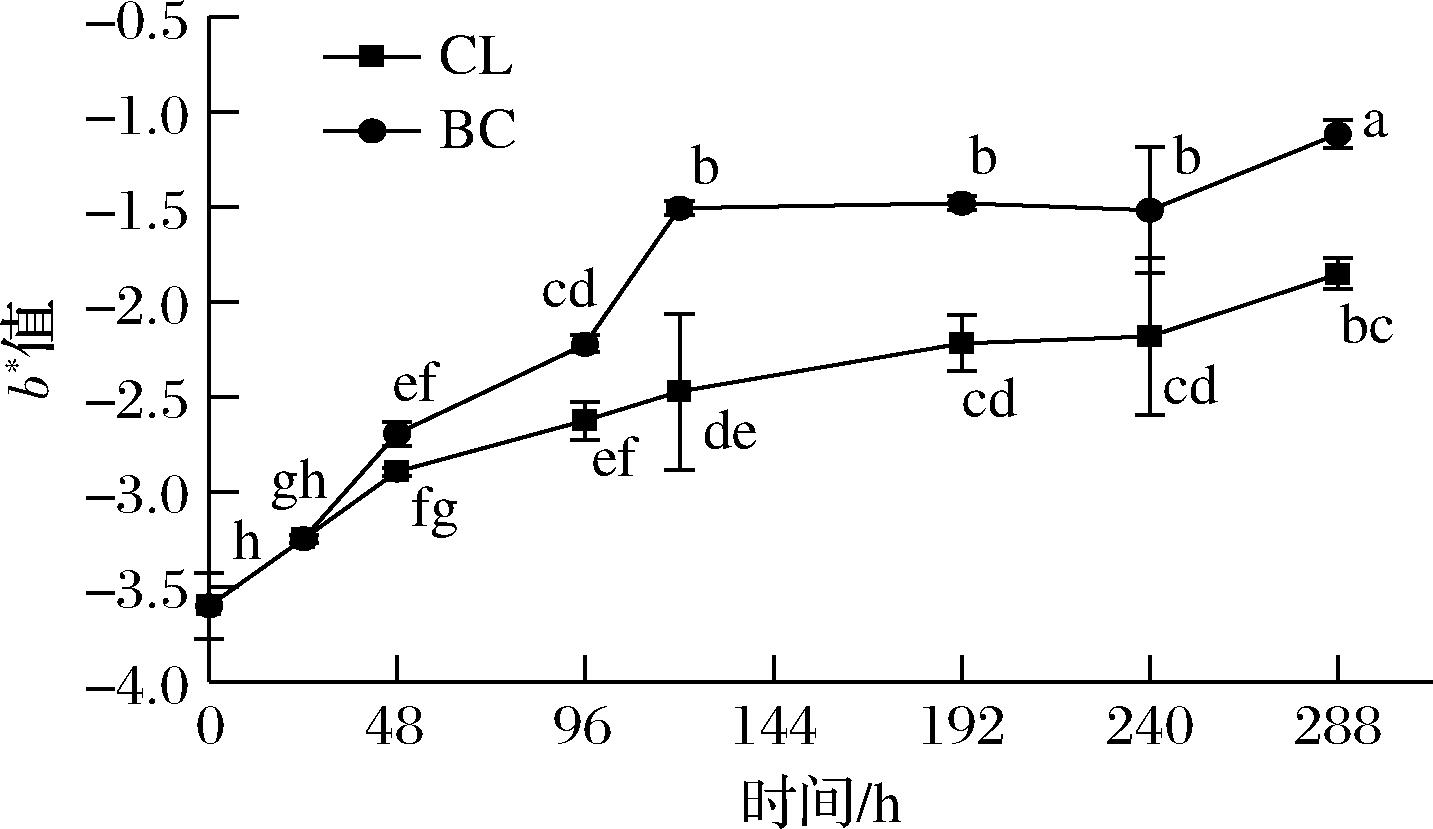
图4 大黄鱼流通过程中b*值的变化
Fig.4 Changes in b* value of P. crocea in the circulation
2.3 质构分析
质构是衡量水产品品质的重要指标,其数值客观反映了鱼肉组织的状态及其食用价值[18]。大黄鱼流通过程中鱼肉质构指标变化如表2所示,随着流通时间的延长,2组大黄鱼样品的硬度、弹性、咀嚼性均呈现下降趋势,这是因为水产品在贮藏过程中鱼体内的蛋白质在酶和微生物的共同作用下分解成肽和氨基酸,肌纤维蛋白和肌肉结缔组织遭到破坏,造成鱼肉软化[19]。随着贮藏时间的不断延长,大黄鱼各质构指标的数值均呈现下降趋势。其中咀嚼性是出现显著变化最早的指标,2组大黄鱼的咀嚼性分别在贮藏96和48 h后出现明显下降。BC组大黄鱼的硬度和弹性在贮藏96 h后,与贮藏初期相比显著降低,而CL组大黄鱼样品则分别在贮藏120和240 h后才呈现明显差别。由此可见,维持贮藏期间温度的稳定能有效延缓大黄鱼鱼肉硬度、弹性等质构特性的改变。
表2 大黄鱼流通过程中质构指标的变化
Table 2 Changes in texture indexes of P. crocea in the circulation

时间/h 硬度/N弹性/mm咀嚼性/mJCLBCCLBCCLBC0594.18±38.11a594.18±38.11a0.60±0.04a0.60±0.04a84.92±0.73a84.92±0.73a24585.14±17.01a585.14±17.01a0.59±0.04ab0.59±0.04ab80.65±3.50ab80.65±3.50ab48558.46±14.44abc548.17±18.42abc0.58±0.02ab0.55±0.02abc79.44±3.12abc74.58±2.98bcd96536.00±25.73abcd520.98±39.48bcd0.55±0.02abc0.52±0.03bcde73.46±3.13cd71.98±4.05d120521.63±20.32bcd507.75±16.75cd0.55±0.01abcd0.52±0.02bcde69.26±1.55d68.83±1.33d192576.84±10.05ab537.83±35.92abcd0.54±0.01abcd0.48±0.01de60.94±1.03e58.26±6.79e240515.67±22.38cd454.19±18.71ef0.50±0.04cde0.47±0.04e58.77±4.15e56.72±0.97ef288485.73±2.12de415.14±28.60f0.48±0.01de0.47±0.03e56.85±0.44ef50.69±3.96f
注:不同小写字母表示各指标组间有显著性差异(P<0.05)(下同)。
2.4 TVB-N值分析
TVB-N指标是反映鱼肉新鲜度的主要指标,通过测定贮藏过程中蛋白质和非蛋白氮物质被分解产生伯胺、仲胺、氨以及其他挥发性碱性含氮化合物的总量来判断鱼肉的状态[20]。SC/T 3101—2010《鲜大黄鱼、冻大黄鱼、鲜小黄鱼、冻小黄鱼》规定,TVB-N含量<13 mg/100 g为一级品,13~30 mg/100 g为合格品,>30 mg/100 g为不合格品。由图5可知,大黄鱼在流通初期时TVB-N含量为(10.48±0.39) mg/100 g,为一级品品质。随着流通时间的延长,TVB-N含量不断增加。BC组样品贮藏48 h后TVB-N值上升至(13.37±0.31) mg/100 g,品质由一级品下降至合格品,在贮藏240 h后,BC组样品超出合格品范围,开始初期腐败。与BC组相比,CL组样品TVB-N值上升缓慢,在贮藏24 h后每个采样时间节点的TVB-N值均显著低于BC组(P<0.05),流通120 h内品质始终控制在一级品的范围内,且在流通末期样品仍属于合格品。这说明温度波动对大黄鱼TVB-N含量有显著影响,可能是温度频繁波动会有利于细菌的生长繁殖和提高内源酶的活性,加速蛋白质降解产生更多伯胺、仲胺等胺类物质。
图5 大黄鱼流通过程中TVB-N值的变化
Fig.5 Changes in TVB-N values of P. crocea in the circulation
2.5 K值分析
鱼类死亡后其肌肉的三磷酸腺苷(ATP)会发生一系列的生化反应,肌肉中的ATP会依次降解为ADP、AMP、IMP、HxR和Hx。HxR和Hx所占比例越高,鱼的腐败程度越高即鲜度越低。一般来说,新鲜鱼K值<20%,K值在20%~40%为二级鲜度,在60%~80%则处于初期腐败[21]。由图6可知,流通初期(0~24 h)大黄鱼样品K值为(6.85±0.02)%和(8.29±0.35)%,属于一级鲜度。随着流通时间的延长,大黄鱼样品K值呈先缓慢再快速增长的趋势,BC组样品在96 h后降为二级鲜度,192 h后开始初期腐败;CL组样品在流通120 h时降为二级鲜度,在288 h时K值增长为(56.61±0.23)%,但仍属于二级鲜度,说明大黄鱼在冷链过程中能维持良好的鲜度品质。

图6 大黄鱼流通过程中K值的变化
Fig.6 Changes in K value of P. crocea in the circulation
2.6 菌落总数
根据水产行业标准SC/T 3101—2010《鲜大黄鱼、冻大黄鱼、鲜小黄鱼、冻小黄鱼》规定,当菌落总数<104时,表示一级鲜度;104~106时,表示二级鲜度;菌落总数>106时,表示腐败变质。当菌落总数增加到107~108 CFU/g时,便会感到强烈的腐败臭味[22]。大黄鱼流通过程菌落总数变化如图7所示,初始样品菌落总数为(3.53±0.03) lg CFU/g,表明鱼肉具有良好的品质,属于一级鲜度。随着贮藏时间的延长,样品的菌落总数不断增加。CL组的菌落总数在流通至120 h时为(5.65±0.05) lg CFU/g,其品质仍属于二级鲜度;BC组样品贮藏至120 h时,菌落总数已达到(6.47±0.01) lg CFU/g,超出二级品的范围,说明温度波动有利于微生物的生长繁殖[23]。
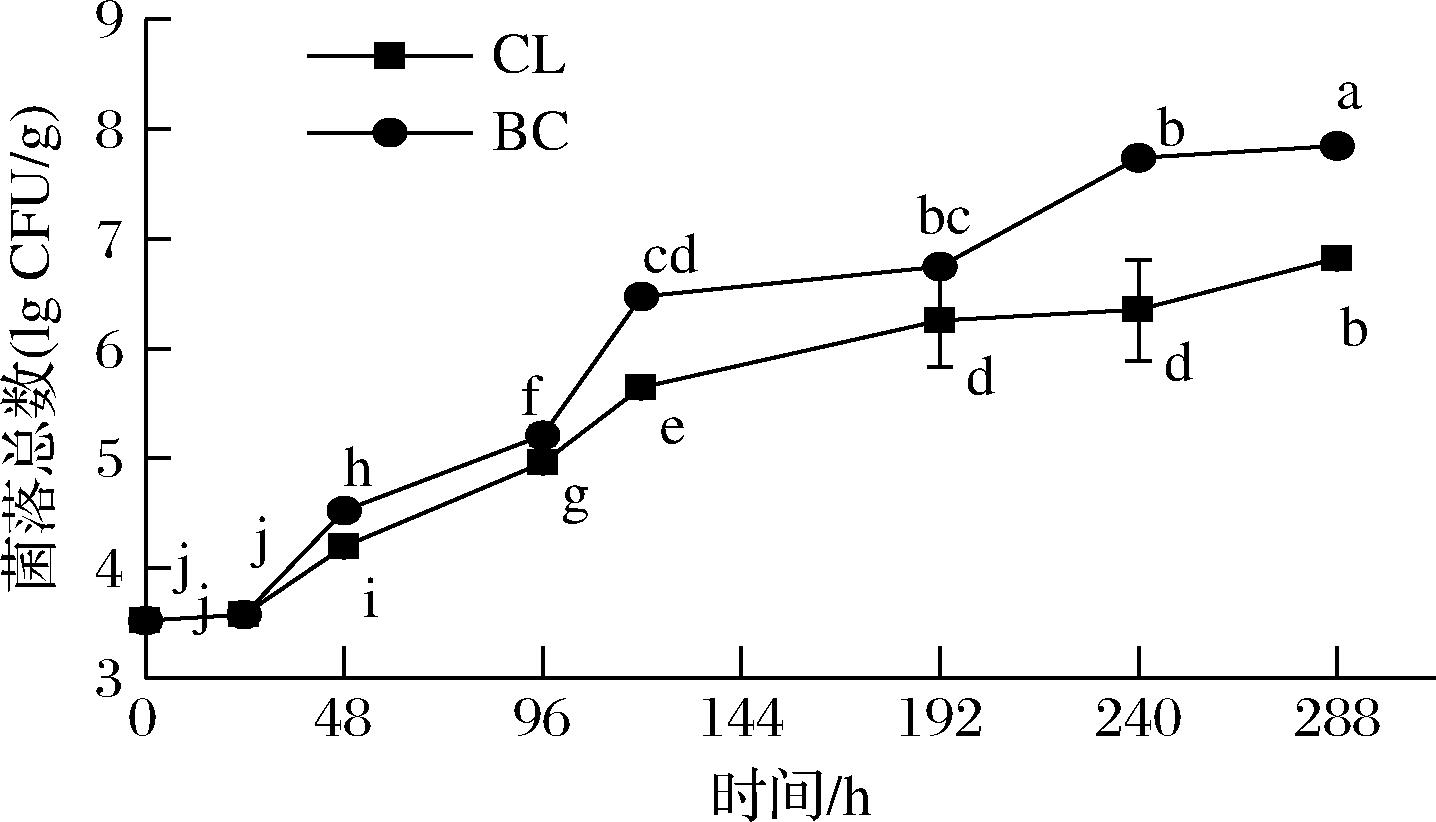
图7 大黄鱼流通过程中菌落总数的变化
Fig.7 Changes in total number of colonies of P. crocea in the circulation
2.7 低场核磁共振分析水分及含量变化
由图8可知,经NMR自身软件反演后的图谱出现了4个波峰,分别代表大黄鱼样品中存在的强结合水(T2b)、弱结合水(T21)、不易流动水(T22)和自由水(T23)。其中,大分子结构中存在的水用T2b(T2<1 ms)表示,与大分子物质结合的水用T21(1~10 ms)表示,不易流动水用T22(30~100 ms)表示,自由水用T23(T2>100 ms)表示。随着流通时间的延长,2组大黄鱼T22幅值呈下降趋势,T2b和T21幅值先增加后减小,T23幅值无明显变化。2组样品T2b和T21弛豫时间有向右移动的趋势,且BC组较CL组右移趋势明显,说明流通过程中结合水与大分子物质之间的作用力逐渐变弱,结合水稳定性下降。

图8 大黄鱼流通过程中弛豫时间(T2)的变化
Fig.8 Changes in relaxation time (T2) of P. crocea in the circulation
由表3可知,随着流通时间的延长,2组大黄鱼样品的结合水面积(A2b+A21)先减少后增加,不易流动水面积(A22)整体呈下降趋势,自由水面积(A23)随流通时间有一定的波动,整体上呈升高趋势,可能是由于流通时间的延长,鱼肉肌原蛋白纤维分子空间结构发生变化,即高级构象发生改变,导致部分不易流动水与蛋白的结合能力减弱,继而转化为自由水流出[24]。沈秋霞等[25]在冷藏虹鳟鱼片中也发现相似结论,随着贮藏时间延长不易流动水比例减少而自由水比例增加。贮藏至48 h和流通后期(120~192 h),CL组与BC组样品结合水面积(A2b+A21)差异显著(P<0.05),说明温度波动对鱼肉内结合水影响较大。
表3 大黄鱼流通过程中3种状态水分峰面积的变化
Table 3 Changes in water peak areas in three states of P. crocea in the circulation

时间/h A2b+A21A22A23CLBCCLBCCLBC0202.18±7.02ef202.18±7.02ef5 927.60±37.83abc5 927.60±37.83abc73.10±1.34f73.10±1.34f24166.69±5.50hi166.69±5.50hi6 061.19±240.57abc6 061.19±240.57abc113.33±7.16ab113.33±7.16ab48166.63±3.93hi207.68±2.16e5 866.82±123.51abc5 810.02±48.33bcd83.29±10.53ef79.78±1.35ef96160.95±3.03i165.34±8.35hi6 101.24±172.48ab6 187.57±27.24a70.82±3.42f75.50±1.38f120242.30±6.06c226.88±12.58d6 093.60±30.49ab6 092.28±31.12ab105.41±2.37abc104.25±12.29abc192279.44±4.56a260.01±2.27b6 006.52±66.10abc5 984.09±23.85abc92.41±3.97de83.45±1.57ef240264.89±9.22b261.67±5.07b5 747.57±150.05cd5 551.23±82.00d119.59±14.14b134.22±7.41a288189.49±4.15fg179.51±7.05gh5 795.32±261.06bcd5 924.94±134.22abc87.15±11.62ef95.44±5.02cde
2.8 相关性分析
大黄鱼流通过程中不同状态水分峰面积和品质指标的相关性分析如表4所示,CL组与BC组大黄鱼的结合水峰面积(A2b+A21)与感官评分、L*值、咀嚼性呈显著负相关(P<0.05),与菌落总数呈显著正相关(P<0.05),其中CL组的结合水峰面积(A2b+A21)与咀嚼性和菌落总数呈极显著差异(P<0.01);BC组大黄鱼的不易流动水峰面积(A22)和自由水峰面积(A23)均与TVB-N值和K值呈显著相关(P<0.05)。这是由于随着流通时间的延长,鱼肉蛋白质氧化降解加剧,肌肉组织结构被破坏,不易流动水流动性增强,自由水含量增加。由相关性分析可知,鱼肉内的不同水分状态的含量变化会影响鱼肉的感官品质、色泽(L*值和b*值)、咀嚼性及食用品质。因此,可以运用低场核磁共振技术测定不同状态水分含量来表征大黄鱼在低温流通期间的品质变化。
表4 大黄鱼流通过程中不同状态水分峰面积和 品质指标的相关性分析
Table 4 Correlation analysis of water peak area and quality indexes in different states of P. crocea in the circulation

指标组别A2b+A21A22A23感官评分CL-0.420∗0.336-0.265BC-0.432∗0.327-0.381L∗值CL-0.410∗0.058-0.34 BC-0.3140.111-0.376b∗值CL 0.437∗-0.154 0.233BC0.421∗-0.139 0.326硬度CL-0.058 0.147-0.246BC-0.1740.258-0.428∗弹性CL-0.318 0.261-0.241BC-0.3760.202-0.288咀嚼性CL-0.582∗∗0.219-0.293BC-0.434∗0.265-0.381
续表4

指标组别A2b+A21A22A23TVB-N值CL0.299-0.3680.181BC0.377-0.449∗0.445∗K值CL0.317-0.3830.256BC0.372-0.442∗0.477∗菌落总数CL 0.589∗∗-0.2110.254BC0.479∗-0.2280.372
注:**表示是在0.01水平上显著相关,*表示在0.05水平上显著相关。
3 结论
随着贮藏时间的延长,大黄鱼的感官评分、L*值呈下降趋势,b*值、TVB-N、K值和菌落总数呈上升趋势,其中断链组样品的各鲜度指标变化速度比同一采样时间节点冷链组样品更快。在物流过程中应严格控制贮藏、运输、销售过程的温度,尽量避免温度波动。采用LF-NMR技术能够准确分辨大黄鱼在冷链物流中不同水分的迁移情况,随着流通时间的延长,大黄鱼T22幅值呈下降趋势,T2b和T21幅值先增加后减小。经相关性分析得出,结合水峰面积与菌落总数、感官品质、色泽(L*值和b*值)、咀嚼性的指标呈显著相关,不易流动水峰面积和自由水峰面积均与TVB-N值和K值呈显著相关。因此,利用低场核磁共振技术可快速判断鱼肉品质变化的程度。
[1] 杨华, 陆森超, 张慧恩, 等.超高压处理对养殖大黄鱼风味及品质的影响[J].食品科学, 2014, 35(16):244-249.
YANG H, LU S C, ZHANG H E, et al.Effects of high hydrostatic pressure processing on the flavor and quality of cultured yellow croaker (Pseudosciaena crocea)[J].Food Science, 2014, 35(16):244-249.
[2] 中华人民共和国农业农村部. 中国渔业统计年鉴[M].北京:中国农业出版社, 2022.
Ministry of Agriculture and Rural Affairs of the People’s Republic of China.China Fishery Statistics Yearbook[M].Beijing:China Agriculture Press, 2022.
[3] 王一帆, 宋晓燕, 刘宝林.冷藏期间温度波动对三文鱼片品质的影响[J].食品与发酵科技, 2016, 52(1):24-27;32.
WANG Y F, SONG X Y, LIU B L.Effect of different temperature fluctuations on quality changes of salmon fillets during the cold storage[J].Food and Fermentation Technology, 2016, 52(1):24-27;32.
[4] LORENTZEN G, AGEEVA T N, HEIDE M, et al.Temperature fluctuations in processing and distribution:Effect on the shelf life of fresh cod fillets (Gadus morhua L.)[J].Food Control, 2020, 112:107102.
[5] 傅丽丽, 高原, 林敏, 等.温度波动及电子束辐照对冷冻大黄鱼品质与货架期的影响[J].核农学报, 2017, 31(12):2350-2357.
FU L L, GAO Y, LIN M, et al.Effect of temperature fluctuations and electron beam irradiation on quality and the shelf life of frozen large yellow croaker[J].Journal of Nuclear Agricultural Sciences, 2017, 31(12):2350-2357.
[6] 王倩, 蓝蔚青, 张墨言, 等.冷链与断链流通对冰藏大黄鱼品质与微生物多样性的影响[J].中国食品学报, 2019, 19(9):221-229.
WANG Q, LAN W Q, ZHANG M Y, et al.Effects of cold chain and broken-off cold chain on the quality and microbial diversity of large yellow croaker (Pseudosciaena crocea) stored in ice[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(9):221-229.
[7] 周卓颖, 谢超, 俞群娣, 等.基于低压核磁共振(LF-NMR)技术对东海带鱼(Trichiurus lepturus)保鲜品质及水分迁移特性的研究[J].海洋与湖沼, 2022, 53(2):440-447.
ZHOU Z Y, XIE C, YU Q D, et al.Study on preservation and water retention in hairtail Trichiurus lepturus from the East China Sea in LF-NMR technology[J].Oceanologia et Limnologia Sinica, 2022, 53(2):440-447.
[8] 孙文彬, 罗欣, 张一敏, 等.低场核磁共振在肉与肉制品水分测定与分析中的应用研究进展[J].食品科学, 2019, 40(15):346-351.
SUN W B, LUO X, ZHANG Y M, et al.A review of the application of low field nuclear magnetic resonance in detection and analysis of water in meat and meat products[J].Food Science, 2019, 40(15):346-351.
[9] 汪经邦, 李沛韵, 谢晶, 等.不同贮藏温度对暗纹东方鲀水分迁移、质构和色泽的影响及其货架期预测[J].食品与发酵工业, 2020, 46(6):73-81.
WANG J B, LI P Y, XIE J, et al.Effects of different temperatures on moisture migration,texture and color of Takifugu obscures during storage and the prediction of shelf-life[J].Food and Fermentation Industries, 2020, 46(6):73-81.
[10] 王硕, 谢晶, 杨凯, 等.三文鱼冷链流通过程中质构、鲜度及感官品质变化规律与水分迁移相关性[J].中国食品学报, 2018, 18(5):173-184.
WANG S, XIE J, YANG K, et al.The correlation between water distribution and texture, freshness and sensory quality of salmon during low temperature logistics[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(5):173-184.
[11] 汪春玲, 付仁豪, 裴志胜, 等.基于低场核磁共振技术研究新微冻气调罗非鱼片水分迁移与品质变化的相关性[J].食品科学, 2020, 41(21):182-188.
WANG C L, FU R H, PEI Z S, et al.Correlation between water migration analyzed by low-field nuclear magnetic resonance and quality change of modified atmosphere packaged tilapia fillets during superchilled and frozen storage[J].Food Science, 2020, 41(21):182-188.
[12] S NCHEZ-ALONSO I, MORENO P, CARECHE M.Low field nuclear magnetic resonance (LF-NMR) relaxometry in hake (Merluccius merluccius, L.) muscle after different freezing and storage conditions[J].Food Chemistry, 2014, 153:250-257.
NCHEZ-ALONSO I, MORENO P, CARECHE M.Low field nuclear magnetic resonance (LF-NMR) relaxometry in hake (Merluccius merluccius, L.) muscle after different freezing and storage conditions[J].Food Chemistry, 2014, 153:250-257.
[13] 胡申才, 楚乐乐, 周敏.假单胞菌噬菌体PrH-181对大黄鱼块防腐效果的研究[J].食品工业科技, 2021, 42(6):288-291;324.
HU S C, CHU L L, ZHOU M.Antiseptic effect of Pseudomonas bacteriophages PrH-181 on large yellow croaker meat[J].Science and Technology of Food Industry, 2021, 42(6):288-291;324.
[14] 郭红霞, 冯涛, 戚文元, 等.电子束辐照对储藏期间三文鱼鲜度的影响[J].保鲜与加工, 2020, 20(6):14-19;24.
GUO H X, FENG T, QI W Y, et al.Effects of electron beam irradiation on freshness of salmon during storage[J].Storage and Process, 2020, 20(6):14-19;24.
[15] 赵永强, 李娜, 李来好, 等.鱼类鲜度评价指标及测定方法的研究进展[J].大连海洋大学学报, 2016, 31(4):456-462.
ZHAO Y Q, LI N, LI L H, et al.Research advancements in assessment indicators and measurement methods of fish freshness:A review[J].Journal of Dalian Ocean University, 2016, 31(4):456-462.
[16] DESAI M A, JOSEPH P, SUMAN S P, et al.Proteome basis of red color defect in channel catfish (Ictalurus punctatus) fillets[J].LWT-Food Science and Technology, 2014, 57(1):141-148.
[17] 黄卉, 郑陆红, 李来好, 等.不同预冷温度对鲈鱼冰藏期间质构和色差的影响[J].食品工业科技, 2018, 39(24):302-308.
HUANG H, ZHENG L H, LI L H, et al.Effects of different precooling temperature on texture and color of Micropterus salmoides during ice storage[J].Science and Technology of Food Industry, 2018, 39(24):302-308.
[18] 蓝蔚青, 胡潇予, 李诗慧, 等.冷藏处理方式对大目金枪鱼贮藏品质及内源酶活性的影响[J].中国食品学报, 2020, 20(2):237-247.
LAN W Q, HU X Y, LI S H, et al.Effect of refrigerated treatment methods on the quality change and endogenous enzyme activity of big-eye tuna(Thunnus obesus)[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(2):237-247.
[19] 刘婧懿, 赵前程, 程少峰, 等.鱼肉质构的影响因素及测定方法研究进展[J].食品安全质量检测学报, 2020, 11(9):3035-3043.
LIU J Y, ZHAO Q C, CHENG S F, et al.Research progress on the influencing factors and determination methods of fish muscle texture[J].Journal of Food Safety &Quality, 2020, 11(9):3035-3043.
[20] ABDOLLAHI M, REZAEI M, FARZI G.Influence of chitosan/clay functional bionanocomposite activated with rosemary essential oil on the shelf life of fresh silver carp[J].International Journal of Food Science &Technology, 2014, 49(3):811-818.
[21] 马聪聪, 张九凯, 卢征, 等.水产品新鲜度检测方法研究进展[J].食品科学, 2020, 41(19):334-342.
MA C C, ZHANG J K, LU Z, et al.A review of methods for freshness detection of aquatic products[J].Food Science, 2020, 41(19):334-342.
[22] 王亚会, 王锡昌, 王帅, 等.水产品新鲜及腐败程度的评价指标[J].食品与发酵工业, 2015, 41(10):240-246.
WANG Y H, WANG X C, WANG S, et al.Advances in freshness and corruption of aquatic product[J].Food and Fermentation Industries, 2015, 41(10):240-246.
[23] 黄文博, 谢晶, 罗超, 等.冷链物流中温度波动对美国红鱼品质变化的影响[J].食品科学, 2016, 37(18):268-274.
HUANG W B, XIE J, LUO C, et al.Effect of temperature fluctuation on quality changes of red drum(Sciaenops ocellatus) in cold chain logistics[J].Food Science, 2016, 37(18):268-274.
[24] 蓝蔚青, 胡潇予, 阮东娜, 等.流化冰处理对南美白对虾冰藏期间品质与水分迁移变化的影响[J].食品科学, 2019, 40(9):248-255.
LAN W Q, HU X Y, RUAN D N, et al.Effect of slurry ice on the quality and water mobility of pacific white shrimps (Litopenaeus vannamei) during storage[J].Food Science, 2019, 40(9):248-255.
[25] 沈秋霞, 朱克永, 李明元, 等.低场核磁结合电子鼻判定复合保鲜剂对冷藏虹鳟鱼片品质变化的影响[J].食品与机械, 2019, 35(12):130-136.
SHEN Q X, ZHU K Y, LI M Y, et al.LF-NMR combined with electronic nose to analyze the quality changes of refrigerated rainbow trout treated with composite preservative[J].Food & Machinery, 2019, 35(12):130-136.