胶原蛋白与人类生活息息相关,在诸多领域起着非常重要的作用[1],例如:在食品领域,因其良好的乳化效果、胶质功能以及分散作用,在食品加工过程中有重要地位[2];在医疗领域内,可制备胶原医用敷料、胶原手术缝合线等用于烧伤、创伤治疗[3];又因其特有的结构组成及特性,还可用作美容化妆品原料[4]。
胶原蛋白在动物体内含量多且分布广,约占体内总蛋白质的25%~30%,因此在传统提取工艺中,胶原蛋白的主要来源为陆生动物,如猪、牛等的皮肤、骨骼中分离获得[5],但由于陆生的畜禽源胶原蛋白酸溶解性相对较低,提取程度不高,在提取过程中容易造成原料的浪费。并且,近年来牛海绵状脑病(bovine spongiform encephalopathy,BSE)、口蹄疫(foot-and-mouth disease,FMD)以及禽流感(avian influenza,AI)等疾病的爆发,使得陆地生物胶原蛋白产品的安全性备受质疑。此外,受部分宗教信仰的影响,如猪源胶原蛋白就不能作为某些食品的添加成分[6]。根据上述原因,我们迫切地需要找到可靠的胶原蛋白替代来源。
在众多替代来源中,鱼类因其疾病传播风险小、暂无宗教障碍、鱼皮胶原蛋白含量达80%以上等特点,成为了胶原蛋白制备所需的新原料[7]。不仅如此,在鱼类加工过程中产生大量的副产物如鱼皮、鱼鳞、鱼骨、内脏等,约占原始原料的50%~70%,这些副产物往往用作饲料或低价值的化肥等,处理不当还可能因其恶臭污染环境[8]。
近几年关于从鱼皮中提取胶原蛋白的研究很多,但仍存在提取率低[9-11],提取时间长[7],提取产物分子质量分布宽[12]等问题,因此有必要对其提取分离工艺进行细致地研究。
本论文的目的是采用酸法和酶法从乌鳢鱼皮中提取胶原蛋白,考察了酶解的条件(如酶用量、料液比、提取时间、酸浓度等)对胶原蛋白提取率的影响,制备出具有完整三螺旋结构,分子质量大(>300 kDa)的胶原蛋白,并对其相关性能进行测试和分析。
1 材料与方法
1.1 实验材料
原材料:以乌鳢为研究对象,购买自南京高新开发区水产批发市场。
主要试剂:NaOH、无水乙醇,分析纯,国药集团化学试剂有限公司;浓盐酸,分析级,上海凌峰化学试剂有限公司;冰醋酸,分析纯,上海申博化工有限公司;胃蛋白酶(从猪胃中提取),西格玛-奥德里奇生化科技有限公司(分子质量为35 kDa,酶活力为400 U/mg protein,最适pH值为2.0~4.0);羟脯氨酸标品试剂盒,北京索莱宝科技有限公司;5E-MAC 6710灰分测定仪测定,长沙开元仪器有限公司。
1.2 实验方法
1.2.1 原料预处理
将采购的新鲜鱼皮用自来水反复冲洗,去除表面残留的鱼鳞、鱼肉、血渍等杂质,然后切成适当大小放入冰箱-20 ℃储存备用。实验前,鱼皮解冻,然后纯水洗涤2~3遍,沥干,接着用8倍体积的0.1 mol/L NaOH溶液进行浸泡,每隔8 h换1次溶液,并且在更换新鲜溶液前,用纯水将鱼皮冲洗干净,共进行3次。然后将鱼皮浸泡在体积分数为20%乙醇溶液中24 h(不断搅拌,每隔6 h更换1次乙醇溶液),去除鱼皮中的脂肪、色素等杂质,最后用纯水将鱼皮上的乙醇溶液洗涤干净,沥干备用。
1.2.2 乌鳢鱼皮中胶原蛋白提取工艺研究的单因素试验
醋酸可以较好地溶解胶原蛋白,且不易引起胶原蛋白的进一步降解[13],此外,加入醋酸后,溶液呈现酸性,pH值为4.0以下,正好处于胃蛋白酶的最适pH范围内,因此本研究也以醋酸为提取剂,并考察各因素对鱼胶原蛋白提取率的影响。
1.2.2.1 醋酸浓度对胶原蛋白提取率的影响
取预处理后的乌鳢鱼皮各1 g置于锥形瓶中,向锥形瓶中加入30 mL浓度分别为0.1、0.3、0.5、0.7、1.0 mol/L的醋酸溶液,将料液混合物置于25 ℃振荡培养箱中振荡取提48 h。提取上清液0.5 mL进行消化,检测其中羟脯氨酸浓度,并计算胶原蛋白提取率。
1.2.2.2 料液比对胶原蛋白提取率的影响
取预处理后的乌鳢鱼皮各1 g置于锥形瓶中,以0.5 mol/L醋酸进行提取,改变料液比(g∶mL)分别为1∶10、1∶20、1∶30、1∶40、1∶50、1∶70,将料液混合物置于25 ℃振荡培养箱中振荡取提48 h。取提取上清液0.5 mL进行消化,检测其中羟脯氨酸浓度,并计算提取率,得出不同料液比与胶原蛋白提取率的关系。
1.2.2.3 酶用量对胶原蛋白提取率的影响
取预处理后的乌鳢鱼皮各1 g置于锥形瓶中,加入30 mL 0.5 mol/L 醋酸溶液。然后加入一定量的胃蛋白酶进行提取,并将料液混合物置于25 ℃振荡培养箱中振荡取提24 h。加酶量分别为鱼皮质量的0.1%、0.25%、0.5%、1%、2.5%、5%。结束后取上清液0.5 mL进行消化,测定提取液中羟脯氨酸的浓度。
1.2.2.4 提取时间对胶原蛋白提取率的影响
取预处理后的乌鳢鱼皮40 g置于烧杯中,酶用量以物料质量1%添加,向烧杯中加入2 L 0.5 mol/L醋酸溶液,将料液混合物于常温下不断搅拌,自开始提取后24、36、48、60、72、84 h为时间节点取样,取0.5 mL上清液进行消化,检测其中Hyp浓度,并计算胶原蛋白提取率,分析得出提取时间对胶原蛋白提取率的影响。
1.2.3 正交试验
以单因素结果为依据建立因素水平表(表1),以胶原蛋白提取率为评判指标,按照L9(34)正交表来进行试验优化方案的设计。
表1 正交试验因素水平设计表
Table 1 Factors and levels of orthogonal experimental

水平醋酸浓度/(mol/L)料液比/(g∶mL)酶用量/%提取时间/h10.31∶300.12420.51∶500.53630.71∶701.048
1.2.4 成品胶原蛋白的制备
按照上述胶原蛋白的提取方法,提取液用NaCl溶液进行盐析,最终溶液中NaCl的浓度为0.1~0.9 mol/L,然后于4 ℃冷藏10 h以上,以使提取液中胶原蛋白充分析出,提高其收率。用真空抽滤的方法收集析出的胶原蛋白沉淀,然后用约5~10倍体积的0.5 mol/L的醋酸溶液复溶,再装入截留分子质量为8 000 Da的透析袋中,利用纯水进行透析,中间换水3~4次,当透析液的电导率<50 us/cm时停止透析。透析后的胶原蛋白冻干,得到胶原蛋白成品。
1.2.5 羟脯氨酸含量的测定及蛋白质提取率的计算
取一定体积的提取液或一定质量的胶原蛋白固体装入具塞的玻璃消化管中,然后加入2 mL 6 mol/L的HCl溶液在110 ℃下水解24 h,消解并冷却至室温后用10 mol/L NaOH调节其pH为中性,纯水定容至10 mL,取上清液通过羟脯氨酸试剂盒进行显色反应,最后用酶标仪测量。
羟脯氨酸是胶原蛋白特有的氨基酸。羟脯氨酸的含量乘以相应的换算系数就可以得到样品中胶原蛋白的含量,羟脯氨酸与胶原蛋白的比例按14.3[14]进行计算,由此可测得蛋白质的浓度,鱼皮中的水分测得约为66%,按公式(1)、公式(2)计算胶原蛋白的提取率:
ρ蛋白=ρHyp×14.3
(1)
提取率![]()
(2)
式中:ρHyp,提取液中羟脯氨酸的质量浓度,g/L;ρ蛋白,提取液中蛋白质的质量浓度,g/L;m鱼皮,初始鱼皮的质量,g;V,提取液的体积,L。
1.2.6 胶原蛋白的表征
1.2.6.1 水分、灰分的测定
在105 ℃下烘干至恒重,测得水分。550 ℃下保持5 h测得灰分,均采用自动快速水分、灰分测定仪测定。
1.2.6.2 胶原蛋白圆二色谱测定
室温下利用圆二色光谱仪对胶原溶液在190~340 nm范围内进行扫描。测定胶原溶液时,将胶原溶于0.5 mol/L乙酸溶液配成0.5 g/L的溶液,利用1 mm光径的石英比色皿对质量浓度为0.1 mg/mL胶原溶液进行扫描。
1.2.6.3 氨基酸组成
取胶原蛋白粉20 mg于EP管中,加入6 mol/L HCl溶液,在110 ℃下水解24 h后,过滤,取滤液0.1 mL 并稀释至1 mL,通过氨基酸全自动分析仪测定样品的氨基酸组分及其含量。
1.2.6.4 聚丙烯酰胺凝胶电泳SDS-PAGE
本实验采用的是8%分离胶和5%浓缩胶(均为质量分数),胶原蛋白用0.5 mol/L醋酸溶解,配成1 g/L溶液[15]。在β-巯基乙醇的存在下,将样品(约20 μL)与缓冲溶液[60 mmol/L Tris-HCl,pH=8.0,包含25%甘油,2%SDS,0.1%溴酚蓝(均为质量分数)]以4∶1(体积比)的比例混合。取蛋白质Marker 10 μL,上样量10 μL。将电压调至60 V,约0.5 h后再将电压调整至110 V,1 h后待溴酚蓝前沿与凝胶相距1 cm左右,结束电泳。取出分离胶于考马斯亮蓝溶液中染色,染色0.5 h后用去离子水冲洗多次,再用脱色液处理,直到背景干净透明即可。
2 结果与分析
2.1 羟脯氨酸含量的测定
采用酶标仪,测得羟脯氨酸的标准曲线为y=0.030 7x, 其线性范围为:0~30 mg/L,回归系数R2=0.999 8(图1)。线性范围低,说明该方法灵敏度高,而回归系数高,说明线性相关程度较高,采用该方法对溶液中的羟脯氨酸进行测定较为准确[16]。
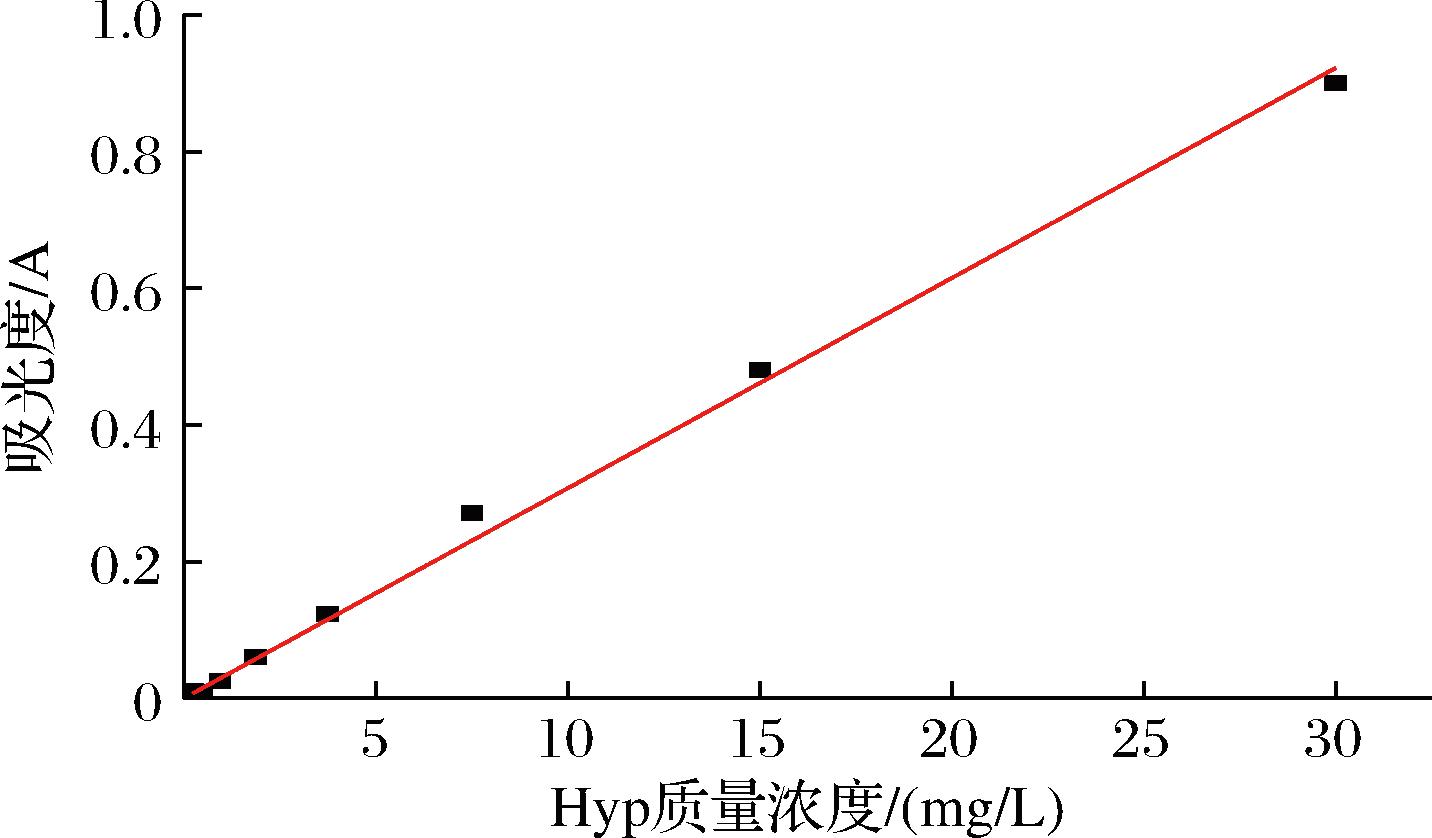
图1 羟脯氨酸标准曲线
Fig.1 Hydroxyproline standard curve
2.2 醋酸浓度对胶原蛋白提取率的影响
如图2所示,随着醋酸浓度升高,提取率随之逐步增加,但增加趋势趋于平缓。提取剂使用0.5 mol/L 醋酸的提取率为25.34%,与之相较,当醋酸浓度升高至1.0 mol/L时提取率为29.09%。提取剂浓度翻了1倍而提取率仅提高了3.75个百分点。由此综合考虑经济效益与提取效率,醋酸浓度为0.5 mol/L较好,既保证了较高的提取率,同时尽可能降低制备成本。LIU等[11]采用酸法和酶法依次从马鲛鱼皮中提取胶原蛋白,得率分别为13.68%和3.49%,总得率为17.17%。本文仅采用醋酸,提取率能达到25%以上,相对较高。

图2 醋酸浓度对胶原蛋白提取率的影响
Fig.2 Effect of acetic acid concentration on the extraction rate
2.3 料液比对胶原蛋白提取率的影响
如图3所示,随着提取剂用量的增加,提取率呈上升趋势,当料液比为1∶50时提取率达到峰值(35.25%)。当提取剂用量继续增加时,提取率开始呈下降趋势,这是由于用醋酸提取鱼皮中的胶原蛋白,主要是为了使鱼皮中的胶原蛋白充分溶出,随着醋酸溶液与鱼皮的比例增大,溶出的胶原蛋白随之增多,因此提取率不断提高。但料液比超过1∶50后,胶原蛋白的提取率反而略有降低,这是由于鱼皮的浓度降低,使得胶原蛋白的提取率下降[17]。
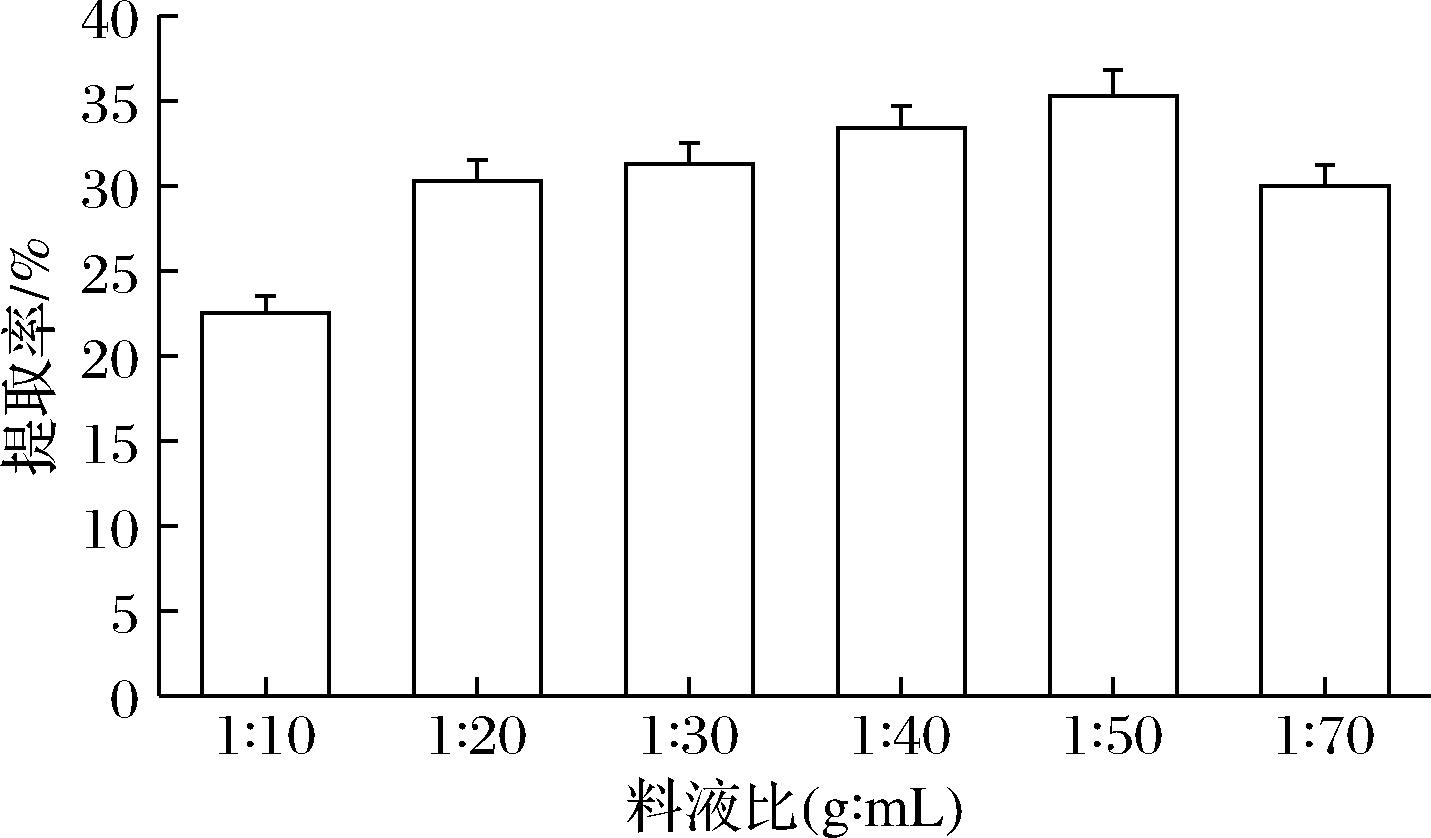
图3 料液比与提取率的关系
Fig.3 The relationship between solid-liquid ratio and extraction rate
2.4 酶用量对胶原蛋白提取率的影响
如上所述,仅采用醋酸提取,需要的时间较长(48 h),且存在部分不能完全溶于醋酸的鱼皮碎块。利用酶对底物高度的特异性,合理用酶可以大幅提高提取效率。其中胃蛋白酶可将胶原蛋白的端肽解聚,增加其在水溶液中的溶解度,但对胶原蛋白的主体结构无影响,且其最适pH值为2~4,因此适合与酸法组合,提高鱼皮中胶原蛋白的提取率。此方法制备所得胶原蛋白主要为酸溶性胶原蛋白和酶促溶性胶原蛋白。如图4所示,胶原蛋白提取率随酶用量的增加而升高。当酶用量超过1%之后,提取率随酶用量的增加不明显。此外,从图5可知,提取24 h胶原蛋白的提取率已达到33%。综合考虑,采用酸法和酶法结合的提取效果较好。
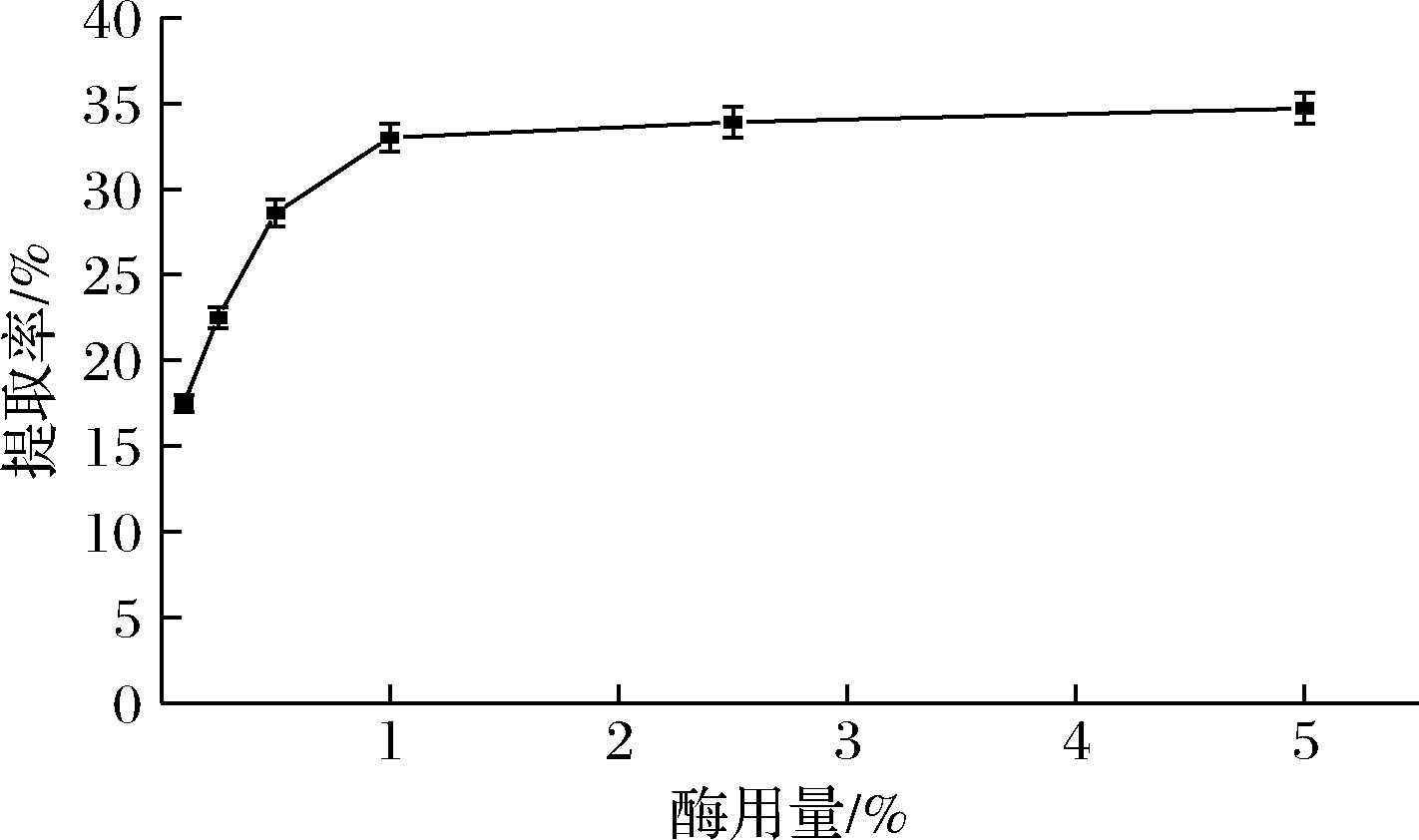
图4 酶用量与提取率的关系
Fig.4 The relationship between enzyme dosage and extraction rate
2.5 提取时间对胶原蛋白提取率的影响
胶原蛋白端肽的解聚及其溶出速率较慢,提取时间也是影响胶原蛋白溶出的主要因素之一。在鱼皮原料粉碎程度相同,其余提取条件一致的前提下,提取时间对胶原蛋白提取率的影响如图5所示。当提取时间达到48 h,胶原蛋白的提取率达到42.6%以上,在60 h达到45.2%。随着时间的进一步增长,胶原蛋白提取率仍在增长,但增长的趋势减缓。结合提取率与成本因素考虑,提取时间为48 h较好。

图5 提取时间与提取率的关系
Fig.5 The relationship between the extraction time and extraction rate
2.6 正交试验
根据单因素试验,选取了醋酸浓度、提取时间、料液比以及酶用量4个因素,进行四因素三水平的正交试验,结果如表2所示,4个因素对胶原蛋白提取率影响大小顺序为:提取时间>酶用量>醋酸浓度>料液比,最优条件组合为A2B3C3D3,即最佳的提取条件为醋酸浓度0.5 mol/L、提取时间48 h、酶用量为1%、料液比1∶70。按照最优条件进行验证试验,测得胶原蛋白提取率为51.2%,高于表2中各组合的胶原蛋白提取率,说明了该方法可靠,因此可用于优化胃蛋白酶酶解提取胶原蛋白的最佳提取工艺条件。
表2 正交试验结果
Table 2 Orthogonal test results

因素A(醋酸浓度)B(提取时间)C(酶用量)D(料液比)实验结果/%实验1111130.2实验2122242.1实验3133346.5实验4212338.9实验5223145.7实验6231241.5实验7313235.6实验8321340.2实验9332143.8均值139.6034.9037.3039.90均值242.0342.6741.6039.73均值339.8743.9342.6041.87极差2.439.035.302.13优先水平A2B3C3D3主次因素B>C>A>D
2.7 胶原蛋白的表征
2.7.1 胶原蛋白的各项参数测定
采用酸法和酶法结合的方式从鱼皮中提取胶原蛋白,从表3中的数据可知,乌鳢鱼皮的蛋白质含量较高,达到了88.6%,经过酸法和酶法提取后,蛋白质的含量(干基)提高至98.0%,而羟脯氨酸的含量也提高至7.1%。此外,胶原蛋白经过盐析以及透析后,灰分仅为0.35%,说明透析过程中可将无机盐基本去除。这些指标已达到山西省地方标准DB 61/T 1202—2018《I型胶原蛋白通用技术要求》。
表3 胶原蛋白各项参数测定结果 单位:%
Table 3 Measurement results of collagen parameters

蛋白质水分灰分羟脯氨酸(干基)蛋白质(干基)乌鳢鱼皮66.10.865.0688.6胶原蛋白6.60.357.198.0
2.7.2 胶原蛋白圆二色谱的测定
如图6所示,在224 nm左右,出现一个正吸收峰,这是胶原蛋白三螺旋结构的特征圆二色谱峰。该结果与罗非鱼皮中胶原蛋白的圆二色谱特征峰基本一致[3]。由此,我们得出通过酸法和酶法提取的胶原蛋白三螺旋结构较为完整。
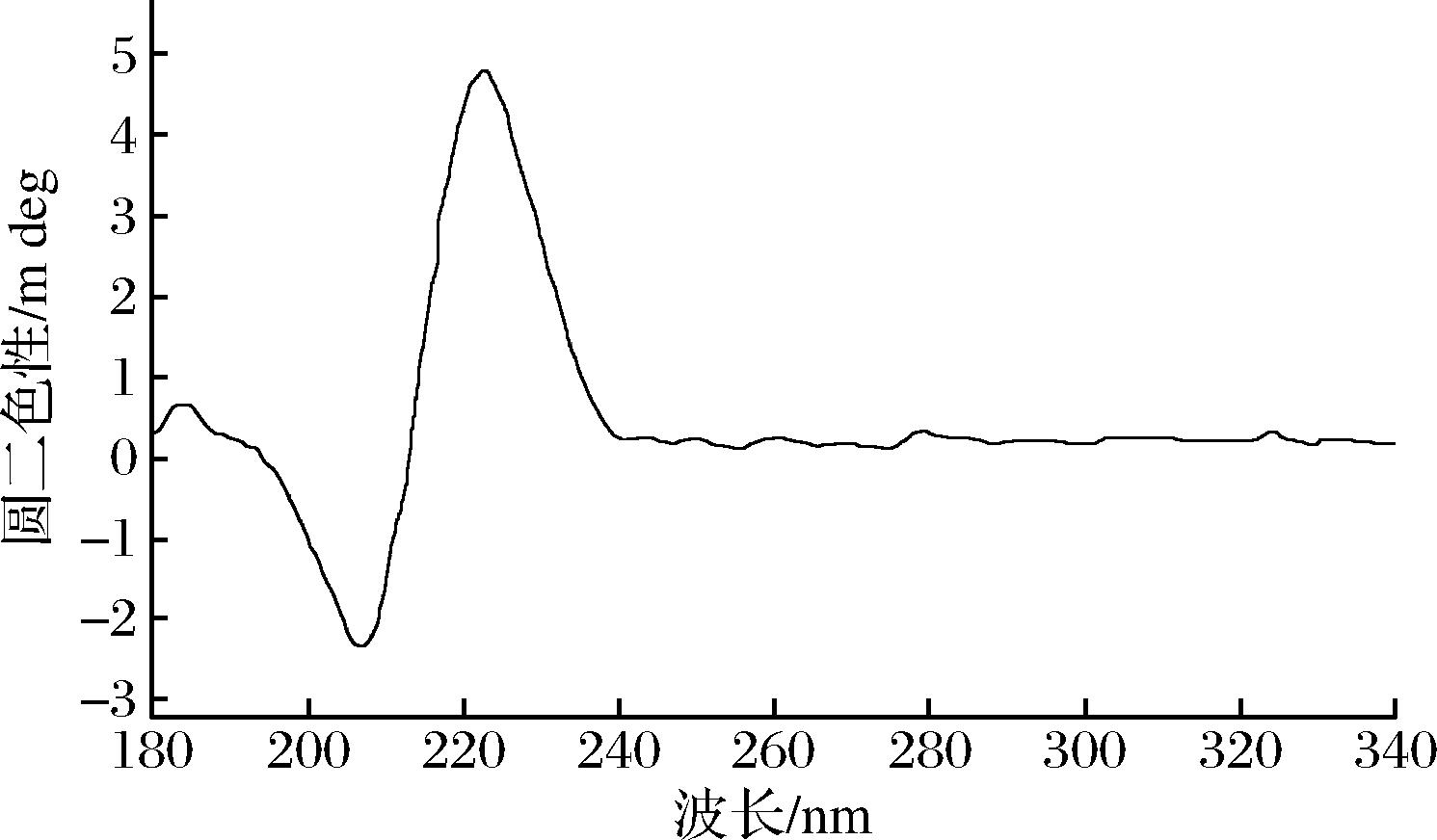
图6 胶原蛋白的圆二色谱
Fig.6 Circular dichroism of collagen
2.7.3 胶原蛋白的氨基酸组成分析
从表4中的数据可知,胶原蛋白富含其特征氨基酸,如甘氨酸为17.81 mg/100 mg(湿重)、羟脯氨酸为6.17 mg/100 mg、脯氨酸为9.63 mg/100 mg,丙氨酸为7.80 mg/100 mg以及谷氨酸为7.43 mg/100 mg。主要氨基酸的含量大小为:甘氨酸>脯氨酸>丙氨酸>谷氨酸>羟脯氨酸,这些结果与CHEN等[9]从罗非鱼皮中提取得到的胶原蛋白结果略有差异,其主要氨基酸含量大小为:甘氨酸>丙氨酸>脯氨酸>羟脯氨酸>谷氨酸。含有疏水性氨基酸的肽(例如丙氨酸、苏氨酸、缬氨酸、脯氨酸、异亮氨酸、亮氨酸、蛋氨酸和苯丙氨酸)通常会产生更强的血管收缩素转化酶(angiotensin converting enzyme,ACE)抑制活性,因为它们的疏水性多肽使它们能够进入ACE的活性位点[18]。乌鳢鱼皮中提取得到的胶原蛋白富含这些氨基酸,其总含量为26.16 mg/100 mg。这表明胶原蛋白可以用于抗氧化肽和抗高血压肽的原料。
表4 胶原蛋白的氨基酸组成
Table 4 Amino acid composition of collagen
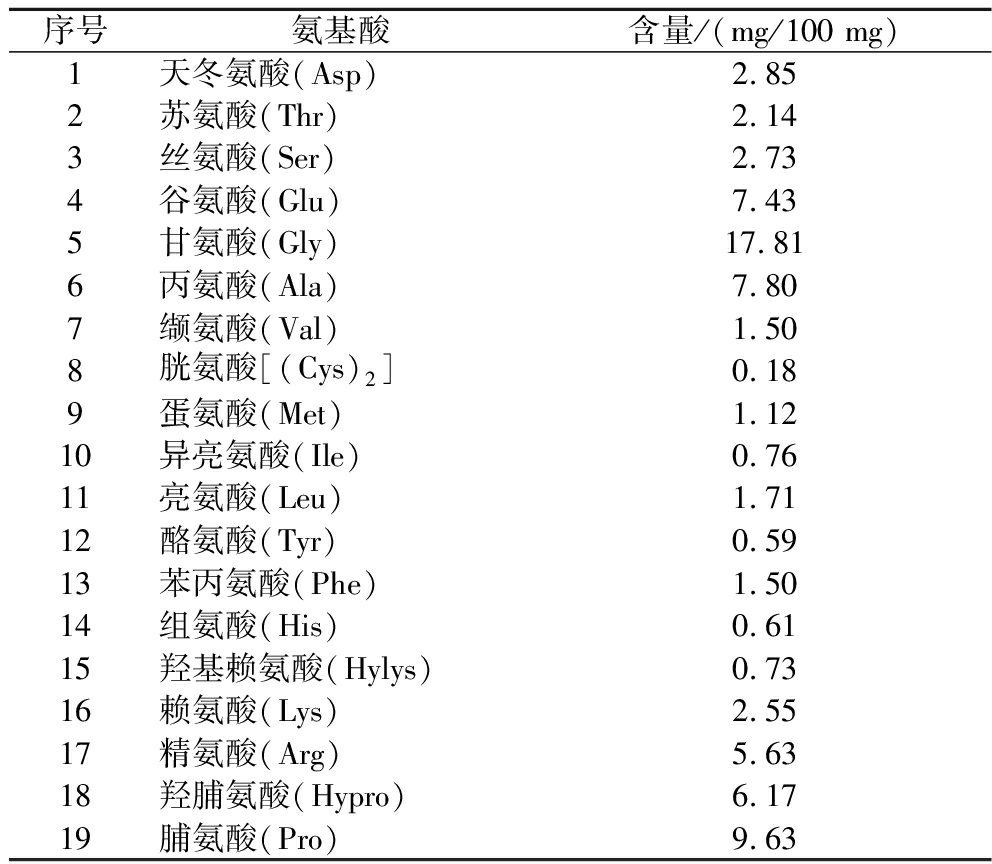
序号氨基酸含量/(mg/100 mg)1天冬氨酸(Asp)2.852苏氨酸(Thr)2.143丝氨酸(Ser)2.734谷氨酸(Glu)7.435甘氨酸(Gly)17.816丙氨酸(Ala)7.807缬氨酸(Val)1.508胱氨酸[(Cys)2]0.189蛋氨酸(Met)1.1210异亮氨酸(Ile)0.7611亮氨酸(Leu)1.7112酪氨酸(Tyr)0.5913苯丙氨酸(Phe)1.5014组氨酸(His)0.6115羟基赖氨酸(Hylys)0.7316赖氨酸(Lys)2.5517精氨酸(Arg)5.6318羟脯氨酸(Hypro)6.1719脯氨酸(Pro)9.63
2.7.4 聚丙烯酰胺凝胶电泳SDS-PAGE
乌鳢鱼皮胶原蛋白凝胶电泳图谱如图7所示,由电泳图谱可知,制备所得胶原蛋白与胶原蛋白I型标品的电泳图一致,均包含2种α-肽链(α1和α2)和1条β-肽链(α肽链的二聚体)。这说明提取得到的胶原蛋白属于I型胶原,分子质量约为340 kDa。此外,在图谱中发现,胶原蛋白中还存在分子质量<100 kDa的肽链,可能是部分胶原蛋白α-肽链在提取过程中降解成更低分子质量的肽链。

图7 乌鳢鱼皮胶原蛋白的SDS-PAGE图谱
Fig.7 SDS-PAGE pattern of collagen from snakehead fish skin
注:1-marker;2-胶原蛋白Ⅰ型标准品(牛跟腱); 3-乌鳢皮胶原蛋白。
3 结论
采用酸法和酶法结合,从乌鳢鱼皮中提取得到胶原蛋白,最优条件为:鱼皮与0.5 mol/L醋酸以1∶70比例混合,按鱼皮质量的1%加入胃蛋白酶,提取48 h,提取率可达到51.2%。后续通过盐析和透析、冻干得到海绵状的胶原蛋白。其蛋白质含量>95%, 羟脯氨酸>5%,灰分<1%。圆二色谱和聚丙烯酰胺凝胶电泳显示制备得到的胶原蛋白为I型胶原蛋白,其三螺旋结构较为完整,分子质量约为340 kDa。氨基酸组成分析结果表明,其富含胶原蛋白的特征氨基酸,如甘氨酸、脯氨酸、羟脯氨酸以及谷氨酸。该提取方法简单易行,具有一定的应用前景。
[1] 王聪艳. 金枪鱼鱼皮胶原蛋白的分离制备、性质及应用研究[D].大连:大连工业大学, 2019.
WANG C Y.Isolation, preparation, properties and application of collagen from tuna fish skin[D].Dalian:Dalian Polytechnic University, 2019.
[2] 周纷, 张艳霞, 张龙, 等.鱼类加工副产物的食用化及其在鱼肉重组制品中的应用[J].食品科学, 2019, 40(11):295-302.
ZHOU F, ZHANG Y X, ZHANG L, et al.Application of edible fish byproducts in restructured fish products[J].Food Science, 2019, 40(11):295-302.
[3] 宋宗元. 罗非鱼鱼皮胶原肽的制备与生物活性研究[D].厦门:集美大学, 2014.
SONG Z Y.Preparation of tilapia skin collagen peptide and its biological activity[D].Xiamen:Jimei University, 2014.
[4] 张静怡. 罗非鱼胶原蛋白与生物组织相互作用关系的研究[D].上海:上海海洋大学, 2019.
ZHANG J Y.Study on the interactions between biological tissues and Tilapia collagen[D].Shanghai:Shanghai Ocean University, 2019.
[5] 李杰. 鱼源胶原蛋白的制备、性能分析及其自聚集构建生物材料的研究[D].青岛:青岛科技大学, 2017.
LI J.Study on the preparation and property analysis of fish collagen and bio-materials constructed through its self-assembly[D].Qingdao:Qingdao University of Science &Technology, 2017.
[6] LI Z R, WANG B, CHI C F, et al.Isolation and characterization of acid soluble collagens and pepsin soluble collagens from the skin and bone of Spanish mackerel (Scomberomorous niphonius)[J].Food Hydrocolloids, 2013, 31(1):103-113.
[7] LIU H Y, LI D, GUO S D.Studies on collagen from the skin of channel catfish (Ictalurus punctaus)[J].Food Chemistry, 2007, 101(2):621-625.
[8] 周垚卿, 董静雯, 何强.鱼类主要副产物的提取与利用[J].食品安全质量检测学报, 2019, 10(13):4284-4289.
ZHOU Y Q, DONG J W, HE Q.Extraction and utilization of major by-products from fish[J].Journal of Food Safety &Quality, 2019, 10(13):4284-4289.
[9] CHEN J D, LI L, YI R Z, et al.Extraction and characterization of acid-soluble collagen from scales and skin of tilapia (Oreochromis niloticus)[J].LWT-Food Science and Technology, 2016, 66:453-459.
[10] 鲜雪梅, 冯冲, 郭雨慧, 等.不同方法提取鲫鱼鱼皮胶原蛋白的比较研究[J].食品安全导刊, 2021(36):153-157;161.
XIAN X M, FENG C, GUO Y H, et al.Comparative study on extraction of colloid protein from crucian carp skin by different methods[J].China Food Safety Magazine, 2021(36):153-157;161.
[11] LIU S X, LI Z H, YU B, et al.Recent advances on protein separation and purification methods[J].Advances in Colloid and Interface Science, 2020, 284:102254.
[12] 崔浩, 牟玉洁, 王凯, 等.基于酶解-膜分离集成的胶原蛋白肽分子量控制技术[J].过程工程学报, 2018, 18(2):427-433.
CUI H, MOU Y J, WANG K, et al.Preparation of collagen peptides with controllable molecular weight range based on enzymatic degradation coupled with membrane separation[J].The Chinese Journal of Process Engineering, 2018, 18(2):427-433.
[13] 黄爱妮, 汪海波, 李丽, 等.鲢鱼鱼皮中酸溶性胶原蛋白提取工艺研究[J].食品研究与开发, 2016, 37(16):78-81;86.
HUANG A N, WANG H B, LI L, et al.Study on extraction of acid-soluble collagens from silver carp skin[J].Food Research and Development, 2016, 37(16):78-81;86.
[14] KO ODZIEJSKA I, SIKORSKI Z E, NIECIKOWSKA C.Parameters affecting the isolation of collagen from squid (Illex argentinus) skins[J].Food Chemistry, 1999, 66(2):153-157.
ODZIEJSKA I, SIKORSKI Z E, NIECIKOWSKA C.Parameters affecting the isolation of collagen from squid (Illex argentinus) skins[J].Food Chemistry, 1999, 66(2):153-157.
[15] LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature, 1970, 227(5259):680-685.
[16] 张茜, 卜德懿, 田永鑫, 等.胶原纤维的酶解液中羟脯氨酸含量测定方法的优化[J].皮革科学与工程, 2019, 29(3):25-30.
ZHANG X, BU D Y, TIAN Y X, et al.Optimization of method for determination of hydroxyproline in enzymatic hydrolysate of collagen fibers[J].Leather Science and Engineering, 2019, 29(3):25-30.
[17] 张敏. 酸法和酶法提取齐口裂腹鱼皮胶原蛋白及鉴定性质研究[D].雅安:四川农业大学, 2014.
ZHANG M.Extraction and characterization of ASC and PSC from skin of Schizothorax prenanti (tchang)[D].Ya’an:Sichuan Agricultural University, 2014.
[18] CHEUNG H S, WANG F L, ONDETTI M A, et al.Binding of peptide substrates and inhibitors of angiotensin-converting enzyme.Importance of the COOH-terminal dipeptide sequence[J].Journal of Biological Chemistry, 1980, 255(2):401-407.