ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)是25~35个L-赖氨酸单体通过α—COOH和ε—NH2缩合形成的一种天然抗菌肽[1]。因其具有广谱抑菌性,在食品防腐领域被广泛研究和应用[2]。另外,它也同样活跃于药物载体、基因载体和新材料等领域,具有广泛的应用前景[3]。
ε-PL目前通过小白链霉菌(Streptomyces albulus)好氧发酵进行工业化生产。以往研究表明,通过发酵过程优化与调控是提升ε-PL生产效率的有效方法。例如,KAHAR等[4]建立了一种分阶段pH值调控策略,在5 L发酵罐的补料分批发酵中实现S.albulus S410的ε-PL产量达到48.30 g/L。REN等[5]提出了一种利用pH冲击提高ε-PL发酵水平的策略,实现5 L发酵罐ε-PL产量达到54.70 g/L;另外,WANG等[6]利用新选育的高产突变株 S.albulus R6,采用pH冲击工艺,实现ε-PL产量突破70.00 g/L。尽管上述发酵策略实现ε-PL产量大幅提升,但存在底物(葡萄糖或甘油)转化率低(10%左右)的问题。利用葡萄糖或甘油做碳源从头合成ε-PL约需要26步胞内生化反应以及众多支路代谢,这可能是转化率低的重要原因。L-赖氨酸是ε-PL合成前体[7],若能实现转化外源L-赖氨酸合成ε-PL将有望解决转化率低的问题,目前尚未见报道。然而,众多研究者探究了外源L-赖氨酸添加对ε-PL发酵的影响。例如,HIROHARA等[8]在培养基中添加11 mmol/L L-赖氨酸可使S.lydicus USE-11的ε-PL产量提升约12.5%,而对Streptomysces sp. USE-51则没有效果。LIU等[9]在培养基中添加3 mmol/L L-赖氨酸使得Streptomyces ahygroscopicus GIM8的ε-PL产量从0.78 g/L 提升到1.16 g/L,但L-赖氨酸消耗较小,仅约为2.0 mmol/L(约0.29 g/L)。LI等[10]也发现在培养基中添加1.00 g/L L-赖氨酸可使Streptomyces diastatochromogenes 6#-7的ε-PL产量提升49.0%。本团队CHEN等[11]在摇瓶中添加2.00 g/L L-赖氨酸使得S.albulus M-Z18的ε-PL产量提升105%,但L-赖氨酸的消耗仅约为0.9 g/L;在5 L发酵罐的补料分批发酵中,从72 h维持1 g/L L-赖氨酸使得ε-PL产量达到37.60 g/L,较对照提升了6.2%。上述研究结果表明,发酵过程中添加外源L-赖氨酸对大部分的ε-PL生产菌有积极作用,但均存在L-赖氨酸利用量低(<2.0 g/L)或ε-PL产量提升不显著(<10%)的问题,说明通过在发酵体系中直接添加L-赖氨酸对提升ε-PL生产效率作用有限。
全细胞转化法是一种利用菌体细胞作为催化剂进行催化的生物合成方法,其本质仍是胞内酶的催化作用。与纯酶催化相比,全细胞转化法生产成本低且拥有完整的酶体系,可在降低生产成本的同时提高催化效率,已被广泛应用于(R)-柠苹酸[12]、胆绿素[13]、D-甘露醇[14]等众多生物制品的生产。基于此,本文以一株ε-PL工业生产菌株S.albulus GS114为研究对象,提出了全细胞转化法生产ε-PL的新方法,并对转化培养基和条件进行了系统优化,在最优体系中实现了S.albulus GS114转化L-赖氨酸大量合成ε-PL。同时,借助合成生物学技术,构建了携带L-赖氨酸特异性通透蛋白基因lysp[15]的工程菌,进一步提升了全细胞转化L-赖氨酸能力和ε-PL生产效率。研究结果一方面说明了通过全细胞转化L-赖氨酸生产ε-PL是可行的,另一方面为S.albulus转化大宗氨基酸L-赖氨酸生产高值ε-PL奠定了坚实的技术基础,具有重要的理论意义和经济价值。
1 材料与方法
1.1 菌株与质粒
本研究所用的菌株和质粒如表1所示。其中S.albulus M-Z18由本实验室保藏,S.albulus GS114由M-Z18诱变而来[18]。大肠杆菌(Escherichia coli) DH5α用作克隆宿主,E.coli ET12567/pUZ8002在接合转移中用作穿梭载体。整合型质粒pIB139用于过表达菌株的构建。
表1 本研究所用菌株和质粒
Table 1 Strains and plasmids used in this study
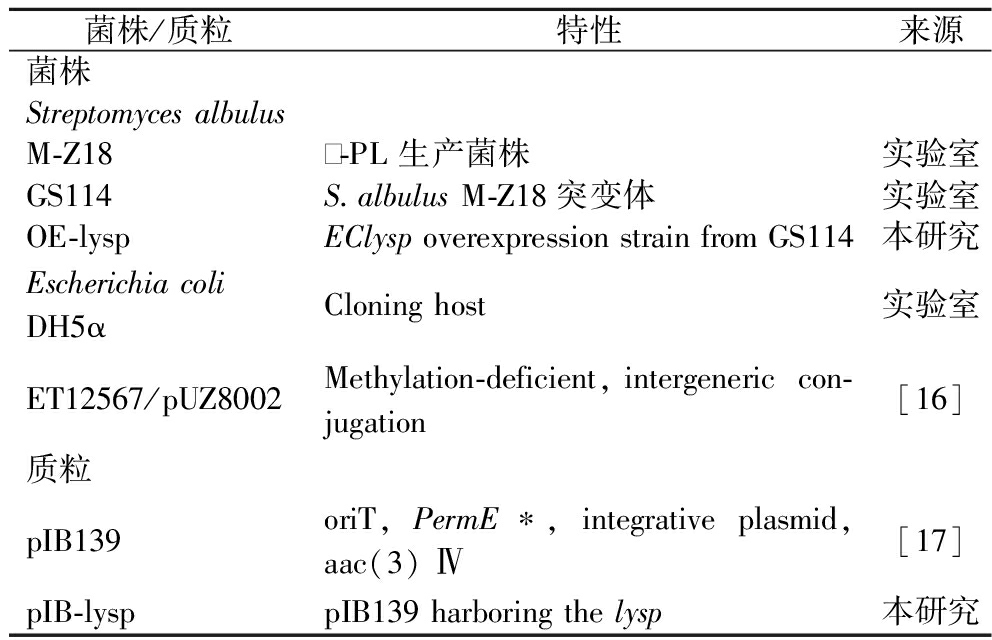
菌株/质粒特性来源菌株Streptomyces albulusM-Z18㔵-PL 生产菌株实验室GS114S.albulus M-Z18突变体实验室OE-lyspEClysp overexpression strain from GS114本研究Escherichia coli DH5αCloning host实验室ET12567/pUZ8002Methylation-deficient,intergeneric con-jugation[16]质粒pIB139oriT, PermE∗, integrative plasmid, aac(3) Ⅳ[17]pIB-lysppIB139 harboring the lysp本研究
1.2 引物
本研究所用引物及其序列如表2所示。
表2 本研究所用引物
Table 2 Sequence of primers used in this study

引物名称引物序列 (5′→3′)用途基因过表达及验证引物lysp-FggttggtaggatccacatATGGTTTCCGAA-ACTAAAACCACAlysp-RcatgattacgaattcgatatcTTATTTCTTAT-CGTTCTGCGGGA扩增 lysp序列;验证qRT-PCR引物qlysp-FCTCAGTTCGTGGCTTTGGTGqlysp-RGTCCAGTTGCTCCAGCCCGCAqRT-PCR for lysp
1.3 试剂与仪器
ClonExpress® MultiS One Step Cloning Kit、2×Phanta® Max Master Mix,南京诺唯赞生物科技有限公司;限制性内切酶、基因组提取试剂盒、片段纯化试剂盒和质粒提取试剂盒,大连TaKaRa公司;Trizol总RNA抽提试剂盒、卡那霉素(Kana)、安普霉素(Am)、氯霉素(Cm)、萘啶酮酸(Nal)、50×TAE缓冲液,上海生物工程股份有限公司;其他试剂均为国产或进口分析纯。
BIOTECH-5BG-7000APCR仪、Gel Doc EZ凝胶成像仪,Bio-Rad公司;DYCP-31DN电泳仪,北京市六一仪器厂;UV-2100微量分光光度计,优尼科仪器有限公司;AB204-N分析天平,瑞士梅特勒公司;GNP-9160恒温培养箱,上海光都仪器设备有限公司;HYL-C组合式摇床,太仓市强乐设备有限公司;SBA-40C生物传感分析仪,山东省科学院生物研究所。
1.4 培养基和培养条件
LB培养基(g/L):NaCl 10.0,胰蛋白胨10.0,酵母提取物5.0,琼脂粉20.0(固体培养基),pH 7.0。此培养基在37 ℃、200 r/min条件下用于大肠杆菌培养。
BTN琼脂培养基(g/L):葡萄糖10.0,蛋白胨2.0,酵母提取物1.0,琼脂20,pH 7.5。此培养基用于链霉菌孢子的生成。
M3G培养基(g/L):葡萄糖 50.0,酵母提取物5.0,(NH4)2SO4 10.0,KH2PO4 1.36,K2HPO4·3H2O 0.8,MgSO4·7H2O 0.5,ZnSO4·7H2O 0.04,FeSO4·7H2O 0.03,pH 6.8。此培养基用于链霉菌种子培养与摇瓶发酵。
MS培养基(g/L):甘露醇20.0,黄豆粉20.0,琼脂20.0。灭菌后加入MgCl2至终浓度10 mmol/L。
2×YT培养基(g/L):胰蛋白胨16.0,酵母提取物10.0,NaCl 5.0,pH 7.0。
菌体生长培养基(g/L):甘油15.0,酵母粉5.0,MgSO4·7H2O 0.5,KH2PO4 0.13,Na2HPO4·12H2O 0.14,pH 6.8。
转化培养基(g/L)(未优化):葡萄糖 60.0,柠檬酸10.0,(NH4)2SO4 10.0,L-赖氨酸8.0,pH 4.5。
转化培养基(g/L)(优化后):葡萄糖80.0,柠檬酸20.0,(NH4)2SO4 6.0,L-赖氨酸15.0,pH 4.0。
以上所有培养基在需要时添加Km、Am、Cm和Nal,终质量浓度分别为50.0、50.0、25.0、25.0 μg/mL。
1.5 发酵方法
种子培养:挑取3环孢子接种至装有80 mL M3G培养基的500 mL锥形瓶,30 ℃、200 r/min,培养24 h。
摇瓶发酵:将种子液以体积分数8%的接种量接入装有40 mL M3G培养基的250 mL锥形瓶,30 ℃、200 r/min,发酵72 h。
全细胞转化:参考两阶段培养法[8]并稍作改动。将种子液以体积分数8%的接种量接入装有80 mL菌体生长培养基的500 mL锥形瓶,30 ℃、200 r/min,培养12 h。5 000 r/min、4 ℃离心8 min收集菌体,弃上清液并用0.85%(质量分数)NaCl溶液等体积清洗菌体1次,相同条件收集菌体并重悬于转化培养基中,随后分装10 mL混合液于25 mL锥形瓶,30 ℃、200 r/min,转化96 h。
1.6 重组菌株的构建
过表达菌株的构建参考张重阳等[19]的方法。首先,以E.coli BL21全基因组为模板,通过引物lysp-F/R PCR扩增得lysp。目标片段纯化后与线性化pIB139(NdeⅠ/EcoRⅠ)质粒连接并转化入E.coli DH5α扩增重组质粒,提取质粒完成双酶切验证并测序。随后,将验证正确的重组质粒转化入E.coli ET12567/pUZ8002,通过接合转移转入S.albulus GS114得OE-lysp[20]。
1.7 RNA提取和实时荧光定量PCR(quantitative real-time-PCR,qRT-PCR)
参考张重阳等[19]的方法。对于每个样本中的目的基因,将对照组(S.albulus GS114)中该基因的转录水平定义为1,结果显示为相对于对照组中的变化倍数。相关基因引物设计见表2。
1.8 检测方法
发酵过程参数测定:ε-PL浓度测定采用甲基橙比色法[21],葡萄糖浓度和L-赖氨酸浓度使用生物传感分析仪进行测定[22],菌体干重测定参照刁文娇等[20]的方法。
2 结果与分析
2.1 培养方式对转化L-赖氨酸合成ε-聚赖氨酸的影响
S.albulus GS114在摇瓶发酵和转化体系的过程参数如图1所示。
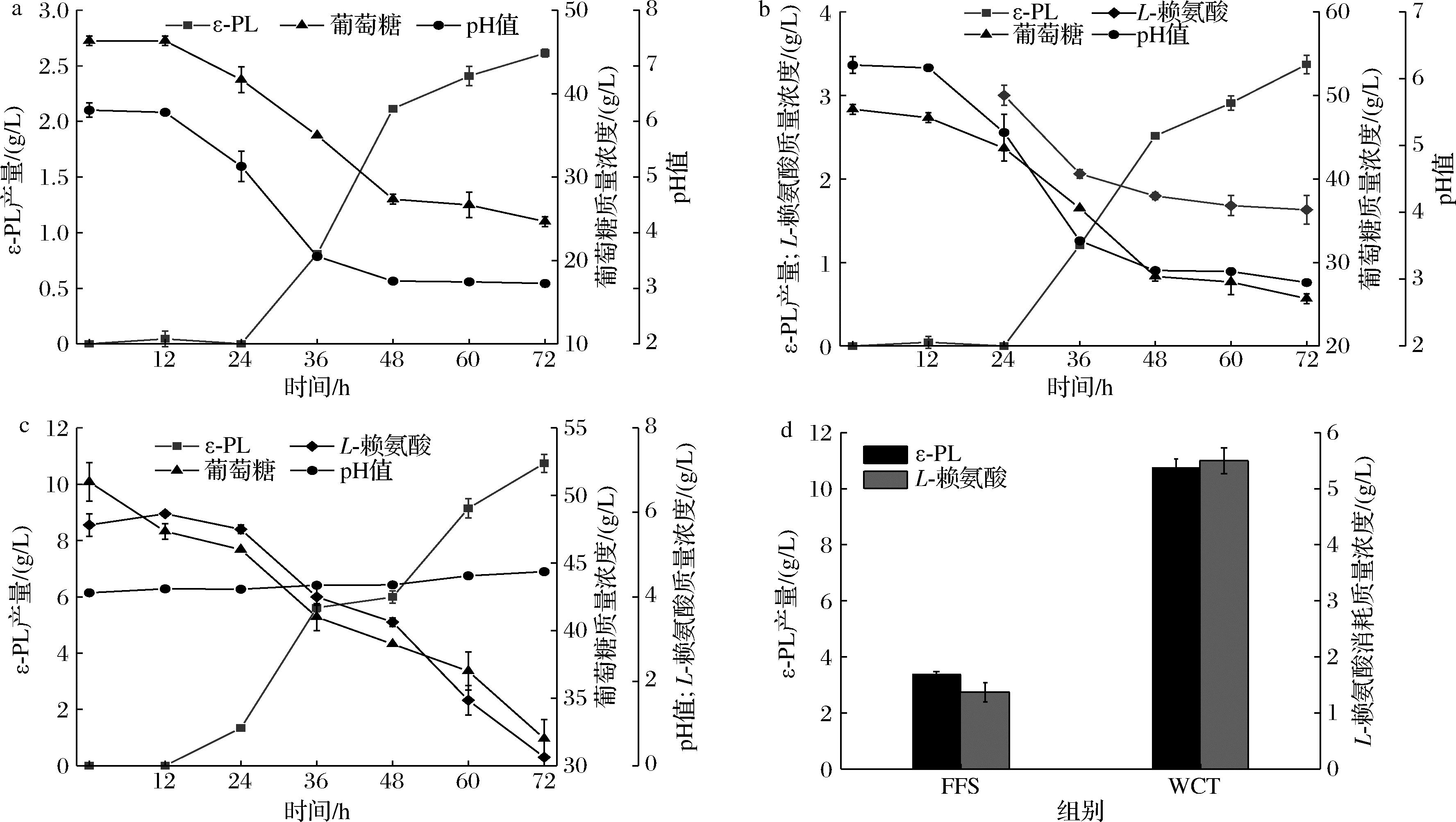
a-摇瓶发酵体系(无L-赖氨酸)发酵过程参数;b-摇瓶发酵体系(有L-赖氨酸)发酵过程参数;c-两阶段转化体系(未优化)发酵过程参数; d-摇瓶发酵体系与转化体系发酵参数对比(FFS:摇瓶发酵体系;WCT:全细胞转化体系)
图1 不同发酵体系对小白链霉菌转化L-赖氨酸合成ε-PL的影响
Fig.1 Effect of different fermentation systems on the transformation of L-lysine to ε-PL synthesis by S.albulus
在摇瓶发酵体系中,随着发酵的进行,培养基pH值在48 h下降至3.0,此后菌株基本不消耗葡萄糖,ε-PL合成也受到严重抑制,最终ε-PL产量为2.71 g/L(图1-a)。在摇瓶发酵体系中添加L-赖氨酸时,低pH也使得葡萄糖、L-赖氨酸利用受到限制(图1-b)。而在全细胞转化体系中,培养基pH值被有效控制在4.00~4.50,最终L-赖氨酸消耗量和ε-PL产量为5.50、10.74 g/L,相较于摇瓶发酵体系分别提升了4.0倍和2.9倍(图1-c和图1-d)。以上结果表明,摇瓶发酵体系pH不可控而产生的低pH环境(≤3.0)使得菌株利用L-赖氨酸的能力显著降低,可能的原因是低pH环境终止了菌株的正常代谢。即便如此,在摇瓶发酵体系中添加的L-赖氨酸仍使得ε-PL产量提升了21.8%,这与LIU等[9]和LI等[10]的结果一致,证明了L-赖氨酸对ε-PL生产具有促进作用。与此同时,全细胞转化体系解决了摇瓶发酵体系中pH不可控的问题,使得L-赖氨酸利用量和ε-PL产量均得到显著提升,展现了其在转化L-赖氨酸合成ε-PL方面的光明前景。
2.2 全细胞转化L-赖氨酸合成ε-聚赖氨酸体系优化
2.2.1 葡萄糖浓度对转化的影响
葡萄糖主要维持菌体的生存,同时也为ε-PL的合成提供部分前体,但过量的葡萄糖会产生抑制作用,因此需要确定合适的葡萄糖浓度。控制菌龄12 h,反应温度30 ℃,L-赖氨酸质量浓度20 g/L,柠檬酸质量浓度20 g/L,初始反应pH 4.5,硫酸铵质量浓度10 g/L,湿菌体量1 600 g/L,在葡萄糖质量浓度分别为60、70、80、90、100 g/L时进行转化。结果如图2-a所示,在葡萄糖质量浓度<90 g/L时,未表现出明显的底物抑制作用,并在80、90 g/L时获得了较高的ε-PL产量,分别为10.20、10.17 g/L。在100 g/L时,底物抑制作用明显,产量下降到8.57 g/L。因此,确定80 g/L的葡萄糖浓度为最佳转化浓度。
2.2.2 菌龄对转化的影响
不同菌龄的菌体通过控制ε-PL合成酶表达量影响ε-PL生产。控制葡萄糖质量浓度80 g/L,反应温度30 ℃,L-赖氨酸质量浓度20 g/L,柠檬酸质量浓度20 g/L,初始反应pH 4.5,硫酸铵质量浓度10 g/L,湿菌体量1 600 g/L,分别利用菌龄8 h(对数中期)、12 h(稳定前期)、16 h(稳定后期)的菌体进行全细胞转化合成ε-PL,结果如图2-b所示。随着菌龄增加,ε-PL产量也逐步提升并在12、18 h获得了较高的ε-PL产量,分别为10.22、10.59 g/L;考虑到18 h较12 h的菌体对ε-PL产量的提升仅为0.36 g/L,故选择最优转化菌龄为12 h。
2.2.3 温度对转化的影响
温度通过影响酶促反应的效率而影响ε-PL的合成。控制葡萄糖质量浓度80 g/L,菌龄12 h,L-赖氨酸质量浓度20 g/L,柠檬酸质量浓度20 g/L,初始反应pH 4.5,硫酸铵质量浓度10 g/L,湿菌体量1 600 g/L,分别在25.0、27.0、30.0、32.0、35.0 ℃下进行全细胞转化合成ε-PL,结果如图2-c所示。随着温度的上升,ε-PL产量呈现先上升后下降的趋势,并在30 ℃时取得最高产量,达到10.90 g/L;在35 ℃时产量较低,仅为2.2 g/L。因此,确定最优转化温度为30 ℃。
2.2.4 L-赖氨酸浓度对转化的影响
L-赖氨酸是ε-PL的直接前体,对ε-PL的合成有着重要影响。控制葡萄糖质量浓度80 g/L,菌龄12 h,反应温度30 ℃,柠檬酸质量浓度20 g/L,初始反应pH 4.5,硫酸铵质量浓度10 g/L,湿菌体量1 600 g/L,在L-赖氨酸质量浓度分别为6、9、12、15、18 g/L时进行转化。结果如图2-d所示,随着L-赖氨酸质量浓度的提升,ε-PL产量呈现先上升后下降的趋势,并在质量浓度15 g/L时获得最高产量,达到13.00 g/L。因此,最佳L-赖氨酸质量浓度为15 g/L。
2.2.5 柠檬酸浓度对转化的影响
柠檬酸与柠檬酸钠组成pH缓冲体系,若柠檬酸不足将导致缓冲体系失效,从而影响ε-PL的生产。控制葡萄糖质量浓度80 g/L,菌龄12 h,反应温度30 ℃,L-赖氨酸质量浓度15 g/L,初始反应 pH 4.5,硫酸铵质量浓度10 g/L,湿菌体量1 600 g/L,在柠檬酸质量浓度分别为 10、15、20、25、30 g/L 时进行转化。结果如图2-e所示,低于20 g/L的柠檬酸浓度对ε-PL产量基本无影响,均取得了较高的产量,分别为13.00、13.10、13.20 g/L。当质量浓度大于20 g/L时,ε-PL产量随柠檬酸浓度的提升而下降,可能的原因是过量的柠檬酸对菌株产生了抑制作用。与此同时,足量的柠檬酸有助于维持缓冲体系稳定性。因此,最终确定最优的柠檬酸质量浓度为20 g/L。
2.2.6 pH对转化的影响
pH值通过控制ε-PL降解酶和合成酶的活性而影响ε-PL生产。控制葡萄糖质量浓度80 g/L,菌龄12 h,反应温度30 ℃,L-赖氨酸质量浓度15 g/L,柠檬酸质量浓度15 g/L,硫酸铵质量浓度10 g/L,湿菌体量1 600 g/L,在初始体系pH值分别为 2.5、3.0、3.5、4.0、4.5、5.0条件下进行转化合成ε-PL。pH对ε-PL生产的影响结果见图2-f,当pH值低于3.0时,ε-PL无法合成;当pH≥3.5时,ε-PL产量随pH的升高呈现先上升后下降的趋势,并在pH 4.0时产量最高,达到13.40 g/L。因此,最优转化pH值为4.0。
2.2.7 硫酸铵浓度对转化的影响
硫酸铵是ε-PL从头合成的氨基供体。控制葡萄糖质量浓度80 g/L,菌龄12 h,反应温度30 ℃,L-赖氨酸质量浓度15 g/L,柠檬酸质量浓度15 g/L,初始反应pH 4.0,湿菌体量1 600 g/L,在硫酸铵质量浓度分别为2、6、10、14、18 g/L时进行转化。结果如图2-g所示,随着硫酸铵浓度的提升,ε-PL产量呈现先上升后下降的趋势,并在6 g/L时ε-PL达到最高产量,为13.70 g/L。因此,最优硫酸铵质量浓度为6 g/L。
2.2.8 湿菌体量对转化的影响
菌体量直接决定酶的含量。菌体量过小时,酶量低,转化效率低;菌体量过大,黏稠的发酵体系将降低营养物质传递速率,从而降低转化效率。因此,选择合适的菌体量对转化非常关键。控制葡萄糖质量浓度80 g/L,菌龄12 h,反应温度30 ℃,L-赖氨酸质量浓度15 g/L,柠檬酸质量浓度15 g/L,初始反应pH 4.0,硫酸铵质量浓度6 g/L,在湿菌体量分别为1 300、1 600、1 900、2 200、2 500 g/L时进行全细胞转化合成ε-PL。结果如图2-h,随着菌体量的增大,ε-PL产量呈现先上升后下降的趋势,并在1 900 g/L时获得最大产量,达到13.8 g/L。确定最优湿菌体量为1 900 g/L。
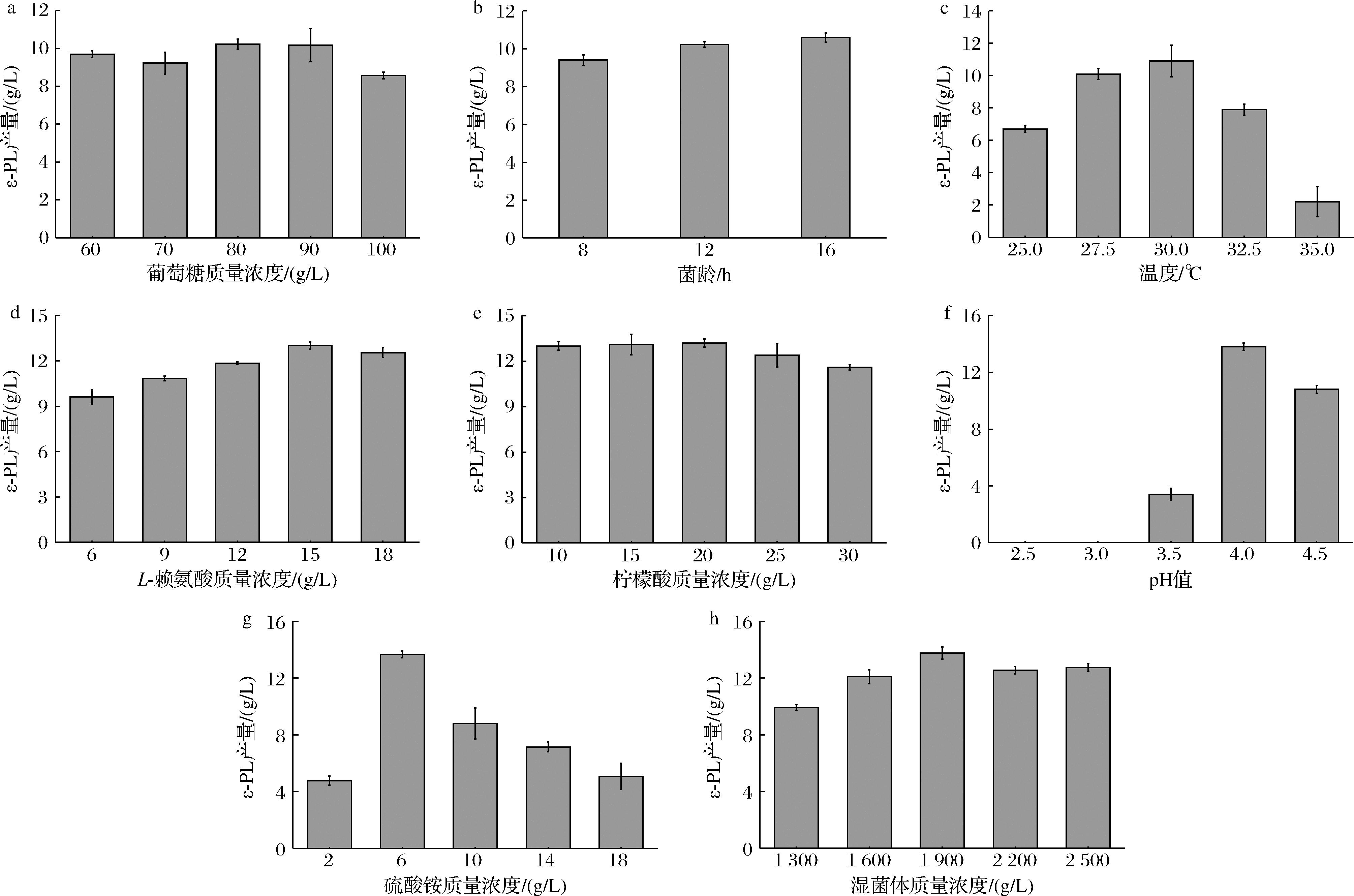
a-葡萄糖浓度;b-菌龄;c-温度;d-L-赖氨酸浓度;e-葡萄糖浓度;f-pH;g-硫酸铵浓度;h-湿菌体量
图2 不同条件对全细胞转化L-赖氨酸合成ε-PL的影响
Fig.2 Effect of different conditions on whole-cell transformation of L-lysine to ε-PL synthesis
2.3 全细胞转化L-赖氨酸合成ε-聚赖氨酸的过程分析
在最优转化体系中考察了转化过程参数,结果如图3-a所示。随着转化进行,L-赖氨酸和葡萄糖被稳定消耗直至转化结束,ε-PL产量从12 h开始稳定增长,96 h达到最高值13.80 g/L。转化过程中,pH值维持在4.00~4.60,处于ε-PL合成的有效pH范围。通过比较分析摇瓶发酵、优化前、优化后和优化后(未添加L-赖氨酸)体系的发酵结果(图3-b),发现优化后转化体系获得了最高的ε-PL产量、L-赖氨酸消耗质量浓度和底物转化率(葡萄糖+L-赖氨酸;消耗的L-赖氨酸等摩尔转化为葡萄糖;下同)达到13.80、7.30 g/L和38.9%,分别是摇瓶发酵的4.1、6.6、3.2倍,较优化前转化体系分别提升了28.5%、32.7%和25.9%。值得注意的是,在优化后(未添加L-赖氨酸)转化体系中,ε-PL的产量和底物转化率仅分别为5.20 g/L和18.4%,表明转化体系中L-赖氨酸是影响ε-PL合成的关键。
2.4 重组小白链霉菌全细胞转化L-赖氨酸合成ε-聚赖氨酸
为了进一步提升S.albulus GS114转化能力,异源表达了来自E.coli BL21的L-赖氨酸特异性通透蛋白基因lysp,以进一步提升菌株的L-赖氨酸摄入能力。重组质粒构建流程如图4-a所示,双酶切验证条带与目标大小相符(图4-b),表明异源表达质粒构建成功,将测序结果正确的重组质粒通过结合转移转入S.albulus GS114中,获得重组菌OE-lysp。重组菌的qRT-PCR结果如图4-c所示,lysp的相对表达水平是出发菌S.albulus GS114的152.4倍,表明目的基因成功异源表达。异源表达菌转化L-赖氨酸合成ε-PL结果如图4-d所示,OE-lysp的ε-PL产量、L-赖氨酸消耗量和底物转化率分别达到17.21、9.20 g/L和45.8%,较出发菌分别提升了34.7%、26.0%和17.7%。以上结果表明,异源表达L-赖氨酸特异性通透蛋白能够进一步提升转化能力。
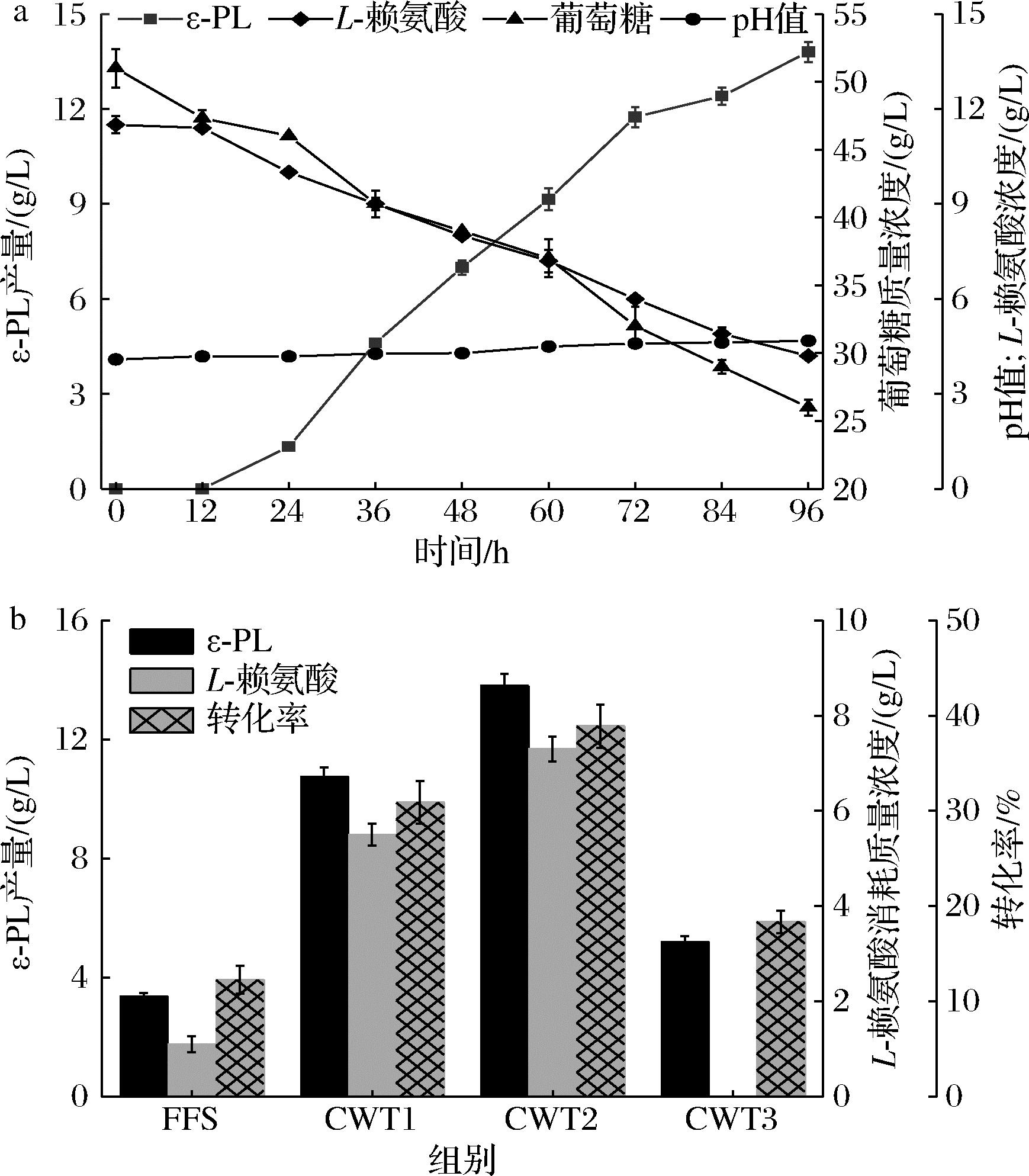
a-全细胞转化体系(优化后)发酵过程参数;b-不同发酵体系转化 L-赖氨酸合成ε-PL结果[FFS:摇瓶发酵;CWT1:优化前; CWT2:优化后;CWT3:优化后(无L-赖氨酸)]
图3 全细胞转化L-赖氨酸合成ε-PL的过程分析
Fig.3 Process analysis of whole-cell transformation to synthesize ε-PL from L-lysine
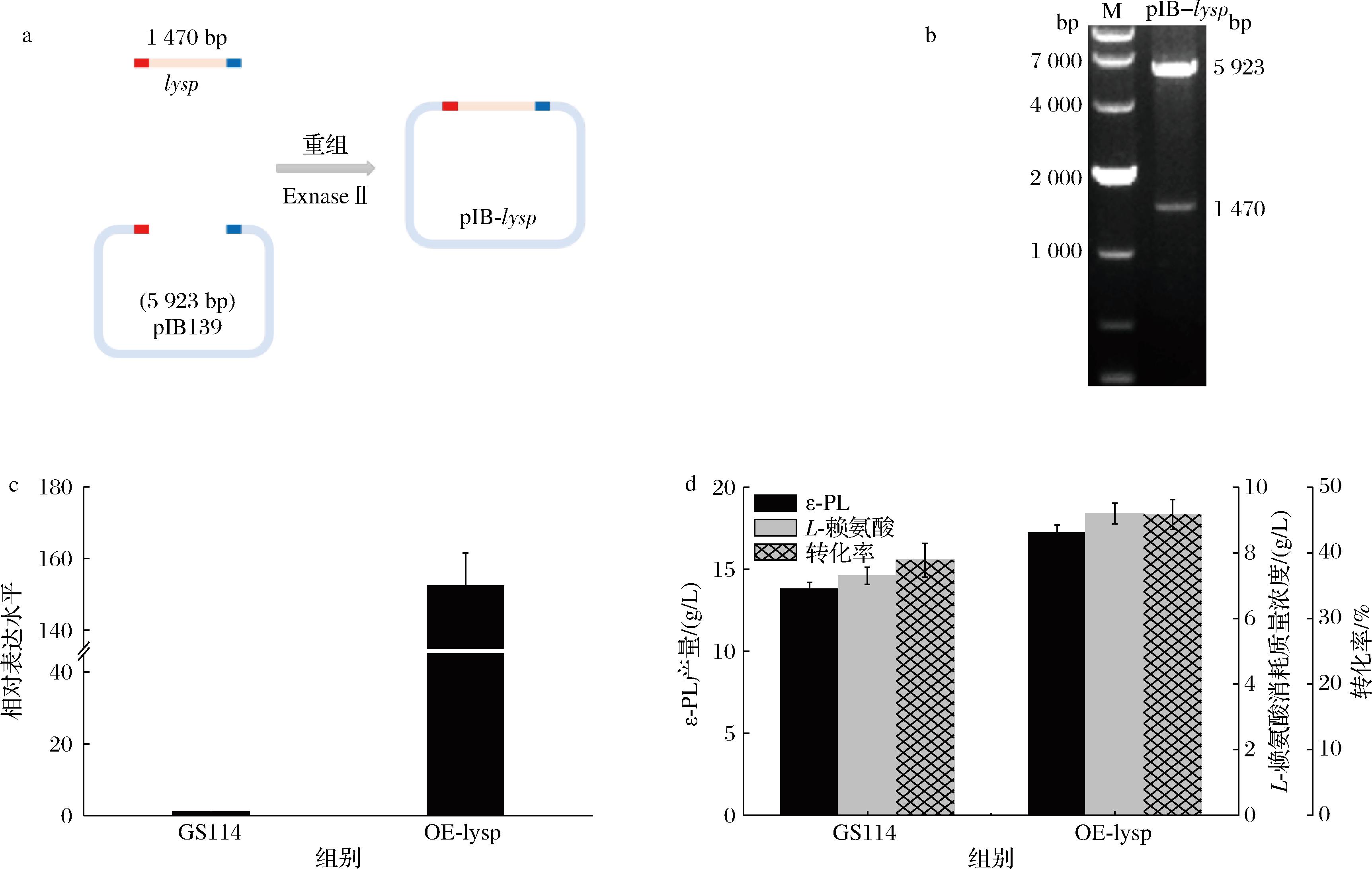
a-重组质粒构建示意图;b-重组质粒双酶切验证结果;c-qRT-PCR;d-重组菌在转化体系中的发酵结果参数
图4 重组小白链霉菌全细胞转化L-赖氨酸合成ε-PL
Fig.4 Recombinant S.albulus for whole-cell transformation to synthesize ε-PL from L-lysine
3 结论
本文通过比较摇瓶发酵体系和全细胞转化体系合成ε-PL的结果,发现了pH不可控是导致摇瓶发酵利用外源L-赖氨酸效率低的重要原因;同时,转化体系表现出较强的L-赖氨酸转化能力,ε-PL产量达到10.74 g/L,较摇瓶发酵提升了2.9倍。随后,对转化培养基和条件进行了系统优化,获得最优转化体系:葡萄糖质量浓度80 g/L,菌龄12 h,反应温度30 ℃,L-赖氨酸质量浓度15 g/L,柠檬酸质量浓度15 g/L,初始反应pH 4.0,硫酸铵质量浓度6 g/L,湿菌体量为1 900 g/L。在最优体系中,ε-PL产量和底物转化率分别为13.80 g/L和38.9%,较摇瓶发酵分别提高了4.1倍和3.2倍。最后,通过异源表达来自E.coli BL21的L-赖氨酸特异性通透蛋白基因lysp进一步提升ε-PL产量和转化率分别至17.21 g/L和45.8%,约为摇瓶发酵的6.4倍和3.3倍。本文研究结果,一方面说明了通过全细胞转化L-赖氨酸生产ε-PL是可行的,另一方面为S.albulus转化大宗氨基酸L-赖氨酸生产高值ε-PL奠定了坚实的技术基础,具有重要的理论意义和经济价值。
[1] HIRAKI J, ICHIKAWA T, NINOMIYA S I, et al.Use of ADME studies to confirm the safety of epsilon-polylysine as a preservative in food[J].Regulatory Toxicology and Pharmacology:RTP, 2003, 37(2):328-340.
[2] YOSHIDA T, NAGASAWA T.ε-Poly-L-lysine:Microbial production, biodegradation and application potential[J].Applied Microbiology and Biotechnology, 2003, 62(1):21-26.
[3] BANKAR S B, SINGHAL R S.Panorama of ε-poly-L-lysine[J].RSC Advances, 2013, 3(23):8586-8603.
[4] KAHAR P, IWATA T, HIRAKI J, et al.Enhancement of ε-polylysine production by Streptomyces albulus strain 410 using pH control[J].Journal of Bioscience and Bioengineering, 2001, 91(2):190-194.
[5] REN X D, CHEN X S, ZENG X, et al.Acidic pH shock induced overproduction of ε-poly-l-lysine in fed-batch fermentation by Streptomyces sp.M-Z18 from agro-industrial by-products[J].Bioprocess and Biosystems Engineering, 2015, 38(6):1113-1125.
[6] WANG L A, LI S, ZHAO J J, et al.Efficiently activated ε-poly-L-lysine production by multiple antibiotic-resistance mutations and acidic pH shock optimization in Streptomyces albulus[J].MicrobiologyOpen, 2019, 8(5):e00728.
[7] SHIMA S, OSHIMA S, SAKAI H.Biosynthesis of ε-poly-L-lysine by washed mycelium of Streptomyces albulus no.346[J].Journal of the Agricultural Chemical Society of Japan, 1983, 57(3):221-226.
[8] HIROHARA H, TAKEHARA M, SAIMURA M, et al.Biosynthesis of poly(ɛ-L-lysine)s in two newly isolated strains of Streptomyces sp[J].Applied Microbiology and Biotechnology, 2006, 73(2):321-331.
[9] LIU S R, WU Q P, ZHANG J M, et al.Effects of L-lysine and D-lysine on ɛ-poly-L-lysine biosynthesis and their metabolites by Streptomyces ahygroscopicus GIM8[J].Biotechnology and Bioprocess Engineering, 2012, 17(6):1205-1212.
[10] LI W C, LV J G, DONG T Y, et al.Effects of amino acids and overexpression of dapA gene on the production of ε-poly-L-lysine by Streptomyces diastatochromogenes strains[J].Current Microbiology, 2021, 78(7):2640-2647.
[11] CHEN X S, REN X D, ZENG X, et al.Enhancement of ε-poly-L-lysine production coupled with precursor L-lysine feeding in glucose-glycerol co-fermentation by Streptomyces sp.M-Z18[J].Bioprocess and Biosystems Engineering, 2013, 36(12):1843-1849.
[12] 沈佳颖, 李由然, 石贵阳.重组地衣芽孢杆菌全细胞转化产(R)-柠苹酸的研究[J].食品与发酵工业, 2023, 49(14):9-15.
SHEN J Y, LI Y R, SHI G Y.Whole-cell biosynthesis of (R)-citramalate by recombinant Bacillus licheniformis[J].Food and Fermentation Industries, 2023, 49(14):9-15.
[13] 闫思翰, 邵明龙, 徐美娟, 等.重组大肠杆菌全细胞催化高效合成胆绿素[J].生物工程学报, 2022, 38(7):2581-2593.
YAN S H, SHAO M L, XU M J, et al.Efficient production of biliverdin through whole-cell biocatalysis using recombinant Escherichia coli[J].Chinese Journal of Biotechnology, 2022, 38(7):2581-2593.
[14] 潘珊, 胡孟凯, 潘学玮, 等.基于双酶级联协调表达策略高效催化合成D-甘露醇[J].生物工程学报, 2022, 38(7):2549-2565.
PAN S, HU M K, PAN X W, et al.Efficient biosynthesis of D-mannitol by coordinated expression of a two-enzyme cascade[J].Chinese Journal of Biotechnology, 2022, 38(7):2549-2565.
[15] BRÖER S, KR MER R.Lysine uptake and exchange in Corynebacterium glutamicum[J].Journal of Bacteriology, 1990, 172(12):7241-7248.
MER R.Lysine uptake and exchange in Corynebacterium glutamicum[J].Journal of Bacteriology, 1990, 172(12):7241-7248.
[16] KIESER T, BIBB M J, CHATER K F, et al.Practical Streptomyces Genetics:A Laboratory Manual[M].Long Island:Cold Spring Harbor Laboratory Press, 2000.
[17] WILKINSON C J, HUGHES-THOMAS Z A, MARTIN C J, et al.Increasing the efficiency of heterologous promoters in Actinomycetes[J].Journal of Molecular Microbiology and Biotechnology, 2002, 4(4):417-426.
[18] 郑根成, 王靓, 高阳, 等.ε-聚赖氨酸高产菌选育与发酵性能评价[J].微生物学报, 2016, 56(9):1450-1458.
ZHENG G C, WANG J, GAO Y, et al.Breeding and fermentation performance of a high-yield ε-poly-L-lysine producing strain[J].Acta Microbiologica Sinica, 2016, 56(9):1450-1458.
[19] 张重阳, 杨昊, 朱道君, 等.过表达L-赖氨酸合成途径关键基因和ε-聚赖氨酸合成酶基因对ε-聚赖氨酸合成的影响[J].食品与发酵工业, 2023, 49(6):1-9.
ZHANG C Y, YANG H, ZHU D J, et al.Effect of overexpression of key genes in L-lysine biosynthesis pathway and ε-poly-L-lysine synthase gene on ε-poly-L-lysine production[J].Food and Fermentation Industries, 2023, 49(6):1-9.
[20] 刁文娇, 朱道君, 潘龙, 等.小白链霉菌ε-聚赖氨酸降解酶生理功能分析[J].微生物学报, 2021, 61(11):3542-3556.
DIAO W J, ZHU D J, PAN L, et al.Physiological function analysis of ε-poly-L-lysine-degrading enzymes in Streptomyces albulus[J].Acta Microbiologica Sinica, 2021, 61(11):3542-3556.
[21] ITZHAKI R F.Colorimetric method for estimating polylysine and polyarginine[J].Analytical Biochemistry, 1972, 50(2):569-574.
[22] 潘龙. 低pH冲击促进小白链霉菌高效积累ε-聚赖氨酸的生理机制研究[D].无锡:江南大学, 2020.
PAN L.Physiological mechanisms of high ε-poly-L-lysine accumulation in Streptomyces albulus by low pH shock strategy[D].Wuxi:Jiangnan University, 2020.