食物过敏是一种对机体不利的免疫反应,在接触特定的食物或相关成分后可重复发生,轻则可引起消化系统疾病和皮肤刺激,重则会导致休克甚至死亡[1]。食物过敏已成为全球性的健康问题,被世界卫生组织认为是最重要的公共卫生问题之一[2]。在发达国家中,约有10%的人会产生食物过敏,其中以儿童为主[3]。此外,在过去的10~20年里,食物过敏发病率有所上升[4-5]。目前,还没有有效的方法可以彻底解决食物过敏问题,对于过敏人群来说,最好的防护措施是避免接触过敏原[6]。因此,一些国家通过食品标签向消费者提供产品有关致敏成分的信息,以达到保护过敏人群的目的。但这种方法有局限性,在原材料或最终产品的加工或储存过程中,由于交叉干扰无意或有意添加而存在的过敏原使食品标签可信度降低,甚至会导致更多食物过敏的发生[7]。
食物过敏原常用检测方法有酶联免疫吸附试验、免疫层析(immunochromatographic assay,ICA)、实时聚合酶链式反应和质谱仪检测等,其中,免疫层析具有便于操作、耗时短、检测成本低等优点[8],非常适用于大规模样品现场快速筛查。在实际应用中,可通过使用不同标记物标记抗体提高免疫层析的检测性能,根据标记物材料可以分为:有色纳米颗粒、磁性纳米颗粒、荧光纳米颗粒[9]。本文对主要食物过敏原及免疫层析检测原理进行了简要介绍,并对免疫层析在主要食物过敏原检测中的应用进行归纳总结。
1 常见食物过敏原
根据联合国粮农组织的统计,超过90%的食物过敏主要与8种食物有关,按来源可以分为植物源性食物(包括花生、大豆、小麦、树生坚果类)和动物源性食物(牛奶、鸡蛋、甲壳类和鱼类)[10]。植物源性和动物源性食物中存在的过敏原主要是少数具有特殊结构的蛋白质[11]。植物源性食物过敏原主要属于Cupin超家族和醇溶蛋白超家族[12]。而动物源性食物过敏原的多样性低于植物源性食物过敏原,它们可分为三大家族:钙结合蛋白(小白蛋白)、原肌球蛋白(甲壳类动物和软体动物)和酪蛋白[13]。常见食物主要过敏原如表1所示。
2 免疫层析检测原理
免疫层析是以免疫技术、色谱层析技术、新材料及标记技术为基础建立的一种免疫学快速检测技术。如图1所示,免疫层析试纸主要包含样品垫、结合垫、吸收垫、硝酸纤维素(nitrocellulose,NC)膜、检测线和质控线等,其原理是以待测物溶液为流动相,在毛细作用下,待测物溶液经样品垫向吸收垫方向移动,先溶解结合垫上的检测抗体后与其相互反应,再与检测线和质控线上固定有的抗原或抗体发生特异性免疫反应,最后,通过检测线和质控线颜色判断测试结果[24]。根据抗原抗体结合方式的差异,主要可以分为2种检测模式:夹心法(如图1-a)和竞争法(如图1-b)。夹心法一般用于大分子物质的检测,在食品过敏原检测中较为常用,而竞争法常用于小分子物质的检测。
表1 常见食物主要过敏原及致敏症状
Table 1 Common food allergens and sensitization symptoms

分类食物来源主要过敏原致敏症状参考文献植物源性食物过敏原花生及其制品Ara h 1、Ara h 2、Ara h 3、Ara h 6血压降低,出现血管性水肿,皮肤出现荨麻疹和弥散的皮炎,严重时引起休克[14-15]大豆及其制品β-伴大豆球蛋白、大豆球蛋白、Gly m Bd 28K、Gly m Bd 30K、和胰蛋白酶抑制因子腹痛腹泻、皮肤红痒、哮喘等[16]小麦及其制品ω-醇溶蛋白咽喉红肿,口腔荨麻疹、鼻塞、头痛、呼吸困难、消化系统异常等症状[17]树坚果及其制品Jug r 1、Jug r 2、Jug r 4口中产生金属异味、口鼻发炎、出现呼吸困难、吞咽困难、全身性荨麻疹等[18-19]动物源性食物过敏原牛奶及其制品α-乳白蛋白,β-乳球蛋白(β-lactoglobulin,β-LG)和酪蛋白呕吐、腹泻、腹绞痛、皮炎、荨麻疹等症状[20]鸡蛋及其制品卵类黏蛋白(Gal d 1)、卵白蛋白(Gal d 2)、卵转铁蛋白(Gal d 3)和溶菌酶(Gal d 4)全身性皮炎、风团疹、呕吐、腹泻、腹痛等症状[21]甲壳类及其制品原肌球蛋白(tropomyosin,TM)恶心、呕吐、腹泻,指尖和脚趾的刺痛感,甚至肌肉麻痹等症状[22]鱼类及其制品小清蛋白(parvalbumin,PV)脸红、荨麻疹、恶心呕吐胃痛、肠出血等症状[23]
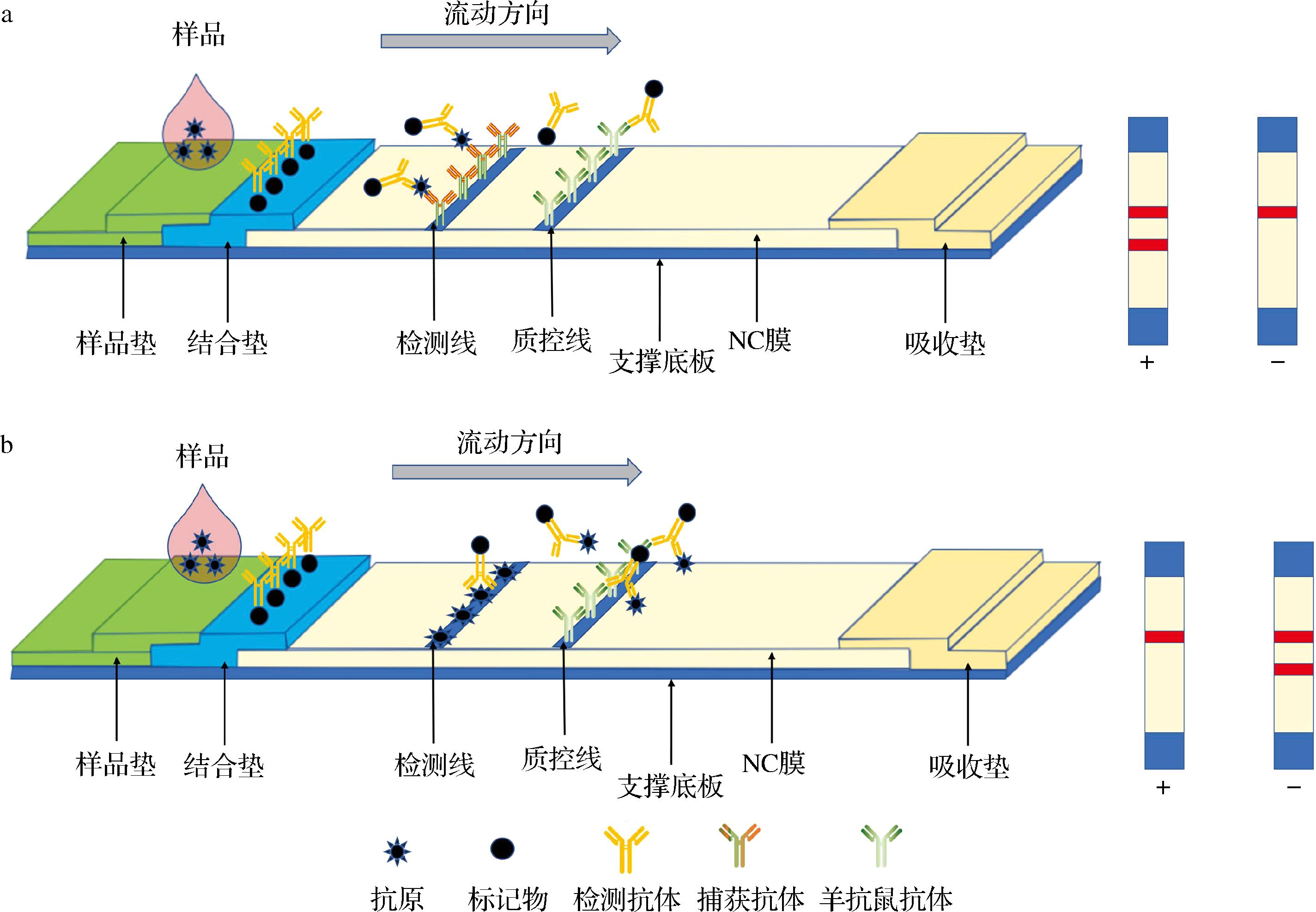
a-夹心法;b-竞争法
图1 免疫层析技术检测模式示意图
Fig.1 Schematic diagram of immunochromatographic assay detection mode
3 免疫层析在食物过敏原检测中的应用
3.1 基于有色纳米颗粒的免疫层析
有色纳米颗粒包括:胶体金、纳米银、乳胶颗粒等,具有良好的光学特性,仅靠肉眼就可以判断结果等优点,在食品过敏原检测过程中应用较为广泛[25]。而胶体金因其生物相容性好且制作简单,在ICA制备中有较多应用[26]。为快速检测花生过敏原,吉坤美等[27]通过提取总花生过敏原,免疫小鼠制备出高效价多克隆抗体,并利用胶体金作为抗体标记物,开发了一种检测花生过敏原的胶体金免疫层析试纸条,目测检出限为50 ng/mL。然而,多克隆抗体的交叉反应,可能会导致免疫层析法出现假阳性结果,为此,WU等[28]将胶体金与检测抗体进行偶联,制备出胶体金检测探针,开发了一种基于双位点单克隆抗体的胶体金免疫层析法,可用于β-LG的检测,所制备的单克隆抗体可在一个小区域(β-LG的Glu-Asn)识别出2个相邻的、单独的表位,没有交叉反应。该方法具有高特异性,可实现对β-LG的快速检测,目测检出限为0.2 ng/mL。WANG等[29-30]分别针对大豆球蛋白和β-伴大豆球蛋白研制了夹心法胶体金免疫层析快速检测试纸条,均基于高度特异性的鼠源单克隆抗体作为捕获抗体,将兔源多克隆抗体作为检测抗体并与胶体金进行偶联,建立了2种主要大豆过敏原的免疫层析试纸条,借助光密度仪扫描试纸条检测线能够实现定量检测,可用于奶粉中2种大豆过敏原的检测,目测检出限分别为0.69和1.66 mg/kg。在免疫层析中竞争法也可用于大分子过敏原检测,王士峰等[31]通过制备β-LG单克隆抗体,利用竞争法检测线上包备β-LG标准品,将胶体金与检测抗体偶联,建立了一种竞争法胶体金免疫层析法,该方法与夹心法相比,节约了抗体的使用量,目测检出限达50 μg/mL。MASIRI等[32]制备了一组针对杏仁、腰果、椰子、榛子和豆奶中存在的修饰蛋白的多克隆抗体,并同时利用夹心法和竞争法,研制了一种胶体金免疫层析试纸条,可以实现多靶标检测。试纸条上设置有2条检测线,检测线T1运用夹心法模式,线上固定有特异性抗体,检测线T2运用竞争法模式,线上包被有待测物标准品。当与试纸条读卡仪配合使用时,可以在25 min内获得检测结果,目测检出限为1.0 μg/mL。胶体金不仅可以作为检测探针,当ICA与其他检测技术相结合时,还可以发挥更多作用,为提高检测能力,XI等[33]将表面增强拉曼光谱技术与免疫层析技术结合,利用对氨基苯硫酚修饰的胶体金作为拉曼光谱增强信号,建立了一种以胶体金为活性基底的拉曼光谱增强免疫层析法,可实现对β-伴大豆蛋白的定量检测,目测检出限为1 μg/mL,仪器检出限为32 ng/mL。YIN等[34]建立了一种条码式的免疫层析法,用于检测麦醇溶蛋白,该方法以胶体金为标记物,并与鸡多克隆抗麦醇溶蛋白免疫球蛋白Y(immunoglobulin Y,IgY)抗体非共价结合,NC膜上设置有2条检测线,测试线1的临界值设置为10 mg/kg,测试线2的临界值设置为50 mg/kg,该方法可通过试纸条上出现的检测线数量与分析物浓度之间的关系来快速提供半定量结果,具有耗时短、低成本等优点,目测检出限为10 mg/kg。在多靶标检测中,胶体金免疫层析检测线颜色过于单一,区分度较低。ANFOSSI等[35]利用金和银纳米颗粒为标记物,建立了一种多色多重免疫层析法,用于多种过敏原检测,该方法将针对卵清蛋白、酪蛋白和榛子过敏原的抗体分别与球形银纳米颗粒(argentum nanoparticles,AgNPs)、球形和沙漠玫瑰状金纳米颗粒(aurum nanoparticles,AuNPs)偶联,作为检测探针,该方法灵敏度高,目测检出限为0.1 mg/L,可产生3种不同颜色(青色/酪蛋白、黄色/卵清蛋白、红色/榛子蛋白),在实际应用中,能够根据探针的颜色轻松识别商品中的过敏原,具有简单便捷、节约成本等优点。GALAN-MALO等[36]建立了一种基于彩色乳胶颗粒的免疫层析法,可以对β-LG和酪蛋白进行同时检测和独立检测。该方法将红色和蓝色羧基改性染色乳胶颗粒作为抗体标记物,与胶体金相比,由于乳胶微球具有良好的稳定性,并且色彩艳丽,具有很好的视觉效果等优点,可以有效提高试纸条检测灵敏度,对β-LG目测检出限为0.5 μg/mL,酪蛋白目测检出限为2 μg/mL。虽然有色纳米颗粒在食物过敏原检测中应用较为广泛,但检测中往往存在一些背景干扰,易出现假阳性或者假阴性等问题。
3.2 基于磁性纳米颗粒的免疫层析
磁性纳米颗粒是指颗粒直径在1~100 nm的磁性材料。根据纳米标记物本身自带的磁性,具有稳定性好、检测信号持续时间长等优点,并且在应用过程中可以简化操作、缩短检测时间、提高检测效率等,在免疫层析技术中具有广阔的应用前景。常见的磁性纳米颗粒有免疫磁性纳米粒子(immunomagnetic nanoparticle,IMNP)[37]、超顺磁性纳米颗粒(superparamagnetic nanoparticle,SPMNP)[38]、Fe3O4/Au纳米粒子[39]等。在食品检测中,对食用油中可能残存的花生过敏原进行检测较为困难,YIN等[40]开发了一种基于IMNP的免疫层析法,该方法将IMNP与抗Ara h 2的多抗偶联形成复合物IMNP-pAbs,并作为检测探针,在外加磁场的作用下可以简便地分离出食用油中的Ara h 2,很大程度上简化了样品处理,并且可以在试纸条上产生棕色信号。在食用油中的目测检出限为0.1 mg/kg。在此基础上,YIN等[41]运用IMNP为抗体标记物开发了一种用于检测加工食品中Ara h 1的免疫层析试纸条,目测检出限为0.01 μg/mL。SHI等[42]开发了一种基于超顺磁性纳米颗粒的免疫层析法用于检测过敏原TM,与传统的标记材料相比,SPMNPs受到食物基质干扰的影响较小,信号不会在很长时间内退化,而且在必要时可以重新检查ICA试纸条,该方法检测范围为0.01~20 μg/mL,仪器检出限为12.4 ng/mL。ZHENG等[43]利用SPMNPs作为抗体标记物,将抗PV的单抗固定在SPMNP表面,制备了PV特异性的SPMNP探针,建立了一种SPMNP探针标记的竞争形式免疫层析法,利用磁性分析阅读器系统读取磁信号来实现定量测量,目测检出限为5 mg/mL,仪器检出限为0.046 mg/mL。对29份食品提取物样品分别进行了免疫层析法和Western Blot检测,比较结果表明,2种方法的相对符合率为93.1%(27/29)。李梦银[44]以Fe3O4为核心,胶体金为壳,制备了金磁(Fe3O4/Au))复合微粒,建立了一种基于金磁复合微粒的免疫层析法,用于高特异性检测过敏原PV,目测检出限为4 ng/mL,该方法与普通胶体金试纸条相比,可通过磁信号分析仪直接得到信号值,灵敏度高,弥补了胶体金免疫层析无法量化的缺陷,达到对PV的定量检测。ZHANG等[45]建立了一种基于Fe3O4/Au的免疫层析法,用于检测过敏原PV,利用Fe3O4/Au纳米微粒具有超顺磁性的性能,采用Fe3O4/Au标记抗体,进一步简化了样品处理,使用试纸条读卡仪进行定量分析,目测检出限为2 ng/mL,仪器检出限达0.691 ng/mL。磁性纳米颗粒作为ICA中新型标记材料,已经引起广泛关注,但在应用中往往需要磁性阅读器辅助读值才能得到检测结果,降低了应用的便捷性。
3.3 基于荧光纳米颗粒的免疫层析
荧光纳米颗粒包括量子点(quantum dot,QD)[46]、荧光微球[47]、上转换荧光微球[48]等,量子点是一种纳米尺度的半导体材料,一般为球形或准球形,直径<10 nm。主要由Ⅱ~Ⅵ族(如CdTe、CdS、ZnSe等)或Ⅲ~Ⅴ族(如In P、In As等)元素组成的纳米颗粒,与传统的标记物相比,量子点具有稳定的荧光和亮度等优异的荧光特性[49]。WANG等[50]建立了一种基于量子点的免疫层析法,将水溶性QD标记多克隆抗体(polyclonal antibodies,pAbs)形成QD-pAbs聚合物,并作为检测探针,该方法通过试纸条读卡仪可以实现定量检测,目测检出限为0.5 μg/mL,仪器检出限为0.05 μg/mL。荧光微球因其构型稳定、荧光强度高、光稳定性好等优点,越来越多地被用作免疫分析的检测标记。杨亚杰等[51]利用表面羧基化修饰的荧光微球与抗体表面的氨基共价结合,形成荧光微球检测探针,建立了一种荧光微球免疫层析法,可用于酪蛋白的检测,由于荧光微球具有发光效率高、稳定性好等优点,灵敏度得到进一步提高,目测检出限达100 ng/mL。虽然荧光纳米颗粒可以通过不同的方法来实现高灵敏度检测,但荧光信号易猝灭等问题导致其不能够长期保存,不利于大规模商业化生产应用。
4 结语
免疫层析技术具有灵敏度高、操作简便、检测成本低等优点,目前,已在食物过敏原快速检测方面有较广泛的应用,然而,免疫层析技术在过敏原检测中仍有很大发展空间。1)食物过敏原多靶标检测。在复杂的食品基质中,往往存在多种食物过敏原,目前,在对多种过敏原同时检测的研究中,存在着灵敏度较低、稳定性较差以及同时检测的最大分析物数量存在固有的限制等问题。利用微阵列格式对检测线进行改造及不同纳米标记物的应用等,开发一种可商业化的、同时检测食品中多种过敏原的免疫层析技术,将是未来发展的一个方向。2)实现定量分析。定量分析是免疫层析研究中的重点,单独依靠免疫层析技术很难实现对目标物的定量分析,在食物过敏原检测中,将智能手机等其他便携式智能设备与免疫层析技术结合,开发可以对食物过敏原进行现场快速定量检测方法是发展的趋势。3)新型纳米标记物的应用。抗体标记物本身的性质会很大程度上影响免疫层析技术检测过敏原的灵敏度,然而,近年来,在过敏原检测中仍以胶体金等传统标记物的应用为主,表2简要总结了近年来不同新型纳米标记物的免疫层析技术在食物过敏原快速检测中的应用。随着新型纳米标记物的出现及应用,将不断推动免疫层析技术在过敏原检测研究中的发展。4)加工食品中过敏原的致敏性变化。食物过敏原在生产加工过程中,会受到各种因素(高温,高压,辐照等)影响导致结构发生改变,其致敏性可能会发生变化,从而影响免疫层析技术的检测结果,在研究中也是值得关注的一个重要问题。5)特异性抗体替代物的研究。适配体因其具有和抗体相似的功能,且稳定性、重复性等方面具有一定优势,可作为抗体的良好替代物,但在众多检测食物过敏原的研究中,利用适配体作为过敏原的识别分子报道较少。因此,筛选食物过敏原的适配体,并将其用于层析检测的识别元件,具有良好的发展前景。6)绿色环保免疫层析试纸条的研究。免疫层析试纸条作为一次性用品,在参与大规模现场检测过程中,会产生很多废弃物,通过对使用的环保材料进行改进,例如用可回收或可生物降解的塑料作为试纸条塑料壳、用纤维素代替硝酸纤维素膜等,开发绿色环保的免疫层析试纸条将成为新的研究方向。
表2 不同纳米标记物在食物过敏原免疫层析检测中的应用
Table 2 Application of different nanomarkers in ICA for food allergens
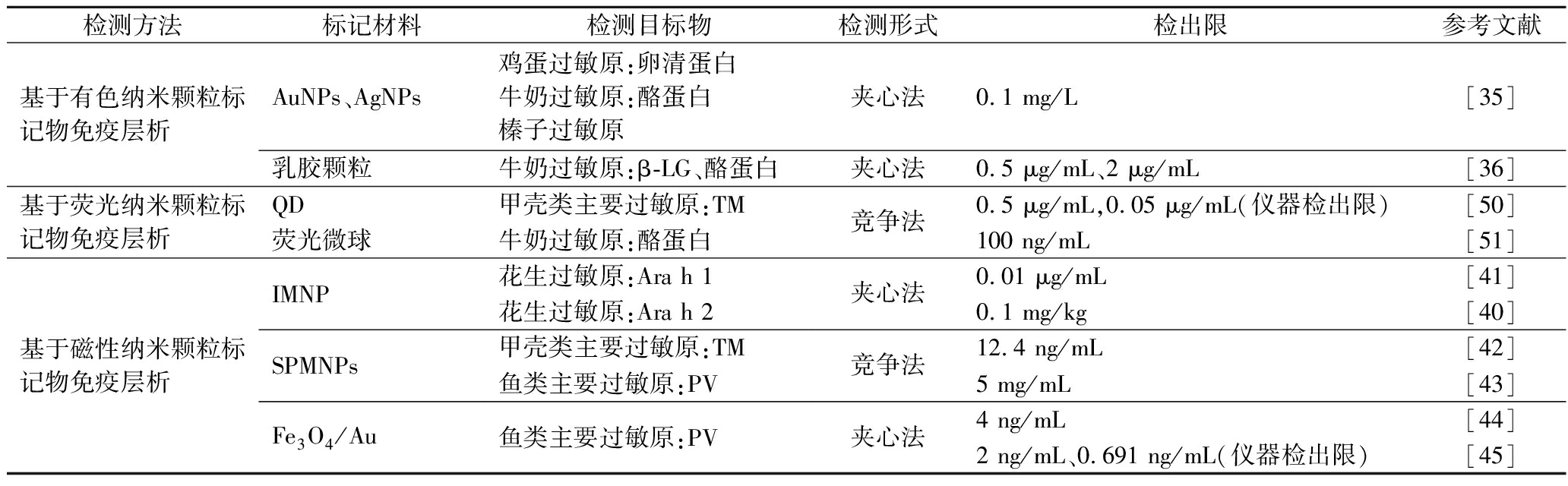
检测方法标记材料检测目标物检测形式检出限参考文献基于有色纳米颗粒标记物免疫层析AuNPs、AgNPs鸡蛋过敏原:卵清蛋白牛奶过敏原:酪蛋白榛子过敏原夹心法0.1 mg/L[35]乳胶颗粒牛奶过敏原:β-LG、酪蛋白夹心法0.5 μg/mL、2 μg/mL[36]基于荧光纳米颗粒标记物免疫层析QD甲壳类主要过敏原:TM竞争法0.5 μg/mL,0.05 μg/mL(仪器检出限)[50]荧光微球牛奶过敏原:酪蛋白100 ng/mL[51]基于磁性纳米颗粒标记物免疫层析IMNPSPMNPsFe3O4/Au花生过敏原:Ara h 1花生过敏原:Ara h 2甲壳类主要过敏原:TM鱼类主要过敏原:PV鱼类主要过敏原:PV夹心法0.01 μg/mL[41]0.1 mg/kg[40]竞争法12.4 ng/mL[42]5 mg/mL[43]夹心法4 ng/mL[44]2 ng/mL、0.691 ng/mL(仪器检出限)[45]
[1] TUPPO L, GIANGRIECO I, TAMBURRINI M, et al.Detection of allergenic proteins in foodstuffs:Advantages of the innovative multiplex allergen microarray-based immunoassay compared to conventional methods[J].Foods, 2022, 11(6):878.
[2] KIMBER I, DEARMAN R J.Food allergy:What are the issues?[J].Toxicology Letters, 2001, 120(1-3):165-170.
[3] XU J Y, YE Y L, JI J A, et al.Advances on the rapid and multiplex detection methods of food allergens[J].Critical Reviews in Food Science and Nutrition, 2022, 62(25):6887-6907.
[4] BUNYAVANICH S, RIFAS-SHIMAN S L, PLATTS-MILLS T A E, et al.Peanut allergy prevalence among school-age children in a US cohort not selected for any disease[J].The Journal of Allergy and Clinical Immunology, 2014, 134(3):753-755.
[5] FU L L, CHERAYIL B J, SHI H N, et al.Food Allergy:From Molecular Mechanisms to Control Strategies[M].Singapore:Springer Singapore, 2019.
[6] LIU C Q, SATHE S K.Food allergen epitope mapping[J].Journal of Agricultural and Food Chemistry, 2018, 66(28):7238-7248.
[7] CAMPUZANO S, RUIZ-VALDEPE AS MONTIEL V, SERAF
AS MONTIEL V, SERAF N V, et al.Cutting-edge advances in electrochemical affinity biosensing at different molecular level of emerging food allergens and adulterants[J].Biosensors, 2020, 10(2):10.
N V, et al.Cutting-edge advances in electrochemical affinity biosensing at different molecular level of emerging food allergens and adulterants[J].Biosensors, 2020, 10(2):10.
[8] LI X M, CHEN X M, WU J X, et al.Portable, rapid, and sensitive time-resolved fluorescence immunochromatography for on-site detection of dexamethasone in milk and pork[J].Foods, 2021, 10(6):1339.
[9] ELAHI N, KAMALI M, BAGHERSAD M H.Recent biomedical applications of gold nanoparticles:A review[J].Talanta, 2018, 184:537-556.
[10] SENA-TORRALBA A, PALL S-TAMARIT Y, MORAIS S, et al.Recent advances and challenges in food-borne allergen detection[J].TrAC Trends in Analytical Chemistry, 2020, 132:116050.
S-TAMARIT Y, MORAIS S, et al.Recent advances and challenges in food-borne allergen detection[J].TrAC Trends in Analytical Chemistry, 2020, 132:116050.
[11] SATHE S K, LIU C Q, ZAFFRAN V D.Food allergy[J].Annual Review of Food Science and Technology, 2016, 7:191-220.
[12] 徐国强, 倪海东, 杨明, 等.食物过敏原蛋白家族分类及其结构特点[J].检验检疫学刊, 2012, 22(5):66-70;76.
XU G Q, NI H D, YANG M, et al.The classification and structural characteristics of food allergen protein familities[J].Journal of Inspection and Quarantine, 2012, 22(5):66-70;76.
[13] IVANCIUC O, GARCIA T, TORRES M, et al.Characteristic motifs for families of allergenic proteins[J].Molecular Immunology, 2009, 46(4):559-568.
[14] POMÉS A, DAVIES J M, GADERMAIER G, et al.WHO/IUIS Allergen Nomenclature:Providing a common language[J].Molecular Immunology, 2018, 100:3-13.
[15] GENG Q, ZHANG Y, SONG M, et al. Allergenicity of peanut allergens and its dependence on the structure[J]. Comprehensive Reviews in Food Science and Food Safety, 2023, 22(2): 1-24.
[16] ZHENG S G, QIN G X, TIAN H, et al.Three-dimensional structure of Gly m 5 (β-conglycinin) plays an important role in its stability and overall allergenicity[J].Food Chemistry, 2017, 234:381-388.
[17] 李玺, 薛文通.小麦致敏蛋白及其过敏病症研究进展[J].食品科技, 2016, 41(8):147-152.
LI X, XUE W T.Research progress of wheat allergens and allergy symptoms[J].Food Science and Technology, 2016, 41(8):147-152.
[18] OFFERMANN L R, BUBLIN M, PERDUE M L, et al.Structural and functional characterization of the hazelnut allergen cor a 8[J].Journal of Agricultural and Food Chemistry, 2015, 63(41):9150-9158.
[19] MATTISON C P, MALVEIRA CAVALCANTE J, IZABEL GALL O M, et al.Effects of industrial cashew nut processing on anacardic acid content and allergen recognition by IgE[J].Food Chemistry, 2018, 240:370-376.
O M, et al.Effects of industrial cashew nut processing on anacardic acid content and allergen recognition by IgE[J].Food Chemistry, 2018, 240:370-376.
[20] SANTI A, JUFFRIE M, SUMADIONO S.IgE-mediated soy protein sensitization in children with cow`s milk allergy[J].Paediatrica Indonesiana, 2012, 52(2):67-71.
[21] 付琴, 宋伟, 王旭清.鸡蛋蛋白过敏综述[J].安徽农业科学, 2012, 40(13):7887-7889;7920.
FU Q, SONG W, WANG X Q.Review of the allergy to egg albumen[J].Journal of Anhui Agricultural Sciences, 2012, 40(13):7887-7889;7920.
[22] RUETHERS T, TAKI A C, JOHNSTON E B, et al.Seafood allergy:A comprehensive review of fish and shellfish allergens[J].Molecular Immunology, 2018, 100:28-57.
[23] JIANG D L, JIANG H, JI J A, et al.Mast-cell-based fluorescence biosensor for rapid detection of major fish allergen parvalbumin[J].Journal of Agricultural and Food Chemistry, 2014, 62(27):6473-6480.
[24] 张改平, 王爱萍, 罗俊, 等.免疫层析试纸快速检测技术[M].郑州:河南科学技术出版社, 2015:6-11.
ZHANG G P, WANG A P, LUO J, et al.Immunochromatographic lateral flow strip test[M].Zhengzhou:Henan Science and Technology Press, 2015:6-11.
[25] 田亚晨, 王淑娟, 马兰, 等.纳米颗粒在侧流免疫层析技术中的应用研究进展[J].食品科学, 2019, 40(17):348-356.
TIAN Y C, WANG S J, MA L, et al.Recent progress on nanoparticles in lateral flow immunochromatographic strip[J].Food Science, 2019, 40(17):348-356.
[26] LIU W H, CHEN M, YANG Y, et al.Colloidal gold in sulphur and citrate-bearing hydrothermal fluids:An experimental study[J].Ore Geology Reviews, 2019,114:103142.
[27] 吉坤美, 陈家杰, 詹群珊, 等.胶体金免疫层析法检测食品中花生过敏原蛋白成分[J].食品研究与开发, 2009, 30(5):101-105.
JI K M, CHEN J J, ZHAN Q S, et al.Development of a gold immunochromatography assay for determination of peanut allergen protein trace in foods[J].Food Research and Development, 2009, 30(5):101-105.
[28] WU X L, HE W Y, JI K M, et al.A simple and fast detection method for bovine milk residues in foods:A 2-site monoclonal antibody immunochromatography assay[J].Journal of Food Science, 2013, 78(3):M452-M457.
[29] WANG Y, DENG R G, ZHANG G P, et al.Rapid and sensitive detection of the food allergen glycinin in powdered milk using a lateral flow colloidal gold immunoassay strip test[J].Journal of Agricultural and Food Chemistry, 2015, 63(8):2172-2178.
[30] WANG Y, LI Z Z, PEI Y F, et al.Establishment of a lateral flow colloidal gold immunoassay strip for the rapid detection of soybean allergen β-conglycinin[J].Food Analytical Methods, 2017, 10(7):2429-2435.
[31] 王士峰, 姚添淇, 冯荣虎, 等.胶体金免疫层析法快速检测配方羊奶粉中的牛β-乳球蛋白[J].食品工业科技, 2018, 39(15):60-64.
WANG S F, YAO T Q, FENG R H, et al.Colloidal gold immunochromatographic assay for rapid detection of bovine β-lactoglobulin in goat milk formulas[J].Science and Technology of Food Industry, 2018, 39(15):60-64.
[32] MASIRI J, BENOIT L, MESHGI M, et al.A novel immunoassay test system for detection of modified allergen residues present in almond-, cashew-, coconut-, hazelnut-, and soy-based nondairy beverages[J].Journal of Food Protection, 2016, 79(9):1572-1582.
[33] XI J, YU Q R.The development of lateral flow immunoassay strip tests based on surface enhanced Raman spectroscopy coupled with gold nanoparticles for the rapid detection of soybean allergen β-conglycinin[J].Spectrochimica Acta Part A-Molecular and Biomolecular Spectroscopy, 2020, 241:118640.
[34] YIN H Y, CHU P T, TSAI W C, et al.Development of a barcode-style lateral flow immunoassay for the rapid semi-quantification of gliadin in foods[J].Food Chemistry, 2016, 192:934-942.
[35] ANFOSSI L, DI NARDO F, RUSSO A, et al.Silver and gold nanoparticles as multi-chromatic lateral flow assay probes for the detection of food allergens[J].Analytical and Bioanalytical Chemistry, 2019, 411(9):1905-1913.
[36] GALAN-MALO P, PELLICER S, PÉREZ M D, et al.Development of a novel duplex lateral flow test for simultaneous detection of casein and β-lactoglobulin in food[J].Food Chemistry, 2019, 293:41-48.
[37] TSAI W, YIN H, LEONG W T, et al.Development of an immunomagnetic nanoparticle-based lateral flow assay for detecting major kiwi allergen Act d1 in processed foods[J].European Food Research and Technology, 2022, 248:1601-1613.
[38] WANG Y Y, XU H, WEI M, et al.Study of superparamagnetic nanoparticles as labels in the quantitative lateral flow immunoassay[J].Materials Science and Engineering:C, 2009, 29(3):714-718.
[39] TANG D, SAUCEDA J C, LIN Z, et al.Magnetic nanogold microspheres-based lateral-flow immunodipstick for rapid detection of aflatoxin B2 in food[J].Biosensors and Bioelectronics, 2009, 25(2):514-518.
[40] YIN H Y, FANG T J, LI Y T, et al.Rapidly detecting major peanut allergen-Ara h2 in edible oils using a new immunomagnetic nanoparticle-based lateral flow assay[J].Food Chemistry, 2019, 271:505-515.
[41] YIN H Y, LI Y T, TSAI W C, et al.An immunochromatographic assay utilizing magnetic nanoparticles to detect major peanut allergen Ara h 1 in processed foods[J].Food Chemistry, 2022, 375:131844.
[42] SHI L A, WANG X C, LIU Y A, et al.Rapid detection of shellfish major allergen tropomyosin using superparamagnetic nanoparticle-based lateral flow immunoassay[J].Advanced Materials Research, 2011, 311-313:436-445.
[43] ZHENG C, WANG X C, LU Y, et al.Rapid detection of fish major allergen parvalbumin using superparamagnetic nanoparticle-based lateral flow immunoassay[J].Food Control, 2012, 26(2):446-452.
[44] 李梦银. 鱼类主要过敏原小清蛋白金磁免疫层析试纸条的研制[D].上海:上海师范大学, 2019.
LI M Y.Development of gold magnetic immunochromatographic test strip for fish allergen albumin[D].Shanghai:Shanghai Normal University, 2019.
[45] ZHANG M K, LI M Y, ZHAO Y, et al.Novel monoclonal antibody-sandwich immunochromatographic assay based on Fe3O4/Au nanoparticles for rapid detection of fish allergen parvalbumin[J].Food Research International, 2021, 142:110102.
[46] ZHANG Y J, LIU B, LIU Z M, et al.Research progress in the synthesis and biological application of quantum dots[J].New Journal of Chemistry, 2022, 46(43):20515-20539.
[47] XU D, WU Y P, LI P, et al.Development of fluorescent microsphere-based immunochromatographic strip for rapid detection of Cronobacter in milk[J].Journal of Medical Microbiology and Immunology Research, 2018(6):1-8.
[48] LEI L J, ZHOU Y, HAN Y W, et al.Rapid detection of serum procalcitonin by immunochromatograghy technology based on freeze-dried up-conversion nanoparticles/antibody conjugates[J].Chinese Journal of Chemistry, 2017, 35(12):1861-1868.
[49] REN M L, XU H Y, HUANG X L, et al.Immunochromatographic assay for ultrasensitive detection of aflatoxin B1 in maize by highly luminescent quantum dot beads[J].ACS Applied Materials &Interfaces, 2014, 6(16):14215-14222.
[50] WANG Y Q, LI Z X, LIN H, et al.Quantum-dot-based lateral flow immunoassay for the rapid detection of crustacean major allergen tropomyosin[J].Food Control, 2019, 106:106714.
[51] 杨亚杰, 倪小琴, 王茜, 等.荧光微球免疫层析法定量检测牛乳中酪蛋白[J].食品安全质量检测学报, 2014, 5(7):1978-1984.
YANG Y J, NI X Q, WANG Q, et al.Quantitative detection of casein in milk by fluorescent microsphere immunochromatography[J].Journal of Food Safety &Quality, 2014, 5(7):1978-1984.