马铃薯作为一种粮、菜、饲和工业原料兼用型经济作物[1],不仅产量高栽培适应性广,而且营养价值高[2-3]。在收获、贮藏、运输和销售过程中,机械损伤、温度、湿度和光照等因素会导致块茎中糖苷生物碱(glycoalkaloids, GAs)的含量急剧上升[4-5]。GAs是茄科和百合科植物产生的次级代谢产物,又名龙葵素。马铃薯中GAs主要成分为α-茄碱和α-卡茄碱,其均以茄啶作为苷元并连接一个三糖侧链(图1)。GAs对所有的哺乳动物都有毒性,且人类对GAs的毒性更加敏感[6]。在我国,由于马铃薯中GAs含量上升而造成的产业损失高达15%~20%。这严重制约着马铃薯产业化发展和粮食安全。因此,降低马铃薯块茎中GAs的含量,减少马铃薯产业损失显得尤为重要。
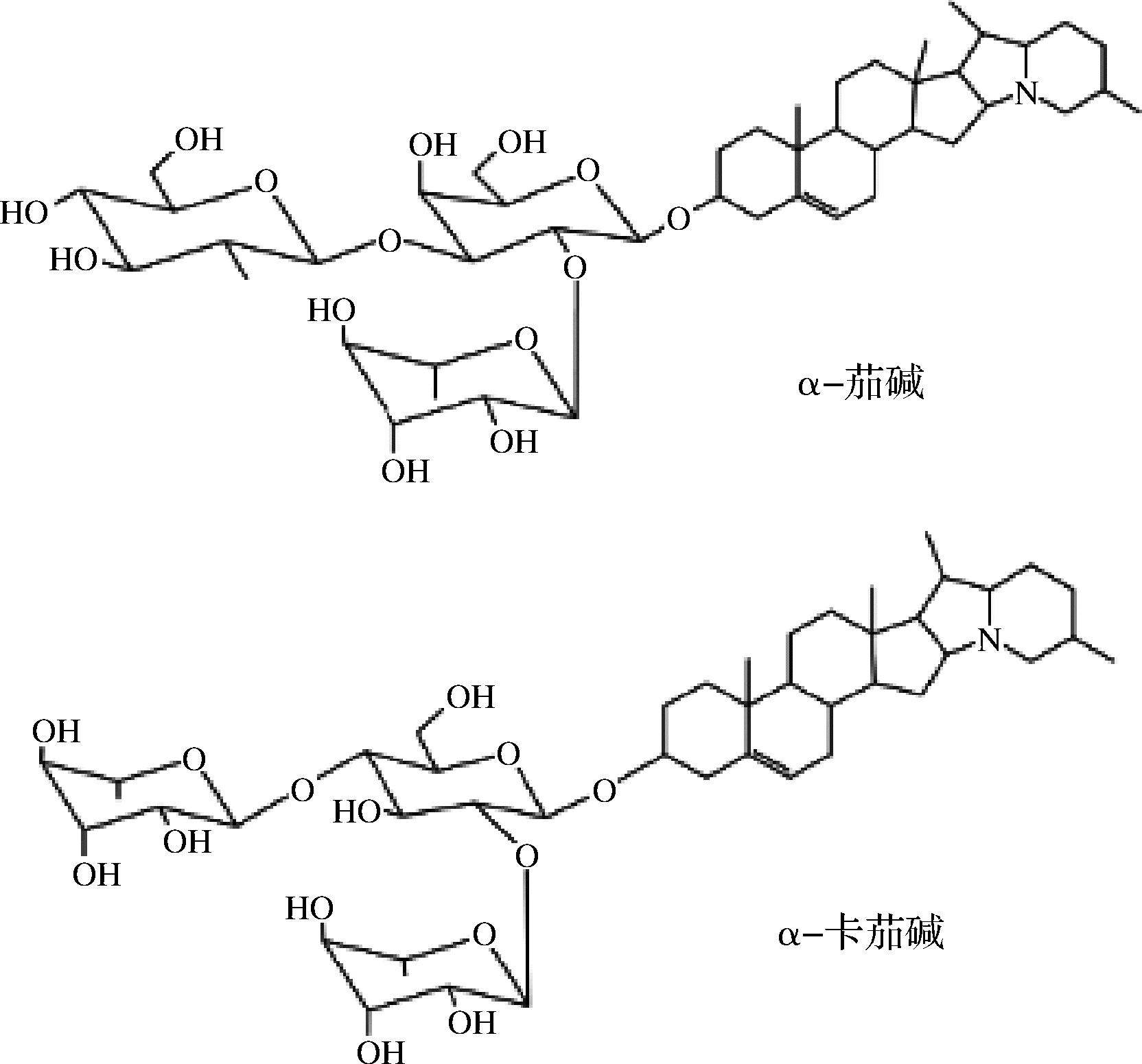
图1 α-茄碱和α-卡茄碱的化学结构
Fig.1 The structures of α-solanine and α-solanine
截止目前的实际生产中,没有专用试剂用于抑制马铃薯块茎产生GAs。通过施用氯苯胺灵(chlorpropham,CIPC)在抑制发芽的同时抑制块茎中产生GAs。但CIPC在安全性上存在一定风险,欧盟自2019年起已禁止使用CIPC。物理方法(控制温湿度、CO2浓度以及避光)也是控制马铃薯GAs含量的手段。但是此方法会增加成本,尤其在经济欠发达地区。在运输和销售过程中难以控制储存条件。通过基因改造进行马铃薯育种,必须在降低块茎中GAs含量的同时维持植株其他器官中GAs的水平,从而保持整个植株的抗性,导致基因改造育种周期长、降毒率不高。因此,亟需寻找新的高效安全的解毒技术。
生物降解是利用微生物或其产物来降解食品中的污染物,包括外源污染物和内源毒素。微生物可以在生长过程中将有毒的污染物转化为无毒化合物。到目前为止,已经开发出许多微生物来降解食品中的污染物。有研究表明,红串红球菌[7]、结合分枝杆菌[8]和嗜麦芽窄食单胞菌[9]可以降解黄曲霉毒素B1。乳酸菌[10]、枯草芽孢杆菌[11]和小片球菌[12]可降解葡萄及其制品中的赭曲霉毒素。微生物降解以其代谢多样性,降解产物对食品和环境没有二次污染等优点成为有效去除食品毒素污染物的首选技术。
本研究从发芽绿化的马铃薯块茎中分离筛选高效降解马铃薯GAs的菌株,通过16S rDNA测序结合菌落形态、生理生化试验进行菌株鉴定,评价其安全性并探究其降解特性和降解产物,以期得到马铃薯GAs高效降解菌,为开发马铃薯GAs的生物降解技术提供科学依据及技术支撑。
1 材料与方法
1.1 试验材料
1.1.1 供试材料
马铃薯块茎购自河北省保定市莲池区人人乐超市。
1.1.2 试剂与仪器
α-茄碱、α-卡茄碱,上海源叶生物科技有限公司;乙腈、甲醇,均为色谱纯,德国Merck公司;PCR试剂盒,北京博迈德基因技术有限公司;质粒提取试剂盒,天根生化科技(北京)有限公司;药敏试剂盒,杭州滨和微生物试剂有限公司。
1260高效液相色谱仪,安捷伦科技有限公司;PCR仪,美国Bio-Rad公司;YXQ-SG46-280S型蒸汽灭菌器,上海博迅实业有限公司医疗设备厂;SHP-250型生化培养箱,上海精宏实验设备有限公司。
1.1.3 培养基
LB液体培养基(g/L):蛋白胨10、牛肉膏3、NaCl 5,调节pH 至7.5;固体培养基添加琼脂15 g;121 ℃高压灭菌20 min。
无机盐液体培养基(g/L):NaCl 1、KH2PO4 0.5、K2HPO4 1.5、(NH4)2SO4 2、MgSO4 0.2,调节pH至7.0,121 ℃灭菌20 min。
筛选培养基:在无机盐培养基中添加α-茄碱或α-卡茄碱至终质量浓度为50 μg/mL。
1.2 试验方法
1.2.1 马铃薯块茎内生菌的分离
参考叶文雨等[13]的方法对马铃薯块茎进行表面消毒。选取绿皮、发芽处块茎和芽进行研磨,加入1 mL无菌水,取100 μL涂布于LB培养基平板,置于30 ℃培养箱中。
1.2.2 GAs降解菌株的筛选
将分离的内生菌接种至筛选固体培养基中,30 ℃培养72 h。挑取菌体分别接种至筛选液体培养基中,30 ℃、200 r/min培养72 h。以不接菌的培养基为空白对照,培养条件同上。参照HENNESSY等[14]的方法并加以改进建立薄层色谱法(thin-layer chromatography,TLC)检测方法:将10 μL培养液点样于GF254硅胶板上,以正丁醇∶乙醇∶水(2∶1∶1,体积比)为流动剂,显影液为50%硫酸,显影时间5 min。将初筛到的菌株按上述方法培养,使用HPLC检测α-茄碱和α-卡茄碱的含量。HPLC检测条件:色谱柱,Agilent ZORBAX Eclipse Plus C18(4.6×250 mm,5 μm);柱温40 ℃;检测器VWD;流动相,V(0.01 mol/L磷酸盐,pH 7.6)∶V(乙腈)=40∶60;进样量10 μL;检测波长210 nm。降解效率按公式(1)计算:
降解率![]()
(1)
式中:C,对照组中GAs含量,μg/mL;T,试验组中GAs含量,μg/mL。
1.2.3 菌株鉴定
1.2.3.1 菌落及细胞形态观察
将筛选得到的GAs降解菌株划接种于LB固体培养基中,30 ℃培养24 h后观察菌落形态特征,并用革兰氏染色法和孔雀绿染色法进行细胞染色观察。
1.2.3.2 生理生化试验
菌株的生理生化试验参考《常见细菌系统鉴定手册》[15]进行测定。
1.2.3.3 16S rDNA鉴定
利用十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)法[16]提取菌株的基因组DNA。以基因组DNA为模板,参照叶文雨等[13]的方法,采用通用引物27F/1492R进行16S rDNA PCR扩增。将扩增成功的PCR产物送至北京六合华大基因科技有限公司进行测序。测序结果在NBCI(https://blast.ncbi.nlm.nih.gov)上进行BLAST对比。使用MEGA-X软件,Neighbor-joining方法进行系统发育树构建。
1.2.4 安全性评价
1.2.4.1 药敏试验
以划线的方式将待测菌液涂布到LB固体培养基中。用无菌镊子取药敏片贴于培养基表面。30 ℃培养24 h后,观察抑菌圈。
1.2.4.2 质粒提取
按照质粒提取试剂盒说明书进行质粒提取,并以1%的琼脂糖凝胶电泳进行检测。
1.2.4.3 有害代谢产物评价
参照《常见细菌系统鉴定手册》[15]中的方法,检测降解菌株的硝基还原酶、氨基脱羧酶活性、吲哚检测。
1.2.4.4 溶血活性检测
将菌液涂布于血琼脂培养基中,30 ℃培养24 h后,观察溶血圈,金黄色葡萄球菌ATCC 25923作为阳性对照。
1.2.5 降解特性测定
挑取菌株C11的单菌落,接种于LB液体培养基,30 ℃ 200 r/min培养至OD600值为1.0获得种子培养液。将菌株C11种子液以1%接种量分别接种于含α-茄碱或α-卡茄碱(50 μg/mL)的LB液体培养基中,分别检测不同温度(20、25、30、35、40 ℃)、pH(5.0、6.0、7.0、8.0、9.0)、时间(1、3、5、7 d)、GAs初始质量浓度(12.5、25、50、75、100 μg/mL)、接种量(1%、5%、10%)和金属离子(Mn2+、Al3+、Cu2+、Fe3+、Fe2+、Mg2+、Zn2+,0.1 mmol/L)对降解率的影响。
1.2.6 降解活性成分测定
菌株C11培养至对数期后,根据LEI等[17]的方法分离胞外培养液、胞内提取物和微生物细胞。将α-茄碱和α-卡茄碱(终质量浓度50 μg/mL)添加到菌株C11全细菌培养物和各组分中,30 ℃孵育72 h,测定GAs含量。
1.2.7 降解产物测定
将菌株C11分别接种到含有α-茄碱或α-卡茄碱(50 μg/mL)的 LB 液体培养基中,37 ℃、200 r/min培养72 h。取 1 mL培养液,加入1 mL体积分数10%的乙酸,混合均匀后12 000×g离心15 min,取上清液。上清液经过有机滤膜(0.22 μm)过滤后,参照郑旭等[18]的方法通过液相色谱-离子阱-飞行时间串联质谱(liquid chromatography-ion trap-time of flight mass spectrometry,LC-IT-TOF-MS)检测降解产物。
1.3 数据统计分析
采用SPSS 18.0进行数据分析,GraphPad Prism 7作图。
2 结果与分析
2.1 GAs降解菌株的分离筛选
通过TLC检测到一株可同时降解α-茄碱和α-卡茄碱的菌株C11,结果见图2。α-茄碱的标准曲线为y=4.346x+46.93,R2=0.997 2, α-卡茄碱的标准曲线为y=4.051x+32.05,R2=0.998 8, 两者R2均大于0.99,满足检测要求。HPLC检测菌株C11对α-茄碱和α-卡茄碱降解率分别为(71±2.0)%和(72.3±1.6)%,具有较好的GAs降解效果。

a-α-茄碱;b-α-卡茄碱
图2 TLC检测GAs
Fig.2 Detection of GAs by TLC
2.2 GAs降解菌株的鉴定
2.2.1 形态学特征
菌株C11的形态学特征见图3。C11菌落白色、不透明、菌落大,边缘褶皱表面光滑。菌株C11为革兰氏阳性菌,菌体呈杆状,且具有芽孢。
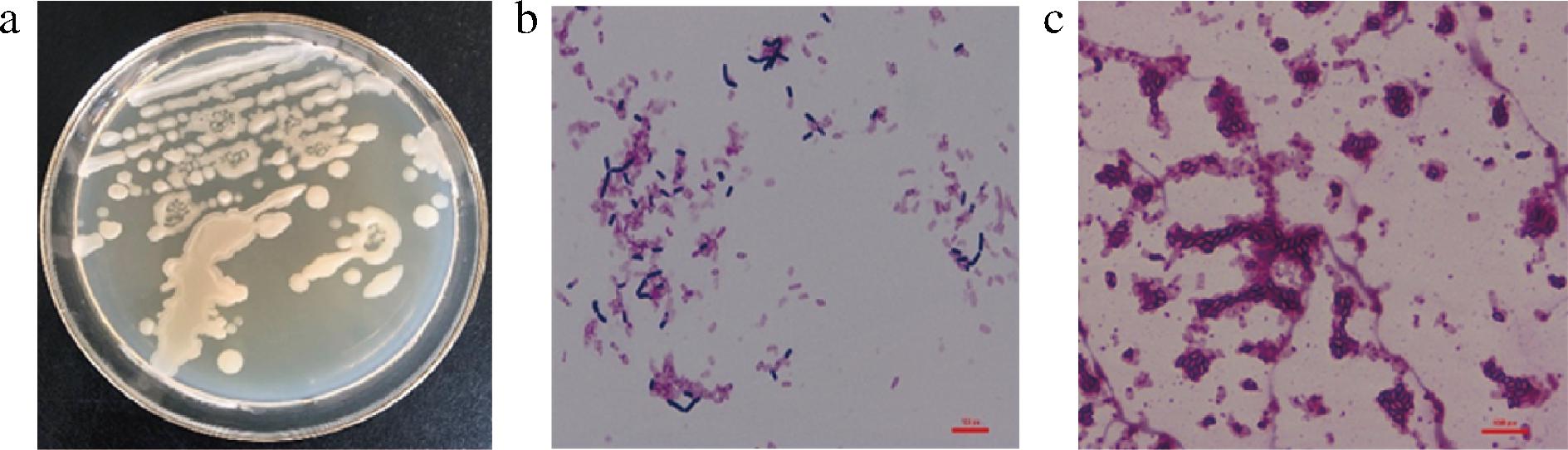
a-菌落形态;b-革兰氏染色;c-孔雀石绿染色
图3 菌株C11的形态学特征
Fig.3 Morphological characteristics of strain C11
2.2.2 生理生化试验
表1显示降解菌的生理生化试验结果。菌株C11的V.P.试验、甲基红试验和硝酸盐还原为阴性,接触酶和明胶液化为阳性,该菌株能利用淀粉、半乳糖、葡萄糖和山梨醇,不能利用木糖醇,不能水解酪蛋白,苯丙氨酸脱氨酶反应阴性,不脱氨。
表1 降解菌的生理生化测定
Table 1 Physiological and biochemical features of degrading strain

测定项目C11V.P.试验-甲基红试验-接触酶+淀粉水解+明胶液化+硝酸盐还原-葡萄糖+木糖醇-半乳糖+山梨醇+苯丙氨酸脱氨酶-酪氨酸水解-
2.2.3 16S rDNA鉴定
将菌株C11的16S rDNA测序结果在NCBI-BLAST进行同源性分析并构建系统发育树,结果见图4。经同源性分析,菌株C11为芽孢杆菌属。系统发育树结果显示,菌株C11与Bacillus velezensis遗传相对距离最近,同源性上最近。结合菌株的形态学特征和生理生化鉴定,菌株C11可确定为贝莱斯芽孢杆菌,命名为Bacillus velezensis C11。

图4 基于16S rDNA序列的菌株C11系统发育树
Fig.4 Phylogenetic tree of strain C11 based on 16S rDNA sequencing
2.3 安全性评价
2.3.1 药敏试验
菌株C11对常抗生素敏感性测定结果见表2。菌株C11对头孢他啶、乙酰螺旋霉素、阿奇霉素、麦迪霉素和四环素具有抗性。
表2 降解菌对常见抗生素的敏感性
Table 2 Sensitivity of degrading strain C11 to common antibiotics

抗生素类别抗生素名称敏感性青霉素类氨苄西林S青霉素GS头孢类头孢哌酮S头孢他啶R
续表2
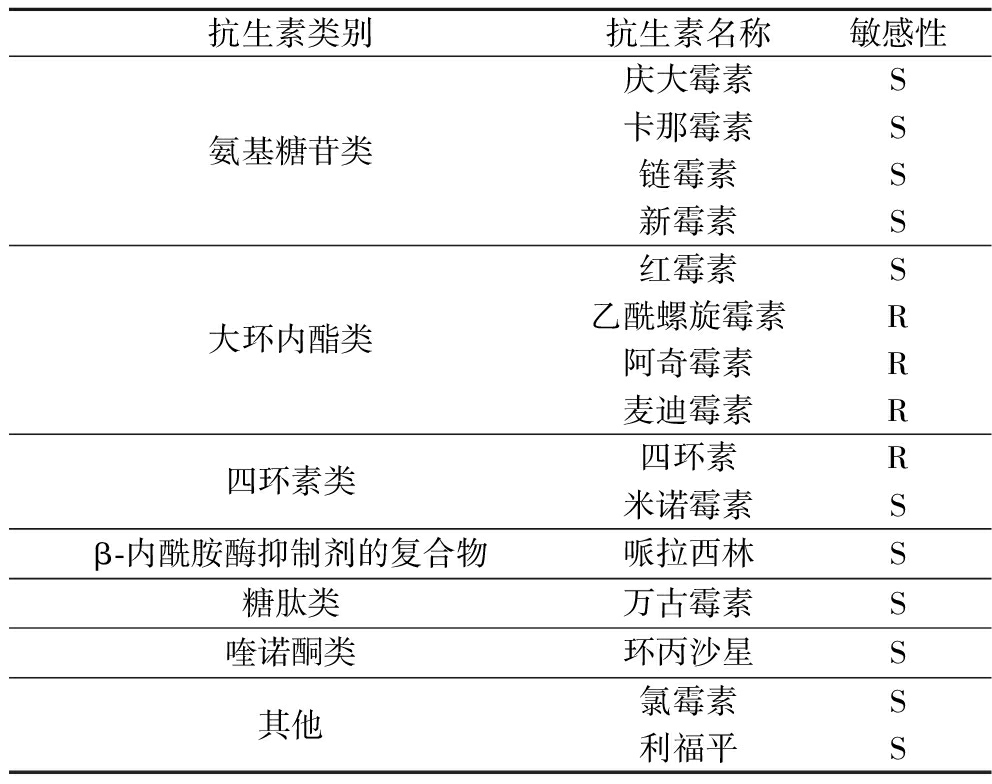
抗生素类别抗生素名称敏感性氨基糖苷类庆大霉素S卡那霉素S链霉素S新霉素S大环内酯类红霉素S乙酰螺旋霉素R阿奇霉素R麦迪霉素R四环素类四环素R米诺霉素Sβ-内酰胺酶抑制剂的复合物哌拉西林S糖肽类万古霉素S喹诺酮类环丙沙星S其他氯霉素S利福平S
注:S代表敏感;R代表抗性。
2.3.2 质粒检测
对菌株C11进行质粒提取,结果显示菌株C11中不含有质粒(图5)。
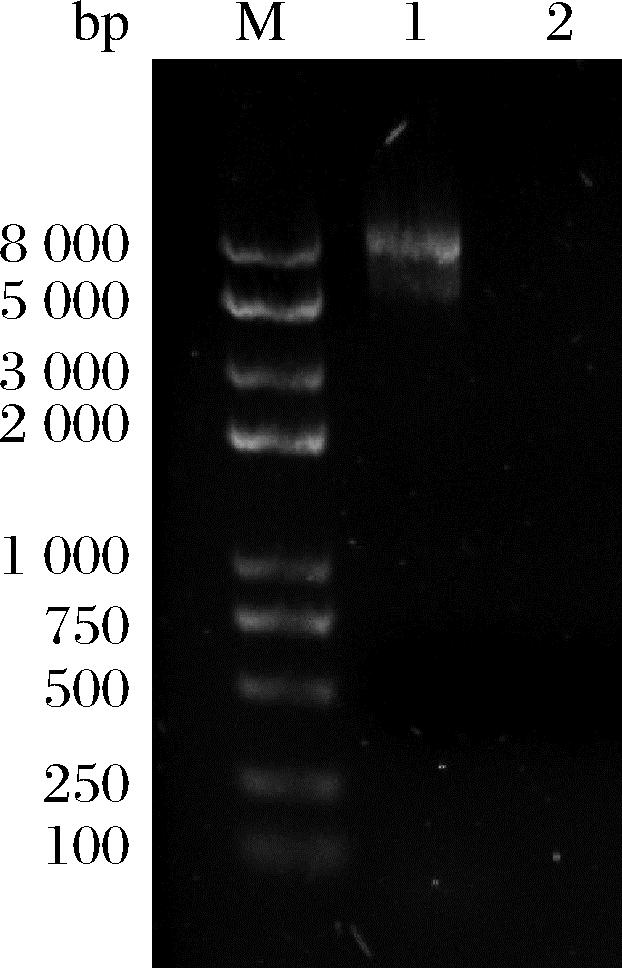
M-DNA marker;1-含有质粒的芽孢杆菌菌株;2-菌株C11
图5 菌株C11质粒提取电泳图
Fig.5 Plasmid extraction electrophoresis of strains C11
2.3.3 有害代谢产物检测
菌株C11的有害代谢产物的测定结果见表3,硝基还原酶和氨基酸脱羧酶活性为阴性,吲哚试验结果为阴性,表明菌株C11不产生亚硝酸盐、生物胺和吲哚。
表3 菌株C11的有害代谢产物检测
Table 3 Detection of harmful metabolites of strain C11
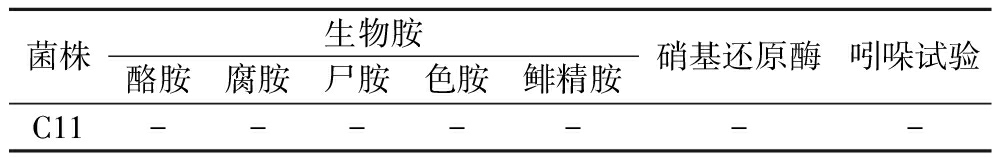
菌株生物胺酪胺腐胺尸胺色胺鲱精胺硝基还原酶吲哚试验C11-------
注:+为阳性;-为阴性。
2.3.4 溶血试验
菌株C11的溶血试验结果见图6。阳性对照菌株金黄葡萄球菌ATCC 25923周围出现溶血圈,表明实验准确。菌株C11的菌落周围没有观察到溶血圈,表明菌株C11没有溶血活性。
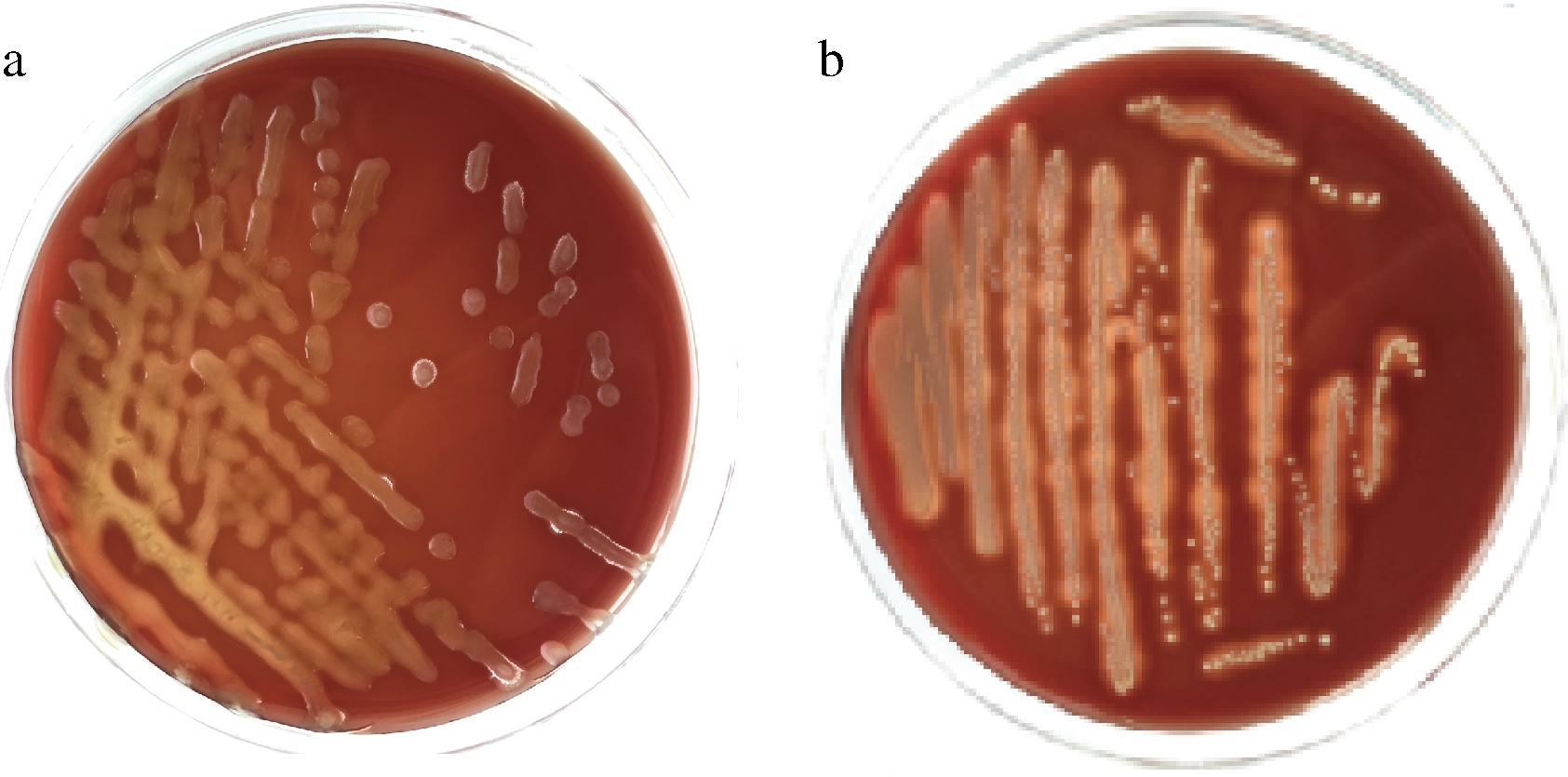
a-菌株C11;b-ATCC 25923
图6 菌株溶血试验结果
Fig.6 Hemolysis test results of strains
2.4 降解特性测定
菌株C11对GAs的降解特性见图7。菌株C11在30 ℃时降解率达到最大,对α-茄碱和α-卡茄碱的降解率分别为79.84%和80.36%。并且菌株在20~35 ℃对GAs的降解率均大于50%。因此,30 ℃是菌株C11对GAs的最适降解温度,同时菌株C11在20~40 ℃均能有效降解GAs。
菌株C11在pH为6.0时,对GAs的降解率最高。在pH 5.0~8.0的范围内菌株C11对GAs的降解率在60%以上。因此菌株C11对GAs的最适降解pH为6.0,并且在较宽的pH范围内有效降解GAs。
随着时间的增加,菌株C11对GAs的降解率逐渐增加,在5 d后对GAs的降解率达到90%以上。随着GAs浓度的升高,菌株C11的降解作用有所下降,但降解率均在65%以上。 结果表明,菌株C11能够耐受并降解高浓度的GAs。菌株C11的接种量对GAs的降解率没有显著影响。1 mmol/L的Cu2+对菌株C11降解GAs有抑制作用,Mn2+对菌株C11降解GAs有激活作用。
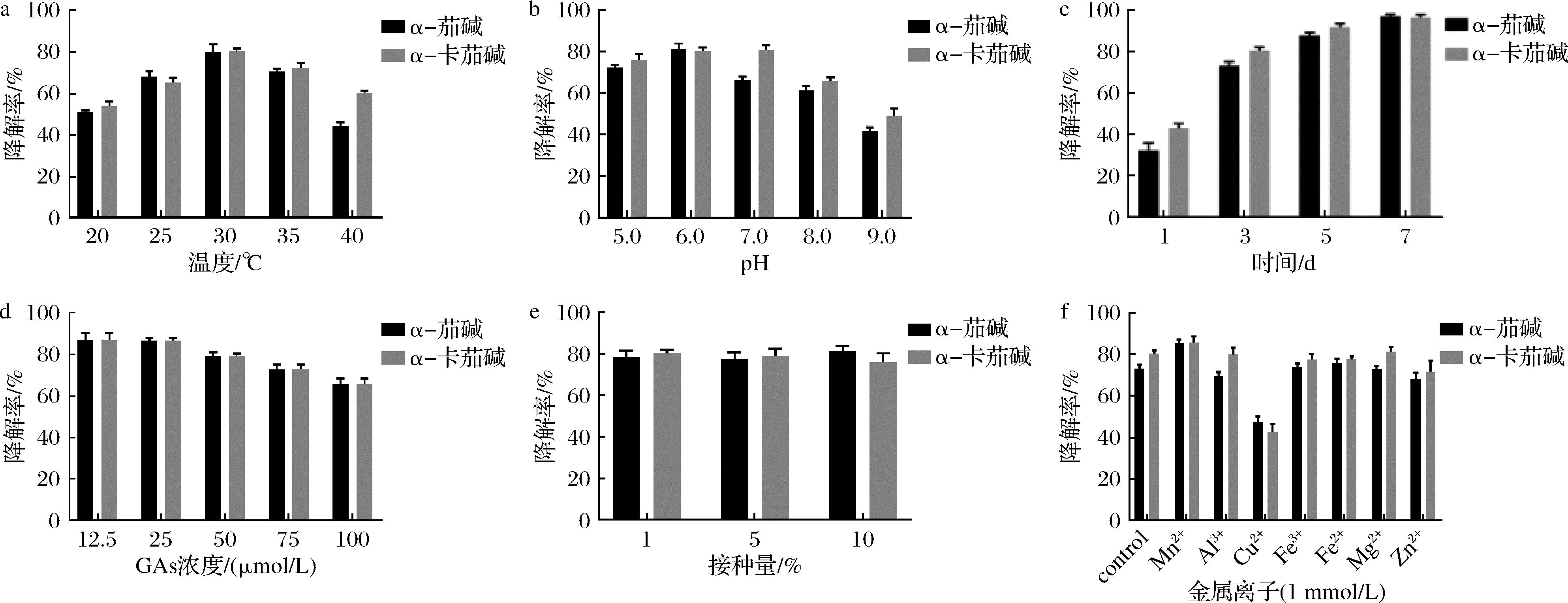
a-温度;b-pH;c-培养时间;d-GAs初始浓度;e-接种量;f-金属离子
图7 菌株C11对GAs的降解特性
Fig.7 Degradation characteristics of GAs by strain C11
2.5 降解GAs的活性成分测定
将菌株C11的全细菌培养物与各种组分的GAs降解率进行比较(图8),全细菌培养液的降解率最高为79.81%(α-茄碱)和81.78%(α-卡茄碱),使用微生物细胞降解率为67.52%(α-茄碱)和59.75%(α-卡茄碱),使用胞内提取物降解率为50.56%(α-茄碱)和46.37%(α-卡茄碱),使用胞外培养液降解率为4.96%(α-茄碱)和8.24%(α-卡茄碱)。结果表明降解GAs的活性成分位于细胞内。
2.6 降解产物的测定
LC-IT-TOF-MS对LB液体培养基中GAs的代谢产物进行检测,结果如图9所示。碎片的质荷比(m/z)由阳离子模式质谱扫描获取,结合降解产物性质,α-茄碱和α-卡茄碱的降解产物可能有茄啶(图9-c和图9-d)和胆固醇(图9-e和图9-f)。
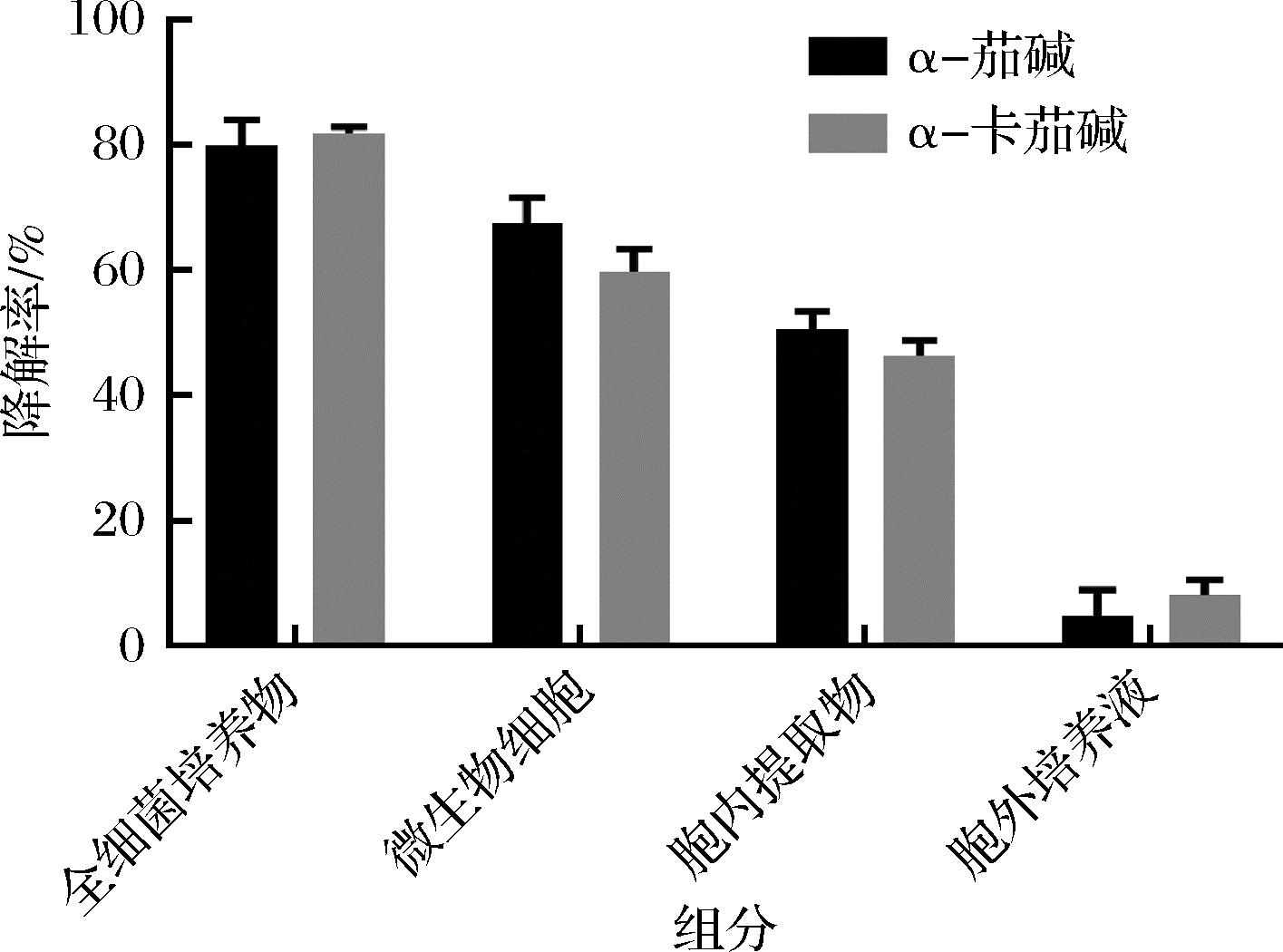
图8 菌株C11不同组分对GAs的降解率
Fig.8 Degradation rate of GAs by different compositions of strain C11
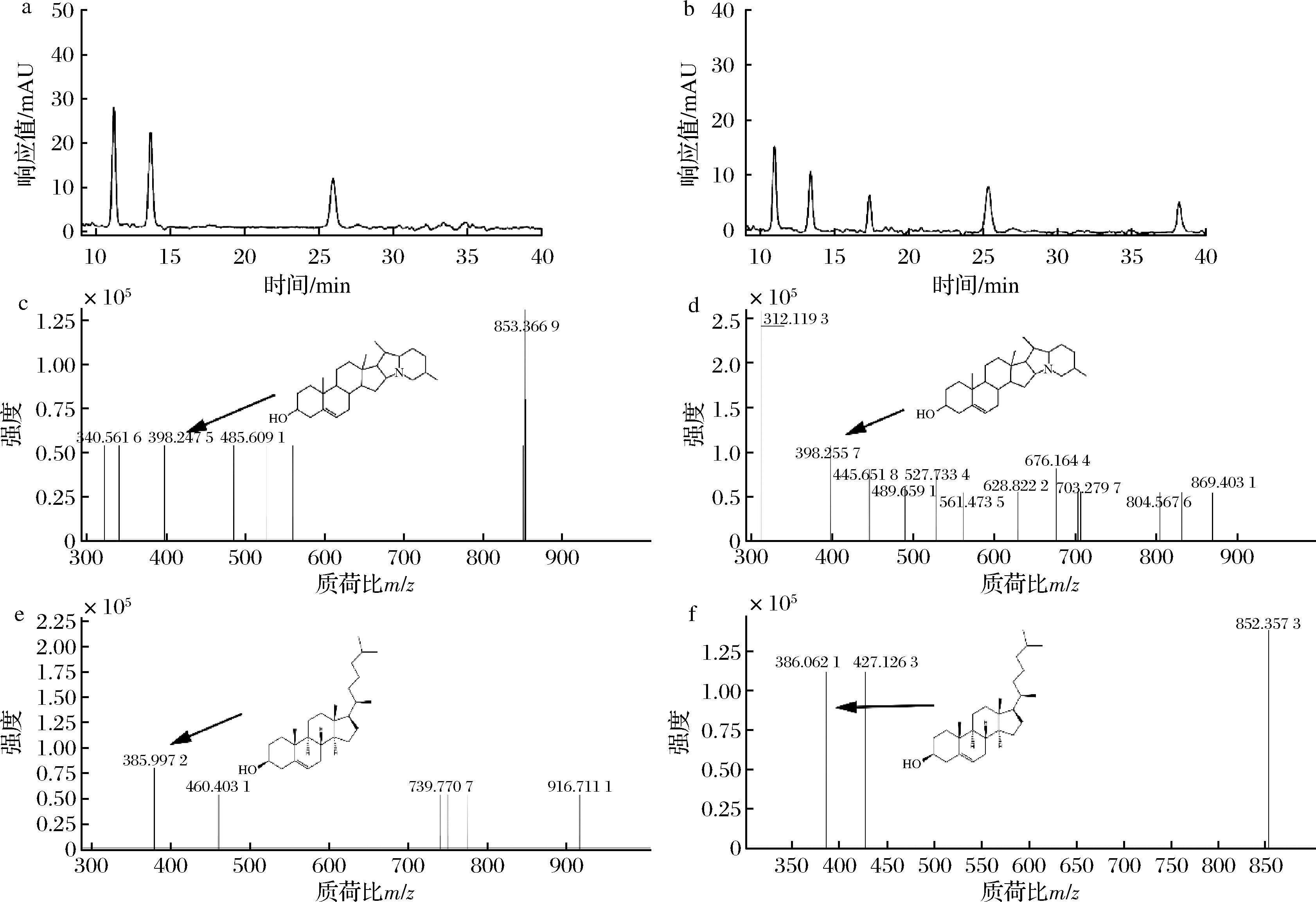
a-对照组α-茄碱和α-卡茄碱的液相色谱;b-菌株C11降解α-茄碱和α-卡茄碱的液相色谱; c、e-菌株C11降解α-茄碱代谢产物的质谱;d、f-菌株C11降解α-卡茄碱代谢产物的质谱
图9 菌株C11 降解GAs的代谢产物
Fig.9 Metabolites of GAs by strain C11 degrading
3 结论与讨论
本研究从发芽和绿化马铃薯块茎中筛选得到GAs降解菌株C11,经鉴定为贝莱斯芽孢杆菌(Bacillus velezensis)。菌株C11可以制备为菌剂,在马铃薯收获后施用于其表面以期在贮藏期间降低GAs含量。菌株C11为芽孢杆菌,形成的孢子能够在各种土壤和植物环境中定殖并且在环境中保持更长的时间,也是芽孢杆菌用于制备菌剂的优势。由于这一特性,菌株C11能够在马铃薯块茎中长时间定殖,从而获得更为持久的GAs降解能力。
对菌株C11进行体外安全性评价发现,虽然菌株C11对部分抗生素有抗性,但是不含有质粒,因此不存在耐药因子转移的风险。同时,菌株C11不具有溶血性,不产生有害代谢产物,综上,可判定菌株C11具有一定的安全性。后续可通过动物试验进一步评价菌株C11的安全性。贝莱斯芽孢杆菌是常见的生防菌,对多种病原菌均具有良好的抑制作用[19-20]。
菌株C11对GAs的最适降解条件为30 ℃、pH 6.0。菌株C11培养5 d即可对GAs的降解率达到90%以上。并且菌株C11具有良好的环境适应性,以及能够耐受并降解高浓度的GAs。三糖侧链的性质强烈影响GAs的毒性。菌株C11在细胞内可能通过脱糖基化去除三糖侧链,生成茄啶,后者可能代谢为胆固醇,再被微生物代谢利用,从而达到解毒的效果。菌株C11将茄啶代谢为胆固醇过程中是否存在中间代谢产物还需进一步确定。这些结果表明菌株C11是一株具有较高潜力的GAs降解菌株。
本研究从发芽绿化马铃薯块茎中分离筛选得到一株马铃薯GAs高效降解菌,经鉴定为贝莱斯芽孢杆菌C11,体外安全性试验表明菌株C11具备一定的安全性。菌株C11具有良好的环境适应性和GAs耐受性,在较大的温度和pH值范围内以及在短时间内有效降解GAs。菌株C11可能在细胞内将GAs降解为胆固醇后进一步代谢利用。本研究为开发绿色安全的马铃薯GAs生物降解技术从而确保食品安全提供了科学依据和技术支持。
[1] CHENG L X, WANG Y P, LIU Y S, et al.Comparative proteomics illustrates the molecular mechanism of potato (Solanum tuberosum L.) tuberization inhibited by exogenous gibberellins in vitro[J].Physiologia Plantarum, 2018, 163(1):103-123.
[2] MANN C C.1493:Uncovering the New World Columbus Created[M].New York:Knopf, 2011.
[3] 赵祉强, 李晓龙.浅议马铃薯的营养价值与功效[J].中国果菜, 2019, 39(1):45-47.
ZHAO Z Q, LI X L.The nutritional value and efficacy of potato[J].China Fruit &Vegetable, 2019, 39(1):45-47.
[4] WANG W T, ZHANG J W, WANG D, et al.Relation between light qualities and accumulation of steroidal glycoalkaloids as well as signal molecule in cell in potato tubers[J].Acta Agronomica Sinica, 2010, 36(4):629-635.
[5] MONDY N I, MUNSHI C B.Effect of selenium fertilization on the glycoalkaloid and nitrate-nitrogen content of potatoes[J].Journal of Food Quality, 1990, 13(5):343-350.
[6] AL SINANI S S S, ELTAYEB E A.The steroidal glycoalkaloids solamargine and solasonine in Solanum plants[J].South African Journal of Botany, 2017, 112:253-269.
[7] ALBERTS J F, ENGELBRECHT Y, STEYN P S, et al.Biological degradation of aflatoxin B1 by Rhodococcus erythropolis cultures[J].International Journal of Food Microbiology, 2006, 109(1-2):121-126.
[8] TENIOLA O D, ADDO P A, BROST I M, et al.Degradation of aflatoxin B1 by cell-free extracts of Rhodococcus erythropolis and Mycobacterium fluoranthenivorans sp.nov.DSM44556T[J].International Journal of Food Microbiology, 2005, 105(2):111-117.
[9] GUAN S, JI C, ZHOU T, et al.Aflatoxin B1 degradation by Stenotrophomonas maltophilia and other microbes selected using coumarin medium[J].International Journal of Molecular Sciences, 2008, 9(8):1489-1503.
[10] FUCHS S, SONTAG G, STIDL R, et al.Detoxification of patulin and ochratoxin A, two abundant mycotoxins, by lactic acid bacteria[J].Food and Chemical Toxicology, 2008, 46(4):1398-1407.
[11] SHI L, LIANG Z H, LI J X, et al.Ochratoxin A biocontrol and biodegradation by Bacillus subtilis CW 14[J].Journal of the Science of Food and Agriculture, 2014, 94(9):1879-1885.
[12] ABRUNHOSA L, IN S A, RODRIGUES A I, et al.Biodegradation of ochratoxin A by Pediococcus parvulus isolated from Douro wines[J].International Journal of Food Microbiology, 2014, 188:45-52.
S A, RODRIGUES A I, et al.Biodegradation of ochratoxin A by Pediococcus parvulus isolated from Douro wines[J].International Journal of Food Microbiology, 2014, 188:45-52.
[13] 叶文雨, 谢序泽, 连加淳, 等.菌草绿洲一号内生菌的分离鉴定及其生物学特性[J].热带农业科学, 2019, 39(1):52-57;74.
YE W Y, XIE X Z, LIAN J C, et al.Isolation and identification of an endophytic bacteria from JUNCAO and their activities biological characteristics[J].Chinese Journal of Tropical Agriculture, 2019, 39(1):52-57;74.
[14] HENNESSY R C, JØRGENSEN N O G, SCAVENIUS C, et al.A screening method for the isolation of bacteria capable of degrading toxic steroidal glycoalkaloids present in potato[J].Frontiers in Microbiology, 2018, 9:2648.
[15] 东秀珠, 蔡妙英, 等.常见细菌系统鉴定手册[M].北京:科学出版社, 2001.
DONG X Z, CAI M Y, et al.Manual for Identification of Common Bacterial Systems[M].Beijing:Science Press, 2001.
[16] WINAND R, BOGAERTS B, HOFFMAN S, et al.Targeting the 16S rRNA gene for bacterial identification in complex mixed samples:Comparative evaluation of second (Illumina) and third (Oxford nanopore technologies) generation sequencing technologies[J].International Journal of Molecular Sciences, 2019, 21(1):298.
[17] LEI Y P, ZHAO L H, MA Q G, et al.Degradation of zearalenone in swine feed and feed ingredients by Bacillus subtilis ANSB01G[J].World Mycotoxin Journal, 2014, 7(2):143-151.
[18] 郑旭, 刘佳萌, 孙玉凤, 等.贮藏期影响不同品种马铃薯龙葵碱风险的主要环境因素[J].食品安全质量检测学报, 2019, 10(9):2481-2493.
ZHENG X, LIU J M, SUN Y F, et al.Main environmental factors of solanum during storage for different potato varieties[J].Journal of Food Safety &Quality, 2019, 10(9):2481-2493.
[19] 李铮, 王金辉, 丁丽丽, 等.贝莱斯芽孢杆菌菌株NZ-4生防潜能及基因组学分析[J].江苏农业科学, 2023, 51(2):117-125.
LI Z, WANG J H, DING L L, et al.Biocontrol potential and genomic analysis of Bacillus velezensis strain NZ-4[J].Jiangsu Agricultural Sciences, 2023, 51(2):117-125.
[20] 贾鹏莉, 沈硕, 胡英杰.一株马铃薯干腐病拮抗菌芽孢杆菌的筛选、鉴定及生防因子初探[J].福建农业学报, 2020, 35(12):1336-1345.
JIA P L, SHEN S, HU Y J.Screening, identification, and preliminary analysis on antagonistic Bacillus sp.against potato dry rot[J].Fujian Journal of Agricultural Sciences, 2020, 35(12):1336-1345.