衰老是机体各器官功能随着年龄增长的自然退行性变化[1]。随着社会的发展,生育率降低和人均寿命的延长使得社会老龄化问题日益凸显,人们对抗衰老功能性产品的需求日益增长。在对衰老机制的不断研究中,学者发现衰老跟自由基的产生密切相关,很多能够清除自由基和具有抗氧化活性的天然物质表现出较好的抗衰老作用,只因这类物质可通过影响机体内抗氧化基因水平的表达,增强机体内氧化-还原防御系统,减少自由基损伤,从而起到抗衰老的作用[2-3]。目前研究的抗衰老功能性产品的原料多来自植物,如多酚类和黄酮类,相对而言动物成分相关研究报道较少。最新研究发现,由于生活环境的特殊性,海洋动物的机体内含有许多结构特殊的生物活性物质和代谢产物,在抗衰老作用中具有潜在的广阔前景。
牡蛎又称生蚝、海蛎子,广泛分布于我国沿海地区,是我国第一大养殖贝类[4]。牡蛎肉质鲜美,口感爽滑,含有蛋白质、氨基酸、多糖、牛磺酸等丰富的营养成分[5],素有“海洋牛奶”的美誉,具有抗氧化[6]、抗衰老[7]、免疫调节[8]、抗肿瘤[9]、降血脂[10]等多种生物活性,表现出极高的药用价值和食用价值,是国家卫生健康委员会第一批批准的药食同源食品之一[11]。近年来几项研究表明,牡蛎具有改善小鼠生殖衰老状态、保护光老化损伤的皮肤以及延长秀丽隐杆线虫寿命的作用[12-14],这为牡蛎在抗衰老功效产品的研发提供了新思路。然而目前的研究还不够深入和系统,存在着很多问题,比如不同加工处理的牡蛎提取物作用是否一致、主要功效因子尚不清楚、作用机制如何等,需要更多的研究去阐明。本文拟采用秀丽隐杆线虫为动物模型,探究3种不同的牡蛎提取物对秀丽隐杆线虫的寿命、急性氧化应激损伤以及体内相关酶活力的影响,试图评价不同牡蛎提取物的抗衰老作用差异,为牡蛎的抗衰老功能性产品开发和附加产值资源化利用提供理论依据。
1 材料与方法
1.1 材料与试剂
牡蛎,购自湛江市场;N2型秀丽隐杆线虫、OP50大肠杆菌,福建上源生物科学技术有限公司;盛美诺牡蛎肽(oyster peptide,OP),海南翔泰渔业股份有限公司(OP为市售产品,样品总重均分子质量为393 Da,1 000以下的分子质量占比约97.6%)。
木瓜蛋白酶(食品级),上海源叶生物科技有限公司;线虫生长培养基(nematode growth medium,NGM),石家庄西默科技有限公司;LB(Luria-Bertuni)琼脂,广东环凯微生物科技有限公司;LB肉汤,青岛高科技工业园海博生物技术有限公司;琼脂粉,上海瑞永生物科技有限公司;盐酸四咪唑、5-氟脱氧尿苷(floxuridine,FUdR),上海麦克林生化科技有限公司;NaClO,上海易恩化学技术有限公司;谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)、超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)试剂盒,北京盒子生工科技有限公司。
1.2 仪器与设备
HH-S4数显恒温搅拌水浴锅,常州市金坛友联仪器研究所;N-1300V-W旋转蒸发仪,上海爱朗仪器有限公司;SW-CJ-2F双人单面垂直送风净化工作台,广州吉迪仪器有限公司;B60F正立生物荧光显微镜;Thermo Lynx 6000 高速落地离心机,美国 Thermo Fisher Scientific 公司;SRL7045显微镜,北京天诺翔科学仪器有限公司;FD8508 冷冻干燥机,成都国光电气股份有限公司。
1.3 实验方法
1.3.1 牡蛎提取物的制备
新鲜牡蛎去壳后清洗牡蛎肉,沥干水分,匀浆,固液比均为1∶4(g∶mL),分别用水提法和酶解法来提取。具体步骤如下:(1)水提法:在50 ℃水浴锅中蒸煮1 h,用 200目纱布过滤,取滤液,再次将滤渣蒸30 min,过滤后合并滤液,得水提液;(2)酶解法:参考张雪妍[15]的研究,制备成溶液后加入3 000 U/g木瓜蛋白酶,用0.1 mol/L NaOH或HCl溶液调节至pH 6.5,62.5 ℃酶解4.5 h,充分搅拌并用均质机均质10 min,酶解适当时间后,沸水浴10 min,8 000 r/min离心20 min取上清液,得酶解液。将得到的水提液与酶解液于30 ℃旋蒸浓缩,真空冷冻干燥,得到牡蛎水提物(oyster water extract, WPO)与牡蛎酶解提取物(enzymolysis extract of oyster, EPO),置于-80 ℃下保存。
1.3.2 基本营养成分的测定
蛋白质测定参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中的凯氏定氮法;脂肪测定参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》中的索氏抽提法;灰分测定参照GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》中的高温灼烧法;总糖测定参照GB/T 9695.31—2008《肉制品 总糖含量测定》中的硫酸-苯酚法。
1.3.3 秀丽隐杆线虫的培养和同期化
参考张培丽等[16]的方法并稍作修改:配制NGM培养基,进行高压灭菌,加入双抗添加剂后倒入60 mm的培养皿中,冷却凝固后得到新鲜培养板,于培养板上滴入300 μL的OP50菌液,晾干,置于20 ℃培养箱中进行培养直至长出菌斑。使用高氯酸钠裂解法[17]。将3日龄的线虫用M9溶液冲洗至2 mL EP管中,静止2 min,去掉上清液获得虫体沉淀,每个EP管中加入500 μL虫体沉淀,1 mL线虫裂解液,盖上盖子充分摇晃5 min直至线虫裂解完全,常温下于3 000 r/min离心30 s,弃上清液留沉淀,用M9溶液重复清洗3次至NaClO刺鼻味消失,将虫卵置于涂有OP50的培养基中,放入20 ℃培养箱中培养48 h后得到同期化线虫。
1.3.4 牡蛎提取物对线虫寿命的影响
收集同期化培养至L4期的线虫,置于含有OP50的NGM培养板表面。培养基板含有不同质量浓度的提取物[50 μg/mL(低剂量)、200 μg/mL(中剂量)、800 μg/mL(高剂量)]和150 mmol/L FUdR(防止产卵),空白对照组以超纯水代替提取物,每组设置3个培养皿,每个培养皿内放置30条线虫,于20 ℃恒温培养箱中进行培养。从转移之日起开始统计死亡线虫,转移当天记为寿命实验第0天。线虫死亡判别标准为挑针触碰虫体而无任何反应并呈现僵直状态,即可断为死亡。直至全部线虫死亡,停止计数,绘制寿命曲线。
1.3.5 牡蛎提取物对线虫产卵能力的影响
参考魏伟[18]的方法并稍作修改:收集同期化线虫培养至L4时期,3种提取物不同质量浓度(50、200、800 μg/mL)处理,设空白对照组,每个培养皿内放置1条线虫,为一个处理组,设置5个平行,将线虫开始产卵的当天记为第 1 天,进行产卵计数,每隔24 h再次计数,并将线虫转移至新的培养皿中,直至线虫停止产卵,统计每天产卵总数,绘制曲线。
1.3.6 牡蛎提取物对线虫脂褐素的影响
收集同期化线虫培养至L4时期,3种提取物不同质量浓度(50、200、800 μg/mL)处理,设空白对照组,每个培养皿放置5条线虫为一个处理组,设置3个平行,培养条件同1.3.4节,培养3 d后将线虫用1 g/L的盐酸四咪唑溶液将其麻醉,转移到2%琼脂糖载玻垫片上,采用荧光显微镜观察并采集图片。使用Image J软件统计分析荧光强度。
1.3.7 牡蛎提取物对线虫身体头尾摆动次数的影响
收集同期化线虫培养至L4时期,根据上述实验确定的最佳作用浓度,进行线虫处理,每个培养皿放置5条线虫,每组设置3个平行,培养期间观察并记录线虫第5、7、9 天的运动能力。基本过程如下:向空培养皿板中滴1滴M9溶液,挑取1条线虫置于M9溶液中,使其在M9溶液中适应20 s,开始记录线虫虫体10 s内的身体摆动次数(线虫头部与尾部同时朝着相反的方向摆动一次后再同时摆回来为1次身体摆动)。
1.3.8 牡蛎提取物对急性氧化应激损伤秀丽隐杆线虫的影响
1.3.8.1 牡蛎提取物对百草枯损伤线虫存活率的影响
收集同期化线虫培养至L4时期,3种提取物在800 μg/mL质量浓度下处理线虫,每组设置3个平行,培养3 d后将其放入96孔板,每个孔板为15条线虫,分别加入200 μL 100 mmoL/L百草枯溶液,于20 ℃培养箱中培养5 h后观察存活率,绘制曲线。
1.3.8.2 牡蛎提取物对百草枯损伤线虫体内抗氧化酶活力的影响
收集同期化线虫培养至L4时期,给药和培养同1.3.8.1节,培养3 d后收集各组线虫于2 mL EP管中,用M9缓冲液洗涤多次,在提取液与水体积比500∶1的条件下处理样品,冰浴超声破碎3 s,间隔10 s,重复30次,8 000 r/min、4 ℃离心 10 min,取上清液置于冰上待测,按照试剂盒所述方法测定SOD、GSH-Px活力和 MDA 含量。
1.3.9 实验数据分析
每组实验独立重复3次。采用SPSS 26软件进行显著性分析(P<0.05),结果以平均值±标准差表示。数据分析采用GraphPad Prism 9作图。
2 结果与分析
2.1 基本营养成分测定结果
如表1所示,3种牡蛎不同提取物的成分具有差异性,总蛋白质的含量均最高,其中OP的蛋白质含量最高,为66.59%,WPO、EPO蛋白质含量分别为56.06%和55.71%,无显著性差异(P>0.05);总糖和灰分的含量较为接近,分别为8.63%~9.78%和7.67%~10.53%,其中,EPO的总糖含量较高;而EPO中的矿物质含量最高,WPO含量最低,对于两者之间的不同,说明单纯通过水提取可能会损失较多的矿物质元素。3种提取物的脂肪含量均很低,且无显著性差异。因此,不同制备方法得到的牡蛎提取物基本成分具有一定的差异,推测其具体成分可能也存在较大差异,其功效可能也有所不同。
表1 三种牡蛎提取物基本成分结果 单位:%
Table 1 Basic components three kinds of oyster extract

组别总蛋白总糖粗灰分粗脂肪EPO56.06±0.25a9.78±0.26a10.53±0.18a0.35±0.03aOP66.59±0.57b8.63±0.33b9.23±0.54b0.30±0.01aWPO55.71±3.4a9.12±0.29ab7.67±0.41b0.46±0.036a
注:组间不同字母之间表示差异性显著(P<0.05)(下同);以干基计。
2.2 牡蛎提取物对线虫寿命的影响
线虫的寿命是衡量线虫衰老最重要的一个直观指标[19]。与空白对照组相比,3种牡蛎提取物在不同质量浓度下(50~800 μg/mL)均能延长线虫平均寿命,寿命曲线均向右移(图1),但低质量浓度(50 μg/mL)下作用不显著,随着浓度的增加,平均寿命均延长显著(P<0.05),最长为(12.21±0.08) d,最多可增加平均寿命32.7%,800 μg/mL的EPO和OP均能使线虫最长寿命从15 d延长至18 d(表2)。综合来看OP的作用最强,生命曲线变化趋势最为明显(图1-b),表明3种不同提取物延长寿命的作用有所不同,可能与其成分不同有关。王力等[14]的研究结果表明,牡蛎酶解产物经超滤制备的组分在高剂量浓度下可使秀丽隐杆线虫平均寿命延长35.4%,与本实验的结果较为一致。
表2 牡蛎提取物对秀丽隐杆线虫寿命的影响
Table 2 Effects of oyster extracts on lifespan of C.elegans

提取物组别平均寿命/d百分比/%最长寿命/dEPO空白对照组9.93±0.66a100.015低剂量11.11±1.08a111.917中剂量11.50±0.08ab115.817高剂量12.15±0.47b 122.418OP空白对照组9.93±0.66a100.015低剂量11.15±0.34a112.317中剂量11.52±0.23b116.017高剂量12.21±0.08c122.918WPO空白对照组9.07±0.34a100.015低剂量10.44±0.99a115.115中剂量11.33±0.36ab124.916高剂量12.04±0.38c132.717
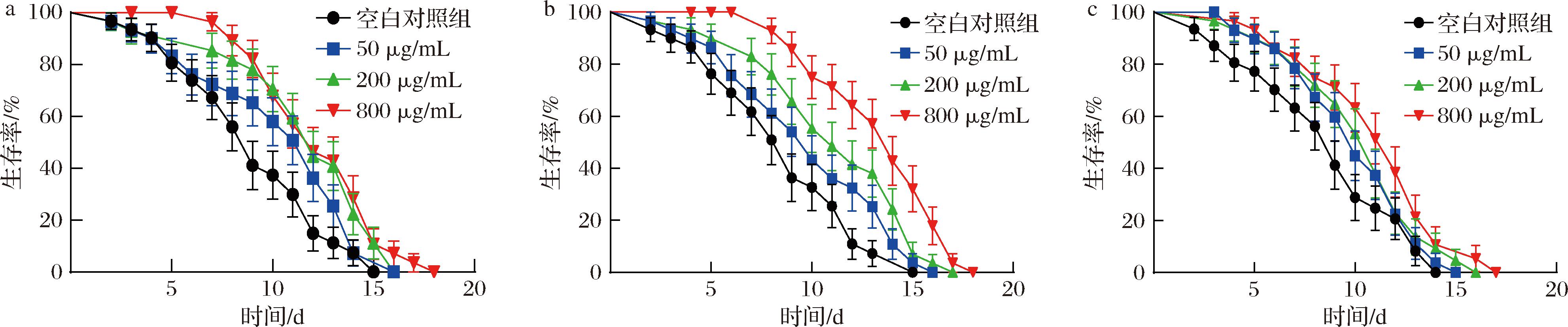
a-EPO 处理组;b-OP 处理组;c-WPO 处理组
图1 牡蛎提取物对秀丽隐杆线虫寿曲线命的影响
Fig.1 Effects of oyster extracts on lifespan curves of C.elegans
2.3 牡蛎提取物对线虫产卵能力的影响
线虫产卵量反映了线虫的生殖功能,与线虫的衰老直接相关,可用于评价线虫的衰老程度,因此,线虫的产卵数目和产卵周期是反映线虫生殖功能衰老状况的重要指标[20]。本研究结果显示,与空白对照组相比,低质量浓度(50 μg/mL)牡蛎提取物除了WPO以外其余2个样品处理均能显著增加线虫的产卵数目(P<0.05),中高质量浓度(200、800 μg/mL)的EPO和WPO组的线虫产卵数显著增加(P<0.05),但彼此之间无显著性差异,而OP随着浓度的增加产卵数目显著性增加(P<0.05),且呈剂量依赖性,分别提高了产卵数目52.5%、66.7%和80.2%。说明与EPO和WPO相比,中高浓度的OP作用更显著(图2)。与李振旺[21]的研究相比(55.7%),本研究的促生殖作用更明显,也间接地证实了牡蛎提取物确实具有促进动物生殖能力的作用[12]。

图2 牡蛎提取物对秀丽隐杆线虫产卵能力的影响
Fig.2 Effects of oyster extract on the spawning capacity of C.elegans
注:组间不同字母之间表示差异显著(P<0.05)(下同)。
2.4 牡蛎提取物对线虫脂褐素的影响
由于衰老会伴随着自由基的产生,自由基使脂肪氧化和溶酶体降解,导致溶酶体消化产物和脂肪残基增加,进而导致线虫体内脂褐素的积累,因此脂褐素是细胞开始衰老的特征,标志着细胞内清除系统功能障碍,是一种被广泛认可的衰老标志物[22]。 结果表明,与空白对照组相比,低中高浓度的EPO、OP和WPO均能显著降低线虫体内脂褐素的积累(P<0.05),且在50~800 μg/mL范围内呈现剂量依赖性,其中50 μg/mL和200 μg/mL处理组中,3种提取物之间无显著差异性,800 μg/mL处理组中,OP对脂褐素的降低作用显著高于EPO和WPO, 分别为98.15%、82.79%和46.5%(图3、图4),说明牡蛎提取物能够抑制衰老线虫体内生成的自由基,从而通过减少大分子和细胞器的损伤来降低脂褐素累积。

图3 牡蛎提取物对秀丽隐杆线虫体内脂褐素 积累的荧光强度图
Fig.3 Fluorescence intensity of lipofuscin accumulation in C. elegans by oyster extract
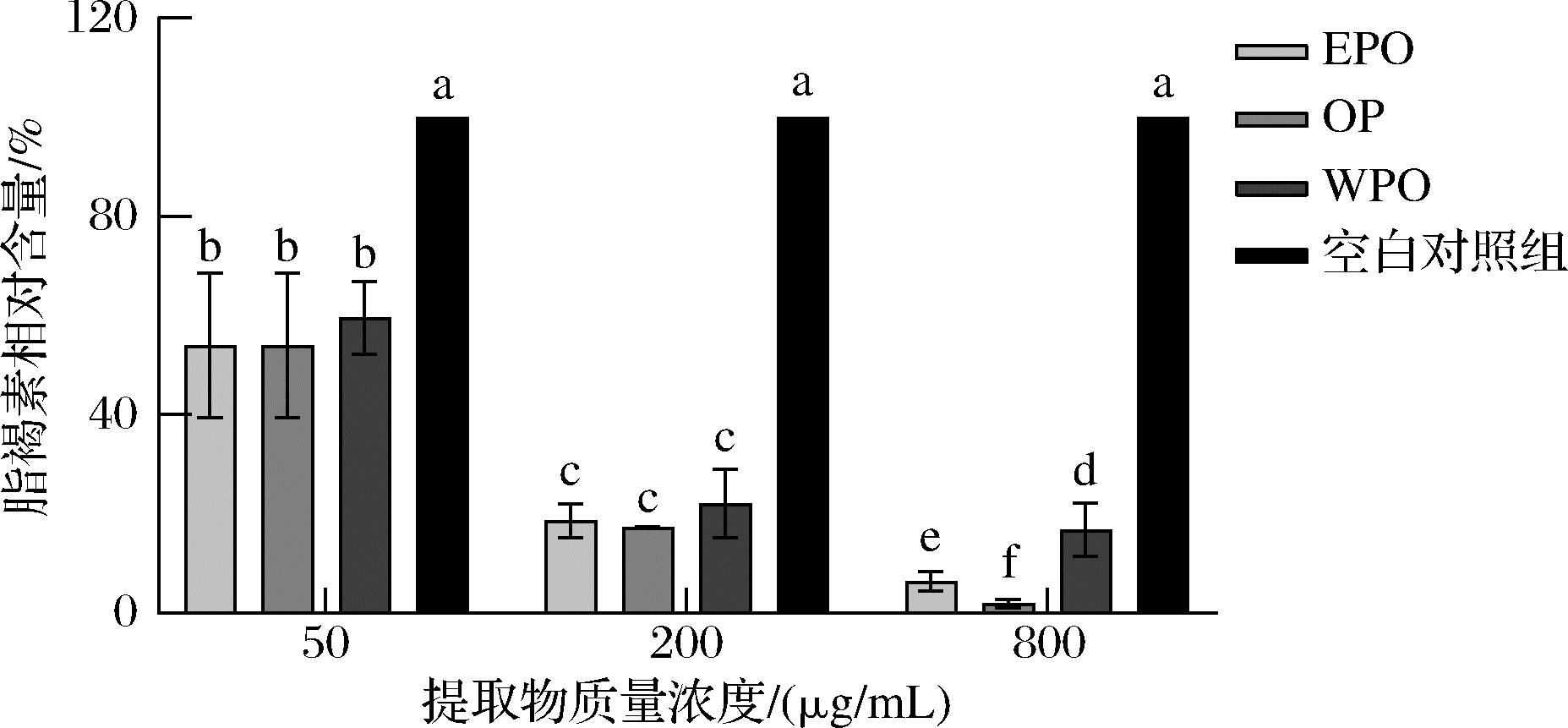
图4 牡蛎提取物对秀丽隐杆线虫体内脂褐素 相对含量的影响
Fig.4 Effect of oyster extracts on relative content of lipofuscin in C.elegans
2.5 牡蛎提取物对线虫运动能力的影响
线虫运动行为能够反映神经系统衰老状态,本研究以线虫的身体头尾摆动次数为生理指标观察牡蛎提取物对线虫运动能力的影响[23]。实验中可观察到,随着培养时间的延长,线虫的身体摆动次数显著减少,EPO、OP和WPO处理后培养9 d,身体摆动次数与5 d时相比降低了30%、20.2%和36.2%(表3),经牡蛎提取物作用5 d时,与空白组相比,运动能力略有升高,但均无显著变化(P>0.05),而随着样品处理时间的延长,在第7天和第9天时,EPO、OP和WPO均能显著增加身体摆动次数,且OP的作用显著高于WPO和EPO(P<0.05),后两者之间无显著差异性(表3),说明牡蛎提取物能够更好地改善衰老状态的线虫运动能力,而对年轻线虫作用影响不大。运动能力往往跟神经系统衰老程度密切相关,因此,牡蛎提取物可能能够延缓线虫神经系统的衰老。
表3 牡蛎提取物对秀丽隐杆线虫身体摆动次数的影响
Table 3 Effects of oyster extract on physical exercise capacity of C.elegans

组别培养时间/d579空白对照17.1±0.14a9.4±0.28a3.7±1.27aEPO 18±0.56a 15±0.28b12.6±0.28bOP18.3±0.9a 17.65±0.63c 14.6±0.35cWPO18.5±1.72a15.35±0.35b 11.8±0.28b
2.6 牡蛎提取物对线虫百草枯急性氧化应激损伤试验
百草枯毒害机制主要包括氧化应激、凋亡等,其中氧化应激是百草枯的主要中毒损伤机制,百草枯作为电子受体可诱导机体产生活性氧,造成细胞膜脂质过氧化,产生氧化损伤,进而导致寿命缩短[24]。本研究结果显示,与空白对照组相比,3种牡蛎提取物(800 μg/mL)的处理均显著提高了百草枯损伤线虫的存活率(P<0.05),其中又以OP的效果最为显著,提高了线虫存活率53.34%(图5),说明WPO、OP和EPO均能缓解百草枯导致的急性氧化应激损伤,但其作用强度不同,该现象与上述抗衰老作用的结果比较一致,说明OP可能含较多的活性成分或者组分的活性强度高。
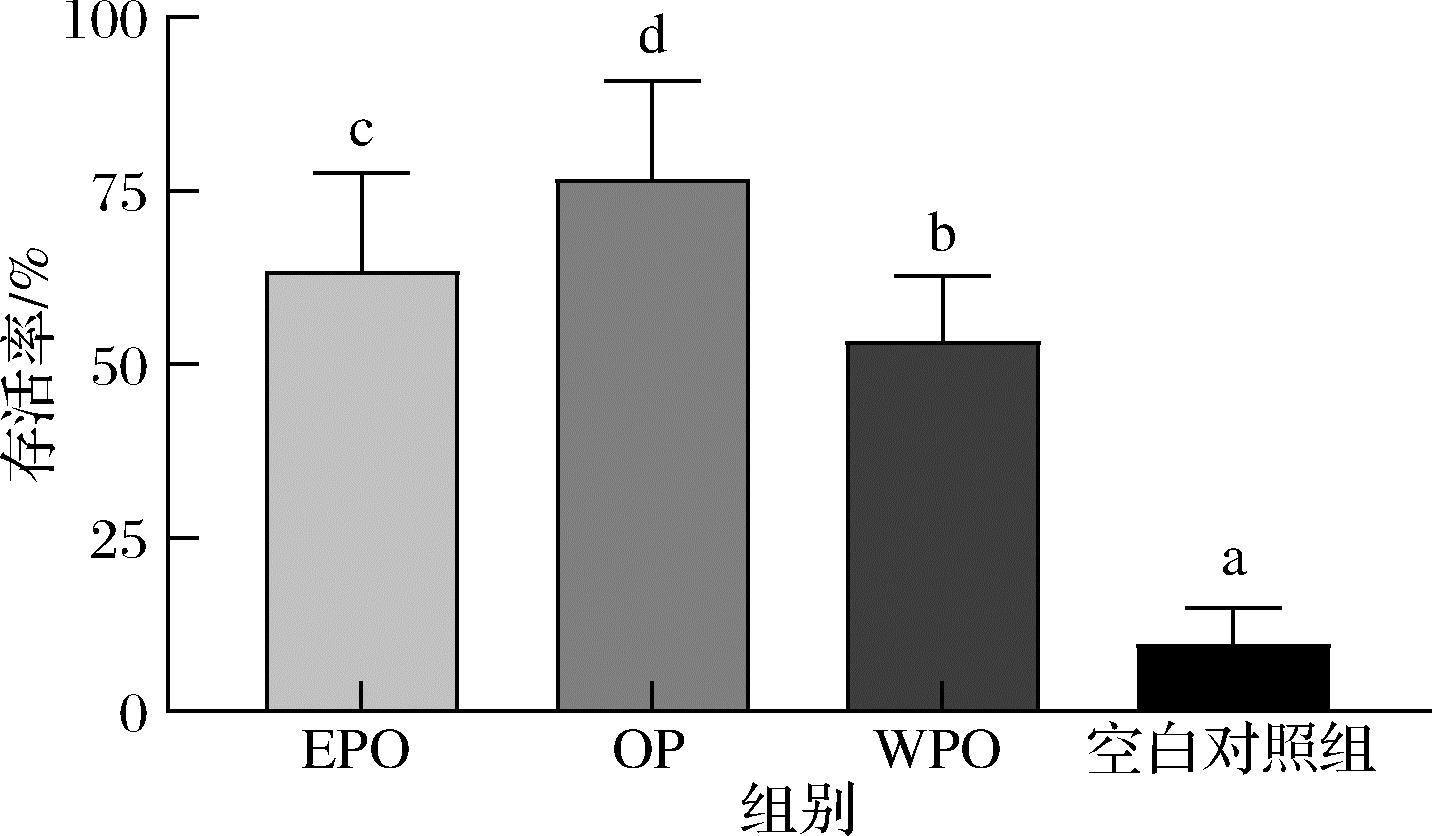
图5 牡蛎提取物对百草枯损伤的秀丽隐杆 线虫存活率的影响
Fig.5 Effect of oyster extracts on survival of paraquat-damaged C.elegans
2.7 牡蛎提取物对线虫抗氧化酶活力的影响
机体内抗氧化酶活性水平可以反应其生长发育状态,衰老过程中或受到抗氧化应激时,细胞内抗氧化酶活性降低,导致氧自由基过度积累引发氧化应激从而加速衰老。SOD和GSH-Px是线虫体内主要的抗氧化酶系统,酶活性的调节可能会提高秀丽隐杆线虫在氧化应激下的存活率,MDA水平代表了机体的膜脂质过氧化水平[25]。本研究结果显示,与空白对照组相比,800 μg/mL的EPO和OP均能显著增加线虫体内GSH-Px和SOD水平(P<0.05),WPO对SOD水平无影响,其中OP的作用效果最好;EPO、OP和WPO处理均显著降低线虫体内氧化产物MDA含量,分别降低了97%、98.2%和89.2%(表4),其中,EPO、OP之间无显著差异,OP效果最为显著。由此说明,牡蛎提取物能够缓解急性氧化应激损伤与线虫体内抗氧化能力增强有关,从而提高其存活率。
表4 牡蛎提取物对秀丽隐杆线虫体内抗氧化酶活力的影响
Table 4 Effects of oyster extracts on physical exercise capacity of C.elegans

组别GSH-Px/(μg/mg prot)SOD/(U/mg prot)MDA/(nmol/mg prot)空白对照33.26±0.01a11.86±1.11a7.77±0.06cEPO96.66±0.28b16.84±0.41bc0.2±0.02aOP132.96±1.03d20.24±6.5c0.14±0.01aWPO113.86±1.22c10.9±1.17b0.84±0.03b
3 结论与展望
本研究对3种牡蛎提取物(EPO、OP和WPO)进行了基本成分的测定,结果表明,其基本成分存在一定的差异,但其主要成分均为蛋白多肽,其次为总糖和灰分,脂肪含量很低。以秀丽隐杆线虫为模型,观察了3种牡蛎提取物的抗衰老作用,通过观察其对线虫寿命、生殖能力、运动状态以及体内脂褐素累积情况的影响,结果表明,EPO、OP和WPO均能不同程度地延长线虫的平均寿命,增加产卵数量,降低脂褐素积累,但作用效果不但与提取物本身有关,且与浓度有关,800 μg/mL处理组的效果最好,三者中OP的作用最强。通过百草枯急性氧化应激损伤实验,结果显示,3种牡蛎提取物均能提高氧化损伤的线虫存活率,说明EPO、OP和WPO均具有缓解氧化应激损伤的作用。为了证实其作用可能与机体内相关的氧化还原水平有关,进行了GSH-Px、SOD和MDA的分析,结果表明,EPO和OP能够显著增加线虫体内GSH-Px和SOD水平,显著降低MDA含量,WPO对SOD无影响,同样以OP的作用最为显著,尤其是高浓度的OP处理组,提高 GSH-Px水平299.7%、SOD水平70.65%,降低MDA水平98.2%。综上所述,不同的牡蛎提取物具有不同程度的抗衰老作用,其中OP的效果最好,但其具体的功能因子及其相关的作用机制还需进行深入的研究。本研究为牡蛎在抗衰老领域的应用提供了理论依据,为相关产品的开发提供基础,具有积极的社会效益和经济效益。
[1] TANAKA K, NISHIZONO S, KUGINO K, et al.Effects of dietary oyster extract on lipid metabolism, blood pressure, and blood glucose in SD rats, hypertensive rats, and diabetic rats[J].Bioscience, Biotechnology, and Biochemistry, 2006, 70(2):462-470.
[2] 王力, 肖嵋方, 刘斌, 等.海洋生物活性物质抗衰老作用研究进展[J].食品工业科技, 2021, 42(22):433-441.
WANG L, XIAO M F, LIU B, et al.Research progress on the anti-aging effect of marine bioactive substances[J].Science and Technology of Food Industry, 2021, 42(22):433-441.
[3] SUGAWARA T, SAKAMOTO K.Killed Bifidobacterium longum enhanced stress tolerance and prolonged life span of Caenorhabditis elegans via DAF-16[J].The British Journal of Nutrition, 2018, 120(8):872-880.
[4] 杨志伟, 解万翠.牡蛎资源的产业现状与食品加工研究进展[J].农产品加工, 2023(5):73-77.
YANG Z W, XIE W C.Current industrial status and development and utilization of oyster resources[J].Farm Products Processing, 2023(5):73-77.
[5] 章超桦. 牡蛎营养特性及功能活性研究进展[J].大连海洋大学学报, 2022, 37(5):719-731.
ZHANG C H.Research progress on nutritional characteristics and bioactivities of oysters:A review[J].Journal of Dalian Ocean University, 2022, 37(5):719-731.
[6] 林靖莹, 黄姝玲, 孟鹏, 等.牡蛎多糖制备工艺研究及体外抗氧化活性评价[J].福建师范大学学报(自然科学版), 2023, 39(3):70-77.
LIN J Y, HUANG S L, MENG P, et al.Preparation and antioxidant activity evaluation of oyster polysaccharide in vitro[J].Journal of Fujian Normal University (Natural Science Edition), 2023, 39(3):70-77.
[7] JAYAKUMAR T, RAMESH E, GERALDINE P.Antioxidant activity of the oyster mushroom, Pleurotus ostreatus, on CCl4-induced liver injury in rats[J].Food and Chemical Toxicology, 2006, 44(12):1989-1996.
[8] TONG Z H, GU W Z, ZHU G, et al.The anti-aging effect of pearl oyster shell powder (POSP)[J].Journal of Traditional Chinese Medicine, 1988, 8(4):247-250.
[9] WANG L L, SONG X R, SONG L S.The oyster immunity[J].Developmental &Comparative Immunology, 2018, 80:99-118.
[10] WANG Y K, HE H L, WANG G F, et al.Oyster (Crassostrea gigas) hydrolysates produced on a plant scale have antitumor activity and immunostimulating effects in BALB/c mice[J].Marine Drugs, 2010, 8(2):255-268.
[11] 朱十伟, 薛立英, 高丽, 等.黄芩不同洗脱部位化学成分分析及抗衰老活性研究[J].山西医科大学学报, 2019, 50(2):175-180.
ZHU S W, XUE L Y, GAO L, et al.Study on constituents analysis and anti-aging effects of different eluting fractions of Scutellaria baicalensis Georgi[J].Journal of Shanxi Medical University, 2019, 50(2):175-180.
[12] 李大炜. 牡蛎活性肽对D-半乳糖致衰老雄性大鼠性行为及生殖功能影响的研究[D].广州:广州中医药大学, 2018.
LI D W.The effects of oyster active peptides on sexual behavior and reproductive function of D-galactose induced aging male rats[D].Guangzhou:Guangzhou University of Chinese Medicine, 2018.
[13] 彭志兰. 牡蛎蛋白源抗皮肤光老化活性肽的分离纯化、鉴定及其作用机理研究[D].湛江:广东海洋大学, 2021.
PENG Z L.Purification and identification of anti-skin photoaging peptides from oyster(Crassostrea hongkongensis) protein and their antiphotoaging mechanisms[D].Zhanjiang:Guangdong Ocean University, 2021.
[14] 王力, 肖嵋方, 陈弘培, 等.牡蛎多肽组分OE-I抗氧化活性及其对秀丽隐杆线虫抗衰老作用[J].食品科学, 2022, 43(3):152-160.
WANG L, XIAO M F, CHEN H P, et al.Antioxidant activity of oyster peptide fraction OE-I and its anti-aging effect on Caenorhabditis elegans[J].Food Science, 2022, 43(3):152-160.
[15] 张雪妍. 太平洋牡蛎酶解产物分离及对小鼠睾丸间质细胞增殖和睾酮分泌的影响[D].湛江:广东海洋大学, 2019.
ZHANG X Y.Purification of enzymatic hydrolysate from oyster Crassostrea gigas and their effects on proliferation and testosterone secretion in TM3 leydig cells[D].Zhanjiang:Guangdong Ocean University, 2019.
[16] 张培丽, 陈雪香, 王群, 等.桑葚多糖T3-3分离及秀丽隐杆线虫抗衰老活性研究[J].天津中医药大学学报, 2017, 36(2):136-141.
ZHANG P L, CHEN X X, WANG Q, et al.Optimization of the extracting parameters of mulberry polysaccharide and its anti-aging activity study[J].Journal of Tianjin University of Traditional Chinese Medicine, 2017, 36(2):136-141.
[17] 安苗青, 徐雅囡, 卓倩婷, 等.龟鹿二仙胶对秀丽隐杆线虫体内抗衰老作用研究[J].广州中医药大学学报, 2022, 39(8):1863-1870.
AN M Q, XU Y N, ZHUO Q T, et al.Study on the anti-aging effect of Guilu Erxian Jiao on Caenorhabditis elegans in vivo[J].Journal of Guangzhou University of Traditional Chinese Medicine, 2022, 39(8):1863-1870.
[18] 魏伟. 马氏珠母贝肉改善老年斑马鱼学习记忆活性及功效成分的研究[D].湛江:广东海洋大学, 2021.
WEI W.Research on the effect of Pinctada martensii on the learning and memory in aging zebrafish and efficacy components[D].Zhanjiang:Guangdong Ocean University, 2021.
[19] 马晓丽. 芝麻粕多肽延长秀丽隐杆线虫健康寿命的分子机制研究[D].太原:山西大学, 2020.
MA X L.Molecular mechanisms underlying extending healthspan of Caenorhabditis elegans by peptides from sesame cake[D].Taiyuan:Shanxi University, 2020.
[20] 蔡佳琦, 秦小明, 卢虹玉, 等.鲍鱼肌肉酶解产物对秀丽隐杆线虫的抗衰老作用研究[J].食品与发酵工业, 2023, 49(12):106-112.
CAI J Q, QIN X M, LU H Y, et al.Anti-aging effect of abalone muscle enzymatic hydrolysate on Caenorhabditis elegans[J].Food and Fermentation Industries, 2023, 49(12):106-112.
[21] 李振旺. 马鹿角水提物对秀丽隐杆线虫抗衰老作用研究[D].长春:长春工业大学, 2022.
LI Z W.Anti-aging effect of red deer(Cervus elaphus)antler water extract on Caenorhabditis elegans[D].Changchun:Changchun University of Technology, 2022.
[22] LI J, CUI X D, WANG Z H, et al.rBTI extends Caenorhabditis elegans lifespan by mimicking calorie restriction[J].Experimental Gerontology, 2015, 67:62-71.
[23] 李红丹, 王洁, 廖振林, 等.大豆酸奶对秀丽隐杆线虫体内抗氧化和寿命的影响[J].现代食品科技, 2023, 39(4):7-12.
LI H D, WANG J, LIAO Z L, et al.Effects of soybean yogurt on antioxidation and lifespan of Caenorhabditis elegans[J].Modern Food Science and Technology, 2023, 39(4):7-12.
[24] 董舒超, 胡慧贞, 彭良才, 等.植物百草枯抗性机理研究进展[J].植物生理学报, 2015, 51(9):1373-1380.
DONG S C, HU H Z, PENG L C, et al.Progress in plant resistance to paraquat[J].Plant Physiology Journal, 2015, 51(9):1373-1380.
[25] 金司仪. 三七粉延缓秀丽隐杆线虫衰老的作用机制及其稳定性研究[D].武汉:湖北中医药大学, 2019.
JIN S Y.Mechanism of Panax notoginseng on delaying senescence of Caenorhabditis elegans and its stability[D].Wuhan:Hubei University of Chinese Medicine, 2019.