琼胶是一种从红藻类植物细胞壁中提取的亲水性胶体,由于其安全无毒且具有良好的成膜性,因此可用于制备可食膜[1],但琼胶膜往往具有柔韧性差、透明度低等缺点,需与其他成膜基材进行复配,以适应实际应用需求[2-3]。海藻酸钠,是从褐藻类植物中提取的阴离子多糖,其分子中含有大量的羟基,与琼胶有良好的相容性,因此可与琼胶复配,改善琼胶膜的性能[4]。
目前国内外可食膜的研究中,关于不同材料的复配方式主要有2种:共混和层层自组装(layer-by-layer, LBL)。LBL是指不同材料通过静电作用、氢键、共价键等分子间作用力相互缔合、逐层交替吸附从而形成结构稳定薄膜的技术[5]。由于成膜方式简单,膜结构组成易于调控等特点,LBL技术已成为国内外可食膜领域的研究热点。研究者[6-8]通过LBL技术分别制备了具有单向防水功能的壳聚糖/玉米醇溶蛋白双层膜、高强度的海藻酸钠/壳聚糖复合膜和高耐水性的海藻酸钠/氧化纳米纤维素三层膜。
然而,目前关于不同制膜方式对琼胶/海藻酸钠复合膜性能影响的研究还未见报道。因此,本研究以琼胶和海藻酸钠为原料,通过溶液浇铸法制备了共混膜和双层膜,并引入交联剂柠檬酸和阿魏酸,探究了LBL技术与交联剂对膜性能提高的协同作用。
琼胶粉,汕头市澄海区琼胶厂;海藻酸钠,酷尔化学(北京)科技有限公司;甘油、阿魏酸、柠檬酸,阿拉丁试剂(上海)有限公司;无水氯化钙,天津市汇杭化工科技有限公司。试剂均为分析纯。
电子拉力试验机,东莞东日仪器有限公司;数显磁力搅拌水浴锅,金坛区西城新瑞仪器厂;BS224S电子天平,美国Sartorius公司;恒温干燥箱,重庆雅马拓科技有限公司;恒温恒湿培养箱,上海力辰邦西仪器科技有限公司;UV2550紫外-可见分光光度计,上海美谱达仪器有限公司;IRAffinity-1红外光谱仪,日本岛津公司;数显测厚仪,浙江德清盛泰芯电子科技有限公司;CR-400色差仪,日本KNOICA MINOLTA公司;Phenom Pro台式扫描电镜,上海复纳科学仪器有限公司;NETZSCH TGA/DSC同步热分析仪,德国耐驰仪器有限公司;其他均为实验室常用仪器。
1.3.1 复合膜的制备[7]
海藻酸钠溶液的制备:称取1 g海藻酸钠于锥形瓶中,加入50 mL去离子水,加热搅拌至完全溶解,再加入质量分数为30%的甘油(以海藻酸钠质量为基准),60 ℃下水浴搅拌30 min,再加入50 mg交联剂(柠檬酸或阿魏酸,下同),水浴搅拌至完全溶解,得到海藻酸钠溶液(未交联膜制备过程中不添加交联剂,下同)。
琼胶溶液的制备:称取1 g琼胶于锥形瓶中,加入50 mL去离子水,加热搅拌至完全溶解,再加入质量分数为30%的甘油(以琼胶质量为基准),60 ℃下水浴搅拌30 min,再加入50 mg交联剂,水浴搅拌至完全溶解,得到琼胶溶液。
共混膜的制备:将海藻酸钠溶液与琼胶溶液混合,60 ℃下水浴搅拌均匀,真空脱气后将溶液倒入18 cm×18 cm×1 cm亚克力板模具中,放入50 ℃干燥箱中恒温干燥24 h,取出、揭膜,然后将膜放入110 ℃干燥箱中干燥10 min。最后将膜放入培养箱(25 ℃,相对湿度50%)中保存。分别记未交联共混膜、柠檬酸交联共混膜、阿魏酸交联共混膜为BL、BLCA、BLFA。
双层膜的制备:将海藻酸钠溶液真空脱气后倒入18 cm×18 cm×1 cm亚克力板模具中,放入50 ℃干燥箱中恒温干燥24 h取出,再将真空脱气后的琼胶溶液倒入模具中,放入50 ℃干燥箱中恒温干燥24 h,取出、揭膜,然后将膜移入110 ℃干燥箱中干燥10 min。最后将膜放入恒温恒湿培养箱中保存待用(25 ℃,相对湿度50%)。分别记未交联双层膜、柠檬酸交联双层膜、阿魏酸交联双层膜为Bi、BiCA、BiFA。
1.3.2 复合膜性能指标测定
厚度测定:使用数显测厚仪(精度为0.001 mm)测定膜的厚度,用于后续指标的计算。每组取3张膜,每张膜随机选取3个位置进行测定,薄膜厚度取其平均值。
机械性能测定:参照ZHAI等[9]的方法,略作修改。将膜裁成2 cm×8 cm条状,使用电子拉力试验机测定膜的拉伸强度(tensile strength, TS)和断裂伸长率(elongation at break percent, EB),测试参数:夹具起始间距40 mm;拉伸速度50 mm/min。每组膜测3个平行,结果取其平均值。TS按公式(1)计算:
(1)
式中:F,膜断裂时承受的最大拉力,N;a,膜的起始宽度,mm;D,膜的起始厚度,mm。
EB按公式(2)计算:
![]()
(2)
式中:L1,膜断裂时的伸长量,mm;L2,夹具起始间距,mm。
溶胀率和水溶性测定:参考HOU等[10]的方法,将膜裁成约2 cm×2 cm小块,置于105 ℃烘箱中干燥至恒重(m1),然后将烘干后的薄膜置于盛有50 mL蒸馏水的小烧杯中,室温下浸泡24 h取出,用滤纸吸干其表面水分,测其质量(m2),然后在105 ℃干燥至恒重(m3)。每组取3个试样测定,结果取其平均值。膜的溶胀率(swelling ratio, SR)和水溶性(water solubility, WS)分别按公式(3)和公式(4)计算:
(3)
![]()
(4)
水蒸气透过率测定:参照ARABESTANI等[11]的方法并略作改动,称取约8 g无水CaCl2于称量瓶(50 mm×30 mm)中,将膜覆盖在瓶口,并用石蜡封好瓶口,测其质量。然后将覆膜的称量瓶置于底部盛有蒸馏水的玻璃干燥器中(提前在25 ℃放置4 h以上),在25 ℃下恒温静置,每隔2 h取出称量瓶测其质量,连续测6次。复合膜水蒸气透过率(water vapor permeability,WVP)按公式(5)计算:
(5)
式中:WVTR,水蒸气透过速率(water vapour transimission rate),g/(m2·h);D,膜厚度,mm;ΔP,膜两侧水蒸气压差,3.167 1 kPa。
色差测定:使用手持色差仪测定膜的L*,a*,b*值。L*值表示颜色的亮度,取值范围0~100,L*值越大表示颜色越亮;a*值表示红绿程度,取值范围-100~100,正值表示红色程度,负值表示绿色程度;b*值表示黄蓝程度,取值范围-100~100,正值表示黄色程度,负值表示蓝色程度。膜的总色差ΔE*按公式(6)计算:
(6)
式中:L, a, b为标准白板的亮度、红绿和蓝黄值。
不透明度测定:参考ABDOLLAHI等[12]的方法,稍作修改。将膜裁成1 cm×4 cm矩形,使其刚好放入比色皿中并紧贴比色皿内壁。然后使用紫外-可见分光光度计在600 nm处测其吸光度,以空白比色皿作对照。每组取3个试样进行测定,结果取平均值。膜不透明度按公式(7)计算:
(7)
式中:Opacity,不透明度,mm-1;A600,600 nm下的吸光度;D,膜厚度,mm。
热稳定性测定:参考WANG等[13]的方法,略作修改。称取10 mg样品于Al2O3坩埚中,使用同步热分析仪在恒定N2流速下(50 mL/min)进行热重分析,设置升温速率为10 ℃/min,测试温度范围30~600 ℃。
扫描电镜(scanning electron microscope, SEM)测定:参考李杨等[14]的方法,略作修改。将膜样品置于液氮中使其自然断裂,然后进行镀金处理,在10 kV加速电压下使用扫描电子显微镜进行微观结构分析。
红外光谱测定:使用衰减全反射-傅里叶变换红外光谱仪(attenuated total reflection-Fourier transform infrared spectrometer,ATR-FITR)对膜的化学结构进行分析。将薄膜在50 ℃下干燥2 h后,以空气为背景,对样品进行红外扫描,扫描波数范围为4 000~400 cm-1,扫描次数为32次,分辨率为4 cm-1,用OMNIC 8.2软件进行数据分析。
1.3.3 数据处理
采用SPSS 22.0和Excel软件进行数据分析,Origin 2018软件绘图。每个样品做3个平行试验,数据采用平均数±标准差表示。
层层自组装和共混成膜方法对膜机械性能的影响如图1所示。

a-拉伸强度;B-断裂伸长率
图1 不同复合膜的机械性能
Fig.1 Mechanical properties of different composite films
注:不同字母表示差异显著(P<0.05)。
由图1可见,一方面,在成膜基质相同的条件下,双层膜的机械性能均显著高于共混膜(P<0.05)。Bi的TS(41.00 MPa)比BL(31.76 MPa)高29.1%,Bi的EB(34.47%)相对于BL(27.72%)提高24.4%;添加交联剂后,BiCA和BiFA的TS(51.57,47.24 MPa)分别比BLCA(39.63 MPa)、BLFA(36.50 MPa)高30.1%和29.4%,BiCA和BiFA的EB(26.02%,26.99%)分别比BLCA(22.61%)、BLFA(23.79%)高15.1%和13.5%。这表明,在相同成膜材料条件下,LBL法较共混法更有助于提高复合膜的机械性能。双层膜的TS较共混膜高,这可能是因为琼胶和海藻酸钠之间存在静电相互作用,琼胶带少量正电(zeta电位:3.5 mV),而海藻酸钠带负电,由于正负电荷相互吸引,两层膜之间的相互作用增强,膜组分之间的连接更加紧密,因此双层膜的TS大于共混膜。双层膜的EB比共混膜高,这可能是因为双层膜通过氢键和静电相互作用,使琼胶层和海藻酸钠层黏附在一起,由于海藻酸钠层的柔韧性较强,所以双层膜的EB也更高。另一方面,制膜方法相同的条件下,添加交联剂后复合膜TS显著增加(P<0.05),而EB显著降低(P<0.05)。BLCA、BLFA的TS相对于BL分别提高了24.8%和14.9%,EB分别降低18.4%和14.2%,BiCA和BiFA的TS相对于Bi分别提高了25.8%和15.2%,EB分别降低24.5%和21.7%。添加交联剂后,2种方法所制得的膜TS均提高,这是因为交联剂与琼胶和海藻酸钠分子链中的—OH和—COOH发生反应,形成分子间氢键和羰基,使成膜基质形成致密的三维网络结构,从而提高了膜的TS[15];但是,三维网络结构的形成也限制了大分子链的自由运动,减小了成膜基质分子间的距离,从而使膜的EB降低[16]。这与MATHEW等[17]的研究结果相同,阿魏酸的添加使淀粉/壳聚糖复合膜的TS从44.50 MPa提升至62.71 MPa,但同时使EB从29.3%降至21.6%。
由表1可知,在成膜基质相同的条件下,层层自组装和共混成膜方法对膜的WVP无显著影响(P>0.05),这说明2种成膜方法不会改变膜对水分子的阻隔能力。在添加交联剂后,双层膜与共混膜的WVP均显著降低(P<0.05),BLCA和BLFA相较于BL分别降低13.8%和22.8%,BiCA和BiFA相较于Bi分别降低17.5%和23.6%。这是因为交联反应使聚合物的网络结构更加紧密,大分子间的间隙减小,限制了水分子的渗透作用,从而降低了膜的WVP[18]。另外,通过对比发现,阿魏酸交联膜的WVP低于柠檬酸交联膜,这可能与阿魏酸在空气中的氧化有关,MATHEW等[17]的研究表明,当阿魏酸被氧化成醌时,能提高与多糖分子的交联能力,从而提高膜对水分子的阻隔能力。
表1 不同复合膜的水蒸气透过率、水溶性和溶胀率
Table 1 Water vapor permeability, water solubility and swelling ratio of different composite films
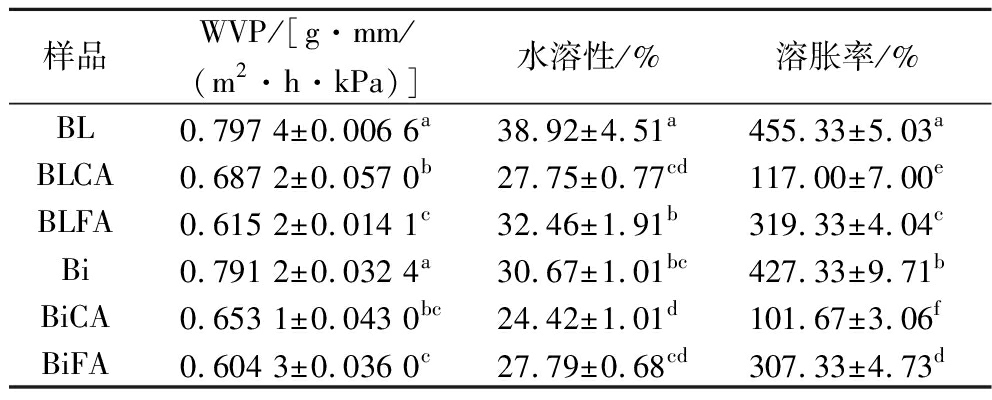
样品WVP/[g·mm/(m2·h·kPa)]水溶性/%溶胀率/%BL0.797 4±0.006 6a38.92±4.51a455.33±5.03aBLCA0.687 2±0.057 0b27.75±0.77cd117.00±7.00eBLFA0.615 2±0.014 1c32.46±1.91b319.33±4.04cBi0.791 2±0.032 4a30.67±1.01bc427.33±9.71bBiCA0.653 1±0.043 0bc24.42±1.01d101.67±3.06fBiFA0.604 3±0.036 0c27.79±0.68cd307.33±4.73d
注:同列不同字母表示差异显著(P<0.05)(下同)。
膜的耐水性一般通过水溶性和溶胀率来评价,水溶性和溶胀率越低,则膜的耐水性越强。由表1可见,一方面,双层膜的水溶性显著低于共混膜(P<0.05),Bi(30.67%)的水溶性相较于BL(38.92%)降低了21.2%,BiCA(24.42%)和BiFA(27.79%)的水溶性相较于BLCA(27.75%)和BLFA(32.46%)分别降低了12.0%和14.4%。LI等[18]的研究表明,薄膜组分之间的结合越紧密,则薄膜的水溶性越低。与共混膜相比,双层膜水溶性更低,其可能原因是琼胶和海藻酸钠之间的静电相互作用收紧了膜的结构,膜组分间的连接更加紧密,从而导致双层膜的水溶性低于共混膜。另一方面,添加交联剂后,复合膜的水溶性显著降低(P<0.05),添加柠檬酸后,BL和Bi的水溶性分别降低了28.7%和20.4%,添加阿魏酸后,BL和Bi的水溶性分别降低了16.6%和9.4%。交联剂使复合膜水溶降低,原因可能是交联剂通过与琼胶和海藻酸钠分子上的羟基和羧基反应形成酯键和氢键,加强了膜组分间的相互作用,使大分子间的连接更加紧密,从而降低了膜的水溶性[19]。
膜的溶胀率取决于聚合物电离基团的数量,当电离基团增多时,由于吸水作用和电离基团的排斥作用,膜的溶胀率增大[20]。由表1可见,复合膜溶胀率的变化与水溶性相似,与共混膜相比,双层膜具有更低的溶胀率(P<0.05)。Bi的溶胀率较BL降低了6.1%,BiCA和BiFA的溶胀率较BLCA和BLFA分别降低了13.1%和3.8%。这是因为琼胶和海藻酸钠分子间的静电相互作用减少了复合膜中电离基团的数量,从而使双层膜的溶胀率低于共混膜[18]。而交联剂对复合膜溶胀率的影响更大(P<0.05),在添加柠檬酸和阿魏酸后,BL的溶胀率分别降低了74.30%和29.9%,Bi的溶胀率分别降低了76.2%和28.1%。这可能是因为交联剂与聚合物中的—OH发生反应,减少了膜表面亲水羟基的数量,从而导致溶胀率显著降低[21]。
另外,由表1可知,柠檬酸交联膜比阿魏酸交联膜的溶胀率和水溶性更低。这可能是因为阿魏酸通过与琼胶和海藻酸钠形成分子间氢键而发生交联,而柠檬酸可与其分子中的羟基发生酯化反应形成共价键实现交联,共价键键能比氢键高,故柠檬酸交联膜中大分子间的紧密程度高于阿魏酸交联膜,因此柠檬酸交联膜的耐水性较阿魏酸交联膜更强。
总之,LBL技术可以显著降低膜的水溶性和溶胀率,提高膜的耐水性,在添加交联剂后,双层膜的水溶性和溶胀率进一步降低,与大豆分离蛋白膜[22]、壳聚糖膜[23]、果胶/明胶复合膜[24]等其他材料可食膜相比,该复合膜具有更优异的耐水性。因此,LBL技术与交联剂结合使用,可以有效提高复合膜的耐水性。
热重分析是使样品在一定温度程序控制下,研究样品质量与温度的变化关系的热分析技术,一般用来研究材料的热稳定性。各膜的热重分析(thermogravimetric analysis, TG)和微商热重分析(differential thermal gravity, DTG)曲线见图2,热力学相关数据见表2。由图2可见,各膜的热分解主要分为3个阶段:第一阶段60~120 ℃,失重率约为14%,该阶段失重的原因是复合膜表面和内部结合水的失去[25];第二阶段200~320 ℃,失重率约为60%,该阶段失重的原因是大分子链上糖苷键的断裂和脱羟基作用,生成稳定的中间产物并释放出CO2和H2O[26];第三阶段320~600 ℃,中间产物进一步分解,最终膜样品完全炭化[27]。与BL相比,Bi的起始分解温度从196.0 ℃提升到218.0 ℃,这可能是因为层层自组装技术通过静电相互作用加强了膜组分的连接,使初始分解温度提高。而随着温度的升高,Bi膜的热分解速率加快,并在231.6 ℃时热失重速率达最大,比BL的最大热失重速率温度(267.7 ℃)降低36.1 ℃,这说明在热分解的第二阶段(200~320 ℃)内,Bi的热稳定性低于BL。而BiCA与BLCA、BiFA与BLFA的最大热失重速率温度和炭化后的残留量相差不大,这说明在添加交联剂后,2种成膜方法对复合膜热稳定性的影响不大。由表2可知,添加柠檬酸和阿魏酸后,BL的初始分解温度从196.0 ℃分别提升至203.0和210.0 ℃,最大热失重速率温度从267.7 ℃分别提升至278.5和269.0 ℃;Bi的初始分解温度略有下降,从218.0 ℃分别降至205.0和211.5 ℃,而最大热失重速率温度从231.6 ℃分别提升至276.2和270.9 ℃,最大热失重速率从-9.80%/min分别提升至-6.54%/min 和-6.55%/min,这说明交联剂的添加可以提高复合膜的热稳定性。因此,交联剂是影响复合膜热稳定的主要因素。
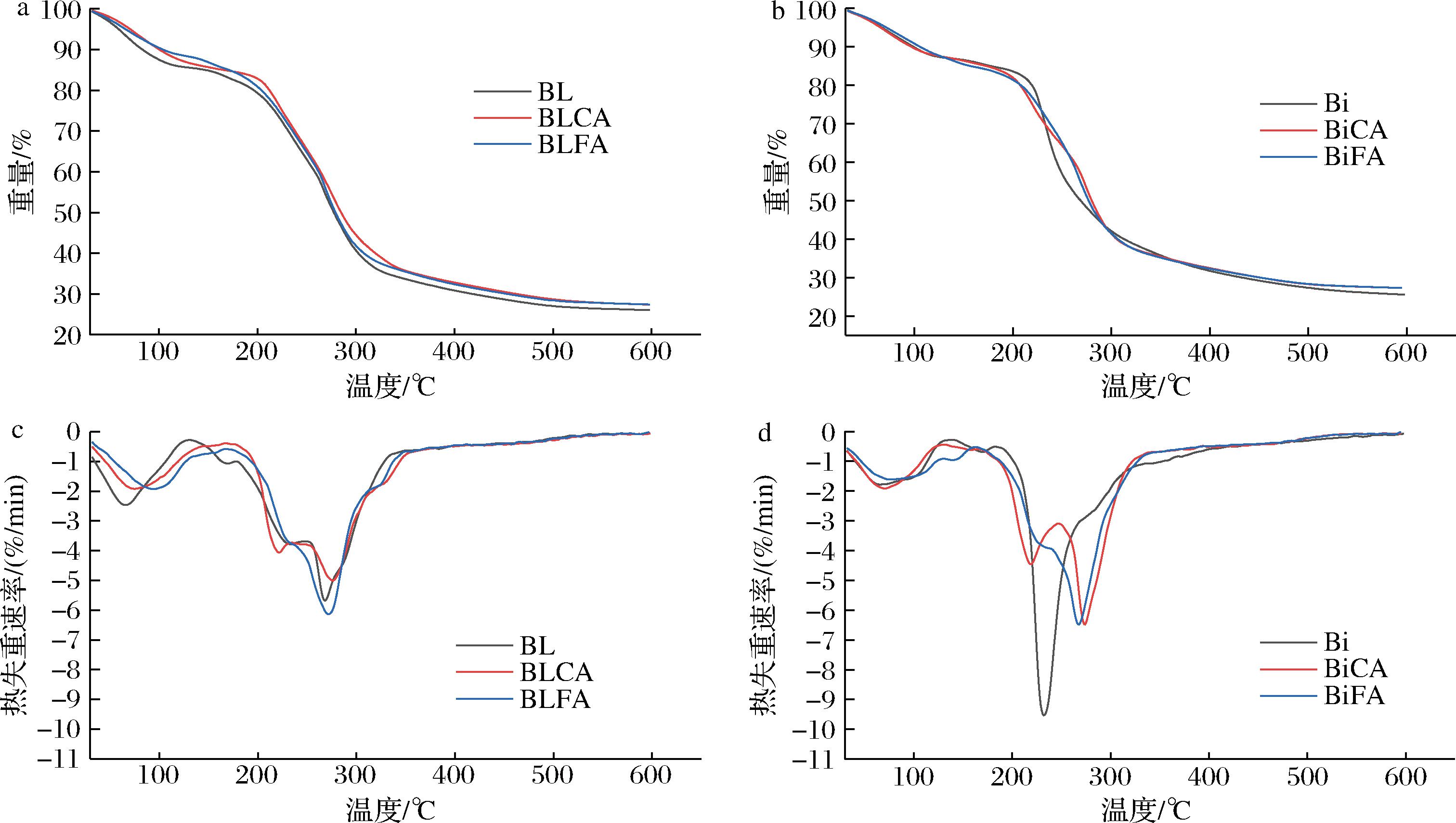
a-共混膜TG曲线图;b-双层膜TG曲线图;c-共混膜DTG曲线图;d-双层膜DTG曲线图
图2 不同复合膜的热重分析图
Fig.2 Thermogravimetric analysis of different composite films
表2 不同复合膜的热力学相关数据
Table 2 Thermodynamic data of different composite films
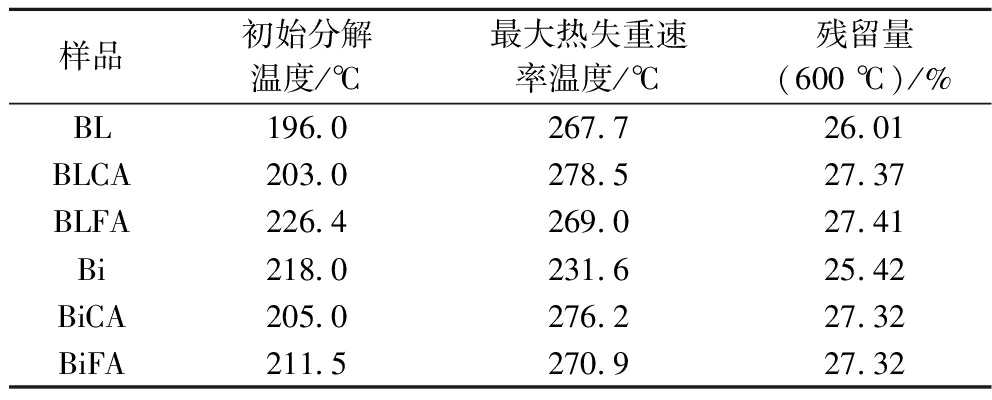
样品初始分解温度/℃最大热失重速率温度/℃残留量(600 ℃)/%BL196.0267.726.01BLCA203.0278.527.37BLFA226.4269.027.41Bi218.0231.625.42BiCA205.0276.227.32BiFA211.5270.927.32
如图3所示,据肉眼观察,未交联膜(图3-a,
图3-d)与柠檬酸交联膜(图3-b,
图3-e)表面光滑且呈无色透明状,而阿魏酸交联膜(图3-c,
图3-f)整体颜色偏黄,部分地方出现白色斑点,透明性较差。
由表3可知,双层膜和共混膜的L*、a*、b*和ΔE*值无显著差异(P>0.05),这说明不同成膜方法对复合膜的颜色无显著影响。而添加交联剂后,复合膜的ΔE*显著提高(P<0.05),这说明交联剂导致复合膜颜色变深,主要体现在L*和a*值降低及b*值提高,这表明交联剂使复合膜颜色变暗,且整体颜色偏向于绿色和黄色。LIGUORI等[28]的研究表明,柠檬酸在与多糖的加热过程中会生产有色不饱和酸,这可能导致了交联膜ΔE*提高。而阿魏酸对复合膜ΔE*的影响更大,这可能是阿魏酸在空气中被氧化导致复合膜颜色加深,从而使复合膜的ΔE*显著提高。

a-BL;b-BLCA;c-BLFA;d-Bi;e-BiCA;f-BiFA
图3 不同复合膜表面直观图
Fig.3 Direct view of different composite films surfaces
表3 不同复合膜的色差和不透明度
Table 3 Color difference and opacity of different composite films
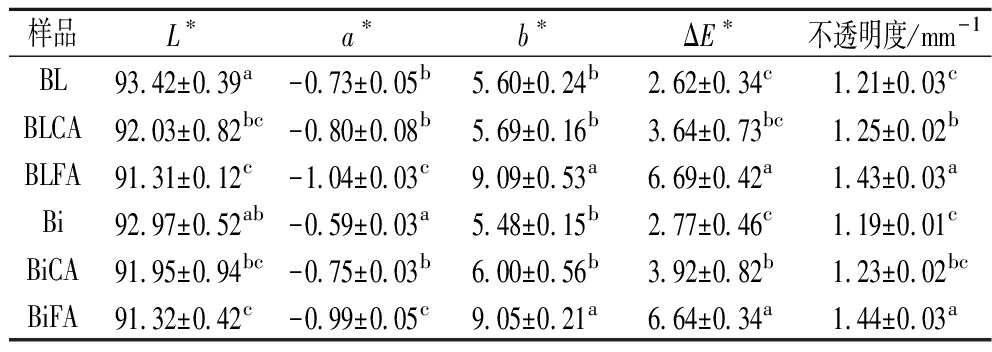
样品L∗a∗b∗ΔE∗不透明度/mm-1BL93.42±0.39a-0.73±0.05b5.60±0.24b2.62±0.34c1.21±0.03cBLCA92.03±0.82bc-0.80±0.08b5.69±0.16b3.64±0.73bc1.25±0.02bBLFA91.31±0.12c-1.04±0.03c9.09±0.53a6.69±0.42a1.43±0.03aBi92.97±0.52ab-0.59±0.03a5.48±0.15b2.77±0.46c1.19±0.01cBiCA91.95±0.94bc-0.75±0.03b6.00±0.56b3.92±0.82b1.23±0.02bcBiFA91.32±0.42c-0.99±0.05c9.05±0.21a6.64±0.34a1.44±0.03a
由表3可知,共混膜与双层膜的不透明度无显著差异(P>0.05),而添加交联剂后,复合膜的不透明度显著提高(P<0.05)。这可能是因为交联剂与成膜基质发生反应,缩短了大分子链间的距离,阻碍了可见光的透过,从而提高了膜的不透明度。而阿魏酸对复合膜不透明度的影响最大,与BL相比,BLFA的不透明度提高了15.38%,与Bi相比,BiFA的不透明度提高了17.36%。这可能是因为阿魏酸在空气中氧化导致复合膜变白,从而使膜的不透明度显著提高。
由图4可知,双层膜的海藻酸钠层和琼胶层的表面结构无明显差异,这可能是因为琼胶和海藻酸钠都属于多糖,且元素组成相似。由图5可见,各共混膜的表面均比较平整、光滑,没有出现明显的孔隙和褶皱,这是因为琼胶和海藻酸钠可以通过氢键提高其相容性。由各膜截面结构图可见,双层膜的截面并未观察到分层结构,这是因为琼胶与海藻酸钠的元素组成相同,且聚合物之间通过氢键和静电相互作用提高了其相容性,所以难以通过扫描电镜观测到膜的层状结构。而共混膜的截面出现横向裂纹和褶皱,这在未交联共混膜中更加明显,这可能是因为成膜基质干燥后呈纤维化取向所导致。通过对比双层膜和共混膜的截面可以发现,双层膜的截面更加均匀、致密,这也从侧面反映了双层膜更高的机械强度。在添加交联剂后,共混膜的裂纹和褶皱减少,且膜的厚度降低,这说明交联剂通过与聚合物形成氢键和酯键形成了更加稳定的三维网络结构,膜组分之间的连接更加紧密,从而使膜截面更加光滑、平整。

a-未交联;b-柠檬酸交联;c-阿魏酸交联
图4 双层膜扫描电镜图
Fig.4 SEM images of bilayer films
注:左-截面,中-琼胶膜表面,右-海藻酸钠膜表面;各膜表面结 构图放大倍数1 000×,截面结构图放大倍数800×(下同)。

a-未交联;b-柠檬酸交联;c-阿魏酸交联
图5 共混膜扫描电镜图
Fig.5 SEM images of blend films
注:左-截面,右-表面
采用ATR-FTIR对双层膜和共混膜进行红外光谱分析,结果如图6所示。复合膜在3 286~3 311 cm-1处的吸收峰是—OH伸缩振动的结果,2 927 cm-1和2 877 cm-1处是琼胶和海藻酸钠分子链上烷基的伸缩振动吸收峰[29],1 593 cm-1处和1 411 cm-1处是—COO—的不对称和对称伸缩振动吸收峰[30],1 373 cm-1处是琼胶中硫酸酯基团的吸收峰[31],1 035 cm-1处的强峰是C—O和C—C的伸缩振动与C—C—O和C—O—H弯曲振动共同作用的结果[32-33]。由图6可见,与BL相比,Bi的红外光谱图中未出现新的吸收峰,这说明在双层膜的制备过程中并未产生新的化学键。而BLCA和BiCA在1 716 cm-1处出现新的吸收峰,这可能是海藻酸钠和琼胶中的—OH与柠檬酸的—COOH进行酯化反应形成C![]() O的结果。而BLFA和BiFA在1 700 cm-1附近未出现新的吸收峰,因此推测阿魏酸在该反应条件下难与海藻多糖发生酯化反应,但可以观察到与BL相比,BLFA的—OH吸收峰从3 311 cm-1移动到3 284 cm-1;与Bi相比,BiFA的—OH吸收峰从3 298 cm-1移动到3 288 cm-1,且BLFA和BiFA的峰形变宽、峰强度增大,这表明分子间形成了更多的氢键[13],因此推测阿魏酸通过氢键与琼胶和海藻酸钠进行非共价交联。
O的结果。而BLFA和BiFA在1 700 cm-1附近未出现新的吸收峰,因此推测阿魏酸在该反应条件下难与海藻多糖发生酯化反应,但可以观察到与BL相比,BLFA的—OH吸收峰从3 311 cm-1移动到3 284 cm-1;与Bi相比,BiFA的—OH吸收峰从3 298 cm-1移动到3 288 cm-1,且BLFA和BiFA的峰形变宽、峰强度增大,这表明分子间形成了更多的氢键[13],因此推测阿魏酸通过氢键与琼胶和海藻酸钠进行非共价交联。
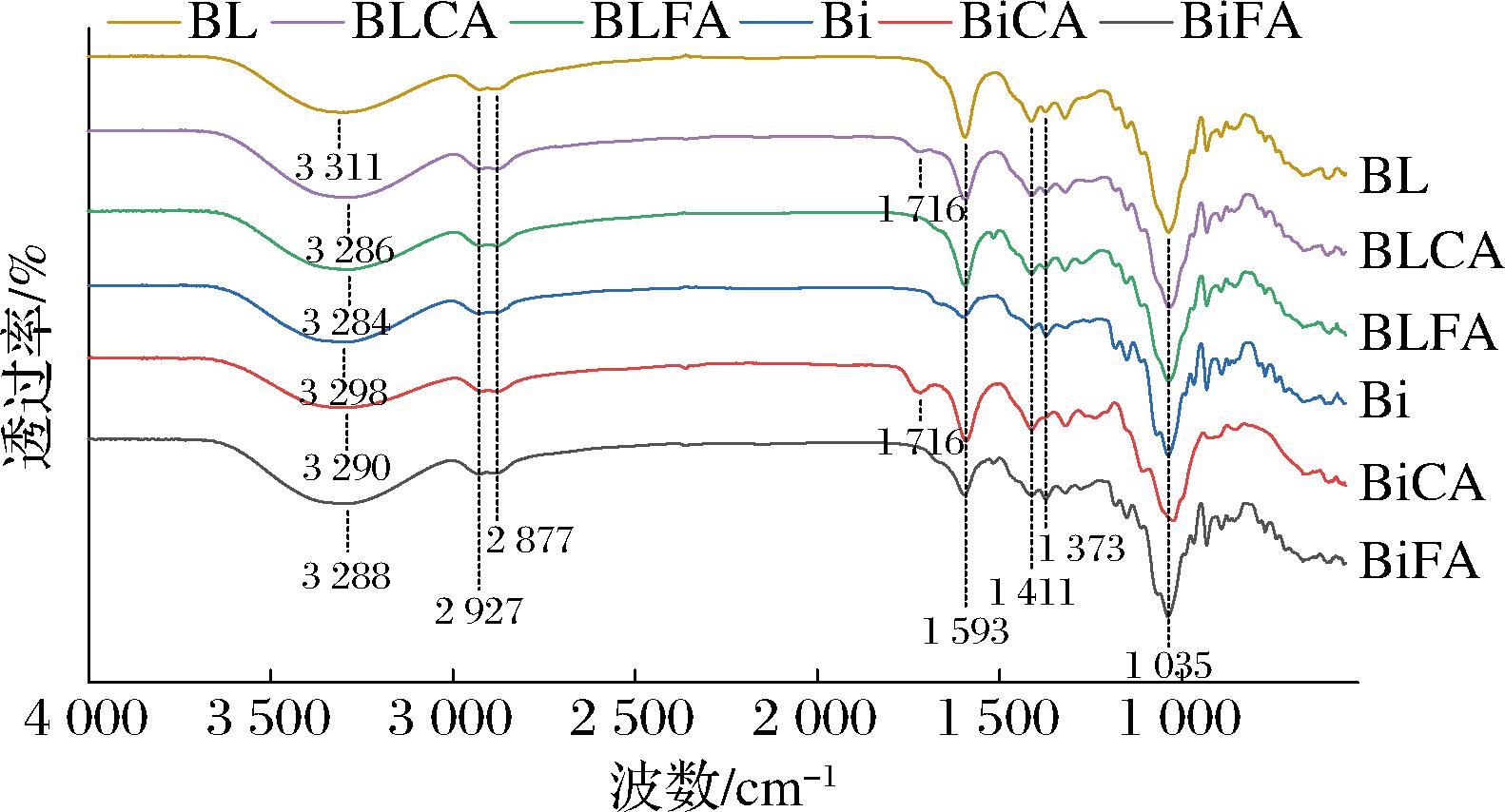
图6 不同复合膜的红外光谱图
Fig.6 Infrared spectra of different composite films
本文通过共混与LBL两种方法制备了琼胶/海藻酸钠共混膜和双层膜,并添加交联剂柠檬酸和阿魏酸,比较了不同制膜方式结合交联剂对复合膜性能的影响。研究表明,双层膜具有更优异的机械性能和耐水性,与BL相比,Bi的TS提高了29.1%,EB提高了24.4%,WS降低了21.2%,SR降低了6.1%;与BLCA相比,BiCA的TS提高了30.1%,EB提高了15.1%,WS降低了12.0%,SR降低了13.1%;与BLFA相比,BiFA的TS提高了29.4%,EB提高了13.5%,WS降低了14.4%,SR降低了3.8%。添加交联剂后,膜的WVP显著降低(P<0.05),膜的拉伸强度、耐水性和热稳定性提高。其中BiFA的综合性能最佳,即拉伸强度51.57 MPa,断裂伸长率26.02%,水溶性24.42%,溶胀率101.67%。IR分析表明柠檬酸通过与琼胶和海藻酸钠发生酯化反应形成C![]() O进行共价交联,而阿魏酸通过与琼胶和海藻酸钠中的—OH和—COOH形成氢键进行非共价交联。扫描电镜分析表明琼胶和海藻酸钠的相容性良好,各膜表面均平整、光滑,没有出现明显的孔隙和褶皱,而添加交联剂后,膜截面褶皱减少,膜结构更加紧密。因此,LBL技术和交联剂结合使用可以制备出综合性能更好的复合膜。本研究为海藻多糖可食膜的开发提供了一定的理论依据和借鉴意义。
O进行共价交联,而阿魏酸通过与琼胶和海藻酸钠中的—OH和—COOH形成氢键进行非共价交联。扫描电镜分析表明琼胶和海藻酸钠的相容性良好,各膜表面均平整、光滑,没有出现明显的孔隙和褶皱,而添加交联剂后,膜截面褶皱减少,膜结构更加紧密。因此,LBL技术和交联剂结合使用可以制备出综合性能更好的复合膜。本研究为海藻多糖可食膜的开发提供了一定的理论依据和借鉴意义。
[1] JUMAIDIN R, SAPUAN S M, JAWAID M, et al.Seaweeds as renewable sources for biopolymers and its composites:A review [J].Current Analytical Chemistry, 2018, 14(3):249-267.
[2] GUO X, WANG Y, QIN Y M, et al.Structures, properties and application of alginic acid:A review [J].International Journal of Biological Macromolecules, 2020, 162:618-628.
[3] CAZ N P, VELAZQUEZ G, RAM
N P, VELAZQUEZ G, RAM REZ J A, et al.Polysaccharide-based films and coatings for food packaging:A review[J].Food Hydrocolloids, 2017, 68:136-148.
REZ J A, et al.Polysaccharide-based films and coatings for food packaging:A review[J].Food Hydrocolloids, 2017, 68:136-148.
[4] HOU X B, XUE Z X, XIA Y Z.Preparation of a novel agar/sodium alginate fire-retardancy film[J].Materials Letters, 2018, 233:274-277.
[5] SAINI A R, SHARMA D, XIA Y Y, et al.Layer-by-layer assembly of cationic guar gum, cellulose nanocrystals and hydroxypropyl methylcellulose based multilayered composite films[J].Cellulose, 2021, 28(13):8445-8457.
[6] XIAO J, ZHAO K X, TIAN X J, et al.Impact of calcium-carboxylate interactions in cellulose nanofiber reinforced alginate based film with triple-decker-like structure[J].LWT, 2021, 151:112197.
[7] ZHANG L M, LI K N, YU D W, et al.Chitosan/zein bilayer films with one-way water barrier characteristic:Physical, structural and thermal properties [J].International Journal of Biological Macromolecules, 2022, 200:378-387.
[8] ZHAO K X, WANG W H, TENG A G, et al.Using cellulose nanofibers to reinforce polysaccharide films:Blending vs layer-by-layer casting [J].Carbohydrate Polymers, 2020, 227:115264.
[9] ZHAI X D, ZOU X B, SHI J Y, et al.Amine-responsive bilayer films with improved illumination stability and electrochemical writing property for visual monitoring of meat spoilage [J].Sensors and Actuators B:Chemical, 2020, 302:127130.
[10] HOU X B, XUE Z X, XIA Y Z, et al.Effect of SiO2 nanoparticle on the physical and chemical properties of eco-friendly agar/sodium alginate nanocomposite film[J].International Journal of Biological Macromolecules, 2019, 125:1289-1298.
[11] ARABESTANI A, KADIVAR M, SHAHEDI M, et al.The effect of oxidized ferulic acid on physicochemical properties of bitter vetch (Vicia ervilia) protein-based films [J].Journal of Applied Polymer Science, 2016, 133(2):42894.
[12] ABDOLLAHI M, DAMIRCHI S, SHAFAFI M, et al.Carboxymethyl cellulose-agar biocomposite film activated with summer savory essential oil as an antimicrobial agent [J].International Journal of Biological Macromolecules, 2019, 126:561-568.
[13] WANG X J, GUO C F, HAO W H, et al.Development and characterization of agar-based edible films reinforced with nano-bacterial cellulose [J].International Journal of Biological Macromolecules, 2018, 118:722-730.
[14] 李杨, 白钰, 许加超, 等.交联体系对海藻酸钠/印度树胶复合膜性能的影响[J].食品工业科技, 2020, 41(17):219-224;278.
LI Y, BAI Y, XU J C, et al.Effect of cross-linking system on properties of sodium alginate/gum ghatti blend film[J].Science and Technology of Food Industry, 2020, 41(17):219-224;278.
[15] AWADHIYA A, KUMAR D, VERMA V.Crosslinking of agarose bioplastic using citric acid[J].Carbohydrate Polymers, 2016, 151:60-67.
[16] CAO N, FU Y H, HE J H.Mechanical properties of gelatin films cross-linked, respectively, by ferulic acid and tannin acid [J].Food Hydrocolloids, 2007, 21(4):575-584.
[17] MATHEW S, ABRAHAM T E.Characterisation of ferulic acid incorporated starch-chitosan blend films [J].Food Hydrocolloids, 2008, 22(5):826-835.
[18] LI K J, ZHU J X, GUAN G L, et al.Preparation of chitosan-sodium alginate films through layer-by-layer assembly and ferulic acid crosslinking:Film properties, characterization, and formation mechanism[J].International Journal of Biological Macromolecules, 2019, 122:485-492.
[19] 贾超, 王利强, 卢立新, 等.阿魏酸对马铃薯淀粉基复合膜性能的影响[J].食品工业科技, 2013, 34(7):82-85.
JIA C, WANG L Q, LU L X, et al.Effect of ferulic acid on properties of potato starch-based composite films[J].Science and Technology of Food Industry, 2013, 34(7):82-85.
[20] 李一凡, 徐永新, 刘捷.pH敏感性凝胶的作用原理,制备及应用领域[J].价值工程, 2012, 31(25):13-15.
LI Y F, XU Y X, LIU J.Reaction principle, preparation and applications of pH-sensitive hydrogels[J].Value Engineering, 2012, 31(25):13-15.
[21] YERRAMATHI B B, KOLA M, ANNEM MUNIRAJ B, et al.Structural studies and bioactivity of sodium alginate edible films fabricated through ferulic acid crosslinking mechanism[J].Journal of Food Engineering, 2021, 301:110566.
[22] INSAWARD A, DUANGMAL K, MAHAWANICH T.Mechanical, optical, and barrier properties of soy protein film as affected by phenolic acid addition[J].Journal of Agricultural and Food Chemistry, 2015, 63(43):9421-9426.
[23] TAN W Q, DONG F, ZHANG J J, et al.Physical and antioxidant properties of edible chitosan ascorbate films[J].Journal of Agricultural and Food Chemistry, 2019, 67(9):2530-2539.
[24] 董宇豪, 陈浩, 刘世永, 等.甜菜果胶-鱼明胶复合可食膜的制备及特性研究[J].食品科学技术学报, 2019, 37(2):88-93;101.
DONG Y H, CHEN H, LIU S Y, et al.Preparation and properties of sugar beet pectin-fish gelation edible composite film[J].Journal of Food Science and Technology, 2019, 37(2):88-93;101.
[25] MOTELICA L, FICAI D, OPREA O C, et al.Antibacterial biodegradable films based on alginate with silver nanoparticles and lemongrass essential oil-innovative packaging for cheese[J].Nanomaterials, 2021, 11(9):2377.
[26] YANG M L, XIA Y Z, WANG Y X, et al.Preparation and property investigation of crosslinked alginate/silicon dioxide nanocomposite films [J].Journal of Applied Polymer Science, 2016, 133(22):43489.
[27] UDDIN K M A, AGO M, ROJAS O J.Hybrid films of chitosan, cellulose nanofibrils and boric acid:Flame retardancy, optical and thermo-mechanical properties [J].Carbohydrate Polymers, 2017, 177:13-21.
[28] LIGUORI A, URANGA J, PANZAVOLTA S, et al.Electrospinning of fish gelatin solution containing citric acid:An environmentally friendly approach to prepare crosslinked gelatin fibers [J].Materials, 2019, 12(17):2808.
[29] SHANKAR S, RHIM J W.Preparation and characterization of agar/lignin/silver nanoparticles composite films with ultraviolet light barrier and antibacterial properties [J].Food Hydrocolloids, 2017, 71:76-84.
[30] COSTA M J, MARQUES A M, PASTRANA L M, et al.Physicochemical properties of alginate-based films:Effect of ionic crosslinking and mannuronic and guluronic acid ratio [J].Food Hydrocolloids, 2018, 81:442-448.
[31] VOLERY P, BESSON R, SCHAFFER-LEQUART C.Characterization of commercial carrageenans by Fourier transform infrared spectroscopy using single-reflection attenuated total reflection[J].Journal of Agricultural and Food Chemistry, 2004, 52(25):7457-7463.
[32] G MEZ-ORD
MEZ-ORD
 EZ E, RUPÉREZ P.FTIR-ATR spectroscopy as a tool for polysaccharide identification in edible brown and red seaweeds[J].Food Hydrocolloids, 2011, 25(6):1514-1520.
EZ E, RUPÉREZ P.FTIR-ATR spectroscopy as a tool for polysaccharide identification in edible brown and red seaweeds[J].Food Hydrocolloids, 2011, 25(6):1514-1520.
[33] PEREIRA L, SOUSA A N, COELHO H, et al.Use of FTIR, FT-Raman and13C-NMR spectroscopy for identification of some seaweed phycocolloids[J].Biomolecular Engineering, 2003, 20(4-6):223-228.