莫能菌素是于1967年首先从肉桂地链霉菌(Streptomyces cinnamonensis)发酵液中分离到的一种聚醚类抗生素[1-2],主要成分包括莫能菌素A与莫能菌素B,其中前者为其主要活性成分[3]。莫能菌素拥有卓越的抗球虫效果,具有抗虫谱广、作用方式独特、耐药性形成缓慢等特点,是畜禽球虫病防治中最重要的防治药物,其销量占现今抗球虫药市场的80%[4]。重要的是,莫能菌素还可以显著改善反刍动物的营养物质利用率等,所以已被广泛用于促生长饲料添加剂[5]。所以莫能菌素已成为绿色、安全、高效的抗生素而被广泛应用在医药、农业等领域,具有广阔的发展前景。
随着工业生物技术蓬勃发展,利用现代生物技术对肉桂地链霉菌进行改造以获得发酵效价高、工业属性强的莫能菌素生产菌,已成为另一种行之有效的方法[6]。其中,通过异源表达将外源基因引入肉桂地链霉菌体内从而促进莫能菌素合成的研究十分有限。2001年,文莹等[7]尝试对生活在贫氧条件下透明颤菌体内的血红蛋白基因vgb进行异源诱导表达以降低肉桂地链霉菌对溶氧量的敏感程度,发现在振幅较大摇床上发酵12 h后诱导表达vgb菌株效价(1 255 U/mL)比未诱导菌株提高15.9%,而通气较差摇床上24 h后诱导表达的最高效价较未诱导菌株提高32.5%。可见,通过异源表达vgb基因来增强菌体的溶氧能力是提高莫能菌素发酵效价的有效方法。而肉桂地链霉菌作为丝状菌,在发酵产莫能菌素过程中自身菌体易结团[8],而且发酵液含有油脂类和黄豆饼粉等导致发酵液黏稠度增加的营养成分,所以如何有效提高发酵溶氧应是促进菌体生长代谢和提高莫能菌素发酵效价的重要途径[9-10],因此在肉桂地链霉菌体内进行vgb异源表达增强菌株摄氧能力可能在莫能菌素工业发酵中具有重要的应用前景,但上述研究并未使用整合型表达载体,需要添加抗生素以确保携带外源基因的质粒稳定存在,而且还要额外添加硫链丝菌素诱导vgb表达,所以有必要进一步改进vgb基因异源表达系统以适用于大规模的发酵工业生产。
除异源表达手段外,对肉桂地链霉菌体内的莫能菌素合成正调控基因[11-12]进行过表达也是值得关注的可靠方法。张洁[13]对莫能菌素生物合成途径中的特异性调控基因monH进行过表达使产量提高了29%,并经过敲除以及回补证明了monH是莫能菌素生物合成基因簇中的正调节基因。在此基础上,TANG等[14]探究了莫能菌素生物合成途径中多种特异性调控基因对莫能菌素产量的影响,从转录水平解释了monH、monR I和monRⅡ的交叉互补作用,并通过组合过表达monR I、monRⅡ和monH使产量(1 100 U/mL)提升了92%。上述研究表明,基因工程手段可显著提升莫能菌素发酵效价水平,但这些工程菌株的最终效价大多停留在野生菌水平(2 000 U/mL以下),尚未见诸贴近工业化生产水平实践的尝试。因此,利用工业生物技术手段有效开展莫能菌素合成菌株的分子改造研究,在提高莫能菌素产量方面仍具有不小的发展潜力。
实验室前期构建了monH过表达及其与monRⅡ串联过表达的工程菌株2110-monH和2110-monH-monRⅡ,摇瓶效价可达6 000 U/mL以上。为进一步提高莫能菌素工业化生产水平,本研究尝试优化肉桂地链霉菌的接合转移系统,以该方法在上述monH和monRⅡ过表达菌株的基础上,利用整合型载体串联vgb基因进行异源整合表达,评估其对莫能菌素高产菌株发酵效价的提升程度,为利用现代生物技术手段进行工业菌育种提供一定的指导意义,并为后期对该菌株进行基因工程改造手段和深入研究提供技术支撑。
1 材料与方法
1.1 实验材料
1.1.1 菌株、质粒和引物
本实验所使用的菌株及质粒如表1所示。目的基因扩增引物如表2所示。
表1 本研究中使用的菌株和质粒
Table 1 Strains and plasmids used in this study
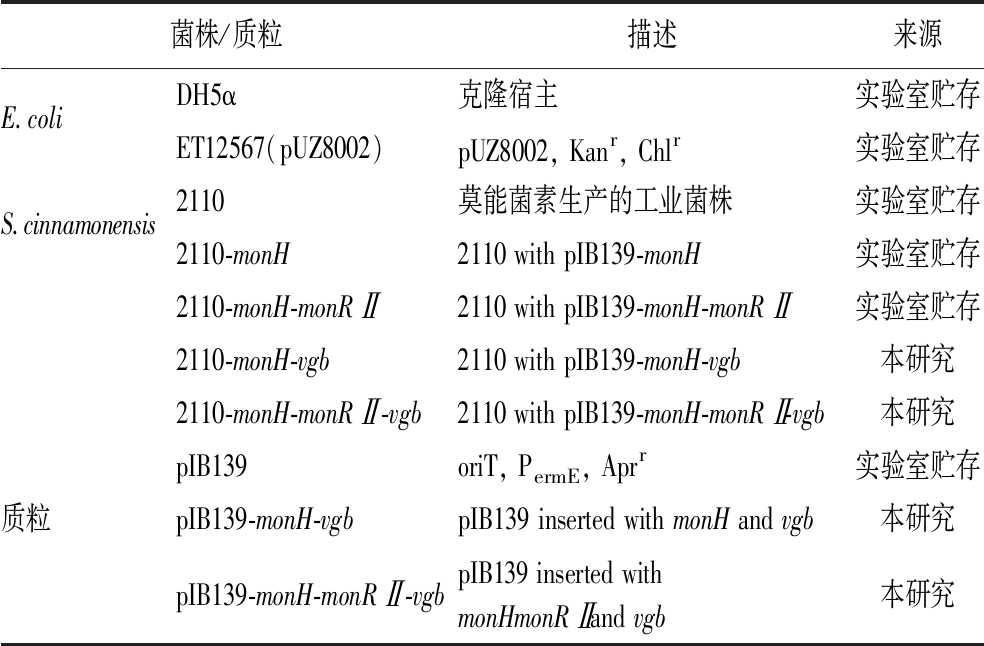
菌株/质粒描述来源E.coliDH5α克隆宿主实验室贮存ET12567(pUZ8002)pUZ8002, Kanr, Chlr实验室贮存S.cinnamonensis2110莫能菌素生产的工业菌株实验室贮存2110-monH2110 with pIB139-monH实验室贮存2110-monH-monRⅡ2110 with pIB139-monH-monRⅡ实验室贮存2110-monH-vgb2110 with pIB139-monH-vgb本研究2110-monH-monRⅡ-vgb2110 with pIB139-monH-monRⅡ-vgb本研究pIB139oriT, PermE, Aprr实验室贮存质粒pIB139-monH-vgbpIB139 inserted with monH and vgb本研究pIB139-monH-monRⅡ-vgbpIB139 inserted withmonHmonRⅡ and vgb本研究
表2 本研究中使用的引物序列
Table 2 Primer sequences used in this study

引物名称引物序列(5′-3′)monH1-FGTTGGTAGGATCCACATATGGTGAGCGGGGTGGAGCGGmonH1-RACTCGGCGTCGGCGAGCGCACCGmonH2-FTGCGCTCGCCGACGCCGAGTGGCGGCTCGACCCmonH2-RTGGTCGAGCCTCCTTATCAGCCGAGGGCTGCCTGmonH3-FGCGGCCCTGATAAGGAGGGTGAGCGGGGTGGAGCGGmonH3-RACTCGGCGTCGGCGAGCGCACCGmonH4-FTGCGCTCGCCGACGCCGAGTGGCGGCTCGACCCmonH4-RTGGTCGAGCCTCCTTATCAGCCGAGGGCTGCCTGmonRII-FGTTGGTAGGATCCACATATGGTGCCTGGTCTGAGAGAACGCmonRII-RCCCGCTCACCCTCCTTATCAGGGCCGCAGGTCTTCvgb-1-FCCCTCGGCTGATAAGGAGGCTCGACCAGCAAACCATCAvgb-1-RTATGACATGATTACGAATTCTCATTCAACCGCTTGAGCGvgb-2-FGCCCTCGGCTGATAAGGAGGCTCGACCAGCAAACCATCvgb-2-RTATGACATGATTACGAATTCTCATTCAACCGCTTGAGCGpIB139-FGAATTCGTAATCATGTCATAGCTGTTTpIB139-RCATATGTGGATCCTACCAACCGGaac-FGTGCAATACGAATGGCGAAAaac-RTCAGCCAATCGACTGGCGAG
表3 本研究中使用的抗生素工作浓度和贮存浓度
Table 3 Titers of antibiotics for use and storage in this study
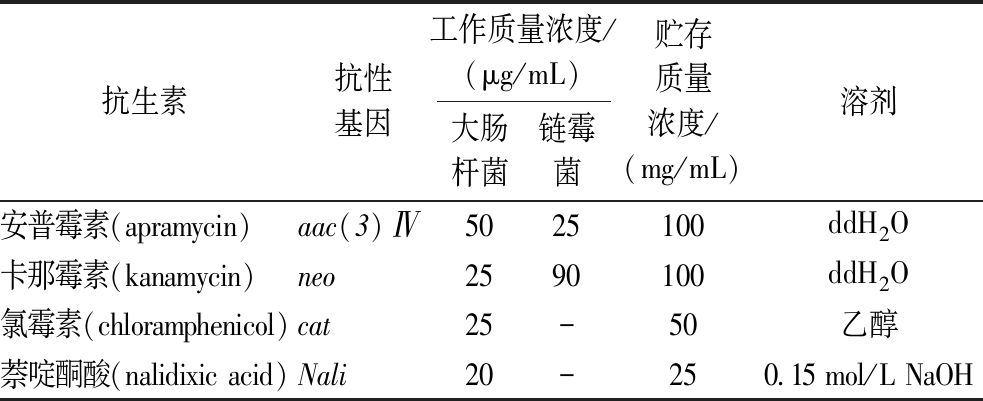
注:“-”表示本研究中未出现该浓度溶液的使用。
抗生素抗性基因工作质量浓度/(μg/mL)大肠杆菌链霉菌贮存质量浓度/(mg/mL)溶剂安普霉素(apramycin)aac(3)Ⅳ5025100ddH2O卡那霉素(kanamycin)neo2590100ddH2O氯霉素(chloramphenicol)cat25-50乙醇萘啶酮酸(nalidixic acid)Nali20-250.15 mol/L NaOH
1.1.2 试剂与仪器
黄豆饼粉、葡萄糖、轻质碳酸钙、豆油,山东胜利生物有限公司;莫能菌素标准品,上海泰坦科技股份有限公司;细菌基因组提取试剂盒、SanPrep柱式质粒小量抽提试剂盒、SanPrep柱式DNA胶回收试剂盒,生工生物工程(上海)股份有限公司;BeyoFusionTM PCR Master Mix(2X)、BeyoAmpTM Extra-long DNA Polymerase、无缝克隆试剂盒,上海碧云天生物技术有限公司。
RePure·D(B)基因扩增仪,杭州柏恒科技有限公司;SpectraMax 190超微量分光光度计,美谷分子仪器(上海)有限公司;SBA-40E生物传感分析仪,山东省科学院生物研究院;UV-3200紫外分光光度计,上海美谱达仪器有限公司。
1.2 实验方法
1.2.1 培养基与溶液
高氏培养基(g/L):可溶性淀粉10,硝酸钾1,氯化钠0.5,磷酸氢二钾0.5,硫酸镁0.5,硫酸亚铁0.01,琼脂30。
种子培养基(g/L):糊精20,黄豆饼粉15,葡萄糖5,酵母粉2.5。用6 mol/L氢氧化钠溶液调pH值至6.8,再加入1 g/L碳酸钙溶液。黄豆饼粉先用少量水溶解混匀,再于微波炉中煮沸3次。
发酵培养基(g/L):黄豆饼粉35,口服葡萄糖35,无水硫酸钠2.2,磷酸氢二钾0.075,七水硫酸亚铁0.1,硫酸铝0.705。用6 mol/L氢氧化钠溶液调pH值至6.8,再加入25 g/L碳酸钙溶液、40 g/L豆油。黄豆饼粉先用少量水溶解混匀,再于微波炉中煮沸3次。
MS培养基(g/L):甘露醇10,黄豆粉20,琼脂20,pH 7。
2×YT培养基(g/L):胰蛋白胨16,酵母粉10,NaCl 5,pH 7.2。
SM菌丝体培养基(g/L):葡萄糖10,蛋白胨4,酵母粉4,KH2PO4 0.2,K2HPO4 0.4,MgSO40.05,pH 7.2,装液量25 mL/250 mL。
SOC培养基(g/L):酵母提取物5,胰蛋白胨20,葡萄糖3.6,NaCl 0.5,KCl 1.17,MgCl2 0.95。分装于-80 ℃冰箱保存。
3%香草醛溶液:称取香草醛3.0 g于100 mL无水甲醇,待其溶解后加入1.0 mL的浓硫酸,混匀后转入棕色瓶中备用。该溶液可于2~8 ℃环境下保存10 d。
1.2.2 肉桂地链霉菌的培养
平板和斜面培养:分别在高氏培养基上培养10 d和8 d。菌丝体的培养:用接种环刮取平板上培养10 d的完整单菌落,接种于SM菌丝体培养基,在30 ℃、250 r/min条件下培养24 h左右直至菌液变得均匀细腻以及菌悬浮体在培养基中呈细小颗粒状。
摇瓶发酵:吸取1 mL保藏孢子悬液或挑取单菌落至种子培养基(装液量100 mL/500 mL)中,在30 ℃、200 r/min条件培养24 h后以10%接种量至发酵培养基(装液量50 mL/500 mL),同上条件发酵10 d。中度限氧摇瓶发酵条件:装液量增加至75 mL/500 mL,其余条件同常规发酵条件。
高度限氧摇瓶发酵条件:装液量增加至75 mL/500 mL,用耐高温组培封口膜与双层牛皮纸封住瓶口,其余条件同常规发酵条件。发酵罐发酵:培养基配方参考摇瓶,有机硅消泡剂添加量0.1%,装液量2 L/5 L发酵罐,接种量10%。初始发酵条件为温度33 ℃、转速500 r/min、通气量3 L/min。
1.2.3 大肠杆菌-链霉菌属间接合转移的初始方法
将1 mL过夜培养的重组大肠杆菌转接至50 mL LB培养基中并加入终浓度为20 mmol/L的MgCl2溶液和相应抗生素,培养至OD600值约为0.5后于4 ℃冰箱预冷。期间加热融化MS培养基并加入终浓度为10 mmol/L的MgCl2溶液,混匀后倒平板备用(即MS-1培养基)。按照1.2.2节中的方法培养肉桂地链霉菌菌丝体,将其转移至50 mL无菌离心管中,于4 ℃和6 500 r/min离心5 min后小心倒掉上清液,加入25 mL的2×YT培养基后用涡旋振荡器洗涤菌丝体,同样离心去上清液,重复洗涤1次后加入3 mL 2×YT培养基,用移液枪吹吸重悬菌丝体,备用。将预冷好的大肠杆菌4 ℃下4 500 r/min离心5 min去上清液后加入15 mL LB培养基(MgCl2终浓度为20 mmol/L)充分洗涤菌体,于4 ℃下4 500 r/min离心5 min后去上清液,重复洗涤1次,加入适量LB培养基以重悬菌体,按照约10∶1的供受体菌比例与浓缩的链霉菌菌丝体混合均匀。混合菌液涂布于备用的MS平板上,30 ℃培养16~18 h。配制1 mg/mL的相应抗生素溶液和0.5 mg/mL的萘啶酮酸溶液,过滤除菌后取1 mL均匀覆盖于整个培养基表面,于超净台中吹干,30 ℃继续培养3~5 d即可见重组子长出。
1.2.4 接合转移系统优化方法
用含有pIB139的大肠杆菌与出发菌2110进行接合转移系统优化实验。对于Ca2+添加量的优化,分别向MS-1培养基中添加终浓度为20、40、60、80 mmol/L的CaCl2溶液,每组实验设置3个平行以及1组空白对照。对于供受体菌比例的优化,通过控制大肠杆菌菌液的OD600及链霉菌菌丝体的培养时间来分别控制供受体菌的比例,设置5组不同的供受比,分别为1∶10、1∶1、10∶1、100∶1、500∶1,每组实验设置3个平行。对于安普霉素和萘啶酮酸覆盖时间的优化,分别在供受体菌混合后的12、14、16、18、20 h时在MS-1表面覆盖抗生素溶液,每组实验设置3个平行。
1.2.5 分子生物学基本操作
肉桂地链霉菌基因组的提取按照上海生工的“细菌基因组提取试剂盒”说明书进行操作。大肠杆菌质粒的提取按照上海生工的“SanPrep柱式质粒小量抽提试剂盒”说明书进行操作。PCR反应体系:BeyoFusionTM PCR Master Mix(2X) 25 μL,上下游引物各1 μL,模板DNA(100 ng/μL) 2 μL,DMSO 2.5 μL,补加超纯水至50 μL。PCR反应程序为:94 ℃,3 min;94 ℃,30 s;T,30 s(T由引物的Tm值计算);72 ℃,t s(ts由待扩增片段长度和所用酶的合成速度计算);35个循环;72 ℃,10 min;4 ℃,+∞。大肠杆菌的培养、感受态制备、质粒转化及DNA回收等基本操作参考文献[14]。
1.2.6 工程菌的构建
在NCBI上查找莫能菌素生物合成基因簇中monH、monRⅡ和透明颤菌血红蛋白基因vgb的序列,前二者以出发菌S.cinnamonensis 2110基因组为模板进行后续PCR扩增,后者以生工生物工程(上海)股份有限公司合成的DNA为模板。用SnapGene绘制质粒图谱,在合适位点将目的基因插入pIB139后用CE Design软件设计出带有同源臂的引物(表2),分别通过PCR扩增得到各目的基因和质粒骨架,经纯化后测定DNA浓度,按照碧云天的“无缝克隆试剂盒”说明书进行操作,从而构建出各重组质粒。接着制备ET12567感受态,将其转入ET12567获得重组子,再按照优化后的接合转移方法将各重组质粒转入出发菌2110中,得到的工程菌后在无抗培养基中松弛培养纯化2代,挑取生长状况良好的菌株保藏进行后续实验。
1.2.7 分析检测方法
生物量:由于培养基中含有大量非菌体固形物,因此采用体积法测定[15]。
葡萄糖浓度测定:采用生物传感分析仪进行测定。用配套的葡萄糖标准溶液定标后,将样品稀释一定倍数,进样25 μL进行测定,仪器示数乘以稀释倍数的1%即为发酵液中葡萄糖浓度。
莫能菌素效价测定:香草醛显色法[16]。莫能菌素效价以1 μg标准品作为一个单位(U),即1 μg/mL莫能菌素溶液效价为1 U/mL。
接合转移效率计算方法:根据链霉菌遗传操作手册,接合转移效率为接合子数量与受体链霉菌菌落数之比,菌落数量采用稀释涂布平板法计算[17]。
2 结果与分析
2.1 肉桂地链霉菌遗传操作系统的优化
2.1.1 Ca2+的添加量
根据已有文献报道,适当地添加Ca2+对接合转移的效率有正向促进作用[18],其能够增大细胞膜的通透性,便于目的质粒的转入[19]。实验对Ca2+的添加量进行优化,结果如图1所示,当Ca2+终浓度为0~40 mmol/L时,接合转移效率随着Ca2+浓度增大而提高,但当Ca2+浓度增大到60 mmol/L时接合效率下降。然而,当Ca2+浓度达到80 mmol/L时,尽管接合效率迅速上升至原始条件的约10倍,但随机挑取接合子进行PCR验证发现其阳性接合子的比例只有20%。因此,实验选择在培养基中添加40 mmol/L作为Ca2+最适添加浓度。
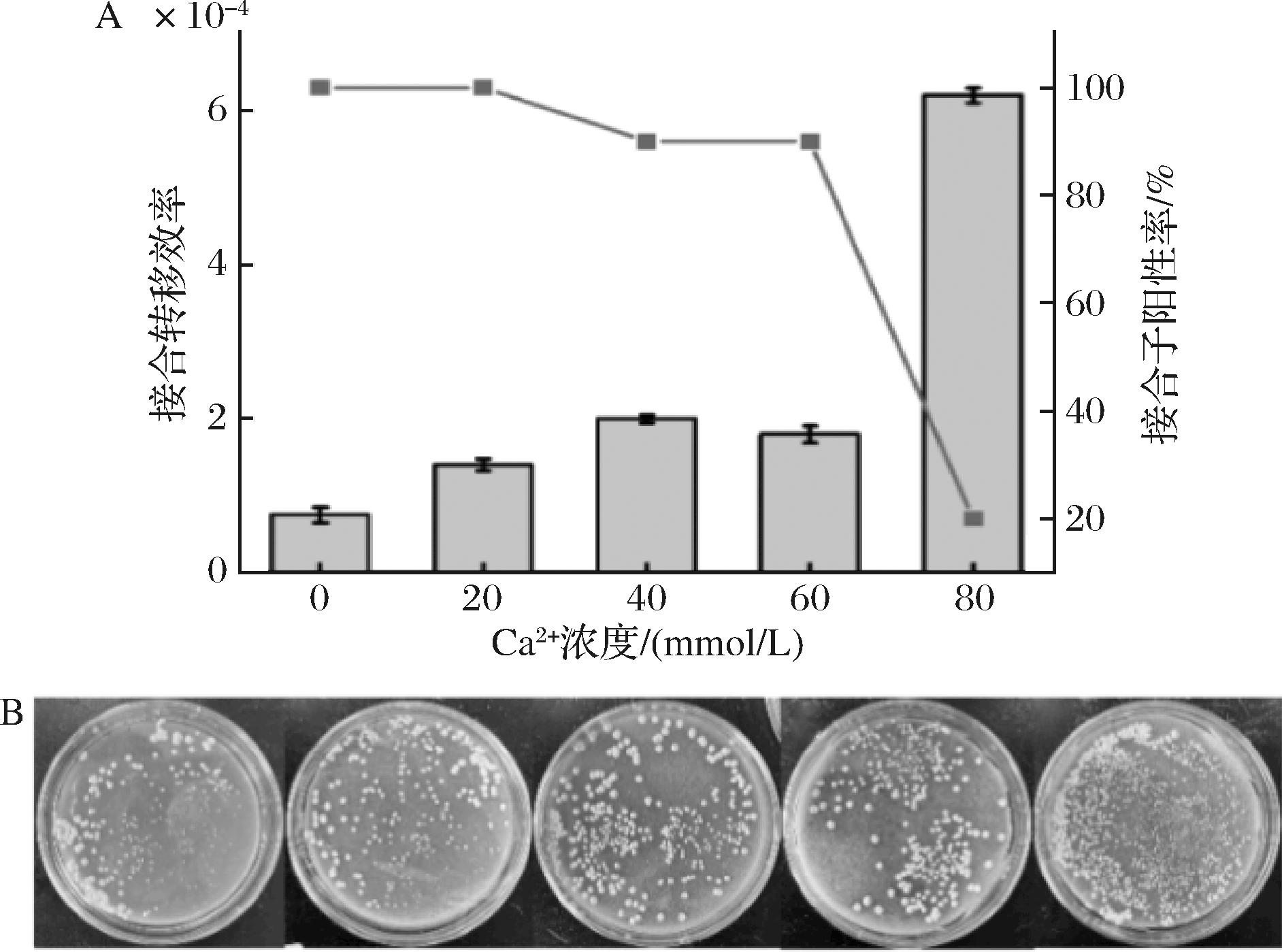
图1 不同浓度Ca2+对接合转移效率的影响
Fig.1 Effects of different Ca2+ concentrations on the conjugation transfer frequency
注:图1-B中从左至右分别表示在MS-1平板上添加Ca2+的终浓度为0、20、40、60、80 mmol/L时接合子的生长情况。
2.1.2 供受体菌比例
有文献表明,适当加大供受比的比例能够提高接合转移的效率[20]。实验比较供受体菌比例对接合转移效率的影响,结果如图2所示,当供受比为1∶10、1∶1、10∶1、100∶1、500∶1时,接合转移效率分别为3.0×10-5、5.8×10-5、2.2×10-4、2.7×10-4、3.1×10-4。可见,接合转移效率随着供受比的增大而提高。然而,在供受比为500∶1时接合转移效率虽较高,但此时菌落太过密集不利于后续的挑取验证,且接合子阳性率不足100%。因此,实验选择100∶1作为最适供受体菌比例。
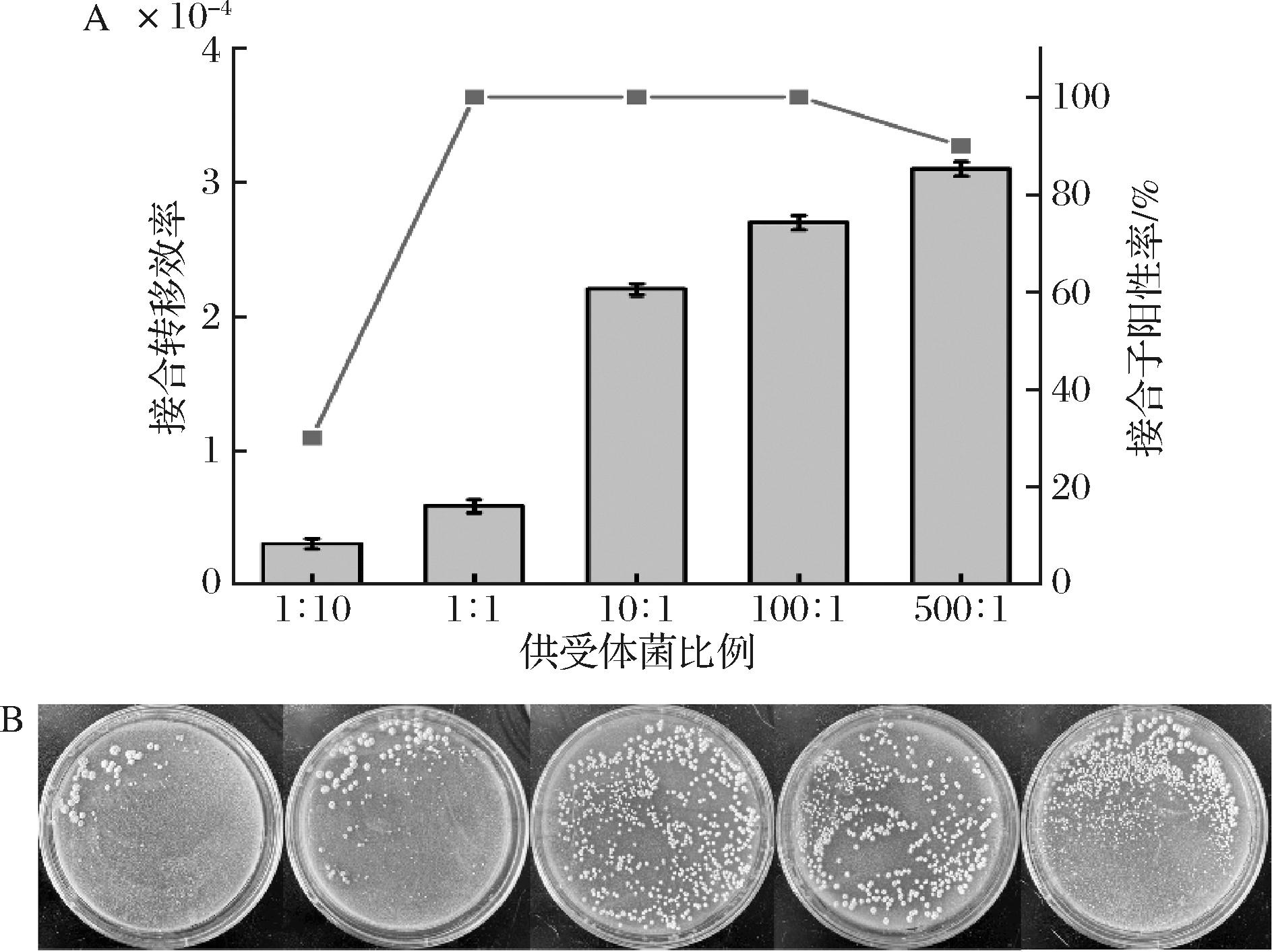
图2 不同的供受体菌比例对接合转移效率的影响
Fig.2 Effects of the donor-receptor ratio on the conjugation transfer frequency
注:图1-B中从左至右分别表示供受体菌比为1∶10、1∶1、10∶1、100∶1、500∶1时接合子的生长情况。
2.1.3 抗生素的覆盖时间
不同种类链霉菌的生长速度对接合转移中抗生素的最佳添加时间有直接影响。在本实验中,pIB139质粒上带有安普霉素抗性基因,所以成功导入质粒的转化子能够在一定浓度安普霉素下生长,从而起到筛选的效果,而加入萘啶酮酸能够抑制供体大肠杆菌的生长,所以接下来的实验探究安普霉素和萘啶酮酸的最佳覆盖时间,结果如图3所示。当覆盖时间为12、14、16、18、20 h时,接合转移效率分别为7.3×10-5、1.1×10-4、2.5×10-4、3.0×10-4、3.4×10-4,表明二者呈正向相关。结合接合子阳性率综合考虑,实验最终选择在供受体菌混合后的18 h覆盖抗生素溶液。
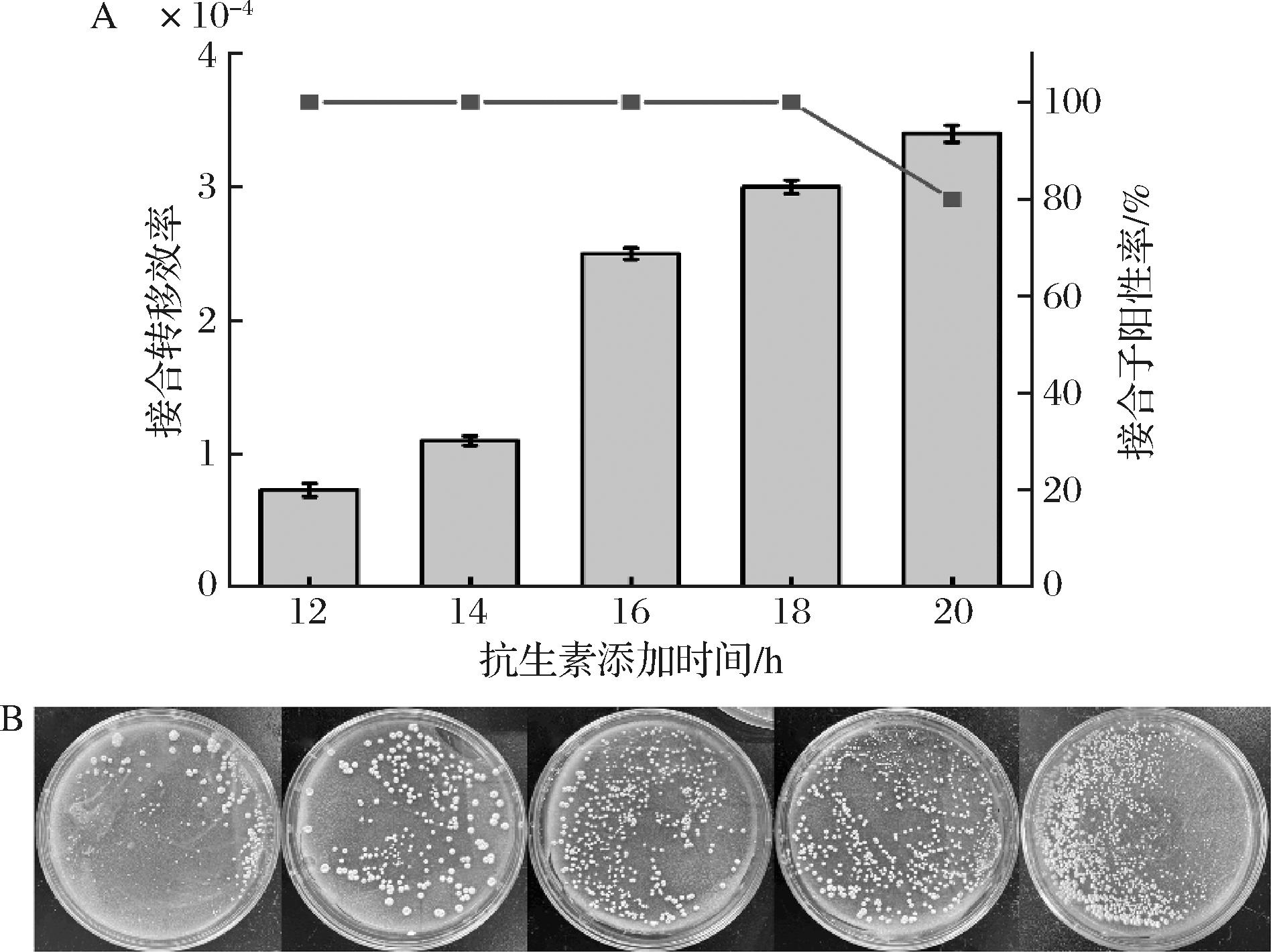
图3 不同的抗生素添加时间对接合转移效率的影响
Fig.3 Effects of different time for antibiotics addition on the conjugation transfer frequency
注:图1-B中从左至右分别表示抗生素覆盖时间为12、14、16、18、20 h时接合子的生长情况。
2.2 基因工程菌株的构建
2.2.1 含同源臂的目的基因片段扩增
以出发菌的基因组DNA为模板进行PCR扩增时,由于monH分子质量较大,GC含量高达70%,所以需要分两段克隆。按表2中的引物克隆出大小分别为1 425、1 574、1 423、1 574、613、477、478 bp的片段;经凝胶电泳分析,结果如图4所示。
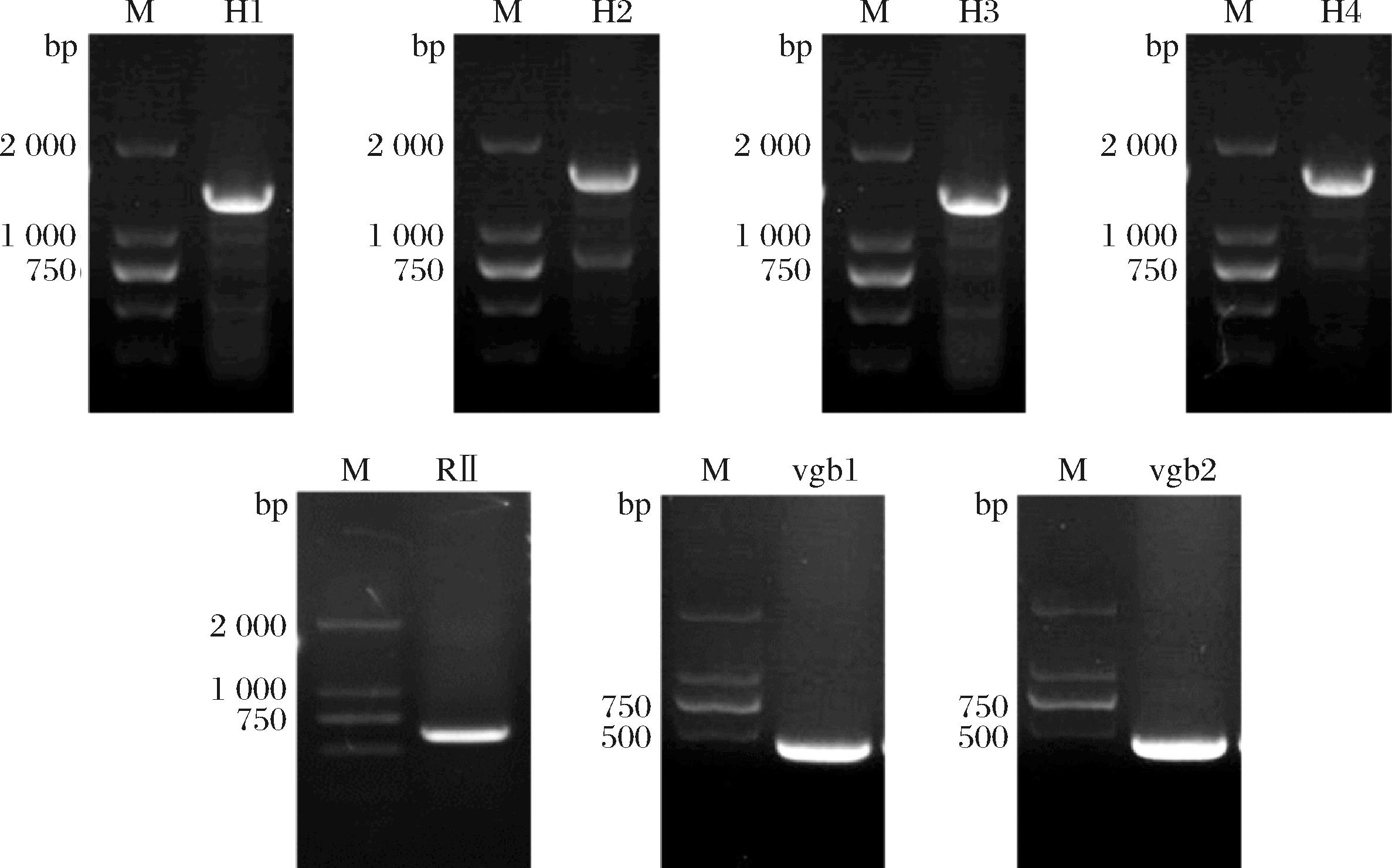
M-Marker;泳道H1、H2-质粒pIB139-monH-vgb中的两段monH;泳道H3、H4-质粒pIB139-monH-monRⅡ-vgb中的两段monH;泳道RⅡ-质粒pIB139-monH-monRⅡ-vgb中的monRⅡ基因;泳道vgb1-质粒pIB139-monH-vgb中的vgb基因;泳道vgb2-质粒pIB139-monH-monRⅡ-vgb中的vgb基因
图4 分段monH、monRⅡ和vgb的电泳图谱
Fig.4 Electropherogram of segmented monH, monRⅡ, and vgb
2.2.2 质粒骨架的反向扩增
pIB139质粒由pSET152质粒改造而来,其中的phiC31整合酶基因和attP整合位点能够高效地将质粒整合到链霉菌的基因组中,从而实现目的基因的过表达。所以,选择pIB139质粒为模板,按表2中的引物pIB139-F、pIB139-R反向扩增出大小为5 883 bp的质粒骨架,随后,经凝胶电泳分析,结果如图5所示。
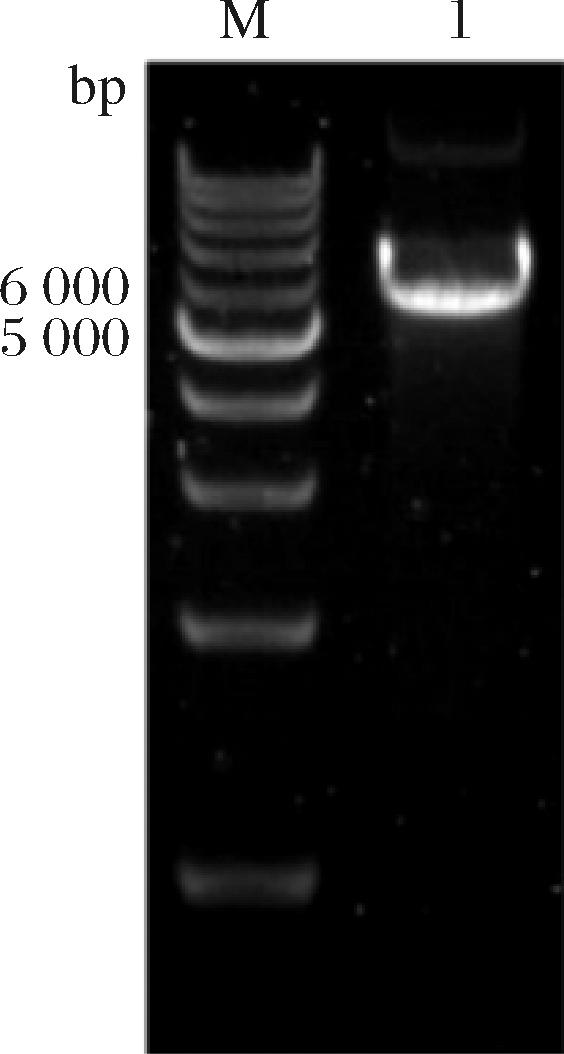
M-Marker;泳道1-质粒pIB139-monH-vgb和pIB139-monH-monRⅡ-vgb的骨架
图5 质粒骨架的电泳图谱
Fig.5 Electropherogram of plasmid backbones
2.2.3 DNA片段连接
将上述所有片段DNA纯化后,分别使用上海碧云天生物技术有限公司的“无缝克隆试剂盒”,根据插入片段和质粒骨架的浓度配制重组体系,按照说明书进行操作,得到重组质粒pIB139-monH-vgb和pIB139-monH-monRⅡ-vgb,质粒图谱如图6所示。
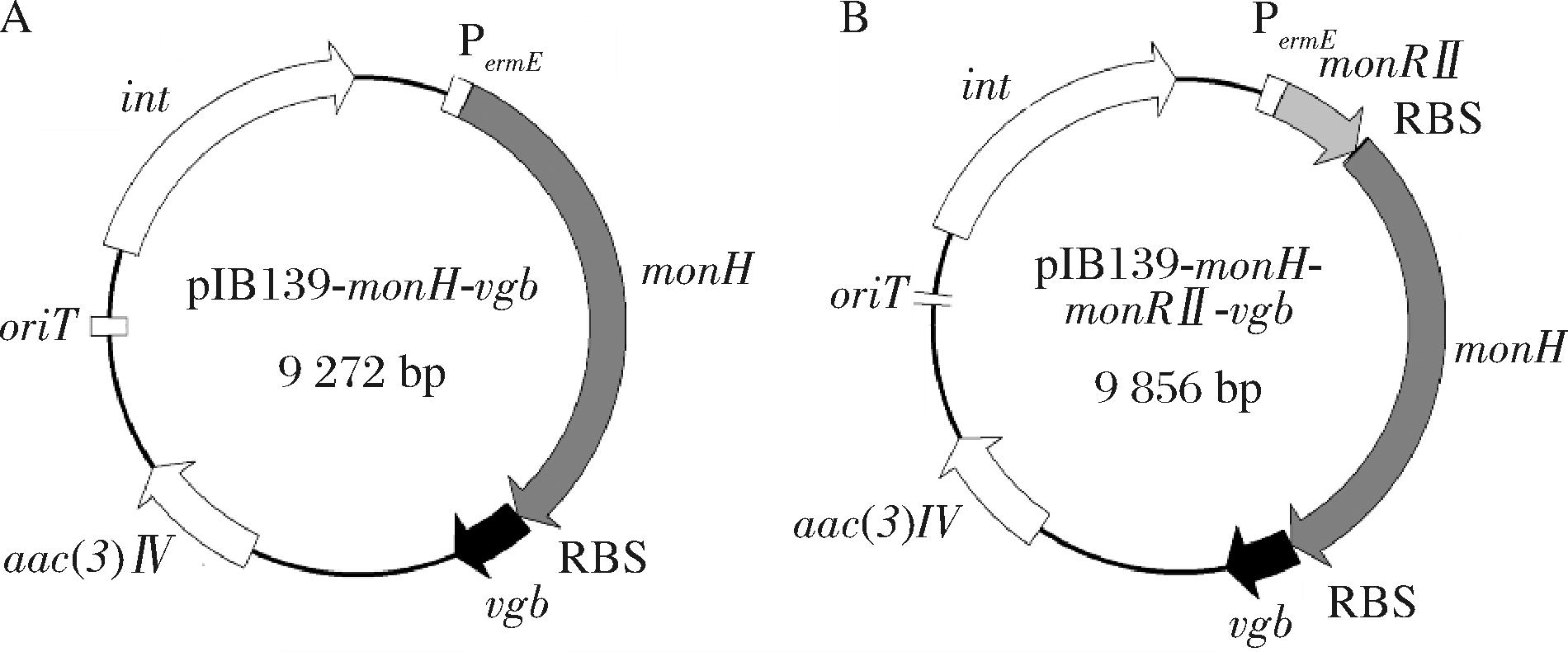
A-pIB139-monH-vgb;B-pIB139-monH-monRⅡ-vgb
图6 pIB139-monH-vgb和pIB139-monH-monRⅡ-vgb的质粒图谱
Fig.6 The map of pIB139-monH-vgb and pIB139-monH-monRⅡ-vgb
2.2.4 基因的整合与表达
ET12567/pUZ8002为甲基化缺陷型菌株,通过其转移的质粒不会被有甲基化修饰的链霉菌降解,从而提高质粒的转化效率[21]。实验首先制备大肠杆菌ET12567感受态,按照1.2.6节的方法构建出各工程菌。由于pIB139为整合型载体,质粒上原有的基因如抗性基因aac(3)Ⅳ都会一同整合至链霉菌基因组上,因此可通过扩增重组子aac(3)Ⅳ基因来判断目的基因是否成功转入。实验按照1.2.2节的方法培养重组子菌丝体,提取基因组后按表2中的引物进行电泳验证,结果如图7所示,条带符合预期,送测序比对结果正确,表明目的基因已成功转入重组子2110-monH-vgb和2110-monH-monRⅡ-vgb。
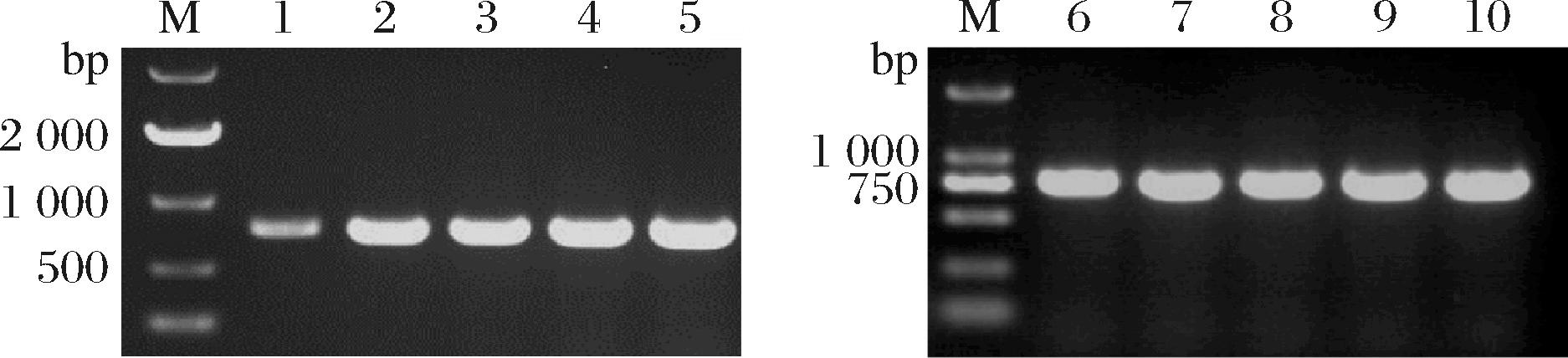
注:M-Marker;泳道1~5、6~10-工程菌株2110-monH-vgb、2110-monH-monRII-vgb的验证
图7 2110-monH-vgb和2110-monH-monRⅡ-vgb电泳图谱
Fig.7 Electropherogram of 2110-monH-vgb and 2110-monH-monRⅡ-vgb
针对vgb基因表达产物VHb蛋白与CO结合后,可以检测到420 nm可见光处特征吸收峰的特点,研究尝试利用CO差示光谱法检测工程菌2110-monH-vgb和2110-monH-monRⅡ-vgb中表达产物VHb蛋白的生物活性。检测结果如图8所示,与出发菌2110相比,工程菌2110-monH-vgb和2110-monH-monRⅡ-vgb的细胞裂解液在通入CO后于420 nm处出现了特征吸收峰,表明工程菌成功表达了VHb且其具有一定的生物学活性。
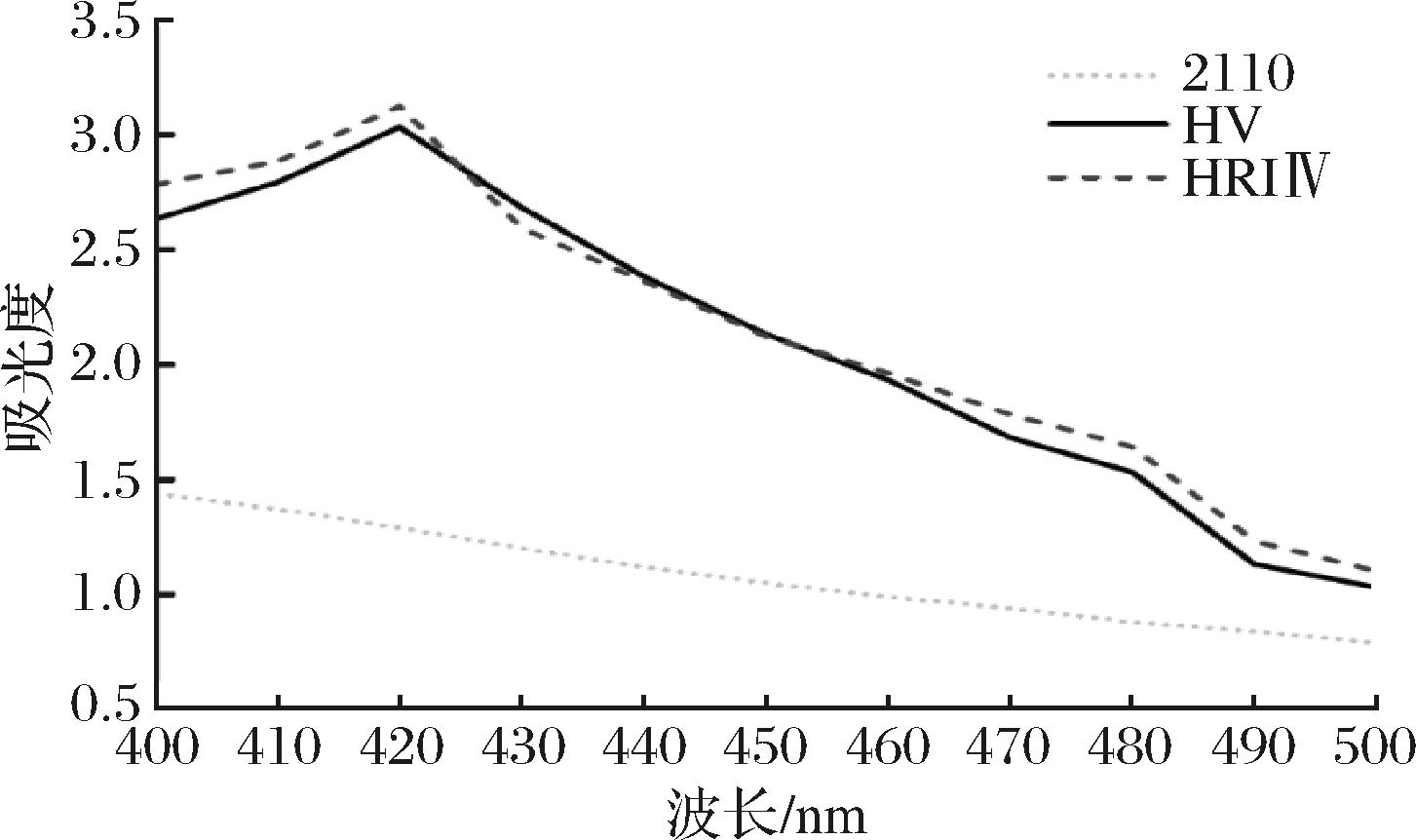
2110-出发菌S.cinnamonensis 2110;HV-2110-monH-vgb;HRIⅣ-2110-monH-monRII-vgb
图8 CO差示光谱分析VHb的生物活性
Fig.8 CO binding difference spectrum of VHb
2.3 基因工程菌株摇瓶发酵
为探究vgb表达对工程菌的生长及莫能菌素发酵水平的影响,实验按照1.2.2节方法通过调整装液量和封口方式来模拟不同发酵溶氧条件,将本研究中的2株工程菌2110-monH-vgb、2110-monH-monRⅡ-vgb与本实验室保藏的原始菌株2110以及前期构建的两株工程菌2110-monH和2110-monH-monRⅡ进行对比,结果如图9所示。

A-普通溶氧条件;B-中度限氧条件;C-高度限氧条件
图9 不同溶氧条件下出发菌与各工程菌的摇瓶发酵情况
Fig.9 Shake flask fermentation of starting and engineering strains under different aerobic conditions
注:菌株2110代表出发菌S.cinnamonensis 2110;菌株H代表2110-monH;菌株HV代表2110-monH-vgb;菌株HRⅡ代表2110-monH-monRⅡ;菌株HRIⅣ代表2110-monH-monRⅡ-vgb。
普通溶氧条件(图9-A)下,对于生物量而言,各菌株之间差异不明显。在发酵效价方面,菌株2110-monH-vgb较2110-monH效价仅提高3.8%,3个基因串联菌株2110-monH-monRⅡ-vgb较2110-monH-monRⅡ效价提高了6.0%。这些数据表明普通溶氧条件下,vgb基因的异源表达对莫能菌素效价的提升作用较小。有趣的是,3个基因串联菌株2110-monH-monRⅡ-vgb发酵效价与出发菌相比提升了30.2%,高于菌株2110-monH-monRⅡ(提升为22.9%),这意味着在普通溶氧条件下,monH、monRⅡ与vgb 3个基因在肉桂地链霉菌中串联表达具有叠加增强的效果。
在中度限氧条件(图9-B)下,菌株2110-monH-vgb生物量较2110-monH提高了4.7%,菌株2110-monH-monRⅡ-vgb生物量较2110-monH-monRⅡ提高了4.1%,这表明vgb异源表达促进了菌体在中度限氧条件下生长。在发酵效价方面,菌株2110-monH-vgb较2110-monH提高了12.1%,三基因串联菌株2110-monH-monRⅡ-vgb较2110-monH-monRⅡ效价提高了7.0%。这些数据说明在中度限氧条件下vgb基因的异源表达对莫能菌素效价的提升具有一定作用。同样地,3个基因串联菌株2110-monH-monRⅡ-vgb发酵效价比出发菌提高了43.9%,菌株2110-monH-monRⅡ提高了34.5%。该对比说明在中度限氧条件下,monH、monRⅡ与vgb 3个基因在肉桂地链霉菌中串联表达不仅有叠加增强的效果,而且这种叠加效果有随溶氧降低而增强的趋势。
在高度限氧条件(图9-c)下,菌株2110-monH-vgb生物量较2110-monH提高了6.0%;菌株2110-monH-monRⅡ-vgb生物量较2110-monH-monRⅡ提高了5.9%,这表明vgb异源表达促进了菌体在高度限氧条件下生长。在发酵效价方面,菌株2110-monH-vgb较2110-monH提高了18.0%,3个基因串联菌株2110-monH-monRⅡ-vgb较2110-monH-monRⅡ提高了23.1%。这些数据表明在高度限氧条件下vgb基因的异源表达对莫能菌素效价具有明显提升作用。同样地,三基因串联菌株2110-monH-monRⅡ-vgb发酵效价比出发菌提高了58.6%,菌株2110-monH-monRⅡ提高了28.9%。该对比说明在高度限氧条件下,monH、monRⅡ与vgb 3个基因在肉桂地链霉菌中串联表达不仅有叠加增强的效果,且这种叠加效果有随溶氧降低而增强的趋势。
与前人报道[7]相比,vgb基因异源表达非常明显地提升莫能菌素高产菌的发酵效价,且提升效果同样随着发酵过程中溶氧降低而增强。不过,先前研究采用非整合型表达载体并添加硫链丝菌诱导VHb的表达,在限氧条件下诱导24 h后可使效价提升32.5%,高于本研究中在限氧条件下效价的提升(最高为23.1%)。原因可能是本文的出发菌自身发酵效价已处于较高水平(8 000 U/mL),而且本研究中串联表达的多个基因加重了菌株代谢负担而导致效价提升上限变小。此外,诱导表达强度高于组成表达也是值得考虑的因素。然而,组成型表达在vgb基因的稳定遗传以及莫能菌素未来的大规模工业化生产会更具发展潜力。
2.4 基因工程菌株罐上发酵
为评估vgb基因与monH和monRⅡ的串联表达对肉桂地链霉菌在5 L罐体系下发酵的影响,实验对出发菌2110、工程菌2110-monH-monRⅡ和2110-monH-monRⅡ-vgb进行5 L罐批次发酵实验,在残糖量、生物量和效价3个方面进行对比。结果如图10所示,在糖耗方面,3个株菌差异不明显。在生物量方面,菌株2110-monH-monRⅡ-vgb拥有较长的稳定期和较晚的衰退期,可能是由于发酵中后期溶氧逐渐不足,使得vgb基因充分发挥了其提高菌株摄氧量的效果,进而达到了更高的生物量。此外,在发酵前期可观察到菌株2110-monH-monRⅡ-vgb的生物量略低于另两株菌,生长速度相对较慢,推测vgb基因可能影响发酵初始阶段菌体的初级代谢,但随着发酵过程的推移,差距逐渐缩小,最后工程菌生物量反超出发菌。该现象在吸水链霉菌[22]中也曾被报道过。在发酵效价方面,3个株菌在前6 d的代谢过程基本相同,莫能菌素都在第3天后进入快速合成阶段;但菌株2110与2110-monH-monRⅡ发酵至第6天达到最高效价水平后于第7天效价回落;而菌株2110-monH-monRⅡ-vgb发酵至第7天才达到最高效价水平,于第8天效价回落。据此推测vgb基因的异源表达可能会延长莫能菌素的合成期,进而使最终效价升高。发酵至第6天,出发菌2110和工程菌2110-monH-monRⅡ效价分别为7.8 kU/mL和10.7 kU/mL,此时2110-monH-monRⅡ-vgb效价为11.3 kU/mL,延长发酵至第7天效价为11.5 kU/mL。对比最高效价,与出发菌相比,前者提高47.3%,后者提高36.4%;菌株2110-monH-monRⅡ-vgb比2110-monH-monRⅡ提高了8.0%。综上,这些罐上发酵数据充分展示了vgb基因异源表达在工业规模上提高莫能菌素高产菌发酵效价的潜力。
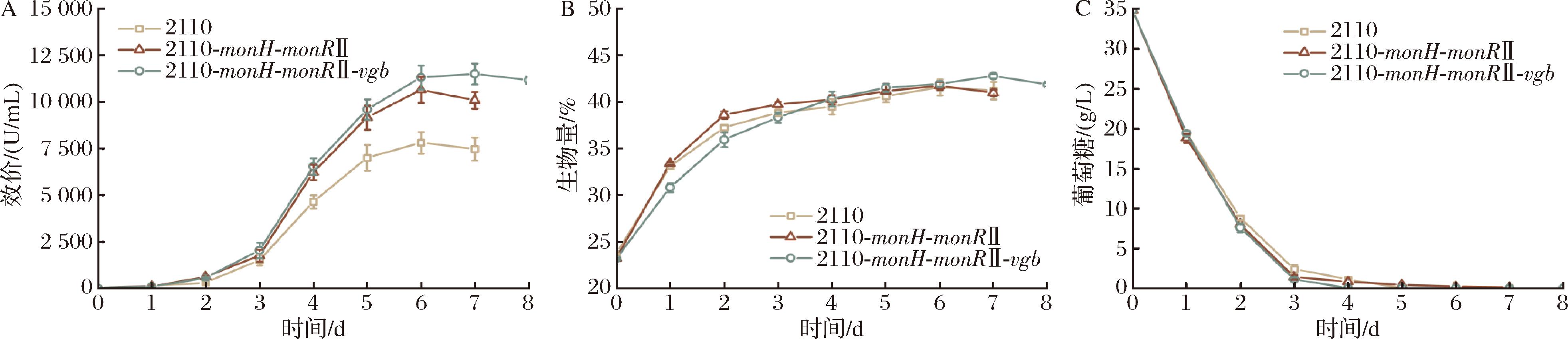
A-效价;B-生物量;C-葡萄糖含量
图10 菌株2110、2110-monH-monRⅡ和2110-monH-monRⅡ-vgb在5 L罐上的发酵情况对比
Fig.10 Comparison of fermentation performance of various strains, 2110, 2110-monH-monRⅡ, and 2110-monH-monRⅡ-vgb in a 5 L bio-fermentor
3 结论
本研究在优化肉桂地链霉菌接合转移系统而提高遗传操作效率基础上,成功使用整合型载体异源表达透明颤菌血红蛋白基因vgb,从而通过改善菌株摄取氧的能力来提高莫能菌素发酵水平。2株工程菌2110-monH-vgb和2110-monH-monRⅡ-vgb在摇瓶高度限氧条件下发酵产莫能菌素效价均显著提升(增加20%左右),在罐上发酵也表现出明显的优势。本研究为利用生物技术手段进行工业微生物育种提供了一定的指导意义。
[1] AGTARAP A, CHAMBERLIN J W.Monensin, a new biologically active compound.IV.Chemistry[J].Antimicrobial Agents and Chemotherapy, 1967, 7:359-362.
[2] WESTLEY J W.Polyether antibiotics:Versatile carboxylic acid ionophores produced by Streptomyces[J].Advances in Applied Microbiology, 1977, 22:177-223.
[3] GORMAN M, CHAMBERLIN J W, HAMILL R L.Monensin, a new biologically active compound.V.Compounds related to monensin[J].Antimicrobial Agents and Chemotherapy, 1967, 7:363-368.
[4] MOLLENHAUER H H, MORRÉ D J, ROWE L D.Alteration of intracellular traffic by monensin;mechanism, specificity and relationship to toxicity[J].Biochimica et Biophysica Acta, 1990, 1031(2):225-246.
[5] 周钰. 多醚类抗生素莫能菌素(Monensin)[J].抗生素, 1980,5(5):65-70.ZHOU Y.Polyether antibiotics Monensin[J].Chinese Journal of Antibiotics, 1980,5(5):65-70.
[6] 白超弦, 卓英, 张立新.利用合成生物学技术深入挖掘放线菌中活性次级代谢产物[J].微生物学通报, 2013, 40(10):1885-1895. BAI C X, ZHUO Y, ZHANG L X.Bioprospecting secondary metabolites of actinomycetes through synthetic biology[J].Microbiology China, 2013, 40(10):1885-1895.
[7] 文莹, 宋渊, 李季伦.透明颤菌血红蛋白在肉桂地链霉菌中的表达对其细胞生长及抗生素合成的影响[J].生物工程学报, 2001,117(1):24-28.WEN Y, SONG Y, LI J L, et al.The effects of Vitreoscilla hemoglobin expression on growth and antibiotic production in Streptomyces cinnamonensis[J].Chinese Journal of Biotechnology, 2001,17(1):24-28.
[8] 胡晓龙, 秦海彬, 吴旭萍, 等.5 L发酵罐中棘白菌素B发酵工艺参数优化[J].食品与发酵工业, 2018, 44(9):130-135.HU X L, QIN H B, WU X P, et al.Optimization of the fermentation parameters for Echinocandin B production in 5 L bioreactor[J].Food and Fermentation Industries, 2018, 44(9):130-135.
[9] 周健, 李翔飞, 李闯, 等.游动放线菌产阿卡波糖高通量筛选模型的建立及优化[J].食品与发酵工业, 2023, 49(20):73-80.ZHOU J, LI X F, LI C, et al.Establishment and optimization of high-throughput screening model for acarbose production by Actinoplanes sp.SE50[J].Food and Fermentation Industries, 2023, 49(20):73-80.
[10] 吴梦萍, 王靓, 张建华, 等.pH-DO组合调控策略提高小白链霉菌ε-聚赖氨酸的生物合成[J].食品与发酵工业, 2023, 49(5):9-17.WU M P, WANG L, ZHANG J H, et al.Enhancing the epsilon-poly-L-lysine biosynthesis of Streptomyces albulus by a pH-DO combined regulation strategy[J].Food and Fermentation Industries, 2023, 49(5):9-17.
[11] XIA H Y, ZHAN X Q, MAO X M, et al.The regulatory cascades of antibiotic production in Streptomyces[J].World Journal of Microbiology and Biotechnology, 2020, 36(1):13.
[12] MART N J F, LIRAS P.Engineering of regulatory cascades and networks controlling antibiotic biosynthesis in Streptomyces[J].Current Opinion in Microbiology, 2010, 13(3):263-273.
N J F, LIRAS P.Engineering of regulatory cascades and networks controlling antibiotic biosynthesis in Streptomyces[J].Current Opinion in Microbiology, 2010, 13(3):263-273.
[13] 张洁. 莫能菌素生物合成调控基因的敲除[D].天津:天津大学, 2013.ZHANG J.Deletion of regulatory genes in monensin biosynthetic cluster[D].Tianjin:Tianjin University, 2013.
[14] TANG Z K, LI X M, PANG A P, et al.Characterization of three pathway-specific regulators for high production of monensin in Streptomyces cinnamonensis[J].Applied Microbiology and Biotechnology, 2017, 101(15):6083-6097.
[15] 徐瑶, 吴涛, 郭美锦, 等.氮源对阿维菌素合成的影响及基于二氧化碳释放速率的阿维菌素发酵调控[J].生物工程学报, 2020, 36(2):287-294.XU Y, WU T, GUO M J, et al.Effect of nitrogen on avermectins biosynthesis and its fermentation optimization based on carbon-dioxide evolution rate[J].Chinese Journal of Biotechnology, 2020, 36(2):287-294.
[16] 曾兆国, 刘波, 陈永辉, 等.分光光度法测定莫能菌素含量[J].中国兽药杂志, 2007,41(4):19-21.ZENG Z G, LIU B, CHEN Y H, et al.Determination of monensin in zymotic fluid by spectrophotometry[J].Chinese Journal of Veterinary Drug, 2007,41(4):19-21.
[17] CHOI S U, LEE C K, HWANG Y I, et al.Intergeneric conjugal transfer of plasmid DNA from Escherichia coli to Kitasatospora setae, a bafilomycin B1 producer[J].Archives of Microbiology, 2004, 181(4):294-298.
[18] WANG X K, JIN J L.Crucial factor for increasing the conjugation frequency in Streptomyces netropsis SD-07 and other strains[J].FEMS Microbiology Letters, 2014, 357(1):99-103.
[19] 刘倩倩, 余志拓, 吴远杰, 等.产子囊霉素吸水链霉菌遗传操作系统的优化及调控基因的研究[J].中国医药工业杂志, 2021, 52(12):1603-1608.LIU Q Q, YU Z T, WU Y J, et al.Optimization of genetic operating system of ascomycin-producing Streptomyces hygroscopicus and the study of regulatory genes[J].Chinese Journal of Pharmaceuticals, 2021, 52(12):1603-1608.
[20] SCH FER A, KALINOWSKI J, SIMON R, et al.High-frequency conjugal plasmid transfer from gram-negative Escherichia coli to various gram-positive coryneform bacteria[J].Journal of Bacteriology, 1990, 172(3):1663-1666.
FER A, KALINOWSKI J, SIMON R, et al.High-frequency conjugal plasmid transfer from gram-negative Escherichia coli to various gram-positive coryneform bacteria[J].Journal of Bacteriology, 1990, 172(3):1663-1666.
[21] ZOTCHEV S B, HUTCHINSON C R.Cloning and heterologous expression of the genes encoding nonspecific electron-transport components for a cytochrome-P450 system of Saccharopolyspora erythraea involved in erythromycin production[J].Gene, 1995, 156(1):101-106.
[22] 余志拓. 子囊霉素菌种选育及发酵工艺优化[D].上海:上海医药工业研究院, 2017.YU Z T.Study on production of ascomycin by strain breeding and process optimization[D].Shanghai:Shanghai Institute of Pharmaceutical Industry, 2017.