帕金森病(Parkinson′s disease, PD)是第二大常见的与年龄相关的神经退行性疾病和最常见的运动障碍疾病[1]。PD的发病机制复杂多样,研究表明氧化应激、线粒体功能障碍、神经炎症等是PD重要的发病机制,这几方面可同时存在,互相影响,最终导致黑质多巴胺能神经元的死亡[2]。而目前针对PD的治疗药物主要以缓解患者运动障碍为主,并不能逆转多巴胺能神经元的丢失,同时存在药物依赖性等副作用[3]。因此开发无毒副作用的天然物质对PD进行干预尤为重要。
壳寡糖是具有良好生物相容性和多种生物活性的天然产物,已被作为功能性食品开发研究[4]。研究已经证明壳寡糖在神经保护方面具有良好的效果,对阿尔兹海默症(Alzheimer′s disease, AD)、缺氧缺血性脑损伤以及酒精诱导新生儿脑损伤等多种神经性疾病均表现出缓解效果[5-7]。NIDHEESH等[8]研究表明壳寡糖能显著抑制有机磷杀虫剂诱导的线虫多巴胺能神经退行性变以及相关的生理性改变,并显著缓解线虫氧化应激水平。PRAMOD等[9]的研究表明,壳寡糖可以逆转鱼藤酮诱导的氧化应激损伤和运动损伤,恢复果蝇的多巴胺水平和运动活力。
本实验室前期研究发现,聚合度为2~5的壳寡糖单体均表现出对PD小鼠的神经保护作用,其中壳三糖显示出更优的多巴胺神经元保护活性,在对PD小鼠行为学障碍的缓解效果中与阳性药物美多巴没有表现出统计学差异[10]。但是,关于壳三糖对PD小鼠保护作用的量效关系及作用机制还需要进一步研究。基于实验室前期的研究基础,本研究采用1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine, MPTP)对小鼠腹腔注射诱导PD模型,通过行为学实验以及病理指标以评估不同剂量壳三糖干预的保护效果。同时,通过检测最佳功效剂量下氧化应激相关理化指标,探究壳三糖干预对PD小鼠的保护机制。旨在为壳寡糖干预PD的功能性食品的开发和应用提供理论依据。
1 材料与方法
1.1 材料与试剂
75只7周龄SPF级雄性C57BL/6 J小鼠,斯贝福(北京)生物技术有限公司。实验小鼠自由饮食,饲养环境条件为:湿度为(55±5)%,温度为(24±2) ℃,光照时间从早上8∶00到晚上20∶00。按照SPF小鼠饲养标准,小鼠每5只一笼,每天观察小鼠状态并称量体重,7 d无异常后,再进行后续实验操作。动物实验均接受了江南大学实验管理与动物福利委员会的审核并形成伦理审核编号:JN.No20220615c0750810[236]。
壳三糖,实验室自制(聚合度为3,脱乙酰度100%,纯度>93%)[10];MPTP,上海麦克林生化科技有限公司;丙二醛(malondialdehyde, MDA)、总抗氧化能力(total antioxidant capacity, T-AOC)和还原型谷胱甘肽(glutathione, GSH)试剂盒,南京建成生物工程研究所;RIPA(radio immunoprecipitation assay)裂解液、苯甲磺酰氟(phenylmethyl sulfonyl fluoride, PMSF)、二喹啉甲酸(bicinchoninic acid, BCA)蛋白浓度测定试剂盒、5×上样缓冲液、电泳胶配制液、脱脂乳粉和羊抗兔免疫球蛋白G(H+L),上海碧云天生物技术有限公司;β-actin、酪氨酸羟化酶(tyrosine hydroxylase, TH)、过氧化氢酶(catalase, CAT)、超氧化物歧化酶(superoxide dismutase, SOD)、核因子E2相关因子(NF-E2-related factor 2, Nrf2)、和血红素氧化酶(heme oxygenase, HO-1)抗体,Affinity Biosciences;0.22 μm聚偏氟乙烯(polyvinylidene fluoride, PVDF)膜,美国Merck &Millipore公司;ECL显影液试剂盒,上海天能有限公司。其他相关试剂均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
Tanon-1000型凝胶成像仪,上海天能科技有限公司;4K15冷冻型离心机,德国Sigma公司;DYY-8C型电泳仪,北京市六一仪器厂;UV-1800型紫外-可见分光光度计,日本岛津公司;SCIENTZ-48型高通量组织研磨器,宁波新芝生物科技股份有限公司;FC全自动酶标仪,美国赛默飞世尔科技公司。
1.3 实验方法
1.3.1 壳三糖干预及PD模型建立
a)动物分组:75只小鼠随机分为5组,每组15只,分别为空白组、模型组、壳三糖低剂量组、壳三糖中剂量组和壳三糖高剂量组。
b)壳三糖干预处理:用生理盐水分别配制质量浓度为3.5、7.0、14.0 mg/mL的壳三糖溶液,早上9点分别给壳三糖低剂量组、壳三糖中剂量组和壳三糖高剂量组灌胃,灌胃体积为0.1 mL/10 g,参照壳寡糖作为新食品原料相关规定及陈爽的实验方法,本实验的灌胃剂量分别为35、70、140 mg/kg[11-12],空白组和模型组灌胃等体积的生理盐水。从第8天到第21天连续灌胃14 d。
c)MPTP诱导PD模型:用生理盐水将MPTP配制为3 mg/mL的溶液,对除空白组以外的其他4组小鼠进行腹腔注射,每只小鼠的注射浓度为30 mg/kg体重[13],给药体积为0.1 mL/10 g体重,第17天到第21天下午5点腹腔注射,连续进行5 d。空白组在相应时间点注射等体积的生理盐水。
1.3.2 行为学实验
1.3.2.1 悬挂实验
实验测试前3 d对小鼠进行悬挂训练。将直径0.5 cm的金属丝拉直固定在距离地面30 cm高处,使小鼠双前爪握住金属丝后处于悬空状态。抓住小鼠尾巴使其靠近金属丝,并待其两只前爪抓握住金属丝后松开,观察10 s。双后爪抓握金属丝记为4分,单后爪抓握金属丝记为3分,双前爪抓握金属丝记为2分,单前爪抓握金属丝记为1分,掉落记为0分,每只动物测试3次并取总分。
1.3.2.2 旷场测试
用隔板拼接大小为45 cm×45 cm×45 cm的方盒作为场地,设定场地中心20 cm×20 cm的区域作为中心区域,并在场地上方用摄像机录像。每只小鼠在测试前5 min放入方盒内使其自由活动以适应方盒内环境,测试时记录小鼠在5 min内的运动轨迹并计算小鼠的总运动路程。
1.3.3 组织采集
各组小鼠眼球取血后脱臼处死,在冰台上取出全脑并分离出纹状体组织,分装在无菌冻存管中,-80 ℃保存,用于后续免疫印迹蛋白和氧化还原状态指标的测定。
1.3.4 免疫印迹蛋白检测
取1.3.3节-80 ℃保存的纹状体组织,每10 mg组织加入100 μL的RIPA裂解液(预先按照体积比1∶100加入PMSF),组织匀浆后在冰上裂解30 min,离心后取上清液,使用BCA试剂盒测定总蛋白含量。分离得到的蛋白样品按比例加入上样缓冲液,沸水浴使蛋白变性。各组蛋白样品经SDS-PAGE分离,每孔上样20~40 μg。湿转后用TBST每次5 min,共3次洗涤膜。然后用5%脱脂乳封闭2 h,再用TBST洗涤膜3次。采用一抗稀释液稀释一抗(β-actin以体积比1∶3 000稀释,TH、CAT、SOD、Nrf2和HO-1均以体积比1∶1 000稀释),将膜在4 ℃下与一抗孵育过夜,再用TBST洗涤膜5次。然后与相应的二抗(1∶2 000,体积比)常温孵育2 h,用TBST洗涤膜5次,每次5 min。采用ECL显影液进行显影后拍照,并用ImageJ计算并分析光密度,进行显著性分析。
1.3.5 纹状体氧化还原状态的检测
取1.3.3节-80 ℃保存的纹状体组织,按相应的试剂盒说明书,制备组织匀浆,并测定纹状体中T-AOC、MDA和GSH水平。
1.4 数据统计与图标绘制方法
所有定量分析至少重复3次独立实验,采用GraphPad Prism 8.0作图,实验数据均以平均值±标准差的形式表示。使用SPSS 20.0统计学软件进行one-way方差分析(ANOVA),采用Scheffe检验分析不同组间的显著性差异,P<0.05为差异显著。
2 结果与分析
2.1 壳三糖对帕金森病小鼠行为学表现的影响
PD是以运动症状著称的第二大神经退行性疾病,临床上主要表现为运动迟缓、肌肉僵直、静止性震颤等行为学功能障碍,因此运动症状常作为PD的评价指标[14]。首先通过悬挂实验评估小鼠的神经肌肉力量以及肢体损伤情况[15],结果如图1所示。模型组小鼠的评分相比于空白组小鼠显著降低(P<0.01),但是通过低中高3种剂量壳三糖干预后的PD小鼠评分显著高于模型组小鼠(P<0.01),且与空白组小鼠相比未表现出统计学差异(P>0.05)。其中,中剂量组小鼠的评分显著高于低剂量组和高剂量组小鼠(P<0.05)。结果表明3个剂量组的壳三糖对PD小鼠的肌肉力量均具有一定程度的缓解效果,且中剂量组效果最显著。
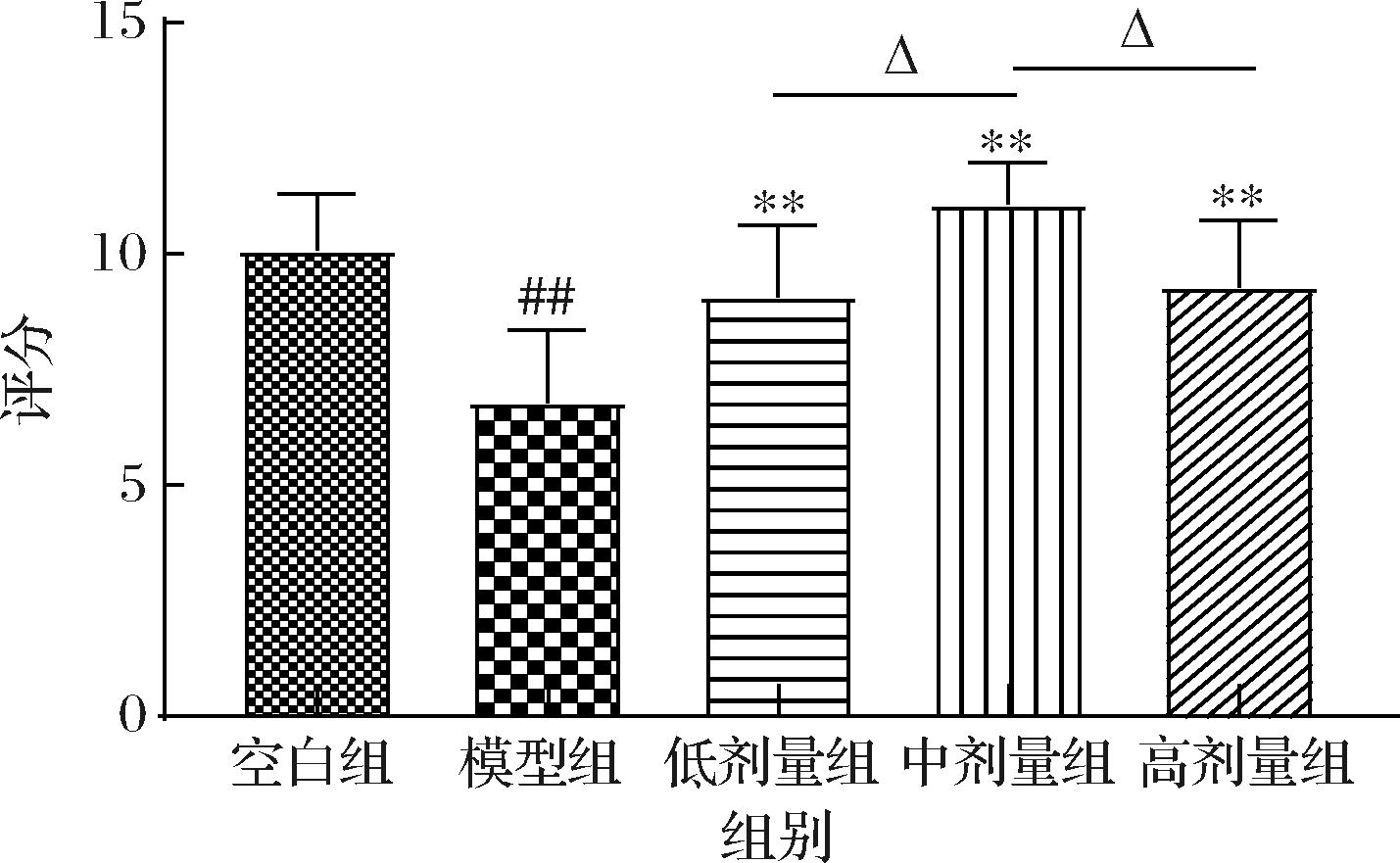
图1 低中高剂量壳三糖对MPTP诱导的帕金森病小鼠悬挂实验的影响
Fig.1 Effects of different doses of chitotriose on traction test in MPTP induced Parkinson′s disease mice
注:#P<0.05,##P<0.01,与空白组比较;*P<0.05,**P<0.01,与模型组比较;ΔP<0.05,ΔΔP<0.01,不同剂量组间比较(下同)。
其次,通过旷场测试分析小鼠的运动轨迹并评价小鼠的运动能力[16],结果如图2所示。实验结果显示,模型组小鼠5 min内自主活动量是最低的,根据轨迹热区图(图2-A)显示,小鼠主要沿着旷场四周活动,中心区域的活动量明显减少,与空白组小鼠相比活动路程降低了44.98%(图2-B,P<0.01)。而低中高3个剂量壳三糖组小鼠,自主运动的路程与模型组小鼠比较显著性增加(图2-B,P<0.01),且小鼠在中心区域的活动量明显比模型组小鼠增加(图2-A)。此外,统计学结果显示,中剂量组小鼠的活动路程显著高于低剂量组和高剂量组小鼠(图2-B,P<0.01)。这与悬挂实验结果一致,表明低中高3个剂量的壳三糖均能改善MPTP诱导的PD小鼠的运动障碍,且壳三糖中剂量组的缓解效果显著优于低剂量组和高剂量组。WANG等[10]研究发现65 mg/kg灌胃剂量的壳寡糖能够改善PD小鼠运动障碍,与本实验结果相一致。在对壳寡糖及作用效果的量效关系研究方面,韩敏敏[17]在探究全乙酰化壳寡糖对AD模型的保护研究中发现,经25、50、100 mg/kg全乙酰化壳寡糖处理后,50 mg/kg灌胃剂量在改善AD模型大鼠的学习记忆功能和抗氧化应激方面效果最好。在结肠炎模型中,陈爽[12]得出了壳寡糖剂量与其对结肠炎的缓解作用成钟形关系。这与本实验所得到的中剂量组壳三糖缓解效果最好的结论相一致。这可能与壳寡糖能刺激多种不同的信号通路并通过多种途径发挥作用,从而产生了功能拮抗有一定的关系,使得壳寡糖的剂量与最终的作用效果呈钟形关系。
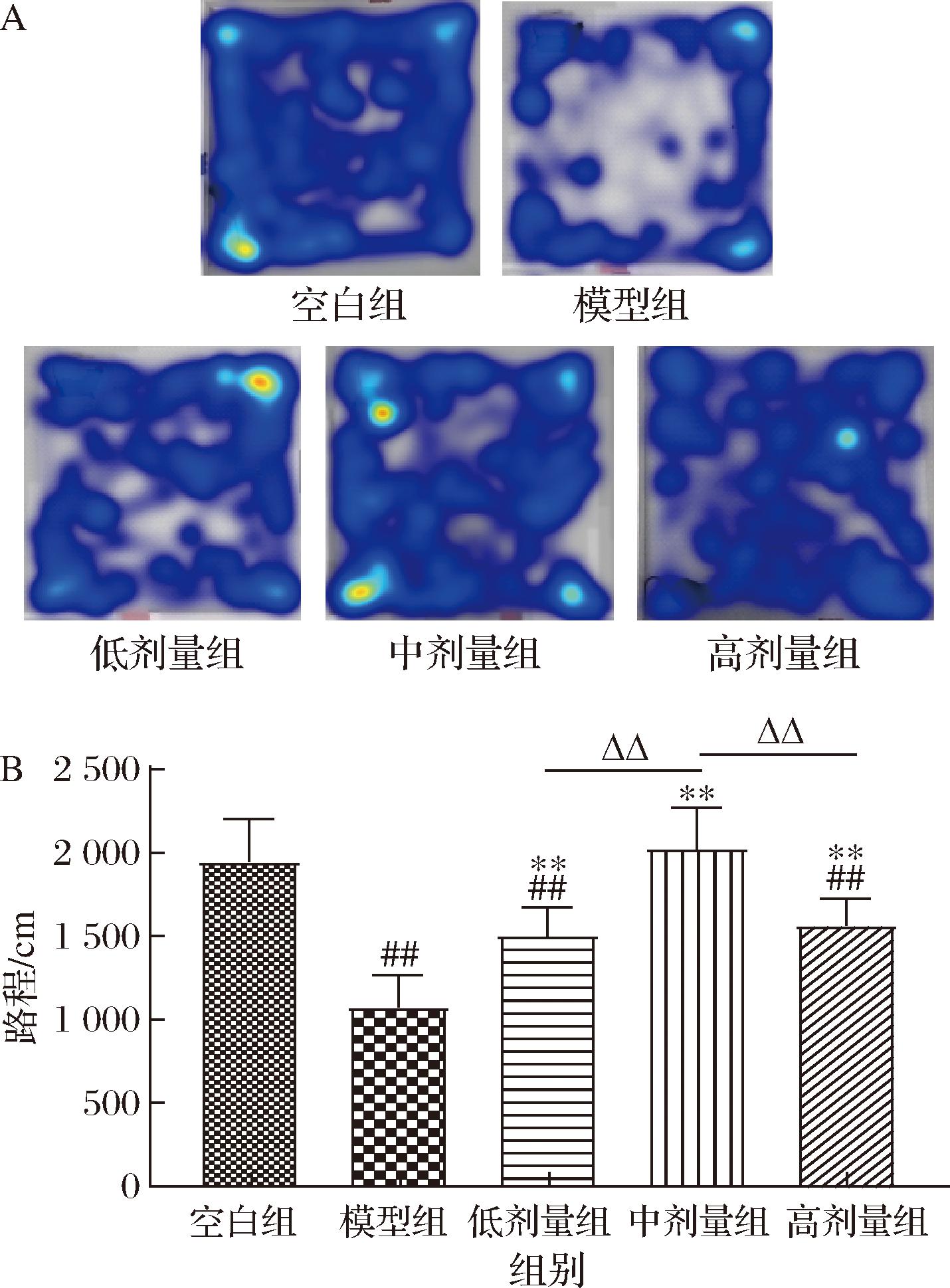
A-轨迹热区图;B-路程
图2 低中高剂量壳三糖对MPTP诱导的帕金森病小鼠旷场测试的影响
Fig.2 Effects of different dose of chitotriose on open-field test in MPTP induced Parkinson′s disease mice in the striatum
2.2 壳三糖对帕金森病小鼠纹状体TH表达水平的影响
PD主要的病理特征是黑质中的多巴胺能神经元发生大量变性丢失导致多巴胺神经递质缺失[18]。TH是多巴胺合成的限速酶,是多巴胺能神经元的特征性标记酶,其功能的缺少或表达不足直接影响多巴胺的合成与分泌,可以通过检测TH的表达反映多巴胺能神经元的损伤情况[19]。对各组小鼠纹状体中TH的蛋白表达水平进行检测,结果如图3所示。与空白组小鼠相比,模型组小鼠的TH表达量减少了55.68%(P<0.01);而经过不同剂量壳三糖干预处理后,3个剂量组小鼠与模型组小鼠相比TH表达量均显著增加(P<0.05);其中,中剂量组小鼠的表达量显著高于低剂量组和高剂量组小鼠(P<0.05)。这与前面行为学实验的结果一致,也侧面印证了PD的运动障碍与多巴胺的合成以及TH的表达量密切相关。有研究发现,通过口服小檗碱提高了TH的活性,从而加速了产左旋多巴的速度,并实现了对PD症状的缓解[20]。
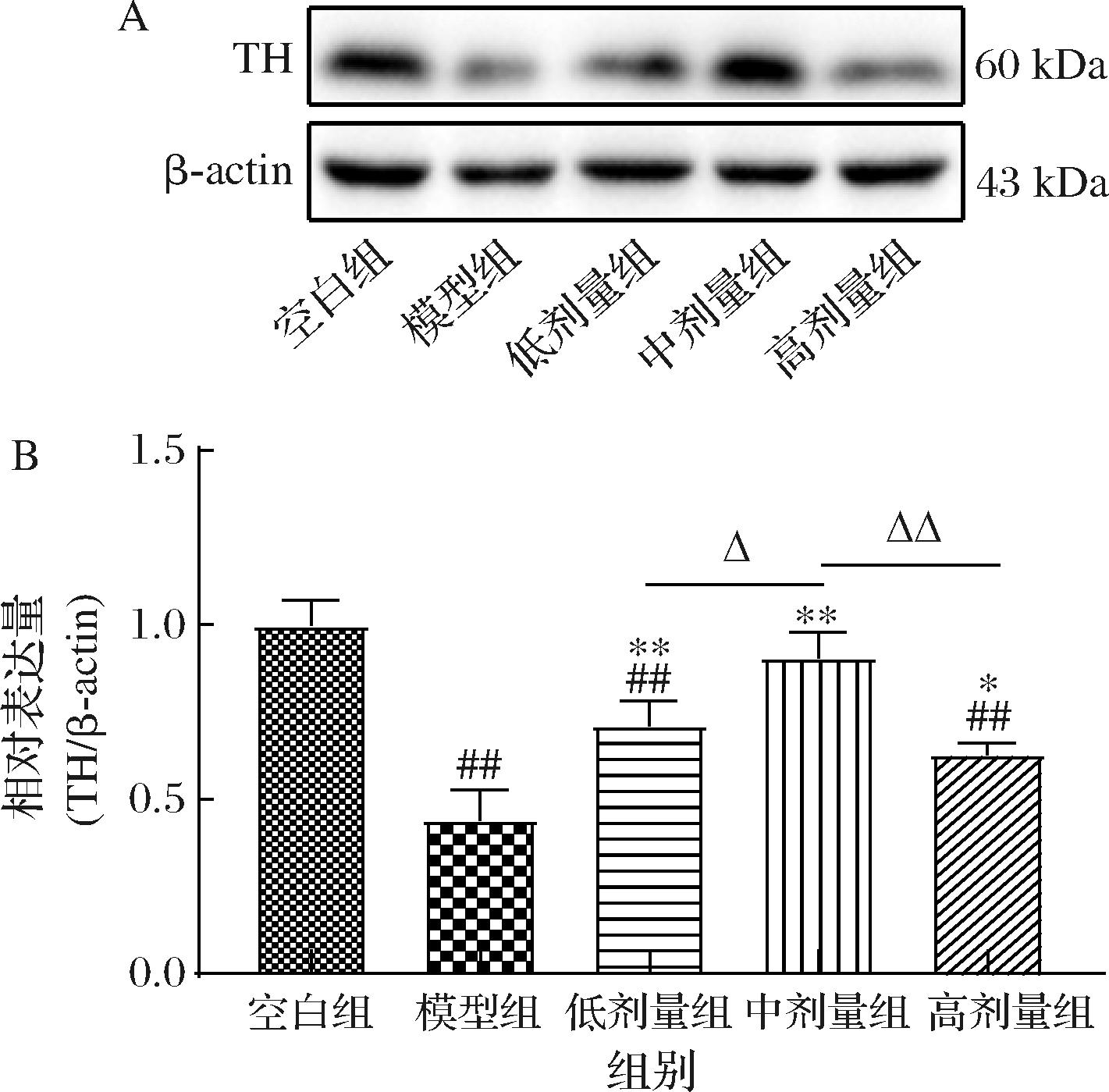
A-纹状体TH和β-actin免疫印迹蛋白条带;B-纹状体TH的相对表达量
图3 低中高剂量壳三糖对MPTP诱导的帕金森病小鼠纹状体TH表达的影响
Fig.3 Effects of different doses of chitotriose on the expression of TH in MPTP induced Parkinson′s disease mice in the striatum
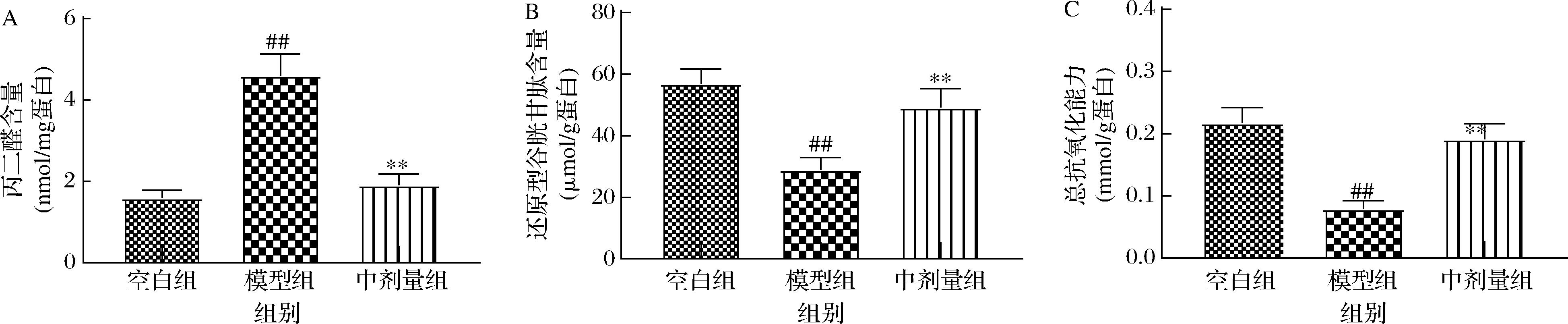
A-丙二醛;B-还原谷胱甘肽;C-总抗氧化能力
图4 壳三糖对MPTP诱导的帕金森病小鼠纹状体氧化应激的影响
Fig.4 Effects of chitotriose on oxidative stress in MPTP induced Parkinson′s disease mice in the striatum
2.3 壳三糖对帕金森病小鼠纹状体氧化应激的影响
行为学实验可以反映小鼠的运动功能是否受损,纹状体TH表达水平可以反映多巴胺能神经元的损伤情况[19],根据行为学实验及TH表达量的结果,均表明中剂量壳三糖的作用效果是最佳的,在后面的实验中以中剂量组小鼠进一步探究壳三糖对PD小鼠的作用机制。氧化应激会造成多巴胺神经元的变性及功能的丧失,因此对PD的发生和发展起着重要作用[21]。细胞内活性氧(reactive oxygen species, ROS)是体内自由基的主要形式,过量的ROS积累会氧化氨基酸上的氨基转化为羟基,从而对蛋白质造成破坏,并导致功能蛋白的失活;此外过量的ROS会导致脂质过氧化并产生MDA,最终导致神经退行性变化[13]。健康的细胞有自己的抗氧化防御系统,可以通SOD、CAT、GSH途径等消除过量的ROS[13]。本研究检测了纹状体中MDA和GSH的含量以及T-AOC水平,结果如图4所示。与空白组小鼠比较,模型组小鼠纹状体中MDA含量显著增加(P<0.01),GSH含量和T-AOC水平均显著降低(P<0.01)。与模型组小鼠相比,中剂量壳三糖组小鼠MDA含量显著减少(P<0.01),GSH含量和T-AOC水平均显著升高(P<0.01)。结果表明,壳三糖可能通过增加PD小鼠纹状体中T-AOC和GSH水平,同时减少脂质过氧化产生MDA来缓解氧化应激。
进一步地,对纹状体中CAT和SOD酶表达量进行检测,实验结果如图5所示。与空白组小鼠相比,模型组小鼠纹状体中CAT和SOD蛋白表达均有所降低(P<0.01)。与模型组小鼠相比,中剂量壳三糖组小鼠纹状体内CAT和SOD表达均显著升高(CAT,P<0.01;SOD,P<0.05),说明壳三糖可能通过上调抗氧化酶CAT和SOD的表达量,减弱MPTP引起的小鼠纹状体组织中的氧化应激。
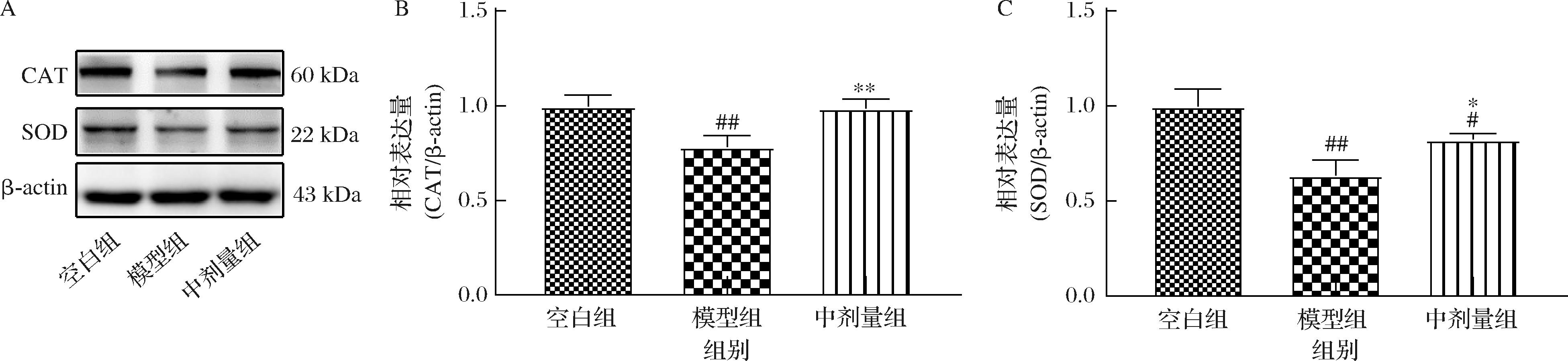
A-纹状体CAT、SOD和β-actin免疫印迹蛋白条带;B-纹状体CAT的相对表达量;C-纹状体SOD的相对表达量
图5 壳三糖对MPTP诱导的帕金森病小鼠纹状体CAT和SOD表达量的影响
Fig.5 Effects of chitotriose on the expression of CAT and SOD in MPTP induced Parkinson′s disease mice in the striatum
壳寡糖具有抗氧化活性已被多次证实,一方面壳寡糖含有羟基、氨基等活性基团,自身具有较强的抗氧化活性,通过将自由基转化为稳定的产物并终止自由基链式反应等方式发挥抗氧化活性[22],ZHANG等[23]发现在无细胞体系下,壳寡糖可以直接清除过氧化氢;另一方面,研究表明壳寡糖可能通过保护或者激活体内抗氧化酶进而增强机体对自由基的清除作用[22]。王斌等[24]在酒精诱导大鼠脑损伤模型中,发现壳寡糖可以缓解酒精造成的脑部氧化应激损伤,提高脑组织中的抗氧化物酶活力。本研究关于壳三糖对氧化应激的保护作用结论与前人研究一致。
2.4 壳三糖对帕金森病小鼠纹状体Nrf2/HO-1信号通路的影响
Nrf2作为对氧化还原敏感性很强的转录因子,可以调控细胞内Ⅱ相解毒酶和抗氧化酶的表达,改善细胞的氧化应激状态,并维持氧化还原稳态。Nrf2被激活后,会进一步调控下游一系列抗氧化因子的表达,HO-1是Nrf2下游众多靶蛋白中研究较多的抗氧化蛋白[25]。在百草枯帕金森模型中,锂可通过激活Nrf2和增加其靶基因HO-1等的表达发挥抗氧化及神经保护作用[26]。因此,本实验通过免疫印迹蛋白检测小鼠纹状体中相关蛋白,探究壳三糖抑制MPTP诱导的PD小鼠氧化应激是否与激活Nrf2通路有关。如图6-A和图6-B所示,模型组小鼠纹状体中Nrf2蛋白表达量相比空白组小鼠显著降低(P<0.01),而中剂量壳三糖组小鼠Nrf2表达量相比模型组小鼠显著增加(P<0.01),表明壳三糖可以上调Nrf2表达量,其可能通过激活该信号通路来缓解MPTP诱导的PD小鼠纹状体中的氧化应激。进一步检测了Nrf2下游的抗氧化蛋白HO-1的表达情况。如图6-A和图6-C所示,模型组小鼠与空白组相比,HO-1蛋白的表达显著降低(P<0.01)。中剂量壳三糖组与模型组相比HO-1表达量显著增加(P<0.01)。结果表明壳三糖可促使抗氧化蛋白HO-1表达增加。

A-纹状体Nrf2、HO-1和β-actin免疫印迹蛋白条带;B-纹状体Nrf2的相对表达量;C-纹状体HO-1的相对表达量
图6 壳三糖对MPTP诱导的帕金森病小鼠纹状体Nrf2和HO-1表达的影响
Fig.6 Effects of chitotriose on the expression of Nrf2 and HO-1 in MPTP induced Parkinson′s disease mice striatum
以前的研究发现,壳寡糖能提高SK-N-SH细胞中HO-1的表达,进而缓解过氧化氢诱导的细胞氧化损伤[27]。一种Nrf2激活剂在MPTP诱导帕金森病模型中表现出抗氧化性能及神经保护作用[28]。TAO等[29]的研究中也指出壳寡糖可以通过上调Nrf2及其下游靶基因HO-1和NQO1来减轻肝组织中的氧化应激。本实验发现壳三糖干预后,Nrf2和HO-1蛋白表达量均显著增加(P<0.01),表明壳三糖可能通过增强Nrf2/HO-1信号通路,从而降低纹状体中的氧化应激水平。
3 结论
本研究结果显示低中高3个剂量组的壳三糖均可以显著缓解MPTP诱导的PD小鼠的行为学障碍和纹状体中TH蛋白表达量的降低,且中剂量组壳三糖表现出更显著的保护效果。进一步地,壳三糖可能通过调控Nrf2/HO-1信号通路和抗氧化酶的表达,缓解PD小鼠纹状体中的氧化应激水平,从而保护多巴胺能神经元,干预PD的发生和发展。本实验结果为壳寡糖干预PD的功能性食品的开发和应用提供理论依据。
[1] KIP E, PARR BROWNLIE L C.Reducing neuroinflammation via therapeutic compounds and lifestyle to prevent or delay progression of Parkinson′s disease[J].Ageing Research Reviews, 2022, 78:101618.
[2] BLOEM B R, OKUN M S, KLEIN C.Parkinson′s disease[J].Lancet, 2021, 397(10291):2284-2303.
[3] 刘永芳, 马开利.帕金森病不同疾病阶段的药物治疗进展[J].医药导报, 2021, 40(6):758-764.LIU Y F, MA K L.Advances in drug therapy in different stages of Parkinson′s disease[J].Herald of Medicine, 2021, 40(6):758-764.
[4] 杨子微. 壳寡糖通过改善氧化应激损伤在保护卵巢功能中的作用及机制研究[D].南昌:南昌大学, 2022.YANG Z W.The role and mechanism of chitosan oligosacchrides in restoring ovarian dysfunction caused by oxidative stress[D].Nanchang:Nanchang University, 2022.
[5] 朱立猛. 壳寡糖对阿尔茨海默病的作用效果评价及其机制初探[D].北京:中国科学院大学, 2021.ZHU L M.Neuroprotective effects of chitosan oligosaccharides on Alzheimer′s disease and its related mechanisms[D].Beijing:University of Chinese Academy of Sciences, 2021.
[6] WU W, WEI W, LU M, et al.Neuroprotective effect of chitosan oligosaccharide on hypoxic-ischemic brain damage in neonatal rats[J].Neurochemical Research, 2017, 42(11):3186-3198.
[7] 陈逸伦. 壳寡糖对新生大鼠酒精性神经损伤的缓解作用研究[D].无锡:江南大学, 2021.CHEN Y L.Effect of chitooligosaccharide on ethanol-induced nerve injury in neonatal rats[D].Wuxi:Jiangnan University, 2021.
[8] NIDHEESH T, SALIM C, RAJINI P S, et al.Antioxidant and neuroprotective potential of chitooligomers in Caenorhabditis elegans exposed to Monocrotophos[J].Carbohydrate Polymers, 2016, 135:138-144.
[9] PRAMOD KUMAR P, HARISH PRASHANTH K V. Diet with low molecular weight chitosan exerts neuromodulation in rotenone induced drosophila model of Parkinson′s disease[J]. Food and Chemical Toxicology: An International Journal Published for the British Industrial Biological Research Association, 2020, 146:111860.[10] WANG B, WANG L, QU Y F, et al.Chitosan oligosaccharides exert neuroprotective effects via modulating the PI3K/Akt/Bcl-2 pathway in a Parkinsonian model[J].Food &Function, 2022, 13(10):5838-5853.
[11] 国家卫生计生委. 关于批准壳寡糖等6种新食品原料的公告(2014年第6号)[J].中国食品添加剂, 2014(4):177-179.National Health and Family Planning Commission.Announcement on the approval of six new food ingredients, including chitosan (No.6 of 2014)[J].China Food Additives, 2014(4):177-179.
[12] 陈爽. 壳寡糖对DSS诱导小鼠结肠炎的缓解作用研究[D].无锡:江南大学, 2020.CHEN S.Ameliorating effects of chitooligosaccharides on DSS-induced colitis in mice[D].Wuxi:Jiangnan University, 2020.
[13] 汪玲. 单一聚合度壳寡糖的分离及其对帕金森模型小鼠的神经保护作用研究[D].无锡:江南大学, 2022.WANG L.Separation of chitosan oligosaccharide monomers with single degree of polymerization and the study of their neuroprotection in parkinsonian mice model[D].Wuxi:Jiangnan University, 2022.
[14] SHULMAN J M, DE JAGER P L, FEANY M B.Parkinson′s disease:Genetics and pathogenesis[J].Annual Review of Pathology:Mechanisms of Disease, 2011, 6:193-222.
[15] SELVAKUMAR G P, AHMED M E, THANGAVEL R, et al.A role for glia maturation factor dependent activation of mast cells and microglia in MPTP induced dopamine loss and behavioural deficits in mice[J].Brain, Behavior, and Immunity, 2020, 87:429-443.
[16] LIU Y J, GENG L H, ZHANG J J, et al.Oligo-porphyran ameliorates neurobehavioral deficits in Parkinsonian mice by regulating the PI3K/Akt/Bcl-2 pathway[J].Marine Drugs, 2018, 16(3):82.
[17] 韩敏敏. 全乙酰化壳寡糖对Aβ诱导AD模型大鼠的保护作用及机制研究[D].青岛:青岛大学, 2019.HAN M M.The protective effects and mechanisms of peracetylated chitosan oligosaccharides against AB-amyloid-induced AD model rats[D].Qingdao:Qingdao University, 2019.
[18] 张秀芳. GDF15在脂多糖诱导的炎症和鱼藤酮诱导的帕金森病模型中的功能研究[D].济南:山东大学, 2022.ZHANG X F.Functional study of GDF15 in LPS-induced inflammation model and rotenone-induced Parkinson′s disease model[D].Jinan:Shandong University, 2022.
[19] KOZINA E A, KHAKIMOVA G R, KHAINDRAVA V G, et al.Tyrosine hydroxylase expression and activity in nigrostriatal dopaminergic neurons of MPTP-treated mice at the presymptomatic and symptomatic stages of parkinsonism[J].Journal of the Neurological Sciences, 2014, 340(1-2):198-207.
[20] WANG Y, TONG Q, MA S R, et al.Oral berberine improves brain dopa/dopamine levels to ameliorate Parkinson′s disease by regulating gut microbiota[J].Signal Transduction and Targeted Therapy, 2021, 6(1):77.
[21] 赵焱. 光甘草定在MPTP帕金森病小鼠的神经保护作用及机制研究[D].武汉:武汉大学, 2017.ZHAO Y.Neuroprotective effects of glabridin on MPTP-induced Parkinson′s disease and its mechanism[D].Wuhan:Wuhan University, 2017.
[22] SUN T, ZHOU D X, XIE J L, et al.Preparation of chitosan oligomers and their antioxidant activity[J].European Food Research and Technology, 2007, 225(3-4):451-456.
[23] ZHANG X X, LIANG S, GAO X H, et al.Protective effect of chitosan oligosaccharide against hydrogen peroxide-mediated oxidative damage and cell apoptosis via activating Nrf2/ARE signaling pathway[J].Neurotoxicity Research, 2021, 39(6):1708-1720.
[24] 王斌, 陈逸伦, 夏文水.壳寡糖对酒精诱导的新生大鼠脑组织氧化应激损伤和凋亡因子的影响[J].食品科学, 2022, 43(7):105-111.WANG B, CHEN Y L, XIA W S.Effect of chitooligosaccharide on ethanol-induced oxidative stress injury and apoptotic factors in neonatal rat brain[J].Food Science, 2022, 43(7):105-111.
[25] 刘新粮. 芹菜素介导AMPK/Nrf2/HO-1信号通路在心肌缺血/再灌注损伤中的保护作用及机制研究[D].南昌:南昌大学, 2022.LIU X L.The protective effect and mechanism of apigenin in myocardial ischemia-eperfusion injury by regulating AMPK/Nrf2/HO-1 signaling pathway[D].Nanchang:Nanchang University, 2022.
[26] ALURAL B, OZERDEM A, ALLMER J, et al.Lithium protects against paraquat neurotoxicity by NRF2 activation and miR-34a inhibition in SH-SY5Y cells[J].Frontiers in Cellular Neuroscience, 2015, 9:209.
[27] 张晓霞, 李筱筱, 孙雅煊, 等.壳寡糖减轻过氧化氢诱导的SK-N-SH细胞氧化损伤机制研究[J].食品与发酵工业, 2021, 47(14):57-62.ZHANG X X, LI X X, SUN X X, et al.Mechanism of chitosan oligosaccharides attenuated oxidative damage induced by H2O2 in SK-N-SH cells[J].Food and Fermentation Industries, 2021, 47(14):57-62.
[28] AHUJA M, KAIDERY N A, YANG L C, et al.Distinct Nrf2 signaling mechanisms of fumaric acid esters and their role in neuroprotection against 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine-induced experimental Parkinson′s-like disease[J].Journal of Neuroscience, 2016, 36(23):6332-6351.
[29] TAO W J, SUN W J, LIU L J, et al.Chitosan oligosaccharide attenuates nonalcoholic fatty liver disease induced by high fat diet through reducing lipid accumulation, inflammation and oxidative stress in C57BL/6 mice[J].Marine Drugs, 2019, 17(11):645.