2021年我国南美白对虾产量高达127.36万t,其加工产品主要是虾仁、虾糜等制品,由此产生的虾头、虾壳、虾尾等废弃物约占整虾质量的40%左右[1]。大量虾壳堆积,不仅会产生难闻气味,给环境带来严重污染,而且会造成资源的严重浪费。在虾壳中,甲壳素(几丁质)含量为20%~30%,蛋白质为30%~40%,灰分为20%~30%[2]。目前虾壳处理主要有填埋法、焚烧法和化学处理法。填埋和焚烧不仅污染环境,还会造成资源浪费;化学法主要用于甲壳素提取[3],不仅会产生大量难以处理的酸碱废水,而且会破坏产物结构,且虾壳中大量的蛋白质资源也无法利用,造成浪费[4]。而采用微生物对虾壳进行脱蛋白,不仅条件温和无污染,还能使蛋白质资源得到利用[5],已逐步取代化学法,成为目前研究热点之一。
目前报道可用于虾壳脱蛋白的微生物包括芽孢杆菌属、假单胞菌属和弧菌属等。FLORES-ALBINO等[6]利用乳杆菌属Lactobacillus sp. B2发酵虾蟹壳来获取几丁质,其脱蛋白率(deproteinization,DP)为56%。JUNG等[7]利用副干酪乳杆菌Lactobacillus paracasei KCTC-3074和褪色沙雷氏菌(Serratia marcescens)FS-3进行双菌联合对虾壳进行脱蛋白研究,最终DP达到68.9%。ZHANG等[8]利用具有高度相容性的枯草芽孢杆菌(Bacillus subtilis)和巴氏酣杆菌(Acetobacter pasteurianus)进行两步发酵,先用B.subtilis发酵3 d后再添加A.pasteurianus继续发酵2 d,发酵液中蛋白酶活为96.9 U/mL。以上研究表明,虽然利用微生物对虾壳脱蛋白研究取得较大进展,但仍存在菌株酶活性低、DP低、加工周期长、降解产物成分不清等系列问题,急需选择优良菌株、优化相关工艺及对降解产物成分进行分析。
本研究在前期筛选得到的产蛋白酶菌株的基础上,先筛选出废弃虾壳脱蛋白效果较好的菌株,再采用单因素、Plackett-Burman和正交试验优化菌株脱蛋白工艺,进一步对菌株所产粗酶液性质及降解产物的成分进行分析,为虾壳脱蛋白应用提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 实验菌株
实验室前期筛选4株有较高的角蛋白酶活性的粘金黄杆菌Chryseobacterium gleum Gxun-5、铜绿假单胞菌Pseudomonas aeruginosa Gxun-7[9]、拟蕈状芽孢杆菌Bacillus paramycoides Gxun-30[10]、弯曲假单胞菌Pseudomonas geniculata Gxun-35及1株大肠杆菌Escherichia coli。
1.1.2 供试材料
供试南美白对虾壳经烘干粉碎后,分别过35目筛与65目筛,取35~65目筛间的虾壳粉。
1.1.3 培养基
酪蛋白培养基(g/L):干酪素 40.0,K2HPO4 1.4,KH2PO4 0.7,NaCl 0.5,MgSO4 0.1,琼脂粉 20.0,pH 7.0;
基础发酵培养基(g/L):虾壳粉 10.0,K2HPO4 1.4,KH2PO4 0.7,NaCl 0.5,MgSO4 0.1,pH 7.0。
1.2 仪器与设备
HNYC-1102智能恒温培养振荡器,天津欧诺仪器股份有限公司;HPS-250恒温培养箱,哈尔滨市东明医疗仪器厂;Multiskan Go酶标仪,赛默飞世尔科技有限公司;L-8900氨基酸自动分析仪,日立高新技术公司;KDN-D1自动定氮仪,上海新嘉电子有限公司。
1.3 实验方法
1.3.1 虾壳脱蛋白菌株的筛选
先将前期研究中所获得的不同产蛋白酶菌株点种在酪蛋白板上进行培养,同时进行虾壳脱蛋白实验,根据透明圈大小及蛋白酶活性筛选出虾壳脱蛋白较好的菌株。
1.3.2 蛋白酶活性的测定
参照国标SB/T 10317—1999《蛋白酶活力测定法》测定蛋白酶活性。酶活定义:在 50 ℃下1 mL酶液1 min催化酪蛋白产生1 μg酪氨酸所需要的酶量为1个蛋白酶活性单位。
1.3.3 单因素试验优化产酶条件
在基础培养基的基础上,研究不同因素对菌株蛋白酶活的影响。a)虾壳粉(g/L):10.0、20.0、30.0、40.0、50.0;b)碳源:10 g/L的蔗糖、麦芽糖、果糖、葡萄糖,确定最适碳源后再进行浓度优化;c)氮源:10 g/L的硫酸铵、尿素、酵母粉、玉米浆、蛋白胨,确定氮源后再进行浓度优化;d)初始pH值:分别调整发酵的初始pH值为6.5、7.0、7.5、8.0、8.5、9.0;e)金属离子:分别添加质量浓度为0.10 g/L的Mn2+、Mg2+、Cu2+、Fe2+、Zn2+、Al3+、Ca2+,确定金属离子后再进行浓度优化。f)接种量(%,体积分数):0.5、1、2、3、4、5;g)发酵时间(h):12、24、36、48、60、72、84、96。初始培养条件为:温度35 ℃,转速200 r/min,接种量1%,装液量30/150 mL,发酵48 h。每组设3个平行,结果取平均值(下同)。
1.3.4 PB(Plackett-Burman)及正交优化试验
单因素试验基础上,用PB试验筛选出酶活性的关键影响因素,再用正交试验确定最佳产蛋白酶条件。
1.3.5 Gxun-7粗酶液酶学性质
粗酶液的获得:将菌株发酵液在4 ℃,12 000 r/min条件下离心15 min,取上清液即为粗酶液。酶反应体系及酶活测定方法同1.2.2节。酶学性质测定如下:
a)最适反应温度及温度稳定性:30、40、50、60、70、80 ℃反应10 min,测定酶活性;温度稳定性:将粗酶溶液分别置于上述温度保温1 h后,测定剩余酶活性,以最高酶活性为100%,计算不同温度下的相对酶活性(以下同);b)最适pH及pH稳定性:粗酶溶液分别置于pH值为 5.0、5.5、6.0、6.5、7.0的PBS缓冲液及pH值为7.0、7.5、8.0、8.5、9.0的Tris-HCl缓冲液中与酪蛋白底物反应10 min;pH稳定性:在4 ℃条件将粗酶液分别放置上述pH缓冲液1 h后测定相对酶活性;c)金属离子:酶反应体系中添加终浓度为0.05 mol/L Ca2+、Mg2+、Mn2+、K+、Fe2+、Cu2+、Al3+,测定剩余酶活;d)化学试剂影响:添加终浓度为0.5 mol/L的十六烷基三甲基溴化铵(hexadecyl trimethyl ammonium bromide,CTAB),乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA),十二烷基磺酸钠(sodium dodecyl sulfate,SDS),聚乙二醇辛基苯基醚(Triton X-100),苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF),异丙醇,β-巯基乙醇和洗洁精(30%的烷基磺酸钠,60%脂肪醇醚硫酸钠等);e)NaCl浓度:分别加入终质量浓度为 0、25、50、75、100 g/L的NaCl溶液,4 ℃保存1 h测定酶活性;f)底物特异性:分别以20 g/L的酪蛋白、虾壳粉、羽毛粉、角蛋白、明胶和牛血清白蛋白为底物,测定相对酶活性。
1.3.6 虾壳脱蛋白率及发酵液成分分析
通过氨基酸全自动分析仪对Gxun-7发酵液进行氨基酸成分及含量测定;参照GB 5009.5—2016《食品中蛋白质的测定》中凯氏定氮法测定Gxun-7在最优产酶条件下发酵虾壳前后的蛋白质含量,计算脱蛋白率,如公式(1)、公式(2)所示:
蛋白含量/%=
(1)
蛋白脱出率/%=
(2)
式中:0.05,盐酸标准滴定溶液浓度,mol/L;0.014,1.0 mL盐酸标准滴定溶液相当于氮的质量,g;6.25,氮转换为蛋白质的系数;30.04,所用虾壳样品中蛋白质平均百分比含量。
2 结果与分析
2.1 虾壳高效脱蛋白菌株的筛选
将具产蛋白酶的4株菌及大肠杆菌(阴性对照)点种在酪蛋白板上培养48 h,结果发现,与其他3株菌相比,P.aeruginosa Gxun-7具有更大的透明水解圈(图1-A),说明Gxun-7具有较好的蛋白质水解能力;进一步以虾壳粉为基质对菌株的蛋白酶活性测定(图1-B),Gxun-7酶活性达(423.81±8.74) U/mL,显著高于其他4株菌。综合酪蛋白透明圈及酶活性结果,选定Gxun-7为虾壳脱蛋白菌株。前期结果表明,该菌为革兰氏阴性菌,在酪蛋白平板上菌落呈淡黄绿色,菌落凸起,表面光滑,可渗入培养基生长[9]。
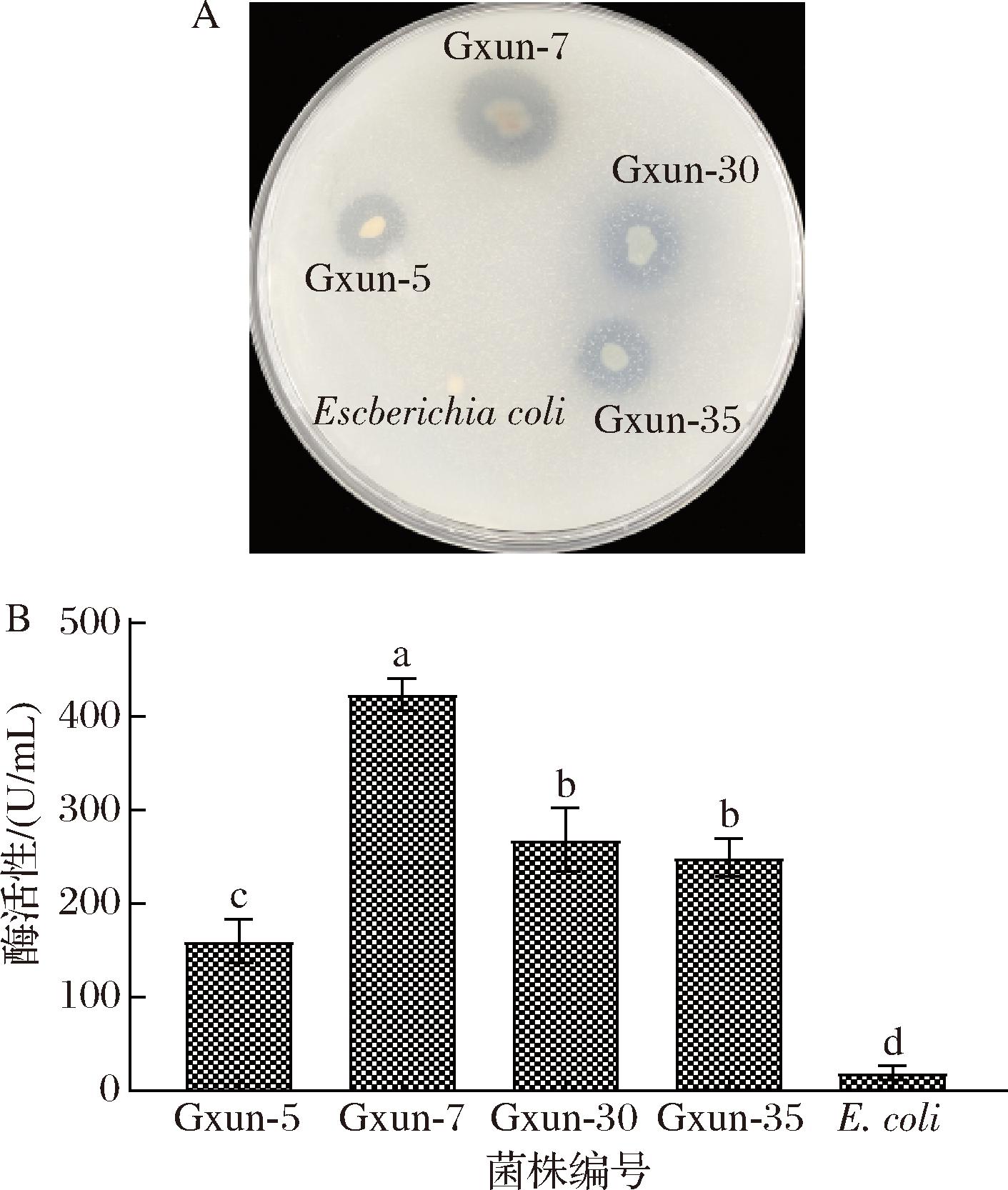
A-酪蛋白板透明圈;B-蛋白酶活性
图1 不同菌株酪蛋白板透明圈及蛋白酶活性结果
Fig.1 Results of casein plate transparent circle and protease enzyme activity of different strains
注:图中小写字母代表差异显著性(P<0.05)(下同)。
2.2 P.aeruginosa Guxn-7发酵虾壳产酶条件的单因素优化
单因素优化结果如图2所示,初始pH 6.5~9.0时,对酶活性影响不显著(P>0.05,图2-A),发酵液pH值均稳定在9.5左右,可能与虾壳中含有大量CaCO3,可作为发酵的pH缓冲剂有关;除Cu2+对菌株产酶有显著抑制(P<0.01)作用外,其他金属离子对菌株产酶影响较小(图2-B);外加碳源会对菌株产酶有一定的抑制,可能是外加碳源满足了菌株生长需求,反而会抑制底物对酶的诱导作用,所以虾壳脱蛋白过程中无需额外添加碳源[11](图2-C);玉米浆和蛋白胨为氮源时,酶活性较高,但考虑发酵成本,选择更为廉价玉米浆为最适氮源,进一步添加量优化结果为5 g/L(图2-D、图2-E);当虾壳质量浓度低于30 g/L时,酶活性随底物浓度增加而升高,但底物超过30 g/L时,酶活性趋于稳定(图2-F),因此,最适虾壳质量浓度为30 g/L,此时酶活性为(612.75±5.45) U/mL;接种量在1%~4%(体积分数),对酶活性影响较小,考虑发酵成本,选择1%(体积分数)为最适接种量(图2-G);发酵时间对酶活性的影响较大,小于 36 h时,酶活性随发酵时间延长而增加,但在36~72 h时,酶活性变化不大,但当大于72 h时,酶活随发酵时间延长反而降低(图2-H),可能是由于蛋白酶随时间增加稳定性逐渐降低。因此,最佳发酵时间为36 h。

A-初始pH; B-金属离子;C-碳源; D-氮源; E-玉米浆浓度; F-虾壳粉浓度; G-接种量; H-发酵时间
图2 P.aeruginosa Gxun-7降解虾壳粉的单因素优化结果
Fig.2 Single-factor optimization results of degradation of shrimp shell powder by Pseudomonas aeruginosa Gxun-7
2.3 Packett-Burman试验分析
PB试验设计及结果见表1,利用Design-Expert 10软件方差分析结果见表2。通过比较各因素P值,将各影响因子的显著性进行排序,结果为:B>G>H>D>F>E>A>E,其中B(底物浓度)和G(发酵温度)对酶活性具有显著影响(P<0.05),H(发酵时间)对酶活具有较显著影响,需要进行正交优化试验。
表1 PB试验结果
Table 1 PB test results

编号A(玉米浆)/(g/L)B(虾壳粉)/(g/L)C(ZnSO4)/(g/L)D(接种量)/%E(MgSO4)/(g/L)F(pH值)G(温度)/℃H(时间)/h酶活性/(U/mL)11(5)-1(20)1(0.1) 1(2)1(0.05)1(7.5)1(35) -1(48)503.78±42.4421(5)-1(20)-1(0.05)-1(1)1(0.1)-1(7) 1(35) 1(72)484.83±7.393-1(2.5)-1(20)-1(0.05)-1(1)-1(0.05)-1(7) -1(32) -1(48)494.91±4.1841(5) 1(30)-1(0.05)-1(1)-1(0.05)1(7.5)1(35) -1(48)524.24±0.715-1(2.5) 1(30)1(0.1)-1(1) 1(0.1)1(7.5)-1(32) -1(48)534.47±3.5461(5)-1(20)1(0.1) 1(2)1(0.1)-1(7) -1(32) -1(48)511.51±5.7971(5) 1(30)-1(0.05) 1(2)1(0.1)1(7.5)-1(32) 1(72) 520.6±10.2981(5) 1(30)1(0.1)-1(1) -1(0.05)-1(7) -1(32) 1(72)523.1±16.49-1(2.5) 1(30)1(0.1) 1(2)-1(0.05)-1(7) 1(35) 1(72)512.72±3.8710-1(2.5)-1(20)-1(0.05) 1(2)-1(0.05)1(7.5)-1(32) 1(72)514.46±1.6111-1(2.5) 1(30)-1(0.05) 1(2)1(0.1)-1(7) 1(35) -1(48)526.97±3.8612-1(2.5)-1(20)1(0.1)-1(1) 1(0.1)1(7.5)1(35) 1(72)484.45±5.47
表2 PB方差分析
Table 2 Variance analysis of PB
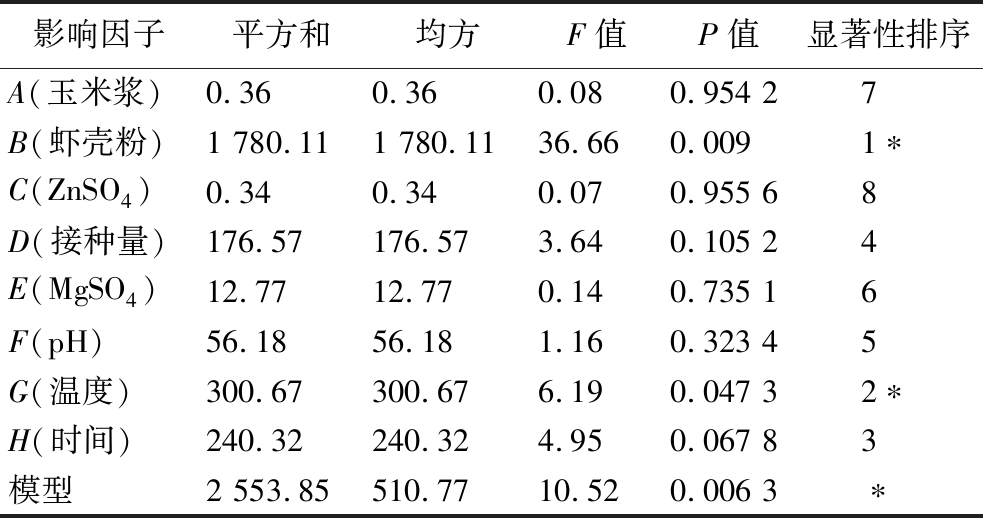
注:*代表差异显著,(P<0.05)。
影响因子平方和均方F值P值显著性排序A(玉米浆)0.360.360.080.954 27B(虾壳粉)1 780.111 780.1136.660.0091∗C(ZnSO4)0.340.340.070.955 68D(接种量)176.57176.573.640.105 24E(MgSO4)12.7712.770.140.735 16F(pH)56.1856.181.160.323 45G(温度)300.67300.676.190.047 32∗H(时间)240.32240.324.950.067 83模型2 553.85510.7710.520.006 3∗
2.4 正交实验结果分析
正交试验结果(表3)表明,3个因素对菌株产酶的影响大小依次为:发酵时间(C)>底物浓度(A)>发酵温度(B),各因素最佳组合为:A3B3C3,即底物40 g/L,发酵温度35 ℃,发酵时间48 h。由表4可以看出虾壳粉浓度和发酵时间2个因素具有极显著性(P<0.05),与表3结果一致。验证实验的蛋白酶活性为(617.13±22.11) U/mL,与预测值相符,较优化前(425.34±11.23) U/mL提高了43.50%。
表3 正交结果分析
Table 3 Analysis of orthogonal results
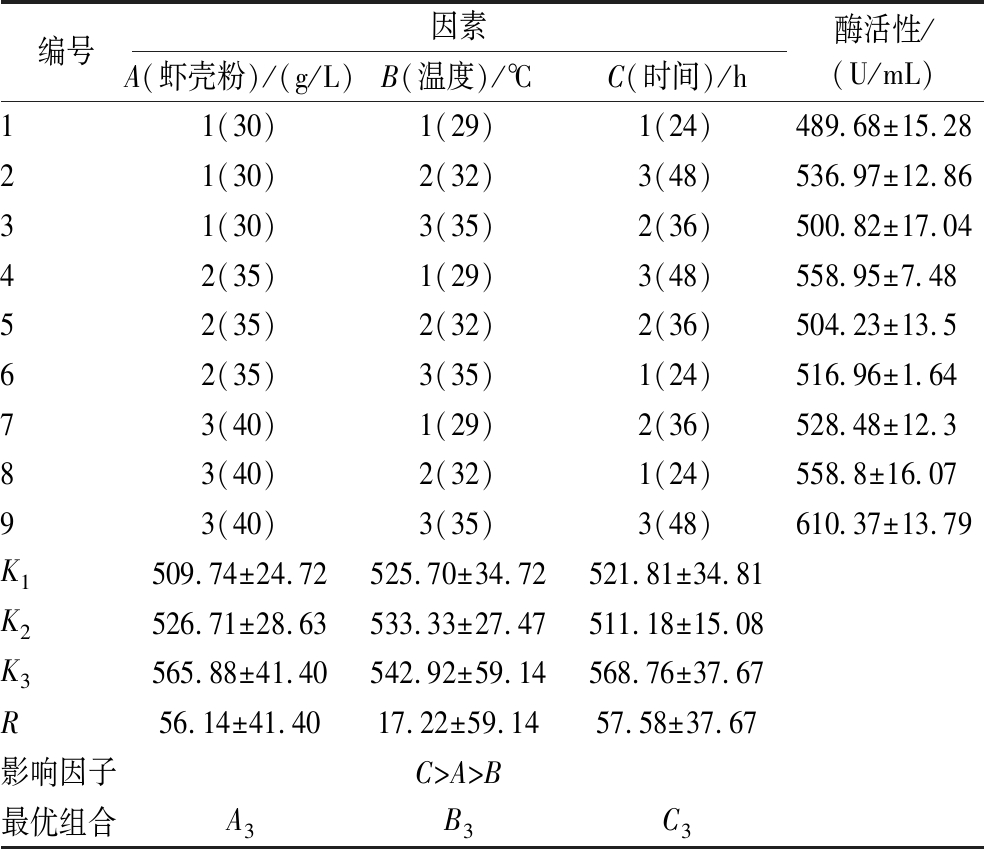
编号因素A(虾壳粉)/(g/L)B(温度)/℃C(时间)/h酶活性/(U/mL)11(30)1(29)1(24)489.68±15.2821(30)2(32)3(48)536.97±12.8631(30)3(35)2(36)500.82±17.0442(35)1(29)3(48)558.95±7.4852(35)2(32)2(36)504.23±13.562(35)3(35)1(24)516.96±1.6473(40)1(29)2(36)528.48±12.383(40)2(32)1(24)558.8±16.0793(40)3(35)3(48)610.37±13.79K1509.74±24.72525.70±34.72521.81±34.81K2526.71±28.63533.33±27.47511.18±15.08K3565.88±41.40542.92±59.14568.76±37.67R56.14±41.4017.22±59.1457.58±37.67影响因子C>A>B最优组合A3B3C3
表4 正交实验方差分析结果
Table 4 Variance analysis result of orthogonal test
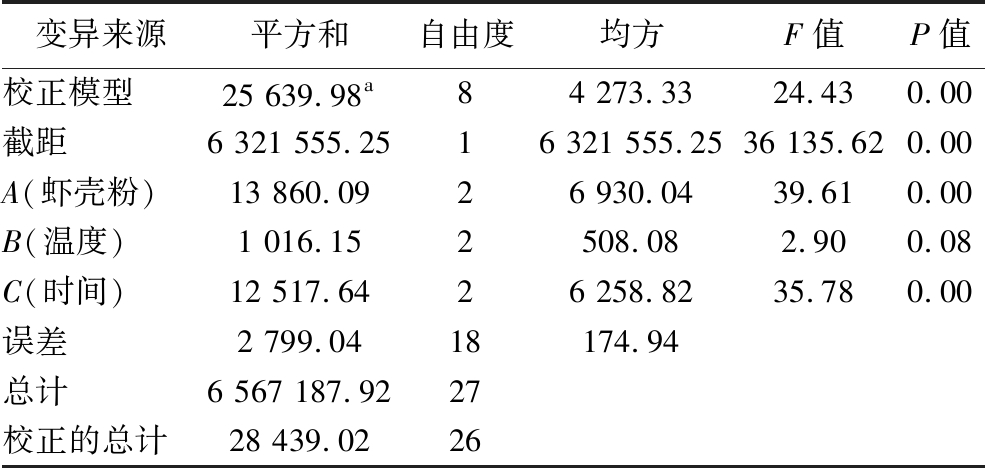
注:a代表R2=0.343。
变异来源平方和自由度均方F值P值校正模型25 639.98a8 4 273.33 24.43 0.00 截距6 321 555.25 1 6 321 555.25 36 135.62 0.00 A(虾壳粉)13 860.09 2 6 930.04 39.61 0.00 B(温度)1 016.15 2 508.08 2.90 0.08 C(时间)12 517.64 2 6 258.82 35.78 0.00 误差2 799.04 18 174.94总计6 567 187.92 27校正的总计28 439.0226
目前微生物发酵虾蟹壳脱蛋白的研究多集中在芽孢杆菌属[12-14],发酵中需外加碳、氮源,且酶活性多小于400 U/mL。而P.aeruginosa Gxun-7虾壳脱蛋白酶活性高,且无需额外添加碳源和无机盐,发酵时间短,可大大节约发酵成本,在虾壳脱蛋白方面具有良好的应用潜力。
2.5 P.aeruginosa Guxn-7产蛋白酶粗酶液酶学性质
2.5.1 酶的最适温度及温度稳定性
粗酶液在30~60 ℃时,酶活性随反应温度升高而逐渐增大,60 ℃时,相对酶活性达到最大;但当超过60 ℃时,酶活性随温度升高而逐步降低,80 ℃时,相对酶活性仍保持在60%以上,说明该酶的最适反应温度为60 ℃,温度耐受性较好(图3-A);温度稳定性结果表明,不同温度下保温2 h后,低于60 ℃时,酶的温度稳定性较好,相对活性超过80%;但60 ℃的稳定性远低于30~50 ℃,可能是由于60 ℃已接近此酶的温度极限值,长时间保存会出现部分变性,从而降低酶活性[9];当高于70 ℃时,相对酶活性急剧下降(低于20%),可能是由于温度过高破坏了维持酶结构的化学键,酶分子空间结构被破坏,进而造成酶活性的丧失[15](图3-B)。
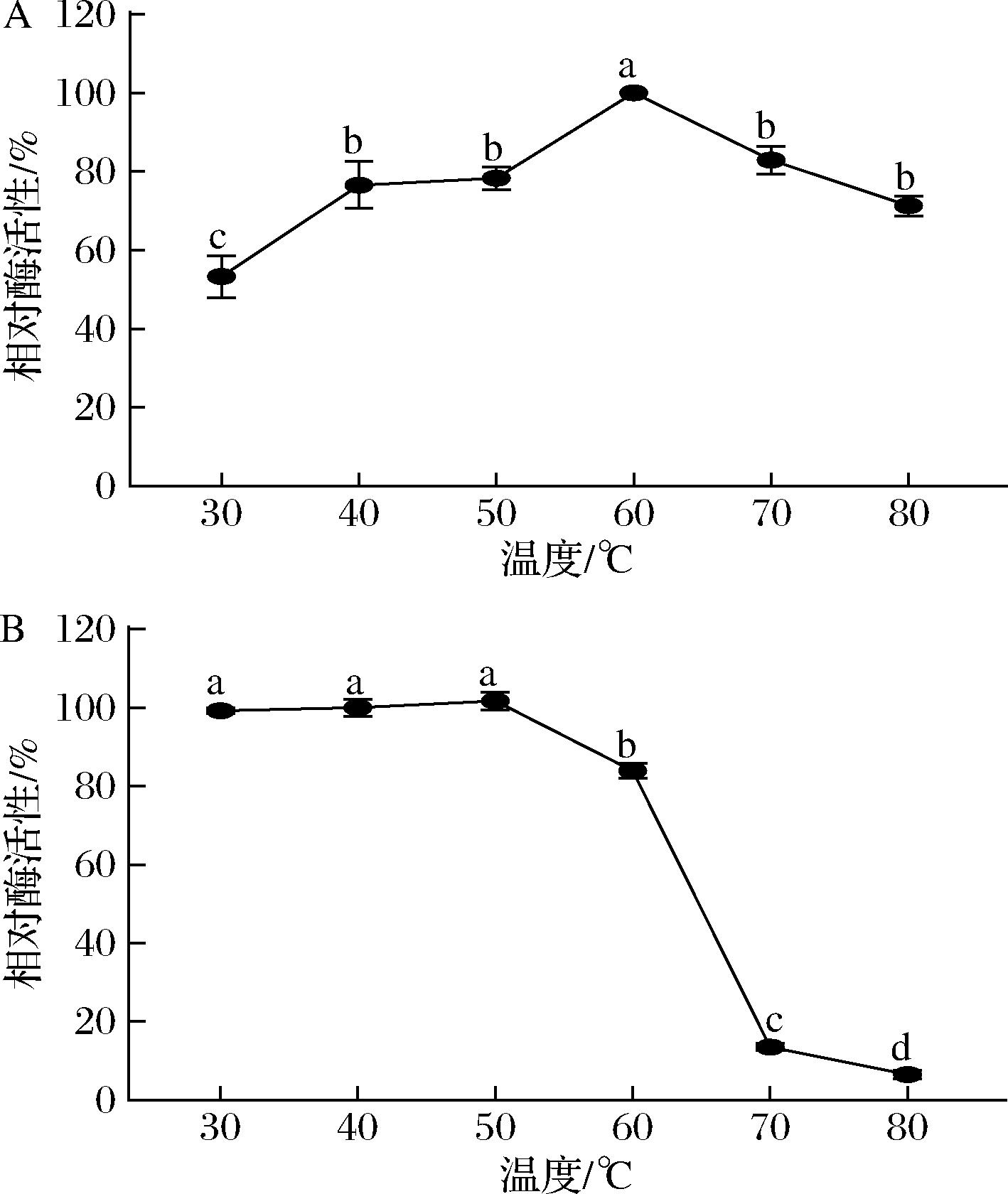
A-最适温度;B-温度稳定性
图3 反应温度对酶活性及稳定性的影响
Fig.3 Effect of temperature on enzyme activity and stability
2.5.2 酶的最适pH及pH稳定性
当反应pH值低于7.0时,酶活性随pH升高而不断增加,且pH为7.0时达到最大;但pH高于7.0时,酶活性随着pH的升高而缓慢降低(图4-A),pH 9.0时,相对酶活性仍大于80%,这表明菌株分泌的蛋白酶为中性蛋白酶,在弱碱性条件下酶活性较高。酶的pH稳定性结果表明,pH 5.0~8.0时,随着pH升高酶活性不断上升,pH 5.0时,相对酶活性仅为39.4%;但pH 7.0~9.0,相对酶活性稳定在85%以上(图4-B),这说明该酶在酸性环境下稳定性较差,中性至弱碱性环境下具有良好的稳定性。因此该酶在洗涤、制革、丝绸等行业具有较大的应用潜力。
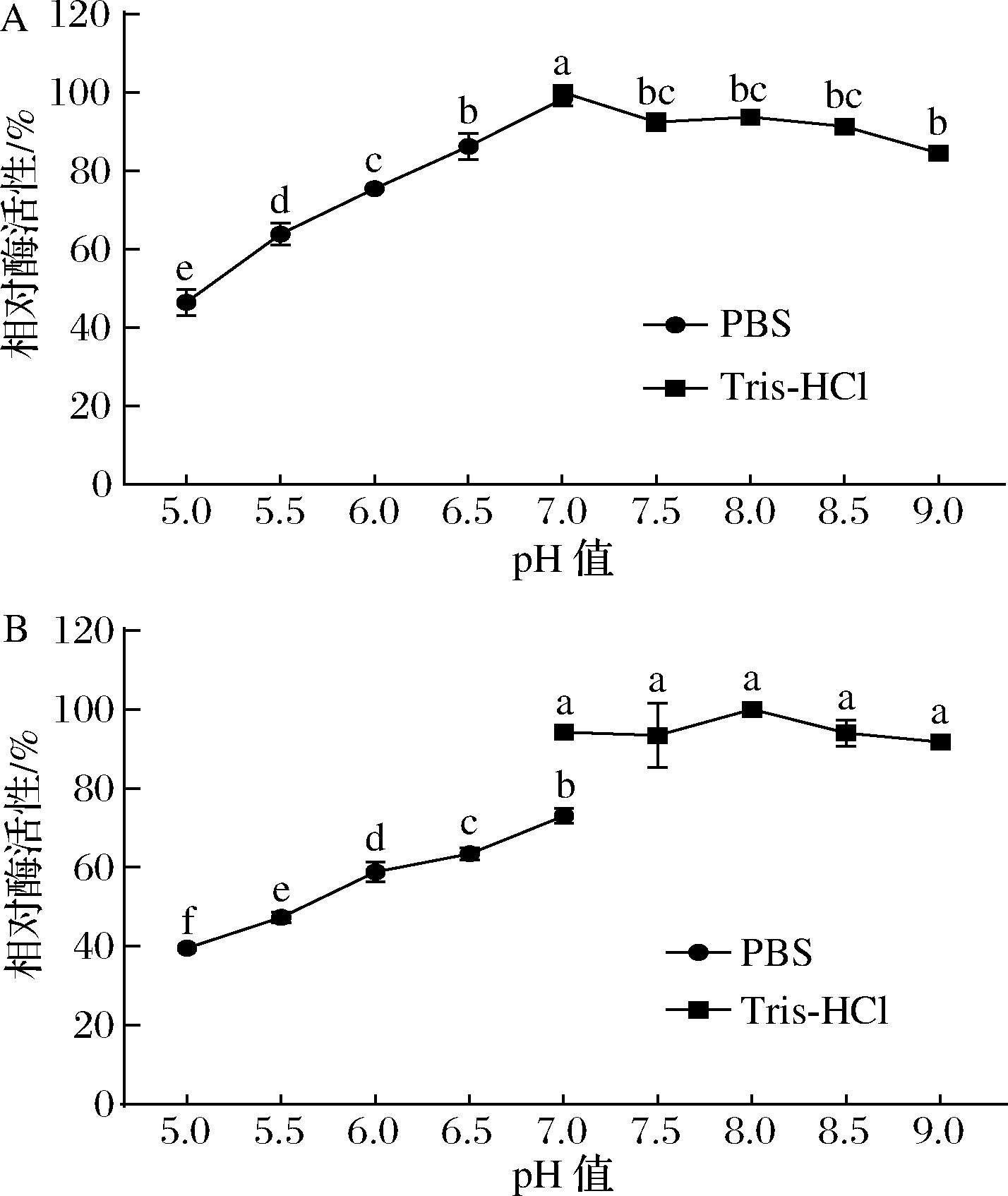
A-最适pH值;B-pH稳定性
图4 不同pH对酶活力及稳定性的影响
Fig.4 Effects of different pH on enzyme activity
2.5.3 金属离子对酶活性的影响
不同金属离子对酶活性影响不同(图5),Cu2+和Al3+对酶活性有显著的抑制作用(P>0.05),剩余相对酶活性仅为10.54%和31.62%,这与舒会[16]报道的P.aeruginosa SWJSS蛋白酶结果一致,可能是由于Cu2+和Al3+破坏蛋白酶的结构,进而影响酶活性;而Fe2+,Ca2+和Mn2+对酶活性有一定抑制作用,但相对酶活性仍能保持在80%左右,说明该酶对Fe2+,Ca2+和Mn2+耐受性较强;Mg2+和K+对酶活性基本无影响。多数报道蛋白酶对Fe2+的耐受性是很差的,如解淀粉芽孢杆菌Bacillus amyloliquefaciens B3所产蛋白酶在Fe2+中酶活性低于20%[17];贝莱斯芽孢杆菌Bacillus velezensis所产蛋白酶在Fe2+中相对酶活性仅剩7.6%[18]。而在本研究中Fe2+对酶活性的影响较小,相对酶活性仍有70%,说明不同菌株所产蛋白酶对金属离子的耐受性差别较大,具体机制有待进一步研究。
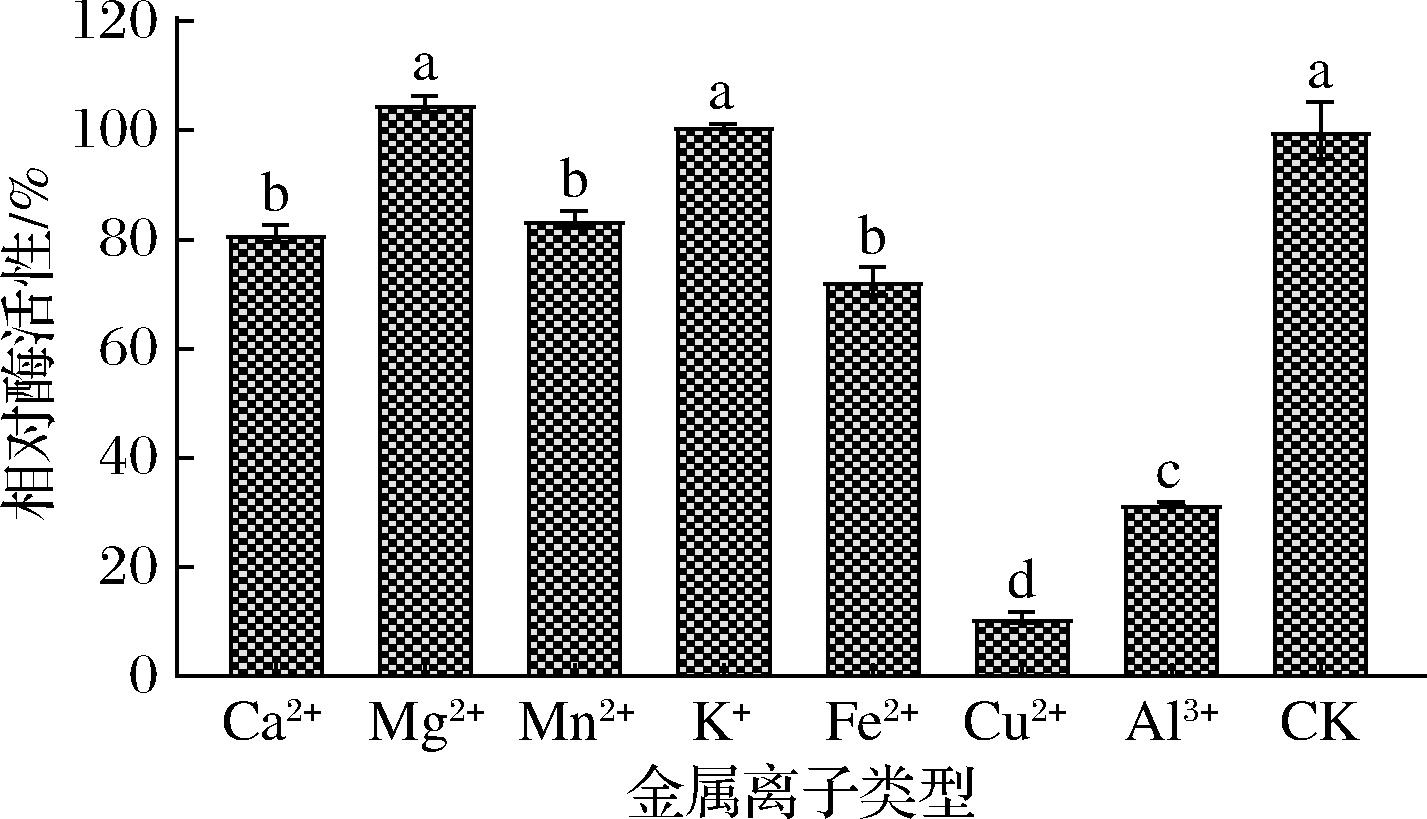
图5 金属离子对酶活力的影响
Fig.5 Effect of metal ions on enzyme activity
2.5.4 NaCl浓度对酶学性质的影响
该酶对NaCl的耐受性较强(图6),100 g/L的NaCl对酶活影响仍然不显著,这说明该酶的耐盐性较好。可能是由于该菌株来源于海洋环境,分泌蛋白酶在长期海洋环境中具有了适应高盐的能力[9],具有一定的生产应用价值。
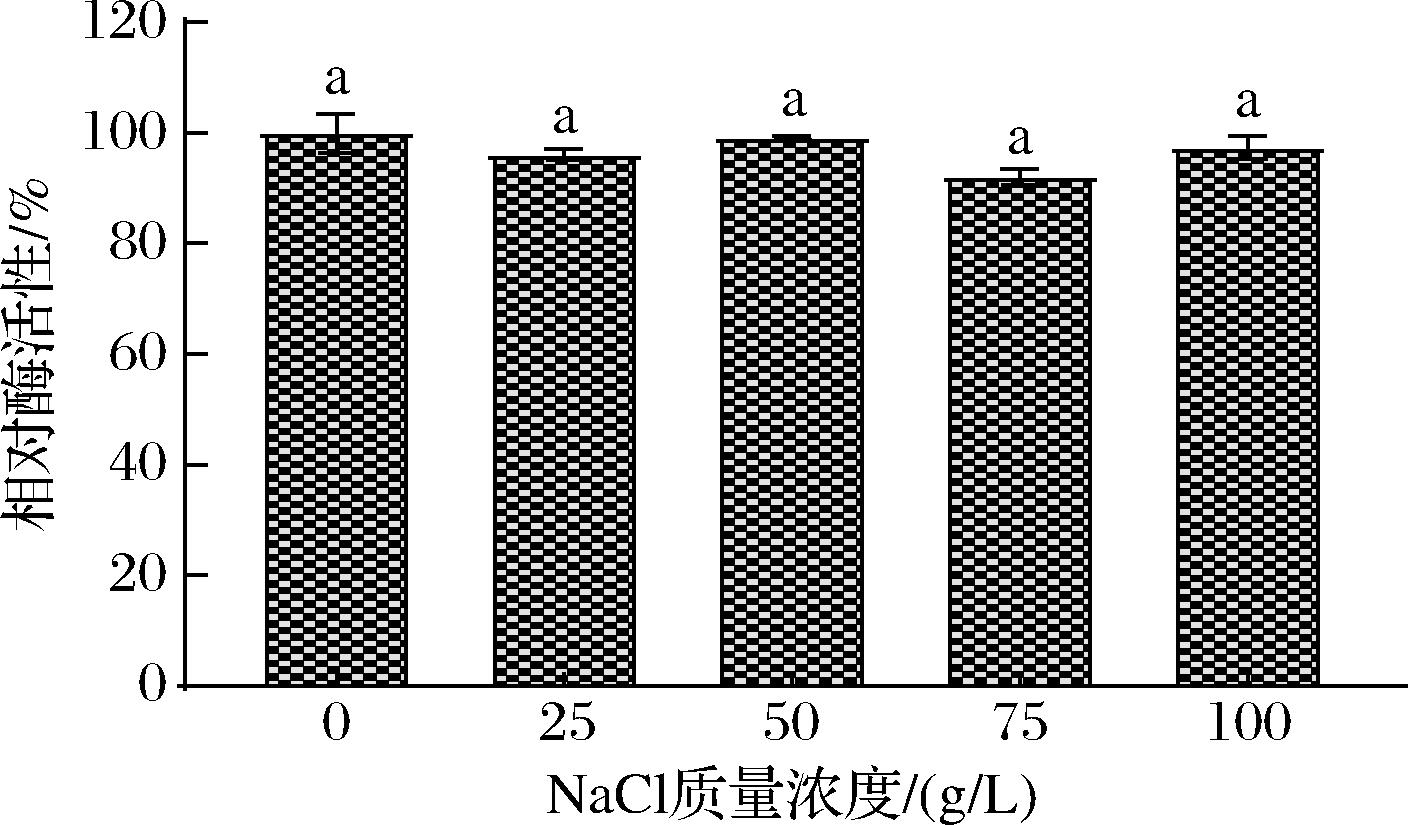
图6 氯化钠浓度对酶活力的影响
Fig.6 Effect of sodium chloride concentration on enzyme activity
2.5.5 不同有机化学试剂对酶学性质的影响
化学试剂对酶活性的影响如图7所示,β-巯基乙醇对该酶有显著的激活作用,相对酶活性可达468%,说明蛋白酶催化过程中可能有巯基基团的参与[19];异丙醇、洗洁精、EDTA和Triton X-100对该酶具有一定的促进作用,EDTA是一种金属蛋白酶抑制剂,可以螯合酶活性中心的金属离子从而使酶失活,而EDTA对该酶有一定的激活作用,可能该酶的活性发挥无需金属离子参与。Triton X-100具有激活作用,可能是其与游离水结合,减小了游离水对蛋白酶构象的影响,从而起到一定的激活作用[20];PMSF是一类蛋白酶抑制剂,可以抑制以丝氨酸为活性中心的蛋白酶类,而本实验PMSF对蛋白酶并无显著抑制,说明该蛋白酶并不属丝氨酸酶类;而SDS和CTAB对酶活具有显著抑制作用(相对酶活性<60%),可能是因为SDS与CTAB为离子型表面活性剂,可通过静电作用结合到蛋白酶表面带有电荷的氨基酸残基上,从而产生抑制,这与芽孢杆菌NCB-01胞外蛋白酶结果一致[15]。综上所述,该酶可能是一种活性中心需巯基参与的非丝氨酸蛋白酶类,有关该酶分子的具体结构及活性中心有待进一步深入研究。
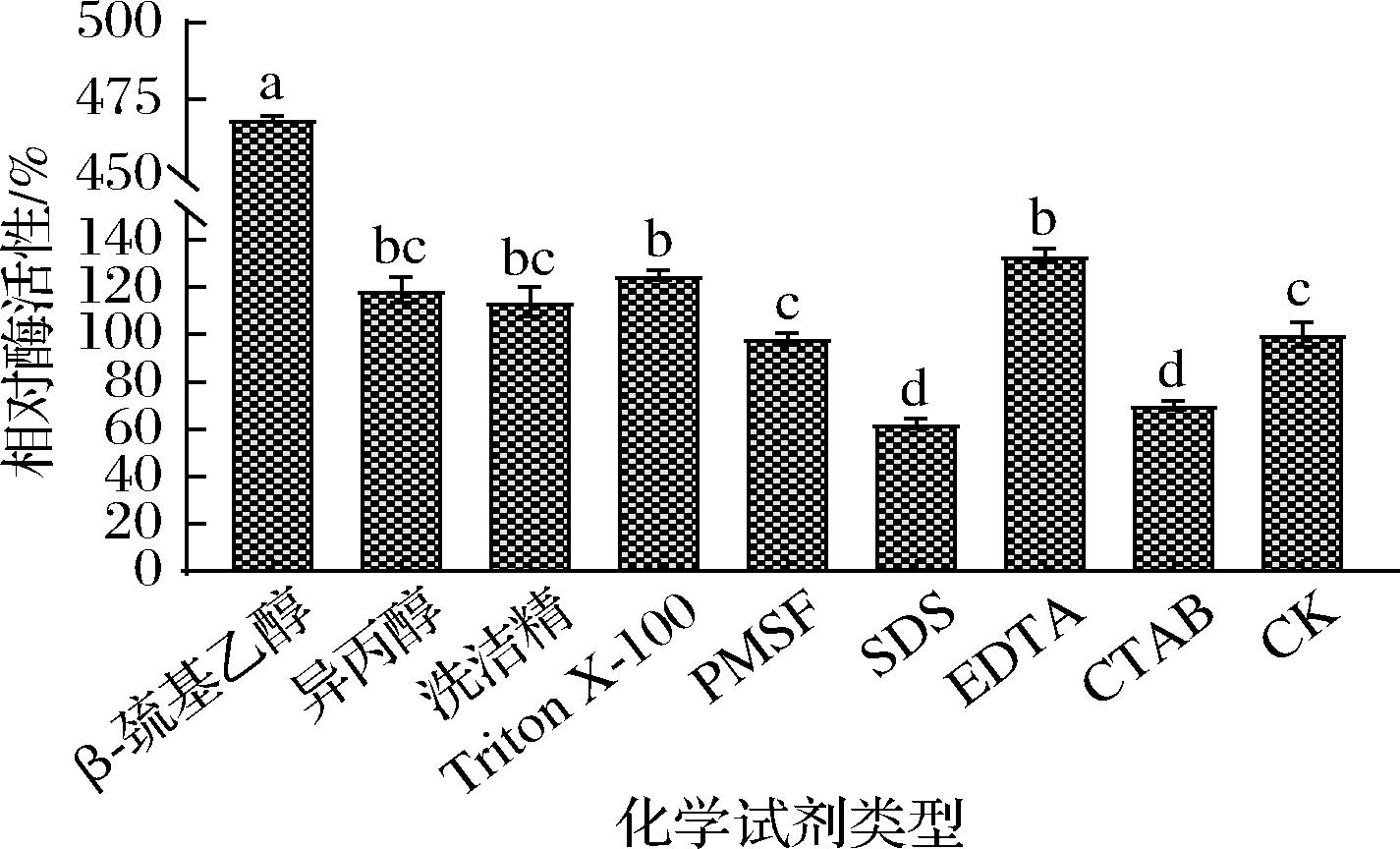
图7 化学试剂对酶活性的影响
Fig.7 Effect of chemical reagents on enzyme activity
2.5.6 酶的底物特异性
该蛋白酶对牛血清白蛋白、角蛋白、明胶和酪蛋白等可溶性底物的活性较强,其中对酪蛋白活性最强;而对虾壳粉和羽毛粉等不溶性底物效果较差,相对酶活<4%。这说明该酶降解可溶性蛋白的效率更高(图8-A)。
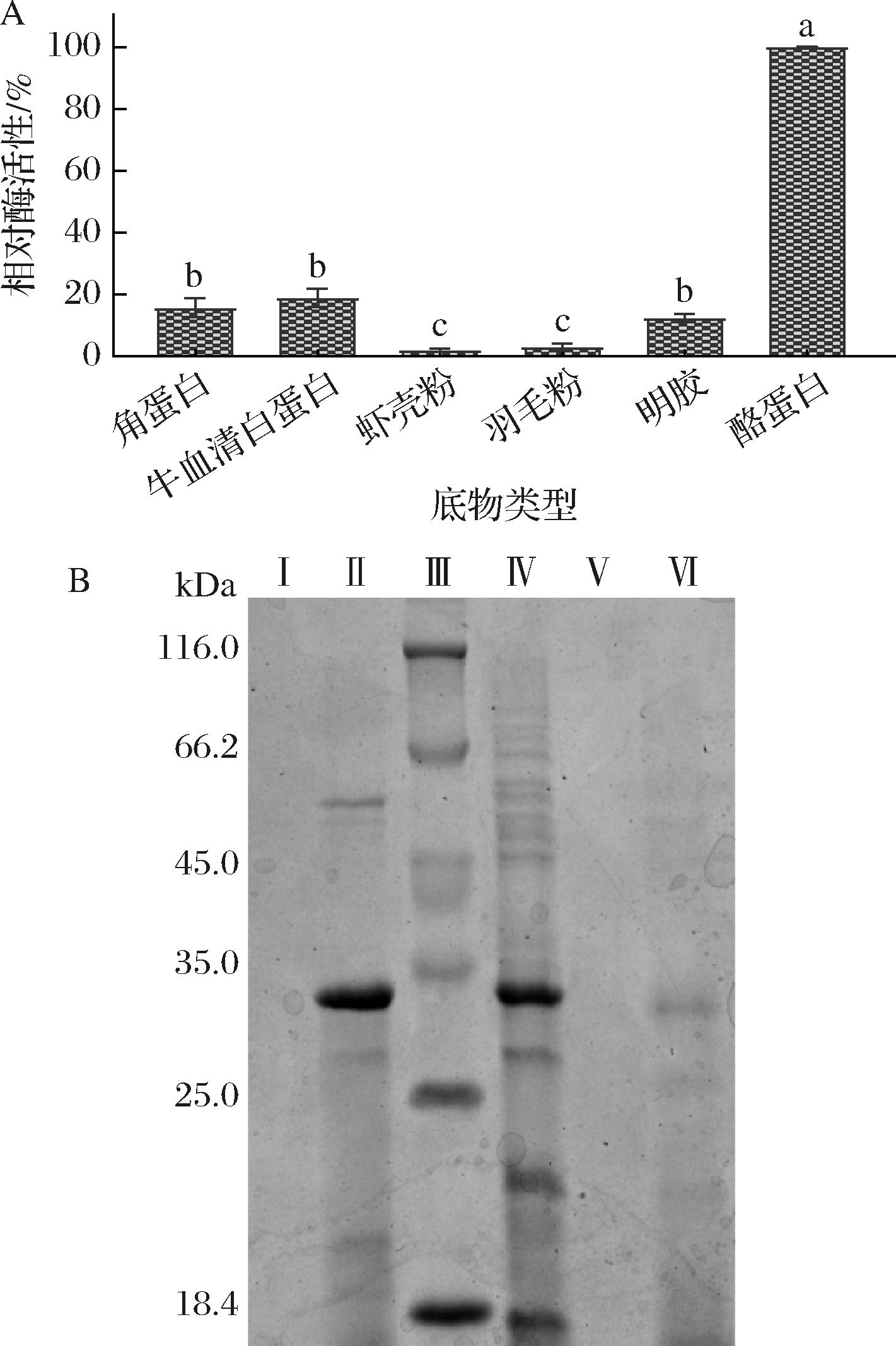
A-不同底物对酶活性的影响;B-不同底物发酵液SDS-PAGE蛋白酶谱(Ⅰ-LB+羽毛未接菌;Ⅱ-LB+羽毛接菌;Ⅲ-蛋白Marker;Ⅳ-LB+虾壳粉接菌;Ⅴ-LB+虾壳粉未接菌;Ⅵ-LB接菌)
图8 酶的底物特异性分析
Fig.8 Substrate-specific analysis of enzymes
SDS-PAGE结果显示,未接菌的虾壳和羽毛培养基中无蛋白条带,LB培养基中所产条带较浅;而添加虾壳及羽毛的LB培养基中,条带较多,这说明蛋白条带均为菌株Gxun-7所分泌;底物不同对菌株诱导产酶也不同,虾壳粉诱导产生大小约为32、22、18 kDa的3个主要条带,而羽毛粉仅有32 kDa的1个条带(图8-B)。这可能是由于羽毛成分相对单一,主要为角蛋白;而虾壳粉含有酪蛋白、角蛋白、胶原蛋白等成分,因而可诱导菌株产生更多蛋白酶。蜡样芽孢杆菌Bacillus cereus TKU006-虾壳脱蛋白时,诱导产生大小约为39 kDa蛋白酶[21],这说明不同菌株同一底物的诱导,所产蛋白酶也不相同。
2.5.7 虾壳脱蛋白率及发酵液成分分析
如图9-A所示,Gxun-7对虾壳DP为(82.61±0.54)%,但脱蛋白后仍检测到蛋白质,可能与凯氏定氮法测定虾壳中含氮几丁质有关[22]。而对照组的DP可能与虾壳粉碎及灭菌时蛋白质被破环有关。
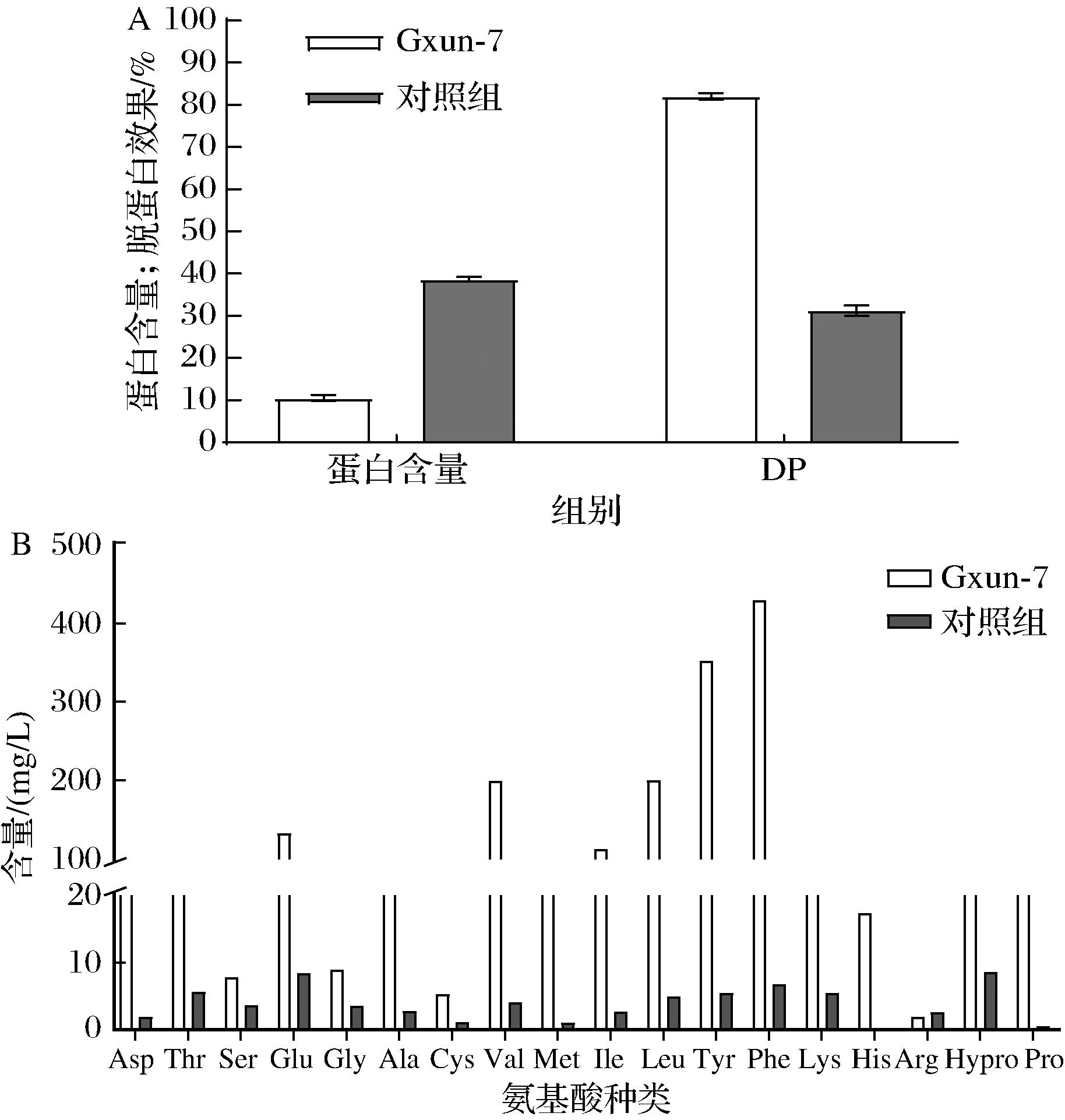
A-Gxun-7脱蛋白效果; B-氨基酸种类及含量
图9 Gxun-7虾壳粉发酵液中脱蛋白效果及成分分析
Fig.9 Deproteinization effect and composition analysis of Gxun-7 shrimp shell powder fermentation broth
图9-B结果表明,菌株Gxun-7虾壳脱蛋白降解液中氨基酸种类和含量丰富,共检测得到氨基酸17种,其中必需氨基酸7种(丝氨酸,缬氨酸,甲硫氨酸,异亮氨酸,亮氨酸,苯丙氨酸和赖氨酸,占比59.08%);氨基酸总量1 856.14 mg/L,其中Phe含量最高为429.56 mg/L。该菌株前期降解羽毛发酵液中共检测出16种氨基酸,其中缬氨酸,苯丙氨酸,亮氨酸和异亮氨酸含量较高,必需氨基酸占67.88%[9]。氨基酸组成和含量与本研究也有较大差别,这说明同一株菌降解不同底物所产生的氨基酸种类和含量有很大差异。必需氨基酸的组成与含量通常是衡量一种蛋白质饲料优劣的重要指标。必需氨基酸含量与非必需氨基酸的比值越高,营养价值越高[23]。赵黎明等[24]、聂芙蓉等[25]、BARON等[26]分别利用传统的酸碱法、物理法和酶解法处理虾壳中蛋白质,必需氨基酸占比分别为38.67%、38.02%和39%。与这些传统脱蛋白方法相比,本研究中氨基酸含量高,种类更丰富,且必需氨基酸占比更高。因此,Gxun-7虾壳脱蛋白降解液具有进一步开发为氨基酸饲料或肥料的潜质。
3 结论
本研究从前期筛选产蛋白酶菌株中筛选出1株对虾壳有高效脱蛋白能力的P.aeruginosa Gxun-7,并对虾壳脱蛋白条件进行了优化,优化后酶活性达(617.13±22.11) U/mL,较优化前提高了43.50 %,菌株所产蛋白酶为诱导酶,最适温度和pH值分别为60 ℃和7.0,酶的耐盐性和稳定性较好,降解液中共检测出17种氨基酸,含量达1 856.14 mg/L。因此,Gxun-7对虾壳具有高效脱蛋白能力,所产蛋白酶稳定性强,降解液中氨基酸含量丰富,为虾壳蛋白降解及利用提供理论依据。但与芽孢杆菌相比,P.aeruginosa为条件致病菌,考虑其潜在致病性,今后可采用发酵后菌株灭活或代谢工程的方法对致病相关基因进行敲除;也可通过基因工程手段异源表达蛋白酶的基因,利用所产蛋白酶应用于虾壳脱蛋白工业。
[1] 高秀君, 闫培生.海产品加工废弃物再利用研究进展[J].生物技术进展, 2014, 4(5):346-354.GAO X J, YAN P S.Progress of reutilization of seafood processing waste[J].Current Biotechnology, 2014, 4(5):346-354.
[2] DENG J J, MAO H H, FANG W, et al.Enzymatic conversion and recovery of protein, chitin, and astaxanthin from shrimp shell waste[J].Journal of Cleaner Production, 2020, 271:122655.
[3] XIE J W, XIE W C, YU J, et al.Extraction of chitin from shrimp shell by successive Two-Step fermentation of Exiguobacterium profundum and Lactobacillus acidophilus[J].Frontiers in Microbiology, 2021, 12:677126.
[4] RAKSHIT S, MONDAL S, PAL K, et al.Extraction of chitin from Litopenaeus vannamei shell and its subsequent characterization:An approach of waste valorization through microbial bioprocessing[J].Bioprocess and Biosystems Engineering, 2021, 44(9):1943-1956.
[5] 辛荣玉. 基于微生物法建立虾壳中甲壳素绿色制备技术研究[D].青岛:青岛科技大学, 2020.XIN R Y.A study on green technologies for chitin preparation from shrimp shells based on microbiological methods[D].Qingdao:Qingdao University of Science and Technology, 2020.
[6] FLORES-ALBINO B, ARIAS L, G MEZ J,et al.Chitin and L(+)-lactic acid production from crab (Callinectes bellicosus) wastes by fermentation of Lactobacillus sp. B2 using sugar cane molasses as carbon source[J].Bioprocess and Biosystems Engineering, 2012, 35(7):1193-1200.
MEZ J,et al.Chitin and L(+)-lactic acid production from crab (Callinectes bellicosus) wastes by fermentation of Lactobacillus sp. B2 using sugar cane molasses as carbon source[J].Bioprocess and Biosystems Engineering, 2012, 35(7):1193-1200.
[7] JUNG W J, JO G H, KUK J H, et al.Production of chitin from red crab shell waste by successive fermentation with Lactobacillus paracasei KCTC-3074 and Serratia marcescens FS-3[J].Carbohydrate Polymers, 2007, 68(4):746-750.
[8] ZHANG Q, WANG L Y, LIU S G, et al.Establishment of successive co-fermentation by Bacillus subtilis and Acetobacter pasteurianus for extracting chitin from shrimp shells[J].Carbohydrate Polymers, 2021, 258:117720.
[9] 杨梦莹, 庞坤容, 潘江欣, 等.一株可高效降解羽毛的铜绿假单胞菌的分离、鉴定、产酶条件优化及其酶活研究[J].微生物学报, 2022,62(3):968-981.YANG M Y, PANG K R, PAN J X, et al.Isolation, identification, optimization of enzyme-producing conditions and enzymatic activity of a feather-degradable Pseudomonas aeruginosa strain[J].Acta Microbiologica Sinica, 2022, 62(3):968-981.
[10] 张妮, 张红岩, 杨梦莹, 等.一株海洋来源高效产角蛋白酶菌株的筛选、鉴定及其酶学性质研究[J].食品与发酵工业, 2020, 46(18):98-104.ZHANG N, ZHANG H Y, YANG M Y, et al.Isolation and identification of a highly efficient keratinase producing strain from marine environment and its enzymatic properties[J].Food and Fermentation Industries, 2020, 46(18):98-104.
[11] 赵雨, 郭建华, 张春枝.蜡状芽孢杆菌ZY12产磷脂酶D的影响因素[J].食品与发酵工业, 2021, 47(9):57-62.ZHAO Y,GUO J H,ZHANG C Z.Factors influencing phospholipase D production by Bacillus cereus ZY12[J].Food and Fermentation Industries, 2021, 47(9):57-62.
[12] LIU Y L, XING R E, YANG H Y, LIU S, et al.Chitin extraction from shrimp (Litopenaeus vannamei) shells by successive two-step fermentation with Lactobacillus rhamnoides and Bacillus amyloliquefaciens[J].International Journal of Biological Macromolecules, 2020, 148:424-433.
[13] 张巧, 黄兴, 李永成.产蛋白酶菌株的鉴定及其对虾壳的脱蛋白研究[J].中国酿造, 2020, 39(9):131-135.ZHANG Q, HUANG X, LI Y C.Identification of a protease-producing strain and deproteinization on shrimp shell[J].China Brewing, 2020, 39(9):131-135.
[14] CAHYANINGTYAS H A A, SUYOTHA W, CHEIRSILP B, et al.Optimization of protease production by Bacillus cereus HMRSC30 for simultaneous extraction of chitin from shrimp shell with value-added recovered products[J].Environmental Science and Pollution International, 2022, 29(15):22163-22178.
[15] 孙艺轩, 郑国栋, 林剑.芽孢杆菌NCB-01胞外蛋白酶酶学特性的初步研究[J].中国酿造, 2020, 39(8):128-133.SUN Y X, ZHENG G D, LIN J.Preliminary study of enzymatic characterization of extracellular protease from Bacillus NCB-01[J].China Brewing, 2020, 39(8):128-133.
[16] 舒会. 深海铜绿假单胞菌的产酶特性及弹性蛋白酶应用研究[D].广州:华南理工大学, 2016.SHU H.Enzymatic characterization of deep-sea strain Pseudomonas aeruginosa and hydrolysis application of elastase[D].Guangzhou:South China University of Technology, 2016.
[17] 周婉婷, 侯宏伟, 贺瑞琦, 等.豆豉中产蛋白酶菌株的酶学性质及风味酶基因挖掘[J].食品与发酵工业, 2022, 48(24):181-193.ZHOU W T, HOU H W, HE R Q, et al.Enzymatic properties of protease-producing strains in Douchi and mining of flavor enzyme genes[J].Food and Fermentation Industries, 2022, 48(24):181-193.
[18] 冯菲, 权淑静, 刘丽, 等.高产蛋白酶菌株的分离、鉴定及酶学性质研究[J].中国酿造, 2021, 40(7):148-152.FENG F, QUAN S J, LIU L, et al.Isolation, identification and enzymatic properties of a high-yield protease strain[J].China Brewing, 2021, 40(7):148-152.
[19] 高岩, 王景会, 李玉秋, 等.枯草芽孢杆菌凝乳酶的酶学性质[J].吉林农业大学学报, 2012, 34(4):385-390.GAO Y, WANG J H, LI Y Q, et al.Enzymological characteristics of chymosin produced by Bacillus subtilis[J].Journal of Jilin Agricultural University, 2012, 34(4):385-390.
[20] 王朋辉, 王伟贤, 杨涛, 等.碱性蛋白酶洗涤性能的影响因素[J].日用化学工业, 2021, 51(11):1109-1117.WANG P H, WANG W X, YANG T, et al.Influencing factors on washing performance of alkaline protease in liquid detergent[J].China Surfactant Detergent&Cosmetics, 2021, 51(11):1109-1117.
[21] WANG S L, CHAO C H, LIANG T W, et al.Purification and characterization of protease and chitinase from Bacillus cereus TKU006 and conversion of marine wastes by these enzymes[J].Marine Biotechnology, 2009, 11(3):334-344.
[22] HOMAEI A, IZADPA NAH QESHMI F.Purification and characterization of a robust thermostable protease isolated from Bacillus subtilis strain HR02 as an extremozyme[J].Journal of Applied Microbiology, 2022, 133(5):2779-2789.
[23] 孙明远. 食品营养学[M].北京:科学出版社, 2006.SUN M Y.Food Nutriology[M].Beijing:Science Press, 2006.
[24] 赵黎明, 夏文水.虾蟹壳生产甲壳素废碱液的成分分析[J].食品工业科技, 2009, 30(8):75-77.ZHAO L M, XIA W S.Composition analysis of alkali wastewater from chitin processing[J].Science and Technology of Food Industry, 2009, 30(8):75-77.
[25] 聂芙蓉, 郭良兴, 李梦云, 等.虾壳粉的营养价值评价及虾青素闪提工艺参数研究[J].现代牧业, 2021, 5(2):5-10.NIE F R, GUO L X, LI M Y, et al. Evaluation of nutritional value of shrimp shell powder and study on technological parameters of astaxanthin flash extraction[J].Modern Animal Husbandry, 2021,5(2):5-10.
[26] BARON R, SOCOL M, KAAS R, et al.Elements for optimizing a one-step enzymatic bio-refinery process of shrimp cuticles:Focus on enzymatic proteolysis screening[J].Biotechnology Reports, 2017, 15:70-74.