高尿酸血症(hyperuricemia,HUA)是由嘌呤代谢紊乱引起的一种代谢性疾病[1]。过量摄入嘌呤,引起机体嘌呤代谢紊乱,导致体内尿酸(uric acid,UA)含量升高,当UA无法及时通过机体代谢排出,而积累过量时,形成了高尿酸血症,进而引发机体产生其他并发症[2]。因此,降低血液中的UA含量成为改善高尿酸血症的关键,而目前常规的降UA药物可能具有潜在的副作用[3],国内外学者为此积极寻找降UA效果显著、安全的天然药食用资源。
桑黄(Sanghuangporus sanghuang),是桑黄属多年生真菌,主要分布于热带美洲、非洲和东亚,是韩国、中国和日本的传统药用真菌。目前,锈革孔菌科(Hymenochaetaceae)桑黄孔菌属(Sanghuangporus)、木层孔菌属(Phellinus)及纤孔菌属(Inonotus)等都统称为广义的“桑黄”[4]。桑黄具有抗肿瘤、免疫调节、抗糖尿病及抗炎等作用[5],近年来国内外学者开始关注桑黄的降UA活性。有研究表明,桑黄可通过抑制黄嘌呤氧化酶(xanthine oxidase,XOD)和腺苷脱氨酶(adenosine deaminase,ADA)的活性从而降低血尿酸水平[6];具有治疗高尿酸血症和急性痛风性关节炎等生物活性[7];但不同来源桑黄的生物活性物质及降尿酸活性可能存在一定差异,而目前关于比较不同来源的桑黄降UA活性并探究其物质基础的研究还鲜有报道。
本实验拟以野生瓦宁木层孔菌、栽培粗毛纤孔菌、栽培瓦宁木层孔菌和野生粗毛纤孔菌4个不同来源的桑黄为研究对象,比较不同来源的桑黄游离酚提取物对XOD的抑制能力以及在高UA细胞模型中降UA的活性差异,以XOD抑制能力和高UA细胞模型中的降UA活性为指标,筛选出优势的桑黄活性提取物,并通过超高效液相色谱-串联质谱(ultra performance liquid chromatography/tandem mass spectrometry,UPLC-MS/MS)分析产生发挥酶抑制活性与降UA活性的化合物,以期为桑黄优质种质资源的筛选及降UA产品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
4个桑黄样品:野生瓦宁木层孔菌、栽培粗毛纤孔菌、栽培瓦宁木层孔菌和野生粗毛纤孔菌均由山东夏津桑黄生物科技有限公司提供。
XOD,南京建成生物工程研究所有限公司;别嘌醇、腺苷、黄嘌呤,上海源叶生物科技有限公司;甲醇、乙腈,均为色谱纯,美国默克集团;没食子酸、甲酸(色谱纯)、DMSO(分析纯),上海阿拉丁生化科技股份有限公司;芦丁,广州市齐云生物科技有限公司。
DMEM/F 12培养基,美国Corning公司;南美胎牛血清(fetal bovine serum,FBS),Biological industries(BI);胰蛋白酶-EDTA(0.25%)、青霉素、链霉素(Penicillin-Streptomycin,100×)、PBS pH 7.4 basic (1×),美国GIBCO公司;CCK-8试剂盒,MedemExpress (MCE)公司;尿酸含量检测试剂盒,苏州格锐思生物科技有限公司;人肾小管上皮细胞(HK-2),广州驷拓柏腾(CytoBiotech)生物科技有限公司。
1.2 仪器与设备
TECAN infinite 200型酶标仪,瑞士TECAN公司;SB-1300型旋转蒸发仪,FDU-2110型冷冻干燥机,日本东京理化器械株式会社公司;DMI 400 B/DFC 450 C型倒置显微镜,德国LEICA公司;SW-CJ-2 FD型无菌操作台,苏净集团苏州安康空气技术有限公司;二氧化碳恒温培养箱,美国Thermo Scientific公司;ExionLCTM AD型超高效液相色谱、QTRAP®6500+型串联质谱,美国AB-SCIEX公司。
1.3 实验方法
1.3.1 不同来源的桑黄游离酚提取物的制备
采用溶剂提取法[8],制备不同桑黄样品的游离酚提取物。称取不同的桑黄粉10 g,按料液比1∶30(g∶mL)加入300 mL体积分数为70%的乙醇溶液,搅拌均匀,在1 788×g,4 ℃下离心10 min,收集上清液;重复提取3次,合并上清液。将上清液于45 ℃条件下旋转蒸发去除乙醇溶剂,定容至25 mL,分装后贮存于-20 ℃,备用。
1.3.2 不同来源的桑黄游离酚含量的测定
采用福林酚法[9]测定不同来源的桑黄游离酚含量。取适当稀释后的待测样品0.5 mL于试管中,加入2 mL超纯水和0.5 mL福林酚试剂后,混匀静置6 min,再加入5 mL质量分数为7%的Na2CO3溶液中和,混匀室温放置90 min,于760 nm处测定其吸光度值。以0.06~0.6 mg/mL没食子酸为标准品在相同条件下测定吸光度值,得到标准曲线方程为y=0.002 9x+0.132 7,相关系数R2=0.999 1。桑黄游离酚含量以单位质量(g)桑黄干样品中所含没食子酸当量(mg)计,mg/g。
1.3.3 不同来源的桑黄游离黄酮含量的测定
采用亚硝酸钠-硝酸铝法[10]测定不同来源的桑黄游离黄酮含量。取适当稀释后的待测样品0.5 mL于试管中,加入5%(体积分数)NaNO2 0.3 mL摇匀,静置6 min,然后加入5%(体积分数)Al(NO3)3 0.3 mL 摇匀,继续静置6 min后,加入4%(体积分数)NaOH 4 mL,最后用蒸馏水定容至15 mL摇匀,静置12 min,在504 nm条件下测定吸光度值。以0~0.332 mg/mL,芦丁为标准品在同条件下测定吸光度值,得到标准曲线方程为y=0.488 6x+0.037 3,相关系数R2=0.999 0。黄酮含量以单位质量(g)桑黄干样品中所含芦丁当量(mg)计,mg/g。
1.3.4 XOD抑制率的测定
参考张晨辉[11]的方法。取40 μL系列稀释浓度的待测桑黄游离酚提取物于96孔板,加入80 μL 8 U/L的XOD,以200 μmol/L的黄嘌呤溶液为底物,以100 μmol/L的别嘌醇作为阳性对照,室温条件下反应30 min,然后加入80 μL黄嘌呤溶液启动反应,混匀后40 ℃下孵育15 min后,在295 nm下测定吸光度值。按公式(1)计算XOD活性抑制率,采用GraphPad Prism 7.0软件,根据不同的样品抑制浓度和抑制率进行计算桑黄游离酚提取物对XOD的半数抑制浓度(IC50值)。
酶活性抑制率![]()
(1)
式中:F1为样品组吸光度;F2为对照组吸光度(等体积缓冲液代替XOD溶液);F3为标准组吸光度(等体积PBS缓冲液代替样品溶液);F4为标准对照组吸光度(等体积PBS缓冲液代替样品及XOD溶液)。
1.4 不同来源的桑黄游离酚提取物对HK-2细胞高UA模型UA含量的影响
1.4.1 样品溶液的制备
取等量的桑黄游离酚提取物,用DMSO(终浓度为5‰)辅助溶解,用完全培养基稀释,制成6 400、3 200、1 600、800、400、100 μg/mL的细胞生长培养液。
1.4.2 高UA细胞模型的建立
1.4.2.1 细胞株
人肾小管上皮细胞(HK-2),细胞特征编码:STR-10675-HK-2。
1.4.2.2 HK-2细胞的培养
将HK-2细胞用含0.25% EDTA的胰蛋白酶将细胞从瓶壁上消化下来,用含10% FBS、1%青霉素和链霉素的DMEM/F 12培养基终止消化,111×g,3 min,离心收集细胞沉淀,按1∶3体积比传代于T 75的细胞培养瓶中,按常规细胞培养方法置于37 ℃、5%(体积分数)CO2,饱和湿度(95%)的恒温培养箱中培养,细胞贴壁生长。当细胞汇合率达到70%~80%时,以上述方法继续传代培养。
1.4.2.3 不同来源的桑黄游离酚提取物对HK-2细胞活力的影响
采用CCK-8法[12]测定不同样品对HK-2细胞增殖的抑制作用。将处于对数生长期的HK-2细胞以1×104个/孔的密度接种于96孔细胞培养板中[13],在培养箱中培养24 h后,细胞生长密度达到70%~80%时,用不同质量浓度的桑黄游离酚提取物生长培养基处理细胞,于培养箱中孵育24 h,除去上清液,用PBS洗涤细胞3次,每孔加入100 μL的质量分数为10% CCK-8的培养基,继续孵育30 min,于540 nm处测定其吸光度值,按公式(2)计算细胞存活率。以细胞存活率≥90%为标准,确定桑黄游离酚提取物的安全剂量。
细胞存活率![]()
(2)
式中:Aa为实验组吸光值;Ab为对照组吸光值。
1.4.2.4 HK-2细胞高UA模型的建立
参考HOU等[14]的方法建立HK-2高尿酸细胞模型,并稍作修改。取对数生长期的细胞,按1.4.2.2节的方法收集细胞沉淀,并将细胞悬液稀释至1×105个/mL。将24孔板用PBS润洗一遍,弃掉PBS,将细胞悬液接种在细胞培养板中,1 mL/孔,放入培养箱中培养。
1.4.2.5 XOD添加量对HK-2细胞高UA模型UA含量的影响
同1.4.2.4节操作,细胞贴壁生长24 h后,每组设置3个复孔:按空白组(完全培养基)、模型组(完全培养基)、阳性组(100 μmol/L别嘌醇的完全培养基);处理24 h后,吸掉培养基,用PBS将细胞洗涤3次,按空白组(完全培养基)、模型组(2.5 mmol/L腺苷无FBS培养基)、阳性组(2.5 mmol/L腺苷无FBS培养基);处理30 h后,加入设置的6个添加量(2、1.5、1.0、0.5、0.05、0.005 U/mL)的XOD,于培养箱中孵育8 h后,收集培养上清液,按照UA试剂盒所标明操作方法测定UA含量,筛选XOD的添加量。
1.4.3 不同来源的桑黄游离酚提取物降UA活性的比较
同1.4.2.4节操作,细胞贴壁生长24 h后,每组设置3个复孔:按空白组(完全培养基)、模型组(完全培养基)、阳性组(100 μmol/L别嘌醇的完全培养基)、样品组(400 μg/mL的完全培养基)换液。处理24 h后,吸掉培养基,用PBS将细胞洗涤3次,操作顺序为:空白组(完全培养基)、模型组(2.5 mmol/L腺苷培养基)、阳性组[V(200 μmol/L别嘌醇)∶V(5 mmol/L腺苷)=1∶1]、样品组[V(400 μg/mL样品)∶V(5 mmol/L腺苷)=1∶1],除空白组以外,其他组的培养基均为无FBS的培养基。处理30 h后,每孔加入筛选后添加量的XOD,于培养箱中孵育8 h后,收集培养上清液,测定UA含量,分析比较其降UA活性。
1.5 桑黄游离酚提取物酚类化合物的测定
基于不同来源桑黄游离酚提取物对XOD的抑制作用比较及在HK-2细胞高UA模型中的降UA活性比较,以强活性游离酚提取物为研究对象,通过UPLC-MS/MS[15-17]对桑黄游离酚提取物多酚类化合物进行定性定量分析。将桑黄游离酚提取物真空冷冻干燥后,研磨至粉状,称取20 mg粉末,加入10 μL 4 000 nmol/L的内标混合工作液和500 μL 70%(体积分数)甲醇溶液,超声30 min,在3 996×g,4 ℃条件下,离心5 min,吸取上清液,用微孔滤膜(0.22 μm)过滤,保存于进样瓶中,备用。
色谱条件:色谱柱为Waters ACQUITY UPLC HSS T3 C18色谱柱(1.8 μm×2.1 mm×100 mm);流动相:A相为超纯水(含体积分数为0.05%的甲酸),B相为乙腈(含体积分数为0.05%的甲酸);梯度洗脱:0 min A/B为90∶10(体积比),1 min为80∶20(体积比),9 min为30∶70(体积比),12.5 min为5∶95(体积比),13.5 min 5∶95(体积比),13.6 min为90∶10(体积比),15 min为90∶10(体积比);流速0.35 mL/min;柱温40 ℃;进样量4 μL。
质谱条件:采用电喷雾离子源,温度550 ℃,正离子模式下质谱电压5 500 V,负离子模式下质谱电压-4 500 V,气帘气35 psi。每个离子对根据优化的去簇电压和碰撞能进行扫描检测。
质谱分析:通过迈特维尔数据库(metware database,MWDB),根据二级质谱信息进行物质定性分析,利用三重四级杆质谱的多反应监测模式对鉴定的化合物进行定量分析。
1.6 数据处理
所有数据均重复3次,结果为平均值±标准差。用SPSS 21.0软件对数据进行分析,得到相应的半数抑制浓度(IC50)值,用Duncan′s多重比较方法进行显著性方差分析。
2 结果与分析
2.1 不同来源的桑黄酚类物质含量比较
不同来源的桑黄游离酚提取物中多酚及黄酮含量见图1。由图1-a可知,4个不同来源桑黄的游离酚提取物中多酚含量具有显著性差异(P<0.05)。其中,栽培粗毛纤孔菌的含量显著高于其他3个来源的桑黄;多酚含量由高到低为栽培粗毛纤孔菌[(16.48±0.21) mg/g]>野生粗毛纤孔菌[(9.43±0.27) mg/g]>野生瓦宁木层孔菌[(9.28±0.41) mg/g]>栽培瓦宁木层孔菌[(3.55±0.21) mg/g]。由图1-b可知,4个不同来源桑黄的游离酚提取物的黄酮含量存在显著性差异(P<0.05),其中栽培粗毛纤孔菌的含量显著高于其他3个来源的桑黄。游离黄酮含量降序排列为:栽培粗毛纤孔菌[(2.11±0.12) mg/g]>野生瓦宁木层孔菌[(1.26±0.07) mg/g]>野生粗毛纤孔菌[(0.13±0.04) mg/g]>栽培粗毛纤孔菌[(0.11±0.02) mg/g]。
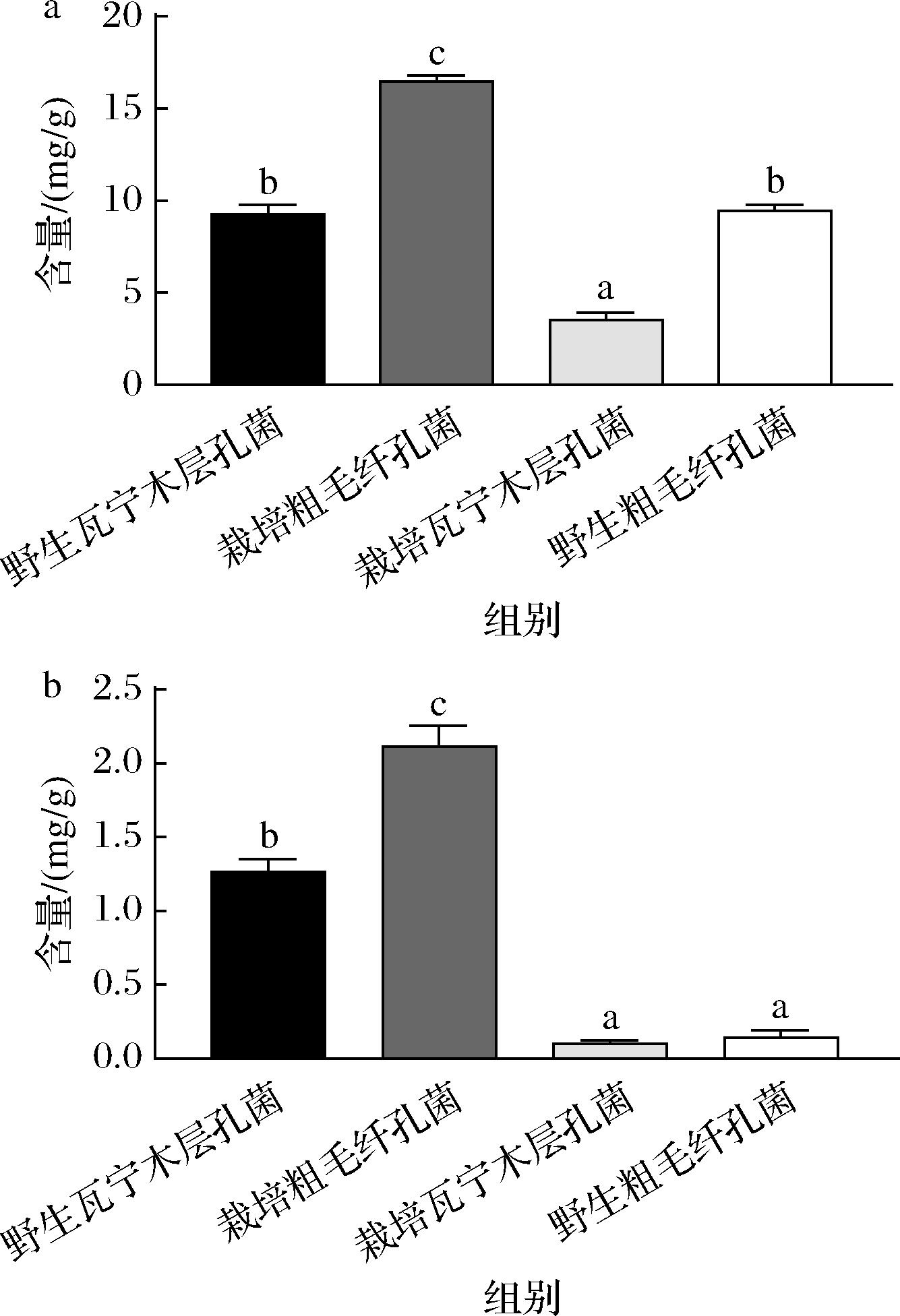
a-多酚含量;b-黄酮含量
图1 不同来源桑黄游离酚提取物的多酚与黄酮含量
Fig.1 Polyphenol and flavonoid contents of free phenol extracts of Sanghuangporus sanghuang from different sources
注:图中不同小写字母表示差异显著(P<0.05)(下同)。
从同一菌株来看,黄酮含量均为野生比栽培的显著更高,可见生长环境对桑黄的活性物质含量具有重要影响。栽培粗毛纤孔菌与栽培瓦宁木层孔菌的多酚与黄酮含量均存在显著性差异(P<0.05),可见除生长环境外,不同的菌株对桑黄的多酚与黄酮含量也存在较大影响。本研究中提取方法与提取溶剂均一致,不同来源桑黄的多酚与黄酮等活性物质含量差异可能与生长环境及菌株等因素有关。
2.2 不同来源的桑黄游离酚提取物对XOD的抑制作用比较
不同来源桑黄游离酚提取物对XOD的抑制作用见图2。XOD是UA形成的关键酶,主要参与UA的合成,催化次黄嘌呤转化为黄嘌呤,进而合成UA[18],抑制其活性可以从源头上有效减少机体中的UA含量。由图2可知,阳性组对XOD的抑制效果显著优于4个不同来源的桑黄游离酚提取物(P<0.05),栽培粗毛纤孔菌、栽培瓦宁木层孔菌和野生粗毛纤孔菌的抑制效果显著优于野生瓦宁木层孔菌。4个不同来源的桑黄游离酚提取物对XOD的抑制效果从高到低依次为:栽培粗毛纤孔菌[(94.63±2.73) μg/mL]、栽培瓦宁木层孔菌[(99.69±2.50) μg/mL]、野生粗毛纤孔菌[(106.32±5.06) μg/mL]、野生瓦宁木层孔菌[(140.64±3.99) μg/mL]。
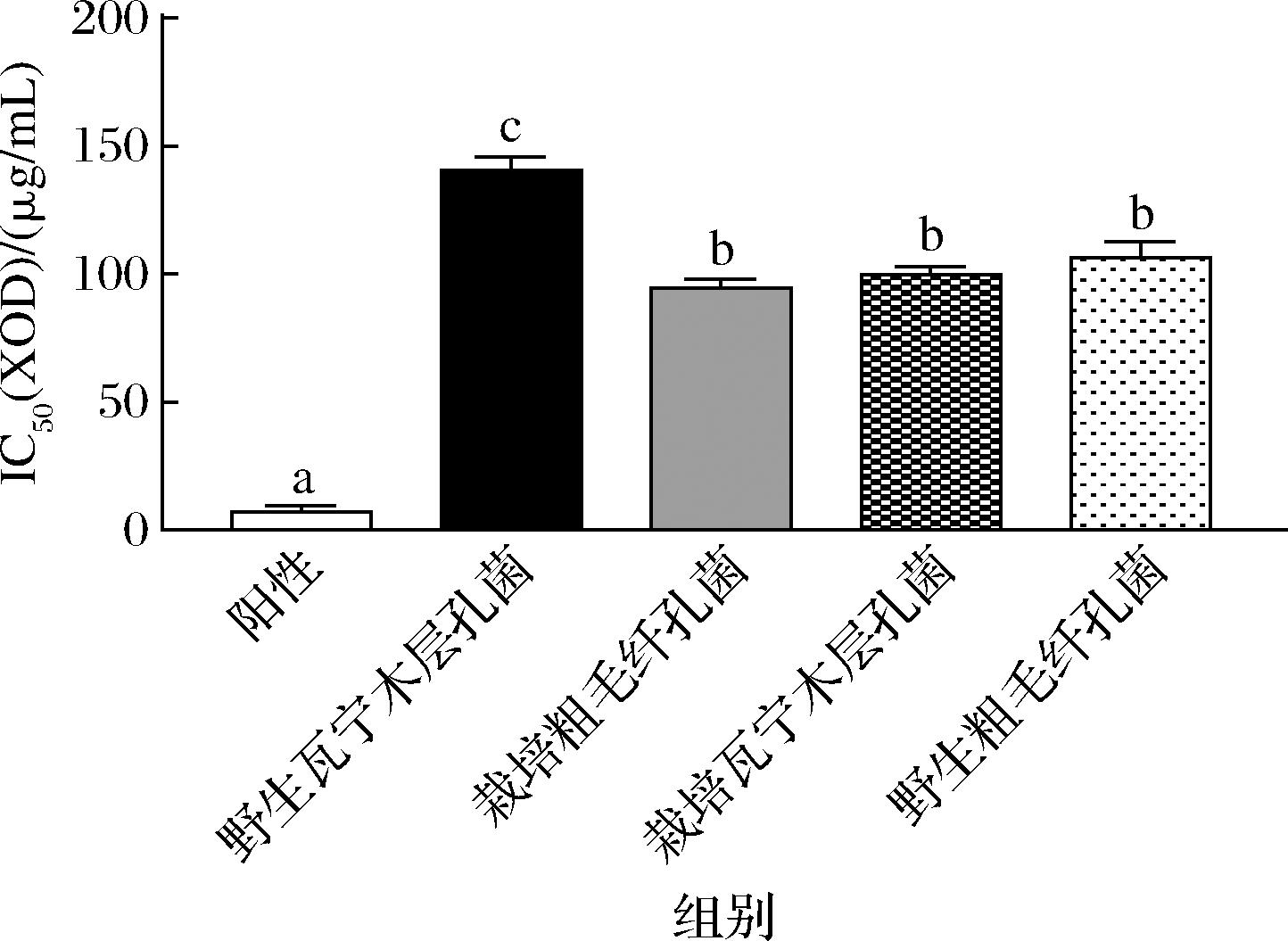
图2 不同来源桑黄游离酚提取物对XOD的抑制作用
Fig.2 Inhibitory effect of free phenol extracts of Sanghuangporus sanghuang from different sources on XOD
2.3 不同XOD添加量对HK-2细胞高UA模型UA含量的影响
不同XOD添加量对HK-2细胞高UA模型UA含量的影响见图3。HK-2模型中缺少XOD,需要将XOD添加到细胞培养基中,使UA的前体物质转化为UA[18],以建立HK-2细胞高UA模型。由图3可知,细胞培养上清液中的UA含量随着酶添加量的增加先增加后逐渐减少,当XOD添加量为0.5 U/mL时,细胞培养上清液UA含量达到(0.189±0.003) mg/mL,因此,本研究将酶添加量0.5 U/mL作为HK-2细胞高UA模型的添加量。
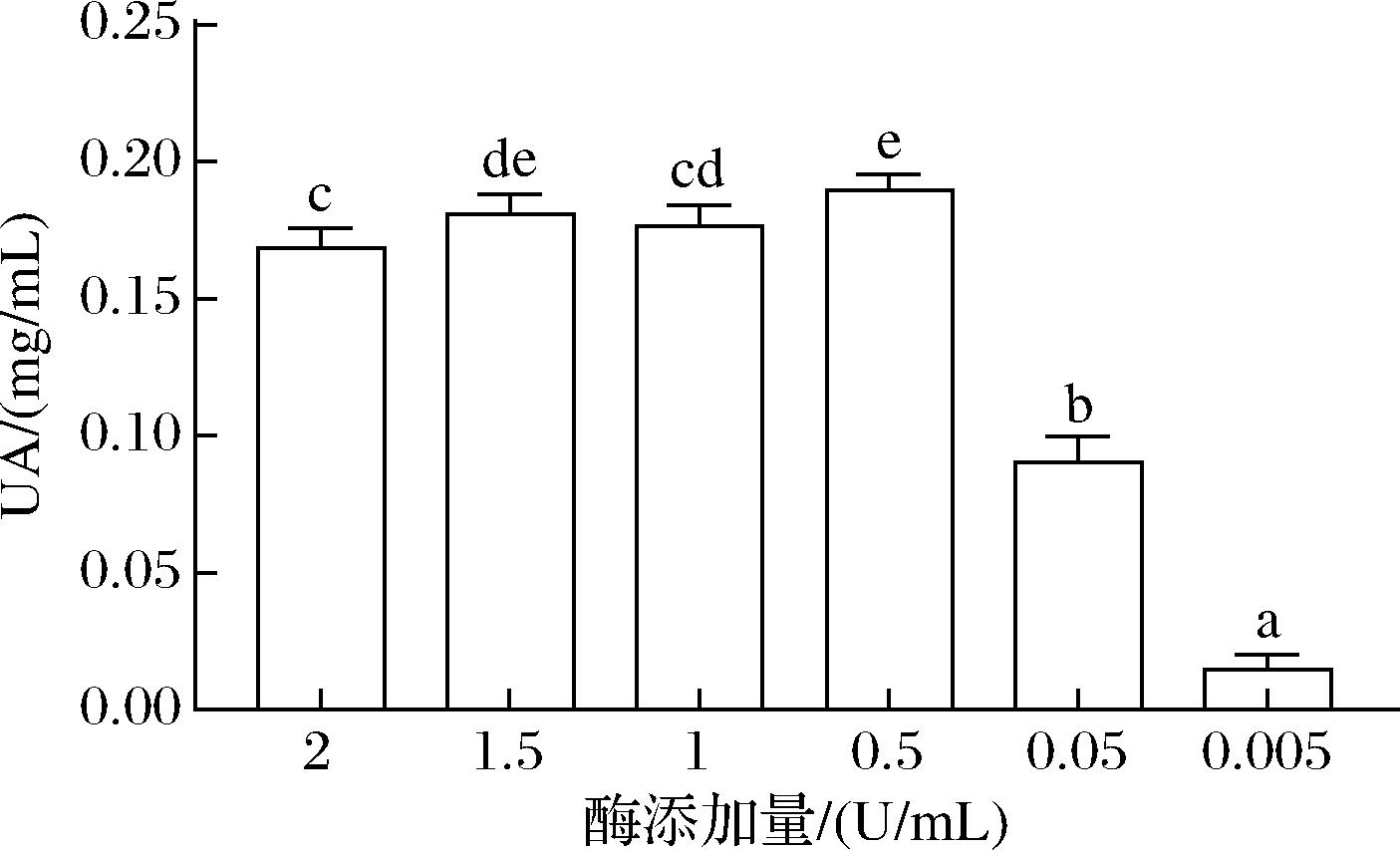
图3 不同酶添加量对HK-2细胞高UA模型UA含量的影响
Fig.3 Effects of different enzyme supplemental levels on UA content on high UA model of HK-2 cell
2.4 不同来源的桑黄游离酚提取物对高UA细胞模型的影响
2.4.1 不同来源的桑黄游离酚提取物对HK-2细胞活力的影响
不同浓度的桑黄游离酚提取物处理HK-2细胞24 h后,细胞存活率见图4-a。由图可知,在400 μg/mL浓度内,各组细胞的存活率保持在90%以上,不同来源的桑黄游离酚提取物对HK-2细胞均没有明显的细胞毒性,可作为降UA活性评价的测试浓度。
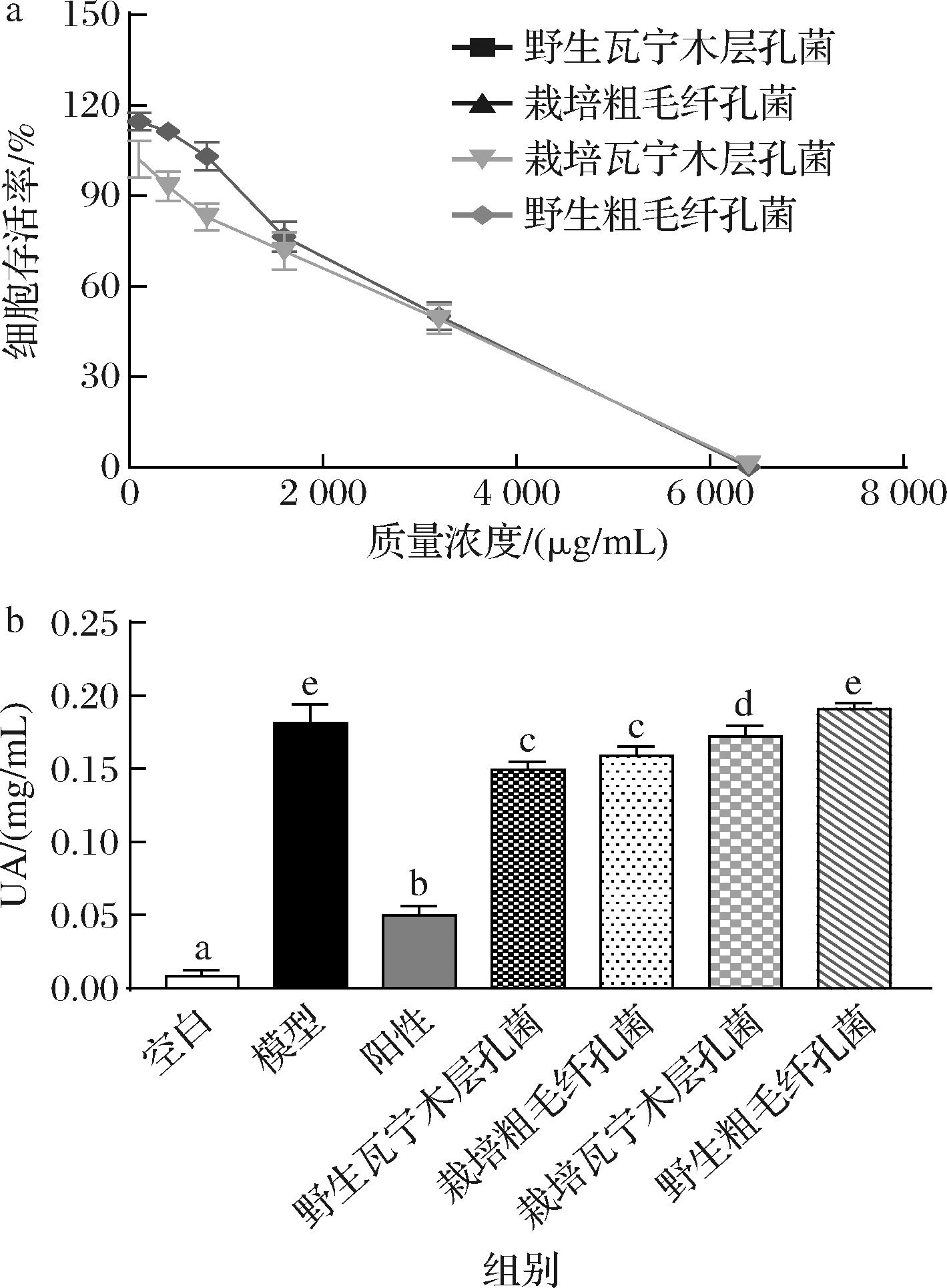
a-对HK-2活力的影响;b-对高UA HK-2模型UA的影响
图4 不同来源的桑黄游离酚提取物对HK-2细胞高UA模型的影响
Fig.4 Effects of free phenol extracts of Sanghuangporus sanghuang from different sources on high UA model of HK-2 cell
2.4.2 不同来源的桑黄游离酚提取物对HK-2细胞高UA模型UA含量的影响
不同来源的桑黄游离酚提取物对HK-2细胞高UA模型UA含量的影响见图4-b,除野生粗毛纤孔菌外,另外3个桑黄游离酚提取物,均具有显著的降UA活性(P<0.05),其中野生瓦宁木层孔菌和栽培粗毛纤孔菌降UA活性更为显著。与模型组[(0.18±0.02) mg/mL]相比,野生瓦宁木层孔菌游离酚提取物作用后,细胞培养上清液的UA含量降低至(0.15±0.01) mg/mL,降低了17.34%;栽培粗毛纤孔菌游离酚提取物作用后,细胞培养上清液的UA含量降低至(0.16±0.01) mg/mL,降低了12.13%。
本研究中由于HK-2为肾小管上皮细胞,主要负责尿酸盐的转运及排泄[19],其内源性XOD较少,当在细胞培养上清液中加入外源性XOD后,模型组的UA含量迅速升高,样品组中野生瓦宁木层孔菌和栽培粗毛纤孔菌与模型组间均存在显著性差异。根据2.2节的结果可知,栽培粗毛纤孔菌的XOD抑制效果优于野生瓦宁木层孔菌,其降UA效果显著的原因可能与其更好地抑制了XOD活性有关。
2.5 栽培粗毛纤孔菌游离酚提取物降UA活性物质基础分析
由不同来源的桑黄游离酚提取物对XOD的抑制作用及其在HK-2细胞高UA模型中发挥降UA活性的结果,筛选出栽培粗毛纤孔菌,并进一步通过UPLC-MS/MS分析其游离酚提取物为降UA活性物质主要的活性化合物(表1),鉴定物质的标准曲线见表2,使用的浓度为0.5~2 000 nmol/L。
表1 栽培粗毛纤孔菌游离酚提取物黄酮类物质信息及含量
Table 1 Information and contents of flavonoids from free phenol extract of cultivated Inonotus hispidus
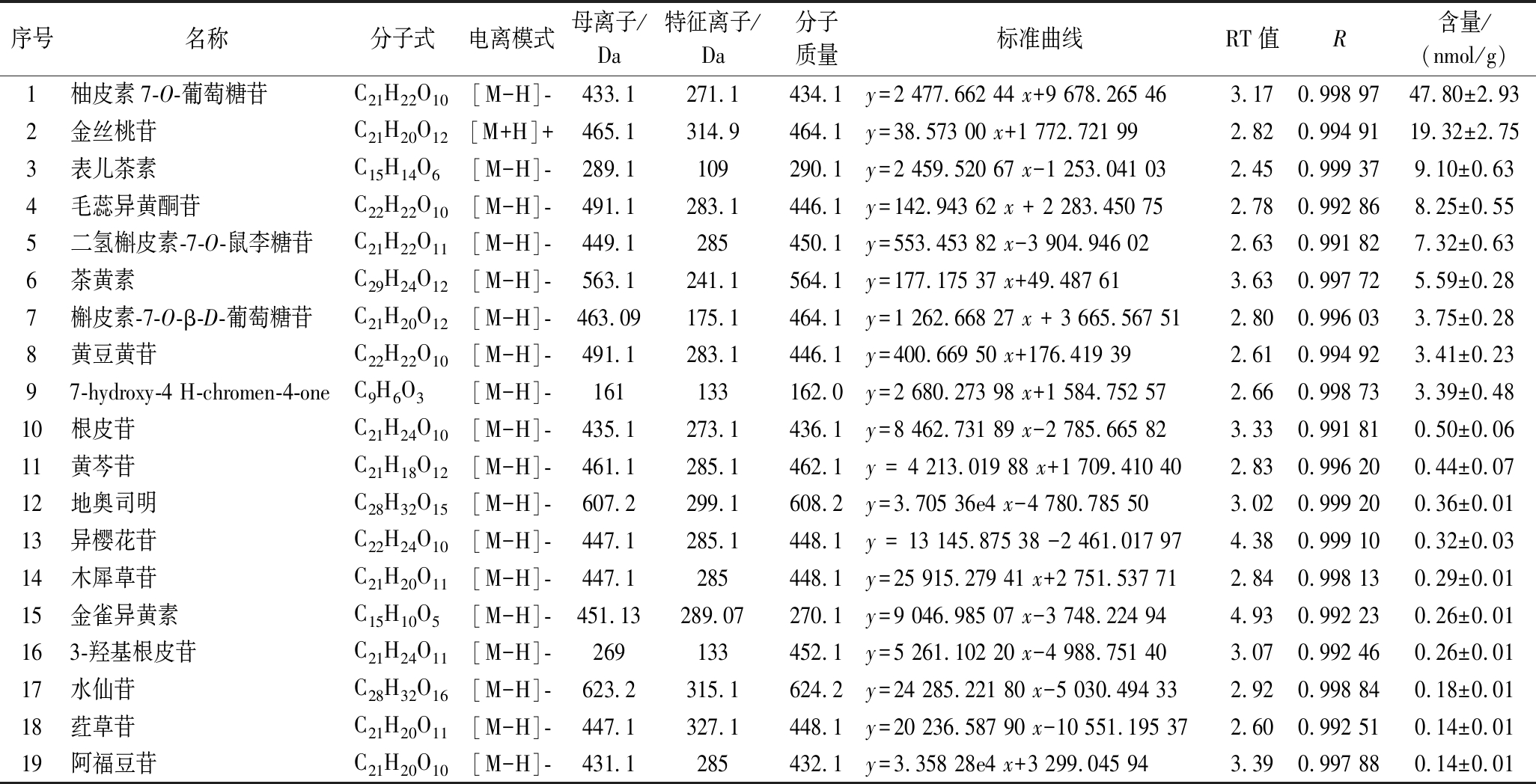
序号名称分子式电离模式母离子/Da特征离子/Da分子质量标准曲线RT值R含量/(nmol/g)1柚皮素7-O-葡萄糖苷C21H22O10[M-H]-433.1271.1434.1y=2 477.662 44 x+9 678.265 463.170.998 9747.80±2.932金丝桃苷C21H20O12[M+H]+465.1314.9464.1y=38.573 00 x+1 772.721 992.820.994 9119.32±2.753表儿茶素C15H14O6[M-H]-289.1109290.1y=2 459.520 67 x-1 253.041 032.450.999 379.10±0.634毛蕊异黄酮苷C22H22O10[M-H]-491.1283.1446.1y=142.943 62 x + 2 283.450 752.780.992 868.25±0.555二氢槲皮素-7-O-鼠李糖苷C21H22O11[M-H]-449.1285450.1y=553.453 82 x-3 904.946 022.630.991 827.32±0.636茶黄素C29H24O12[M-H]-563.1241.1564.1y=177.175 37 x+49.487 613.630.997 725.59±0.287槲皮素-7-O-β-D-葡萄糖苷C21H20O12[M-H]-463.09175.1464.1y=1 262.668 27 x + 3 665.567 512.800.996 033.75±0.288黄豆黄苷C22H22O10[M-H]-491.1283.1446.1y=400.669 50 x+176.419 392.610.994 923.41±0.2397-hydroxy-4 H-chromen-4-oneC9H6O3[M-H]-161133162.0y=2 680.273 98 x+1 584.752 572.660.998 733.39±0.4810根皮苷C21H24O10[M-H]-435.1273.1436.1y=8 462.731 89 x-2 785.665 823.330.991 810.50±0.0611黄芩苷C21H18O12[M-H]-461.1285.1462.1y = 4 213.019 88 x+1 709.410 402.830.996 200.44±0.0712地奥司明C28H32O15[M-H]-607.2299.1608.2y=3.705 36e4 x-4 780.785 503.020.999 200.36±0.0113异樱花苷C22H24O10[M-H]-447.1285.1448.1y = 13 145.875 38 -2 461.017 974.380.999 100.32±0.0314木犀草苷C21H20O11[M-H]-447.1285448.1y=25 915.279 41 x+2 751.537 712.840.998 130.29±0.0115金雀异黄素C15H10O5[M-H]-451.13289.07270.1y=9 046.985 07 x-3 748.224 944.930.992 230.26±0.01163-羟基根皮苷C21H24O11[M-H]-269133452.1y=5 261.102 20 x-4 988.751 403.070.992 460.26±0.0117水仙苷C28H32O16[M-H]-623.2315.1624.2y=24 285.221 80 x-5 030.494 332.920.998 840.18±0.0118荭草苷C21H20O11[M-H]-447.1327.1448.1y=20 236.587 90 x-10 551.195 372.600.992 510.14±0.0119阿福豆苷C21H20O10[M-H]-431.1285432.1y=3.358 28e4 x+3 299.045 943.390.997 880.14±0.01
栽培粗毛纤孔菌游离酚提取物中共鉴定出19个化合物(图5)。将检测到的色谱峰的保留时间(retention time,RT)、母离子、特征离子等信息与迈特维尔数据库中的信息进行比对,对化合物进行初步鉴定,进一步参考标准品的RT值和峰型信息,对检测到的色谱峰进行积分校正,进行定性和定量分析。鉴定的主要黄酮类化合物的含量依次为:柚皮素7-O-葡萄糖苷[(47.80±2.93) nmol/g]、金丝桃苷[(19.32±2.75) nmol/g]、表儿茶素[(9.10±0.63) nmol/g]、毛蕊异黄酮苷[(8.25±0.55) nmol/g]、二氢槲皮素-7-O-鼠李糖苷[(7.32±0.63) nmol/g]及茶黄素[(5.59±0.28) nmol/g]。本研究中部分物质含量较少,在图5中无明显的色谱峰,主要通过积分校正进行定性和定量分析,图中部分响应值较高的物质未能进行鉴定,主要原因是迈特维尔数据库中暂无该物质的基本信息,无法进行比对。有研究表明,黄酮类物质是天然产物中XOD的抑制剂以及缓解高尿酸血症的重要活性物质基础[20]。金丝桃苷通过混合竞争性可逆地抑制XOD,两者相互作用受氢键和范德华力影响,XOD受其影响,α-螺旋及无规则卷曲增加,β-折叠和β-转角减少,并且在结合过程中发生静态荧光猝灭而降低了XOD的荧光强度,从而发挥降UA活性[21]。表儿茶素能够竞争性地抑制XOD活性,抑制率达(51.82±0.19)%[22]。茶黄素也可以抑制XOD活性,减少UA产生[23];并且茶黄素能上调NPT4、GLUT9的mRNA表达,降低OAT1、OAT2蛋白的表达,增加GLUT9蛋白的表达,从而发挥降UA的作用[24]。黄岑苷可以与XOD的活性中心结合,从而阻止次黄嘌呤和黄嘌呤的进入,达到抑制XOD活性的作用[25]。木犀草苷可以使XOD酪氨酸残基的疏水性增加,其二级结构的含量发生变化,α螺旋增加,进而降低了催化活性[26];能够降低尿酸盐转运蛋白1(human urate transporter 1,URAT1)的水平,具有显著的XOD抑制活性[27],增加UA排泄[28]。此外,地奥司明也可以有效降低血清尿酸水平[29]。
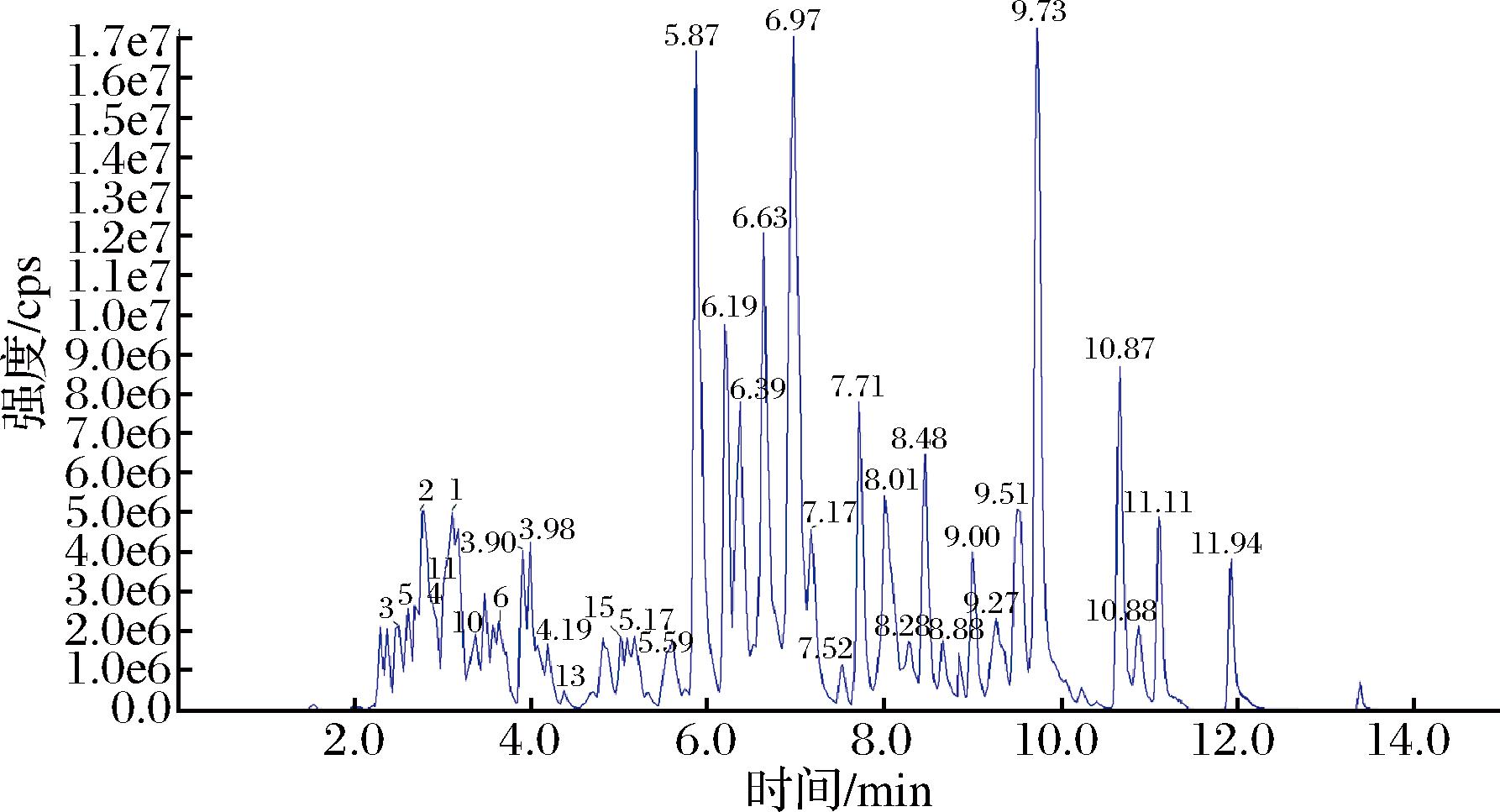
图5 栽培粗毛纤孔菌游离酚提取物总离子流色谱图
Fig.5 Total ion current chromatography of free phenol extract from cultivated Inonotus hispidus
3 结论
4个不同来源的桑黄中栽培粗毛纤孔菌的游离酚提取物中多酚含量显著高于其他3个桑黄样品,桑黄菌种及生长环境的影响可能是其差异的主要原因。栽培粗毛纤孔菌、栽培瓦宁木层孔菌及野生粗毛纤孔菌对XOD具有较强的抑制活性,而野生瓦宁木层孔菌和栽培粗毛纤孔菌具有更强的降UA活性。对降UA强活性的栽培粗毛纤孔菌游离酚提取物的生物活性物质分析,发现黄酮类物质中金丝桃苷、表儿茶素、茶黄素、地奥司明及木犀草苷等可能是其中发挥降UA活性的部分主要活性物质。
[1] BECKER M A, JOLLY M.Hyperuricemia and associated diseases[J].Rheumatic Diseases Clinics of North America, 2006, 32(2):275-293.
[2]  LVAREZ-LARIO B, ALONSO-VALDIVIELSO J L.Hyperuricemia and gout;the role of diet[J].Nutricion Hospitalaria, 2014, 29(4):760-770.
LVAREZ-LARIO B, ALONSO-VALDIVIELSO J L.Hyperuricemia and gout;the role of diet[J].Nutricion Hospitalaria, 2014, 29(4):760-770.
[3] ROOS N J, DUTHALER U, BOUITBIR J, et al.The uricosuric benzbromarone disturbs the mitochondrial redox homeostasis and activates the NRF2 signaling pathway in HepG2 cells[J].Free Radical Biology and Medicine, 2020, 152:216-226.
[4] 王豪, 钱坤, 司静, 等.桑黄类真菌多糖研究进展[J].菌物学报, 2021, 40(4):895-911.WANG H, QIAN K, SI J,et al.Research advances on polysaccharides from Sanghuang[J].Mycosystema, 2021, 40(4):895-911.
[5] HE P Y, ZHANG Y, LI N.The phytochemistry and pharmacology of medicinal fungi of the genus Phellinus:A review[J].Food and Function, 2021, 12(5):1856-1881.
[6] 李醒, 褚夫江, 蒋诗林, 等.桑黄乙醇提取物对大鼠尿酸代谢及肠道微生物影响的初步研究[J].中国中药杂志, 2021, 46(1):177-182.LI X, CHU F J, JIANG S L, et al.Preliminary study on effect of Phellinus igniarius ethanol extract on serum uric acid metabolism and gut microbiome in rats[J].China Journal of Chinese Materia Medica, 2021, 46(1):177-182.
[7] CHENG J W, SONG J L, WANG Y B, et al.Conformation and anticancer activity of a novel mannogalactan from the fruiting bodies of Sanghuangporus sanghuang on HepG2 cells[J].Food Research International, 2022, 156:111336.
[8] PANG D R, YOU L J, ZHOU L, et al.Averrhoa carambola free phenolic extract ameliorates nonalcoholic hepatic steatosis by modulating mircoRNA-34a, mircoRNA-33 and AMPK pathways in leptin receptor-deficient db/db mice[J].Food and Function, 2017, 8(12):4496-4507.
[9] S NCHEZ-HERN
NCHEZ-HERN NDEZ S, ESTEBAN-MU
NDEZ S, ESTEBAN-MU OZ A, SAMANIEGO-S
OZ A, SAMANIEGO-S NCHEZ C, et al.Study of the phenolic compound profile and antioxidant activity of human milk from Spanish women at different stages of lactation:A comparison with infant formulas[J].Food Research International, 2021, 141:110149.
NCHEZ C, et al.Study of the phenolic compound profile and antioxidant activity of human milk from Spanish women at different stages of lactation:A comparison with infant formulas[J].Food Research International, 2021, 141:110149.
[10] 王蕙. 银杏黄酮类化合物的提取及免疫功能的研究[D].大连:大连工业大学, 2009.WANG H.Studies on the immune function and extraction of flavones from ginkgo lcaves[D].Dalian:Dalian Polytechnic University, 2009.
[11] 张晨辉. 短管兔耳草化学成分及其对XOD的抑制活性研究[D].南昌:江西中医药大学, 2019.ZHANG C H. Chemical constituents of lagotis brevituba maxim and their inhibitory effects on XOD[D].Nanchang:Jiangxi University of Traditional Chinese Medicine, 2019.
[12] TANG J, DIAO P, SHU X H, et al.Quercetin and quercitrin attenuates the inflammatory response and oxidative stress in LPS-induced RAW264.7 cells:In vitro assessment and a theoretical model[J].BioMed Research International, 2019, 2019:7039802.
[13] WANG M, CHEN D Q, CHEN L, et al.Novel inhibitors of the cellular renin-angiotensin system components, poricoic acids, target Smad3 phosphorylation and Wnt/β-catenin pathway against renal fibrosis[J].British Journal of Pharmacology, 2018, 175(13):2689-2708.
[14] HOU C L, LIU D, WANG M, et al.Novel xanthine oxidase-based cell model using HK-2 cell for screening antihyperuricemic functional compounds[J].Free Radical Biology and Medicine, 2019, 136:135-145.
[15] DI PAOLA-NARANJO R D, S NCHEZ-S
NCHEZ-S NCHEZ J, GONZ
NCHEZ J, GONZ LEZ-PARAM
LEZ-PARAM S A M, et al.Liquid chromatographic-mass spectrometric analysis of anthocyanin composition of dark blue bee pollen from Echium plantagineum[J].Journal of Chromatography A, 2004, 1054(1-2):205-210.
S A M, et al.Liquid chromatographic-mass spectrometric analysis of anthocyanin composition of dark blue bee pollen from Echium plantagineum[J].Journal of Chromatography A, 2004, 1054(1-2):205-210.
[16] ACEVEDO DE LA CRUZ A, HILBERT G, RIVIÉRE C, et al.Anthocyanin identification and composition of wild Vitis spp.accessions by using LC-MS and LC-NMR[J].Analytica Chimica Acta, 2012, 732:145-152.
[17] DE FERRARS R M, CZANK C, SAHA S, et al.Methods for isolating, identifying, and quantifying anthocyanin metabolites in clinical samples[J].Analytical Chemistry, 2014, 86(20):10052-10058.
[18] GLIOZZI M, MALARA N, S.MUSCOLIS, et al.The treatment of hyperuricemia[J].International Journal of Cardiology, 2016, 213:23-27.
[19] FATHALLAH-SHAYKH S A, CRAMER M T.Uric acid and the kidney[J].Pediatric Nephrology, 2014, 29(6):999-1 008.
[20] YUAN L Y, BAO Z J, MA T C, et al.Hypouricemia effects of corn silk flavonoids in a mouse model of potassium oxonated-induced hyperuricemia[J].Journal of Food Biochemistry, 2021:e13856.
[21] 王敏, 徐国辉, 赵一灵, 等.金丝桃苷对黄嘌呤氧化酶的抑制作用及分子机理[J].食品工业科技, 2022, 43(12):92-99.WANG M, XU G H, ZHAO Y L, et al.Inhibition effect and molecular mechanism of hypericin on xanthine oxidase[J].Science and Technology of Food Industry, 2022, 43(12):92-99.
[22] WU Z Y, ZHANG H, LI F, et al.Evaluation of xanthine oxidase inhibitory activity of flavonoids by an online capillary electrophoresis-based immobilized enzyme microreactor[J].Electrophoresis, 2020, 41(15):1326-1332.
[23] PELUSO I, SERAFINI M.Antioxidants from black and green tea:From dietary modulation of oxidative stress to pharmacological mechanisms[J].British Journal of Pharmacology, 2017, 174(11):1195-1208.
[24] 周启蒙, 赵晓悦, 王海港, 等.茶黄素降低高尿酸血症小鼠血清尿酸的作用与机制探究[J].中国新药杂志, 2018, 27 (14):1631-1638.ZHOU Q M, ZHAO X Y, WANG H G, et al.Mechanism and uric acid reducing effects of theaflavin on potassium oxonate-induced hyperuricemia in mice[J].Chinese Journal of New Drugs, 2018, 27(14):1631-1638.
[25] 刘永杰. 黄芩苷抗高尿酸血症肾病的作用及机制研究[D].武汉:武汉轻工大学, 2020.LIU Y J.Study on the effect and mechanism of baicalin against hyperuricemia nephropathy[D].Wuhan:Wuhan Polytechnic University, 2020.
[26] 闫家凯. 木犀草素对黄嘌呤氧化酶、α-葡萄糖苷酶抑制机理的探讨[D].南昌:南昌大学, 2014.YAN J K.Study on the inhibition mechanism of luteolion on xanthine oxidase and α-glucesidase[D].Nanchang:Nanchang University, 2014.
[27] SONG H P, ZHANG H, FU Y, et al.Screening for selective inhibitors of xanthine oxidase from Flos Chrysanthemum using ultrafiltration LC-MS combined with enzyme channel blocking[J].Journal of Chromatography. B, Analytical Technologies in the Biomedical and Life Sciences,2014, 961:56-61.
[28] LIN Y, LIU P G, LIANG W Q, et al.Luteolin-4′-O-glucoside and its aglycone, two major flavones of Gnaphalium affine D.Don, resist hyperuricemia and acute gouty arthritis activity in animal models[J].Phytomedicine, 2018, 41:54-61.
[29] PRABHU V V, SATHYAMURTHY D, RAMASAMY A, et al.Evaluation of protective effects of diosmin (a citrus flavonoid) in chemical-induced urolithiasis in experimental rats[J].Pharmaceutical Biology, 2016, 54(9):1513-1521.