糖尿病是以高血糖代谢为特征的代谢紊乱性疾病[1]。随着人民生活方式改善和营养水平的提高,糖尿病的患病率不断攀升并呈现年轻化趋势,严重威胁人类健康[2],也极大增加了患病家庭经济负担,为社会经济带来巨大冲击。寻找安全、无毒副作用且能有效预防和改善糖尿病的手段,是全球亟待解决的问题[3]。目前,除了许多预防和改善糖代谢紊乱的药物外,在研究天然活性产物改善糖尿病方面也取得了重要进展。α-葡萄糖苷酶通过水解葡萄糖苷键释放出葡萄糖,在维持血糖平衡方面发挥着重要作用[4]。大量研究表明,多酚类化合物可以通过抑制α-葡萄糖苷酶的活性改善糖尿病及其并发症[5]。
芦荟大黄素(aloe-emodin, AE)是一种天然多酚化合物,广泛存在于芦荟等植物中,具有抗癌、抗炎和肝脏保护活性等多种作用[6],可用作保健食品添加剂。有研究表明AE可以通过减轻小鼠的胰岛素抵抗作用来调节体内血糖水平[7]。但AE通过影响α-葡萄糖苷酶活性进而调控体内血糖的研究尚未报道。因此,本文通过酶抑制实验、多光谱实验和分子对接实验研究AE与α-葡萄糖苷酶的相互作用及机理,为AE作为糖尿病辅助治疗的新食品资源的开发提供依据。
1 材料与方法
1.1 材料与试剂
AE(纯度≥97%),上海源叶生物科技有限公司;α-葡萄糖苷酶(来自酿酒酵母,规格100U),合肥博美生物科技有限责任公司;4-硝基-苯基-α-D-吡喃葡萄糖苷(4-nitrophenyl β-D-glucopyranoside,pNPG)、阿卡波糖,阿拉丁化工有限公司;其他试剂均为分析纯。
1.2 仪器与设备
UV-2600紫外可见分光光度计,日本Shimadzu公司;Cary eclipse荧光分光光度计,美国Agilent公司;VERTEX70傅里叶红外变换光谱仪,德国Bruker公司;多功能酶标仪,美国Bio-Rad公司;722 N可见分光光度计,上海仪电分析仪器有限公司;HH-2数显恒温水浴锅,江苏科析仪器有限公司。
1.3 酶活性抑制
1.3.1 α-葡萄糖苷酶活性测定
AE对α-葡萄糖苷酶活性的抑制率按照姚芬[8]的实验方法并进行修改。将50 μL不同质量浓度(0.01~0.1 mg/mL)的AE加入到50 μL的α-葡萄糖苷酶溶液(0.5 U/mL)中,在37 ℃条件下振荡反应10 min后,加入50 μL的pNPG(5 mmol/L),继续振荡反应30 min,最后加入50 μL的Na2CO3(1 mol/L)终止反应,并在405 nm处测量吸光度。选用阿卡波糖作为阳性对照,AE和阿卡波糖对α-葡萄糖苷酶的抑制率(%)计算如公式(1)所示:
抑制率![]()
(1)
式中:A1、A2、A3和A4分别表示空白对照组、空白对照背景组,样品组和样品背景的吸光度。
1.3.2 抑制动力学分析
按照王梦婷[9]的方法并进行修改。在α-葡萄糖苷酶溶液(0.5 U/mL)中加入不同浓度(0、0.1、0.3 mmol/L)的AE,于37 ℃振荡反应10 min后,在405 nm处测定吸光度;不同浓度(0.5、1、2、3、5、10 mmol/L)的pNPG,反应30 min后于405 nm处测量吸光度。根据实验结果绘制Lineweaver-Burk双倒数图,并根据Lineweaver-Burk方程[公式(2)]判断AE对α-葡萄糖苷酶的抑制类型:
(2)
式中:v表示反应速率;[S]表示底物浓度;[I]表示AE的浓度;Vmax表示最大反应速率;Km代表米氏常数;Kic表示抑制剂与酶的解离常数;Kiu表示抑制剂与酶和底物复合物的解离常数。
1.4 紫外-可见吸收光谱法
按照HUANG等[10]的实验方法并进行修改。在185~700 nm波长进行全波长扫描,扫描精度为1.0 nm。测定α-葡萄糖苷酶溶液,AE溶液,α-葡萄糖苷酶与AE的混合溶液3组溶液的吸光度,分析紫外吸收光谱的差异。
1.5 荧光猝灭光谱
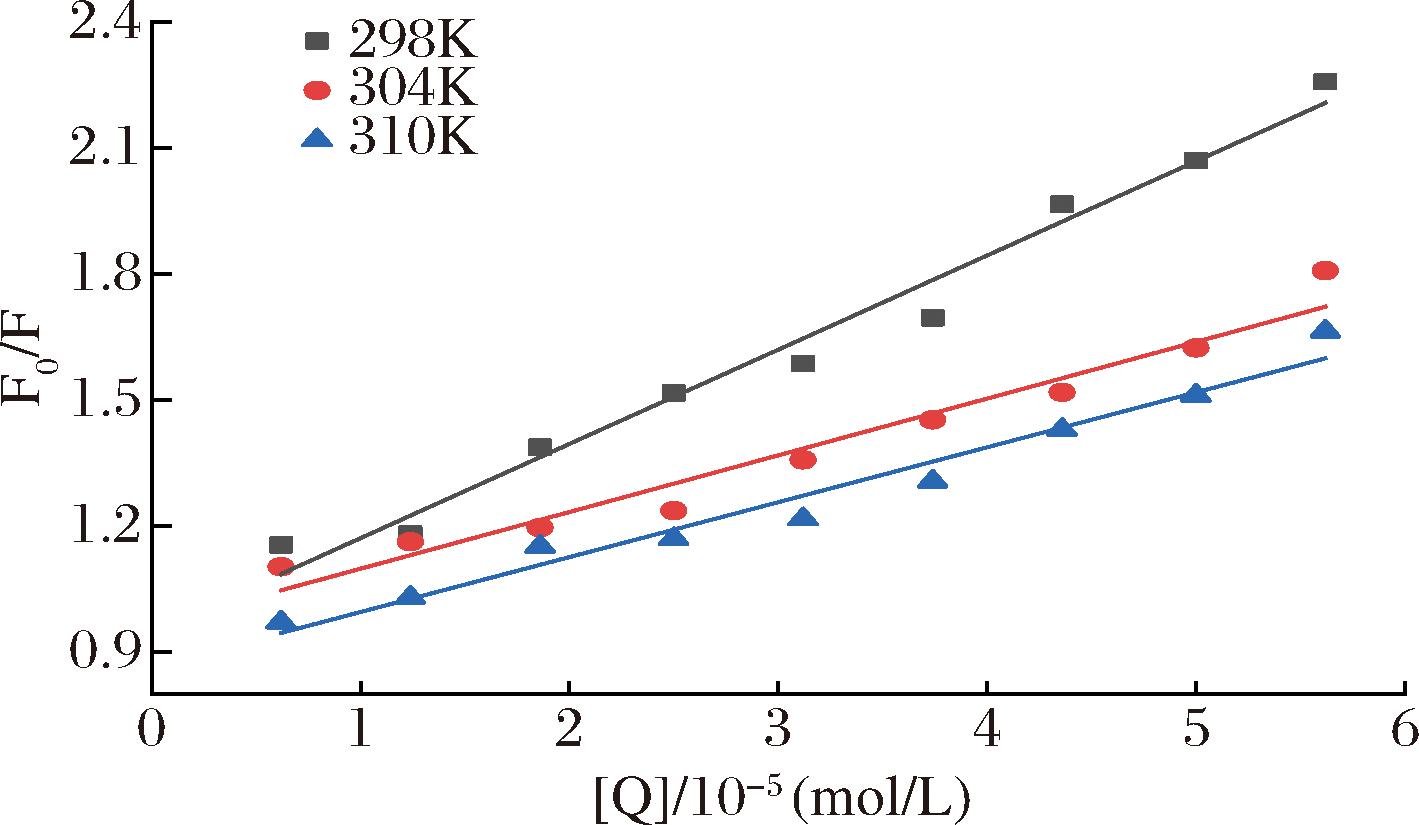
荧光光谱实验按照曹舒云等[11]的方法并稍作修改。将不同浓度的AE(0、0.12×10-4、0.25×10-4、0.37×10-4、0.50×10-4、0.62×10-4、0.75×10-4、0.87×10-4、1.00×10-4、1.12×10-4 mol/L,分别对应图3、图4中1→10AE浓度)与α-葡萄糖苷酶溶液(0.5 U/mL)混合,分别在不同温度(298、304、310 K)反应15 min后测定其荧光强度。测定参数如下:激发波长为280 nm,发射波长为300~500 nm,激发、发射狭缝的宽度均为5 nm,扫描速度为600 nm/min。
AE对酶的猝灭类型通过Stern-Volmer方程[公式(3)]判断:
(3)
式中:F0和F分别表示加入AE前后酶的荧光强度;[Q]是AE的浓度;Kq和Ksv分别表示猝灭速率常数和猝灭常数;τ0表示未加入AE时α-葡萄糖苷酶的平均荧光寿命。
根据公式(4)获得AE与酶相互作用的结合常数K和结合位点n:
(4)
根据公式(5)和公式(6)计算出AE和α-葡萄糖苷酶的结合过程中吉布斯自由能变化(ΔG)、焓变化(ΔH)和熵变化(ΔS),以确定结合过程中的主要作用力类型:
(5)
ΔG=ΔH-TΔS
(6)
式中:R表示气体常数;K表示结合常数;T表示实验温度。
1.6 同步荧光光谱法
在298 K下进行。用于测量的参数如下[12]:固定激发波长和发射波长间距为15 nm和60 nm,激发波长范围为200~500 nm,其他实验条件与1.5节相同。
1.7 三维荧光光谱分析
在298 K下进行。用于测量的参数如下[13]:激发波长为200~400 nm,发射测量为200~500 nm,激发波长速度为5 nm,其他实验条件与1.5节相同。
1.8 傅里叶变换红外光谱
在4 000~400 cm-1范围内测量α-葡萄糖苷酶加入和不加入AE的傅里叶变换红外光谱(Fourier transform infrared spectroscopy, FT-IR),光谱的分辨率为4 cm-1,扫描次数为60次[14]。
1.9 分子对接模拟
α-葡糖糖苷酶(PDB ID:3A4A,来自酿酒酵母)[15]的3D结构模型可以从蛋白质数据库(http://www.rcsb.org/)下载,从PubChem数据库中获得AE的结构,所有分子构象文件以PDB格式保存。利用PyMOL(1.5.0.3)对晶体结构进行预处理,Autodock(4.2.6)用于分子对接操作。对接方法采用柔性对接,在分子对接过程中,均以受体几何中心为对接盒子(grid box)的中心点,设置盒子尺寸为126 Å×126 Å×126 Å,搜索参数选用拉马遗传基因算法(Lamarckian genetic algorithm, LGA),算法对接的轮数(number of GA runs)设为100,能量评估的最大数目(maximum number of evals)设为250 000,其他参数取默认值。对接完成后取能量最低的结果通过PyMOL和Discovery Studio软件对结合位点进行可视化分析。
1.10 统计分析
实验均重复3次,结果表示为“平均值±标准误差”。使用Origin 2018软件进行绘图,通过SPSS 25.0对数据进行统计分析,P<0.05被认为具有统计学意义。
2 结果与分析
2.1 酶活性实验
2.1.1 AE对α-葡萄糖苷酶活性的抑制作用
AE的α-葡萄糖苷酶抑制活性如图1所示。当抑制剂质量浓度达到0.057 mg/mL时,AE对α-葡萄糖苷酶的抑制率达到80%,AE的IC50值[(0.031±0.001) mg/mL]显著低于阿卡波糖[(2.575±0.012) mg/mL](P<0.05),说明AE对α-葡萄糖苷酶的抑制作用显著高于阿卡波糖。SUN等[16]研究青苹果多酚也得出了类似的结果。多酚与酶结合后,其羟基可与酶分子中氨基酸残基之间形成氢键,或多酚本身共轭的结构可以与酶形成高度共轭体系,进而抑制酶的活性[17]。
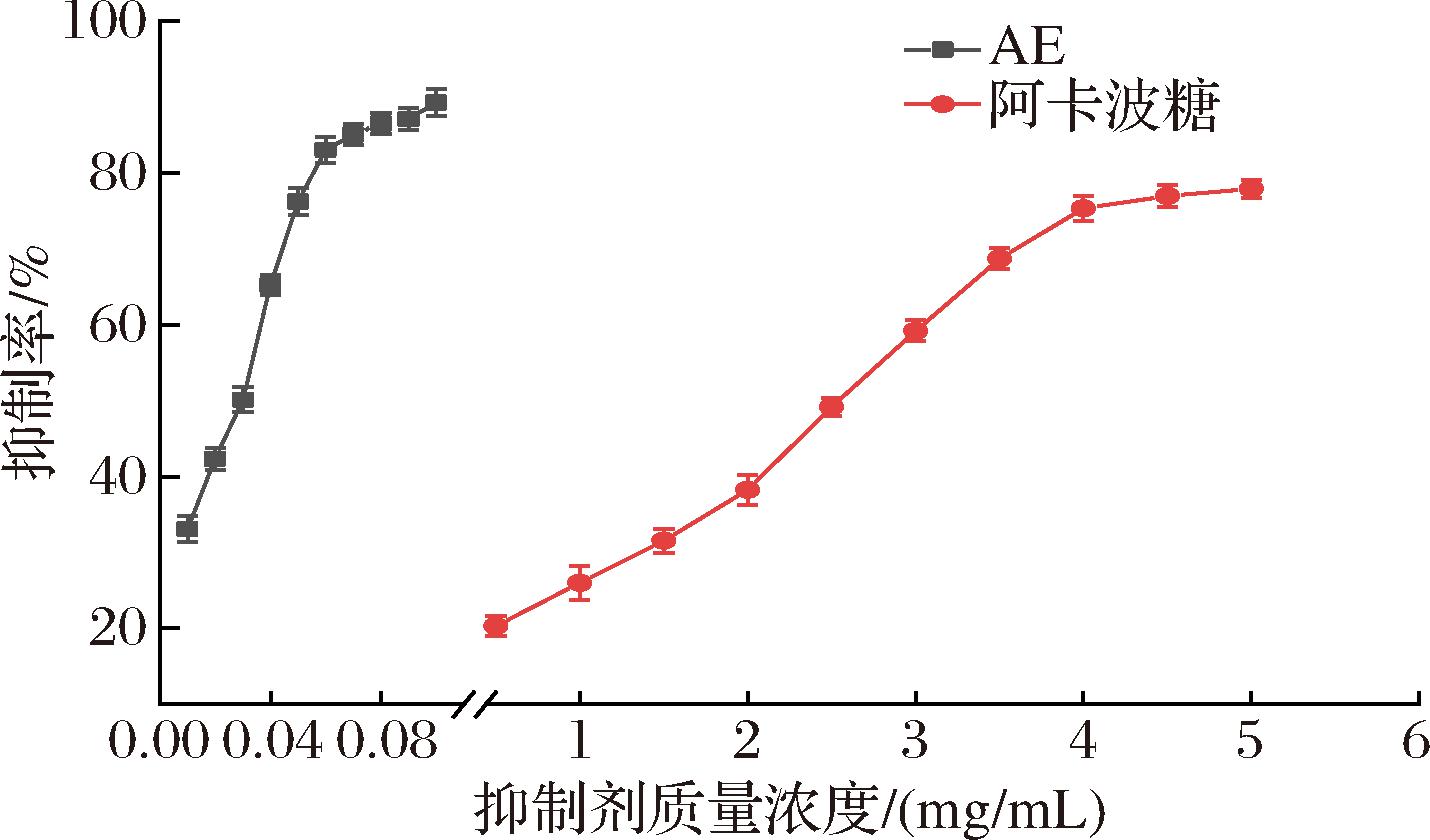
图1 AE和阿卡波糖对α-葡萄糖苷酶的抑制作用
Fig.1 Inhibitory effect of AE and acarbose on the activity of α-glucosidase
2.1.2 酶反应动力学分析
根据Lineweaver-Burk双倒数作图,AE对α-葡萄糖苷酶的活性抑制作用如图2所示。从图2中可以看出,双倒数曲线的交点不在坐标轴上,而是在第二象限中,并且随着AE的添加量的增加,X轴的截距减小、Y轴的截距增加。可以判断出AE对α-葡萄糖苷酶的抑制类型是混合型抑制[18],这说明AE既可以与酶结合,又可以与酶-底物复合物结合[19]。对混合型抑制进一步分析,Kic(AE与酶的解离常数)值为0.309 mmol/L,而Kiu(AE与酶-底物复合物的解离常数)的值为0.125 mmol/L。解离常数越小,说明与抑制剂的结合效果越强[20],说明AE与酶-底物复合物结合的可能性要大于与游离酶结合的可能性。
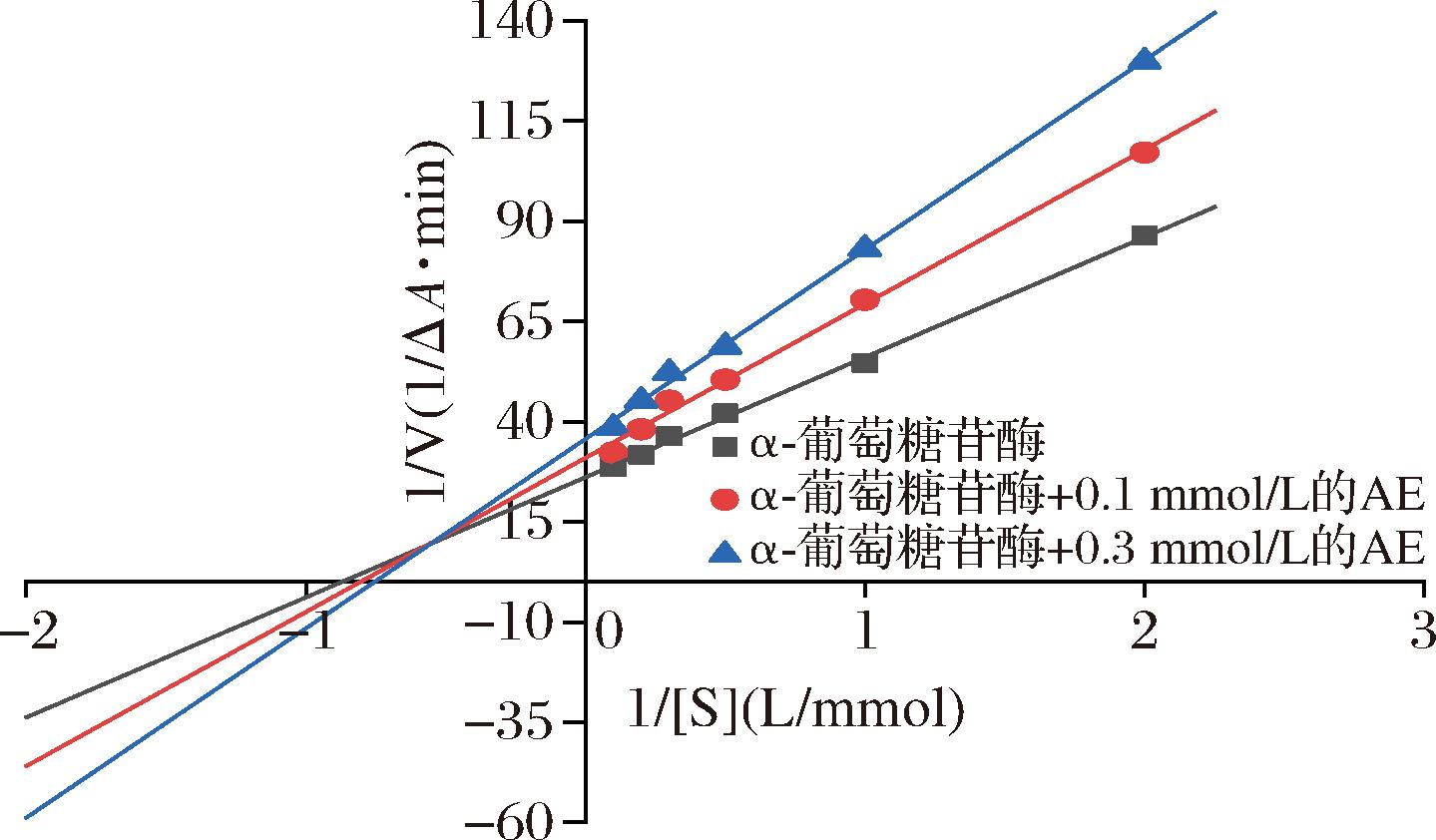
图2 AE抑制α-葡萄糖苷酶的Lineweaver-Burk曲线
Fig.2 Lineweaver-Burk curve of inhibitory effect of AE on α-glucosidase
2.2 紫外吸收光谱分析
蛋白质分子中芳香族氨基酸残基的微环境变化会改变蛋白质的紫外吸收。从图3可以看出,α-葡萄糖苷酶在279 nm处有一个特征吸收峰,该峰反映的是酶中的荧光基团的紫外吸收[21],加入AE后,特征峰从279 nm红移到了283 nm,吸收峰的强度明显增强,曲线D和曲线C并不重合。说明AE与α-葡萄糖苷酶相互作用并结合形成了复合物,改变了荧光基团的微环境,导致酶的构象发生了变化[22]。
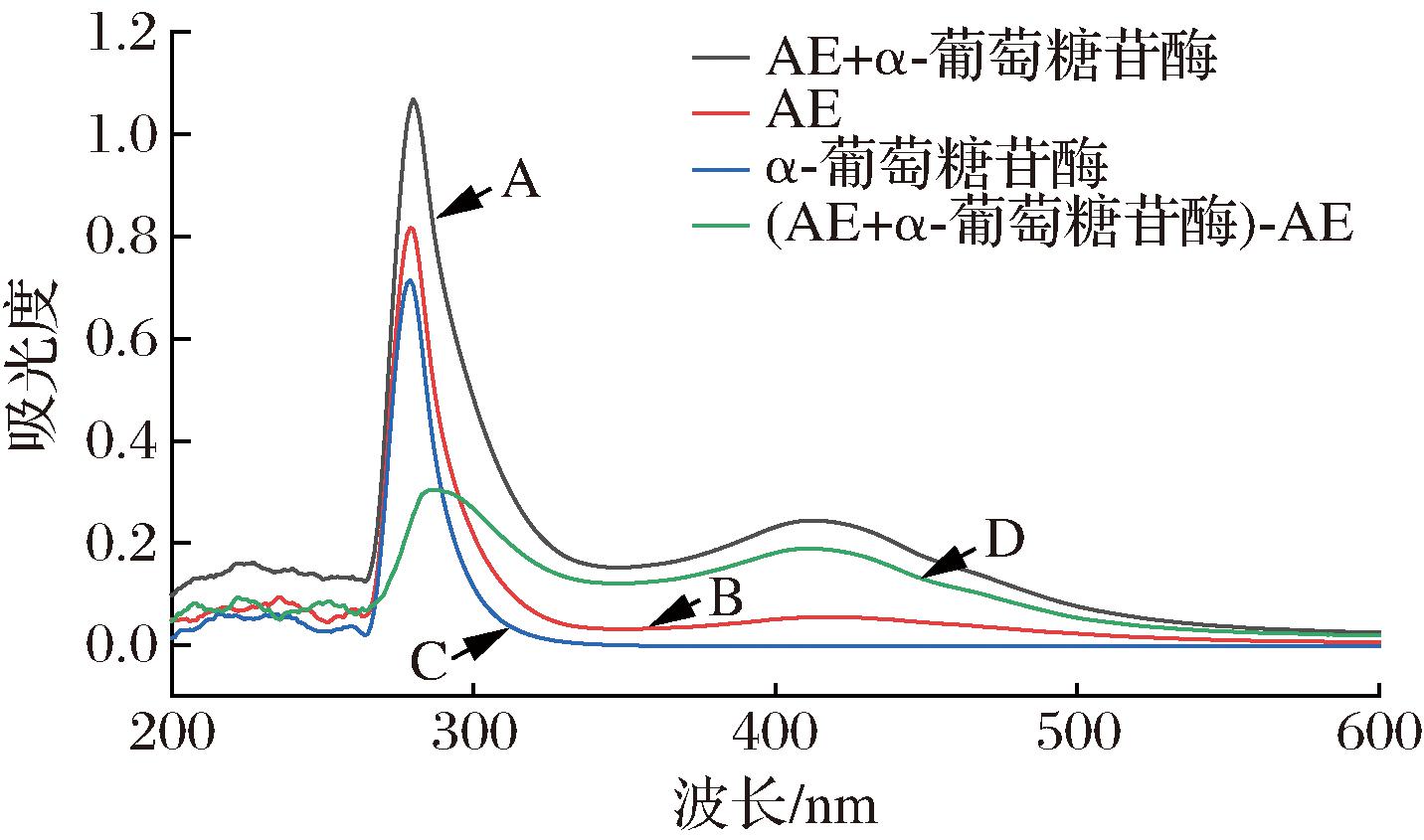
图3 298 K下α-葡萄糖苷酶与AE(1.00×10-4 mol/L)相互作用的紫外可见吸收光谱
Fig.3 UV-Vis absorption spectra for the interaction between α-glucosidase and AE (1.00×10-4 mol/L) at 298 K
2.3 荧光猝灭光谱
2.3.1 AE对α-葡萄糖苷酶的猝灭类型
在蛋白质中的色氨酸(tryptophan, Trp)和酪氨酸(tyrosine, Tyr)是主要的荧光基团,酶和小分子之间的相互作用会改变Trp和Tyr残基的微环境,从而导致荧光降低[23]。α-葡萄糖苷酶在不同浓度的AE作用下的荧光光谱如图4所示。随着AE浓度的增加,α-葡萄糖苷酶的荧光强度逐渐减弱,最大发射波长(λmax)从341 nm红移到352 nm。表明AE可能与酶发生了相互作用,并与蛋白质结合形成了复合物,使荧光基团发生了荧光猝灭[24]。
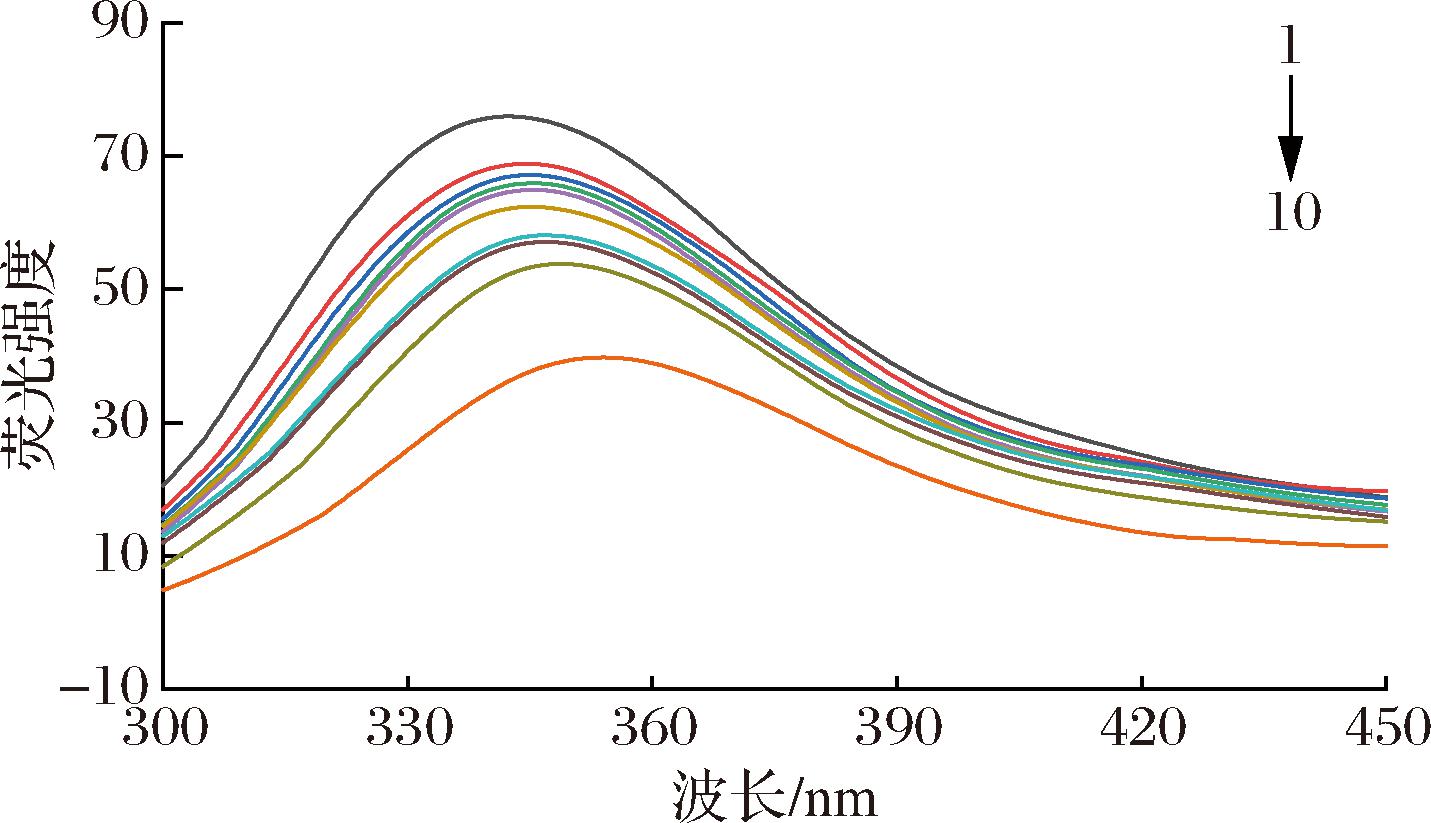
图4 298 K下α-葡萄糖苷酶与不同浓度AE相互作用的荧光光谱
Fig.4 Fluorescence spectra of α-glucosidase interacting with different concentrations of AE at 298 K
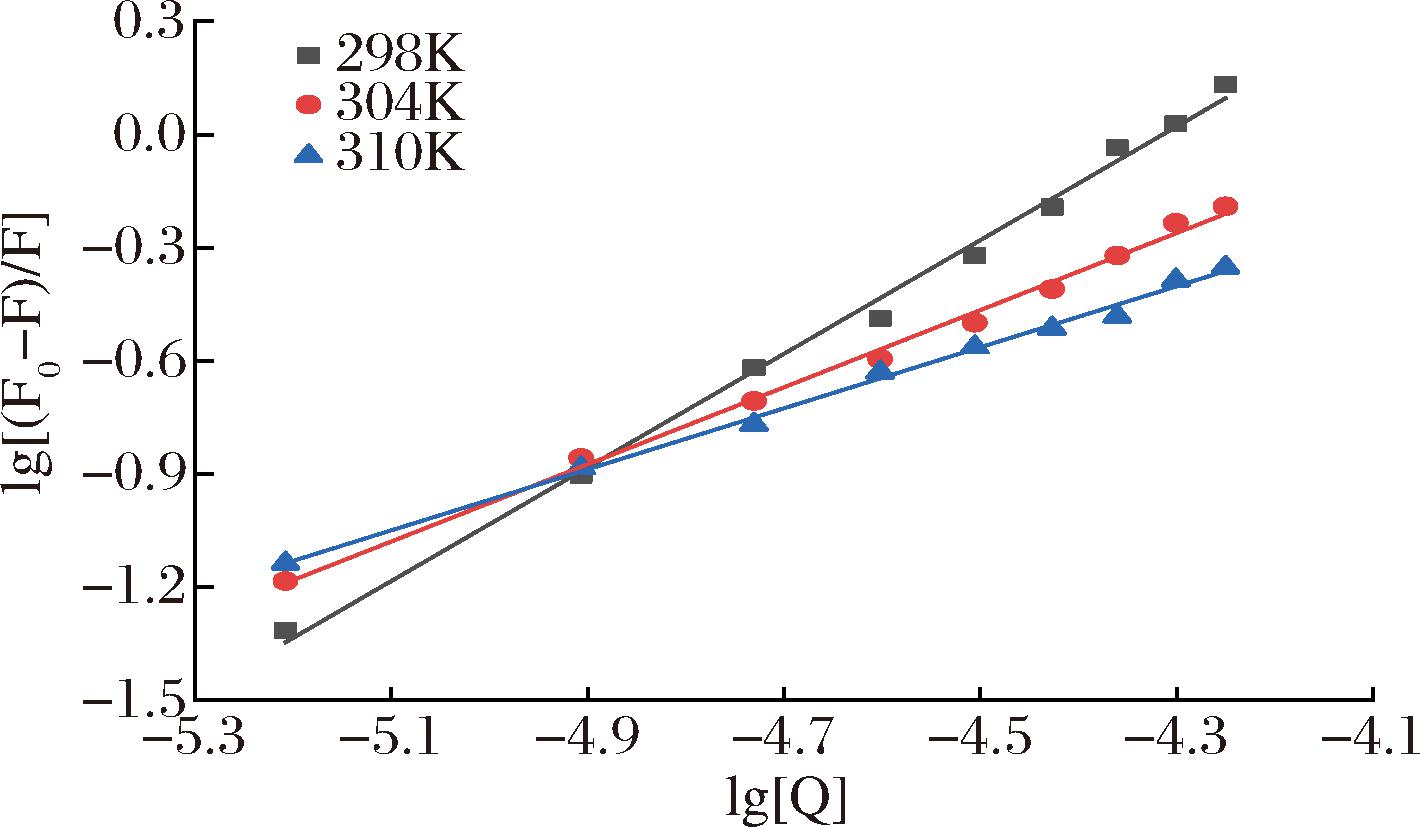
根据Stern-Volmer方程得到Stern-Volmer图(https://doi.org/10.13995/j.cnki.11-1802/ts.036611)进而获得的Kq、Ksv与温度的关系(表1)。从表中可以看出Kq、Ksv与实验温度成反比,二者的值随实验温度的升高而下降。除此之外,Kq的值大于2.0×1010(最大扩散碰撞速率常数),由此判断AE对α-葡萄糖苷酶的猝灭机制是静态猝灭[25]。
表1 三种温度下AE与α-葡萄糖苷酶相互作用的猝灭常数、结合常数、结合位点数和热力学参数
Table 1 Quenching constant, binding constants, number of binding sites, and thermodynamic parameters for the interaction between AE and α-glucosidase at three temperatures

温度/KKsv/(L/ mol)Kq/(L/mol·S)结合常数/(L/mol)结合位点数ΔG/(kJ/mol)ΔH/(kJ/mol)ΔS/ (J/mol·K)2982.238 4×1042.238 4×10123.170 3×1061.306 8-37.0883041.438 2×1041.438 2×10121.371 1×1061.022 7-24.077-503.43-156.893101.181 2×1041.181 2×10121.194 0×1060.809 0-18.261
2.3.2 结合常数和结合位点数
根据公式4做出双对数图(https://doi.org/10.13995/j.cnki.11-1802/ts.036611),进而获得结合常数K和结合位点数的值(表1)。如表1所示,结合常数K随着温度的升高而降低,3种温度下结合位点数均近似等于1,说明温度越高,AE与α-葡萄糖苷酶结合能力越低,并且AE可以和α-葡萄糖苷酶结合形成复合物,具有一个结合位点[26]。
2.3.3 热力学参数和主要作用力类型
由表1可知ΔG<0,说明AE和α-葡萄糖苷酶的结合是自发的[27]。ΔH为-503.43 kJ/mol,ΔS为-156.89 J/(mol·k),二者均小于0,表明在AE与α-葡萄糖苷酶结合过程中起主导作用是氢键和范德华力[28]。
2.4 同步荧光光谱分析
同步荧光光谱可反映出蛋白质荧光基团微环境的变化,当Δλ为15 nm或60 nm时,同步荧光光谱分别反映出Tyr和Trp残基的信息[29]。如图5所示。随着AE浓度的增加,Tyr和Trp的荧光强度逐渐降低,最大发射峰分别从283 nm和284 nm红移到了287 nm和295 nm,表明AE与酶结合形成了复合物,并使结合位点的Tyr和Trp的极性增强,蛋白质构象趋于疏松,酶的构象发生变化[30]。
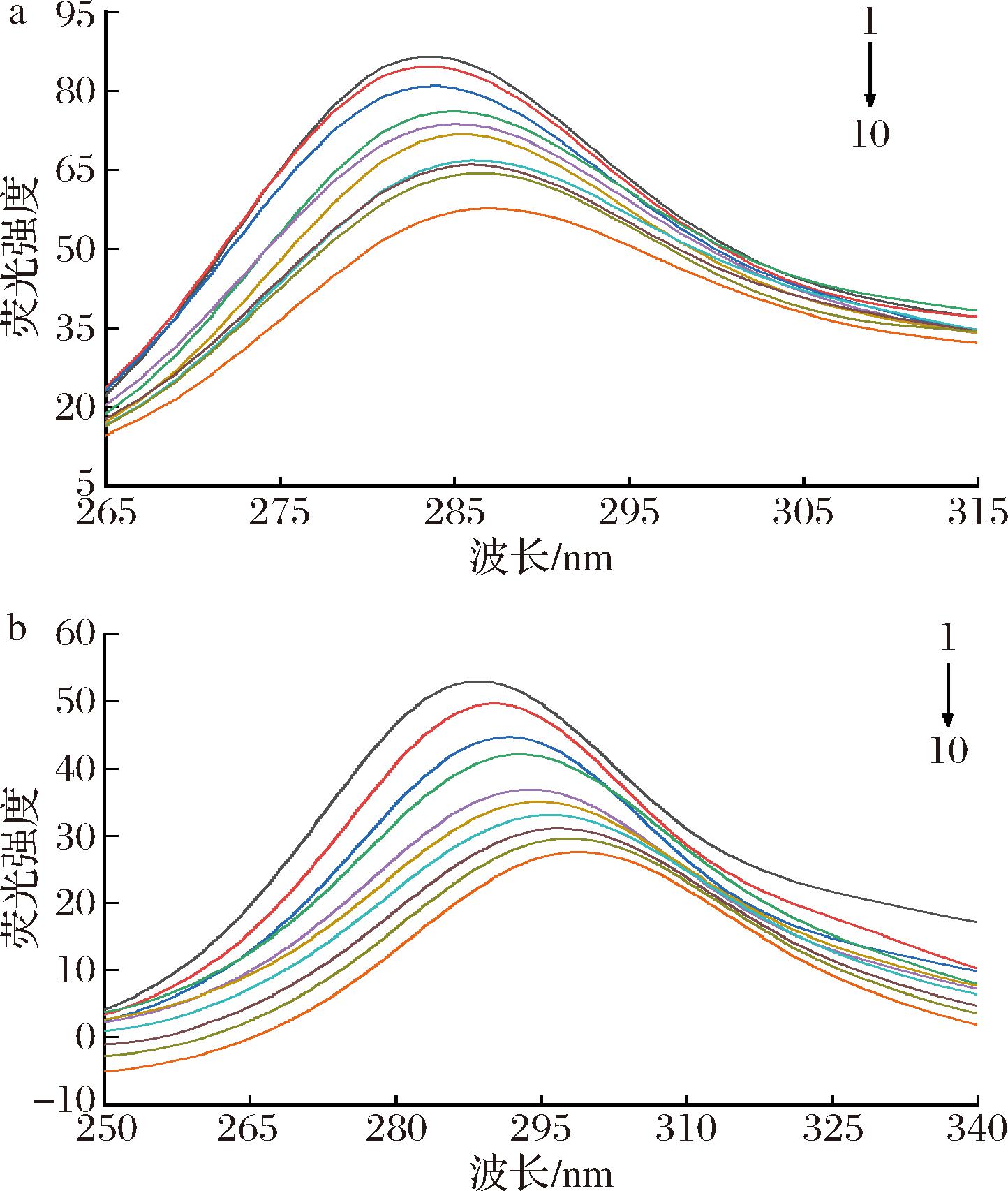
a-Δλ=15 nm; b-Δλ=15 nm
图5 298 K下α-葡萄糖苷酶与不同浓度AE相互作用的同步荧光光谱
Fig.5 Synchronized fluorescence spectra of α-glucosidase interacting with different concentrations of AE at 298 K
2.5 三维荧光光谱分析
如图6所示,图中出现Peak a峰(瑞利散射峰)、Peak 1和Peak 2峰,Peak 1出现在λex/λem为286/340 nm处,是α-葡萄糖苷酶的特征峰,主要揭示α-葡萄糖苷酶中氨基酸残基的荧光特性[29];Peak 2出现在λex/λem为230/340 nm处,反映了蛋白质二级结构的变化[30]。加入AE后Peak 1和Peak 2分别红移了11 nm和9 nm,并且荧光强度明显降低,结果表明AE与酶结合改变了荧光基团的极性,可能导致酶的二级结构发生变化[31],这将通过FT-TR光谱进一步研究。
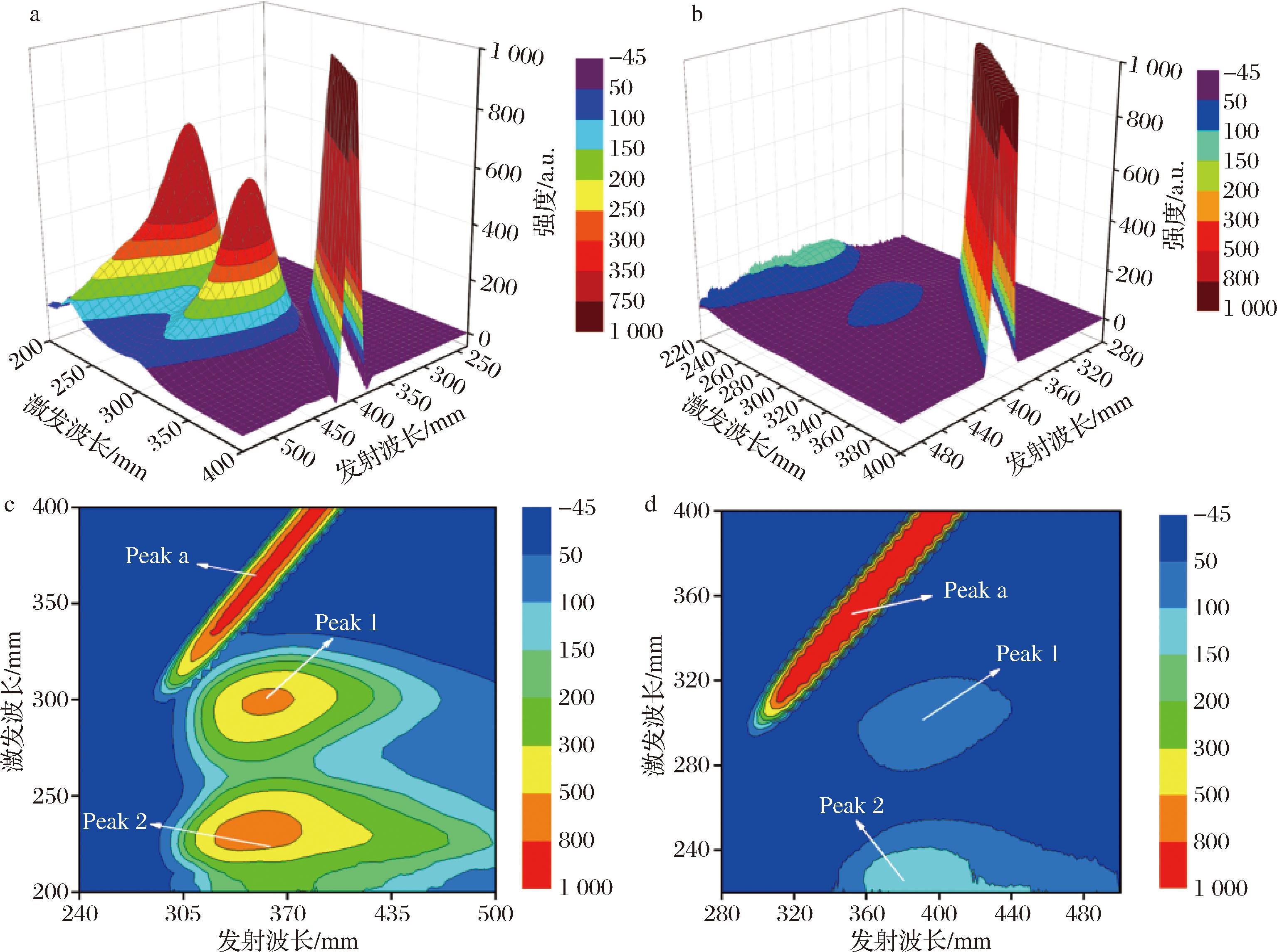
a-α-葡萄糖苷酶;b-α-葡萄糖苷酶+AE;c-α-葡萄糖苷酶;d-α-葡萄糖苷酶+AE
图6 298 K下α-葡萄糖苷酶在AE(1.00×10-4 mol/L)不存在和存在时的三维荧光光谱和等高线图
Fig.6 Three-dimensional fluorescence spectra and contour map of α-glucosidase in the absence and the presence of AE (1.00×10-4 mol/L) at 298 K
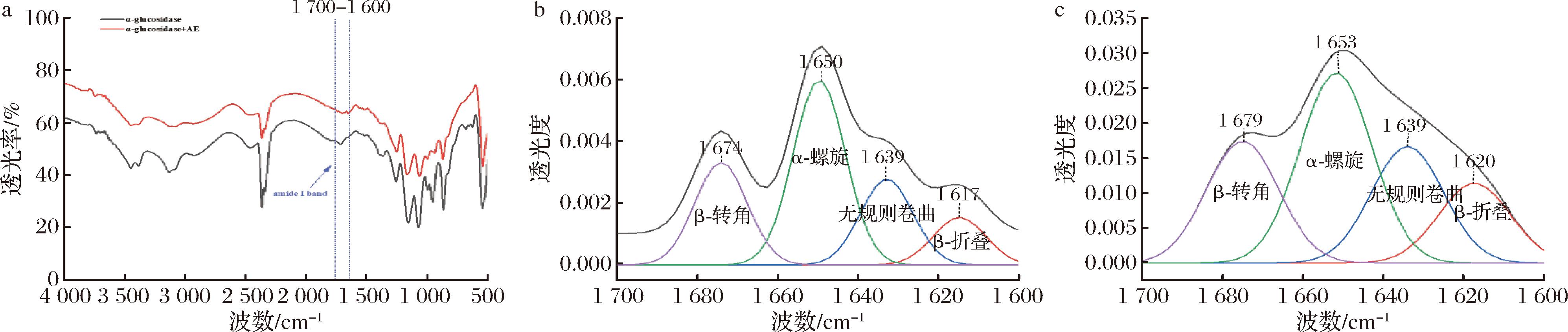
a-FT-IR光谱;b-α-葡萄糖苷酶酰胺Ⅰ曲线拟合图;c-α-葡萄糖苷酶+AE酰胺Ⅰ曲线拟合图
图7 α-葡萄糖苷酶与AE作用前后的FT-IR光谱图和酰胺Ⅰ曲线拟合图
Fig.7 FT-IR spectra and amide I curve fit of α-glucosidase before and after interaction with AE
2.6 FT-IR光谱分析
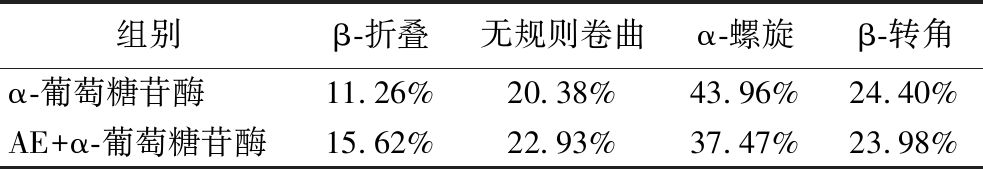
红外光谱的结果如图7-a所示,对酰胺Ⅰ带的峰进行去卷积处理,得到各二级结构的含量[32],结果如图7-b,图7-c和表2所示,α-葡萄糖苷酶含有43.96% α-螺旋,11.26% β-折叠,24.40% β-转角,20.38%无规则卷曲;在与AE相互作用后,α-葡萄糖苷酶中α-螺旋含量降至37.47%,β-折叠含量增加至15.62%,β-转角含量降至23.98%,无规则卷曲增至22.93%。实验结果表明AE与酶结合后改变了的二级结构[33]。
表2 α-葡萄糖苷酶与AE作用前后二级结构的含量
Table 2 The contents of secondary structures of α-glucosidase in the presence or absence of AE
组别β-折叠无规则卷曲α-螺旋β-转角α-葡萄糖苷酶11.26%20.38%43.96%24.40%AE+α-葡萄糖苷酶15.62%22.93%37.47%23.98%
2.7 分子对接模拟
为了进一步了解α-葡萄糖苷酶与AE的潜在相互作用机制,利用分子对接对AE的结合位点进行了探索。图8展示了AE与α-葡萄糖苷酶的模拟结果(最低结合能-6.98 kcal/mol)。AE与酶结合具有一个结合位点,结合位点位于酶活性中心(Glu411;Tyr158;Glu277)[34]以外的疏水结合腔内,AE被Thr290、Leu297、Glu296、Asn259、His295、Glu271、Lys16、Trp343、Ser298、Asp341、Cys342、Ser291、Trp15、Lys13和Ala292包围(4 Å范围内),并与结合位点的氨基酸残基(Thr290,1.9 Å;Leu297,2.1 Å;Glu296,2.6 Å;Asn259,2.0 Å;His295,1.9 Å)形成5条氢键,与Glu271、Lys16、Cys342、Asp341、Trp343和Ser298等氨基酸残基产生范德华力。此外,AE还与Trp15、Ala292和Lys13发生π-π相互作用,这些作用力稳定了AE与结合位点之间的相互作用[35],导致酶的构象发生变化。

A-AE与α-葡萄糖苷酶的结合位;B-AE与α-葡萄糖苷酶4 Å范围内氨基酸残基相互作用的三维结果;C-AE与α-葡萄糖苷酶4 Å范围内氨基酸残基相互作用的二维结果
图8 AE与α-葡萄糖苷酶的分子对接图
Fig.8 Molecular docking diagram of AE with α-glucosidase
3 结论
通过酶活性实验,证明了AE对α-葡萄糖苷酶具有抑制作用,并且抑制类型为混合型抑制。使用多光谱方法结合分子对接技术,分析了AE与α-葡萄糖苷酶相互作用机理,表明AE通过多种作用力与α-葡萄糖苷酶结合,改变了α-葡萄糖苷酶的空间构象,进而抑制其活性。这些结果为AE作为一种潜在的α-葡萄糖苷酶抑制剂的应用提供了科学支持,并可能作为降糖食品配料的应用提供信息。
[1] NAEMI R, SHAHMORADI L.Global experience of diabetes registries:A systematic review[J].Advances in Experimental Medicine and Biology, 2021, 1307:441-455.
[2] 曹维, 金杜欣, 刘瑞, 等.食源性黄酮通过肠道菌群调节II型糖尿病的作用机制研究进展[J].食品与发酵工业, 2024,50(2):372-378.CAO W, JIN D X, LIU R, et al, Research progress on the mechanism of food-derived flavonoids regulating type II diabetes mellitus via gut microbiota[J].Food and Fermentation Industries, 2024,50(2):372-378.
[3] GRUNBERGER G.Should side effects influence the selection of antidiabetic therapies in type 2 diabetes?[J].Current Diabetes Reports, 2017, 17(4):21.
[4] AMPARO T R, DJEUJO F M, DA SILVA D, et al.New potential use of Protium spruceanum in hyperglycemia:α-Glucosidase inhibition and protection against oxidative stress[J].Journal of the Brazilian Chemical Society, 2021, 32:1988-1996.
[5] PANI A, BARATTA F, PASTORI D, et al.Prevention and management of type II diabetes chronic complications:The role of polyphenols[J].Current Medicinal Chemistry, 2022, 29(6):1099-1109.
[6] ABDELLATEF A A, FATHY M, MOHAMMED A E S I, et al.Inhibition of cell-intrinsic NF-κB activity and metastatic abilities of breast cancer by aloe-emodin and emodic-acid isolated from Asphodelus microcarpus[J].Journal of Natural Medicines, 2021, 75(4):840-853.
[7] PÉREZ Y Y, JIMÉNEZ-FERRER E, ZAMILPA A, et al.Effect of a polyphenol-rich extract from aloe vera gel on experimentally induced insulin resistance in mice[J].The American Journal of Chinese Medicine, 2007, 35(6):1037-1046.
[8] 姚芬. 柿单宁对淀粉消化特性的影响及其机制研究[D].武汉:华中农业大学, 2017.YAO F.Study on the effects of persimmon tannin on starch digestibility and its mechanism[D].Wuhan:Huazhong Agricultural University, 2017.
[9] 王梦婷. 杨梅叶原花色素基于调控淀粉消化吸收和肝糖代谢的降血糖作用机制[D].杭州:浙江大学, 2021.WANG M T.The hypoglycemic mechanism of Ye Yuan anthocyanin in Myrica rubra is based on the regulation of starch digestion and absorption and liver sugar metabolism[D].Hangzhou:Zhejiang University, 2021.
[10] HUANG X, ZHU J X, WANG L, et al.Inhibitory mechanisms and interaction of tangeretin, 5-demethyltangeretin, nobiletin, and 5-demethylnobiletin from citrus peels on pancreatic lipase:Kinetics, spectroscopies, and molecular dynamics simulation[J].International Journal of Biological Macromolecules, 2020, 164:1927-1938.
[11] 曹舒云, 郑瑜雪, 柴子淇, 等.芹菜素-8-C-葡萄糖苷对淀粉消化酶抑制作用机制[J].食品科学, 2023, 44(8):131-136.CAO S Y, ZHENG Y X, CHAI Z Q, et al.Inhibition mechanism of apigenin-8-c-glucoside on starch digestive enzymes[J].Food Science, 2023, 44(8):131-136.
[12] NAN G J, SUN J, DING M W, et al.Interaction behavior between myricetin and dihydromyricetin with pepsin by spectroscopic and docking methods[J].Journal of Molecular Liquids, 2016, 223:128-135.
[13] WANG J M, MA L, ZHANG Y H, et al.Investigation of the interaction of deltamethrin (DM) with human serum albumin by multi-spectroscopic method[J].Journal of Molecular Structure, 2017, 1129:160-168.
[14] ZHENG Y X, TIAN J H, YANG W H, et al.Inhibition mechanism of ferulic acid against α-amylase and α-glucosidase[J].Food Chemistry, 2020, 317:126346.
[15] ZENG L, DING H F, HU X, et al.Galangin inhibits α-glucosidase activity and formation of non-enzymatic glycation products[J].Food Chemistry, 2019, 271:70-79.
[16] SUN L J, CHEN W Q, MENG Y H, et al.Interactions between polyphenols in thinned young apples and porcine pancreatic α-amylase:Inhibition, detailed kinetics and fluorescence quenching[J].Food Chemistry, 2016, 208:51-60.
[17] ![]() I,
I, ![]() D, PICHLER A, et al.Dietary polyphenols as natural inhibitors of α-amylase and α-glucosidase[J].Life, 2022, 12(11):1692.
D, PICHLER A, et al.Dietary polyphenols as natural inhibitors of α-amylase and α-glucosidase[J].Life, 2022, 12(11):1692.
[18] 梁宗瑶, 魏园园, 任维维, 等.橡子仁萃取物成分分析及对α-淀粉酶、α-葡萄糖苷酶的抑制作用[J].食品工业科技, 2021, 42(17):47-55.LIANG Z Y, WEI Y Y, REN W W, et al.Composition analysis and inhibitory effect against α-amylase and α-glucosidase of acorn kernel extractions[J].Science and Technology of Food Industry, 2021, 42(17):47-55.
[19] WANG M T, JIANG J, TIAN J H, et al.Inhibitory mechanism of novel allosteric inhibitor, Chinese bayberry (Myrica rubra Sieb.et Zucc.) leaves proanthocyanidins against α-glucosidase[J].Journal of Functional Foods, 2019, 56:286-294.
[20] FEI Q Q, GAO Y, ZHANG X, et al.Effects of Oolong tea polyphenols, EGCG, and EGCG3” Me on Pancreatic α-amylase activity in vitro[J].Journal of Agricultural and Food Chemistry, 2014, 62(39):9507-9514.
[21] HEIBATI-GOOJANI F, FARHADIAN S, SHAREGHI B, et al.Insights into the binding mechanism of putrescine on α-amylase by multiple spectroscopic techniques and molecular docking[J].Journal of Molecular Structure, 2021, 1242:130702.
[22] CAI X, YU J N, XU L M, et al.The mechanism study in the interactions of sorghum procyanidins trimer with porcine pancreatic α-amylase[J].Food Chemistry, 2015, 174:291-298.
[23] HAN L, FANG C, ZHU R X, et al.Inhibitory effect of phloretin on α-glucosidase:Kinetics, interaction mechanism and molecular docking[J].International Journal of Biological Macromolecules, 2017, 95:520-527.
[24] LIN M Z, CHAI W M, ZHENG Y L, et al.Inhibitory kinetics and mechanism of rifampicin on α-glucosidase:Insights from spectroscopic and molecular docking analyses[J].International Journal of Biological Macromolecules, 2019, 122:1244-1252.
[25] REN G Y, SUN H, GUO J Y, et al.Molecular mechanism of the interaction between resveratrol and trypsin via spectroscopy and molecular docking[J].Food &Function, 2019, 10(6):3291-3302.
[26] PAUL B K, GHOSH N, MUKHERJEE S.Binding interaction of a prospective chemotherapeutic antibacterial drug with β-lactoglobulin:Results and challenges[J].Langmuir, 2014, 30(20):5921-5929.
[27] DAI T T, CHEN J, LI Q, et al.Investigation the interaction between procyanidin dimer and α-amylase:Spectroscopic analyses and molecular docking simulation[J].International Journal of Biological Macromolecules, 2018, 113:427-433.
[28] LI Y B, LIU X L, ZHOU H Y, et al.Inhibitory mechanism of engeletin against α-glucosidase[J].Natural Product Communications, 2021, 16(1):1934578X2098672.
[29] HUANG Q, CHAI W M, MA Z Y, et al.Inhibition of α-glucosidase activity and non-enzymatic glycation by tannic acid:Inhibitory activity and molecular mechanism[J].International Journal of Biological Macromolecules, 2019, 141:358-368.
[30] ZHANG C, ZHANG G W, LIAO Y J, et al.Myricetin inhibits the generation of superoxide anion by reduced form of xanthine oxidase[J].Food Chemistry, 2017, 221:1569-1577.
[31] AVWIOROKO O J, ANIGBORO A A, OTUECHERE C A, et al.α-Amylase inhibition, anti-glycation property and characterization of the binding interaction of citric acid with α-amylase using multiple spectroscopic, kinetics and molecular docking approaches[J].Journal of Molecular Liquids, 2022, 360:119454.
[32] SHEN H Y, WANG J, AO J F, et al.Structure-activity relationships and the underlying mechanism of α-amylase inhibition by hyperoside and quercetin:Multi-spectroscopy and molecular docking analyses[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2023, 285:121797.
[33] SEKAR G, SIVAKUMAR A, MUKHERJEE A, et al.Existence of hydroxylated MWCNTs demotes the catalysis effect of amylases against starch degradation[J].International Journal of Biological Macromolecules, 2016, 86:250-261.
[34] ZENG L, ZHANG G W, LIAO Y J, et al.Inhibitory mechanism of morin on α-glucosidase and its anti-glycation properties[J].Food & Function, 2016, 7(9):3 953-3 963.
[35] 王静, 刁翠茹, 王华丽, 等.鼠尾草酸对α-淀粉酶的抑制作用[J].食品科学, 2020, 41(3):12-17.WANG J, DIAO C R, WANG H L, et al.Inhibitory mechanism of carnosic acid on α-amylase[J].Food Science, 2020, 41(3):12-17.