紫苏(Perilla frutescens L.)为唇形科一年生草本植物,又名苏麻、桂荏、白紫苏等,主要分布在中国、日本、韩国、缅甸、印度尼西亚和俄罗斯[1]。紫苏为药食同源类植物,其茎、叶、籽均可入药,富含多种活性物质。古籍记载紫苏常被用于治疗外感风寒、鱼蟹中毒、妊娠呕吐等疾病。在中国被当作油料作物或药材种植,广泛用于烹饪和传统医药[2]。紫苏籽中的营养物质包括脂肪、蛋白质、纤维素、多糖等。目前的研究主要集中在紫苏籽油的提取和活性研究上。紫苏籽油富含不饱和脂肪酸,含量高达90%以上,其中ω-3型多不饱和脂肪酸是紫苏油中的主要不饱和脂肪酸[3],具有抗炎、改善认知、降低胆固醇、降低结肠癌发病率、预防心脑血管疾病的功效[4-6]。紫苏粕是紫苏籽榨油后的副产物,脱脂紫苏粕的蛋白富集率可提升至57.90%[7],是一种极具开发潜力的农副产品。
氧化应激是指机体氧化与抗氧化作用失衡的一种状态,常表现为自由基的积累和炎症反应,导致细胞和组织损伤。长期的氧化应激会导致许多非传染性慢性疾病,如帕金森、动脉粥样硬化、高血压、关节炎、糖尿病、癌症等[8-9]。目前,市场上广泛使用化学合成的抗氧化剂作为外源性抗氧化剂缓解氧化应激,但是副作用较为明显。人们更倾向于寻找安全高效的天然抗氧化剂,如抗氧化肽。抗氧化肽即具有抗氧化活性的多肽,其本身还具有水溶性高、稳定性强、消化吸收率高的特点[10]。目前,对抗氧化肽的研究主要集中在抗氧化肽制备、纯化、序列鉴定、活性评价及作用机制分析上,其目的是获得序列确定的多肽及其体内外抗氧化活性信息。抗氧化肽的体外抗氧化活性包括自由基清除能力、铁离子还原力、金属离子螯合能力、延缓脂质过氧化能力等,体内抗氧化活性包括对各细胞系或生物体中活性氧(reactive oxygen species,ROS)、丙二醛(malonaldehyde,MDA)含量、抗氧化酶活性以及某些通路的影响,存在“单一成分-单一靶点-单一途径”的局限性,缺乏整体性和系统性。
网络药理学基于目标分子、生物功能和生物活性化合物生成复杂的相互作用网络,并能够从系统的角度在分子水平上阐明复合药物的作用机制,是研究复合药物的一种整体策略,为生物活性化合物的发现、机理研究、质量控制等领域提供了新的视野[11]。本文采用碱性蛋白酶酶解脱脂紫苏粕,对其进行超滤分级,分析不同级分的体外抗氧化活性,研究级分UF-4对4T1细胞氧化损伤的保护作用,利用网络药理学探讨其发挥抗氧化作用的潜在机制,使用分子对接进行初步验证。研究结果可为提高紫苏粕的附加值、紫苏粕抗氧化肽的后续研究提供参考。
1 材料与方法
1.1 材料与试剂
脱脂紫苏籽粕,实验室自制;4T1乳腺癌细胞,上海富衡生物科技有限公司提供;碱性蛋白酶(30 000 U/mL),南宁东恒华道生物科技有限责任公司;过硫酸钾,上海阿拉丁生化科技股份有限公司;ABTS、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2H-tetrazolium bromide,MTT],索莱宝生物科技有限公司;DPPH,上海化成工业发展有限公司;过氧化氢,天津市恒兴化学试剂制造有限公司;PBS、DMEM高糖培养基,Hyclone公司;胰酶,博士德生物科技有限公司;双抗,大连美仑生物技术有限公司;乳酸脱氢酶(lactic dehydrogenase,LDH)、MDA、谷胱甘肽(glutathione,GSH)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)试剂盒,南京建成生物研究所;乙腈、甲酸、碳酸氢铵、二硫苏糖醇、碘乙酰胺,Sigma-Aldrich公司。
1.2 仪器与设备
V-1200可见分光光度计、P4紫外可见光分光光度计,上海美谱达仪器有限公司;JY92-IIN超声破碎机,宁波新芝生物科技股份有限公司;BPN-8OCH CO2培养箱,海尔生物医疗有限公司;BL-120双目倒置显微镜,北京世纪科信科学仪器有限公司;HZK-FA210分析型天平,华志(福建)电子科技有限公司;DNM-9620G酶标分析仪,北京普朗新技术有限公司;Easy-nLC 1200毛细管高效液相色谱仪、Quadrupole-OrbitrapTM电喷雾-组合型离子阱Orbitrap 质谱仪,Thermo Fisher Scientific;Concentrator plus真空离心浓缩仪,Eppendorf;TGL-16.5M台式高速冷冻离心机,上海卢湘仪离心机仪器有限公司。
1.3 实验方法
1.3.1 紫苏粕多肽制备
将紫苏粕粉碎,过40目筛,在底物质量分数为7.5%、pH 11.5,酶底比7 000 U/g,酶解温度60 ℃的条件下酶解8 h。沸水浴10 min灭酶,10 000 r/min、4 ℃离心10 min,上清液为紫苏粕碱性蛋白酶水解液,即紫苏粕多肽。
1.3.2 紫苏粕多肽超滤分级
参照卢韵君[12]的方法,依次使用规格为10、3、1 kDa的50 mL Pall超滤离心管对紫苏粕碱性蛋白酶酶解液进行超滤分级,离心转速5 000 r/min,离心时间30 min。收集各离心管的截留液与滤过液,得到截留分子质量>10 kDa(UF-1)、3~10 kDa(UF-2)、1~3 kDa(UF-3)和<1 kDa(UF-4)组分。使用量筒测量超滤分级前紫苏粕碱性蛋白酶酶解液及分级后各组分的溶液体积,双缩脲法[13]测定其蛋白质浓度,各组分得率计算如公式(1)所示:
得率![]()
(1)
式中:V组分,各组分的体积,mL;C组分,各组分的蛋白质质量浓度,mg/mL;V酶解液,酶解液的体积,mL;C酶解液,酶解液的蛋白质质量浓度,mg/mL。
将各组分冷冻干燥,参照GB/T 39100—2020《多肽抗氧化性测定-DPPH和ABTS法》测定各组分抗氧化活性。
1.3.3 UF-4抗氧化应激作用
1.3.3.1 细胞培养
4T1细胞于完全培养基[DMEM高糖培养基+10%胎牛血清+1%(体积分数)双抗]、置于37 ℃,5%(体积分数)CO2,饱和湿度下培养。
1.3.3.2 细胞毒性检测
采用MTT法测定紫苏粕多肽UF-4组分对4T1细胞的毒性。取处于对数生长期且生长状态良好的的细胞,按每孔5×104个细胞接种于96孔板中,每孔100 μL,于细胞培养箱中培养24 h。弃上清液,空白组加入100 μL完全培养基,样品组则加入UF-4终质量浓度为250、500、1 000、2 000 μg/mL且经过滤膜过滤除菌的完全培养基100 μL,每个浓度设置6个重复,继续培养12 h。弃上清液,加入100 μL完全培养基,再加入10 μL MTT溶液(5 mg/mL,溶于PBS),继续培养4 h。弃上清液,加入150 μL DMSO,振荡培养10 min,溶解蓝色晶体,570 nm处测定吸光度值,细胞存活率的计算如公式(2)所示:
细胞存活率![]()
(2)
1.3.3.3 建立细胞氧化损伤模型
取处于对数生长期且生长状态良好的的细胞,分成空白组和H2O2组。按每孔5×104个细胞接种于96孔板中,每孔100 μL,于细胞培养箱中培养24 h。弃上清液,H2O2组加入H2O2终浓度为50、100、200、400、800 μmol/L的完全培养基,经过滤膜过滤除菌后,向H2O2组加入100 μL,每个浓度设置6个重复,刺激4 h;空白组加入等体积完全培养基,培养4 h。弃上清液,加入100 μL完全培养基,再加入10 μL MTT溶液(5 mg/mL,溶于PBS),继续培养4 h。弃上清液,加入150 μL DMSO,振荡培养10 min,溶解蓝色晶体,570 nm处测定吸光度值。参照1.3.3.2节计算不同浓度H2O2刺激下4T1细胞的细胞存活率。
1.3.3.4 UF-4对H2O2诱导的4T1细胞胞外LDH活性的影响
取处于对数生长期且生长状态良好的的细胞,分成空白组、模型组和样品组。按每孔1×106个细胞接种于6孔板中,每孔2 mL,于细胞培养箱中培养24 h。弃上清液,空白组和模型组加入2 mL完全培养基;样品组加入等体积UF-4终质量浓度为250、500、1 000、2 000 μg/mL且经过滤膜过滤除菌的完全培养基,培养12 h。结束后,弃上清液,模型组和样品组加入H2O2终浓度为200 μmol/L且经过滤膜过滤除菌的完全培养基2 mL,刺激4 h;空白组加入等体积完全培养基,培养4 h。结束后,取上清液,根据试剂盒使用说明书测定上清液LDH活性。
1.3.3.5 UF-4对H2O2诱导的4T1细胞胞内MDA含量的影响
细胞分组及培养同1.3.3.3节。结束后,使用胰酶消化细胞,1 000 r/min离心5 min收集细胞,经过超声破碎仪破碎后,根据试剂盒使用说明书测定细胞中MDA的含量。
1.3.3.6 UF-4对H2O2诱导的4T1细胞胞内GSH及抗氧化酶水平的影响
细胞分组及培养同1.3.3.3节。结束后,使用胰酶消化细胞,1 000 r/min离心5 min收集细胞,经过超声破碎仪破碎后,根据试剂盒使用说明书测定细胞中蛋白浓度、GSH含量以及抗氧化酶SOD和CAT的活性。
1.3.4 UF-4序列鉴定
对紫苏粕多肽UF-4组分进行还原烷基化处理,之后将处理好的样品通过液质联用(nanoLC-ESI-Orbitrap-MS/MS)分析,得到质谱原始结果的raw文件,经过软件Byonic分析,匹配数据,得到鉴定结果。
毛细管液相色谱条件:Acclaim PepMap RPLC C18色谱柱(150 mm×0.15 mm,1.9 μm);流动相:A相为0.1%甲酸水溶液,B相为80%乙腈水溶液(含0.1%甲酸);流动相梯度洗脱程序:0 min,4% B;0~2 min,4~8% B;2~45 min,8%~28% B;45~55 min,28%~40% B;55~56 min,40%~95% B;56~66 min,95% B;进样量为5 μL;流速为600 nL/min。
质谱条件:赛默飞Q ExactiveTM Hybrid Quadrupole-OrbitrapTM质谱仪;喷雾电压:2 200 V;毛细管温度:270 ℃;一级质谱参数:扫描范围300~1 800 m/z,分辨率为70 000;自动增益控制目标(AGC target)为3e6,最大喷射时间(MaximumIT)为100 ms;二级质谱参数:解离方式为高能碰撞解离(high energy collision dissociation,HCD),扫描范围300~1 800 m/z,分辨率为17 500,AGC target为3e6,MaximumIT为100 ms,归一化碰撞能量(normalized collision energy,NCE)28,topN为20。
1.3.5 网络药理学研究
文章网络药理学研究部分主要依据各数据库、在线网站等进行分析和解释,所用到的工具如表1所示。
表1 文章所用工具及网址
Table 1 Websites of the tools used

工具名称网址Uniprothttps://www.uniprot.org/PeptideRankerhttp://distilldeep.ucd.ie/PeptideRanker/BIOPEP-UWMhttps://biochemia.uwm.edu.pl/biopep-uwm/SwissADMEhttp://www.swissadme.ch/Swiss TargetPredictionhttp://www.swisstargetprediction.chGeneCardshttps://www.genecards.org/Veney 2.1.0https://bioinfogp.cnb.csic.es/tools/venny/index.htmlSTRINGhttps://cn.string-db.org/DAVIDhttps://david.ncifcrf.gov/微生信https://www.bioinformatics.com.cn/
1.3.5.1 潜在活性成分筛选
使用PeptideRanker对UF-4中质谱鉴定的所有序列进行生物活性打分,筛选出得分大于0.8的序列,通过BIOPEP-UWM数据库的SMILE模块将其转化为标准Smile格式,在SwissADME网站中预测其ADME性质,如氢键受体个数(H-bond acceptors)、血脑屏障透过性(BBB permeant)、糖蛋白底物(Pgp substrate)、疏水常数(MLOGP)、生物可用性评分(Bioavailability Score)等,以此筛选潜在活性成分。
1.3.5.2 筛选药物作用于疾病的核心靶点
将潜在活性成分的标准Smile格式导入Swiss Target Prediction 网站中获得其对应的作用靶点,将潜在活性成分的作用靶点信息进行合并、剔除筛选项。以antioxidant为关键词[14]从GeneCards数据库中收集氧化应激有关的致病靶点。使用Veney 2.1.0网站将疾病的致病靶点与潜在活性成分的作用靶点取交,得出UF-4潜在活性成分缓解氧化应激的核心作用靶点,绘制韦恩图。
1.3.5.3 蛋白互作(protein-protein interaction,PPI)分析
使用1.3.5.2节中获得的核心作用靶点在STRING数据库上构建PPI网络。设置最低要求交互得分为0.9,隐藏网络中未连接点。应用Cytoscape 3.7.2软件对PPI网络进行可视化。采用CytoNCA插件计算网络节点的Betweenness(BC)、Closenes(CC)、Degree(DC)值。分别采用Cytohubba插件中BC、CC、DC 3种算法筛选出PPI网络中前10个主要靶点,取交获得核心基因。
1.3.5.4 GO和KEGG富集分析
使用1.3.5.2节中获得的核心作用靶点在DAVID数据库中进行基因本体论GO和KEGG富集分析,并在微生信平台进行可视化。
1.3.5.5 分子对接
分子对接采用discovery studio(DS)软件完成。使用Pymol软件构建多肽结构,在DS中添加CHARMm力场,并优化其结构。蛋白受体的晶体结构从PDB数据库中下载。通过原配体定义对接口袋的位置,设置半径为10 Å后删除晶体结构中的水分子和原配体并加氢。使用CDOCKER模块执行对接任务,在同一个抗氧化肽不同对接结果中,选择-CDOCKER ENERGY最高的一个作为最终结果。
1.4 统计与分析
数据以平均值±标准差[mean±standard deviation(SD)]表示,使用IBM SPSS statistics 25软件进行单因素方差方差分析,Origin 2018软件进行作图。
2 结果与分析
2.1 紫苏粕多肽的超滤分级
氨基酸组成、多肽序列、分子质量大小、二级结构等是影响抗氧化肽活性的关键因素。研究表明,多数情况下,分子质量较低的多肽拥有更强的抗氧化活性[15],且更易被人体吸收[16]。由表2可知,紫苏粕中的蛋白质经过碱性蛋白酶酶解后产生低分子质量的小肽,级分UF-4占比为33.73%。同时,UF-4还具有最低的清除ABTS阳离子自由基的IC50值,其清除DPPH自由基的IC50值虽然不是最低,但与最低值UF-3的0.978±0.073无显著性差异(P>0.05),表明级分UF-4的抗氧化活性最强。因此,选择UF-4进行接下来的细胞实验。
表2 紫苏粕多肽各级分得率及其抗氧化活性
Table 2 Extraction rate and antioxidant activity of perilla meal polypeptide
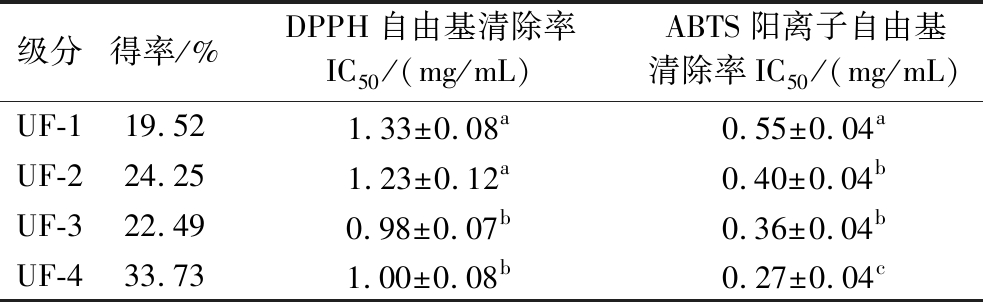
注:同一指标不同小写字母表示差异显著(P<0.05)(下同)。
级分得率/%DPPH自由基清除率IC50/(mg/mL)ABTS阳离子自由基清除率IC50 /(mg/mL)UF-119.521.33±0.08a0.55±0.04aUF-224.251.23±0.12a0.40±0.04bUF-322.490.98±0.07b0.36±0.04bUF-433.731.00±0.08b0.27±0.04c
2.2 UF-4细胞实验
2.2.1 UF-4及H2O2浓度对4T1细胞存活率的影响
分别用终质量浓度250、500、1 000、2 000 μg/mL的UF-4处理4T1细胞12 h后,通过MTT法检测细胞存活率,以此判断UF-4对4T1的毒副作用。如图1-A所示,经过4种质量浓度的UF-4处理12 h后,样品组的细胞存活率相对于空白组并没有显著降低(P<0.05)。说明在此质量浓度范围内,UF-4对4T1细胞无细胞毒性。

A-UF-4浓度;B-H2O2浓度
图1 UF-4和H2O2浓度对4T1细胞存活率的影响
Fig.1 Effect of UF-4 and H2O2concentration on survival rate of 4T1 cells
注:同一指标不同小写字母表示差异显著(P<0.05)(下同)。
H2O2属于非自由基型活性氧,可与还原性Fe2+和Cu+发生Fenton反应生成·HO[17]。·HO是最具活性和破坏性的活性氧,很容易与蛋白质、DNA 等生物分子发生反应,造成细胞凋亡或坏死[18]。合适的H2O2浓度对于氧化损伤模型的建立具有重要意义。如图1-B所示,4T1细胞的存活率与H2O2浓度间存在明显的剂量效应。经过50、100、200、400、800 μmol/L的H2O2的刺激4 h后,4T1的细胞存活率分别下降至(89.24±4.32)%、(78.63±5.49)%、(54.28±3.16)%、(19.88±2.15)%、(4.28±1.73)%。因此,选择200 μmol/L作为最佳半数致死浓度,建立氧化损伤模型。
2.2.2 UF-4对H2O2诱导的4T1细胞胞外LDH活性及胞内MDA含量的影响
LDH作为一种胞浆酶稳定地存在于细胞质中。当细胞受到外源物质的刺激,细胞膜通透性改变时,LDH被释放到培养液中[19]。培养液中LDH的活性越高,表示细胞膜的损伤程度越高。如图2-A所示,H2O2诱导的氧化应激导致LDH的释放极显著增加(P<0.01),模型组培养液中的LDH活力为(698.97±19.90)%,是空白组的3.5倍,表明模型组细胞完整性受到破坏。然而,经过UF-4预处理后,4T1细胞胞外LDH活性降低,且降低程度呈现出UF-4剂量依赖性。终质量浓度为250、500、1 000、2 000 μg/mL的UF-4预处理后,培养液中LDH活性分别降低了44.51、222.39、276.89、390.86 U/L。PENG等[20]研究了章鱼来源的抗氧化肽GGAW对H2O2诱导的 IEC-6 细胞氧化应激的保护作用,发现GGAW能维持细胞膜完整性,降低损伤组LDH的释放。其实验结果与本项研究结果一致。
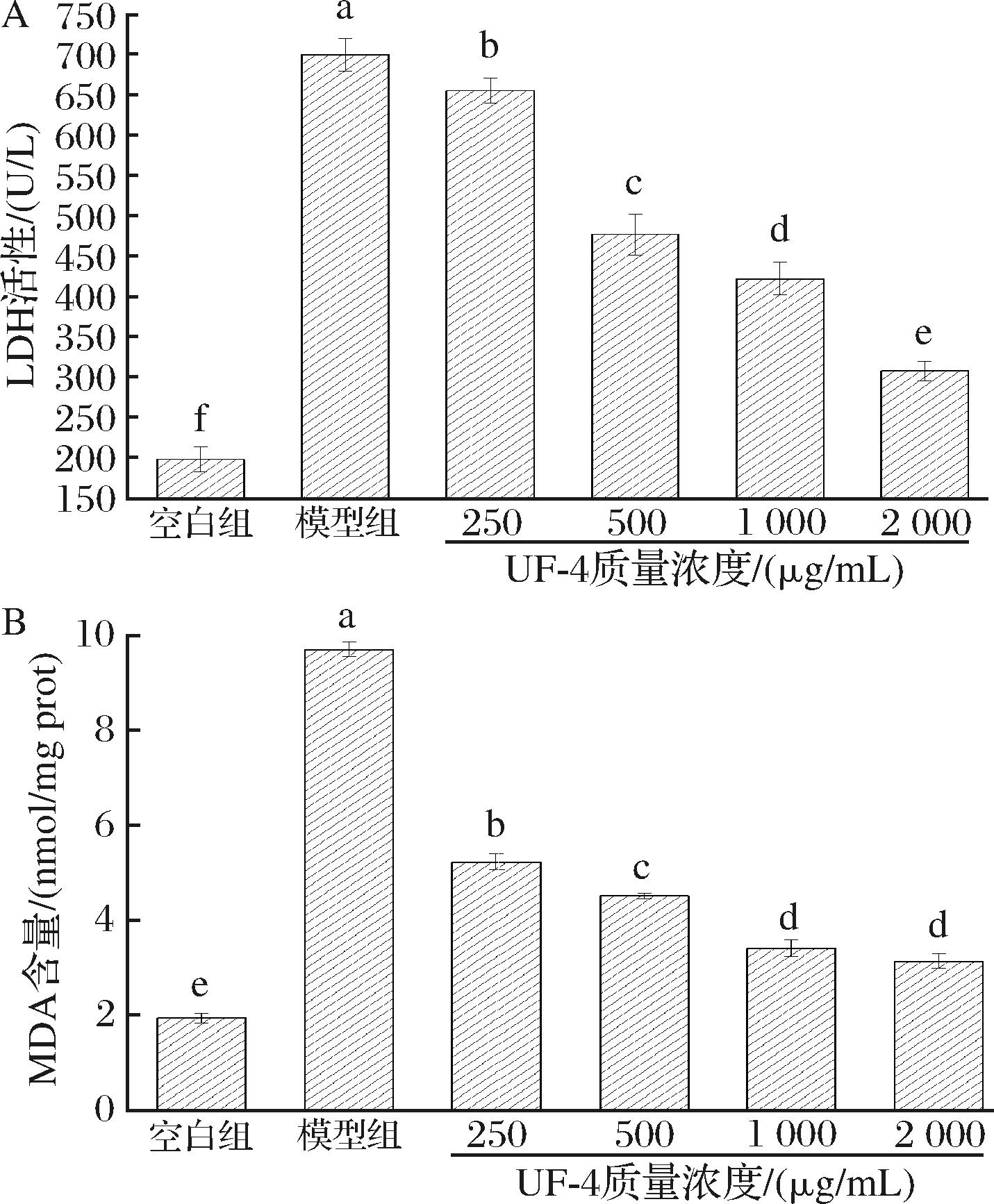
A-胞外LDH活性;B-胞内MDA含量
图2 UF-4对H2O2诱导氧化损伤4T1细胞胞外LDH活性及胞内MDA含量的影响
Fig.2 Effect of H2O2 induced oxidative damage on extracellular LDH release activity and intracellular MDA content in 4T1 cells
细胞发生氧化应激常伴随着脂质氧化反应的发生。作为脂质过氧化的最终产物,MDA直接反映脂质过氧化程度,也间接反映了细胞氧化应激损伤程度[21]。如图2-B所示,空白组胞内MDA含量为(1.94±0.10) nmol/mg prot,经过200 μmol H2O2刺激4 h后,模型组胞内MDA含量达到了(9.70±0.15) nmol/mg prot,为空白组的5倍,说明损伤组细胞内发生了脂质过氧化。而经过UF-4预处理后,MDA含量极显著降低(P<0.01)。终质量浓度为250 μg/mL的UF-4即可将MDA的增加量降低57.69%,说明UF-4对H2O2诱导的4T1细胞脂质过氧化损伤具有一定的保护作用。这与MA等[22]报道的螺旋藻低分子质量组分(<3 kDa)能显著抑制L02氧化损伤细胞中MDA含量增加的结果一致。
2.2.3 UF-4对H2O2诱导的4T1细胞胞内抗氧化因子及抗氧化酶水平的影响
GSH是人体非酶抗氧化系统中最重要的组成成分,可通过可逆的翻译后修饰(谷胱甘肽化)保护蛋白质免受氧化,减少活性氧介导的氧化损伤。此外,它还可以螯合促氧化金属离子,调控氧化还原依赖性信号转导途径[23]。SOD和CAT均属于酶抗氧化酶系统。SOD催化超氧化物自由基歧化为H2O2,CAT催化H2O2生成H2O和O2[24]。如表3所示,模型组GSH含量及SOD、CAT活性均极显著低于空白组(P<0.01)。说明4T1细胞在H2O2诱导的氧化应激状态下,大量消耗了GSH、SOD及CAT。而经过终质量浓度为250、500、1 000、2 000 μg/mL的UF-4预处理后,4T1细胞中的GSH含量及SOD、CAT活性均得到极显著提高(P<0.01)。其中,当UF-4终质量浓度为2 000 μg/mL时,SOD活性由(12.43±1.59) U/mg prot提高到(30.80±1.36) U/mg prot,与空白组无显著性差异(P<0.05)。在植物源[25-26]、动物源[27]、真菌源[19]抗氧化肽组分发挥胞内抗氧化作用的实验中,均可观察到抗氧化因子及抗氧化酶水平的提高。
表3 UF-4对H2O2诱导的4T1细胞胞内抗氧化因子及抗氧化酶水平的影响
Table 3 Effects of UF-4 on intracellular antioxidant factors and antioxidant enzymes in 4T1 cells induced by H2O2
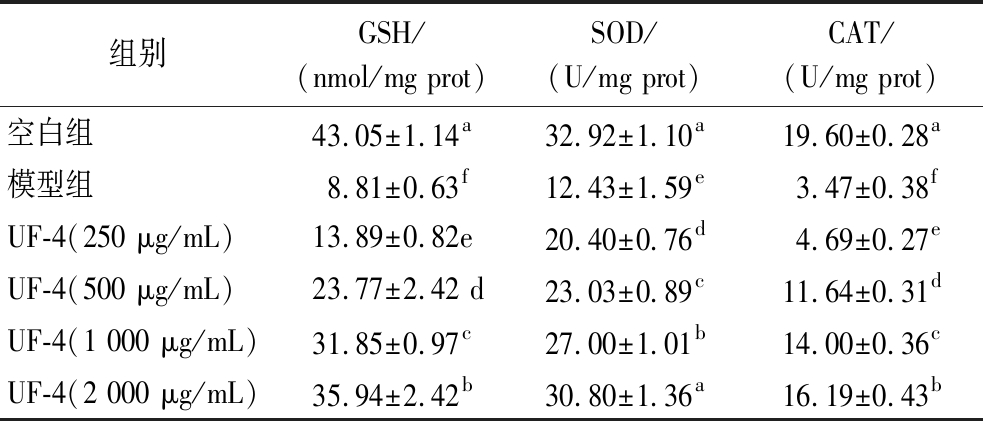
组别GSH/(nmol/mg prot)SOD/(U/mg prot)CAT/(U/mg prot)空白组43.05±1.14a32.92±1.10a19.60±0.28a模型组8.81±0.63f12.43±1.59e3.47±0.38fUF-4(250 μg/mL)13.89±0.82e20.40±0.76d4.69±0.27eUF-4(500 μg/mL)23.77±2.42 d23.03±0.89c11.64±0.31dUF-4(1 000 μg/mL)31.85±0.97c27.00±1.01b14.00±0.36cUF-4(2 000 μg/mL)35.94±2.42b30.80±1.36a16.19±0.43b
2.3 UF-4序列鉴定
利用nanoLC-ESI-Orbitrap-MS/MS对UF-4进行序列鉴定。UF-4经过毛细管高效色谱分离,图3为其总离子流色谱图。随后,肽段经过电喷雾(electrospray ionization,ESI)离子化,进入轨道阱(orbitrap)质量分析器筛选出目标离子,检测器采集信号并记录交由软件处理成一级质谱图。一级质谱出现的是分子离子峰,可确定多肽分子质量。二级质谱是在一级质谱的基础上将一级质谱中的母离子通过HCD进一步解离成碎片离子,得到碎片离子峰。在Uniprot蛋白质数据库中检索出物种为Perilla frutescens的全部蛋白质序列,计算机模拟碱性蛋白酶酶切获得肽段序列,随后肽段模拟HCD碎裂获得理论二级质谱图,将实际二级质谱图与理论二级质谱图进行比对、打分,从而获得肽段序列信息。UF-4共鉴定出495条多肽序列。表4列出了得分前五的多肽的鉴定结果。
图3 UF-4毛细管色谱总离子流色谱图
Fig.3 Total ion flow chromatogram of UF-4 capillary chromatograph
表4 得分最高的前5条肽段的详细鉴定结果
Table 4 Detailed identification results of the first five peptides with high scores
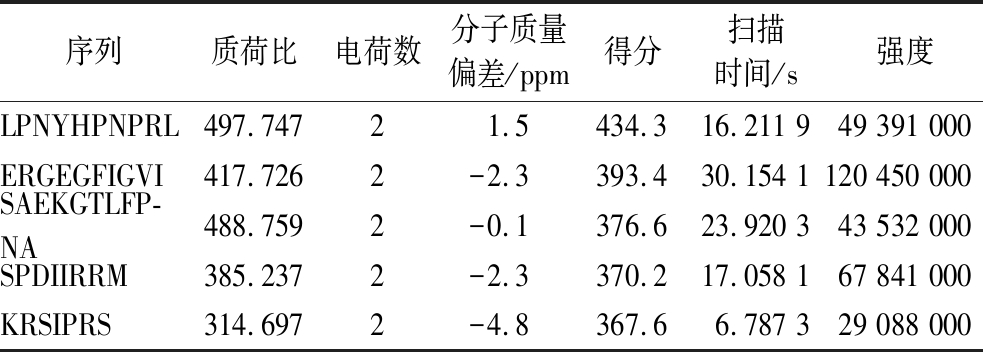
序列质荷比电荷数分子质量偏差/ppm得分扫描时间/s强度LPNYHPNPRL497.74721.5434.316.211 949 391 000ERGEGFIGVI417.7262-2.3393.430.154 1120 450 000SAEKGTLFP-NA488.7592-0.1376.623.920 343 532 000SPDIIRRM385.2372-2.3370.217.058 167 841 000KRSIPRS314.6972-4.8367.66.787 329 088 000
2.4 网络药理学研究
2.4.1 潜在活性成分
潜在活性成分的筛选标准为Peptide Ranker得分≥0.8、氢键受体个数≤10、不具有血脑屏障透过性、是糖蛋白底物、疏水常数≤0.5、生物可用性得分≥0.17。共筛选出18个潜在活性成分,结果见表5。
表5 UF-4中潜在活性成分
Table 5 Potential active ingredients in UF-4
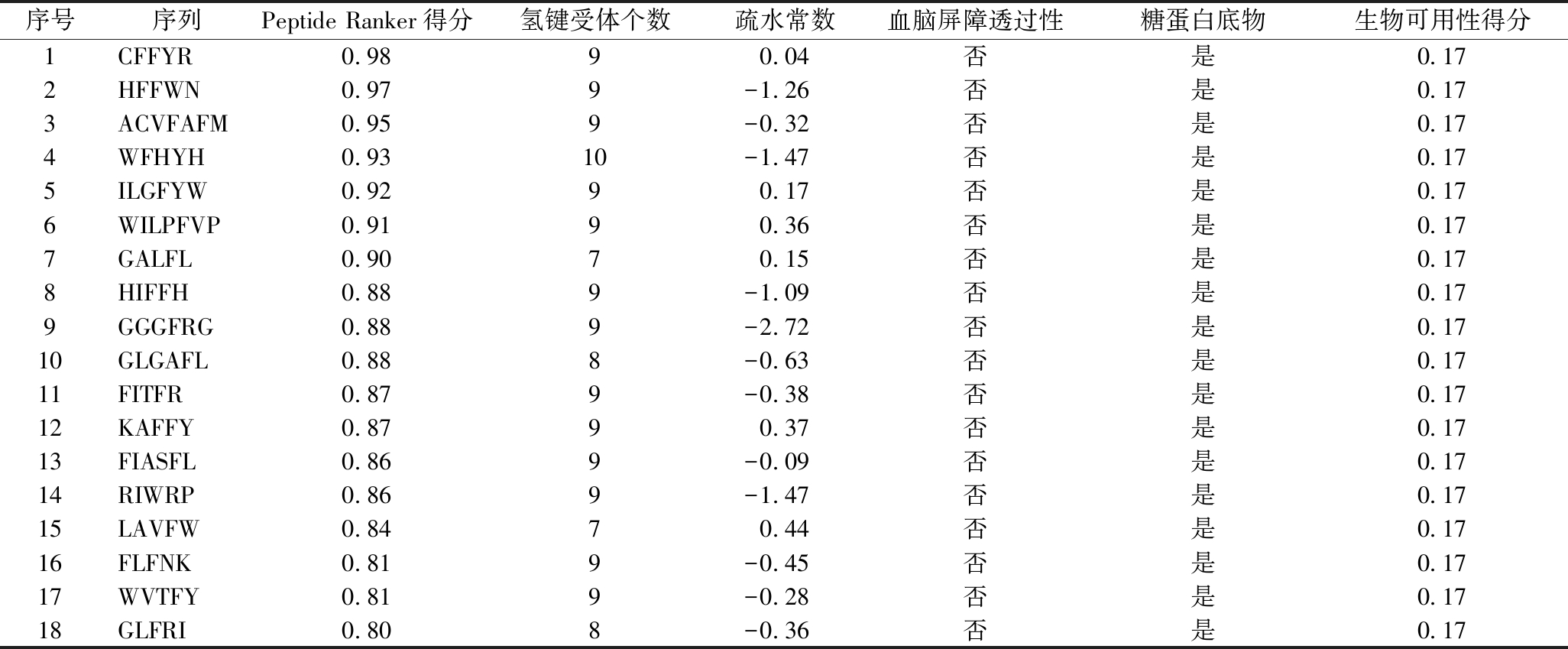
序号序列Peptide Ranker得分氢键受体个数疏水常数血脑屏障透过性糖蛋白底物生物可用性得分1CFFYR0.98 90.04否是0.172HFFWN0.97 9-1.26否是0.173ACVFAFM0.95 9-0.32否是0.174WFHYH0.93 10-1.47否是0.175ILGFYW0.92 90.17否是0.176WILPFVP0.91 90.36否是0.177GALFL0.90 70.15否是0.178HIFFH0.88 9-1.09否是0.179GGGFRG0.88 9-2.72否是0.1710GLGAFL0.88 8-0.63否是0.1711FITFR0.87 9-0.38否是0.1712KAFFY0.87 90.37否是0.1713FIASFL0.86 9-0.09否是0.1714RIWRP0.86 9-1.47否是0.1715LAVFW0.84 70.44否是0.1716FLFNK0.81 9-0.45否是0.1717WVTFY0.81 9-0.28否是0.1718GLFRI0.80 8-0.36否是0.17
2.4.2 药物作用于疾病的核心靶点与PPI网络分析
如图4-A所示,使用Swiss Target Prediction获得UF-4潜在活性成分作用靶点288个,以“antioxidant”为关键词在GeneCard数据库搜索得靶点4 516个,两者取交集获得核心靶点176个,占UF-4潜在活性成分作用靶点总数的61.11%,UF-4对氧化应激的靶点映射率为3.90%,说明UF-4在抗氧化应激方面具有显著特异性。

A-抗氧化核心靶点;B-核心靶点的PPI网络互作图
图4 UF-4抗氧化核心靶点及其PPI网络互作图
Fig.4 Interaction diagram of UF-4 antioxidant core targets and their PPI network
将176个交集靶点提交至STRING平台构建PPI网络,并在Cytoscape软件进行可视化。如图4-B所示,PPI网络共有176个节点、470条边。节点代表蛋白,边代表蛋白与蛋白之间的相互作用。每个节点根据Betweeness值以不同大小呈现,Betweeness值越大,节点面积越大,颜色越深。
分别采用Cytohubba插件中BC、CC、DC 3种算法筛选出PPI网络中前10个主要靶点。取交获得核心基因6个(表6),分别为非受体酪氨酸激酶c(non-receptor tyrosine kinase c, SRC)、信号转导及转录激活蛋白3(signal transducer and activator of transcription 3, STAT3)、热休克蛋白90 kDa(heat shock protein 90 alpha family class A member 1, HSP90AA1)、原癌基因LCK, Src家族酪氨酸激酶(LCK proto-oncogene, Src family tyrosine kinase, LCK)、丝裂原活化蛋白激酶1(mitogen-activated protein kinase 1, MAPK1)、FYN原癌基因,Src家族酪氨酸激酶(FYN proto-oncogene, Src family tyrosine kinase, FYN)。
表6 核心靶点拓扑分析
Table 6 Core targets topology analysis
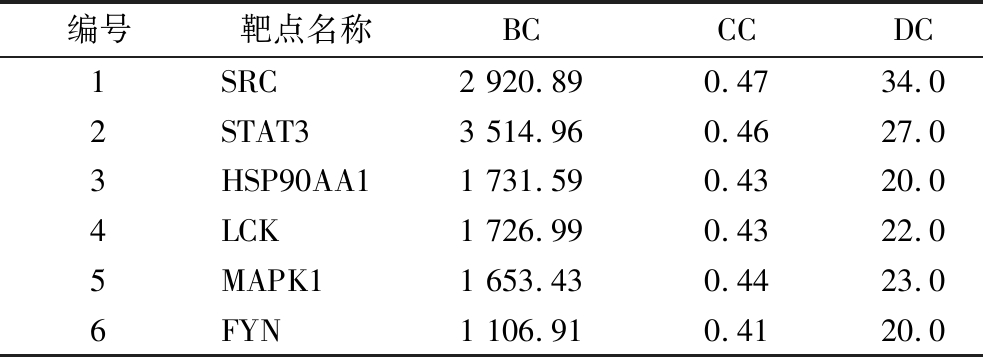
编号靶点名称BCCCDC1SRC2 920.890.4734.02STAT33 514.960.4627.03HSP90AA11 731.590.4320.04LCK1 726.990.4322.05MAPK11 653.430.4423.06FYN1 106.910.4120.0
SRC、LCK、FYN同属SRC激酶家族(Src family kinase, SFK)的成员。其中SRC是目前研究最多的SRC激酶。SRC被激活后是许多生化级联反应的关键点,可介导NADPH氧化酶(reduced nicotinamide adenine dinucleotide phosphate oxidase/NADPH oxidase,NOX)激活从而增加 ROS 水平,而增加的ROS水平可以通过促进关键半胱氨酸残基的氧化和硫化进一步激活SRC[28]。SRC还与非偶联内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)在血管内皮生长因子(vascular endothelial growth factor,VEGF)的刺激下磷酸化HSP90的Thr300残基,促进eNOS与HSP90的偶联,促进NO的释放,且在NO的负反馈调节机制中仍然存在SRC的作用[29]。此外,SRC还调节核因子-E2相关因子的核输出及降解,抑制下游抗氧化酶基因的表达[30]。信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)调节人类正常和恶性组织中的许多关键功能,例如分化,增殖,存活,血管生成和免疫功能。STAT3在癌症的发生和进展中发挥着重要的作用,是目前癌症治疗的重要靶标[31]。同时,在其他研究条件下,STAT3也可激活JAK-STAT3、MAPK-ERK、PI3-AKT等通路保护细胞免受氧化损伤[32]。MAPK1也称ERK2,属于丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)家族,是控制许多基本细胞过程的重要途径,如细胞增殖、氧化应激、存活和凋亡[33],因此,MAPK1可能在细胞氧化应激的调节中发挥重要作用。HSP90AA1是热休克蛋白90α的核心成员,在细胞应激如高温、紫外线、氧化剂中发挥重要作用,HSP90α蛋白可通过激活NF-κB通路和STAT3转录诱导炎症,加重氧化应激[34]。
2.4.3 GO和KEGG分析
使用DAVID数据库对176个共同靶点从细胞组成(cell composition, CC)、分子功能(molecular function, MF)和生物学过程(biological process, BP)3个方面进行GO富集分析,按P值由小到大排列,图5-A展示了每部分前10个GO条目的富集情况。图中圆圈大小表示基因富集数量,颜色代表基因P值大小。CC部分主要富集在质膜(plasma membrane)、细胞表面(cell surface)、粘着斑(focal adhesion)、胞外区(extracellular region)及突触外膜(postsynaptic membrane)等;MF部分主要富集在内肽酶活性(endopeptidase activity)、肽酶活性(peptidase activity)、丝氨酸型内肽酶活性(serine-type endopeptidase activity)、金属内肽酶活性(metalloendopeptidase activity)及酶结合(enzyme binding)等;BP部分主要富集在蛋白水解(proteolysis)、细胞外基质分解(extracellular matrix disassembly)、缺氧反应(response to hypoxia)、胶原蛋白分解代谢过程(collagen catabolic process)及胞浆钙离子浓度的正调节(positive regulation of cytosolic calcium ion concentration)等。
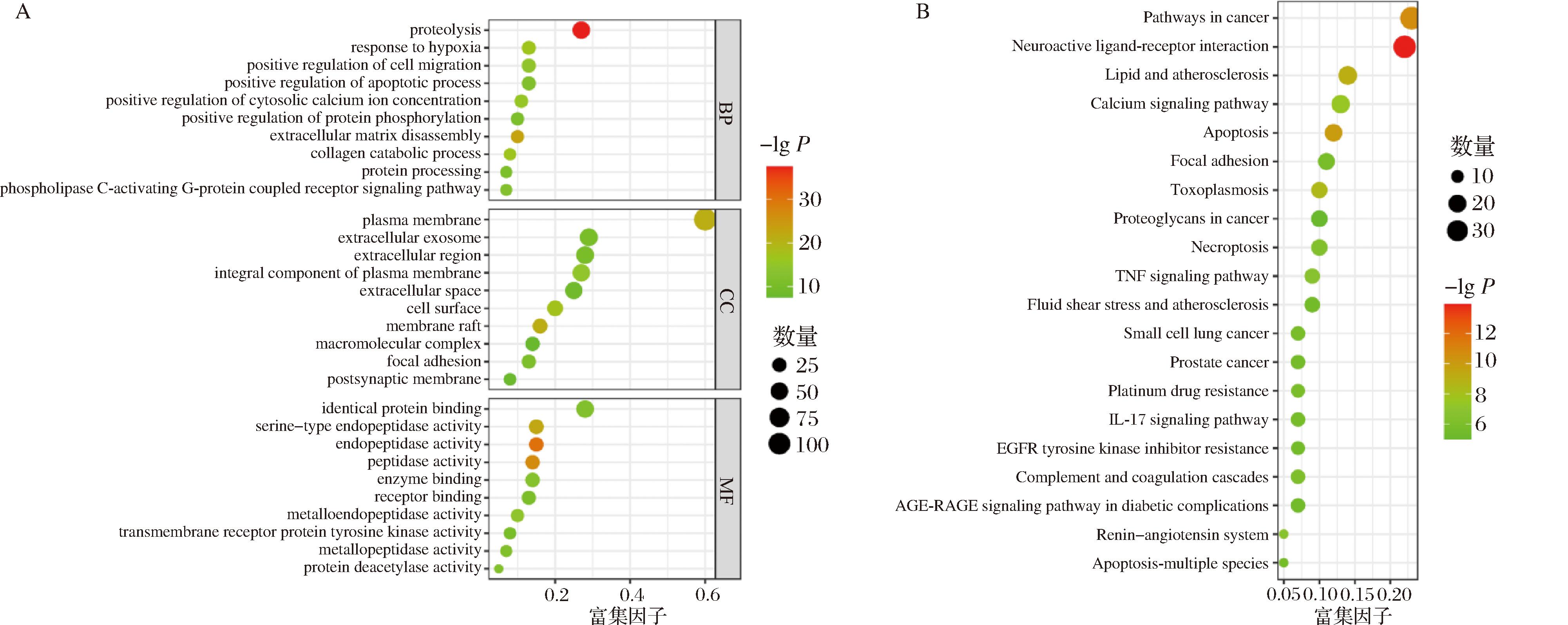
A-GO富集分析;B-KEGG富集分析
图5 UF-4抗氧化潜在靶点GO和KEGG富集分析
Fig.5 GO and KEGG enrichment analysis of UF-4 antioxidant potential targets
通过DAVID数据库对176个共同靶点进行KEGG富集分析,按P值由小到大排列,共得到72条KEGG条目。图5-B展示了前20个KEGG条目的富集情况,包括细胞凋亡(Apoptosis)、脂质与动脉粥样硬化(Lipid and atherosclerosis)、钙信号通路(Calcium signaling pathway)、TNF信号通路(TNF signaling pathway)、IL-17信号通路(IL-17 signaling pathway)、AGE-RAGE信号通路(AGE-RAGE signaling pathway)等。研究表明,Ca2+信号通过靶向主要ROS生成位点(包括线粒体呼吸和NOX酶)来控制ROS水平[35],TNF信号通路和IL-17信号通路是促发炎症的关键信号通路,ROS可通过AGE-RAGE信号通路间接导致核转录因子NF-κB磷酸化并调控多种损伤反应相关基因的表达[36]。表明UF-4主要作用于细胞凋亡相关通路、脂质与动脉粥样硬化相关通路、钙调节相关通路、炎症相关通路等调节氧化应激,且各通路间存在相互联系和影响。
2.4.4 分子对接结果
由交集靶点的PPI核心网络图以及拓扑分析可知,SRC、STAT3、HSP90AA1、LCK、MAKP1、FYN等是UF-4潜在活性成分作用于氧化应激的关键靶点,因此以SRC代表SRC激酶家族,以SRC(PDB ID:4U5 J)、STAT3(PDB ID:1BJ1)、HSP90AA1(PDB ID:2YI7)、LCK(PDB ID:1QPD)、MAKP1(PDB ID:4H3P)、FYN(PDB ID:2DQ7)作为蛋白受体,以2.4.1节中18个潜在活性成分作为配体进行分子对接,作为初步的验证。
CDOCKER是discovery studio中基于分子动力学的半柔性对接,可在CHARMm立场下产生高精度分子对接结果。-CDOCKER ENERGY值越高,表明受体与配体对接亲和力越强,相互作用越强。结果如表7所示,UF-4中18个潜在成分可全部与STAT3对接成功,其次是LCK、FYN、SRC、MAPK1、HSP90AA1,对接成功的个数分别为17、15、12、11、5,说明靶点与对应活性成分之间亲合度较高。此外GALFL、GGGFRG、GLGAFL、LAVFW与6个靶点全部对接成功,其中GGGFRG与6个靶点的总-CDOCKER ENERGY最高,图6对其相互作用进行了展示。
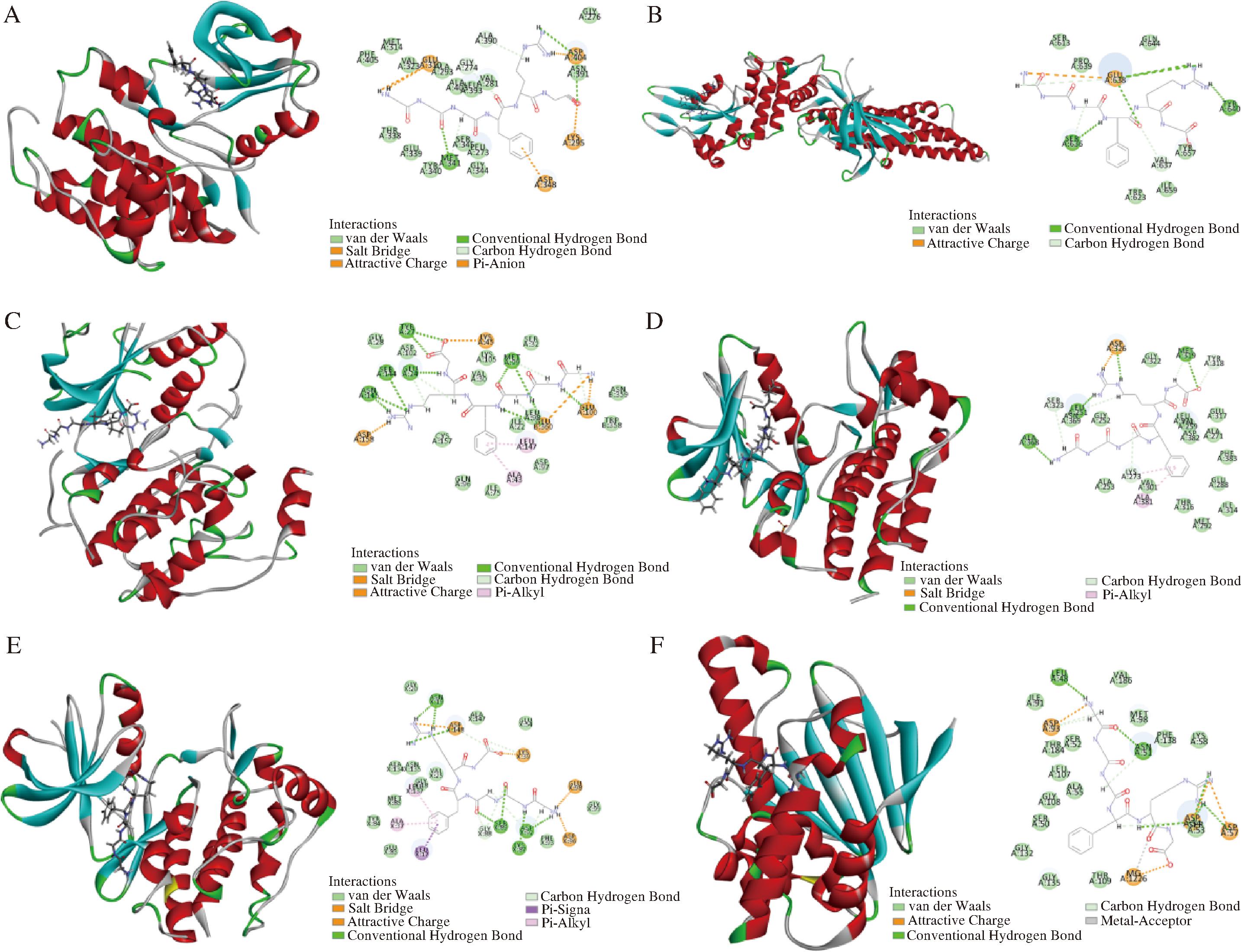
A-GGGFRG-SRC; B-GGGFRG-STAT3; C-GGGFRG-MAPK1; D-GGGFRG-LCK; E-GGGFRG-FYN; F-GGGFRG-HSP90AA1
图6 GGGFRG与核心靶点分子对接示意图
Fig.6 Diagrams of GGGFRG docking with core targets
表7 UF-4潜在活性成分和核心靶点分子对接结果
Table 7 The docking results of UF-4 potential active ingredients and core target molecules
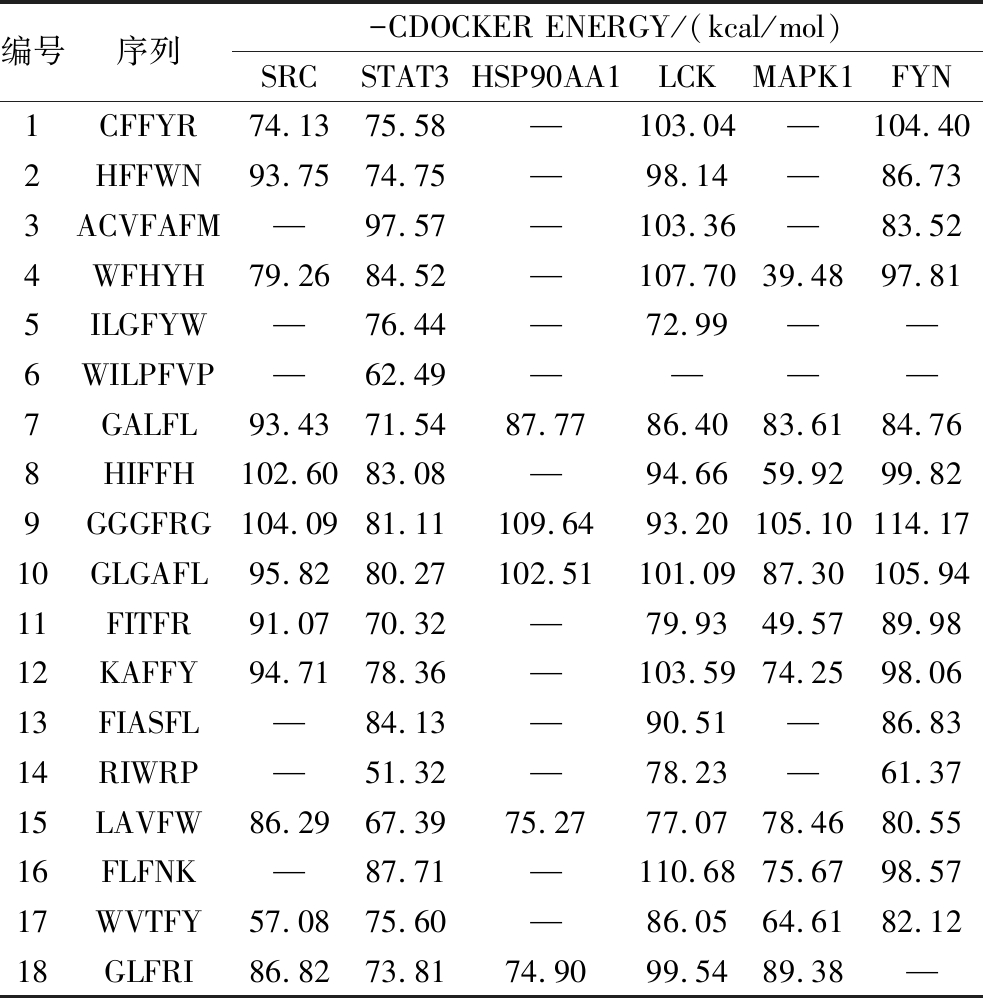
注:—表示未给出。
编号序列-CDOCKER ENERGY/(kcal/mol)SRCSTAT3HSP90AA1LCKMAPK1FYN1CFFYR74.1375.58—103.04—104.402HFFWN93.7574.75—98.14—86.733ACVFAFM—97.57—103.36—83.524WFHYH79.2684.52—107.7039.4897.815ILGFYW—76.44—72.99——6WILPFVP—62.49————7GALFL93.4371.5487.7786.4083.6184.768HIFFH102.6083.08—94.6659.9299.829GGGFRG104.0981.11109.6493.20105.10114.1710GLGAFL95.8280.27102.51101.0987.30105.9411FITFR91.0770.32—79.9349.5789.9812KAFFY94.7178.36—103.5974.2598.0613FIASFL—84.13—90.51—86.8314RIWRP—51.32—78.23—61.3715LAVFW86.2967.3975.2777.0778.4680.5516FLFNK—87.71—110.6875.6798.5717WVTFY57.0875.60—86.0564.6182.1218GLFRI86.8273.8174.9099.5489.38—
GGGFRG与各靶点间的主要相互作用力有氢键(Conventional Hydrogen Bond)、盐键(Salt Bridge)、静电吸引力(Attractive Charge)、范德华力(Van der Waals)、π-阴离子(π-Anion)、π-烷基(π-Akyl)、π-Sigma等。其中氢键是稳定配体-受体复合物的主要力量。GGGFRG中的酰胺基、C端羧基中的氧原子作为氢受体,精氨酸侧链胍基、N端氨基中的氢原子作为氢供体参与琴键的形成。如在GGGFRGC端羧基与SRC中Asn391,MAPK1中Tyr27,LCK中Met319形成氢键;精氨酸侧链胍基与SRC中Asp404,STAT3中Glu638,MAPK1中Ser144、Asn145,LCK中Asp326,FYN中Asn19,HSP90AA1中Asp54、Asp57形成氢键;与酰胺基形成的氢键有SRC中Met34,STAT3中Glu638、Ser636,MAPK1中Glu24、Met99、Leu98,FYN中Ser89、Asp89、Asp92,HSP90AA1中Asn51、Asp54;与N端氨基形成氢键的有LCK中Ala368、FYN中Asp92、HSP90AA1中Leu48。此外GGGFRG中N端氨基、N端羧基以及精氨酸侧链胍基还参与盐键、静电吸引力的形成,苯丙氨酸残基侧链中的苯环参与π-阴离子、π-烷基、π-Sigma等相互作用力的形成。总之,GGGFRG对各靶点的结合口袋均具有较高的适配性,具有进一步研究的潜力。
3 结论
本研究基于体外实验和网络药理学探讨了紫苏粕多肽抗氧化应激的作用机制。研究表明了紫苏粕小分子量多肽UF-4在体内和体外都具有抗氧化活性,其清除DPPH自由基和ABTS阳离子自由基的IC50值为(1.00±0.08)、(0.27±0.04) mg/mL;可通过改善细胞膜损伤、降低胞内MDA含量,提高抗氧化因子GSH的含量及抗氧化酶SOD、CAT活性,保护4T1细胞免受氧化应激;nanoLC-ESI-Orbitrap-MS/MS鉴定UF-4由495种多肽组成,从中筛选出潜在活性成分18种,这些肽段作用于细胞凋亡、脂质与动脉粥样硬化、钙调节以及炎症相关通路以调节氧化应激,系统性阐释了UF-4体内抗氧化应激过程中多靶点、多通路的作用特点。后续仍需进一步通过小鼠试验对网络药理学中预测的结果进行验证,以期为紫苏粕多肽的应用提供理论依据及数据参考。
[1] ZHANG H J, LI H Z, ZHANG Z J, et al. Optimization of ultrasound-assisted extraction of polysaccharides from perilla seed meal by response surface methodology: Characterization and in vitro antioxidant activities[J]. Journal of Food Science, 2021, 86(2):306-318.
[2] 任志清, 李会珍, 张志军, 等. 不同品种紫苏叶迷迭香酸的提取及其生物活性[J]. 现代食品科技, 2021, 37(1):92-100.REN Z Q, LI H Z, ZHANG Z J, et al. Extraction of rosmarinic acid from different varieties of Perilla leaves and its biological activity[J]. Modern Food Science and Technology, 2021, 37(1):92-100.
[3] HWANG Y J, KIM J M, YOON K Y. Characteristics of water-soluble polysaccharides extracts produced from Perilla seed meal via enzymatic hydrolysis[J]. CyTA-Journal of Food, 2020, 18(1):653-661.
[4] TANTIPAIBOONWONG P, CHAIWANGYEN W, SUTTAJIT M, et al. Molecular mechanism of antioxidant and anti-inflammatory effects of omega-3 fatty acids in Perilla seed oil and rosmarinic acid rich fraction extracted from Perilla seed meal on TNF-α induced A549 lung adenocarcinoma cells[J]. Molecules, 2021, 26(22):6757.
[5] HASHIMOTO M, MATSUZAKI K, HOSSAIN S, et al. Perilla seed oil enhances cognitive function and mental health in healthy elderly Japanese individuals by enhancing the biological antioxidant potential[J]. Foods, 2021, 10(5):1130.
[6] RAO C V, PATLOLLA J M R, COOMA I, et al. Prevention of familial adenomatous polyp development in APC Min mice and azoxymethane-induced colon carcinogenesis in F344 Rats by ω-3 fatty acid rich Perilla oil[J]. Nutrition and Cancer, 2013, 65(Suppl 1):54-60.
[7] 胡东亚, 张志军, 曹千慧, 等. 紫苏饼粕的残油醇提工艺及品质分析[J]. 现代食品科技, 2022, 38(2):218-223; 271.HU D Y, ZHANG Z J, CAO Q H, et al. Alcohol extraction process and quality analysis of residual oil from Perilla cake meal[J]. Modern Food Science and Technology, 2022, 38(2):218-223; 271.
[8] MIRZAEI M, MIRDAMADI S, EHSANI M R, et al. Production of antioxidant and ACE-inhibitory peptides from Kluyveromyces marxianus protein hydrolysates: Purification and molecular docking[J]. Journal of Food and Drug Analysis, 2018, 26(2):696-705.
[9] LIGUORI I, RUSSO G, CURCIO F, et al. Oxidative stress, aging, and diseases[J]. Clinical Interventions in Aging, 2018, 13:757-772.
[10] 高蕾蕾. 牡丹籽蛋白的理化和功能特性及多肽的抗氧化活性研究[D]. 济南: 齐鲁工业大学, 2018.GAO L L. Study on physicochemical and functional properties of tree peony seed protein and antioxidant activity of polypeptides[D]. Jinan: Qilu University of Technology, 2018.
[11] SHAO T T, HUANG K. Network pharmacology-based analysis on Lonicera japonica for chronic osteomyelitis treatment[J]. Journal of Oncology, 2022, 2022:1706716.
[12] 卢韵君. 鱼源胶原蛋白肽酶解工艺及其分子量检测方法研究[D]. 广州: 华南理工大学, 2016.LU Y J. Enzymatic hydrolysis and molecular weight detection method of fish collagen peptide[D]. Guangzhou: South China University of Technology, 2016.
[13] 宋永令, 李江河, 王若兰. 谷朊粉糖基化改性对其结构及溶解性的影响[J]. 中国粮油学报, 2016, 31(12):125-131; 138.SONG Y L, LI J H, WANG R L. Structure and solubility of gluten-polysaccharide conjugates[J]. Journal of the Chinese Cereals and Oils Association, 2016, 31(12):125-131; 138.
[14] YANG Z, MO Y N, CHENG F, et al. Antioxidant effects and potential molecular mechanism of action of Limonium aureum extract based on systematic network pharmacology[J]. Frontiers in Veterinary Science, 2022, 8:775490.
[15] FAMUWAGUN A A, ALASHI A M, GBADAMOSI O S, et al. Antioxidant and enzymes inhibitory properties of Amaranth leaf protein hydrolyzates and ultrafiltration peptide fractions[J]. Journal of Food Biochemistry, 2021, 45(3): e13396.
[16] YANG L H, GUO Z L, WEI J Q, et al. Extraction of low molecular weight peptides from bovine bone using ultrasound-assisted double enzyme hydrolysis: Impact on the antioxidant activities of the extracted peptides[J]. LWT, 2021, 146:111470.
[17] HYMAN L M, FRANZ K J. Probing oxidative stress: Small molecule fluorescent sensors of metal ions, reactive oxygen species, and thiols[J]. Coordination Chemistry Reviews, 2012, 256(19-20):2333-2356.
[18] QIAN Z J, JUNG W K, BYUN H G, et al. Protective effect of an antioxidative peptide purified from gastrointestinal digests of oyster, Crassostrea gigas against free radical induced DNA damage[J]. Bioresource Technology, 2008, 99(9):3365-3371.
[19] KIMATU B M, FANG D L, ZHAO L Y, et al. Agaricus bisporus peptide fractions confer cytoprotective ability against hydrogen peroxide-induced oxidative stress in HepG2 and Caco-2 cells[J]. Journal of Food Measurement and Characterization, 2020, 14(5):2503-2519.
[20] PENG B, CAI B N, PAN J Y. Octopus-derived antioxidant peptide protects against hydrogen peroxide-induced oxidative stress in IEC-6 cells[J]. Food Science &Nutrition, 2022, 10(11):4049-4058.
[21] JELIC M D, MANDIC A D, MARICIC S M, et al. Oxidative stress and its role in cancer[J]. Journal of Cancer Research and Therapeutics, 2021, 17(1):22-28.
[22] MA J, ZENG X K, ZHOU M, et al. Inhibitory effect of low-molecular-weight peptides (0-3 kDa) from Spirulina platensis on H2O2-induced oxidative damage in L02 human liver cells[J]. Bioresources and Bioprocessing, 2021, 8(1):36.
[23] ZHAO H M, RUAN H H, LI H T. Progress in the research of GSH in cells[J]. Chinese Science Bulletin, 2011, 56(28):3057.
[24] PRABHA N, GURU A, HARIKRISHNAN R, et al. Neuroprotective and antioxidant capability of RW20 peptide from histone acetyltransferases caused by oxidative stress-induced neurotoxicity in in vivo zebrafish larval model[J]. Journal of King Saud University-Science, 2022, 34(3):101861.
[25] WANG L Y, DING L, YU Z P, et al. Intracellular ROS scavenging and antioxidant enzyme regulating capacities of corn gluten meal-derived antioxidant peptides in HepG2 cells[J]. Food Research International, 2016, 90:33-41.
[26] 穆秋霞, 赵玉滨, 董宪慧, 等. 英国红芸豆抗氧化肽组分对H2O2诱导PC12细胞氧化应激损伤的保护作用[J]. 食品工业科技, 2022, 43(8):348-356.MU Q X, ZHAO Y B, DONG X H, et al. Protective effects of British red kidney bean antioxidant peptide components on H2O2 induced oxidative stress damage in PC12 cells[J]. Science and Technology of Food Industry, 2022, 43(8):348-356.
[27] HE Y, BU L J, XIE H D, et al. Characteristics of antioxidant substances and identification of antioxidant peptides in duck embryo eggs[J]. British Poultry Science, 2022, 63(6):779-787.
[28] HUSSAIN M, IKRAM W, IKRAM U. Role of c-Src and reactive oxygen species in cardiovascular diseases[J]. Molecular Genetics and Genomics: MGG, 2023, 298(2):315-328.
[29] 伍鹏龙, 魏盟, 朱伟. Src信号通路及在心力衰竭病理生理中的作用[J]. 国际心血管病杂志, 2013, 40(1):6-8; 15.WU P L, WEI M, ZHU W. Src signaling pathway and its role in pathophysiology of heart failure[J]. International Journal of Cardiovascular Disease, 2013, 40(1):6-8; 15.
[30] NITURE S K, JAIN A K, SHELTON P M, et al. Src subfamily kinases regulate nuclear export and degradation of transcription factor Nrf2 to switch off Nrf2-mediated antioxidant activation of cytoprotective gene expression[J]. The Journal of Biological Chemistry, 2011, 286(33):28821-28834.
[31] WANG X C, CROWE P J, GOLDSTEIN D, et al. STAT3 inhibition, a novel approach to enhancing targeted therapy in human cancers (review)[J]. International Journal of Oncology, 2012, 41(4):1181-1191.
[32] BARRY S P, TOWNSEND P A, MCCORMICK J, et al. STAT3 deletion sensitizes cells to oxidative stress[J]. Biochemical and Biophysical Research Communications, 2009, 385(3):324-329.
[33] MO Y N, CHENG F, YANG Z, et al. Antioxidant activity and the potential mechanism of the fruit from Ailanthus altissima swingle[J]. Frontiers in Veterinary Science, 2021, 8:784898.
[34] CHEN M L, SU W X, CHEN F L, et al. Mechanisms underlying the therapeutic effects of 4-octyl itaconate in treating sepsis based on network pharmacology and molecular docking[J]. Frontiers in Genetics, 2022, 13:1056405.
[35] MADREITER-SOKOLOWSKI C T, THOMAS C, RISTOW M. Interrelation between ROS and Ca2+ in aging and age-related diseases[J]. Redox Biology, 2020, 36:101678.
[36] 夏悦昕, 刘志远, 宋文倩, 等. 先天性纯红细胞再生障碍性贫血氧化应激相关差异表达基因的生物信息学分析[J]. 临床输血与检验, 2023, 25(1):82-87.XIA Y X, LIU Z Y, SONG W Q, et al. Identification of key genes and pathways associated with DBA by bioinformatics analysis[J]. Journal of Clinical Transfusion and Laboratory Medicine, 2023, 25(1):82-87.