荞麦属于蓼科,为一年生双子叶作物。目前,在亚洲、欧洲和美洲广泛种植的2种品种分别为普通荞麦(common buckwheat)和苦荞(tartary buckwheat)[1]。中国是栽培苦荞的起源国和大面积种植国,在四川省凉山彝族自治州,苦荞的种植成为了当地高山和丘陵地区农民的主要收入来源。与普通荞麦相比,苦荞在某些功能性上显得相当独特,包括低胆固醇活性、抑制体内脂肪积累、抗高血压和减少结肠癌的发生等[2]。已有文献报道,荞麦可以作为乳糜泻患者无麸质食品的主要成分[3]。当前已开发出各种荞麦食品,包括醋、啤酒、饼干、麦片等,并且这些荞麦制品大多数已能从市场上买到。
黑苦荞属于苦荞的一种,因其黑色的外壳被成为“黑珍珠”,而淀粉是黑苦荞全粉中的主要成分,占其干重的75%以上[4]。因此,淀粉质量在很大程度上决定了黑苦荞食品的质量。湿磨通常用于提取淀粉,首先在低浓度的碱溶液中浸泡种子,使得纤维分离,随后将淀粉悬浮离心、纯化、脱水和干燥[5]。强碱可以通过攻击脱水葡萄糖单体单元上的一个或多个官能团来降解淀粉,并且碱也有助于水渗透,从而使淀粉颗粒膨胀,但该法对环境污染较大。张国权[6]也曾采用碱性蛋白酶水解工艺分离荞麦(榆荞2号)淀粉,并获得了荞麦蛋白产品,提高了利用率。可见,提取方法可以决定淀粉的纯度和结构,这导致淀粉不同的功能特性。另外,了解淀粉的理化和结构有利于进一步将其应用到食品加工中,扩大黑苦荞的应用范围。
不同荞麦淀粉之间的差异显著,淀粉颗粒的形状大小受到研磨方法、栽培气候和条件、生物来源等多因素的影响[7]。目前的研究品种大多数集中在普通荞麦和黄苦荞,而对黑苦荞淀粉的提取以及理化结构特性之间的研究报道较少。因此,本研究选取了普通荞麦淀粉作为对照,以黑苦荞全粉为原料,采用常用的酶法和碱浸法提取黑苦荞淀粉,对2种方法制备的黑苦荞淀粉的特性进行系统研究,主要包括基本营养成分、微观形貌、溶解度、膨胀度、长/短程结构、热稳定性和直/支链淀粉分布,以期为提高对黑苦荞淀粉的认识和利用提供方向和建议,并扩大黑苦荞淀粉在食品工业领域的应用。
1 材料与方法
1.1 材料与试剂
黑苦荞全粉,环太生物科技股份有限公司;普通荞麦淀粉,富源淀粉有限公司;直链淀粉试剂盒(A152-1-1),南京建成生物工程研究所;葡萄糖氧化酶检测试剂盒,Biosharp公司;木瓜蛋白酶、糖化酶(100 000 U/g)、DNS试剂(NY/T法)、α-淀粉酶(20 000 U/g),源叶生物有限公司;无水乙醇、氢氧化钾、氢氧化钠和所有其他使用的化学品都是分析级的;溴化钾为光谱纯。
1.2 仪器与设备
数显恒温水浴锅,中国浙江纳德科学仪器有限公司;Vortex genius3漩涡混匀器,中国广州艾卡仪器设备;TD-5M台式低速离心机,中国四川蜀科仪器有限公司;UV2400紫外分光光度计,中国上海舜宇恒平科学仪器;傅里叶红外光谱变换仪,中国上海珀金埃尔默仪器有限公司;2500PC X射线衍射仪,日本理学;BSA124S万分之一天平,中国赛多利斯;Axia ChemiSEM扫描电镜,赛默飞;DSC差示扫描量热仪(differential scanning calorimeter,DSC),瑞士梅特勒。
1.3 实验方法
1.3.1 提取淀粉
参考XU等[4]的方法,略作修改。取适量黑苦荞全粉置于烧杯中,以料液比1∶10(g∶mL)加入70%(体积分数)的乙醇溶液,混匀后放入恒温水浴锅50 ℃培育2 h,随后倾倒上层黄色溶液,将沉淀装入离心瓶中,以3 500 r/min离心20 min,加入蒸馏水重复离心3次。将沉淀倒入烧杯后加入合适比例的蒸馏水,再加入蛋白酶,混匀后放入恒温水浴锅50 ℃培育1.5 h。沸水灭酶5 min。沉淀加水调成悬浮液离心,每次倒去上清液后刮去上层软黏层,重复离心直到上清液不再发黄,将得到的沉淀放入恒温鼓风干燥机,于50 ℃干燥8 h,粉碎过筛,放入密闭干燥器中保存,得到的样品为酶法提取的黑苦荞淀粉(black tartary buckwheat starch extracted by enzymatic method, eBTBNS)。
参考LIU等[8],采用碱法提取黑苦荞淀粉。将黑苦荞全粉浸泡在0.3%(质量分数)的氢氧化钠溶液中,用磁力搅拌器将样品和溶液混匀,在室温下放置过夜。随后,将浆液在3 500 r/min离心20 min,加蒸馏水重复离心过程,直到在离心瓶底部获得紧密的白色淀粉沉淀。最后,将沉淀在50 ℃的烘箱中干燥8 h,粉碎后过100目筛放入密闭干燥器中保存,得到的样品为碱浸法提取的黑苦荞淀粉(black tartary buckwheat starch extracted by alkaline leaching method, BTBNS)。购买的普通荞麦淀粉为普通荞麦淀粉(common buckwheat starch, CBNS)。
1.3.2 基本成分测定
水分含量使用水分测定仪测定;总淀粉含量、蛋白质含量、总黄酮含量分别参考SHAH等[9];直链淀粉含量使用直链淀粉试剂盒(A152-1-1)测定;抗性淀粉的测定参考ENGLYST等[10],并稍作修改。将淀粉和4 mL酶混合物(胰腺α-淀粉酶和淀粉糖苷酶)添加到每个离心管中,然后在水浴中反应16 h(37 ℃)以水解可消化淀粉。添加95%乙醇以沉淀抗性部分,用50%乙醇洗涤所得残留物2次,并用氢氧化钾溶液(4 mol/L,2 mL)处理以溶解抗性淀粉。随后,用8 mL 1.2 mol/L醋酸钠缓冲液(pH=3.8)将所得抗性淀粉溶液调节至pH值为4.5。最后,加入淀粉葡萄糖苷酶在50 ℃下反应30 min后,将样品在3 000 r/min下离心10 min。上清液中还原糖的含量采用3,5-二硝基水杨酸法测定,用分光光度计在550 nm处测量样品,使用标准曲线计算样品中的游离葡萄糖量,抗性的含量计算为葡萄糖含量×0.9。
1.3.3 微观形态
将喷金处理后的样品放入样品台,调节样品和物镜之间的工作距离,加速电压为为7 kV,放大倍数分别为1 000、2 000、5 000倍。
1.3.4 溶解度和膨胀度
淀粉的溶解度和膨胀度分析参照XU等[11]的方法。将样品(0.5 g)分别加入50 mL带盖离心管中,加入10 mL蒸馏水,随后置于50 ℃的水浴锅中保持45 min,以4 000 r/min离心15 min,收集上清液,最后在105 ℃下干燥至恒定重量,然后称量记为m1。沉积物部分被直接称质记为m2。溶解度和膨胀度的计算如公式(1)和公式(2)所示:
溶解度![]()
(1)
膨胀度![]()
(2)
式中:m1为离心后上清液干燥至恒定的质量;m2为离心管底部沉淀物的质量。
1.3.5 傅立叶变换红外光谱(Fourier transform infrared spectroscopy, FT-IR)和X射线衍射(X-ray diffraction, XRD)
利用FT-IR技术可以检测到淀粉分子在短程尺度上排列的结构变化。将普通荞麦淀粉和2种不同方式提取的黑苦荞淀粉在玛瑙中用溴化钾研磨并干燥。使用FT-IR以4 cm-1速率对400~4 000 cm-1进行扫描。而XRD对淀粉的长程有序敏感,用来测定双螺旋堆积成的有序晶体阵列。衍射仪分别设置为40 kV和40 mA,衍射角(2θ)为5°~60°,扫描速率为10 °/min。采用Jade 6.5软件计算相对结晶度(relative crystauinity,RC)。
1.3.7 热力学特性
参照LIANG等[12]的方法测定了淀粉的热力学特性。准确称取5 mg淀粉和15 μL蒸馏水到带定位针的坩埚中。加盖密封,在室温下放置过夜以达到水分平衡。在测试过程中,设置了一个空坩埚作为参考,然后将样品从20 ℃加热至150 ℃,加热速率为10 ℃/min。
1.3.8 直链淀粉分布
参照BABU等[13]的方法测定直链淀粉分布。称取淀粉5 mg,重悬于0.9 mL水中,沸水浴15 min,间断涡旋混匀;加入0.1 mL醋酸钠(0.1 mol/L,pH=3.5)、NaN3(5 mL,40 mg/mL)和10 μL异淀粉酶(1 400 U),37 ℃水浴3 h。加入5 mL无水乙醇,4 000×g离心10 min。加入1 mL DMSO/LiBr溶液,在混匀仪中,350 r/min,80 ℃溶解2 h。色谱系统采用的是凝胶色谱-示差系统。液相系统为U3000(Thermo,USA),示差检测器为OPTILAB T-rex(Wyatt technology,CA,USA)。选用的色谱柱为Ohpak SB-805 HQ(300 mm×8 mm),柱温控制为60 ℃;进样量为100 μL;流动相A(0.5% LiBr,DMSO);流速0.3 mL/min;洗脱梯度:等度120 min。
1.3.9 支链淀粉分布
支链淀粉分布的测定参照CHUNG等[14]的方法。称取适量淀粉(约10 mg),重悬于水中,沸水浴并间断涡旋混匀;加入醋酸钠(0.6 mol/L,pH=4.4),NaN3(10 μL,20 g/L)和异淀粉酶(1 400 U),37 ℃保持24 h。加入5 g/L硼氢化钠溶液,涡旋混匀后放置20 h。取适量于离心管中,室温氮吹干燥。溶于NaOH中60 min,加水稀释,离心,取上清液上样。色谱系统采用的是Thermo ICS5000离子色谱系统(ICS500+,Thermo Fisher Scientific,USA),利用电化学检测器对淀粉进行分析检测。采用DionexTM CarboPacTM PA200(250 mm×4.0 mm,10 μm)液相色谱柱,进样量为5 μL。流动相A相:0.2 mol/L NaOH;B相:0.2 mol/L NaOH/0.2 mol/L NaAC,柱温为30 ℃,利用电化学检测器对组分进行分析检测。流速0.4 mL/min;洗脱梯度:0 min A/B(90∶10),10 min A/B(90∶10),30 min A/B(40∶60),50 min A/B(40∶60);50.1 min A/B(90∶10);60 min A/B(90∶10)。
1.4 数据处理
使用统计软件SPSS和Jade 6.5进行相关数据处理。采用单因素方差分析和Duncan检验,P<0.05代表数据间具有显著性差异。除链长分布实验,其余实验至少进行2次。
2 结果与分析
2.1 淀粉的基本组成、溶解度和膨胀度
CBNS、BTBNS和eBTBNS的基本成分如表1所示。eBTBNS和BTBNS的淀粉产量分别为88.59%和89.95%,CBNS的淀粉产量为71.83%。在2种黑苦荞淀粉样品中观察到蛋白质含量、总黄酮含量、直链淀粉含量和抗性淀粉含量之间的显著差异。在碱浸法提取淀粉的过程中,长时间的浸泡使更多的蛋白质能够在后期被降解,而低浓度的氢氧化钠溶液可以溶解复合淀粉颗粒周围的蛋白质,从而在提取过程中产生更多的单一淀粉颗粒[15]。采用乙醇联合蛋白酶提取黑苦荞淀粉的工艺,最终可以获得黑苦荞淀粉、黑苦荞蛋白和黄酮类浓缩物,这大大增加了黑苦荞的资源利用,同时产量也比普通荞麦淀粉高18.12%。因此,在本研究中,采用碱浸法和酶法都可以从黑苦荞全粉中提取更多淀粉,从而减少淀粉损失。酶法的提取过程包括乙醇同步提取黄酮和去蛋白质,这可能是eBTBNS中总黄酮含量较低的原因。另外,2种黑苦荞淀粉的水分含量未见显著性差异(P>0.05)。值得注意的是,不同提取方式得到的黑苦荞淀粉的直链淀粉含量和抗性淀粉含量差异显著。由于直链淀粉具有较强的耐拉伸能力,所以eBTBNS可能更适合应用到食品中增加其脆性。抗性淀粉是淀粉或淀粉水解产物中不能被小肠吸收,而可能进入结肠进行发酵的部分[16]。相关文献表明,抗性淀粉作为一种益生元,可以降低患结肠癌的风险,并增加镁和钙等矿物质的摄入量[17]。之前的研究结果表明,直链淀粉和抗性淀粉的含量呈正比,这是因为直链淀粉分子之间发生碰撞的概率较高。直链淀粉可以通过氢键重新排列并形成稳定的双螺旋结构,从而导致抗性淀粉含量增加。eBTBNS中抗性淀粉的增加可能是由于灭酶过程中导致了淀粉的轻微糊化。糊化使淀粉颗粒膨胀和破裂,导致直链淀粉和支链淀粉链的更高可用性,这提供了分子重新排列和聚集机会[18]。
表1 普通荞麦淀粉、碱浸法和酶法提取的黑苦荞淀粉样品的基本组成
Table 1 Basic composition of common buckwheat starch, black tartary buckwheat starch extracted by enzymatic and alkaline leaching methods
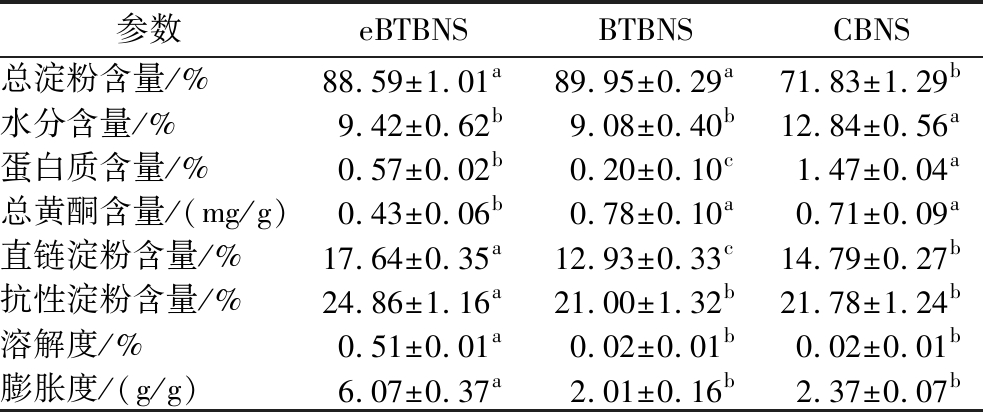
注:数据表示为平均值±标准偏差,同一行数据后不同的字母表明差异显著(P<0.05)(下同)。
参数eBTBNSBTBNSCBNS总淀粉含量/%88.59±1.01a89.95±0.29a71.83±1.29b水分含量/%9.42±0.62b9.08±0.40b12.84±0.56a蛋白质含量/%0.57±0.02b0.20±0.10c1.47±0.04a总黄酮含量/(mg/g)0.43±0.06b0.78±0.10a0.71±0.09a直链淀粉含量/%17.64±0.35a12.93±0.33c14.79±0.27b抗性淀粉含量/%24.86±1.16a21.00±1.32b21.78±1.24b溶解度/%0.51±0.01a0.02±0.01b0.02±0.01b膨胀度/(g/g)6.07±0.37a2.01±0.16b2.37±0.07b
当淀粉在过量的水中被加热时,淀粉的溶解度表示为加热到一定温度时淀粉颗粒的溶解百分比,反映了直链淀粉分子从淀粉颗粒中逃逸的能力。膨胀力可以评估淀粉颗粒结晶部分中键的强度,代表淀粉的易煮性,反映了淀粉颗粒中直链淀粉的特性。影响溶解度和膨胀度的因素包括淀粉颗粒的大小、分子结构、分支的程度、直链淀粉/支链淀粉的比例对水和淀粉相互作用的程度[11]。当淀粉在过量的水中加热时,由于氢键断裂,晶体结构被破坏,水分子通过氢键与淀粉链暴露的羟基结合在一起。eBTBNS、BTBNS和CBNS在50 ℃下的溶解度和膨胀度总结如表1所示,不同种类的荞麦淀粉的溶解度和膨胀度间未见显著性差异,而不同提取方式对黑苦荞淀粉的溶解度和膨胀度影响显著。在50 ℃下,eBTBNS、BTBNS和CBNS的溶解度分别为0.51、0.02、0.02,膨胀度分别为6.07、2.01、2.37。可见,碱浸法提取的黑苦荞淀粉更接近普通荞麦淀粉。与碱浸法相比,eBTBNS的溶解度和膨胀度均升高。灭酶过程中,加热步骤导致淀粉轻微糊化,淀粉颗粒的结构变得松散、膨胀甚至塌陷,从而允许更多的短线性链溶解在水中。同时,BTBNS和CBNS的膨胀度低于eBTBNS,说明BTBNS和CBNS更不容易膨胀,表现出良好的蒸煮特性,不容易产生糊汤现象。因此,碱浸法提取的黑苦荞淀粉和普通荞麦淀粉可能更适合制作粉丝、米粉等食品。
2.2 淀粉的微观形貌分析
CBNS、BTBNS和eBTBNS的微观形貌如图1所示。CBNS和BTBNS淀粉颗粒呈多面体或不规则形状,具有光滑的表面和相似的单个颗粒,并且观察到明显凹陷(图1-B3和图1-C3)。eBTBNS和BTBNS间存在明显的表面差异,eBTBNS呈现块状特征,表面粗糙或不规则,失去了独立的颗粒形状,并形成更大、更紧密的层粘连结构(图1-A1)。eBTBNS的电镜结果进一步表明,在灭酶的过程中,淀粉颗粒发生糊化,导致淀粉失去原有的颗粒形状,同时,eBTBNS的颗粒较大,晶体结构密度的增加可能会提高了其对酶攻击的抵抗力[19]。另外,BTBNS与CBNS的形态相似,说明碱浸法提取的黑苦荞淀粉的工艺是可行的。结合2.1节的结果,BTBNS和CBNS的溶解度和膨胀度都比eBTBNS低,这可能是因为它们坚固的颗粒形态(图1-B3和图1-C3)。淀粉颗粒的大小会影响蒸煮过程中的结构变化,较小粒径的BTBNS和CBNS可能在煮熟后口感更好。研究发现,较小粒径的淀粉在食品、化妆品、包装业上也有应用的潜能[7]。其他文献报道,淀粉颗粒的结构、大小和形状还会影响长/短程有序结构黏度、热稳定性和体外消化率[4]。

A-eBTBNS;B-BTBNS;C-CBNS
图1 普通荞麦淀粉、酶法和碱浸法提取的黑苦荞淀粉的SEM图
Fig.1 SEM images of common buckwheat starch, black tartary buckwheat starch extracted by enzymatic and alkaline leaching methods
2.3 淀粉的热力学性质分析
CBNS、BTBNS和eBTBNS的热特性参数如表2所示。3种淀粉在起始糊化温度(T0)、峰值糊化温度(Tp)、终止糊化温度(Tc)和糊化焓(ΔH)存在显著性差异(P<0.05),eBTBNS、BTBNS和CBNS的T0分别为78.83、73.67、76.80 ℃,这与它们的直链淀粉含量变化一致。另一方面,淀粉颗粒的大小、支链淀粉的链长分布、直/支链淀粉的相互作用和淀粉脂质之间额外复合物也会影响天然淀粉的Tp和Tc。eBTBNS的ΔH最高,这说明需要更多的能量才能打破淀粉颗粒中的分子间键[20]。ΔH主要反映淀粉分子在糊化过程中晶体域内相邻支链淀粉双螺旋相互作用程度,ΔH值越高,表明双螺旋结构越紧凑。与CBNS相比,在本研究中得到的2种黑苦荞淀粉的ΔH较高,说明黑苦荞淀粉的双螺旋结构形成了有效的堆积。尽管天然淀粉的热焓特性已被广泛研究,但黑苦荞淀粉的热特性还有待进一步探究。
表2 普通荞麦淀粉、碱浸法和酶法提取的黑苦荞淀粉样品的热稳定性参数
Table 2 Thermal stability parameters of common buckwheat starch, black tartary buckwheat starch extracted by enzymatic and alkaline leaching methods

参数eBTBNSBTBNSCBNS起始糊化温度T0/℃78.83±0.70a73.67±0.60c76.80±0.30b峰值糊化温度Tp/℃84.78±0.83a82.83±0.21b80.23±0.33c终止糊化温度Tc/℃111.26±0.73c137.32±0.53a135.12±0.45b糊化焓ΔH/(J/g)102.47±0.97b104.50±0.36a75.81±0.50c
2.4 淀粉的短程有序结构解析
FT-IR被认为对分子水平上的结构变化敏感,包括淀粉链、螺旋度和双螺旋构象,所以利用FT-IR技术可以检测到淀粉分子在短程尺度上排列的结构变化[21]。如图2所示,eBTBNS、BTBNS和CBNS的谱图相似,并未出现新的衍射峰,只有一些吸收峰的相对强度发生变化,表明颗粒微观结构发生了改变,这些改变属于物理变化。因此在黑苦荞淀粉的提取过程中并不会在淀粉分子内/间产生新的化学键。3 100~3 700 cm-1区域是O—H的拉伸振动吸收峰,1 600 cm-1和1 350 cm-1分别对应C![]() O不对称拉伸振动吸收峰和葡萄糖环弯曲振动吸收峰[22]。在3 400~3 100 cm-1,与eBTBNS比,BTBNS的吸收峰向较高的波段移动,说明碱浸法提取中淀粉的构象发生变化,受到不同提取方式的影响。除此之外,eBTBNS在1 660~1 610 cm-1出现了1个尖锐的峰,这可能与其残留的蛋白质含量有关。在提取过程中,酶法提取的黑苦荞淀粉中蛋白质的二级结构构象可能发生变化,包括α-螺旋和β-折叠,导致eBTBNS的性质发生变化。另外,995、1 022、1 047 cm-1处的吸收带能够反映淀粉聚合物有序结构和结晶度等信息。一般地,1 047/1 022 cm-1和995/1 022 cm-1处吸光度的比率分别反映了淀粉分子的有序度(degree of order,DO)和双螺旋结构内部的变化(degree of double helix,DD)[23]。如表3所示,eBTBNS的DD和DO最高,分别为0.84和0.70,表明eBTBNS中双螺旋得到更有效的堆积,分子排列更加有序,这与DSC的结果一致。所有样品的DD均高于DO,说明并不是所有堆积的双螺旋都能形成有序结晶。另一方面,双螺旋的有序度和起始糊化温度变化趋势一致,这表明有序的双螺旋微晶可以提高淀粉的热稳定性。
O不对称拉伸振动吸收峰和葡萄糖环弯曲振动吸收峰[22]。在3 400~3 100 cm-1,与eBTBNS比,BTBNS的吸收峰向较高的波段移动,说明碱浸法提取中淀粉的构象发生变化,受到不同提取方式的影响。除此之外,eBTBNS在1 660~1 610 cm-1出现了1个尖锐的峰,这可能与其残留的蛋白质含量有关。在提取过程中,酶法提取的黑苦荞淀粉中蛋白质的二级结构构象可能发生变化,包括α-螺旋和β-折叠,导致eBTBNS的性质发生变化。另外,995、1 022、1 047 cm-1处的吸收带能够反映淀粉聚合物有序结构和结晶度等信息。一般地,1 047/1 022 cm-1和995/1 022 cm-1处吸光度的比率分别反映了淀粉分子的有序度(degree of order,DO)和双螺旋结构内部的变化(degree of double helix,DD)[23]。如表3所示,eBTBNS的DD和DO最高,分别为0.84和0.70,表明eBTBNS中双螺旋得到更有效的堆积,分子排列更加有序,这与DSC的结果一致。所有样品的DD均高于DO,说明并不是所有堆积的双螺旋都能形成有序结晶。另一方面,双螺旋的有序度和起始糊化温度变化趋势一致,这表明有序的双螺旋微晶可以提高淀粉的热稳定性。
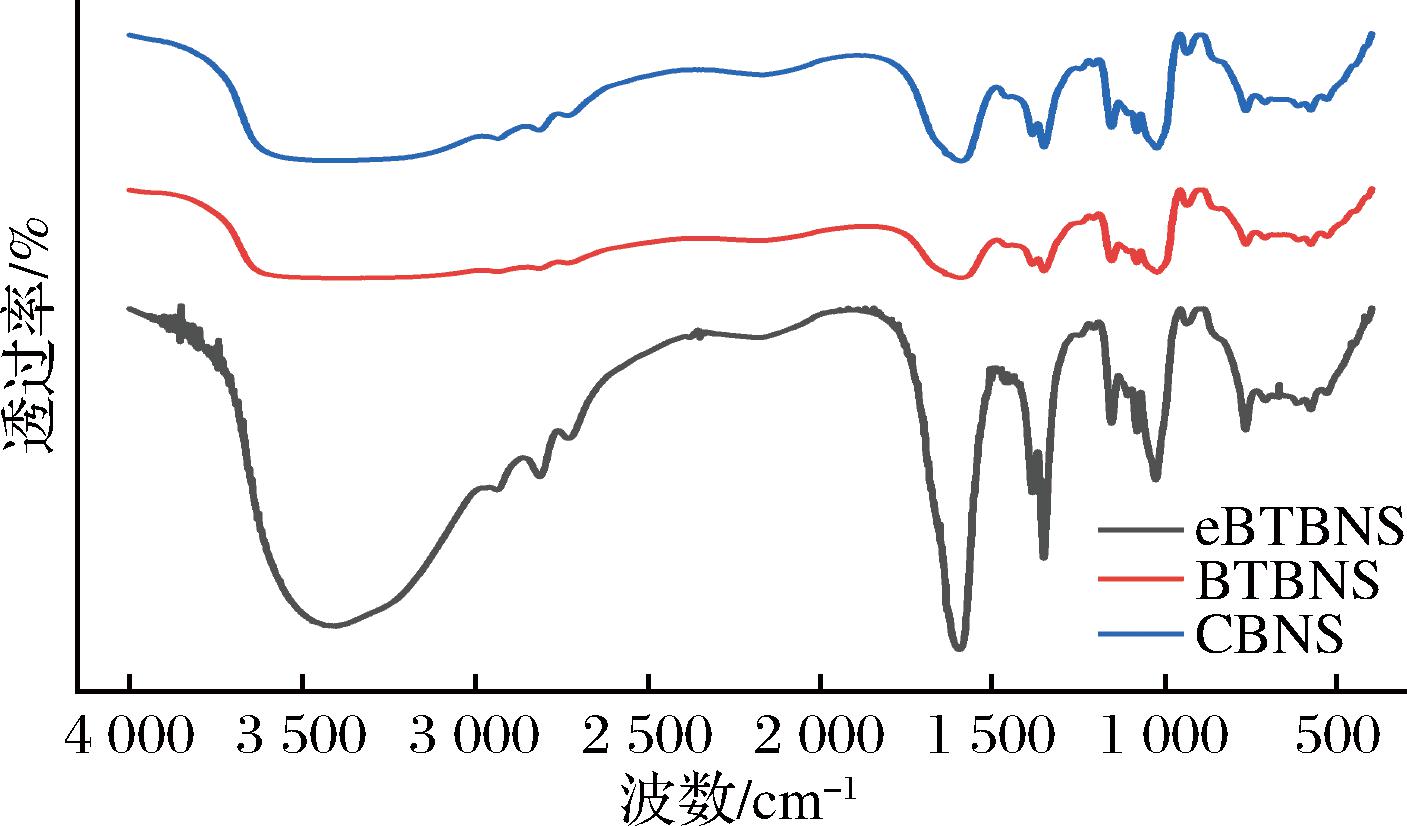
图2 普通荞麦淀粉、酶法和碱浸法提取的黑苦荞淀粉的FT-IR图
Fig.2 FT-IR patterns of common buckwheat starch, black tartary buckwheat starch extracted by enzymatic and alkaline leaching methods
表3 普通荞麦淀粉、碱浸法和酶法提取的黑苦荞淀粉的短程有序参数
Table 3 Short-range ordering parameters of common buckwheat starch, black tartary buckwheat starch extracted by enzymatic and alkaline leaching methods
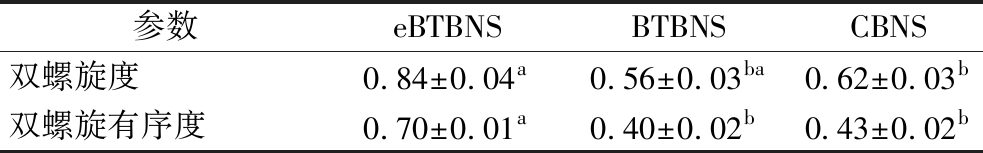
参数eBTBNSBTBNSCBNS双螺旋度0.84±0.04a0.56±0.03ba0.62±0.03b双螺旋有序度0.70±0.01a0.40±0.02b0.43±0.02b
2.5 淀粉的长程有序结构解析
XRD对淀粉的长程有序敏感,用来测定双螺旋堆积成的有序晶体阵列。根据晶体特征,淀粉可分为四类:A型、B型、C型和V型。黑苦荞淀粉和普通荞麦淀粉的XRD图谱和相对结晶度分别总结在图3和表4。BTBNS和CBNS的X射线衍射图相似,在15°、17°、18°和23.5°出现明显的衍射峰,这是典型的A型晶体特征,故BTBNS和CBNS可以在工业上作为原料。eBTBNS在17.32°和20.26°,这与V型淀粉的结构特征相似[9]。据文献报道,不同的晶体形式会表现出不同的抗酶解特性。V型淀粉抗酶解能力最强,而A型淀粉抗酶解能力最弱[4]。结合扫描电子显微镜(scanning electron microscope, SEM)的观察结果,eBTBNS在提取过程中出现糊化迹象,这导致淀粉颗粒中的直链淀粉会以无规则卷曲的形式浸出。淀粉颗粒由结晶相和非晶相2部分组成,而淀粉的RC会受到平均支链淀粉链长度、支链淀粉含量和晶体尺寸等因素的影响。eBTBNS、BTBNS和CBNS的RC分别为22.20%、37.18%和35.71%。结合FT-IR的结果,eBTBNS结晶度的降低可能归因于非晶态结构的增加和晶体域的减少。因此,酶法的提取过程可能会影响黑苦荞淀粉的结晶和非结晶区域,即直链淀粉和支链淀粉的结构可能受到影响。
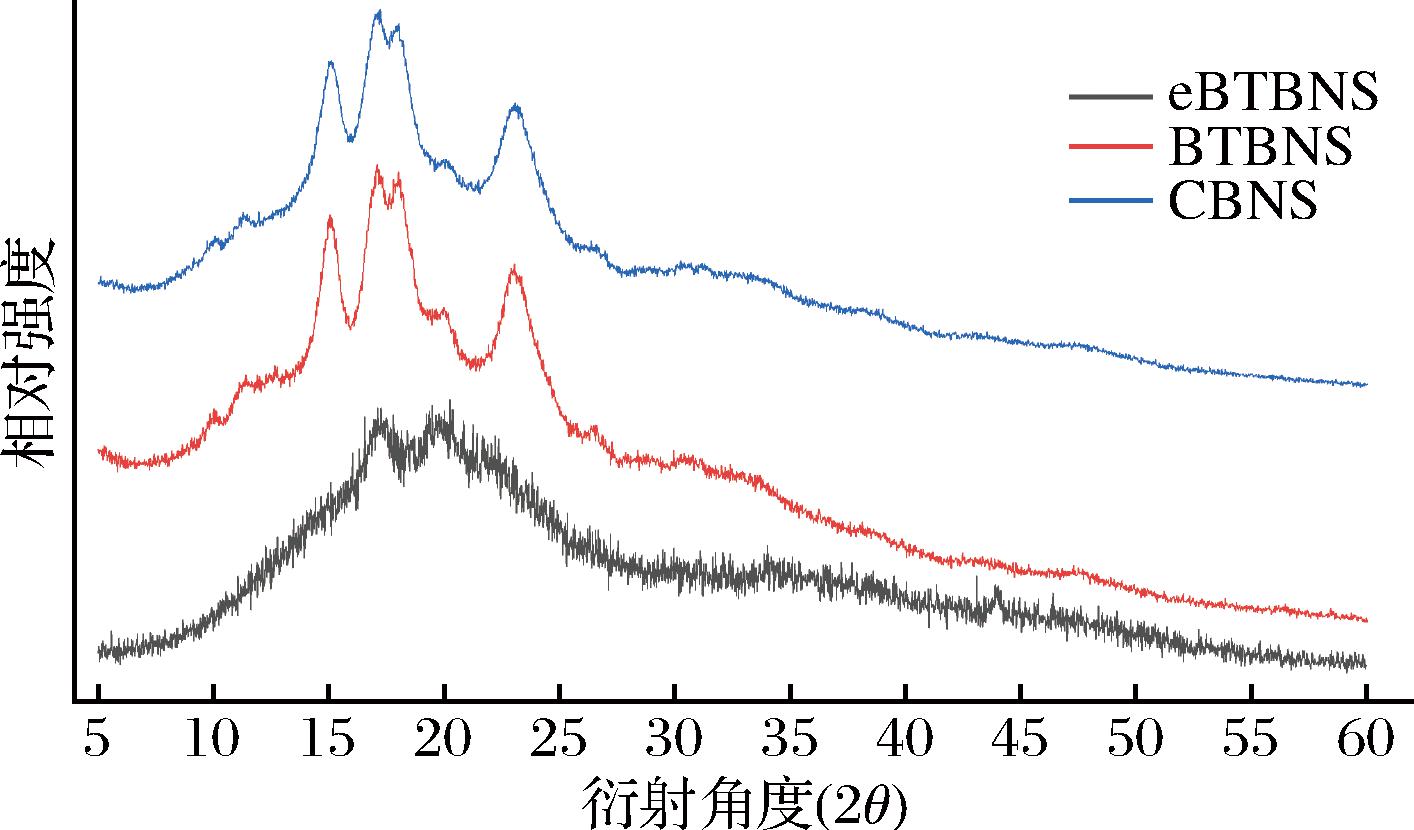
图3 普通荞麦淀粉、酶法和碱浸法提取的黑苦荞淀粉的XRD图
Fig.3 XRD patterns of common buckwheat starch, black tartary buckwheat starch extracted by enzymatic and alkaline leaching methods
表4 普通荞麦淀粉、碱浸法和酶法提取的黑苦荞淀粉的长程有序参数
Table 4 Long-range ordering parameters of common buckwheat starch, black tartary buckwheat starch extracted by enzymatic and alkaline leaching methods

参数eBTBNSBTBNSCBNS相对结晶度/%22.20±0.89c37.18±0.31a35.71±0.53b晶型V型A型A型
2.6 淀粉的链长分析
层状晶体层主要由支链淀粉的双螺旋形成,通过高效阴离子交换色谱仪测定淀粉样品的支链链长分布。根据聚合度(degree of polymerization, DP)的不同,黑苦荞淀粉和普通荞麦淀粉的链分布分为A链(DP 6~12)、B1链(DP 13~24)、B2链(DP 25~36)和B3+链(DP≥37)[24]。如图4-A~图4-C所示,eBTBNS、BTBNS和CBNS的最高DP和平均链长分别为12、11和11、21.13、20.81和20.86,淀粉链长度与双螺旋度和有序程度成正相关。3种淀粉的支链淀粉分布相似,它们都包含较高数量的短链(A和B1链,74.95%~75.70%)和较低数量的长链(B2和B3+链,24.30%~25.04%),主要包括DP 6~24和DP 37~60的2个峰。eBTBNS和BTBNS的短/长支链(short/long chain,S/L)分别为2.99和3.16(表5),表明eBTBNS中有更多的短支链。具有大量短链的支链淀粉可能会增加其抗酶解能力[4]。结合SEM和XRD的结果,eBTBNS有糊化的迹象,与BTBNS相比,酶法提取过程中并没有观察到淀粉链明显的降解。另外,eBTBNS、BTBNS和CBNS的分子尺寸分布如图4-D所示。对于所有样品,凝胶色谱(gel permeation chromatography, GPC)曲线中包括大分子峰和未被普鲁兰酶完全脱支的支链分子峰,峰1主要代表支链淀粉的短链(A链和短B链),峰2是支链淀粉的较长链(长B链),峰3指向直链淀粉峰[25]。从图4-D可以观察到3条GPC曲线的峰1和峰2基本重合,峰1和2所占比例为73.58%~76.84%,峰3所占比例为23.16%~26.42%,这与直链淀粉试剂盒测定的结果相似,无论是酶法还是碱浸法提取的黑苦荞淀粉,它们都具有较高比例的支链淀粉。
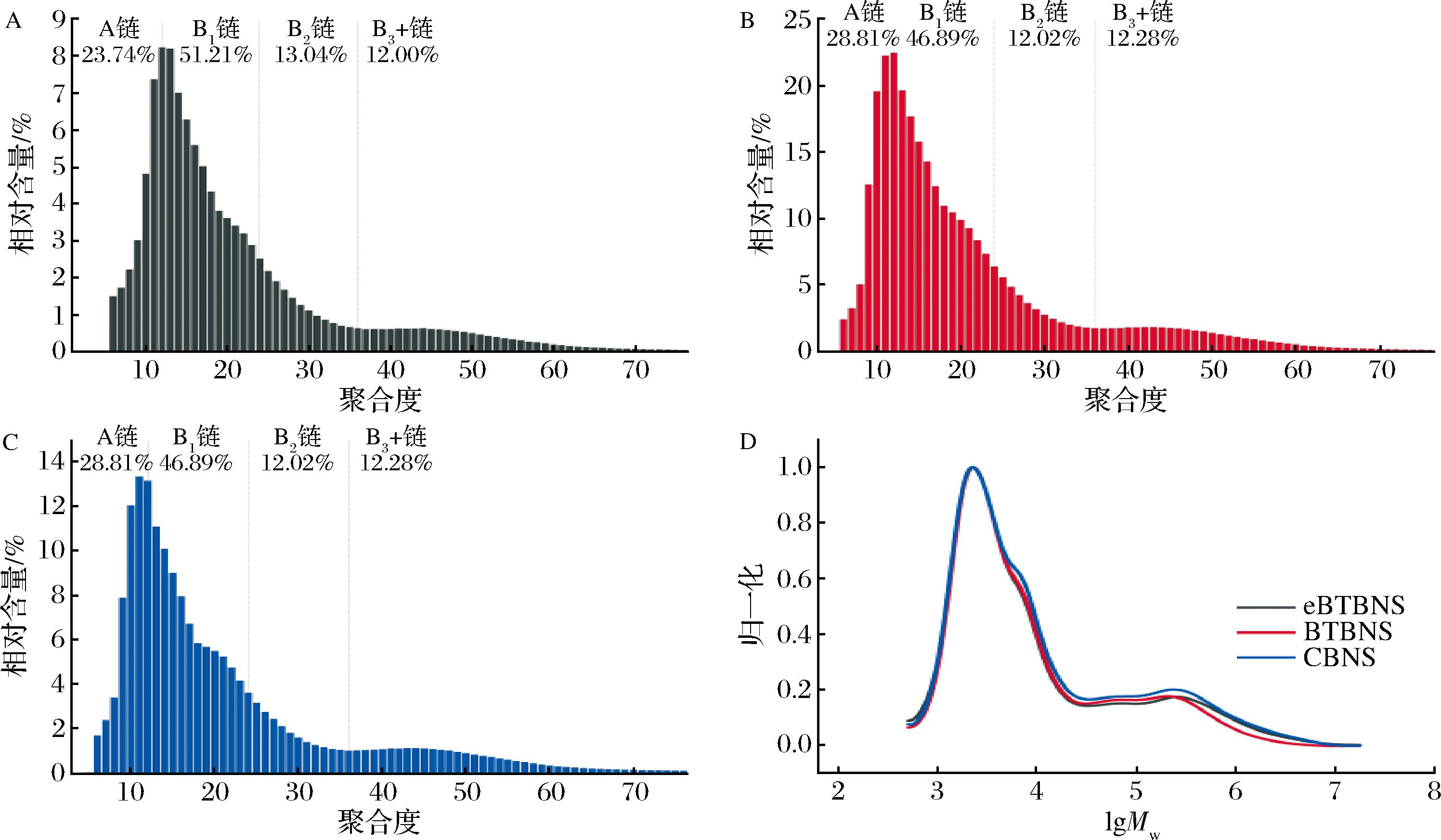
A-酶法提取的黑苦荞淀粉的支链淀粉分布图;B-碱浸法提取的黑苦荞淀粉的支链淀粉分布图;C-普通荞麦淀粉的支链淀粉分布图;D-3种淀粉的直链淀粉分布图
图4 普通荞麦淀粉、酶法和碱浸法提取的黑苦荞淀粉的直/链淀粉分布图
Fig.4 Amylose/amylopectin distributions of common buckwheat starch, black tartary buckwheat starch extracted by enzymatic and alkaline leaching methods
注:Mw为分子质量。
表5 普通荞麦淀粉、碱浸法和酶法提取的黑苦荞淀粉的直/支链淀粉相关参数
Table 5 Amylose/amylopectin parameters of common buckwheat starch, black tartary buckwheat starch extracted by enzymatic and alkaline leaching methods
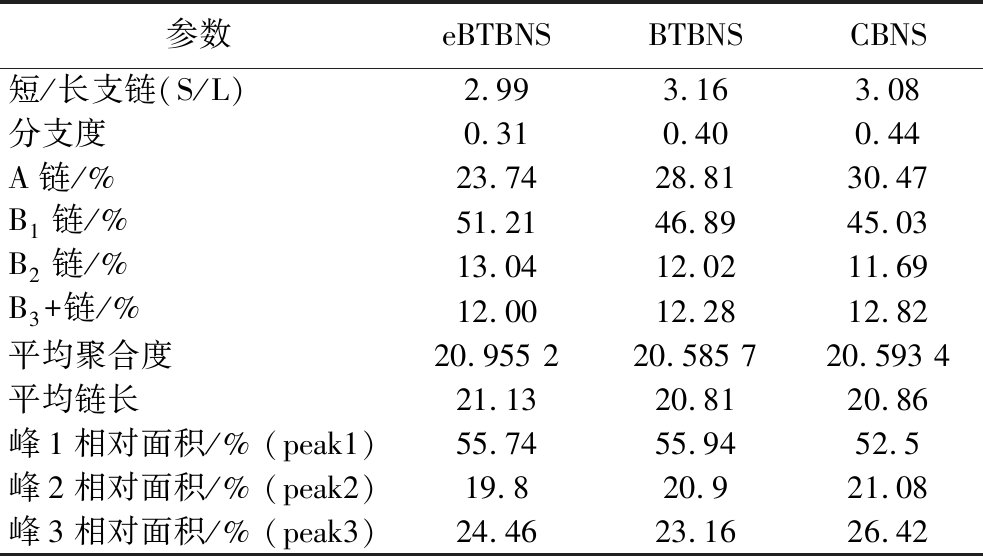
参数eBTBNSBTBNSCBNS短/长支链(S/L)2.993.163.08分支度0.310.400.44A链/%23.7428.8130.47B1链/%51.2146.8945.03B2链/%13.0412.0211.69B3+链/%12.0012.2812.82平均聚合度20.955 220.585 720.593 4平均链长21.1320.8120.86峰1相对面积/% (peak1)55.7455.9452.5峰2相对面积/% (peak2)19.820.921.08峰3相对面积/% (peak3)24.4623.1626.42
2.7 相关性分析
为了确定所测量的测试结果之间是否具有交叉项效应,进行了皮尔逊相关性分析(P<0.05)。如图5所示,S/L值与溶解度、膨胀力、DD和DO呈负相关,表明越多的长支链可能会导致颗粒中双螺旋的堆积越无序,导致更容易膨胀和吸水[11]。ΔH与B3+链呈负相关(r=-0.91),和peak1呈正相关(r=0.99),这表明淀粉的短支链和直链共同影响淀粉的热稳定性。较高的ΔH意味着淀粉具有更稳定的分子结构,破坏它们也需要更多的热能。另外,支链淀粉的较长链(B1链和B2链)与DO呈正相关(r=0.96,r=0.98),说明支链淀粉的较长链可能有助于在具有较高热稳定性的淀粉中更有序地堆积双螺旋,这也表现为淀粉糊化过程中较高的峰值糊化温度。一般来说,淀粉相对结晶度与晶体尺寸、结晶区域的数量、双螺旋的取向结构和双螺旋相互作用的程度密切相关[9]。在本研究中,黑苦荞淀粉和普通荞麦淀粉的RC与B链(B1链和B2链,r=-0.92、-0.94)呈负相关,而与短支链(A链)呈正相关(r=0.94),原因是更多的B链可能会产生更不平行的双螺旋堆积[24]。另外,黄酮含量与RC呈正相关(r=0.96),这表明黄酮类化合物可能与淀粉链的氢键结合,导致结晶区域更加紧密。可以推测,槲皮素与直链淀粉螺旋腔的内径可能不匹配,限制了其进入淀粉双螺旋内部,仅与淀粉螺旋结构的侧链络合。在本研究中,淀粉和黄酮类化合物之间的相互作用可能是氢键。因此,可以通过直链淀粉或支链淀粉的链长分布来分析淀粉的结构,进而预测其理化和结构特性。
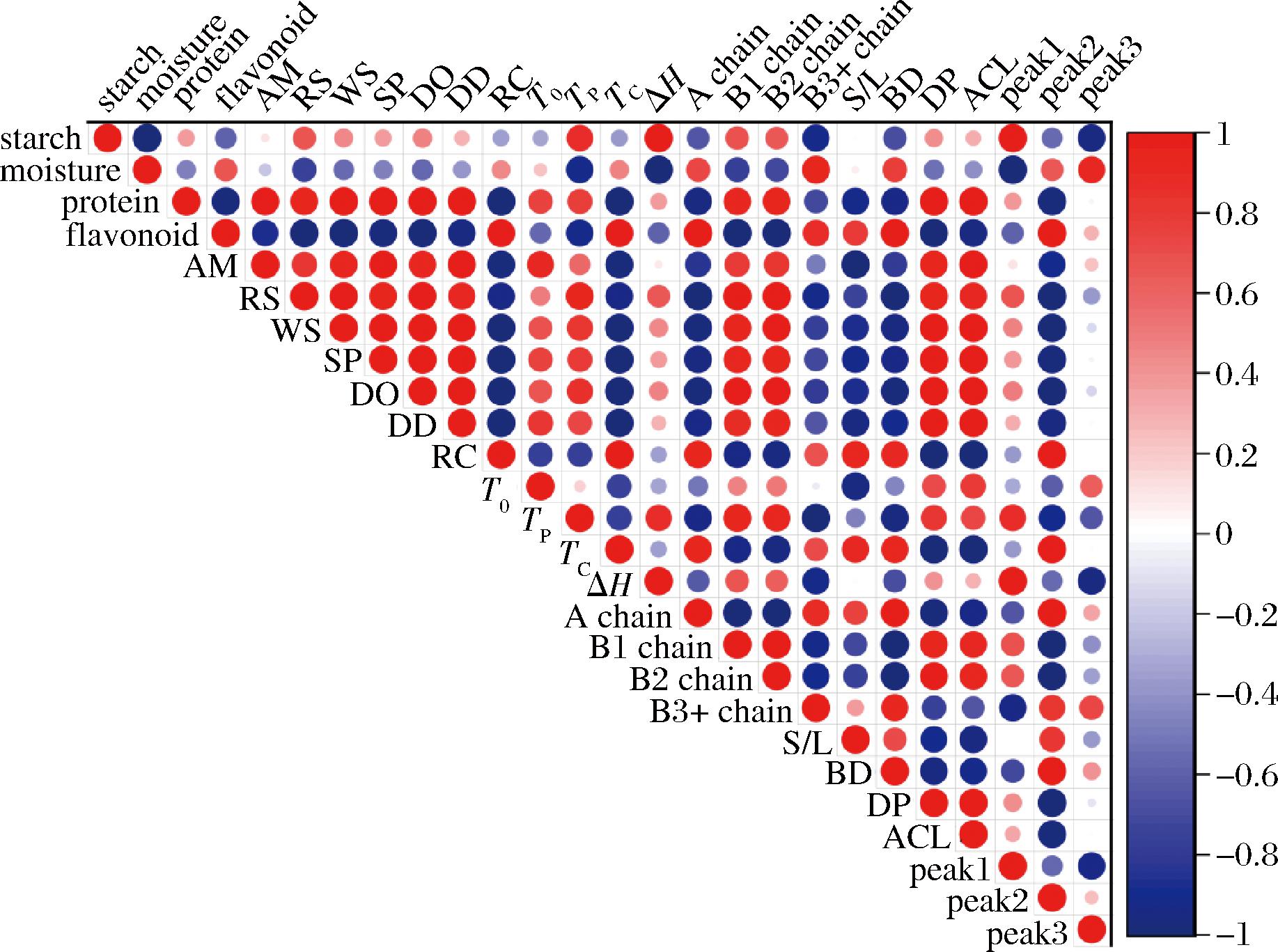
图5 普通荞麦淀粉、酶法和碱浸法提取的黑苦荞淀粉结构和理化功能特性的相关性分析
Fig.5 Correlation analysis of the structural and physicochemical functional properties of common buckwheat starch, black tartary buckwheat starch extracted by enzymatic and alkaline leaching methods
注:starch-淀粉含量;moisture-水分含量;protein-蛋白质含量;flavonoid-黄酮含量;AM-直链淀粉含量;RC-抗性淀粉含量;WS-溶解度;SP-膨胀力;BD-分支度;DP-聚合度;ACL-平均链长。
3 结论
酶法和碱浸法提取的黑苦荞淀粉的基本营养成分、热稳定性和短/长程有序结构均存在一定差异。受到直链淀粉和残留蛋白质的影响,酶法提取的黑苦荞淀粉的溶解度、膨胀度较高,长程有序结构受到削弱,而双螺旋的有序度得到一定的增强。普通荞麦淀粉、酶法和碱浸法提的黑苦荞淀粉的起始糊化温度、峰值糊化温度、终止糊化温度和热焓值分别为73.67~78.83 ℃、80.23~84.78 ℃、111.26~137.32 ℃和75.81~104.50 J/g。3种淀粉的直/支链淀粉分布相似,酶法提取的黑苦荞淀粉虽有糊化迹象,但与BTBNS相比,并未观察到淀粉链明显的降解。相关性分析结果表明,支链淀粉的较长链可能有助于在具有较高热稳定性的淀粉中更有序地堆积双螺旋。与普通荞麦淀粉相比,黑苦荞淀粉的总淀粉含量较高,结构更为紧密,具有较高的热稳定性。黑苦荞淀粉和普通荞麦淀粉各具特性,在不同领域具有应用潜力,如eBTBNS中高抗性淀粉含量可能适合作为抗消化食物,而CBNS和BTBNS的粒径小且均匀,可能是化妆品添加剂的良好选择。这些研究结果为黑苦荞淀粉的制备方法和相关理化结构特性提供了理论基础,以期扩展黑苦荞产业,同时为消费者提供更丰富的食物种类,从而提高营养和健康水平。
[1] WIJNGAARD H H, ARENDT E K.Buckwheat[J].Cereal Chemistry, 2006, 83(4):391-401.
[2] KAUR K D, JHA A, SABIKHI L, et al.Significance of coarse cereals in health and nutrition:A review[J].Journal of Food Science and Technology, 2014, 51(8):1429-1441.
[3] CHRISTA K, SORAL-SMIETANA M, LEWANDOWICZ G.Buckwheat starch:Structure, functionality and enzyme in vitro susceptibility upon the roasting process[J].International Journal of Food Sciences and Nutrition, 2009, 60(Suppl 4):140-154.
[4] XU Q L, ZHENG F Y, YANG P, et al.Effect of autoclave-cooling cycles combined pullulanase on the physicochemical and structural properties of resistant starch from black tartary buckwheat[J].Journal of Food Science, 2023, 88(1):315-327.
[5] ZHENG G H, SOSULSKI F W, TYLER R T.Wet-milling, composition and functional properties of starch and protein isolated from buckwheat groats[J].Food Research International, 1997, 30(7):493-502.
[6] 张国权. 荞麦淀粉理化特性及改性研究[D].杨凌:西北农林科技大学, 2007.ZHANG G Q.Physicochemical properties and modification of buckwheat starch[D].Yangling:Northwest A &F University, 2007.
[7] TESTER R F, KARKALAS J, QI X.Starch-Composition, fine structure and architecture[J].Journal of Cereal Science, 2004, 39(2):151-165.
[8] LIU H, LYU M M, PENG Q, et al.Physicochemical and textural properties of tartary buckwheat starch after heat-moisture treatment at different moisture levels[J].Starch-Stärke, 2015, 67(3-4):276-284.
[9] SHAH A, MASOODI F A, GANI A, et al.In-vitro digestibility, rheology, structure, and functionality of RS3 from oat starch[J].Food Chemistry, 2016, 212:749-758.[10] ENGLYST H N, KINGMAN S M, CUMMINGS J H.Classification and measurement of nutritionally important starch fractions[J].European Journal of Clinical Nutrition, 1992, 46(Suppl 2):S33-S50.
[11] XU Q L, ZHENG F Y, CAO X T, et al.Effects of airflow ultrafine-grinding on the physicochemical characteristics of tartary buckwheat powder[J].Molecules, 2021, 26(19):5841.
[12] LIANG Q F, CHEN X X, REN X F, et al.Effects of ultrasound-assisted enzymolysis on the physicochemical properties and structure of arrowhead-derived resistant starch[J].LWT, 2021, 147:111616.
[13] BABU A S, MOHAN R J, PARIMALAVALLI R.Effect of single and dual-modifications on stability and structural characteristics of foxtail millet starch[J].Food Chemistry, 2019, 271:457-465.
[14] CHUNG H J, LIU Q, LEE L, et al.Relationship between the structure, physicochemical properties and in vitro digestibility of rice starches with different amylose contents[J].Food Hydrocolloids, 2011, 25(5):968-975.
[15] TRAN T T B, SHELAT K J, TANG D, et al.Milling of rice grains.The degradation on three structural levels of starch in rice flour can be independently controlled during grinding[J].Journal of Agricultural and Food Chemistry, 2011, 59(8):3964-3973.
[16] RAIGOND P, EZEKIEL R, RAIGOND B.Resistant starch in food:A review[J].Journal of the Science of Food and Agriculture, 2015, 95(10):1968-1978.
[17] ZHOU Y, MENG S H, CHEN D Y, et al.Structure characterization and hypoglycemic effects of dual modified resistant starch from indica rice starch[J].Carbohydrate Polymers, 2014, 103:81-86.
[18] HARALAMPU S G.Resistant starch-a review of the physical properties and biological impact of RS3[J].Carbohydrate Polymers, 2000, 41(3):285-292.
[19] 刘霞, 黄雅萍, 卢旭, 等.抗性淀粉的结构性质与功能关系研究进展[J].食品与发酵工业, 2020, 46(18):279-286.LIU X, HUANG Y P, LU X, et al.Advances in structural properties and its correlation with physiological functions of resistant starch[J].Food and Fermentation Industries, 2020, 46(18):279-286.
[20] 吕欣欣. 高直链玉米淀粉与交联淀粉结构及消化性研究[D].无锡:江南大学, 2021.LYU X X.Study on the structure and digestibility of high amylose corn starch and cross-linked starch[D].Wuxi:Jiangnan University, 2021.
[21] 缪铭. 慢消化淀粉的特性及形成机理研究[D].无锡:江南大学, 2009.MIAO M.Characteristic and formation mechanism of slowly digestible starch[D].Wuxi:Jiangnan University, 2009.
[22] 孙沛然. 高静压对玉米淀粉颗粒结构的影响[D] 北京:中国农业大学, 2015.SUN P R.Effect of high hydrostatic pressure on granule structures of maize starch[D].Beijing:China Agricultural University, 2015.
[23] GUO K, LIU T X, XU A H, et al.Structural and functional properties of starches from root tubers of white, yellow, and purple sweet potatoes[J].Food Hydrocolloids, 2019, 89:829-836.
[24] CHANG R R, JIN Z Y, LU H, et al.Type III resistant starch prepared from debranched starch:Structural changes under simulated saliva, gastric, and intestinal conditions and the impact on short-chain fatty acid production[J].Journal of Agricultural and Food Chemistry, 2021, 69(8):2595-2602.
[25] SHI J L, SWEEDMAN M C, SHI Y C.Structural changes and digestibility of waxy maize starch debranched by different levels of pullulanase[J].Carbohydrate Polymers, 2018, 194:350-356.