木聚糖(xylan)是存在于自然界中含量最丰富的半纤维素,在甘蔗渣、玉米芯、大麦壳等农业废弃物中含量超过30%[1-2]。将富含木聚糖的农业废弃物转化为高附加值的产品如生物能源、低聚木糖(xylooligosaccharides, XOS,聚合度为2~6个木糖单元的寡糖)、木糖醇等具有巨大的环境效益和经济效益。特别是XOS,因其在低pH和高温下具有更高的稳定性、更好的抗消化能力和刺激双歧杆菌生长的能力,因此被认为是最有前途的新型功能性食品[3-4]。据预测,到2023年,全球益生元原料市场的XOS总值将达到1.3亿美元,复合年增长率为10.4%[5]。此外,据报道XOS还具有预防糖尿病[6-7]、预防结肠炎症[8]和抗肿瘤等作用[9-10],因此,XOS也受到了医疗和制药行业的关注。同时,XOS的抗氧化[11]和保湿能力也引起了化妆品行业兴趣[12]。以富含木聚糖的农业生产废弃物为原料制备XOS具有巨大的市场前景,深受人们重视。其中木聚糖酶(endo-1,4-β-xylanases,E.C.3.2.1.8)在生物酶法制备XOS的过程中发挥着至关重要的作用,它从木聚糖内部水解β-1,4糖苷键生成XOS和少量的木糖。与其他家族木聚糖酶相比,GH11家族木聚糖酶因其较高的底物特异性被称为“真正的木聚糖酶(true xylanase)”[13]。大部分GH11家族木聚糖酶不具有纤维素酶活性,也没有木糖苷酶活性或者阿拉伯糖苷酶活性,其水解产物没有纤维寡糖或木糖等副产物污染,故而在XOS的制备中更有优势。而且低分子质量的GH11家族木聚糖酶能更快穿透木质素屏障与木聚糖底物结合,因此在甘蔗渣、玉米芯粉等废弃物的转化方面更具应用潜力[13]。
本研究前期获得来自Fusarium sp.21的GH11家族具有较高底物特异性和较强pH稳定性的木聚糖酶Xyn11A[14],为了提高Xyn11A的稳定性和重复使用率,降低XOS的生产成本,本研究建立了2种Xyn11A固定化方法,有机-无机杂化纳米花法[15]和酶蛋白羧基基团与树脂上的氨基基团形成酰胺键共价固定法[16],分析了固定化酶的酶学性质,并初步研究了固定化酶转化甘蔗渣和玉米芯粉制备低聚木糖的能力,为Xyn11A在以农业废弃物为原料制备低聚木糖的应用提供依据。
1 材料与方法
1.1 材料与试剂
带有xyn11a基因的重组质粒pGEX-6p-xyn11a已有本实验室构建并转化至表达菌株E.coli BL21 (DE3)中,由本实验室保存。
Bradford蛋白定量检测试剂盒,上海生工生物有限公司;GST融合蛋白纯化试剂盒,南京金斯瑞生物科技公司;氨基乙基琼脂糖树脂(aminoethyl agarose resins,AM-1),ABT公司;薄层层析硅胶板(10 cm×20 cm),青岛海洋化工有限公司;榉木木聚糖(beechwood xylan),美国Sigma公司;木寡糖标准品(包括木二糖、木三糖、木四糖、木五糖和木六糖),北京索莱宝科技有限公司;其他化学试剂无特殊说明均为国产分析纯。
1.2 仪器与设备
NanoDrop 2000核酸蛋白分析仪、Multiskan Spectrum全波长酶标仪,美国Thermo Fisher 公司;Hitachi SU8010场发射扫描电子显微镜,日本日立公司。
1.3 实验方法
1.3.1 木聚糖酶Xyn11A的纯化及浓度
划线活化含重组质粒pGEX-6p-xyn11a的E.coli BL21 (DE3),挑取单菌落接种至5 mL含有100 μg/mL氨苄青霉素的LB液体培养基中,200 r/min,37 ℃培养过夜。然后以1%接种量转接于1 L含有100 μg/mL氨苄青霉素的LB液体培养基中37 ℃ 培养至OD600值为0.6~0.8,加入IPTG至终浓度为0.1 mmol/L,18 ℃ 诱导培养14 h后,收集细胞,参照LI等[14,17]的方法纯化Xyn11A,随后SDS-PAGE分析纯化所得木聚糖酶纯度,并根据Bradford蛋白定量检测试剂盒说明书测定木聚糖酶蛋白浓度。
1.3.2 木聚糖酶酶活及固定化率测定
采用3,5-二硝基水杨酸(dinitrosalicylic acid, DNS)比色法测定还原糖含量。取10 μL酶液(固定化酶)至1.5 mL离心管中,再加入90 μL最适pH缓冲液配制的10 mg/mL榉木木聚糖底物,最适温度下反应10 min,然后加入100 μL DNS终止反应,沸水浴5 min,加蒸馏水定容至1 mL,再取200 μL至96孔板中,酶标仪测定A540读数,以木糖为标准,计算还原糖含量。一个木聚糖酶活力单位(unit)定义为:在上述实验条件下,每分钟产生1 μmol还原糖所需要的酶量定义为1个酶活力单位。
采用Bradford蛋白定量检测试剂盒测定酶蛋白浓度,根据公式(1)计算固定化率(immobilization yield,IY)[18]。
(1)
式中:C0为固定前酶蛋白的浓度;V0为固定前酶液体积;Cf为固定后上清液的酶蛋白酶浓度;Vf 为固定后酶液体积。
1.3.3 Xyn11A-Cu3(PO4)2无机杂化纳米花的固定化
参照KUMAR等[19]方法制备 Xyn11A-Cu3(PO4)2无机杂化纳米花。固定化前酶浓度对固定化率和固定化酶活影响较大,为确定Xyn11A最佳固定化浓度,用PBS缓冲液(pH 7.4)配制质量浓度为0.10,0.15,0.20,0.25 mg/mL的Xyn11A酶溶液,取992 μL不同浓度的酶溶液,分别加入8 μL 100 mmol/L CuSO4至Cu2+终浓度为0.8 mmol/L,置于4 ℃中100 r/min振荡3 d。振荡结束后12 000 r/min离心30 min分离沉淀和上清液,上清液利用Bradford蛋白定量检测试剂盒测定蛋白浓度,根据公式(1)计算固定化率;沉淀用ddH2O洗涤3次,置于真空冷冻干燥器中冻干,冻干后的粉末一部分用扫描电镜分析其结构,具体操作参照文献[19],另一部分测定木聚糖酶活性,以最高固定化酶活性为100%,计算不同酶浓度下的固定化酶相对酶活。
1.3.4 Xyn11A- agarose 共价固定化
取100 μL 氨基乙基琼脂糖载体(载体实际体积为50 μL),去除20%的乙醇浸泡液后用双蒸水冲洗2次,并用PBS缓冲液平衡。加入400 mL质量浓度分别为300、400、500和700 μg/mL的Xyn11A蛋白溶液,再加入50 μL 浓度为1 mol/L EDC[1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐]溶液,置于室温80 r/min缓慢振荡。2 h后将树脂离心12 000 r/min离心2 min,取一部分上清液测定蛋白质浓度,沉淀用双蒸水冲洗2次,然后用1 mol/L NaCl冲洗,然后悬浮于PBS缓冲液(pH 7.4)中测定木聚糖酶活性,计算酶的回收率和相对酶活,确定最佳蛋白浓度。
1.3.5 固定化酶酶学性质及动力学研究
分别在最佳条件大量制备Xyn11A-Cu3(PO4)2无机杂化纳米花和Xyn11A-agarose固定化酶,研究2种固定化酶的酶学性质,包括最适反应pH值、pH稳定性、最适反应温度、热稳定性以及动力学参数,具体方法参考文献[20]。
1.3.6 固定化酶的循环使用分析
取10 μL的固定化酶,加入90 μL最适pH缓冲液配制的10 mg/mL的榉木木聚糖底物,置于45 ℃反应10 min,然后12 000 r/min离心3 min,将上清液转移至1支干净离心管,加入100 μL DNS试剂,沸水浴5 min后加水至1 mL,测定其540 nm吸光值。沉淀的固定化酶用蒸馏水清洗3次,直至除掉残余的产物和底物,再次加入90 μL底物,测定第2次反应的酶活,如此反复进行12轮循环。以第1次测定的固定化酶的活性为100%,计算每次循环的相对活性。
1.3.7 固定化酶对农业废弃物的降解作用
称取玉米芯粉和甘蔗渣粉各1 g,分别加入10 mL和20 mL 10% NaOH溶液(因为甘蔗渣具有很强的吸水性),115 ℃加热30 min,冷却后6 000 r/min离心10 min除去残渣,然后用HCl中和上清液至中性,再加入等体积的无水乙醇,离心收集沉淀;沉淀经真空冷冻干燥后即为木聚糖。再分别加入10 U固定化酶,置于最适温度反应4 h,离心后取上清液,利用DNS法测定生成的还原糖量。酶解反应结束后,离心分离上清液,一部分上清液直接进行薄层层析,另一部分上清液用截留分子质量为3 kDa的超滤管超滤以除去未水解的底物,超滤后的样品进行薄层层析。展层剂为V(正丁醇)∶V(乙酸)∶V(双蒸水)=2∶1∶1;显色液为溶于浓硫酸/甲醇(10∶90)的终浓度为2 g/L的苔黑酚。染色结束后,薄层置于100 ℃烘箱中加热数分钟至糖显色[17]。
2 结果与分析
2.1 Xyn11A-Cu3(PO4)2无机杂化纳米花的固定化
为了确定形成Xyn11A-Cu3(PO4)2纳米花的最佳蛋白浓度,测定了不同蛋白浓度对固定化率的影响。结果如图1-A所示,随着蛋白浓度的增加,固定化率在缓慢增加;当酶质量浓度增加至200 μg/mL时,固定率达到最大约为30%;随后固定化率缓慢降低。测定不同浓度Xyn11A形成的Xyn11A-Cu3(PO4)2纳米花固定化酶的酶活性,发现当蛋白质量浓度为150 μg/mL时,Xyn11A-Cu3(PO4)2纳米花固定化酶的酶活性最高(图1-B),当蛋白浓度低于该浓度或者高于该浓度形成的Xyn11A-Cu3(PO4)2纳米花固定化酶的活性均较低。
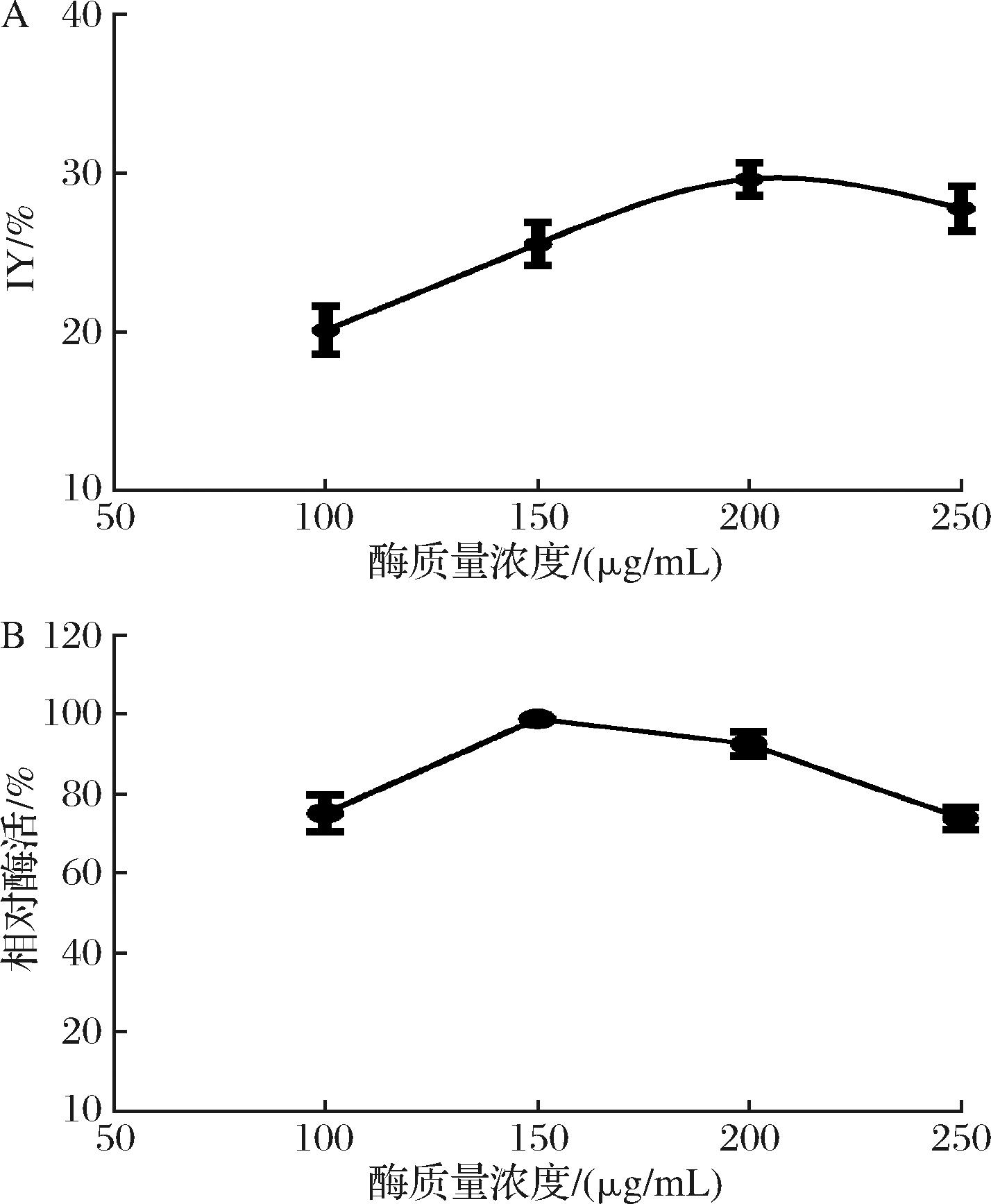
A-固定化率;B-相对酶活
图1 蛋白浓度对Xyn11A-Cu3(PO4)2固定化率及活性的影响
Fig.1 The effect of concentration of enzyme on the IY and the relative activity of Xyn11A-Cu3(PO4)2
扫描电镜观察不同浓度蛋白形成的Xyn11A-Cu3(PO4)2纳米花(图2),纳米花的形成和大小强烈依赖于体系中酶蛋白的浓度。当蛋白浓度低的时候,形成的纳米花朵比较小,花瓣层数少、稀疏;随着浓度增加,花朵直径增大,花朵层数增加,且每一层之间更紧凑。紧密的花瓣可能影响底物的进入,从而导致活性下降,相似的结果在其他酶-杂化纳米花制备过程中也有报道[19,21-22]。
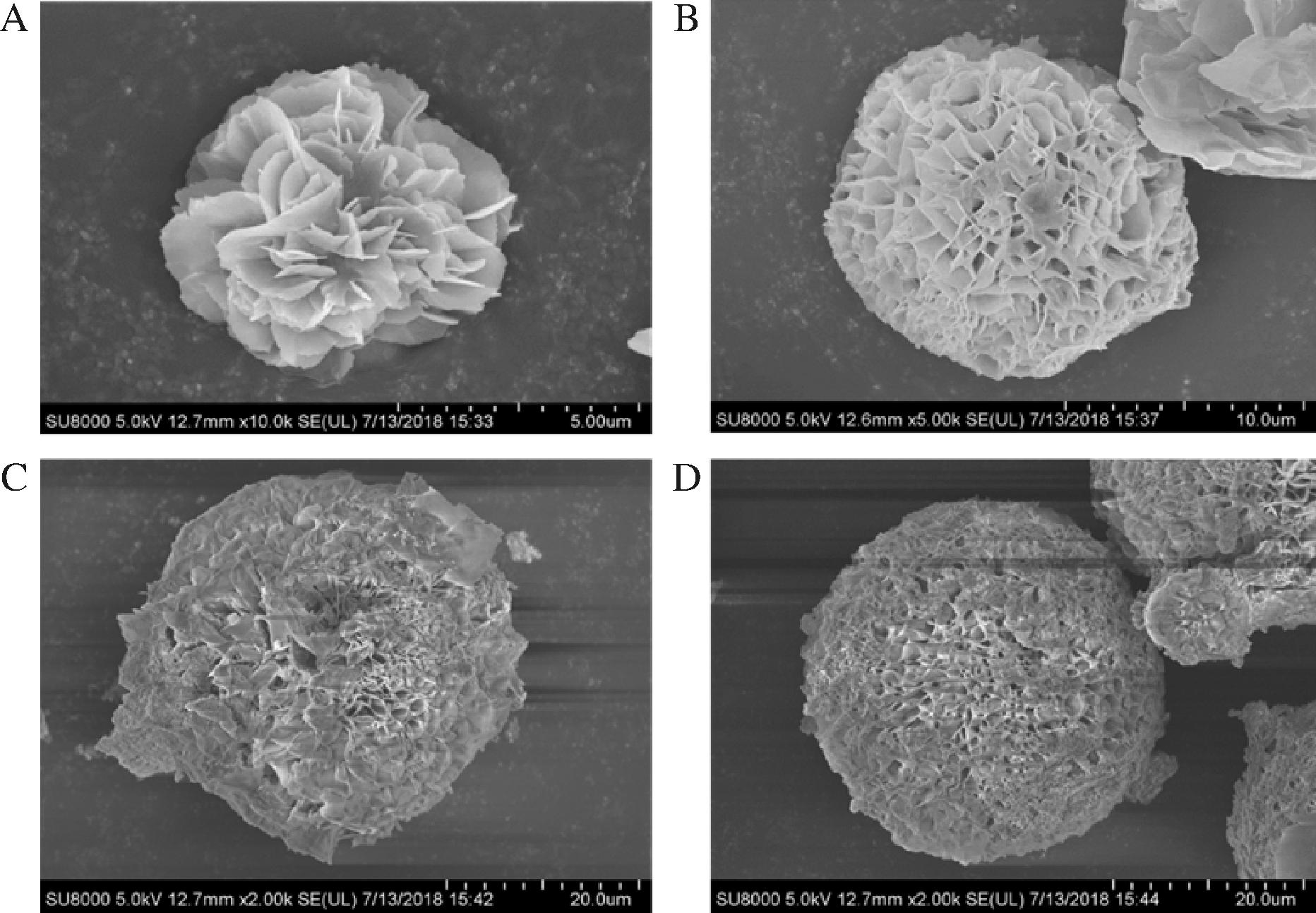
A-100 μg/mL酶蛋白形成的纳米花;B-150 μg/mL酶蛋白形成的纳米花;C-200 μg/mL酶蛋白形成的纳米花;D-250 μg/mL酶蛋白形成的纳米花
图2 不同蛋白浓度形成纳米花电镜扫描图
Fig.2 Scanning electron microscope images of hybrid nanoflowers with different concentration of enzyme
2.2 Xyn11A-氨基乙基琼脂糖共价固定化
测定不同浓度的Xyn11A与氨基乙基琼脂糖的固定化率,如图3-A所示,当Xyn11A的质量浓度为400 μg/mL时,固定化率达到最高约为55%左右;当质量浓度超过400 μg/mL时,固定化率降低,说明该浓度超过了柱材料的结合能力。测定不同的固定化酶的酶活,发现质量浓度超过400 μg/mL时,固定化酶的活性达到最大。G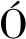 MEZ等[18]采用相同的凝胶材料固定来源Fusarium oxysporum的木聚糖酶Xyl2,最高固定化率为25%,低于Xyn11A的固定化率。推测可能是不同酶蛋白具备的可结合的羧基位点数量不同,影响酰胺键形成的能力,从而影响固定化率。
MEZ等[18]采用相同的凝胶材料固定来源Fusarium oxysporum的木聚糖酶Xyl2,最高固定化率为25%,低于Xyn11A的固定化率。推测可能是不同酶蛋白具备的可结合的羧基位点数量不同,影响酰胺键形成的能力,从而影响固定化率。

A-固定化率;B-相对酶活
图3 酶浓度对固定化率及酶活的影响
Fig.3 The effect of concentration of enzyme on the IY and relative activity of Xyn11A- agarose
2.3 固定化酶学性质研究
2.3.1 固定化酶的最适pH及pH稳定性
游离的Xyn11A的最适pH是6.0[14],测定2种不同固定化酶的最适反应pH(图4-A),Xyn11A-Cu3(PO4)2的最适pH是6.0,与游离的Xyn11A一致;而Xyn11A-Agarose在pH 6.5时活性最高,向碱性偏离约0.5。当pH为4.0时,Xyn11A-Cu3(PO4)2活性约为最高酶活性的25%,与游离的Xyn11A相似,而Xyn11A-Agarose的活性能达到最高酶活性的80%。说明Xyn11A-Agarose在酸性条件下的活性高于游离Xyn11A活性,而Xyn11A-Cu3(PO4)2在酸性条件下酶活与游离Xyn11A相似。推测可能是酶蛋白的羧基基团与载体形成共价键,影响了酶的解离,最终影响酶的最适反应pH。
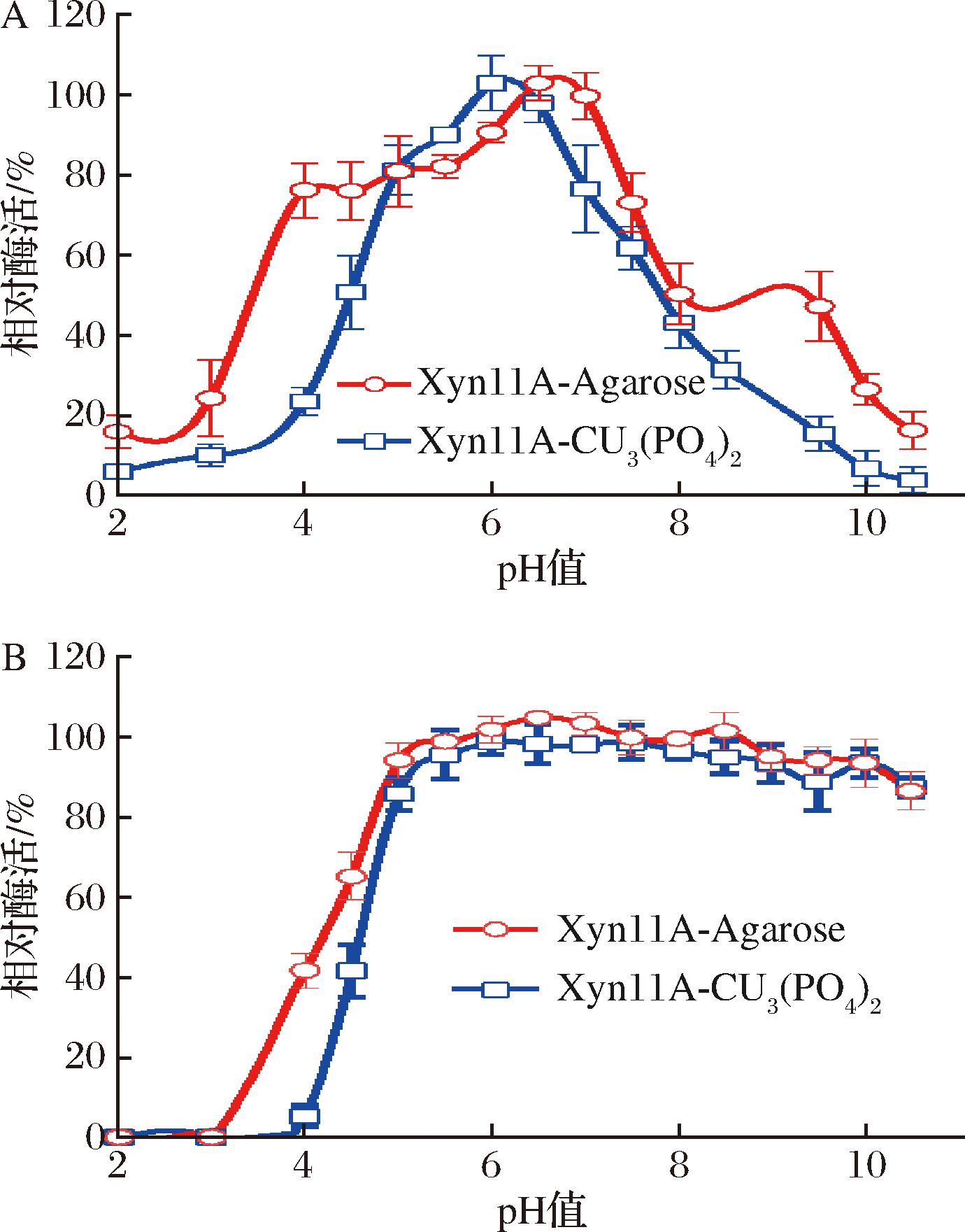
A-最适pH;B-pH稳定性
图4 固定化酶的最适pH及pH稳定性
Fig.4 Effect of pH on activity and stability of immobilized xylanase
将2种固定化酶置于不同pH缓冲液中4 ℃处理24 h后,分别测定它们的残余酶活性(图4-B),发现pH 5~10.5的缓冲液处理过夜后,2种固定化酶的酶活性几乎不受影响,均保持90%以上的残余活性;pH 4.0~4.5的缓冲液处理后,Xyn11A-Agarose仍有40%~65%的残余活性,Xyn11A-Cu3(PO4)2则有10%~40%的残余活性。相同条件下,游离的Xyn11A只有不到10%的残余酶活[14]。说明2种固定化酶比游离的Xyn11A具有更好的pH稳定性,其中Xyn11A-Agarose固定化酶pH稳定性最强。
2.3.2 固定化酶的最适反应温度及热稳定性
测定2种固定化酶的最适反应温度,结果如图5-A所示,2种固定化酶的最适反应温度均为45 ℃,与游离的Xyn11A一致。当温度为55 ℃时,Xyn11A-Cu3(PO4)2只有30%的相对活性,与游离的Xyn11A的相对活性相似,而Xyn11A-Agarose能达到60%的相对活性,说明Xyn11A-Agarose在高温环境仍有较高的酶活性。
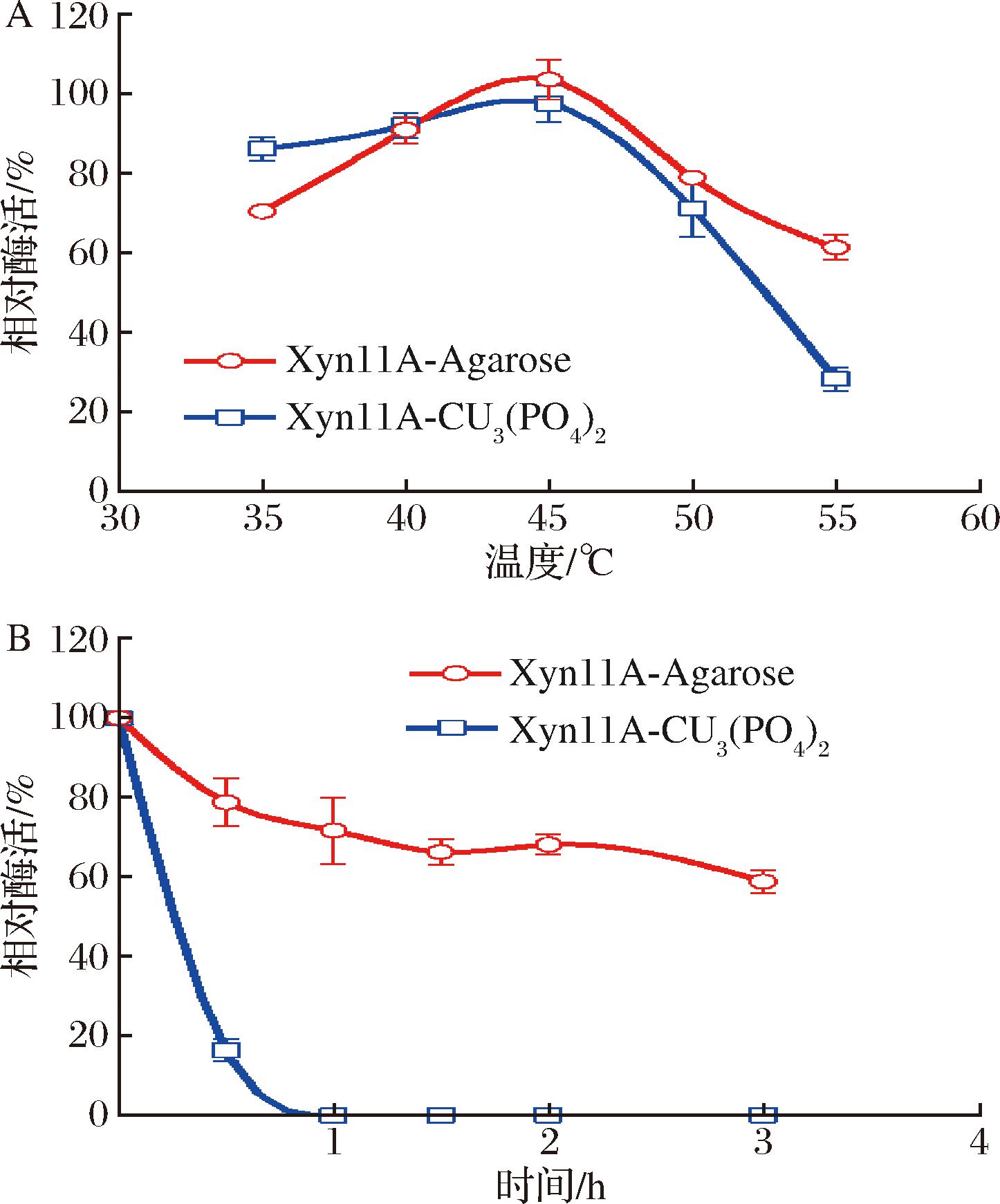
A-最适反应温度;B-热稳定性
图5 固定化酶的最适反应温度及热稳定性
Fig.5 Effect of temperature on activity and stability of immobilized xylanase
Xyn11A的热稳定性较差,45 ℃处理0.5 h后,酶活性完全丧失[14]。为了验证固定后的Xyn11A热稳定性是否提高,将2种固定化酶置于50 ℃处理不同的时间,测定残余活性。结果如图5-B所示,Xyn11A-Cu3(PO4)2处理0.5 h后只剩下约20%的残余活性,而Xyn11A-Agarose处理3 h后仍有60%的残余活性。与游离的Xyn11A相比,2种固定化酶的热稳定性都有较大提高,特别是Xyn11A-Agarose的热稳定性更好,推测共价结合固定化更有利于酶的热稳定性。
2.3.3 固定化酶的动力学研究
以榉木木聚糖为底物,测定2种固定化酶的动力学参数,结果如表1所示。Xyn11A-Cu3(PO4)2和Xyn11A-Agarose的Km分别是游离Xyn11A 的Km值的2.39倍和5.06倍,但Kcat/Km分别约为游离酶的79%和22%,说明固定化酶对底物的亲和力和催化效率有所降低。主要原因是酶固定后导致物质传递受到限制、酶的运动受到限制以及可能导致酶产生不利构象变化。Xyn11A-Cu3(PO4)2的pH稳定性和热稳定性均优于游离酶,而且Kcat约是游离酶的1.87倍。磷酸铜杂化纳米花具有较大的表面积,降低了物质传递限制,以及纳米颗粒中酶的协同作用、酶与金属离子的协同作用等增强磷酸铜杂化纳米花中酶的活性[23]。Xyn11A-Cu3(PO4)2的Km值是游离酶的2.39倍,原因是载体基质会影响底物的进入和结合,从而导致Xyn11A-Cu3(PO4)2对底物的亲和力下降。
表1 固定化酶的动力学参数
Table 1 Kinetic parameters of immobilized xylanase

动力学参数Xyn11A-Cu3(PO4)2Xyn11A-AgaroseXyn11A[14]Vmax/[μmoL/(min·mg)]418.42±7.23363.27±10.55325.17±6.99Km/(mg/mL)10.14±3.5621.52±2.334.25±0.29Kcat/(s-1)241.76±11.63144.91±5.65128.95±2.77Kcat/Km/[mL/(s·mg)]23.84±1.156.70±0.2630.34±0.65
2.4 固定化酶的循环使用分析
测定2种固定化酶的循环使用次数,如图6所示,发现Xyn11A-Cu3(PO4)2测定6轮反应后,酶活性下降至30%左右,而Xyn11A-Agarose即使催化12轮反应,酶活仍有90%左右,说明Xyn11A-Agarose循环使用效率更好。推测Xyn11A-Agarose是共价结合固定化,木聚糖酶与载体基质形成共价键,结合紧密,不容易丢失,所以重复利用率高。Xyn11A-Cu3(PO4)2的固定化是非共价结合,在使用过程中酶容易脱离载体基质。
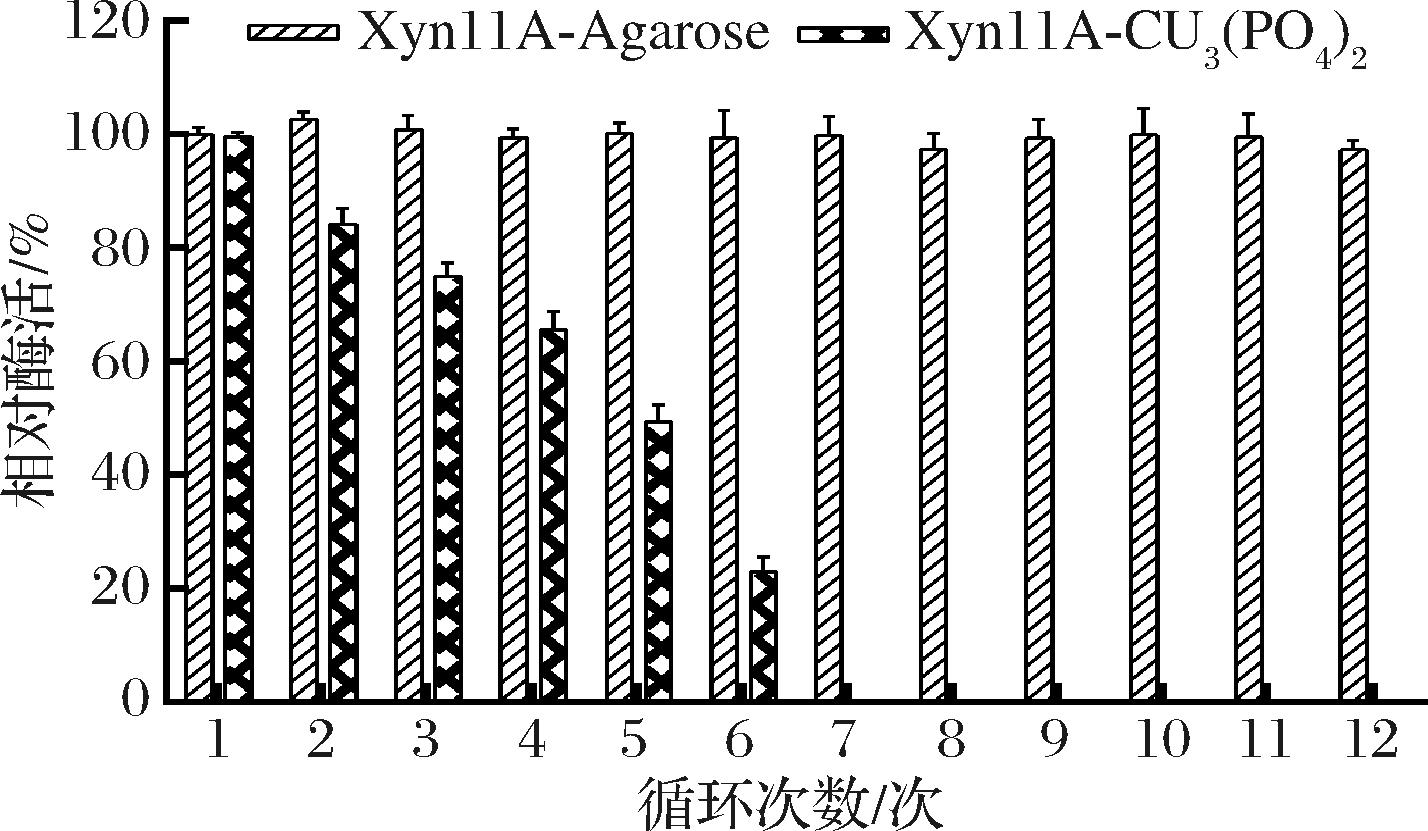
图6 固定化酶的循环使用
Fig.6 Reutilization of the immobilized xylanases
2.5 固定化酶对农业废弃物的降解作用
2种固定化木聚糖酶分别在最适条件下作用碱提取后的甘蔗渣木聚糖和玉米芯木聚糖4 h后,测定反应体系中还原糖含量(图7),发现Xyn11A-Cu3(PO4)2水解甘蔗渣和玉米芯粉的能力高于Xyn11A-Agarose的水解能力,且2种固定化酶降解甘蔗渣的能力更强。
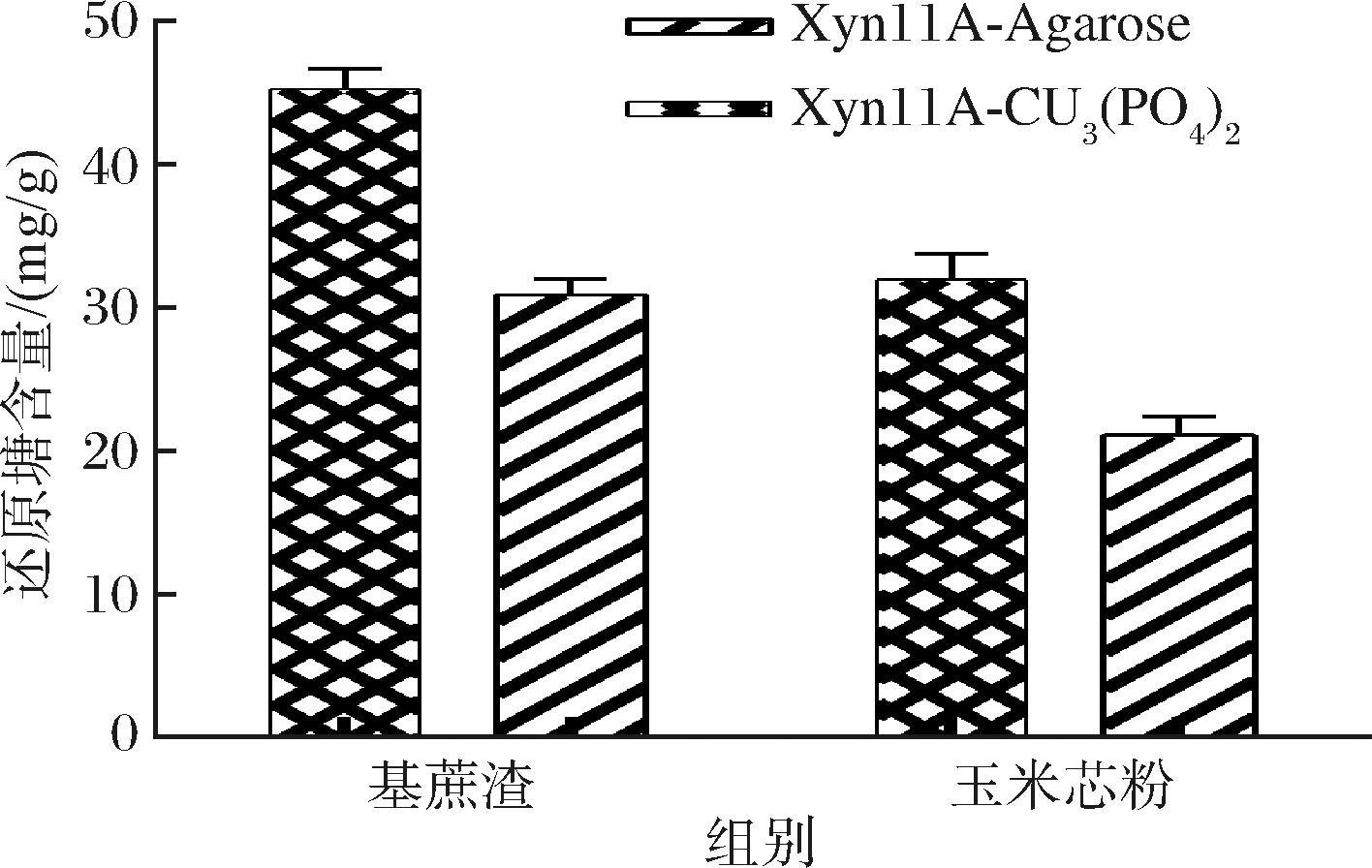
图7 木聚糖酶对甘蔗渣和玉米芯粉的降解作用
Fig.7 Hydrolysis products of agriculture wastes by immobilized xylanases
薄层层析(thin layer chromatography,TLC)分析固定化木聚糖酶水解甘蔗渣和玉米芯粉超滤前的产物,结果如图8-A所示,2种固定化酶水解甘蔗渣和玉米芯粉的产物没有木糖,产生XOS的聚合度(degree of polymerization,DP)>3,且有分子质量大于木六糖的XOS生成,但是各种寡糖分离效果较差,推测是由于可溶的大分子量的XOS影响低分子质量XOS的分离。将酶解产物用截留分子质量为3 kDa的超滤管超滤后分析,如图8-B所示,Xyn11A-Cu3(PO4)2水解甘蔗渣和玉米芯粉的产物以低聚木糖为主,包括木二糖、木三糖、木四糖、木五糖和木六糖,其中木二糖和木三糖含量最高,木四糖含量最低,推测木四糖更容易被水解成木二糖。Xyn11A-Agarose水解甘蔗渣和玉米芯粉的产物包括木二糖至木六糖,其中各种XOS含量相当。推测Xyn11A的氨基酸残基的羧基基团与载体基质的氨基形成共价键,从而引起活性中心空间结构改变,影响酶与底物结合的亚位点结构,最终导致生成的产物类型不同。超滤后的产物未见明显的大分子的XOS,推测是大分子的XOS被截留或者因为含量低未能被检测到。ROMERO-FERN NDEZ等[24]利用共价固定在乙醛基活化的甲基丙烯酸聚合物载体上,设计填充床反应器连续水解玉米芯木聚糖制备低聚木糖。ARAGON等[25]将Aspergillus versicolor的木聚糖酶固定在乙醛基活化的琼脂糖载体上,制作填充床反应器连续水解桦木木聚糖生成低聚木糖(X2~X6)。后续拟将Xyn11A-Agarose开发成填充床反应器,优化反应条件,研究连续制备低聚木糖生产工艺。
NDEZ等[24]利用共价固定在乙醛基活化的甲基丙烯酸聚合物载体上,设计填充床反应器连续水解玉米芯木聚糖制备低聚木糖。ARAGON等[25]将Aspergillus versicolor的木聚糖酶固定在乙醛基活化的琼脂糖载体上,制作填充床反应器连续水解桦木木聚糖生成低聚木糖(X2~X6)。后续拟将Xyn11A-Agarose开发成填充床反应器,优化反应条件,研究连续制备低聚木糖生产工艺。
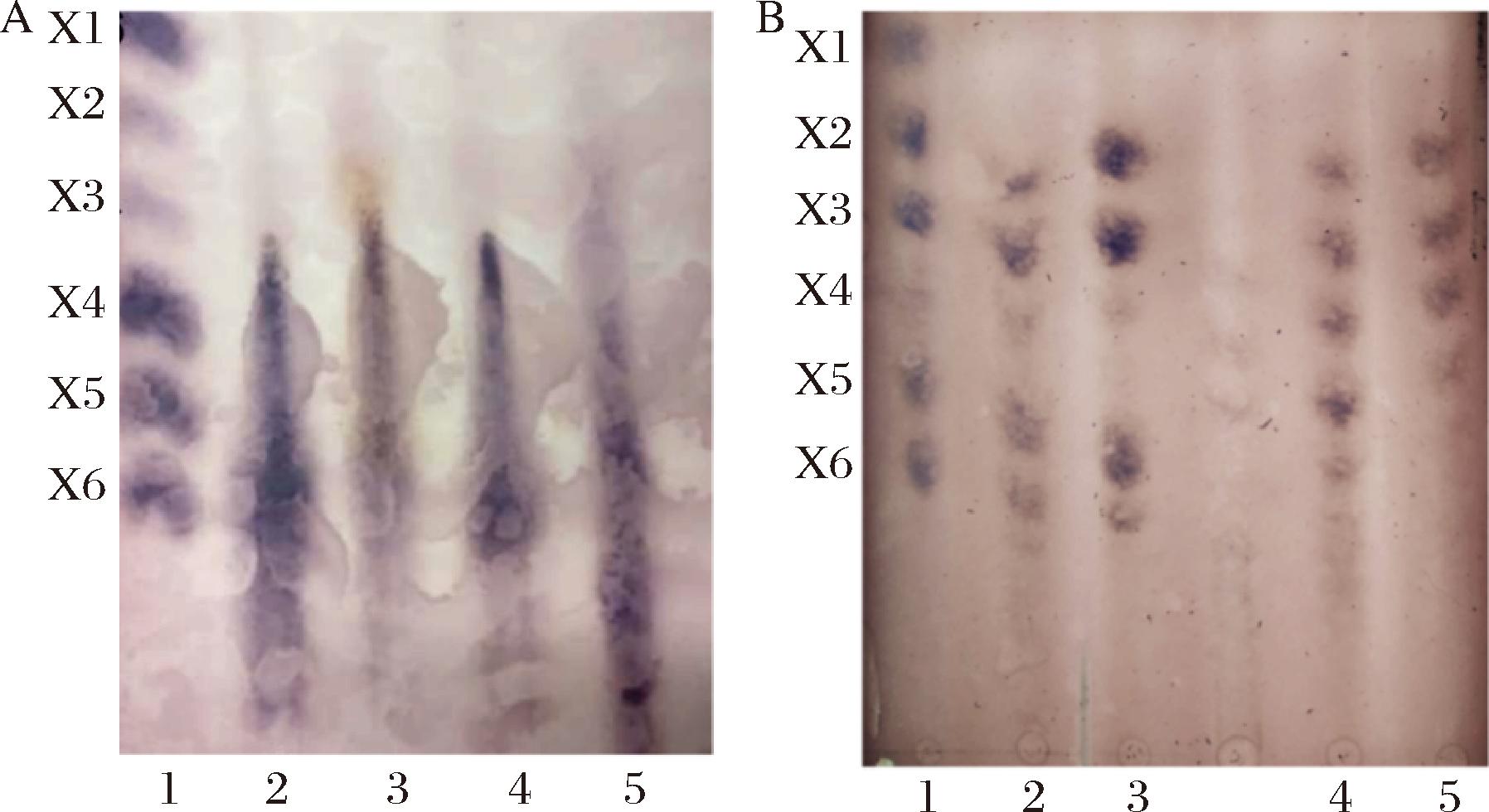
A-固定化酶水解甘蔗渣和玉米芯粉超滤前的产物分析;B-固定化酶水解甘蔗渣和玉米芯粉超滤后的产物分析
图8 TLC分析固定化酶水解甘蔗渣和玉米芯粉的产物
Fig.8 TLC analysis of hydrolysis products from sugar bagasse and corn cob by immobilized xylanases
注:图8-A中:1为木糖(X1)、木二糖(X2)、木三糖(X3)、木四糖(X4)、木五糖(X5)和木六糖(X6)标准品;2、3分别为Xyn11A-Cu3(PO4)2水解甘蔗渣和玉米芯粉的水解产物(超滤前);4、5分别为Xyn11A-Agarose水解甘蔗渣和玉米芯的水解产物(超滤前);图8-B中:1为木糖(X1)、木二糖(X2)、木三糖(X3)、木四糖(X4)、木五糖(X5)和木六糖(X6)标准品;2、3分别为Xyn11A-Cu3(PO4)2水解玉米芯粉和甘蔗渣的水解产物;4、5分别为 Xyn11A-Agarose水解玉米芯粉和甘蔗渣的水解产物。
3 结论
以有机-无机杂化纳米花技术和氨基乙基-琼脂糖为载体共价结合法制备固定化酶Xyn11A-Cu3(PO4)2和Xyn11A-Agarose,研究发现两种固定化酶的pH稳定性和热稳定性均有较大提高,特别是Xyn11A-Agarose在50 ℃处理3 h后仍有50%的残余活性,循环使用12次后仍保留了约90%的残余活性,重复使用率远高于Xyn11A-Cu3(PO4)2的使用率。Xyn11A-Cu3(PO4)2和Xyn11A-Agarose都能水解碱处理后的甘蔗渣和玉米芯粉生成低聚木糖,且Xyn11A-Agarose水解碱处理的甘蔗渣和玉米芯粉能生成木二糖至木六糖。研究表明Xyn11A-Agarose在生产低聚木糖中具有更大应用潜力。
[1] SANTIB
 EZ L, HENRIQUEZ C, CORRO-TEJEDA R, et al.Xylooligosaccharides from lignocellulosic biomass:A comprehensive review[J].Carbohydrate Polymers, 2021, 251:117118.
EZ L, HENRIQUEZ C, CORRO-TEJEDA R, et al.Xylooligosaccharides from lignocellulosic biomass:A comprehensive review[J].Carbohydrate Polymers, 2021, 251:117118.
[2] YANG S, YANG B, DUAN C, et al.Applications of enzymatic technologies to the production of high-quality dissolving pulp:A review[J].Bioresource Technology, 2019, 281:440-448.
[3] NORDBERG KARLSSON E, SCHMITZ E, LINARES-PASTÉN J A, et al.Endo-xylanases as tools for production of substituted xylooligosaccharides with prebiotic properties[J].Applied Microbiology and Biotechnology, 2018, 102(21):9081-9088.
[4] 任春霖, 董红丽, 王风芹, 等.低聚木糖生产技术及其对动物益生作用研究进展[J].食品与发酵工业, 2021, 47(9):293-298.REN C L, DONG H L, WANG F Q, et al.Research progress of xylooligosaccharides production technology and its prebiotic effect on animals[J].Food and Fermentation Industries, 2021, 47(9):293-298.
[5] POLETTO P, PEREIRA G N, MONTEIRO C R M, et al.Xylooligosaccharides:Transforming the lignocellulosic biomasses into valuable 5-carbon sugar prebiotics[J].Process Biochemistry, 2020, 91:352-363.
[6] KHAT-UDOMKIRI N, TOEJING P, SIRILUN S, et al.Antihyperglycemic effect of rice husk derived xylooligosaccharides in high-fat diet and low-dose streptozotocin-induced type 2 diabetic rat model[J].Food Science &Nutrition,2020, 8(1):428-444.
[7] CHONEVA M, SHISHMANOVA-DOSEVA M, DIMOV I, et al.Xylooligosaccharides and aerobic training regulate metabolism and behavior in rats with streptozotocin-induced type 1 diabetes[J].Open Medicine, 2022, 17(1):1 632-1 644.
[8] LIU N, WANG H Y, YANG Z Z, et al.The role of functional oligosaccharides as prebiotics in ulcerative colitis[J].Food &Function, 2022, 13(13):6875-6893.
[9] BATSALOVA T, GEORGIEV Y, MOTEN D, et al.Natural xylooligosaccharides exert antitumor activity via modulation of cellular antioxidant state and TLR4[J].International Journal of Molecular Sciences, 2022, 23(18):10430.[10] CAPETTI C C, VACILOTTO M M, DABUL A N G, et al.Recent advances in the enzymatic production and applications of xylooligosaccharides[J].World Journal of Microbiology &Biotechnology.2021, 37(10):169.
[11] SILVA V T F, RUSCHONI U C M, FERRAZ A, et al.Xylan, xylooligosaccharides, and aromatic structures with antioxidant activity released by xylanase treatment of alkaline-sulfite-pretreated sugarcane bagasse[J].Frontiers in Bioengineering and Biotechnology, 2022, 10:940712.
[12] HUANG C X, YU Y X, LI Z, et al.The preparation technology and application of xylo-oligosaccharide as prebiotics in different fields:A review[J].Frontiers in Nutrition, 2022, 9:996811.
[13] PAЁS G, BERRIN J G, BEAUGRAND J.GH11 xylanases:Structure/function/properties relationships and applications[J].Biotechnology Advances, 2012, 30(3):564-592.
[14] LI C J, KUMAR A, LUO X, et al.Highly alkali-stable and cellulase-free xylanases from Fusarium sp.21 and their application in clarification of orange juice[J].International Journal of Biological Macromolecules, 2020, 15(155):572-580.
[15] SHCHARBIN D, HALETS-BUI I, ABASHKIN V, et al.Hybrid metal-organic nanoflowers and their application in biotechnology and medicine[J].Colloids and Surfaces B, Biointerfaces, 2019, 182:110354.
[16] HEINEN P R, PEREIRA M G, RECHIA C G V, et al.Immobilized endo-xylanase of Aspergillus tamarii Kita:An interesting biological tool for production of xylooligosaccharides at high temperatures[J].Process Biochemistry, 2017, 53:145-152.
[17] LI C J, HONG Y Z, SHAO Z Z, et al.Novel alkali-stable, cellulase-free xylanase from deep-sea Kocuria sp.Mn22[J].Journal of Microbiology and Biotechnology, 2009, 19(9):873-880.
[18] G MEZ S, PAYNE A M, SAVKO M, et al.Structural and functional characterization of a highly stable endo-β-1,4-xylanase from Fusarium oxysporum and its development as an efficient immobilized biocatalyst[J].Biotechnology for Biofuels, 2016, 9(1):191.
MEZ S, PAYNE A M, SAVKO M, et al.Structural and functional characterization of a highly stable endo-β-1,4-xylanase from Fusarium oxysporum and its development as an efficient immobilized biocatalyst[J].Biotechnology for Biofuels, 2016, 9(1):191.
[19] KUMAR A, PATEL S K S, MARDAN B, et al.Immobilization of xylanase using a protein-inorganic hybrid system[J].Journal of Microbiology and Biotechnology, 2018, 28(4):638-644.
[20] 李婵娟, 石慧, 王曼玥, 等.嗜热脂肪芽孢杆菌木聚糖酶A的H297F 定点突变、表达及酶学性质变化[J].食品与发酵工业, 2018, 44(3):41-46.LI C J, SHI H, WANG M Y, et al.Site-directed mutagenesis, expression and enzymatic properties of H297F in xylanase XynA of Geobacillus stearothermophilus[J].Food and Fermentation Industries, 2018, 44(3):41-46.
[21] SOMTURK B, YILMAZ I, ALTINKAYNAK C, et al.Synthesis of urease hybrid nanoflowers and their enhanced catalytic properties[J].Enzyme and Microbial Technology, 2016, 86:134-142.
[22] GE J, LEI J D, ZARE R N.Protein-inorganic hybrid nanoflowers[J].Nature Nanotechnology, 2012, 7(7):428-432.
[23] CUI J D, JIA S R.Organic-inorganic hybrid nanoflowers:A novel host platform for immobilizing biomolecules[J].Coordination Chemistry Reviews, 2017, 352:249-263.
[24] ROMERO-FERN NDEZ M, MORENO-PEREZ S H, ORREGO A, et al.Designing continuous flow reaction of xylan hydrolysis for xylooligosaccharides production in packed-bed reactors using xylanase immobilized on methacrylic polymer-based supports[J].Bioresource Technology, 2018, 266:249-258.
NDEZ M, MORENO-PEREZ S H, ORREGO A, et al.Designing continuous flow reaction of xylan hydrolysis for xylooligosaccharides production in packed-bed reactors using xylanase immobilized on methacrylic polymer-based supports[J].Bioresource Technology, 2018, 266:249-258.
[25] ARAGON C C, SANTOS A F, RUIZ-MATUTE A I, et al.Continuous production of xylooligosaccharides in a packed bed reactor with immobilized-stabilized biocatalysts of xylanase from Aspergillus versicolor[J].Journal of Molecular Catalysis B:Enzymatic, 2013, 98:8-14.