清香型白酒采用“地缸固态发酵,清蒸二次清”的酿造工艺,因清香醇甜、纯正高雅和余味爽净的风格特点而受到众多消费者的青睐[1]。清香型大曲作为清香型白酒的糖化发酵剂,以大麦和豌豆为主要原料,经历上霉、晾霉、潮火、干火和后火等5个发酵阶段制作而成,其中潮火阶段温度最高为45~50 ℃[2]。相较于浓香型和酱香型大曲,清香型大曲的发酵温度较低,因而蕴含的微生物类群和酶系更为丰富,它们与清香型白酒的风格特征间具有密不可分的联系[3]。随着中国酒文化的逐渐流行,酒曲的品质、微生物类群及其功能也成为了当下的研究热点[4-5]。通过对汾酒清香型大曲中的微生物进行解析,雷振河等[6]发现其中的优势真核生物主要由曲霉菌属(Aspergillus)、热子囊菌属(Thermoascus)和根霉菌属(Rhizopus)等。通过对南北方清香型大曲微生物多样性展开比较分析,凌荔等[7]发现南方清香型大曲中的乳酸菌种类较北方清香型大曲更为丰富。通过解析清茬曲、后火曲和红心曲3种类型清香型大曲的微生物类群功能,HOU等[5]发现清茬曲和红心曲中的微生物类群具有较强的降解碳水化合物能力,而后火曲中的微生物类群在产生白酒风味物质方面的能力较强,因而3种清香型大曲的功能具有互补性。由此可见,清香型大曲中微生物类群丰富,且在白酒酿造中发挥了不可忽视的作用。
我国清香型白酒主要以山西汾酒、湖北黄鹤楼以及河南宝丰酒等为代表。此外,陕西白水地区亦存在品质较高的清香型白酒品牌,然而目前有关当地清香型大曲的研究还鲜有报道,因而对当地清香型大曲的理化指标和微生物类群进行解析对了解当地清香型大曲品质具有一定的积极意义。随着白酒产业进入到黄金发展阶段,我国逐渐涌现出大批白酒新产区。湖北襄阳地区作为新产区之一,当地出产的“霸王醉”酒具有“中国第一高度”的美誉,酒精度高达70%vol。该地区清香型大曲微生物类群受到了科研人员的广泛关注[5,8],CAI等[8]研究发现其中的真菌类群主要为红曲霉菌属(Monascus)、酵母菌属(Saccharomycopsis)和Thermoascus。MiSeq高通量测序技术因其检测速度快、准确性高以及成本低等优点已成为解析酒曲微生物类群的重要技术手段[6-8]。采用该技术,CAI等[8]比较分析了3种类型清香型大曲的微生物类群,结果发现红心曲中的细菌丰度和多样性最高,而清茬曲中的真菌丰度和多样性最高,该研究结果揭示了发酵顶温对清香型大曲群落结构产生了较大影响。
本研究首先采用常规理化检测方法对陕西白水地区清香型大曲的各项理化指标进行测定,同时采用MiSeq高通量测序技术对其中的真菌类群进行解析,并探究真菌类群与理化指标之间的相关性。在此基础上,本研究从MG-RAST数据库中下载湖北襄阳地区清香型大曲的真菌序列,进一步对陕西白水与湖北襄阳地区清香型大曲的真菌群落结构展开比较分析。最后采用纯培养法对白水地区清香型大曲中的可培养酵母菌进行分离鉴定。通过本研究的开展以期为陕西白水地区清香型大曲产品品质提升提供一定的理论数据参考,同时为相关从业人员在不同产区清香型大曲微生物类群差异方面提供一些新的见解。
1 材料与方法
1.1 材料与试剂
清香型大曲样品于2022年9月在陕西省渭南市白水县采集了某清香型白酒企业生产的清茬清香型大曲样品10份,样品均生产自同一批次,编号为BS1~BS10。纳入本研究的清香型大曲样品采用大麦和豌豆为原料,培菌阶段的顶温处于40~50 ℃,经历了3个月的成熟期。
氢氧化钠、碘、盐酸、乙酸、己酸、次甲基蓝、酒石酸钾钠、葡萄糖、硫酸、硫酸铜、乙酸钠、甲醛、乙醇(均为分析纯),中国医药集团有限公司;土壤基因组DNA提取试剂盒DP336,天根生化科技(北京)有限公司;rTaq聚合酶,宝日医生物技术(北京)有限公司;正/反向引物ITS3F/ITS4R(ITS3F:5′-GCATCGATGAAGAACGCAGC-3′;ITS4R:5′-TCCTCCGCTTATTGATATGC-3′)和ITS1/ITS4(ITS1:5′-TCCGTAGGTGAACCTGCGG-3′;ITS4:5′-TCCTCCGCTTATTGATATGC-3′),上海赛恒生物科技有限公司;Axygen清洁试剂盒,康宁生命科学吴江有限公司;Illumina MiSeq测序试剂盒v3,美国Illumina公司。
1.2 仪器与设备
AW-1水分活度仪,无锡碧波电子设备厂;KBF1700高温箱式炉,南京南大仪器厂;SH-10A水分测定仪,上海力辰仪器科技有限公司;PHS-3C数显台式酸度计,上海越平科学仪器有限公司;Vetiri梯度基因扩增仪,美国AB公司;164-5050基础电泳仪,美国Bio-Rad公司;MiSeq PE300高通量测序平台,美国Illumina公司;R930机架式服务器,美国DELL公司;ECLIPSE Ci生物显微镜,日本Nikon公司。
1.3 实验方法
1.3.1 清香型大曲的理化指标测定
参照轻工行业标准QB/T 4257—2011《酿酒大曲通用分析方法》中的方法对清香型大曲的酸度、灰分、淀粉含量、氨基酸态氮、酒化力、发酵力、液化力、酯化力和糖化力等指标进行测定。使用水分测定仪和水分活度仪分别测定大曲的水分含量和水分活度,测定步骤参考仪器使用说明书。
1.3.2 宏基因组DNA提取、PCR扩增和高通量测序
首先参照土壤基因组DNA提取试剂盒DP336提供的方法提取样本宏基因组DNA,继而使用含有barcode(核苷酸标签)的引物ITS3F/ITS4R对真菌内源转录间隔区(internally transcribed spacer, ITS)2区进行PCR扩增,最后将扩增成功的PCR产物纯化后送至上海美吉生物医药科技有限公司基于Hiseq-PE150平台完成测序[9]。
1.3.3 序列质控和生物信息学分析
白水地区低温大曲真菌的测序数据均于QIIME(v1.9.0)平台完成生物信息学分析。首先使用PyNAST(v 1.2.2)软件根据Barcode信息将下机fq文件中的原始序列进行归并,之后参照CAPORASO等[10]提出的标准对序列进行质控。通过质控的有效序列按照97%序列相似度构建分类操作单元(operational taxonomic units, OTU)划分[11],同时采用UCHIME(v 4.1)软件对OTU序列进行嵌合体检查和过滤[12],最后选取OTU中并基于Unite(v 7.2)数据库完成真菌物种信息注释[13]。
此外,本研究从MG-RAST公开数据库(https://www.mg-rast.org/)中下载了CAI此前研究的10份襄阳地区清茬清香型大曲样品的真菌序列,该研究数据与本研究测序数据被进一步展开了合并分析[8]。基于合并分析获得的OTU计算2个地区样本的真菌超1指数、发现物种数、香农指数和辛普森指数,并基于UniFrac距离和Bray-curtis距离的主坐标分析(principal coordinate analysis, PCoA)对2个地区样本的β多样性进行评估,同时采用LEfSe(linear discriminant analysis effect size)在线工具甄别2个地区清香型大曲的特征微生物[14]。
1.3.4 酵母菌菌株的分离鉴定
称取10 g清香型大曲样品置于装有90 mL无菌生理盐水和玻璃珠的250 mL锥形瓶中,将已装样的锥形瓶置于30 ℃摇床中振荡30 min,即制成10-1倍稀释液,继而按照10倍比例连续稀释至10-5梯度。选择10-3~10-5梯度稀释液涂布于PDA固体平板后,将平板置于28 ℃培养箱中培养3~5 d。培养结束后,根据菌落形状、颜色和大小挑取单菌落进行划线纯化。纯化后的菌株按照朱祎一等[9]的方法提取菌株DNA,并使用特异性引物ITS1/ITS4对菌株ITS区域全长进行PCR扩增,继而对扩增产物进行浓度检测和纯化,最后将质量合格的PCR产物寄至上海赛恒生物科技有限公司进行测序。
1.4 数据处理
使用GraphPad Prism9软件绘制箱型图对各项理化指标数据进行可视化;使用Origin 2021软件绘制柱形图对优势真菌门属相对含量数据进行可视化;使用SAS(v8)软件计算优势真菌属与理化指标间的相关性系数和显著性,并使用Cytoscape(v3.7.2)软件绘制相关性网络图对结果数据进行可视化;使用R软件(v 4.2.2)绘制提琴图对2个地区清香型大曲真菌的α多样性指数进行可视化,绘制主坐标图实现菌群β多样性的可视化,绘制upset图和瀑布图分别对OTU数量统计和核心OTU相对含量数据进行可视化。
2 结果与分析
2.1 白水地区清香型大曲的理化指标分析
理化指标通常是评估大曲品质的主要参考依据,因而本研究测定了白水地区某企业生产的清香型大曲样本的水分活度、酸度、氨基酸态氮含量和灰分等11项理化指标,结果如表1所示。
表1 白水地区清香型大曲的各项理化指标分析
Table 1 Analysis of the physicochemical indicators of light-flavor Daqu from the Baishui region

检测指标平均值中位数(最小值,最大值)变异系数/%水分活度/aw0.620.62(0.59,0.65)2.59酸度/(mmol/10 g)0.610.6(0.52,076)10.58水分含量(质量分数)/%11.0810.97(10.47,11.55)3.17淀粉含量/(g/100 g)57.2357.8(53.50,60.30)3.55氨基酸态氮含量/(g/kg)2.512.51(2.35,2.80)5.32灰分含量/(g/100 g)2.562.58(2.40,2.80)4.91酒化力/U8.087.9(5.54,10.94)19.59发酵力/U0.460.46(0.34,0.58)16.33液化力/U1.050.95(0.51,1.66)40.64酯化力/U691.73700.29(605.61,714.96)4.67糖化力/U447.39437.8(315.80,654.20)23.30
由表1可知,该企业生产的清香型大曲的水分活度为0.59~0.65 aw;酸度在0.52~0.76 mmol/10 g;氨基酸态氮含量为2.35~2.80 g/kg;水分含量为10.47%~11.55%(质量分数);淀粉含量为53.50~60.30 g/100 g;大曲的酒化力为5.54~10.94 U;发酵力为0.34~0.58 U;液化力为0.51~1.66 U;酯化力为605~714 U;糖化力为336~654 U。不同样品在酒化力、发酵力、液化力和糖化力指标上的变异系数(coefficients of variation, CV)值均大于15%,这表明不同样品在这些指标上的差异较大。通常酒化力和液化力的大小分别与大曲产酒精能力和出酒率呈正相关。发酵力主要评估大曲中的酶利用碳水化合物产生CO2和乙醇能力的强弱[15]。糖化力主要反映大曲的糖化效率,它往往受到小麦原料自身含有的糖化酶以及霉菌在发酵过程中产生的大量糖化酶驱动[15]。因而,这些差异很可能是不同样品中的微生物类群和酶类物质存在差异所导致的。此外,大曲的酸度和水分含量亦是评估大曲质量的重要指标。大曲中的酸度主要来源于原料浸泡和大曲发酵过程中微生物代谢碳水化合物产生的有机酸,以及蛋白质和脂质降解所产生的各种酸类物质[15-16]。适宜的酸度可抑制杂菌生长,但酸度过高又会影响到酿造微生物的生长繁殖,一般认为酸度为1.0~3.5 mmol/10 g最为适宜[17]。水是参与微生物生长和代谢的重要组分,但水分过高会造成大曲霉变,因而大曲的水分含量通常应在12.5%以下[18]。由此可见,该企业生产的清香型大曲水分含量适宜,但酸度稍低,同时在部分大曲指标上存在一定波动。
2.2 基于MiSeq高通量测序不同类型高温大曲真菌多样性解析
所有白水地区清香型大曲样品经过MiSeq高通量测序共得到813 451条序列,经过质量控制删除739条低质量序列,余下812 712条有效序列,按照97%序列相似度共划分得到558个OTU。平均每个样本中含有81 271条有效序列和263个OTU,各样本的真菌测序情况统计如表2所示。
表2 十份白水地区清香型大曲样品的真菌测序情况统计
Table 2 Statistics of fungal sequencing of 10 samples of light-flavor Daqu from Baishui region
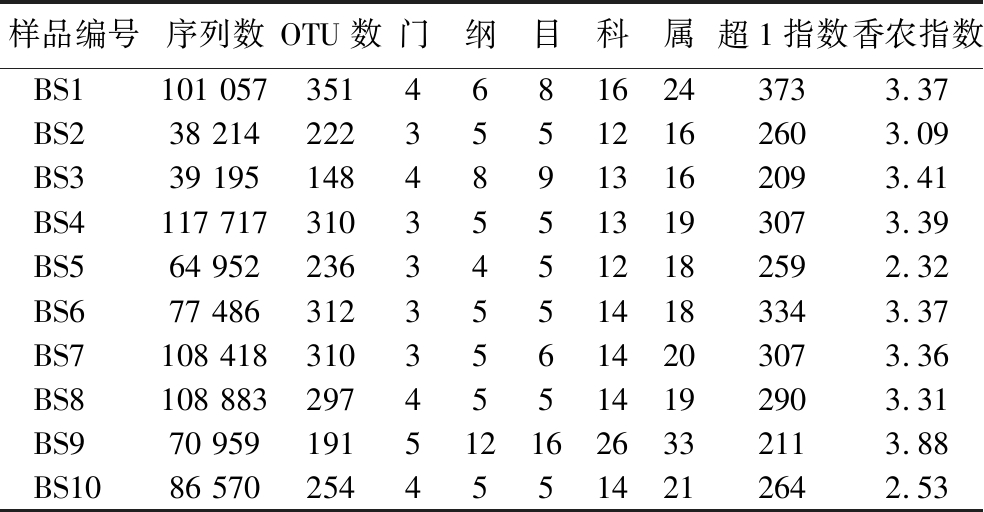
注:超1指数和香农指数均在测序深度为38 010条序列时计算得到。
样品编号序列数OTU数门纲目科属超1指数香农指数BS1101 05735146816243733.37BS238 21422235512162603.09BS339 19514848913162093.41BS4117 71731035513193073.39BS564 95223634512182592.32BS677 48631235514183343.37BS7108 41831035614203073.36BS8108 88329745514192903.31BS970 9591915121626332113.88BS1086 57025445514212642.53
由表2可知,所有有效序列共鉴定到了5个门、12个纲、16个目、26个科和33个属,分别有0.65%和2.05%的序列未鉴定到门和属水平。α多样性指数计算结果显示,纳入本研究样品中的最小和最大真菌超1指数之间相差162,而最小和最大真菌香农指数之间相差1.05,表明不同清香型大曲样品在真菌丰度和多样性上亦存在一定差异。此外,样品BS1中的真菌超1指数最大,而样品BS9中的真菌香农指数最大,这表明样品BS1中的真菌丰度最高,而样品BS9中的真菌多样性最高。本研究进一步从门和属水平解析了清香型大曲中的真菌类群,并将平均相对含量>1.0%的门和属定义为优势真菌门和属,结果如图1所示。
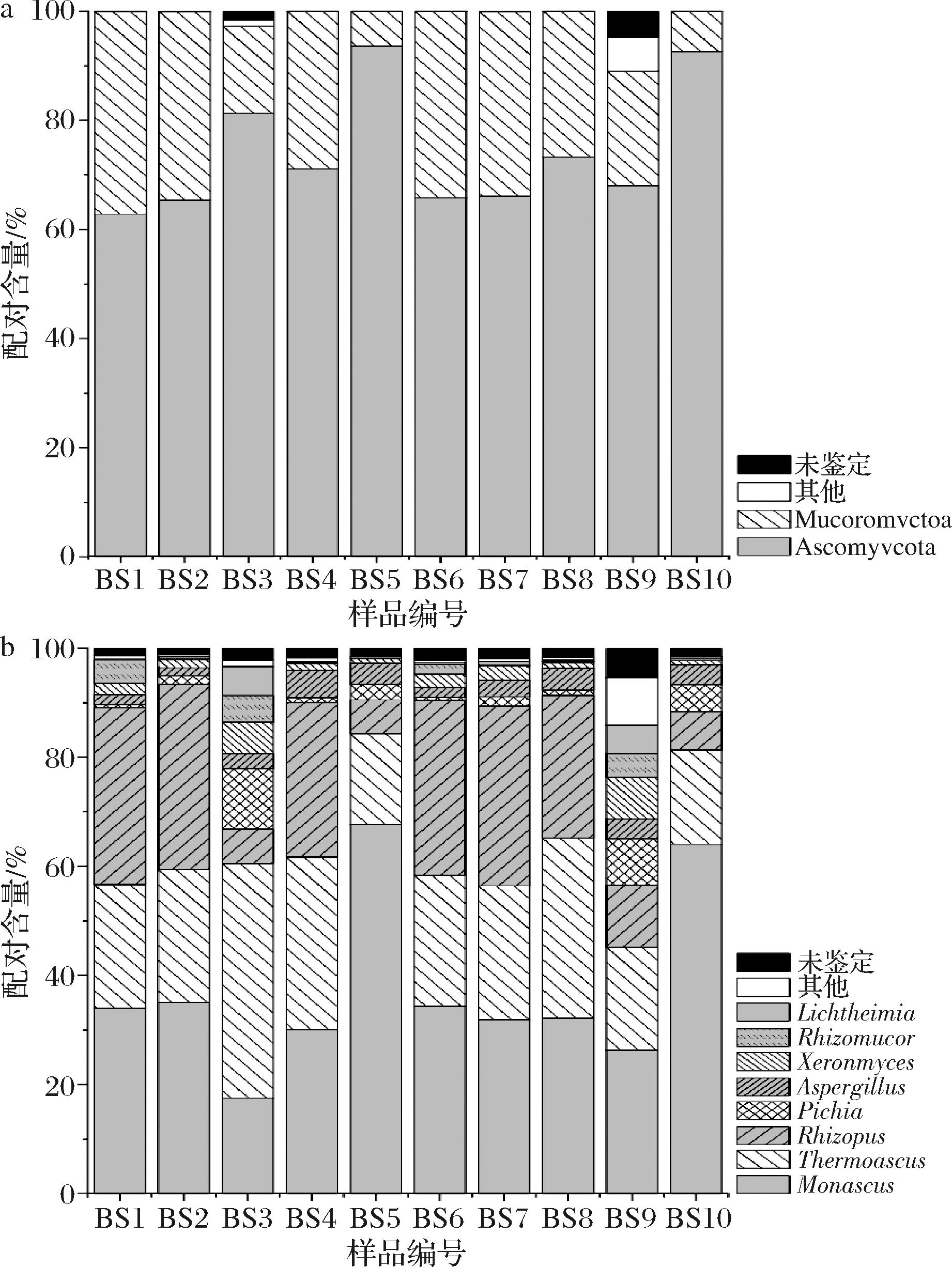
a-优势真菌门;b-优势真菌属
图1 白水地区清香型大曲中的优势真菌门和真菌属的相对含量
Fig.1 Relative content of dominant fungal phyla and fungal genera of light-flavor Daqu from the Baishui region
由图1可知,优势门共有2个,分别为子囊菌门(Ascomycota,74.00%)和毛霉菌门(Mucoromycota,24.58%);优势属共有8个,分别为隶属于Ascomycota的Monascus(红曲霉菌属,37.37%)、Thermoascus(25.57%)、Pichia(毕赤酵母属,3.34%)、Aspergillus(3.12%)和耐干霉菌属(Xeromyces,2.58%),隶属于Mucoromycota的Rhizopus(21.70%)、毛霉菌属(Rhizomucor,1.65%)和横梗霉属(Lichtheimia,1.29%),累计占比96.62%。优势真菌类群中有6个属于霉菌类群,2个属于酵母菌类群,可见清香型大曲中霉菌类群较为丰富。清香型大曲进入曲房培菌时最先经历上霉阶段,在这一阶段大曲水分含量较高且升温缓慢,为霉菌提供了良好的生长繁殖条件,使其最先成为优势菌群[19]。值得注意的是,Monascus、Thermoascus、Rhizopus和Aspergillus在所有样品中的相对含量均大于1.0%,累计含量达87.77%,这些优势真菌属在其他研究中亦常出现[2,20]。而其余优势真菌属的相对含量在部分样品中并未达到1.0%,例如Pichia在样品BS1、BS4和BS6中的相对含量均不足1.0%,而Lichtheimia仅在样品BS3和BS9中的相对含量大于1.0%。由此可见,清香型大曲中存在大量共有优势真菌类群,仅在部分相对含量较低的优势真菌类群上存在差异,这些差异真菌类群及其产生的酶类物质或许是导致产品质量存在波动的原因之一。
2.3 清香型大曲优势真菌属与理化指标间的相关性分析
在解析了清香型大曲理化指标和真菌多样性的基础上,本研究进一步探讨了优势真菌属与理化指标间的相关性,如图2所示。
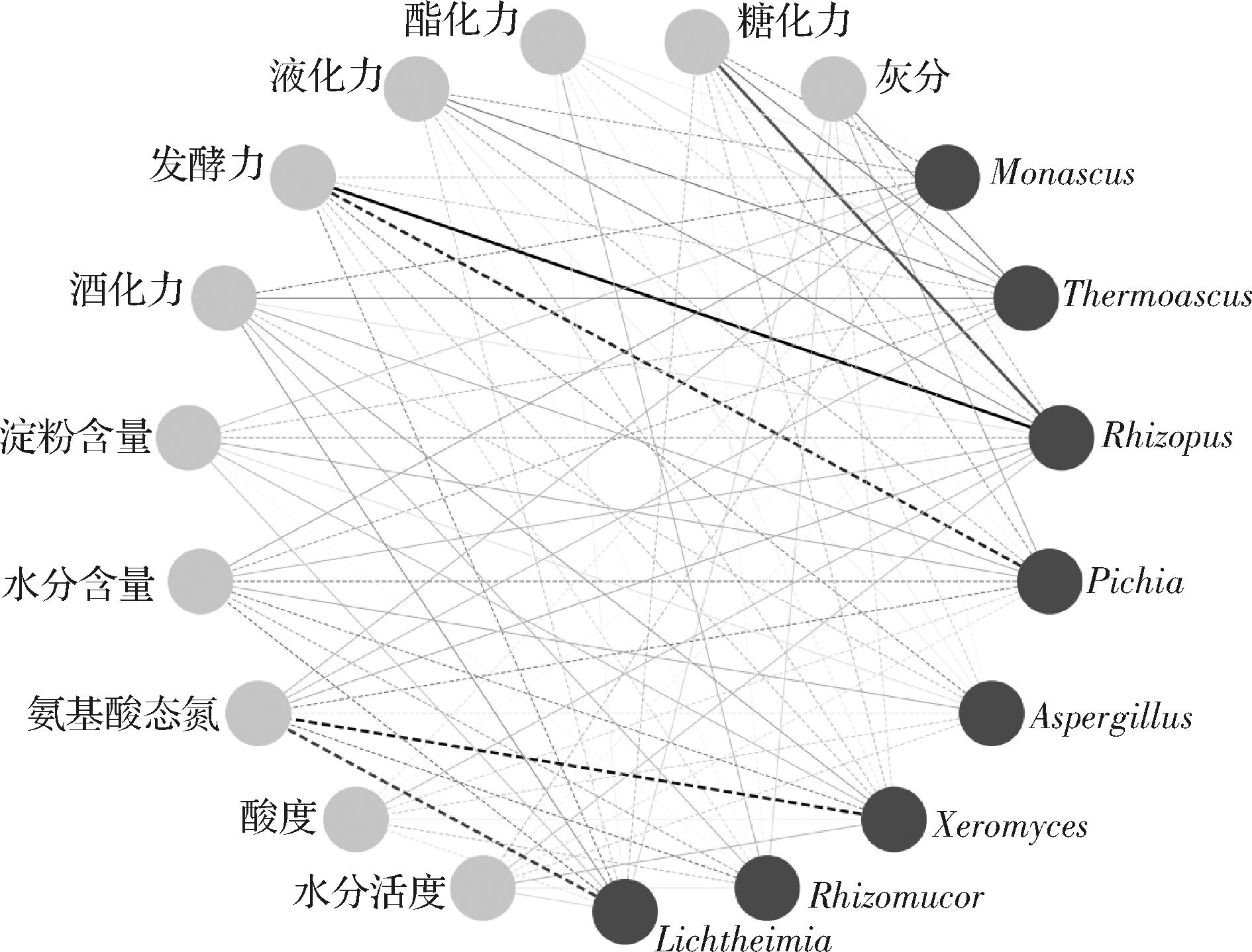
图2 白水地区清香型大曲中优势真菌属与理化指标之间的相关性分析
Fig.2 Correlation analysis between the dominant fungal genus and physicochemical indicator of light-flavor Daqu from the Baishui region
注:实线代表正相关关系,虚线代表负相关关系;线条颜色越深代表相关性系数越大;粗线条代表相关性显著(P<0.05)。
由图2可知,Rhizopus与糖化力(R=0.632,P<0.05)之间存在显著正相关关系,与发酵力之间存在极显著正相关关系(R=0.887,P<0.001),而Pichia与发酵力之间存在非常显著负相关关系(R=-0.789,P<0.01),Xeromyces与氨基酸态氮含量之间存在非常显著负相关关系(R=-0.830,P<0.01),Lichtheimia与氨基酸态氮含量之间存在显著负相关关系(R=-0.704,P<0.05)。Rhizopus能产生高活性胞外蛋白酶和糖化酶,且属于嗜热真菌类群,即使在温度较高的潮火阶段也依然能保持较高的活性[21]。因而Rhizopus产生的酶类物质可能在大曲的糖化效率和产酒精能力方面起到了积极作用。
2.4 白水和襄阳地区清香型大曲真菌群落结构的比较分析
通过从公开数据库MGRAST中下载该研究的核苷酸序列,本研究将其与陕西白水地区清香型大曲的序列进行了合并分析,进而实现了2个地区清香型大曲真菌群落结构的比较分析,以丰富相关从业人员在不同产区清香型大曲微生物群落结构上的认识。本研究首先计算了2个地区清香型大曲真菌的超1指数、发现物种数香农指数和辛普森指数等α多样性指数,其中超1指数和发现物种数常用于表征物种丰度,而香农指数和辛普森指数常用于表征物种多样性,结果如图3所示。

a-超1指数小提琴图;b-发现物种数小提琴图;c-香农指数小提琴图;d-辛普森指数小提琴图;e-基于非加权UniFrac距离;f-Bray-Curtis距离的PCoA分析
图3 白水和襄阳地区清香型大曲真菌α多样性和β多样性的比较分析
Fig.3 Comparative analysis of fungal α-diversity and β-diversity of light-flavor Daqu from Baishui and Xiangyang regions
注:NS代表P>0.05,差异不显著;“***”代表P<0.05,差异极显著。
由图3可知,白水和襄阳地区清香型大曲真菌的平均超1指数分别为388和459,平均发现物种数为291和315,平均香农指数分别为3.28和1.15,平均辛普森指数分别为0.77和0.37。尽管白水地区清香型大曲的真菌超1指数和发现物种数均要低于襄阳地区,然而两者之间的差异并不显著(P>0.05)。相反,白水地区清香型大曲真菌的香农指数和辛普森指数均要极显著高于襄阳地区(P<0.05)。因而,2个地区清香型大曲中的细菌丰度较为相似,但白水地区清香型大曲中真菌的多样性要显著高于襄阳地区。由图3-e可知,在基于非加权UniFrac距离的PCoA主坐标中,白水地区清香型大曲样本均分布在X轴的负半轴,而襄阳地区清香型大曲样本均分布在X轴的正半轴,二者在空间分布上呈现出明显的分离趋势。由图3-f可知,基于Bray-curtis距离的主坐标呈现出与非加权UniFrac距离主坐标相同的趋势。由此可见,2个地区清香型大曲的真菌群落结构间存在较大差异。
2.5 白水和襄阳地区清香型大曲的差异和核心真菌类群解析
本研究在初步探究了2个地区清香型大曲真菌群落结构差异的基础上,进一步采用LEfSe分析甄别了二者各自的特征真菌类群,同时基于OTU水平探究了2个地区清香型大曲中的核心真菌类群,结果如图4所示。
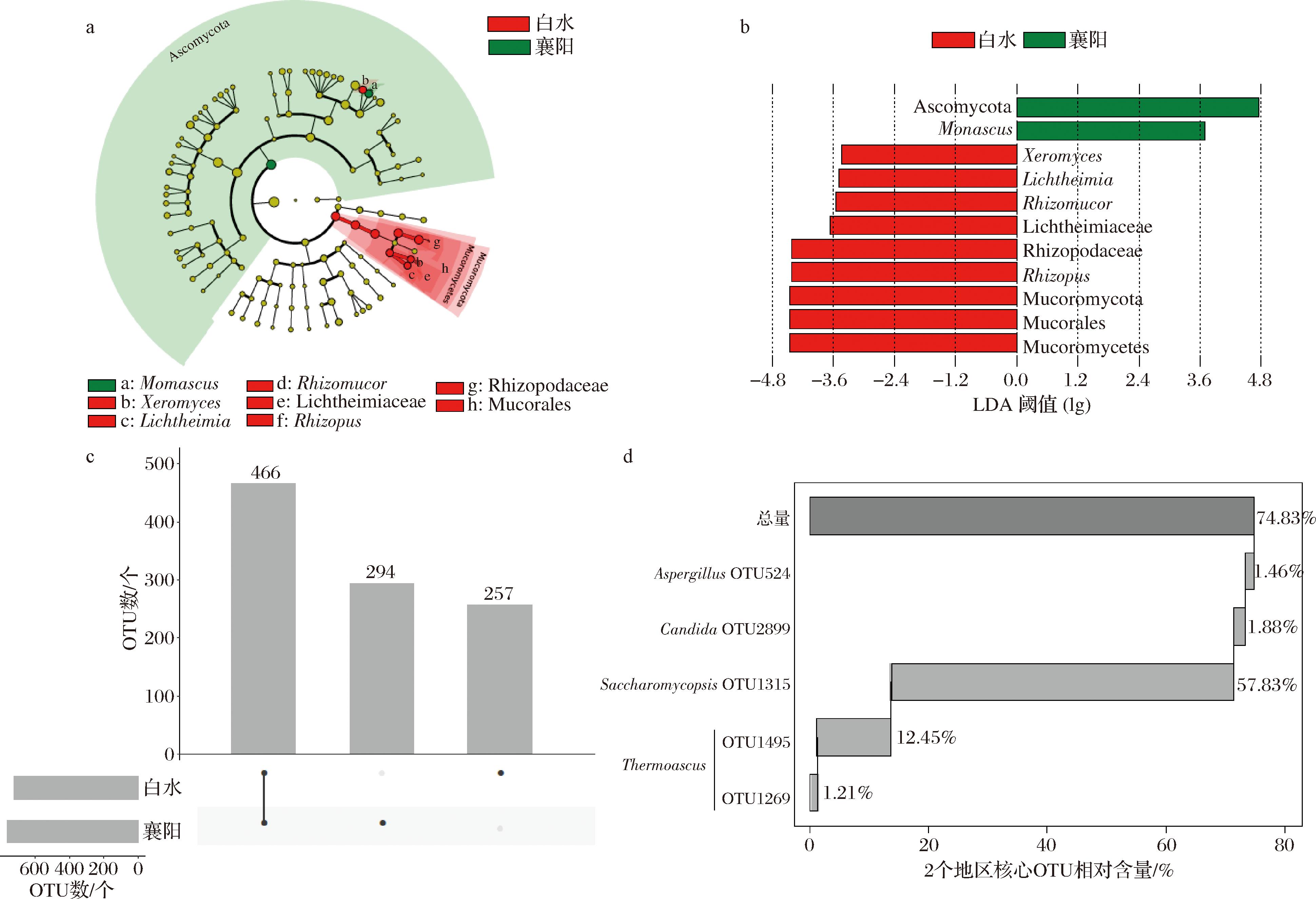
图4 白水和襄阳地区清香型大曲基于OTU水平的LEfSe分析和核心真菌类群分析
Fig.4 LEfSe analysis and core fungal community analysis based on OTU level of light-flavor Daqu from Baishui and Xiangyang regions
由图4-a可知,白水地区清香型大曲的特征真菌类群均隶属于Mucoromyctoa分支,而白水地区清香型大曲的特征真菌类群则隶属于Ascomycota分支。由图4-b可知,当线性判别分析(linear discriminant analysis, LDA)阈值大于3.0时,白水地区清香型大曲具有9个特征真菌类群,属水平上的为Rhizomucor和Lichtheimia。然而,襄阳地区清香型大曲仅有2个特征真菌类群,分别为Ascomycota和Monascus。可见2个地区清香型大曲的特征微生物分别隶属于不同的真菌门。由图4-c可知,2个地区清香型大曲中有466个共有OTU,白水地区清香型大曲特有257个OTU,而襄阳地区清香型大曲特有294个OTU。此外,有27个OTU在20份样品中均存在,其中OTU1269、OTU1495、OTU1315、OTU2899和OTU524的平均相对含量>1.0%,因而被定义为核心OTU。由图4-d可知,5个核心OTU分别被鉴定为Thermoascus(13.66%)、Saccharomycopsis(酵母菌属,57.83%)、Candida(假丝酵母菌属,1.88%)和Aspergillus(1.46%)。由此可见,相较于襄阳地区清香型大曲,白水地区清香型白酒中的Rhizomucor和Lichtheimia要显著偏高,而Monascus则显著偏低。Thermoascus、Saccharomycopsis、Candida和Aspergillus则为2个地区清香型大曲中的核心真菌类群。
2.6 酵母菌菌株的分离鉴定
最后,本研究采用纯培养法从10份白水地区清香型大曲中共分离出12株疑似酵母菌菌株,并选取了一株分离株的菌落形态和细胞形态为代表呈现在图5中,如图5所示。
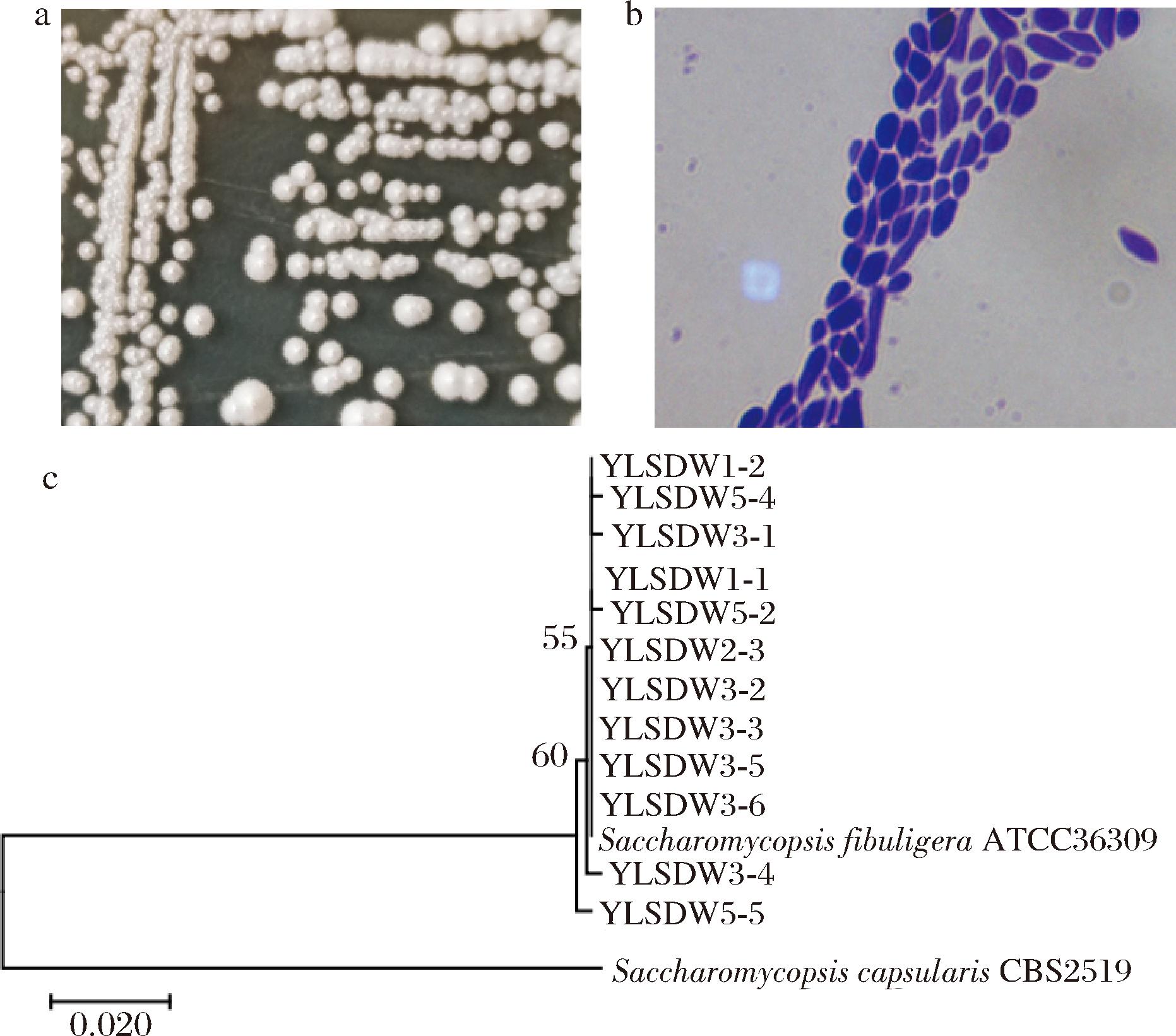
a-菌落形态;b-细胞形态;c-系统发育树
图5 白水地区清香型大曲中酵母菌分离株的菌落形态、细胞形态和系统发育树
Fig.5 Colony morphology, cellular morphology and phylogenetic tree of yeast isolates in light-flavor Daqu from the Baishui region
由图5可知,分离株的菌落均呈规则的白色凸起圆形,表面干燥,而细胞形态呈不规则椭圆形。由图5-c系统发育树可知,所有分离株的序列均与菌株S.fibuligera ATCC36309最相近,因而均被鉴定为S.fibuligera。尽管Saccharomycopsis并不属于白水地区清香型大曲中的优势真菌类群,但其属于2个地区中的核心真菌类群之一。Saccharomycopsis广泛存在于麦曲、红曲和小曲等各类酒曲样品中[22-23],且S.fibuligera具有优良的产酶特性,可生产葡萄糖苷酶、淀粉酶和酸性蛋白酶等多种酶类物种,是谷物发酵和酿酒过程中的重要功能微生物[24]。
3 结论
白水地区某企业生产的清香型大曲在水分含量、氨基酸态氮、酸度和淀粉含量等指标上均较为稳定,而在酒化力、液化力、发酵力和糖化力等指标上存在一定的波动,同时大曲的酸度指标偏低。该地区清香型大曲样品在真菌丰度和多样性亦存在一定波动,优势真菌属主要为Monascus、Thermoascus和Rhizopus等,其中Rhizopus与糖化力和发酵力间均呈现显著正相关关系(P<0.05)。此外,白水和襄阳地区清香型大曲真菌群落结构的比较分析结果显示白水地区清香型大曲的真菌多样性要显著高于襄阳地区,Rhizopus、Lichtheimia和Monascus是2个地区的差异真菌类群,而Thermoascus、Saccharomycopsis、Candida和Aspergillus则为核心真菌类群。纯培养结果显示白水地区清香型大曲中的可培养酵母菌主要为Saccharomycopsis fibuligera。
[1] 曹苗文, 相里加雄, 杨凯环, 等.清香型大曲白酒酿造中发酵微生物的分析研究[J].酿酒科技, 2022, 331(1):36-41;46.CAO M W, XIANGLI J X, YANG K H, et al.Analysis of fermentation microorganisms in the production of Daqu Qingxiang Baijiu[J].Liquor-Making Science &Technology, 2022, 331(1):36-41;46.
[2] HU Y N, HUANG X N, YANG B, et al.Contrasting the microbial community and metabolic profile of three types of light-flavor Daqu[J].Food Bioscience, 2021, 44:101395.
[3] ZHENG X W, YAN Z, HAN B Z, et al.Complex microbiota of a Chinese “Fen” liquor fermentation starter (Fen-Daqu), revealed by culture-dependent and culture-independent methods[J].Food Microbiology, 2012, 31(2):293-300.
[4] KANG J M, CHEN X X, HAN B Z, et al.Insights into the bacterial, fungal, and phage communities and volatile profiles in different types of Daqu[J].Food Research International, 2022, 158:111488.
[5] HOU Q C, WANG Y R, CAI W C, et al.Metagenomic and physicochemical analyses reveal microbial community and functional differences between three types of low-temperature Daqu[J].Food Research International, 2022, 156:111167.
[6] 雷振河. 采用高通量测序技术分析清香型白酒酿造微生物[J].食品与发酵工业, 2015, 41(9):164-167.LEI Z H.Primary analysis on the fermented microorganism of Fen-flavor liquor by high-throughput sequencing[J].Food and Fermentation Industries, 2015, 41(9):164-167.
[7] 凌荔, 方尚玲, 牟飞燕, 等.基于高通量测序技术分析南方清香型白酒大曲的微生物多样性[J].酿酒科技, 2023(1):51-60.LING L, FANG S L, MOU F Y, et al.Analysis of microbial diversity of Qingxiang Daqu based on high-throughput sequencing[J].Liquor-Making Science &Technology, 2023(1):51-60.
[8] CAI W C, WANG Y R, NI H, et al.Diversity of microbiota, microbial functions, and flavor in different types of low-temperature Daqu[J].Food Research International, 2021, 150(Part A):110734.
[9] 朱祎一, 文安燕, 王琴, 等.贵州望谟板栗冷藏期致腐真菌鉴定及其生物学特性研究[J].食品与发酵工业, 2023, 49(8):113-120.ZHU Y Y, WEN A Y, WANG Q, et al.Identification and biological characteristics of pathogenic fungi of refrigerated chestnut from Wangmo, Guizhou province[J].Food and Fermentation Industries, 2023, 49(8):113-120.
[10] CAPORASO J G, KUCZYNSKI J, STOMBAUGH J, et al.QIIME allows analysis of high-throughput community sequencing data[J].Nature Methods, 2010, 7(5):335-336.
[11] WEI Z G, ZHANG X D, CAO M, et al.Comparison of methods for picking the operational taxonomic units from amplicon sequences[J].Frontiers in Microbiology, 2021, 12:644012.
[12] EDGAR R C, HAAS B J, CLEMENTE J C, et al.UCHIME improves sensitivity and speed of chimera detection[J].Bioinformatics, 2011, 27(16):2194-2200.
[13] K LJALG U, NILSSON R H, ABARENKOV K, et al.Towards a unified paradigm for sequence-based identification of fungi[J].Molecular Biology, 2013, 22(21):5271-5277.
LJALG U, NILSSON R H, ABARENKOV K, et al.Towards a unified paradigm for sequence-based identification of fungi[J].Molecular Biology, 2013, 22(21):5271-5277.
[14] CHANG F, HE S S, DANG C Y.Assisted selection of biomarkers by linear discriminant analysis effect size (LEfSe) in microbiome data[J].Journal of Visualized Experiments:JoVE, 2022,16: 183.
[15] 杨勇, 李燕荣, 姜雷, 等.中高温大曲曲块部位间生化指标的差异及变化规律[J].食品与发酵工业, 2019, 45(19):73-78.YANG Y, LI Y R, JIANG L, et al.Study on the difference and change regulation of biochemical indices between parts of medium and high temperature Daqu[J].Food and Fermentation Industries, 2019, 45(19):73-78.
[16] PANG X N, HUANG X N, CHEN J Y, et al.Exploring the diversity and role of microbiota during material pretreatment of light-flavor Baijiu[J].Food Microbiology, 2020, 91:103514.
[17] 唐佳代, 赵益梅, 冉光耀, 等.基于第三代测序与理化指标评价不同压曲工艺酱香大曲品质[J].中国酿造, 2022, 41(12):74-78.TANG J D, ZHAO Y M, RAN G Y, et al.Evaluation of the quality of sauce-flavor Daqu with different molding processes based on third-generation sequencing and physicochemical indexes[J].China Brewing, 2022, 41(12):74-78.
[18] 王俏, 郭聃洋, 王旭亮, 等.中国白酒不同香型酒曲理化性能对比分析[J].酿酒科技, 2015(6):6-10.WANG Q, GUO D Y, WANG X L, et al.Comparative analysis of physiochemical properties of Baijiu (liquor) starter of different flavor types[J].Liquor-Making Science &Technology, 2015(6):6-10.
[19] FAN G S, SUN B G, FU Z L, et al.Analysis of physicochemical indices, volatile flavor components, and microbial community of a light-flavor Daqu[J].Journal of the American Society of Brewing Chemists, 2018, 76(3):209-218.
[20] ZHENG Y F, LIANG F, WU Y, et al.Unraveling multifunction of low-temperature Daqu in simultaneous saccharification and fermentation of Chinese light aroma type liquor[J].International Journal of Food Microbiology, 2023, 397:110202.
[21] HUANG Y H, YI Z L, JIN Y L, et al.Metatranscriptomics reveals the functions and enzyme profiles of the microbial community in Chinese Nong-flavor liquor starter[J].Frontiers in Microbiology, 2017, 8:1747.
[22] XIAO C, WANG L, ZHANG Y G, et al.A comparison of microbial communities and volatile compounds in wheat Qu from different geographic locations[J].LWT, 2021, 148:111752.
[23] HUANG Z R, GUO W L, ZHOU W B, et al.Microbial communities and volatile metabolites in different traditional fermentation starters used for Hong Qu glutinous rice wine[J].Food Research International, 2019, 121:593-603.
[24] XIE Z B, ZHANG K Z, KANG Z H, et al.Saccharomycopsis fibuligera in liquor production:A review[J].European Food Research and Technology, 2021, 247(7):1569-1577.