燕麦(Arena sativa L.)是世界七大栽培作物之一,具有较高的营养价值,被中国营养学会列为十大谷物之一。燕麦含有丰富的蛋白质、膳食纤维、不饱和脂肪酸、酚酸、黄酮和皂苷类等营养物质[1],研究证明它们可以降低血液中胆固醇、甘油三酯的含量,从而减少心脏病、高血压、高血脂、动脉硬化和糖尿病等疾病的风险[2]。
目前我国燕麦以燕麦片和燕麦粉为主要加工形式,产品种类单一是限制燕麦产品市场规模扩大、国民燕麦摄入量提升的重要原因之一。另外,目前消费者对加工食品健康属性、便携性、即食性等方面的需求日益增强,对加工方式和产品品质提出了更高的要求。生物加工方式可延长产品的货架期,改善感官品质,且可通过微生物自身的代谢及酶系,调整食品的宏量营养组成,从而提高食品的健康属性[3]。
乳酸菌是一类将糖类转化为乳酸的益生菌,乳酸菌发酵食品历史悠久,但主要以乳制品为主。近年来,越来越多的关注集中于以植物原料为基质的乳酸菌发酵[4]。乳酸菌发酵既能改善植物基饮料的风味,提高营养价值,也能延长货架期,增强保健作用[5]。由于兼具植物原料高纤维素特点和乳酸菌的益生特性,迎合消费者的健康需求,乳酸菌发酵成为植物型原料加工领域的新热点,也势必是加工燕麦的可行方式。然而,菌种是影响发酵食品的重要因素,不同乳酸菌的生长性能和代谢特性对发酵燕麦浆的质构、风味和营养特性影响巨大[6]。但是目前对发酵燕麦的适配性菌种的开发仍然欠缺,发酵产品的风味和理化质控指标也不明确,因此亟待以燕麦为对象选择适配性高、风味好的菌种,开发燕麦的益生菌加工技术。
综上,本文以燕麦为发酵基质,对比不同乳酸菌组合发酵对燕麦总酚、总黄酮含量和抗氧化活性的影响,并结合活菌数、有机酸、风味物质组成、感官等指标筛选出最适宜发酵的乳酸菌组合,旨在开发针对燕麦原料发酵的适宜菌种组合,为工业生产兼具营养功能和风味特性的益生菌发酵燕麦饮品提供理论依据和可借鉴的生产流程。
1 材料与方法
1.1 材料与试剂
燕麦粉,阜新佳麦粮品有限公司;草酸、酒石酸、奎宁酸、丙酮酸、苹果酸、莽草酸、乳酸、乙酸、柠檬酸、琥珀酸标准品,Solarbio公司;总抗氧化能力(total antioxidant capacity,T-AOC)检测试剂盒(ABTS、DPPH),上海生工有限公司;甲醇、乙腈(均为色谱级),国药集团有限公司。
1.2 实验菌种
所有菌株均由实验室前期自不同食品中分离筛选得到,通过16S rRNA序列测序并在NCBI比对后鉴定得出分类学信息。具体见表1。
表1 菌株信息
Table 1 The information of lactic acid bacteria strains

菌株来源保加利亚乳杆菌Lactobacillus delbrueckii,菌株编号:L4本实验室留存嗜热链球菌 Streptococcus thermophilus,菌株编号:L1本实验室留存植物乳杆菌Lactobacillus plantarum,菌株编号:D、F、AR2、M、R、PL-4、2-41、1-21本实验室留存鼠李糖乳杆菌Lactobacillus rhamnosus,菌株编号:S本实验室留存谷糠乳杆菌Lactobacillus farraginis,菌株编号:JN-3、JN-5本实验室留存瑞士乳杆菌Lactobacillus helveticus,菌株编号:RS本实验室留存戊糖乳杆菌Lactobacillus pentosus,菌株编号:WT本实验室留存乳酸片球菌Pediococcus acidilactici,菌株编号:DR1本实验室留存副干酪乳杆菌Lactobacillus paracasei,菌株编号:3-F本实验室留存哈尔滨乳杆菌Lactobacillus Beijerinck,菌株编号:P1-1本实验室留存乳酸乳球菌Lactococcus lactis,菌株编号:005本实验室留存嗜酸乳杆菌Lactobacillus acidophilus,菌株编号:ACD本实验室留存
1.3 仪器与设备
UV-8000紫外-可见分光光度计,上海精密仪器仪表有限公司;数字pH计,瑞士Mettler-Toledo公司;Waters2695高效液相色谱仪,美国Waters公司;GC 7890B-MSD 5977B 气相色谱-质谱联用仪,美国Agilent公司。
1.4 实验方法
1.4.1 菌种活化
将甘油管中的菌株接种到MRS肉汤培养基中,于37 ℃恒温培养18~20 h,活化3次后于5 000×g、4 ℃离心10 min收集菌体,用生理盐水洗涤3次后重悬,用于接种。
1.4.2 燕麦浆发酵
燕麦浆制备:按料水比1∶4(g∶mL)加入燕麦粉和纯净水搅拌均匀后,加入质量分数为0.05%的淀粉酶于60 ℃液化50 min,再添加质量分数为0.11%的糖化酶于60 ℃糖化70 min,最后于95 ℃加热10 min灭酶灭菌,制得燕麦浆。
接种发酵:按3%(体积分数)接种量将菌悬液接种于燕麦浆中,于37 ℃下发酵9 h,得到发酵燕麦浆。以相同条件下未接种发酵的燕麦浆为对照。具体分组如下:
a)对照组(CON:燕麦原浆);
b)单菌发酵组(AR2组:接种植物乳杆菌AR2,接种量3%;F组:接种植物乳杆菌F,接种量3%);
c)混菌发酵组(L1-L4组:接种保加利亚乳杆菌L4和嗜热链球菌L1,接种量各1.5%;L1-L4-AR2组:接种植物乳杆菌AR2、保加利亚乳杆菌L4和嗜热链球菌L1,接种量各1%;L1-L4-F组:接种植物乳杆菌F、保加利亚乳杆菌L4和嗜热链球菌L1,接种量各1%)。
1.4.3 发酵性能测定
生物量:使用紫外-可见分光光度计测定活化后菌株的OD600;活菌数:采用平板稀释涂布法测定活菌数;pH值:使用pH计测定;总酸:参考MARKKINEN等[7]的方法测定总酸含量;还原糖:参考尹雪林等[8]的方法测定还原糖含量。
1.4.4 菌株的淀粉酶活性测定
参考徐一涵[9]的方法,采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定乳酸菌的淀粉酶活力。酶活力单位定义:37 ℃条件下,每小时能降解淀粉生成1 mg麦芽糖所需的酶量定义为一个酶活力单位,表示1 U/mL。
1.4.5 总酚和总黄酮的测定
参考KWAW等[10]方法测定燕麦浆总酚含量。将样品10 000 r/min离心10 min,取0.2 mL上清液采用福林-酚法测定样品的总酚含量。以没食子酸当量(mg/mL)表示总酚含量。
参考WANG等[11]方法测定燕麦浆的总黄酮含量。将样品10 000 r/min离心10 min,取0.15 mL质量分数为5%的NaNO2溶液与0.5 mL样品上清液混合反应6 min,然后加入0.15 mL质量分数为10%的硝酸铝溶液并反应6 min,再向混合物中添加2 mL质量分数为4%的NaOH溶液,振荡混匀3 min后测定508 nm处吸光度,以芦丁当量(mg/mL)表示总黄酮含量。
1.4.6 抗氧化性的测定
DPPH自由基清除活性和ABTS阳离子自由基清除活性测定依据覃超等[12]方法。铁还原/抗氧化能力(ferric reducing/antioxidant power,FRAP)测定依据黄豪等[13]方法。
1.4.7 持水力的测定
根据王鑫磊等[14]方法测定。称取5 g发酵燕麦浆置于15 mL离心管中,离心去上清液后称重。按公式(1)计算持水力:
持水力![]()
(1)
式中:m1,离心后样品的质量,g;m2,离心前样品的质量,g。
1.4.8 挥发性成分的测定
使用顶空固相微萃取-气相色谱-质谱联用技术分析挥发性化合物。根据张佳等[15]方法对GC-MS条件稍作改进。使用C-WR-95/PDMS/10萃取头在50 ℃下平衡5 min,然后在350 r/min转速下萃取40 min,最后在250 ℃进样口解吸附5 min完成进样。
色谱条件:DB-WAX毛细管柱,柱长30 m,内径0.25 mm,液膜厚度0.5 μm;He流量1.0 mL/min;升温程序:起始温度50 ℃,保持3 min;以6 ℃/min升温至100 ℃;再以10 ℃/min升温至250 ℃,保持7 min;不分流进样。质谱条件:离子源EI源,离子源温度200 ℃,接口温度250 ℃,电子能量70 eV,扫描范围m/z 33~350 amu。
样品预处理:准确称取3 g样品于进样瓶中,加入2 g NaCl,并向其中加入10 μL质量浓度为10 mg/L的2-辛醇作为内标,摇匀后放入自动进样器中等待进样。
1.4.9 感官评定
在感官分析实验室根据GB/T 16291.1—2012《感官分析 选拔、培训与管理评价员一般导则 第1部分:优选评价员》中的方法进行感官人员筛选和训练,选出8名合格的人员组成感官评价小组。将各样品分别装于一次性品尝杯中,每个杯中约15 mL,由品评员对发酵样品的色泽(30分)、组织状态(20分)、风味(30分)、口感(30分)进行综合打分。各项指标评价标准如表2所示。
表2 感官评价指标
Table 2 Sensory evaluation index

项目评分标准感官评分/分颜色异常0~5色泽(20分)色泽不均匀、颜色较深5~10色泽不均匀、呈浅黄色10~15色泽均匀一致、呈米白色15~20有杂质、凝乳裂纹、有气泡、上清液析出严重0~5凝乳组织粗糙、有裂纹、有气泡、上清液析出5~10组织状态(20分)凝乳均匀较细腻、表面光滑、无气泡、少量上清液析出10~15凝乳均匀细腻、表面光滑、无气泡、无上清液析出15~20风味异常0~5风味(30分)仅有乳酸味5~10微弱的燕麦味、奶味10~20微弱的燕麦味、浓郁的奶味20~30口感异常0~5口感(30分)口感粗糙、有颗粒5~10口感较细腻、酸度适中10~20口感细腻润滑、酸度适中20~30
1.5 数据分析
所有实验均进行3次生物学重复,采用GraphPad Prism ver8.02进行显著性分析和图表绘制。
2 结果与分析
2.1 不同乳酸菌在MRS培养基中的发酵性能评价
如图1所示,在所有测试菌株中,植物乳杆菌在MRS培养基中生长20 h后OD600均可达到7.0以上,生长状况较好,其中AR2和F的生长性能最佳,其OD600值可高达11.04和10.48。随着菌体的生长,有机酸积累,pH值下降。植物乳杆菌的pH值均在3.6以下,总酸含量均在1.7 g/100 mL以上,产酸性能较好,而乳酸乳球菌005、嗜酸乳杆菌ACD和谷糠乳杆菌JN-5、JN-3总酸含量较低。

a-生物量;b-pH;c-总酸;d-还原糖
图1 不同乳酸菌在MRS培养基中的性能评价
Fig.1 The performance of different lactic acid bacteria strains cultured in MRS broth
2.2 不同乳酸菌的淀粉酶活性评价
燕麦中含有大量的淀粉,具有淀粉酶活性的乳酸菌可将淀粉转化为低聚糖和乳酸,可加速发酵进程,也可改善产品质构,形成良好的风味,因此本研究进一步评估了乳酸菌的淀粉酶活性(图2)。在测试菌株中,仅谷糠乳杆菌、植物乳杆菌、副干酪乳杆菌和嗜酸乳杆菌具有淀粉酶活性,谷糠乳杆菌JN-3和JN-5的淀粉酶活性均低于1 U/mL,而植物乳杆菌和副干酪乳杆菌酶活性普遍较其他菌株高,其中以植物乳杆菌AR2、F、R、M表现出最高的酶活性,酶活性均在7.69 U/mL以上,这与徐一涵[9]的研究结果一致。
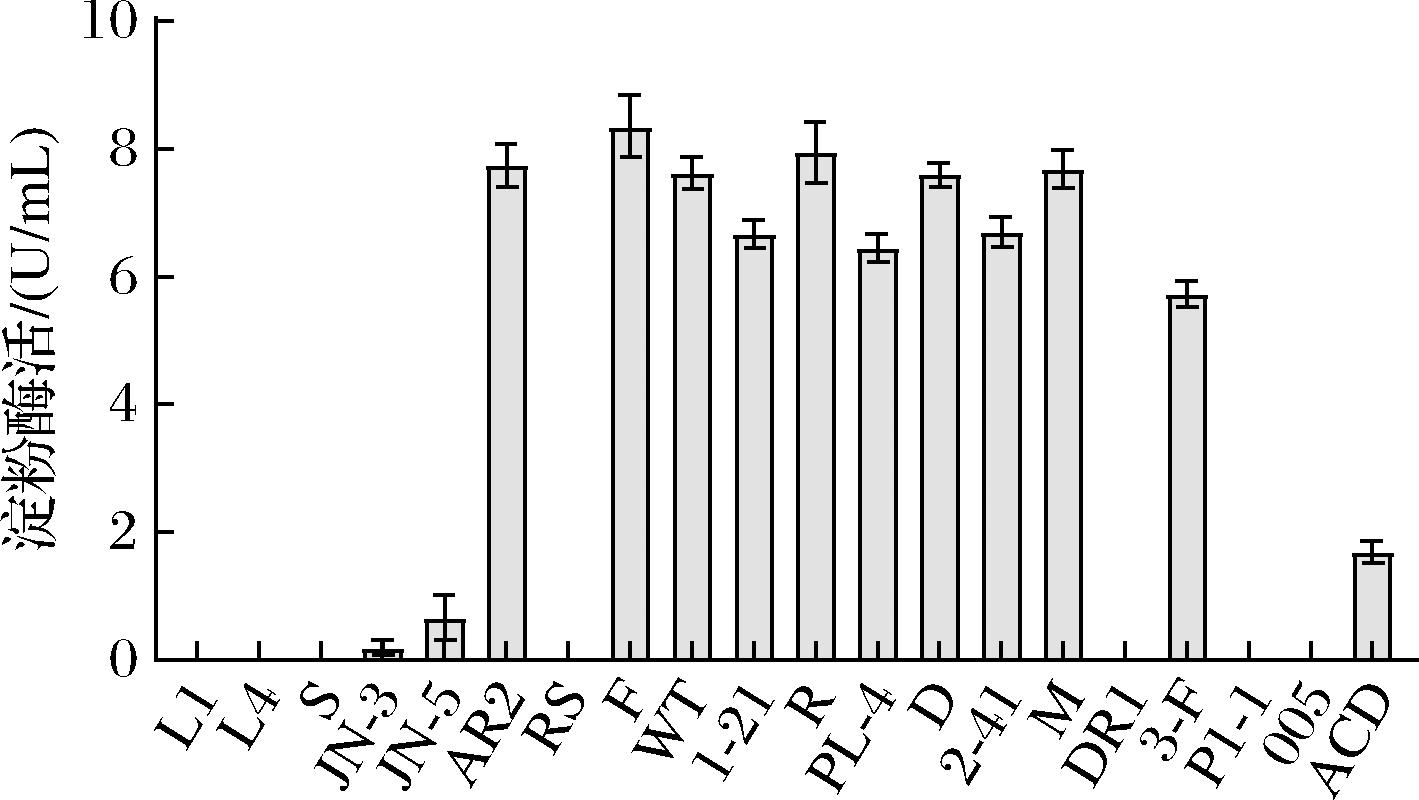
图2 不同乳酸菌的淀粉酶活性
Fig.2 The amylase activity of different lactic acid bacteria strains
保加利亚乳杆菌和嗜热链球菌是目前酸奶发酵剂中的最常见混合菌种,二者间的协同共生的良性关系可以大大提升酸奶品质[16]。因此本实验选择性能优良的植物乳杆菌F和AR2作为发酵菌株,同时将保加利亚乳杆菌L4和嗜热链球菌L1作为一种固定的菌种搭配在燕麦基质中进行发酵。
2.3 乳酸菌在燕麦中的发酵性能评价
2.3.1 发酵燕麦浆中的生物量
如图3-a所示,燕麦浆发酵9 h后乳酸菌的活菌数均增加至109 CFU/mL以上,植物乳杆菌F单菌发酵组中的活菌数最高为7.3×1010 CFU/mL。植物乳杆菌单菌发酵组活菌数均显著高于其他组,且植物乳杆菌的加入提高了保加利亚乳杆菌和嗜热链球菌混菌发酵组L1-L4生物量。表明植物乳杆菌与牛乳发酵菌株的菌种组合在燕麦基质中具有更强的适应性,这可能与植物乳杆菌具有更强的糖苷水解酶活性特性相关,这与GARCIA等[17]和周小莉[18]的研究结果一致。
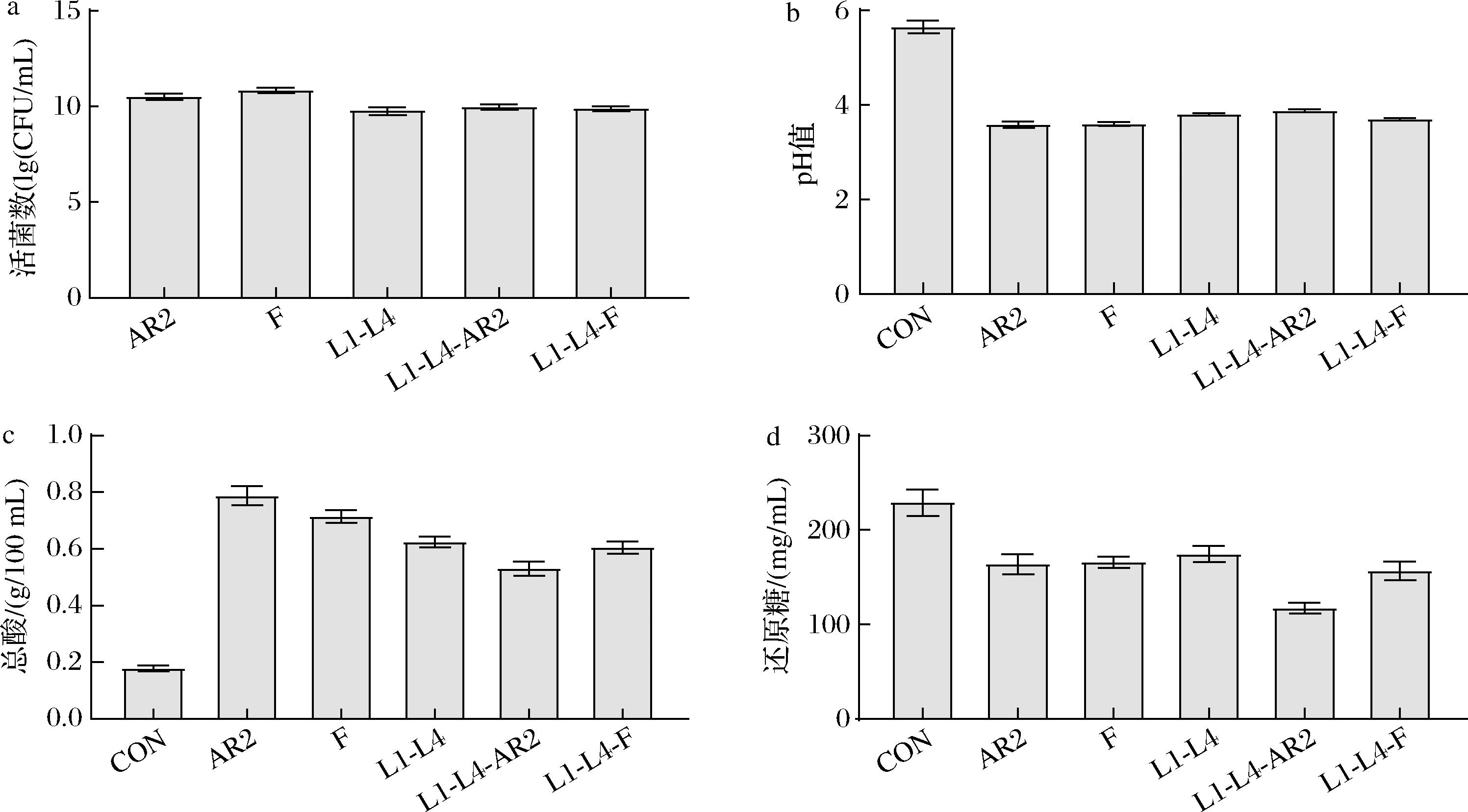
a-活菌数;b-pH;c-总酸;d-还原糖
图3 乳酸菌在燕麦浆中的发酵性能评价
Fig.3 The fermentation performance of lactic acid bacteria strains in oat
2.3.2 乳酸菌发酵对燕麦浆pH、总酸和还原糖的影响
总酸、pH和还原糖是表征菌株生长和发酵程度的重要指标。由图3-d可知,所有发酵组的还原糖含量均显著下降,加入植物乳杆菌的L1-L4-AR2和L1-L4-F发酵组还原糖降低最为显著,分别降低了48.83%和31.58%,这说明植物乳杆菌的加入促进了燕麦基质中碳源的利用。由图3-b可知,发酵过程中产生有机酸导致pH值下降,不同乳酸菌发酵燕麦的总酸均显著提高,其中植物乳杆菌AR2单菌发酵组总酸最高,为0.79 g/100 mL,而加入植物乳杆菌的L1-L4-AR2和L1-L4-F发酵组总酸含量未有显著提高。L1-L4-AR2和L1-L4-F发酵组有效降低了燕麦中还原糖且不产生过量的酸,在一定程度降低燕麦摄入后的升糖水平,同时保证了发酵燕麦浆的风味品质,是“低糖燕麦”产品开发的可行工艺。
2.4 乳酸菌发酵对燕麦浆的植物化学成分和抗氧化活性的影响
燕麦富含酚酸和黄酮类物质,研究表明其具有抗炎、抗氧化和降血糖等作用[19-20]。如图4-a所示,发酵后燕麦总酚和总黄酮含量显著增加,分别增加了30.5%~60.9%和21.7%~78.6%,其中以植物乳杆菌F单菌发酵组总酚含量最高,为0.57 mg/mL;L1-L4-AR2混菌发酵组总黄酮含量最高,为0.27 mg/mL。此外,植物乳杆菌AR2和F的加入显著促进了L1-L4发酵燕麦中总酚和总黄酮含量的提高,这可能由于植物乳杆菌具有强大的多酚水解酶系统,促进了纤维中的酚酸及黄酮的释放[21]。
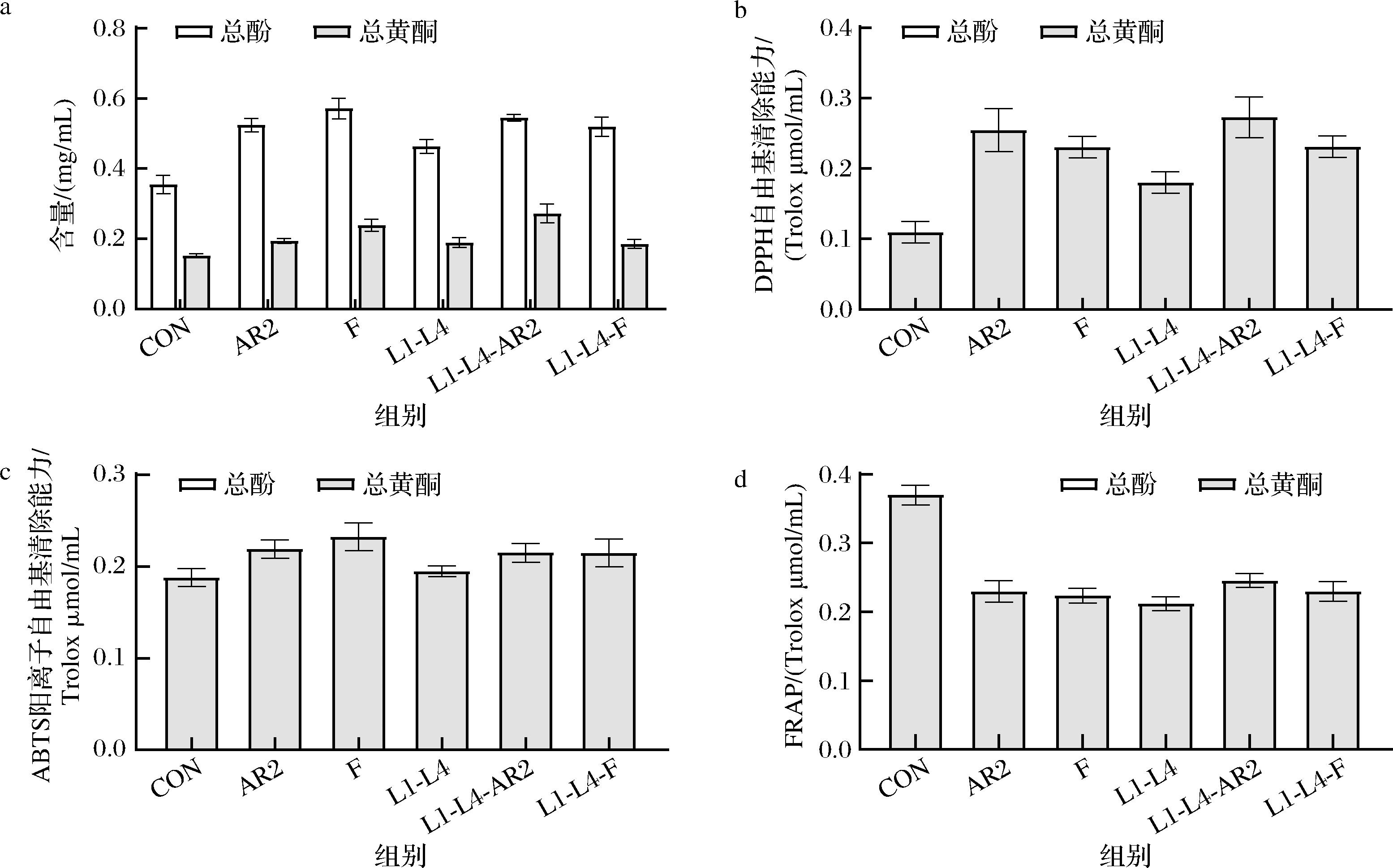
a-总酚和总黄酮含量;b-DPPH自由基清除能力;c-ABTS阳离子自由基清除能力;d-FRAP
图4 乳酸菌发酵对燕麦浆植物化学成分和抗氧化活性的影响
Fig.4 Effect of varied lactic acid bacteria strains on phytochemicals composition and antioxidant activity of oat
如图4-b、图4-c所示,乳酸菌发酵显著提高了燕麦浆的DPPH自由基和ABTS阳离子自由基清除能力,其中L1-L4-AR2混菌发酵组表现出最强的DPPH自由基清除能力,为0.29 Trolox μmol/mL,植物乳杆菌F单菌发酵组则表现出最强的ABTS阳离子自由基清除能力,为0.22 Trolox μmol/mL;且总酚和总黄酮含量与DPPH自由基、ABTS阳离子自由基清除能力呈显著正相关。燕麦浆的FRAP则在发酵后显著降低,在发酵组中,L1-L4-AR2表现出最强的FRAP,为0.29 Trolox μmol/mL。此外,植物乳杆菌的加入均显著提高L1-L4混菌发酵组燕麦浆的抗氧化性。乳酸菌发酵对抗氧化能力的改善与覃超等[12]的结果一致,对DPPH自由基、ABTS阳离子自由基产生的不同影响可归因于反应机制的差异[22]。因此本研究中总多酚和总黄酮含量的增加,利于燕麦抗氧化能力的增强。
2.5 乳酸菌发酵对燕麦浆持水力的影响
持水力对发酵燕麦浆的组织状态、口感及其稳定性有一定影响,是表征其质构特性的指标之一[23]。如图5所示,燕麦浆发酵后的持水力均有增加,其中植物乳杆菌AR2单菌发酵组的持水力最高,达62.2%,但植物乳杆菌的加入未显著提高L1-L4混菌发酵组的持水力。在本研究中,乳酸菌发酵可提高燕麦浆的持水力,且持水性与发酵积累的总酸呈正相关关系。

图5 乳酸菌发酵对燕麦浆持水力的影响
Fig.5 Effect of lactic acid bacteria fermentation on water holding capacity of oat
2.6 乳酸菌发酵对燕麦浆挥发性成分的影响
乳酸菌发酵燕麦浆过程中糖类、氨基酸、脂肪酸、醛、酮等物质经代谢转化可产生大量挥发性物质,从而赋予燕麦浆新的风味[24]。如图所示,在燕麦原浆和发酵燕麦浆中共检出71种挥发性化合物,醇类19种,酸类14种,酯类14种,酮类9种,醛类11种,呋喃类1种,酚类2种,硫化物1种。主成分分析(principalcomponentsanalysis,PCA)结果表明,燕麦原浆和发酵燕麦浆的挥发性物质组成差异显著,且不同发酵组间也存在明显差异。
如图6-c所示,燕麦原浆中的挥发性物质主要为酮类和酯类,除植物乳杆菌F单菌发酵组外,燕麦浆经乳酸菌发酵后挥发性物质总量均显著增加,醇类、酸类和醛类含量增加,酮类含量降低,酯类则在各发酵组间呈现不同的变化趋势,植物乳杆菌AR2单菌发酵组、L1-L4和L1-L4-F混菌发酵组中酯类物质显著增加,AR2发酵的样品增加最为显著,其中具有朗姆酒、水果和奶油的香气的乳酸乙酯增加最多。
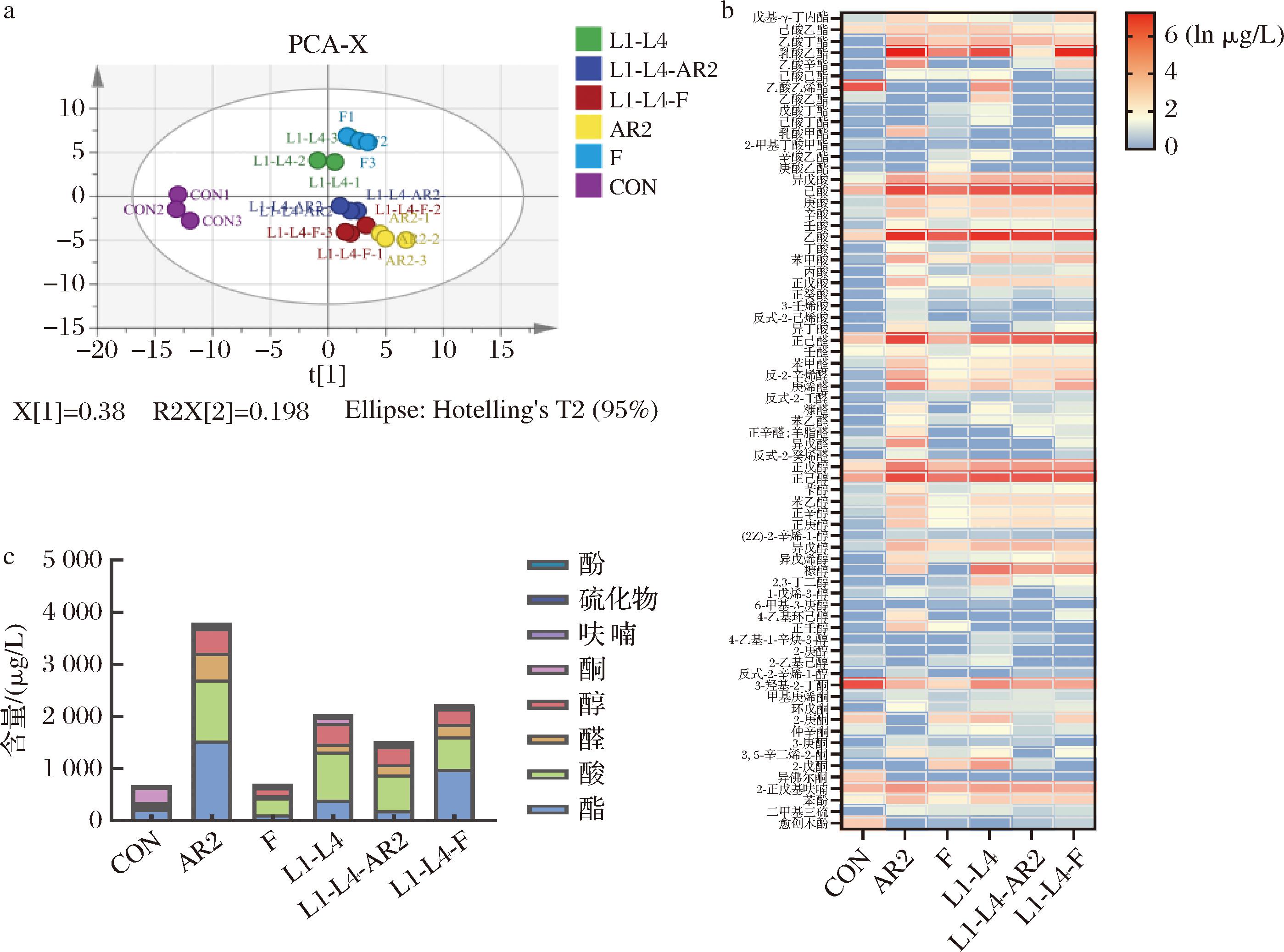
a-基于挥发性成分的PCA;b-挥发性物质相对含量;c-挥发性物质总量
图6 不同乳酸菌发酵对燕麦浆挥发性成分的影响
Fig.6 Effect of lactic acid bacteria strains on volatile components of oat after fermentation
在乳酸菌进行糖、氨基酸、甲基酮等的物质代谢时,可由相应的醛通过脱氢酶还原形成某些醇[25]。L1-L4-AR2和L1-L4-F发酵组中正己醇和正戊醇含量增加最多,为3.71~5.29 μg/L,其中正己醇具有淡嫩叶香气,正戊醇具有青草香和水果香气。正庚醇具有油脂气息,正辛醇具有花香和柑橘香,均在AR2单菌发酵组中含量最高,分别为2.68 μg/L和2.63 μg/L。异戊醇具有苹果白兰地香气,L1-L4-F发酵组中增加最为显著,为2.67 μg/L。苄醇略带香气,苯乙醇具有清甜的玫瑰香,这些醇类赋予乳酸菌发酵燕麦浆鲜香醇厚的特征香气。
乳酸菌发酵使酸类物质总量增加,主要为乙酸和己酸,但其阈值较高,分别为22 000 μg/L和2 517 μg/L,对发酵燕麦浆整体香气贡献不大[26-27]。乳酸菌发酵增加了燕麦浆中的醛类,其中正己醛和壬醛具有脂肪气息,苯甲醛具有杏仁味,反-2-辛烯醛具有坚果香气,这些醛类对燕麦特有风味有香气贡献。在酮类物质中,呈奶油和脂肪香气的3-羟基-2-丁酮和带有樟脑气息的异佛尔酮在发酵后显著降低,带有水果香气的甲基庚烯酮和带有薄荷香气的环戊酮则在发酵后增加。
值得注意的是,嗜热链球菌L1和保加利亚乳杆菌L4参与的发酵燕麦中,呈奶油香气的3-羟基-2-丁酮的含量均显著高于单菌发酵组,加入植物乳杆菌的L1与L4混菌发酵组中,苯乙醛、2,3-丁二醇显著增加。
2.7 发酵燕麦浆的感官评价
本研究从色泽、组织状态、风味和口感4个方面评价样品的感官特性。如表3所示,燕麦浆经发酵后色泽均有所改善,其中L1-L4和L1-L4-F混菌发酵组色泽状态最佳;发酵改善了燕麦浆的组织状态,其中混菌发酵组均质地均匀,流动性较好,得分较高;发酵丰富了燕麦浆的香气和滋味,混菌发酵组均较单菌发酵组获得更高的风味评分,其中L1-L4-AR2组酸甜适中,燕麦香气显著,风味最佳;发酵燕麦浆口感较未发酵更加细腻,加入AR2和F的混菌发酵组表现出最佳的口感。在所有样品中,L1-L4-F混菌发酵组具有更高香气质量,滋味协调,口感醇厚细腻,表现出最佳的感官特性。
表3 发酵燕麦浆的感官评价
Table 3 The sensory evaluation of oat fermented by lactic acid bacteria strains
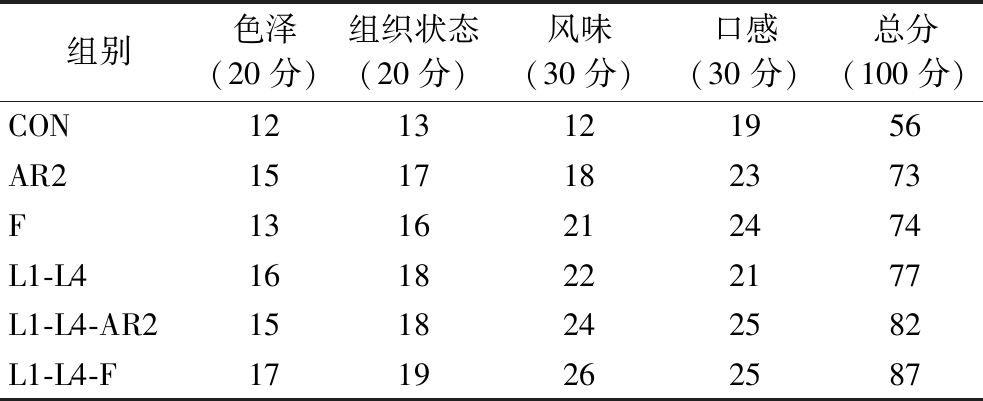
组别色泽(20分)组织状态(20分)风味(30分)口感(30分)总分(100分)CON1213121956AR21517182373F1316212474L1-L41618222177L1-L4-AR21518242582L1-L4-F1719262587
3 结论
植物乳杆菌较其他菌株普遍表现出较高的生长量、产酸性能及淀粉酶活性。乳酸菌发酵提高了燕麦浆的营养特性,促进了燕麦基质中多酚和黄酮的释放,同时改善了燕麦浆的风味品质。添加植物乳杆菌的嗜热链球菌和保加利亚乳杆菌组合发酵模式更有利于提高燕麦浆的品质,是较优的发酵燕麦浆的菌种组合,具有更大的研究和开发价值。同时,研究发现不同菌种混合发酵模式也为相关原料的生物加工提供可借鉴的思路。
[1] 田西, 代以琴, 杨梅, 等.燕麦化学成分及其生物活性研究进展[J].食品工业科技, 2020, 41(11):353-362;368.TIAN X, DAI Y Q, YANG M, et al.Research progress on chemical constituents and biological activities of oats[J].Science and Technology of Food Industry, 2020, 41(11):353-362;368.
[2] 任顺成, 马瑞萍.燕麦的功效因子及其保健功能[J].粮食科技与经济, 2013, 38(3):58-60.REN S C, MA R P.Efficacy factor and health care function of oat[J].Grain Science and Technology and Economy, 2013, 38(3):58-60.
[3] LEONARD W, ZHANG P Z, YING D Y, et al.Fermentation transforms the phenolic profiles and bioactivities of plant-based foods[J].Biotechnology Advances, 2021, 49:107763.
[4] WANG Y Q, WU J T, LV M X, et al.Metabolism characteristics of lactic acid bacteria and the expanding applications in food industry[J].Frontiers in Bioengineering and Biotechnology, 2021, 9:612285.
[5] 赵谋明, 董红竹, 林恋竹.功能性水果饮料发酵工艺及抗氧化活性研究[J].食品科学技术学报, 2017, 35(4):24-32.ZHAO M M, DONG H Z, LIN L Z.Preparation of fruit fermented beverage with strong antioxidant activities[J].Journal of Food Science and Technology, 2017, 35(4):24-32.
[6] FILANNINO P, DI CAGNO R, GOBBETTI M.Metabolic and functional paths of lactic acid bacteria in plant foods:Get out of the labyrinth[J].Current Opinion in Biotechnology, 2018, 49:64-72.
[7] MARKKINEN N, LAAKSONEN O, NAHKU R, et al.Impact of lactic acid fermentation on acids, sugars, and phenolic compounds in black chokeberry and sea buckthorn juices[J].Food Chemistry, 2019, 286:204-215.
[8] 尹雪林, 龚丽娟, 钟武, 等.戴尔有孢圆酵母与酿酒酵母混合发酵对猕猴桃酒香气的影响[J].食品科学, 2021, 42(22):216-223.YIN X L, GONG L J, ZHONG W, et al.Effect of mixed fermentation with Saccharomyces cerevisiae and Torulaspora delbrueckii on the aroma of kiwifruit wine[J].Food Science, 2021, 42(22):216-223.
[9] 徐一涵. 产淀粉酶乳酸菌在马铃薯粉发酵中的应用[D].上海:上海交通大学,2019.XU Y H.Application amylase-producing of lactic acid bacteria producing amylase in potato powder fermentation[D].Shanghai:Shanghai Jiao Tong University, 2019.
[10] KWAW E, MA Y K, TCHABO W, et al.Effect of lactobacillus strains on phenolic profile, color attributes and antioxidant activities of lactic-acid-fermented mulberry juice[J].Food Chemistry, 2018, 250:148-154.
[11] WANG Z N, FENG Y Z, YANG N N, et al.Fermentation of kiwifruit juice from two cultivars by probiotic bacteria:Bioactive phenolics, antioxidant activities and flavor volatiles[J].Food Chemistry, 2022, 373(Pt B):131455.
[12] 覃超, 唐富豪, 滕建文, 等.产β-葡萄糖苷酶乳酸菌发酵对百香果皮多酚含量和功能活性的影响[J].食品与发酵工业, 2023, 49(8):230-236.QIN C, TANG F H, TENG J W, et al.Effect of β-glucosidase producing lactic acid bacteria fermentation on polyphenol content and functional activity of passion fruit peel[J].Food and Fermentation Industries, 2023, 49(8):230-236.
[13] 黄豪, 周义, 陈佳慧, 等.乳酸菌发酵对山楂汁理化性质、酚类化合物、抗氧化性及风味的影响[J].食品科学, 2022, 43(10):97-106.HUANG H, ZHOU Y, CHEN J H, et al.Effect of lactic acid bacteria fermentation on physicochemical properties, phenolic compounds, antioxidant activity and volatile components of hawthorn juice[J].Food Science, 2022, 43(10):97-106.
[14] 王鑫磊, 王萌, 闫春晓, 等.马乳酒样乳杆菌ZW3对酸奶风味及质构的影响[J].食品科学, 2022, 43(10):119-123.WANG X L, WANG M, YAN C X, et al.Effect of Lactobacillus kefiranofaciens ZW3 on the texture and flavor characteristics of yogurt[J].Food Science, 2022, 43(10):119-123.
[15] 张佳, 马永昆, 崔凤杰, 等.乳酸菌发酵酸豆乳香气成分分析及评价[J].食品科学, 2010, 31(20):298-302.ZHANG J, MA Y K, CUI F J, et al.Determination and evaluation of volatile components of soymilk yoghurts fermented by lactic acid bacteria[J].Food Science, 2010, 31(20):298-302.
[16] 崔欣, 孙亚琳, 王开云, 等.嗜热链球菌和德氏乳杆菌保加利亚亚种共生关系的研究进展[J].食品研究与开发, 2021, 42(6):184-189.CUI X, SUN Y L, WANG K Y, et al.Research progress on symbiotic relationship between Streptococcus thermophilus and Lactobacillus delbrueckii subsp.bulgaricus[J].Food Research and Development, 2021, 42(6):184-189.
[17] GARCIA E F, DE OLIVEIRA ARA JO A, LUCIANO W A, et al.The performance of five fruit-derived and freeze-dried potentially probiotic Lactobacillus strains in apple, orange, and grape juices[J].Journal of the Science of Food and Agriculture, 2018, 98(13):5000-5010.
JO A, LUCIANO W A, et al.The performance of five fruit-derived and freeze-dried potentially probiotic Lactobacillus strains in apple, orange, and grape juices[J].Journal of the Science of Food and Agriculture, 2018, 98(13):5000-5010.
[18] 周小莉. 乳酸菌在燕麦基质中生长特性研究[D].无锡:江南大学,2012.ZHOU X L.Study on the growth properties of lactic acid bacteria in oat substrate[D].Wuxi:Jiangnan University, 2012.
[19] AIELLO P, CONSALVI S, POCE G, et al.Dietary flavonoids:Nano delivery and nanoparticles for cancer therapy[J].Seminars in Cancer Biology, 2021, 69:150-165.
[20] HUANG Z K, ZHAO M M, CUI C, et al.A new sight on soy isoflavones during the whole soy sauce fermentation process by UPLC-MS/MS[J].LWT, 2021, 152:112249.
[21] DI CAGNO R, CODA R, DE ANGELIS M, et al.Exploitation of vegetables and fruits through lactic acid fermentation[J].Food Microbiology, 2013, 33(1):1-10.
[22] CIAFARDINI G, MARSILIO V, LANZA B, et al.Hydrolysis of oleuropein by Lactobacillus plantarum strains associated with olive fermentation[J].Applied and Environmental Microbiology, 1994, 60(11):4142-4147.
[23] 刘梦云. 酪蛋白对凝固型酸奶凝胶构效关系的影响研究[D].杭州:浙江科技学院,2017.LIU M Y.Effect of casein on structure-activity relationship of coagulated yogurt[D].Hangzhou:Zhejiang University of Science and Technology, 2017.
[24] 刘凤杰. 燕麦淀粉物化特性及燕麦粉中风味成分的研究[D].南昌:南昌大学, 2016.LIU F J.Physicochemical properties of oat starch and the flavor ingredients in oatmeal[D].Nanchang:Nanchang University, 2016.
[25] 周春丽, 刘伟, 李慧, 等.混合菌株发酵南瓜汁及其香气分析[J].现代食品科技, 2014, 30(5):301-310.ZHOU C L, LIU W, LI H, et al.Mixed culture fermentation of pumpkin juice and its aroma analysis[J].Modern Food Science and Technology, 2014, 30(5):301-310.
[26] 解寒, 刘瑞山, 张晓娟, 等.乳杆菌有机酸耐受性及发酵果蔬汁性能分析[J].食品科学, 2022, 43(6):149-157.XIE H, LIU R S, ZHANG X J, et al.Tolerance of Lactobacillus to organic acids and their fermentation performances in fruit and vegetable juices[J].Food Science, 2022, 43(6):149-157.
[27] CAVALCANTE W, LEIT O R, GEHRING T, et al.Anaerobic fermentation for n-caproic acid production:A review[J].Process Biochemistry, 2017, 54(12):106-119.
O R, GEHRING T, et al.Anaerobic fermentation for n-caproic acid production:A review[J].Process Biochemistry, 2017, 54(12):106-119.