大菱鲆(Turbot),俗称欧洲比目鱼,在中国被称为“多宝鱼”,是硬骨鱼纲鲽形目鲆科菱鲆属海洋底栖鱼类,是一种优质食用鱼[1]。因肉质鲜美、口感鲜嫩、骨刺少、内脏小、高蛋白、低脂肪等特点,深受消费者喜爱。同时,大菱鲆体内含有高含量的神经胶质蛋白,对人类的肾脏和脑组织健康都十分有益[2] 。随着全国水产养殖的迅猛发展,养殖大菱鲆产量也在逐渐增加,2021年产量达到12.2万t,同比2019年增长4.9%[3] 。但由于大菱鲆其特殊的营养成分,易受微生物和内外源酶的影响,发生腐败变质,导致部分营养成分流失,且色、香、味发生不良变化,贮藏时的货架期缩短。
低温贮藏是工业和家庭中最常见的贮藏方式之一,但传统的冷藏(0~4 ℃)温度相对较高,产品货架期较短,而冷冻(-18 ℃)产品冻结严重,易破坏肌肉细胞结构,造成汁液流失,品质降低。冰温保鲜是指将产品放置在0 ℃~冻结点温度区保持不冻结的状态,既避免冻结引起的品质劣变,又可以保持较好的新鲜度[4],微冻是指将食品内部的水分部分冻结,通常是将食品冷却至低于冰点±0.5 ℃,导致食品中5%~30%水分形成冰晶[5],既能有效延长食品货架期,又能降低冰晶对食品的损伤。目前将微冻保鲜应用于多种鱼类保鲜,如大菱鲆[6]、鳙鱼[7]、带鱼[8]、大西洋鳕鱼[9]、团头鲂[10]、大西洋鲭鱼[11]等,可见微冻技术在未来有一定的发展前景,但目前大多是将鲜鱼持续贮藏在特定的温度下,针对目前市场销售鲜鱼的方式(冰藏),考虑经市场冰藏后转入微冻贮藏的形式,来探讨微冻混合冰藏保鲜效果。
本研究通过对比市场冰藏方式,比较大菱鲆在微冻和先冰藏后微冻条件下的pH值、挥发性盐基氮(total volatile basic nitrogen, TVB-N)值、色差、菌落总数、核磁共振成像(magnetic resonance imaging, MRI)、K值、可溶性肽含量、微观结构,并结合感官评价与质构的变化,探讨大菱鲆从市场到家庭的可食用货架期,为未来微冻保鲜的应用市场提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
鲜活大菱鲆,购自上海市浦东新区芦潮港海鲜市场。鱼体表面明亮,黏液少且透明,眼球饱满,有水充氧保活运回实验室。
PCA琼脂培养基,广州天骏生物科技有限公司;氯化钠,上海麦克林生化科技有限公司;三氯乙酸(分析纯)、氢氧化钠(优级纯)、柠檬酸钠、柠檬酸(均为色谱纯)、轻质氧化酶,国药集团化学试剂有限公司;ATP相关代谢物标准品、17种氨基酸混标(色谱纯),中国计量科学研究院化学计量与分析科学研究所。
1.2 仪器与设备
A.XT Plus质构仪,英国SMS公司;pH计,奥豪斯仪器有限公司;XUEKE制冰机,深圳市森德制冰系统有限公司;CR-400型色彩色差仪,柯尼卡美能达(中国)投资有限公司;MesoMR23-060H.I低场核磁共振成像分析仪,上海纽迈电子科技有限公司;BD/BC-257冷藏箱,日本Hitachi公司;Kjeltec8400全自动凯氏定氮仪,丹麦FOSS公司;高效液相色谱仪,美国沃特世(Waters)公司;H-1850离心机,湖南湘怡实验室仪器开发有限公司;SU5000热场发射扫描电镜,日本日立有限公司;BS-210型电子天平,德国Sartorius Instruments有限公司。
1.3 实验方法
1.3.1 原料预处理
鲜活大菱鲆,体质量(0.6±0.2) kg/条,采用即杀(重击头部致晕)方式,去除头部、内脏、鱼尾等,洗净后沿鱼脊背切成两半,剔除鱼骨,去皮、去裙带,将已解剖的鱼片整形,切成长、宽、厚为4 cm×4 cm×2 cm的鱼块,擦干鱼表面水分,分为三部分装入食品保鲜袋中,每袋大约280 g。将分装的鱼片分为3组,分别为微冻(superchilling storage, SS)组:-2 ℃,采用4%的冰盐混合铺满泡沫箱,放入鱼片进行微冻贮藏;冰藏(ice storage , IS)组:0 ℃,采用铺满碎冰实现;先冰藏后微冻(ice storage+ superchilling storage, IS+SS)组:先冰藏后微冻保鲜是将生鱼片先放置0 ℃下保藏4 d,当K值达一级与二级鲜度临界点时采用微冻贮藏(-2 ℃)。从每组中随机取3个鱼片测定pH值、色差、TVB-N、质构、MRI、可溶性肽、K值、菌落总数、微观结构、感官评价等指标。
1.3.2 冰点的测定
参考郑稳等[12]的方法,将多点温度仪的热偶探头插入到鱼背肌肉中,迅速放于-18 ℃冰箱,每隔2 min记录1次温度,时间为2 h,根据记录的温度时间冻结曲线分析可得大菱鲆的冰点。
1.3.3 pH值的测定
参考ZHOU等[13]的方法,精确称取切碎的大菱鲆肌肉5 g,加入45 mL蒸馏水均质,静置30 min后过滤,通过pH计测定滤液的pH。
1.3.4 色差的测定
采用色差计测定亮度值L*、红绿值a*、黄蓝值b*,根据这3个参数可以反映鱼肉在不同温度贮藏过程中色泽的变化。
1.3.5 质构的测定
取2 cm×2 cm×2 cm鱼块,每组随机取5块,选用P50探头,测量模式为TPA,重复测量4次,求平均值。测定指标包括硬度、弹性、咀嚼性、内聚性。测定参数:测前速度3 mm/s,测试速度1 mm/s,测试后速度4 mm/s,触发力5 g,形变量50%,来回3次。
1.3.6 TVB-N值测定
使用NEIRA等[14]的方法加以修改。称取精确量10 g的碎大菱鲆肌肉置于蒸馏管中并与1 g左右的MgO混合。然后用凯氏定氮仪进行测定。
1.3.7 菌落总数测定
依据GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》,测定大菱鲆肌肉的菌落总数。菌落总数采用平板计数,菌落计数以菌落形成单位(colony-forming units, CFU)表示,大菱鲆鱼肉菌落总数测定结果以lgCFU/g表示。
1.3.8 K值的测定
参考ZHANG等[15]的方法,用预冷高氯酸提取样品中的ATP及其分解产物,调节pH值至6.5,并去除杂质,将提取的物质经C18柱分离,用紫外-可见光检测器检测。利用保留时间和标准品进行对照鉴别。K值定义为肌苷和次黄嘌呤与ATP相关降解产物总和的百分比。
1.3.9 核磁共振成像测定
参考蓝蔚青等[16]的方法加以修改,通过MRI测定大菱鲆肌肉的质子密度图谱,将样品(1.5 cm×1.5 cm×1 cm)放入核磁管中,在MRI中分析,最终的质子密度图像由8次扫描重复累加所得,再将所得的质子密度图像进行映射、伪彩处理。
1.3.10 可溶性肽含量的测定
称取3 g鱼肉,加入27 mL 5%的冷三氯乙酸,均质30 s,重复3次,在冰水浴中保持1 h,而后离心10 min(4 ℃,10 000×g),根据XU等[17]的方法测定上清液中可溶性肽的含量,并表示为μmol酪氨酸/g肌肉。
1.3.11 感官评价
由6名经过训练的评价员组成的感官评价小组,根据表1,以色泽、气味、弹性和组织状态为评分对象。采用10分制评估,非常理想为10分,可取为8分,可接受为6分,无法接受为4分(作为不能接受的界限),完全无法接受为2分[18]。
表1 大菱鲆鱼片感官鉴定标准
Table 1 Sensory evaluation criteria for turbot

感官指标感官评分/分108642外观色泽具有产品应有的色泽,横切面有色泽色泽较明亮,横切面稍有色泽色泽稍明亮,横切面略带色泽色泽较暗淡,横切面几乎无色泽色泽暗淡,横切面无色泽气味固有气味浓郁,清新固有气味较浓,较清新固有气味淡,略带异味无固有气味,有腥臭味强烈腥臭味组织紧密度肌肉组织致密,纹理很清晰肌肉组织较致密,纹理较清晰肌肉组织不致密,局部松软,不松散肌肉组织松软,局部松散肌肉组织松软,松散组织弹性肌肉组织坚实弹性好,手指按压立即恢复肌肉组织有弹性好,手指按压恢复快肌肉组织有弹性,手指按压恢复慢肌肉组织稍有弹性,手指按压恢复慢肌肉组织无弹性,手指按压凹陷不恢复
1.3.12 微观结构
参考JIANG等[19]的方法取大菱鲆背部肌肉切成1 cm×1 cm×0.5 cm左右的小块,用2.5%戊二醛溶液固定24 h,用体积分数50%、70%、80%、95%和无水乙醇梯度各脱水15 min,然后将样品冻干、镀金。喷金后用扫描电镜观察鱼肉微观结构。
1.4 数据处理
实验数据均采用3个平行组的平均值,结果以平均值±标准偏差表示,采用Excel 2016整理数据并绘图,差异显著性通过SPSS 25进行t检验和分析。
2 结果与分析
2.1 大菱鲆冻结点曲线
由图1可知,大菱鲆肌肉在前40 min内由初始温度的13.5 ℃下降到0.5 ℃,当中心温度达到-1~-1.4 ℃时呈现平稳时期,这是由于肌肉经过预冷达到了冻结点,肌肉表面有部分水会形成1~3 mm的冰层,此时,会放出部分结晶潜热,使得释放的热量与外界的温度抵消,导致此过程温度下降缓慢。此过程持续50 min左右后,温度继续又呈现下降趋势。冰点是指产品中的水分与冰平衡时的温度,即是图中较为平稳阶段的温度(-1.2 ℃),微冻贮藏通常定义为低于食品冰点±0.5 ℃[20]。因此实验将-2 ℃作为大菱鲆微冻贮藏温度。
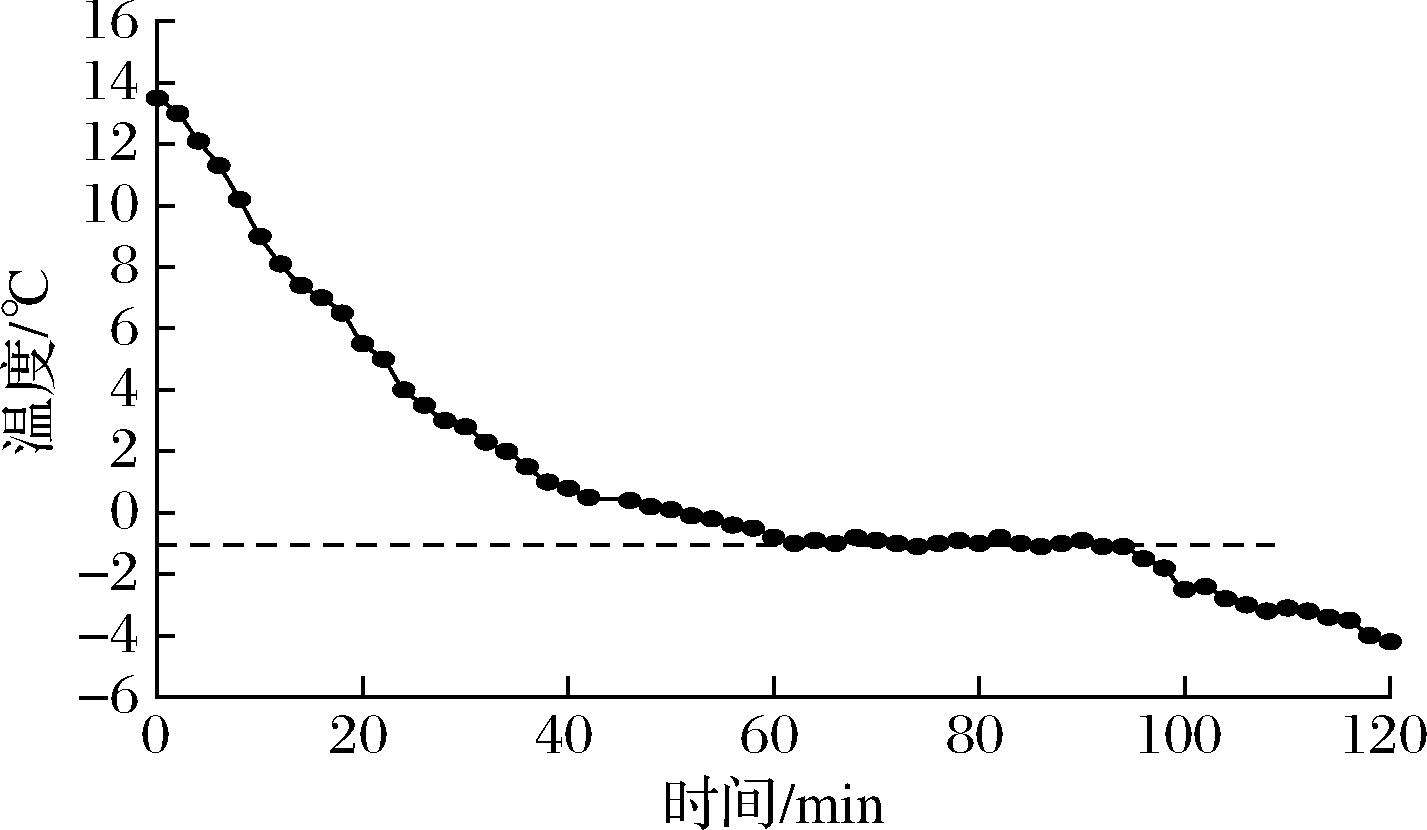
图1 大菱鲆肌肉冻结曲线
Fig.1 The freezing temperature curve of turbot
2.2 pH值的变化
图2是大菱鲆在3种不同温度下pH值的变化情况。由图可知,大菱鲆初始pH值为6.68,随着贮藏时间的延长,3组的pH值总体呈现先下降后上升的趋势,均在第4天左右达到最低值。pH先下降是由于肌肉死后处于僵直状态,体内糖原代谢仍然进行,积累了大量无机磷酸和乳酸,致使pH下降,而后肌肉处于解僵、自溶状态,在微生物和酶作用下分解鱼肉蛋白质产生氨、胺和其他碱性物质,使pH升高[21]。贮藏后期IS组的pH较SS组和IS+SS组上升更快,到第21天时,3组分别比初始值上升了9.5%、20%、16.2%。而微冻组在第16天时,出现明显下降趋势,可能是因为微冻过程中冰晶形成不均匀,致使破坏了部分细胞结构,引起水分损失,造成细胞内溶质浓度增加或蛋白质变性引起的氢离子释放。但总体SS组能够更好地保持大菱鲆的鲜度,这可能因为微冻的温度较低,影响了鱼体内生命活动相关酶活性,从而减弱了对蛋白质的分解作用,使得产生更少的氨类等碱性物质[22]。此外,低温还可以延长鱼肉的尸僵持续时间,使得体内ATP分解速率下降,使得鱼处于解僵的状态较长,保持了较高的鲜度水平。
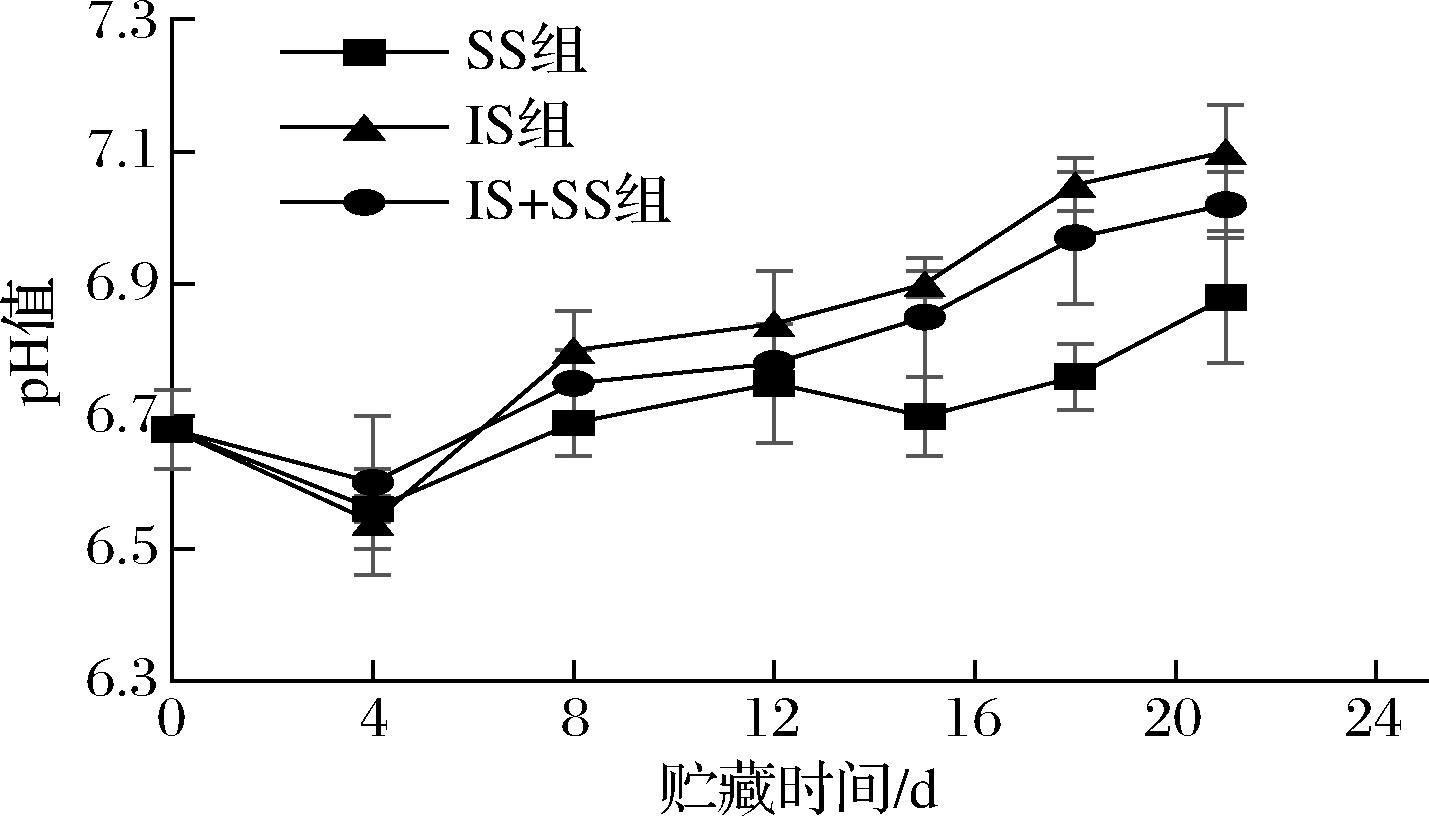
图2 大菱鲆肌肉贮藏过程中pH的变化
Fig.2 Changes in pH value of turbot meat during storage
2.3 色差的变化
色泽是评估鱼肉品质的重要指标之一,可以利用色泽直观判断鱼肉的新鲜度。L*值的变化规律为新鲜的大菱鲆鱼片呈现白色,随着贮藏时间的延长会逐渐变为黄褐色,达到不可接受的状态。有研究证实在贮藏过程中鱼肉的血红蛋白和肌红蛋白会与空气中的氧气反应,导致蛋白和血红素颜色减少,使得亮度值降低[23]。如图3所示,随着贮藏时间的延长,3组大菱鲆的L*均呈降低趋势,这与相悦等[24]用琼胶寡糖及EGCG处理冰藏花鲈鱼片后的L*变化趋势一致。其中,IS组L*下降最快,在第21天时,达到54.66,下降速率为41.2%,SS组和IS+SS组L*整体呈下降且伴随上下波动的趋势,2组从初始到末期分别下降了20.7%和28.2%,贮藏末期的L*在SS组中最高。这可能因为SS组能将肌肉内部分自由水形成少量冰晶,能固定水分不易流动,增加了肌肉的复水能力,使得在贮藏期间L*值始终高于其他组,随着时间的延长,鱼肉会出现不同程度的失色现象,但SS组略微能提高鱼肉的色泽。
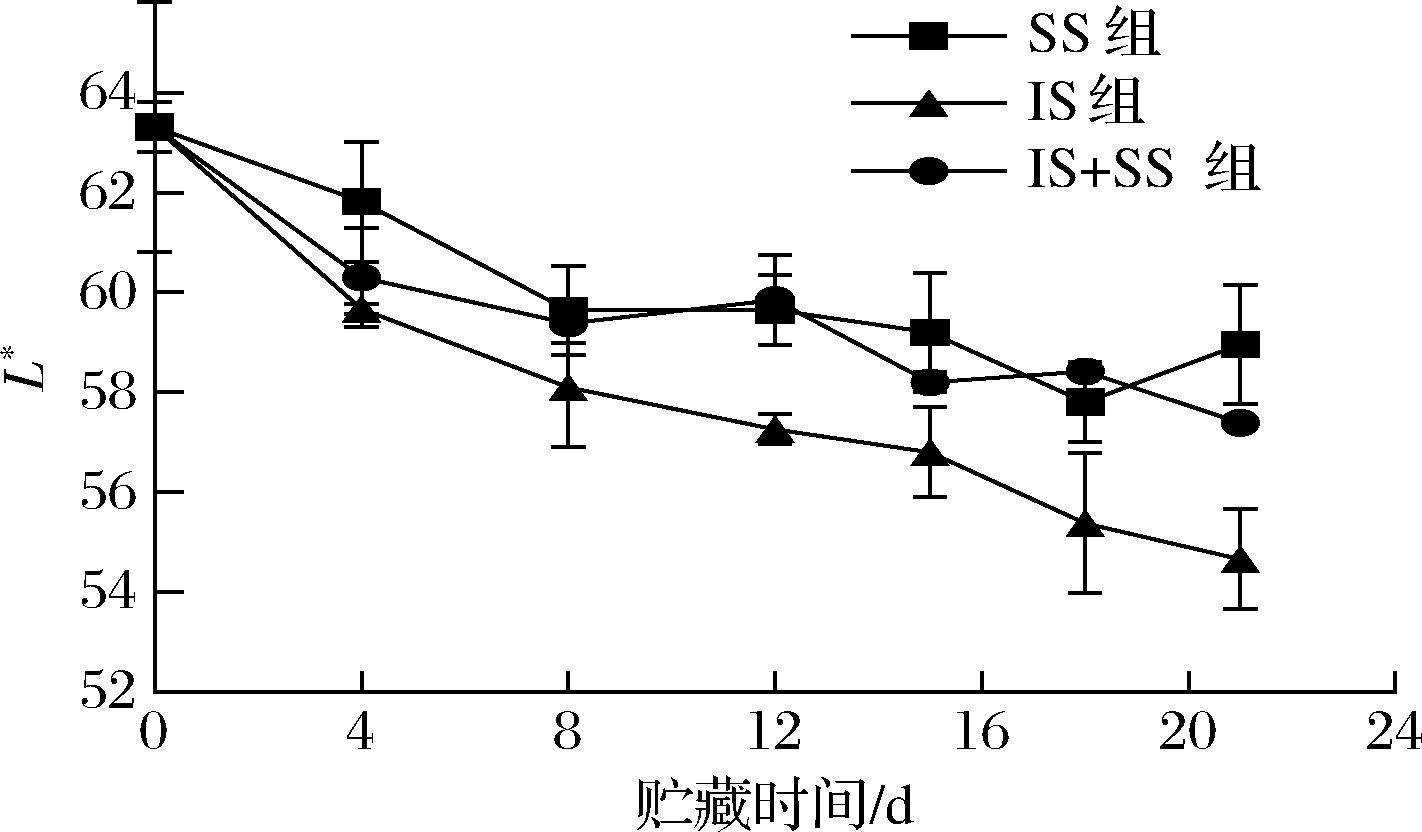
图3 大菱鲆肌肉贮藏过程中L*值的变化
Fig.3 Changes of L* value in turbot meat during storage
a*代表红绿值,该值越高,说明肉的颜色越红。有研究表明a*值与高铁肌红蛋白含量显著相关,还与脂质氧化、pH、温度、离子强度等因素有关,当含有Fe2+的氧合肌红蛋白和脱氧肌红蛋白与空气接触自动氧化成含有Fe3+的褐色高铁肌红蛋白。如图4所示,3组a*随时间延长逐渐降低。这与相悦等[25]对冰藏花鲈的研究一致。IS组a*由初始值2.68下降到第21天的0.29,下降了11.4%,而IS+SS组和SS组a*由初始到末期分别下降了10.2%和9.8%,均显著高于IS组。可能是IS组表面脂肪氧化较SS组快,产生的自由基破坏了高铁肌红蛋白还原酶活力,无法将高铁肌红蛋白还原,造成高铁肌红蛋白的累积,进而使鱼肉色泽变成了黄褐色,进而IS组的a*下降更明显。但3组变化速率差异不大,可能因为大菱鲆属于低脂鱼,粗脂肪仅为1.6%[26],使得各组脂肪氧化程度不高。
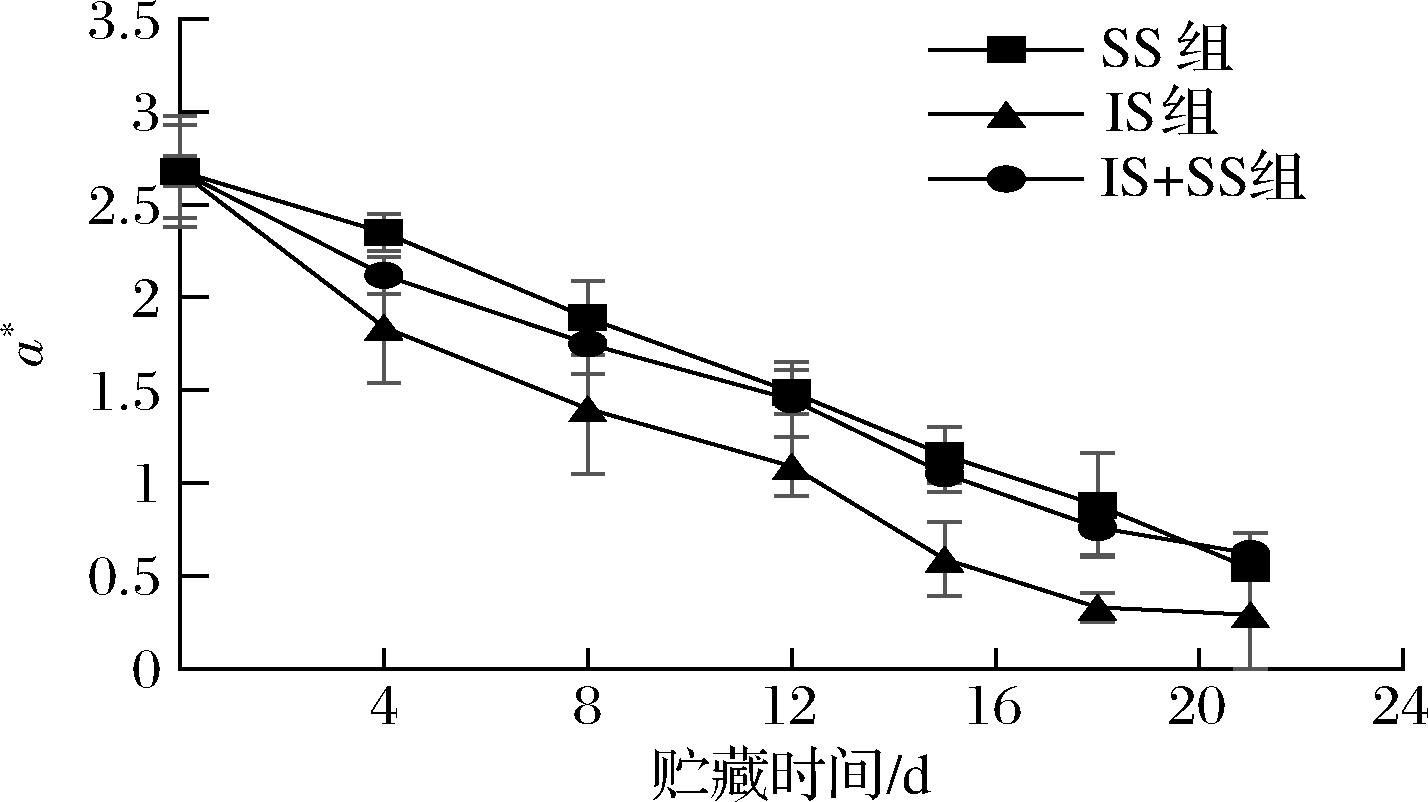
图4 大菱鲆肌肉贮藏过程中a*值的变化
Fig.4 Changes of a* value in turbot meat during storage
b*值表示鱼肉的黄度值,b*越高,与脂肪氧化发生非酶褐变,产生大量黄色素有密切关系。也有研究认为b*值变化可反映鱼肉的抗氧化性,b*越高,其抗氧化能力越差[27]。由图5可知,温度降低可使得b*值降低,但随着贮藏时间的延长,b*值均呈现逐渐上升的趋势,且3组之间有明显差异。在贮藏前4 d时,3组的差异变化不明显,可能是因为受外界环境影响较小,且受到的温度波动小,鱼肉脂肪氧化速率较慢,肉色变化不明显,在贮藏后期,IS组的b*值上升快速,由初始值为-3.99到第21天时升高了17.2%。而SS组和IS+SS组b*由初始值到贮藏21 d分别上升了13.0%、15.7%。因为在IS组贮藏中,蛋白酶活性还未完全被抑制,且脂肪氧化相比微冻快,产生的自由基易攻击诱导色素蛋白与肌原纤维蛋白发生交联,蛋白变性氧化,使得鱼片黄度值增加[28];而SS组条件下,肌肉内部水分部分冻结形成胞外冰晶,且处在冰盐混合环境中,隔绝了空气,减缓微生物繁殖的速度,脂肪氧化较慢,蛋白质交联变性程度低,使得b*较低,因此,SS组可以一定程度上延缓肉色变化,保持更持久的新鲜度。
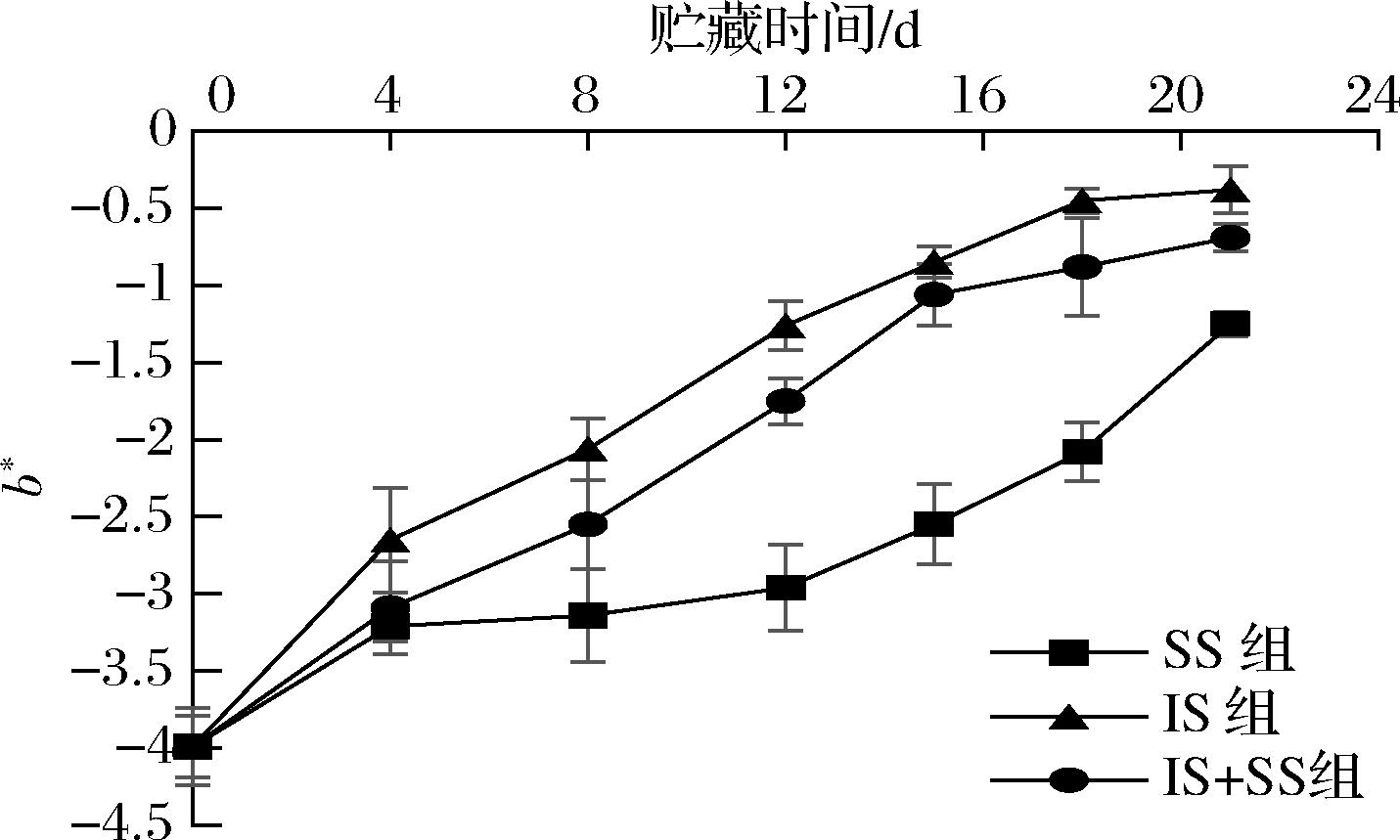
图5 大菱鲆肌肉贮藏过程中b*值的变化
Fig.5 Changes of b* value in turbot meat during storage
2.4 质构的变化
鱼肉的质构是评价鱼肉新鲜度的重要指标,质地的软化与肌原纤维蛋白降解密切相关,有关微冻草鱼的质地研究中解释肌原纤维蛋白尤其是结蛋白和肌联蛋白降解,导致Z盘和M线的破坏以及横纹肌结构的解体,致使鱼肉质地软化[29]。大菱鲆肌肉在SS组、IS组和IS+SS组贮藏期间的硬度值、弹性值、内聚性及咀嚼性的变化如图6所示。SS组大菱鲆肌肉的硬度呈现先升高后降低的趋势,IS组和IS+SS组呈一直下降趋势,且整体上SS组比其他2组的硬度值高。这可能因为大菱鲆死后,体内氧气和营养供应不足,细胞在缺氧和ATP不足的状态下乙酰化,且肌球蛋白和肌动蛋白形成肌动球蛋白,造成尸体僵硬,硬度上升[30]。而当肌肉进入非僵硬状态时,体内磷酸化反应及组织蛋白酶会分解肌动球蛋白,致使肌肉硬度下降。且温度越低,体内酶活性越低,蛋白质交联程度越低,生理生化反应缓慢,使得硬度下降越慢。
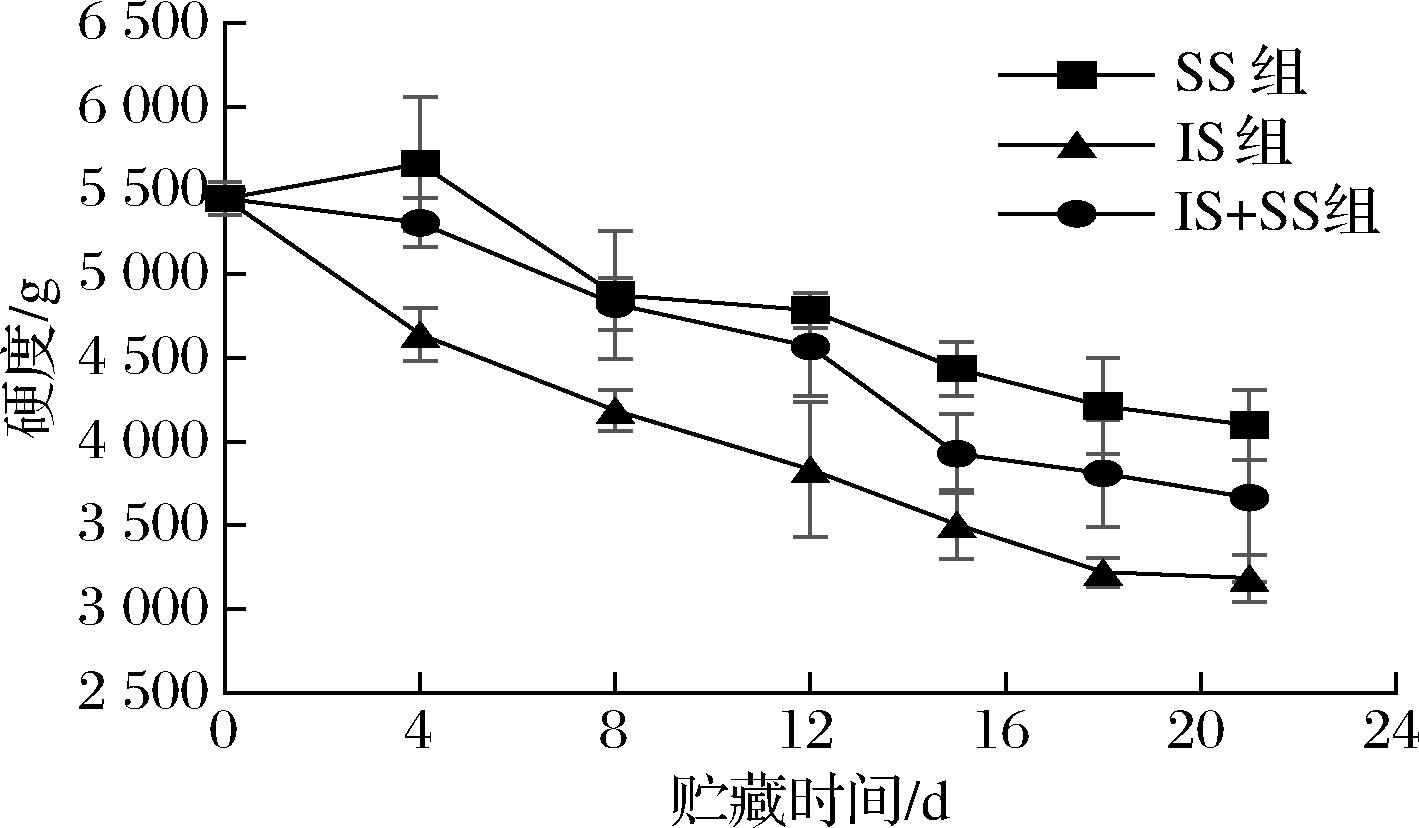
图6 大菱鲆肌肉贮藏过程中硬度的变化
Fig.6 Changes of hardness in turbot meat during storage
如图7所示,大菱鲆肌肉的弹性随贮藏时间的延长而逐渐下降,且下降速度为IS组>IS+SS组>SS组,其中IS组弹性由初始0.914下降至第21天0.51,下降了19.2%,IS+SS组和SS组在第21天时的弹性仅达到0.623和0.702,分别降低了13.8%和10.0%。说明SS组相比于其他2组能使大菱鲆保持更高的弹性。这是由于低温使得鱼内组织蛋白酶等活性降低,分解体内的肌球蛋白和肌动蛋白更慢,分解释放的热量更少,使得肌肉纤维收缩变软的速率更低[31],所以微冻组具有较高弹性的肉质。
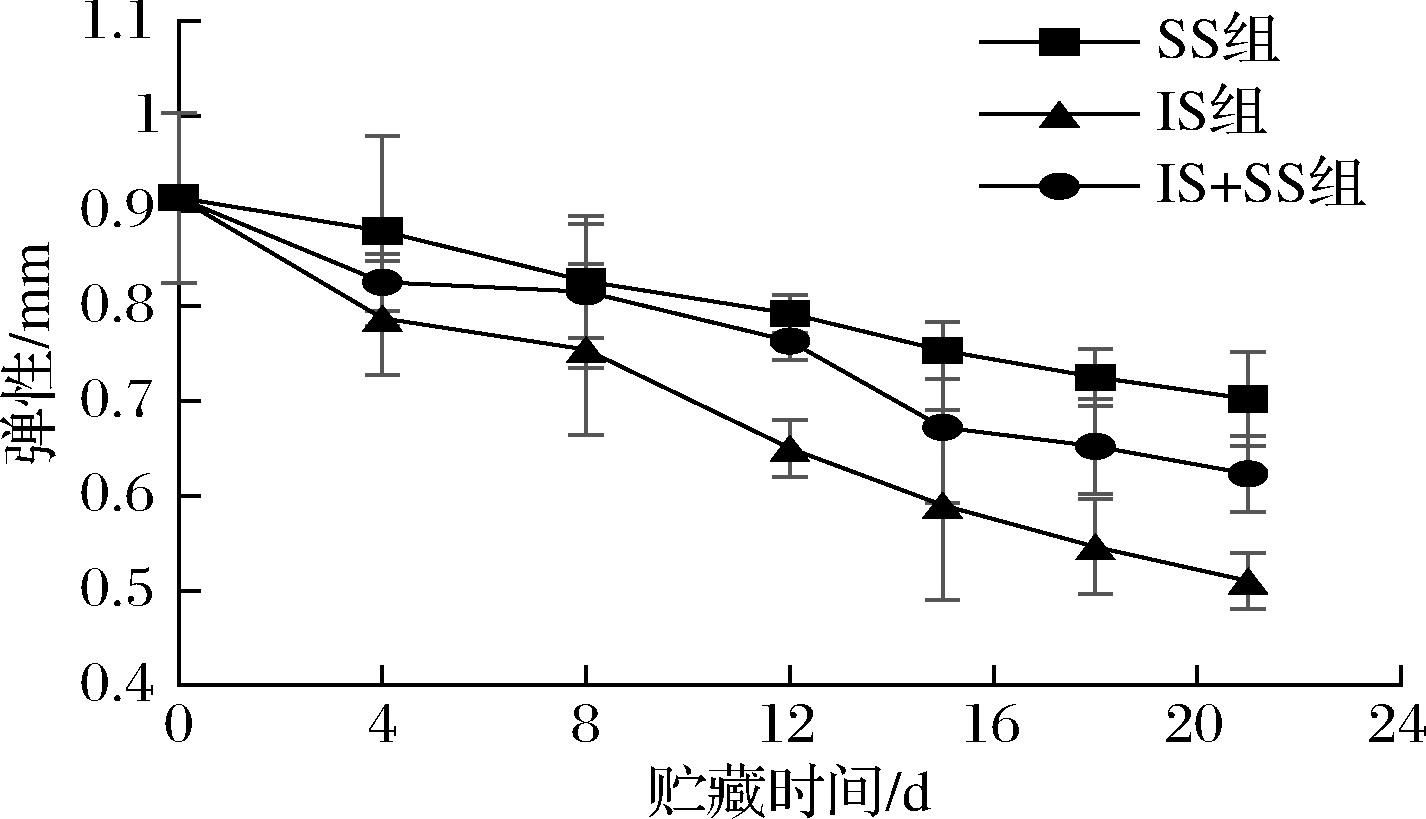
图7 大菱鲆肌肉贮藏过程中弹性的变化
Fig.7 Changes of springiness in turbot during storage
内聚性是当咀嚼鱼肉时,鱼肉所表现的抵抗受损并将其紧密连接使其保持完整的性质,同时也表示细胞之间结合力的大小[32],结合力越大,鱼肉的内聚性值越大,口感更紧实细腻,这与鱼肉的弹性值变化相一致。如图8所示,鱼肉在贮藏前,内聚性为0.756,但随着贮藏时间延长,3组温度的内聚性均下降,且在IS组下降最快,在第21天已降至0.465,在SS组鱼肉内聚性下降最慢,第21天才降至0.611,IS+SS组下降趋势在其他2组之间,第21天为0.534。表明在贮藏期间鱼肉间的结合力大小为SS组>IS+SS组>IS组。这是因为随贮藏时间延长,鱼体内ATP酶活性下降,肌原纤维蛋白发生变性而降解,而温度越低,酶活性下降越慢,蛋白分解程度越低,导致的细胞间结合力越大,内聚性也越大。这与BAO等[10]对不同温度下团头鲂的质构变化相一致。
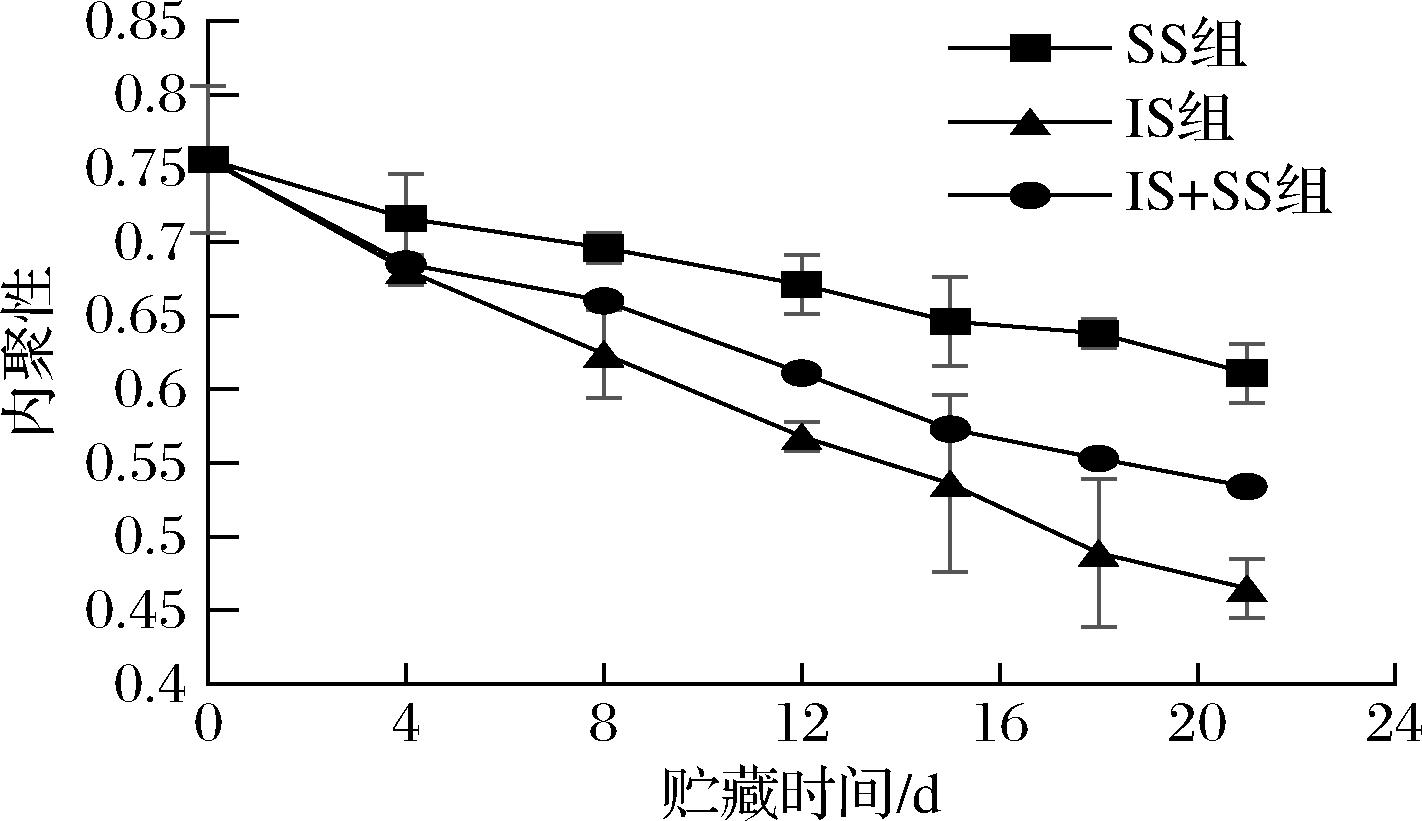
图8 大菱鲆肌肉贮藏过程中内聚性的变化
Fig.8 Changes of cohesiveness in turbot meat during storage
咀嚼性指把固态食品咀嚼为能够吞咽的状态下所需要的能量,如图9所示,随着贮藏时间的延长,3组贮藏条件下咀嚼性呈现明显的降低趋势,且下降速度为IS组>IS+SS组>SS组,这是由于低温抑制体内酶活性及微生物活动,且温度越低,抑制作用越强,这与硬度、弹性和内聚性变化趋势一致。王晓君等[33]也证实了这一变化趋势。实验说明了温度越低,鱼肉的质构变化趋势越小,品质越好,SS组更能有效延缓鱼肉质构的变化,保持较好的弹性、咀嚼性等组织状态,且延长了大菱鲆的货架期。
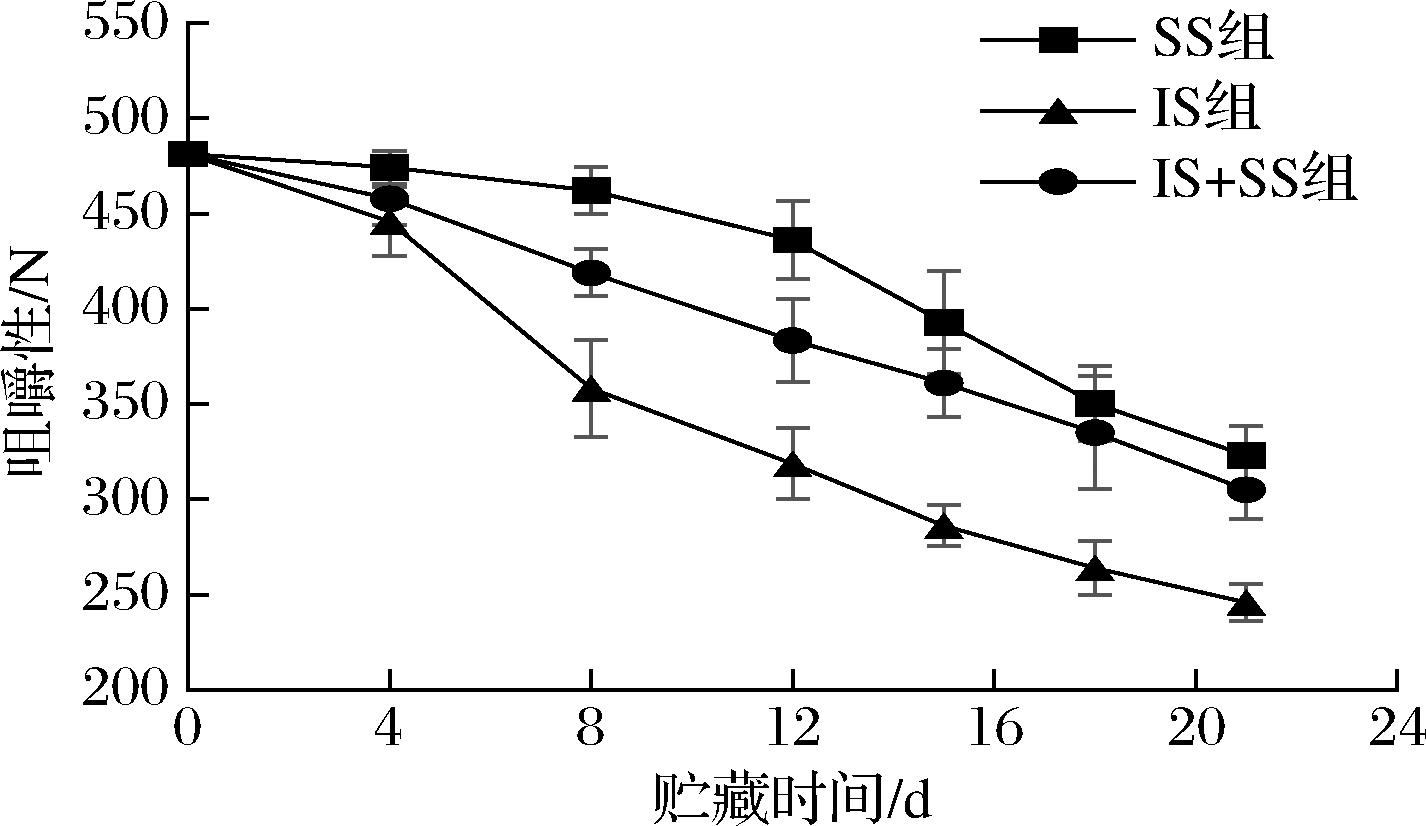
图9 大菱鲆肌肉贮藏过程中咀嚼性的变化
Fig.9 Changes of chewiness in turbot meat during storage
2.5 TVB-N值的变化
鱼类是一种易腐食品,在贮藏过程中,易受到微生物和内源酶作用使蛋白质分解产生胺类等碱性含氮物质,反映鱼肉新鲜度变化。TVB-N是蛋白质和胺降解的生物标志物,宰后TVB-N水平取决于微生物的腐败程度与酶活性水平,因此,它可作为鱼肉新鲜度和食品安全的指标[34]。一般鱼肉腐败越严重,TVB-N值越高。根据GB/T 18108—2019《鲜海水鱼通则》规定TVB-N值≤20 mg/100 g,鱼肉为二级鲜度,当TVB-N值>30 mg/100 g时,鱼肉不可食用。从图10可以看出,随着贮藏时间的延长,3种贮藏温度下TVB-N值均显著上升,且上升速率为IS组>IS+SS组>SS组,大菱鲆初始TVB-N值仅为5.77 mg/100 g,到贮藏后期,IS组、IS+SS组分别在第12、15天达到不可食用,而SS组在第21天仍在可食用限定范围内。这种差异一方面可能是微冻抑制了微生物的生长,减弱了腐败菌的活跃度,使得非蛋白化合物氧化脱氨基速度减慢;另一方面,温度越低,对酶活性的抑制程度越大,进而减缓了对鱼肉蛋白的降解作用[21]。
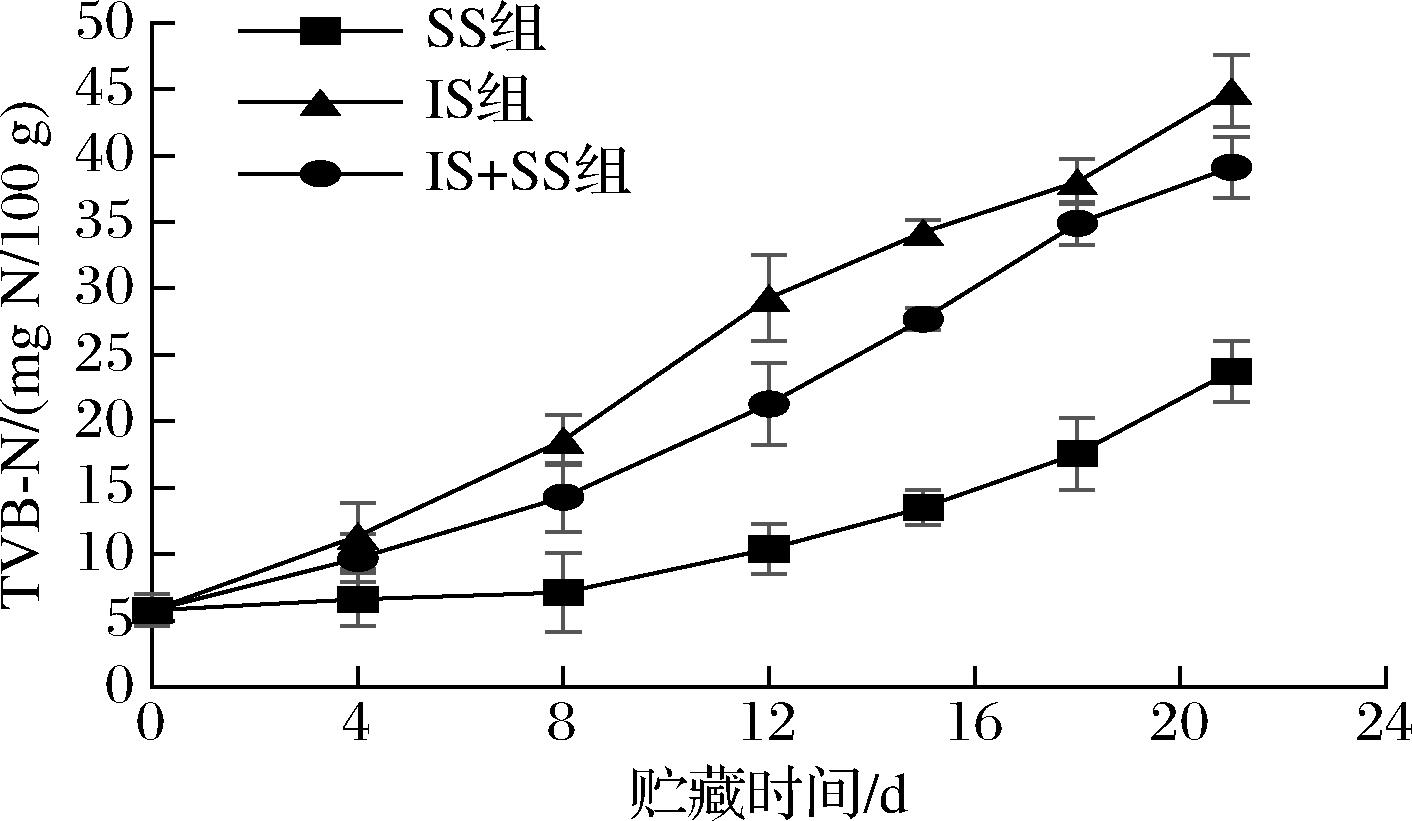
图10 大菱鲆肌肉贮藏过程中TVB-N值的变化
Fig.10 Changes of TVB-N values in turbot meat during storage
2.6 菌落总数的变化
大菱鲆贮藏过程中的菌落总数变化如图11所示,新鲜大菱鲆的菌落总数为2.63 lg CFU/g,随着贮藏时间延长,3种温度下的菌落总数呈逐渐上升的趋势,且IS组上升最快,在第12天已达到5.98 lg CFU/g,已接近所规定的的限量值6 lg CFU/g,IS+SS组贮藏期间呈稳定上升趋势,在第15天达到6.05 lg CFU/g,超过了规定限值,不可食用,而SS组贮藏下,菌落总数在前8 d内上升速率缓慢,且在第4天,有稍下降趋势,可能因为贮藏初期微冻形成的冰晶对微生物抑制较明显,微生物未能适应环境导致繁殖能力减弱。在贮藏后期,菌落总数值均上升,在第21天的菌落总数为6.1 lg CFU/g,达到不可食用的临界值。同样的结果在LU等[35]研究中也有所体现,证实了微冻贮藏的镜鲤比冷藏条件下效果更好。这是由于微冻能使微生物细胞中的自由水部分冻结,使得细胞液浓度增加,水分活度降低,抑制了微生物的繁殖[20]。
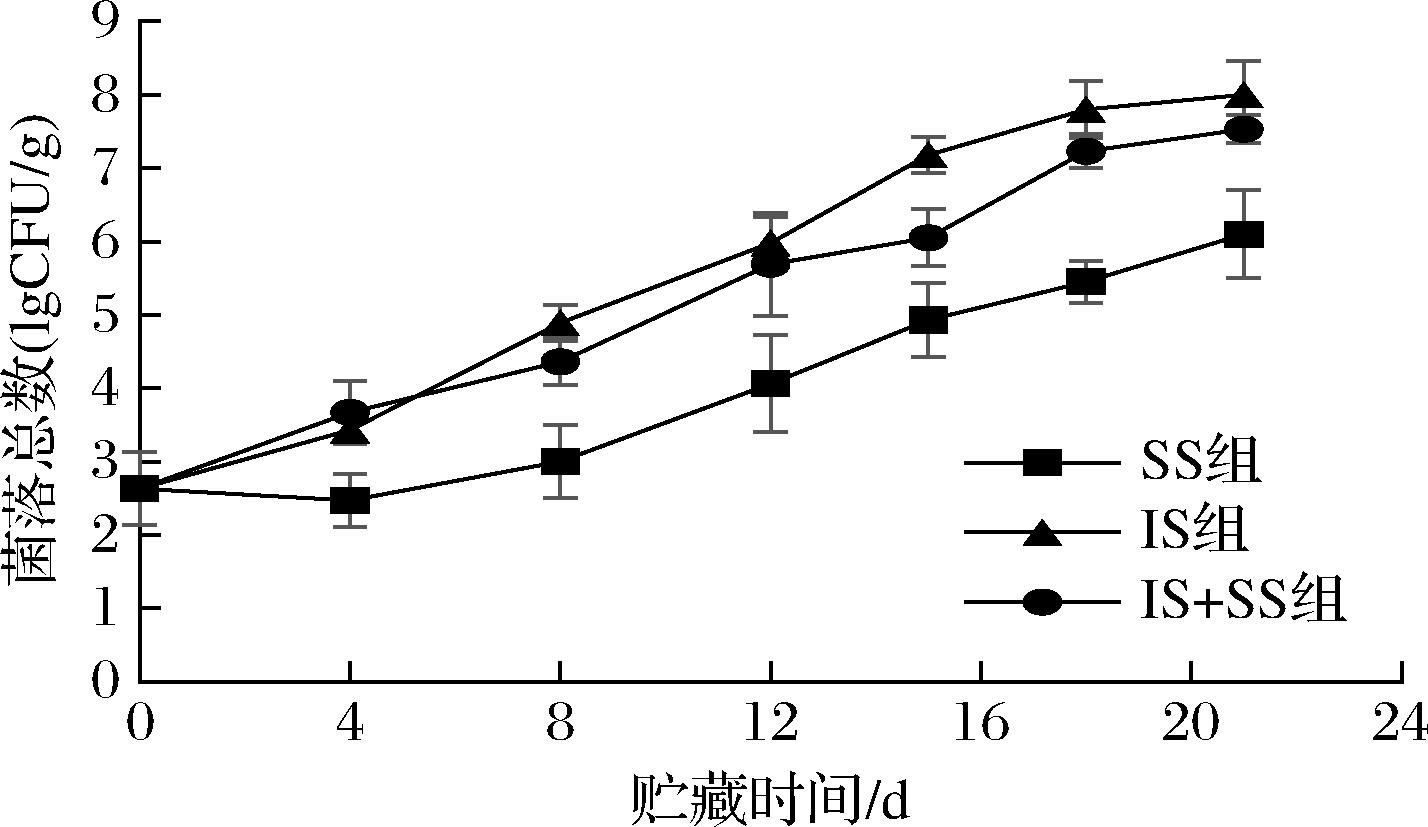
图11 大菱鲆肌肉贮藏过程中菌落总数的变化
Fig.11 Changes of total viable count in turbot meat during storage
2.7 K值的变化
K值是评价肉类腐败的标志物,一般认为当K值<20%为一级鲜度;20%<K值<40%为二级鲜度;K值>60%认为彻底腐败,不可食用[34]。大菱鲆在不同贮藏条件下的K值变化如图12所示,随着贮藏时间的延长,各贮藏条件下的K值均呈上升趋势,且IS组下增长速度最快,SS组在前8 d内K值上升较为平缓,始终保持在一级鲜度以内,之后快速上升。IS组下在第12天达到56.4%,接近腐败;IS+SS组在第15天K值达到57.2%,近乎腐败,相比于IS组延长了3 d;而SS组在第21天时,K值为45.21%,远未达到腐败程度。说明SS组能够有效抑制内源酶活性,降低ATP及其代谢物的分解速度,保持大菱鲆的新鲜度,比处理组延长了6~9 d。这与菌落总数、TVB-N值、感官评分等结果基本一致。

图12 大菱鲆肌肉贮藏过程中K值的变化
Fig.12 Changes of K value in turbot meat during storage
2.8 MRI分析
通过MRI可观察大菱鲆在贮藏过程中的内部组织形态和水分分布情况,如图13所示。红黄色代表高质子区域,水分含量较高,蓝色代表低质子区域,水分含量较低。从图13中可看出,随着贮藏时间的延长,3种条件下的大菱鲆鱼片MRI的质子图像有较明显的变化,第0天的鱼片呈现红橙色,分布均匀,水分含量较高。随着贮藏时间的延长,各组的质子密度逐渐出现不同程度的蓝黄色,同时,相比于IS组,SS组和IS+SS组在贮藏末期的质子密度显示出明显的黄蓝色。这可能是因为微冻形成的细胞外冰晶破坏了肌肉组织的完整结构,使得组织液中渗透到细胞外,并降低了肌肉的重吸收能力,导致固定水转为了自由水,造成了水分流失[36]。IS组未形成冰晶,内部水分流失不严重,但是由于微生物和酶作用使得蛋白氧化需要水分参与,伴随一些水分流失。
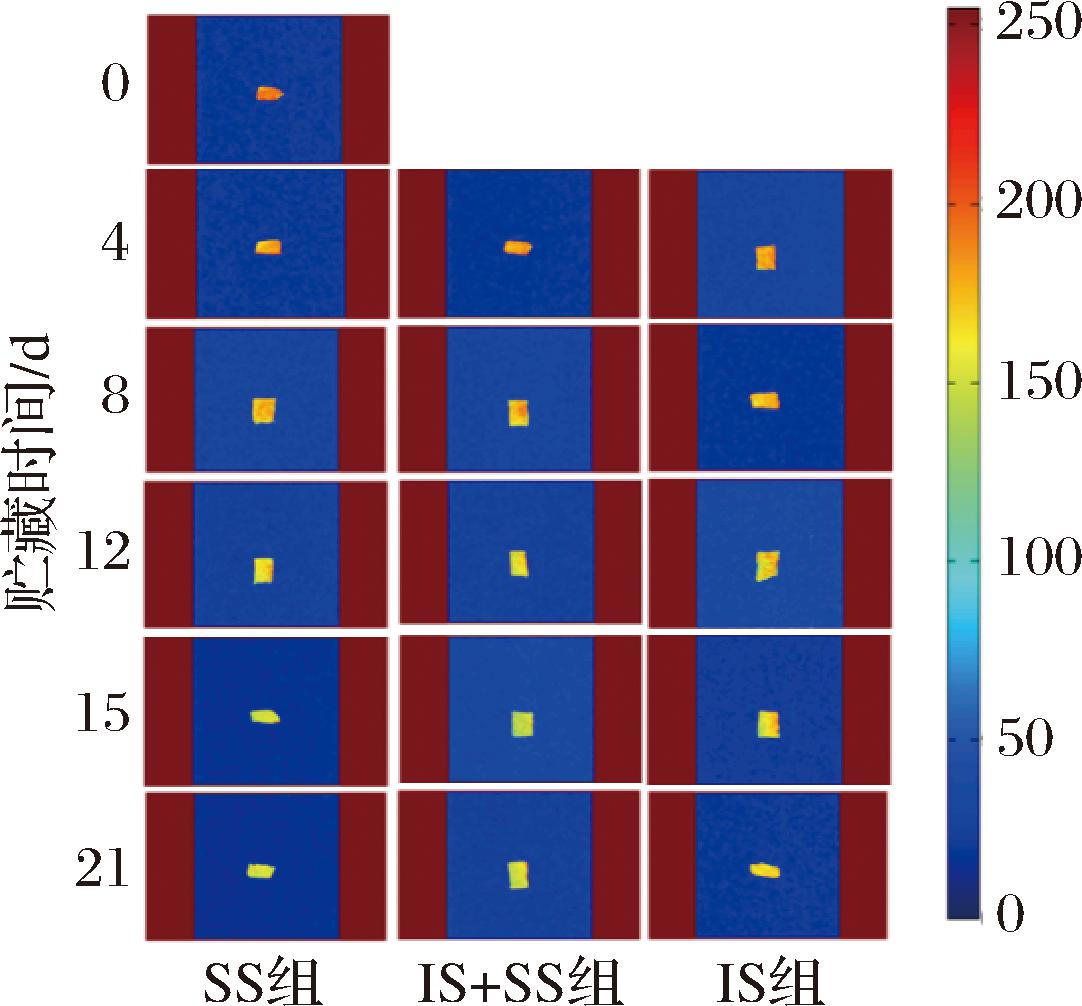
图13 大菱鲆肌肉贮藏过程中MRI的变化
Fig.13 Changes of MRI in turbot meat during storage
2.9 可溶性肽含量
可溶性肽是鱼肉中的蛋白被内源性酶和微生物代谢产生的酶分解产生的小分子肽,其含量变化影响最终鱼肉的质构与新鲜度[37]。可溶性肽含量随贮藏时间的变化如图14所示,结果表明,3种贮藏条件下,可溶性肽含量均随着贮藏时间的延长而增加,前4 d内增加缓慢,且IS组增加最快,由初始的0.5 μmol酪氨酸/g到第21天的2.56 μmol酪氨酸/g,IS+SS组和SS组的可溶性肽含量在第21天分别为1.93、1.44 μmol酪氨酸/g,较IS组分别减少了24.6%和43.7%。可溶性肽含量的增加可能由于内源酶及微生物代谢产生的蛋白酶分解蛋白质产生所致,在贮藏初期,肌肉处于尸僵状态,体内生化代谢仍然进行,由内源蛋白酶分解蛋白产生少量的可溶性肽,且可以作为微生物生长的基质,随着贮藏时间的延长,肌肉处于自溶状态加快,微生物数量增加,第5天之后可溶性肽含量增加较快,这可能是微生物代谢分泌更多的蛋白酶加速蛋白质分解所致。总体来说,IS组的可溶性肽含量更高,SS组贮藏下可溶性肽含量增长较为缓慢,这与前期弹性、硬度、内聚性、咀嚼性下降有密切关系,也预示着鱼肉新鲜度下降。结果表明,微冻贮藏可以保持更低的蛋白酶活性,延缓了蛋白质的降解,使得肌肉分解产生的含氮化合物更少。
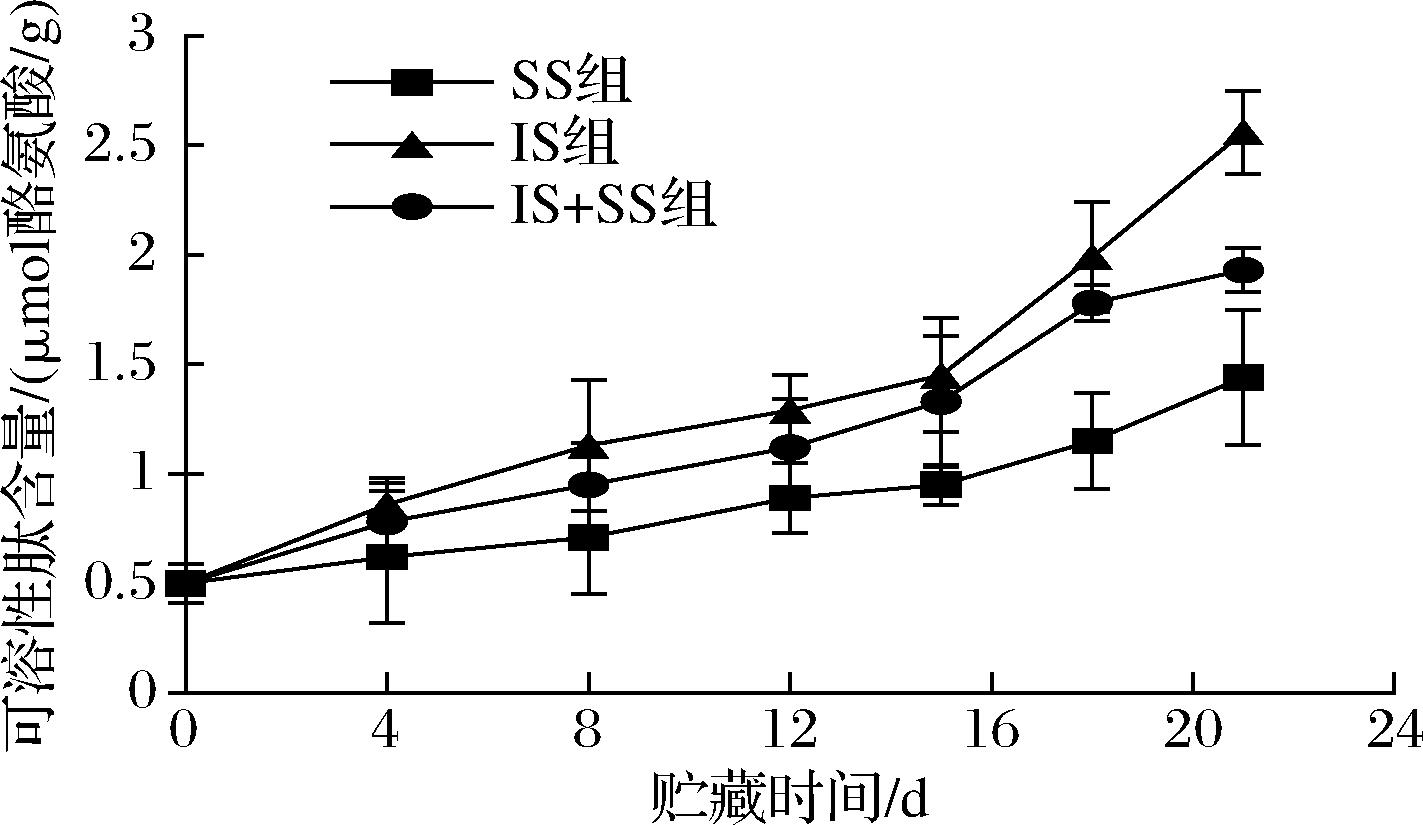
图14 大菱鲆肌肉贮藏过程可溶性肽含量的变化
Fig.14 Changes of soluble peptide in turbot meat during storage
2.10 感官评价
新鲜大菱鲆鱼肉有明显的鱼腥味,鱼肉富有弹性,有鲜亮的光泽,组织较为紧实。由图15可知,大菱鲆在不同条件下贮藏的感官评分随着温度升高下降。IS组在第12天时评分由10分降为4.3分,接近不可接受状态,IS+SS组在前4 d评分下降缓慢,随贮藏时间延长在第15天左右,评分达到4.5分,已处于不可接受的临界值,而SS组感官评分相对其他2组高,在整个贮藏期间均在可接受范围内,这是由于微冻使得肌肉表面形成一层冰膜,减缓了微生物的繁殖,鱼肉品质得以保持,由此可知,SS组相比于IS组和IS+SS组更能保持肌肉的感官品质,货架期更长。
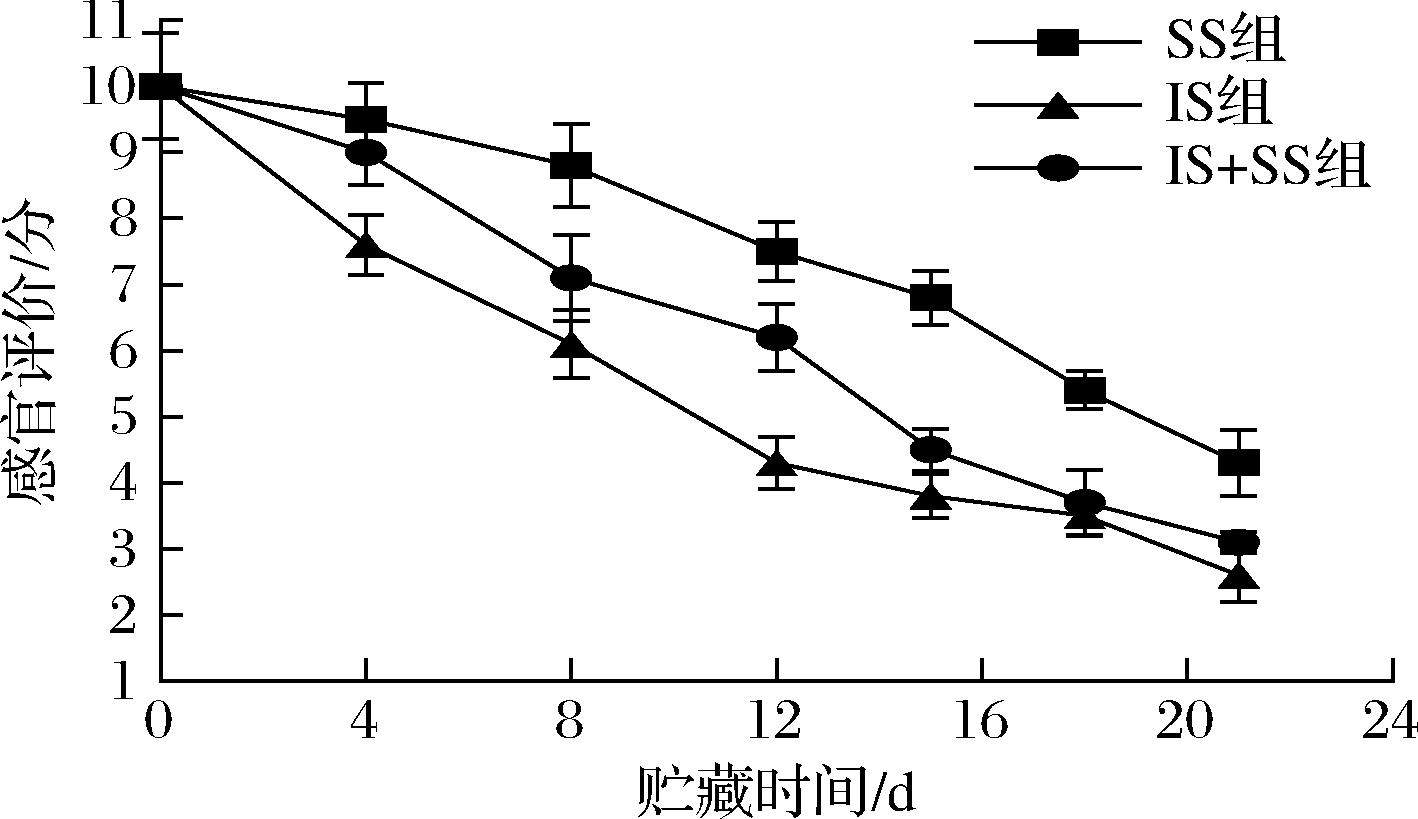
图15 大菱鲆肌肉贮藏期间的感官评价
Fig.15 Changes of sensory scores in turbot meat during storage
2.11 微观结构的变化
组织微观结构是评价肌肉品质的直观指标,图16显示了大菱鲆肌肉在不同条件下贮藏中的微观结构形态,明显看出新鲜大菱鲆的肌肉纤维清晰紧密,排列整齐,肌纤维中间有线状间隙,当贮藏12 d时,SS组出现明显的肌纤维分离,并且沿着肌纤维方向出现了扭曲,IS+SS组肌纤维也出现轻微扭曲且存在少量的纤维分离;IS组肌纤维线状间隙发生变化,断面轮廓稍有模糊,到贮藏第21天时,SS组存在严重扭曲变形,冰晶形成的空隙增多,导致纤维之间的间隙变大,边缘出现絮状物,并伴有纤维断裂;IS+SS组肌纤维间隙明显变大,且纤维之间出现黏连,可能是因为后期微冻产生的冰晶造成的损伤;IS组肌纤维排列有序,但相比对照组(0 d)只存在微弱的分离,肌纤维出现不均匀缝隙,整体未见明显的肌束断裂状态。综上分析,SS组的肌肉纤维结构变化最为明显,这一方面可能是因为肌肉蛋白受微生物和酶作用发生降解,造成纤维断裂分离;一方面是微冻产生了部分冰晶,且大小分布不均匀,导致细胞内外压力增大,对细胞造成机械损伤所致[38]。而IS+SS组先进行冰藏后微冻,一定程度上减缓了冰核形成的速度,因此组织结构的破坏程度次于持续微冻;对于IS组胞内不形成冰晶,但可能受到肌原纤维蛋白降解的影响,出现肌纤维之间的微观变化。
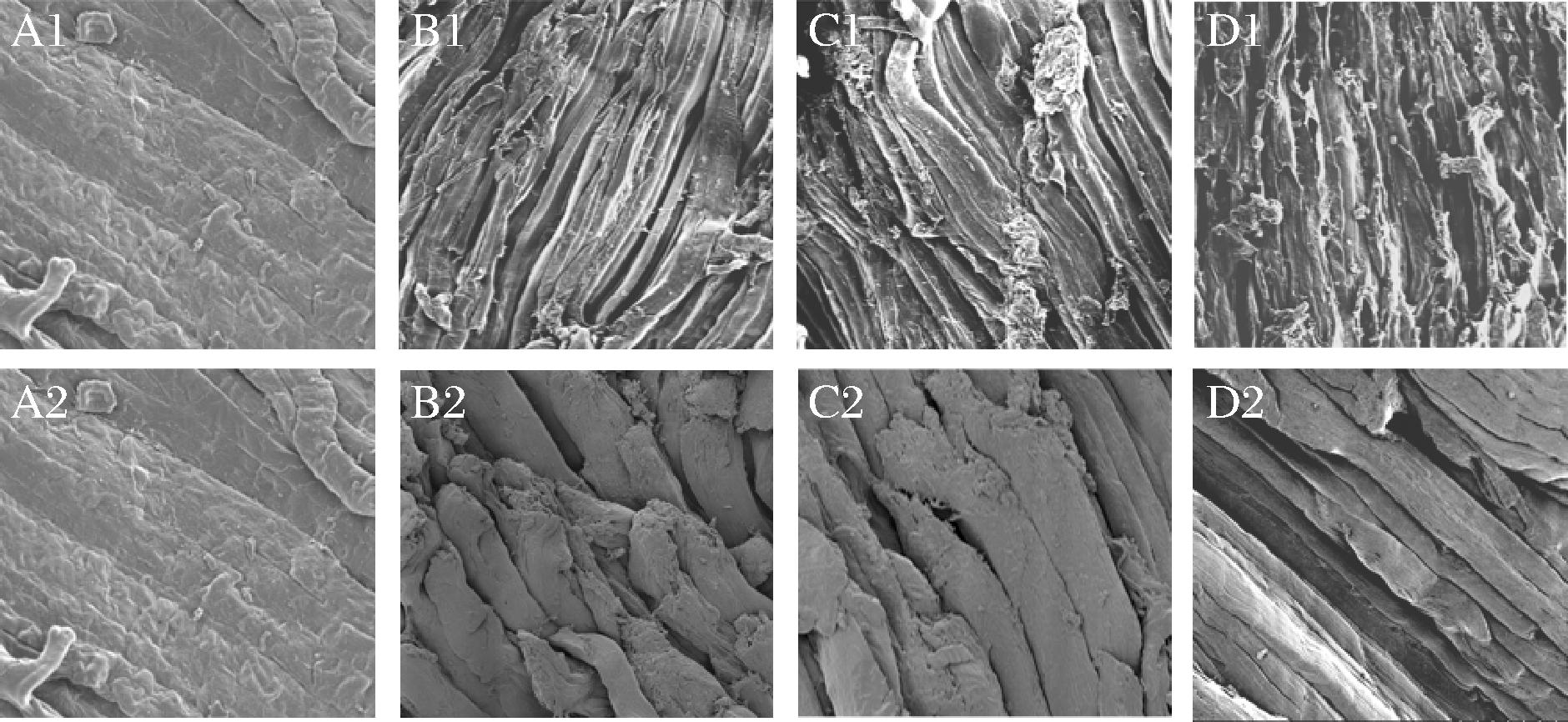
A1-0 d;B1-SS组(12 d);C1-IS-SS组(12 d);D1-IS组(12 d);A2-0 d;B2-SS组(21 d);C2-IS-SS组(21 d);D2-IS组(21 d)
图16 大菱鲆肌肉贮藏过程微观结构的变化
Fig.16 Changes of microstructure in turbot meat during storage
3 结论
本文研究了大菱鲆在微冻(SS组)、冰藏(IS组)和冰藏+微冻(IS+SS组)贮藏21 d的鲜度指标、组织结构和水分状态等变化规律,以市场冰藏对比分析,结果表明,随着贮藏时间的延长,各组pH均呈现先下降后上升的趋势。3种条件下的b*、硬度、弹性、咀嚼性和内聚性均呈现下降趋势,且温度越低,下降速度越慢。感官评分达到不可接受的贮藏天数为SS组>IS+SS组>IS组。L*和a*值呈逐渐上升趋势,温度越低,上升越慢。3组的可溶性肽含量由初期到贮藏末期分别增加了13.4%、29.4%、20.4%。IS+SS组、IS组的TVB-N值分别在第15、12天左右超过二级鲜度(30 mg/100 g),而SS组在21 d仍在可接受范围内。3组的K值分别在第21、12、15天达到45.21%、56.4%、57.2%。3组菌落总数均呈上升趋势,分别在第21、12、15天超过国家限定值6 lg CFU/g。3种条件下的核磁成像显示,SS组能保留较多的水分,更能维持鱼肉的新鲜度。从微观结构看,微冻贮藏对肌肉组织结构影响较为显著。基于各项指标的变化规律,发现微冻(SS组)能更好地保持大菱鲆的品质和感官特性,且比其他2组货架期延长了6~9 d。后期应从蛋白质特性、挥发性风味物质、冰晶形态等揭示大菱鲆微冻变化规律及保鲜机制。
[1] 朱逢乐, 章海亮, 邵咏妮, 等.基于高光谱成像技术的多宝鱼肉冷藏时间的可视化研究[J].光谱学与光谱分析, 2014, 34(7):1938-1942.ZHU F L, ZHANG H L, SHAO Y N, et al.Visualization of the chilling storage time for turbot flesh based on hyperspectral imaging technique[J].Spectroscopy and Spectral Analysis, 2014, 34(7):1938-1942.
[2] NIE X B, ZHANG F, WANG T T, et al.Physiological and morphological changes in Turbot (Psetta maxima) gill tissue during waterless storage[J].Aquaculture, 2019, 508:30-35.
[3] 关长涛, 杨正勇, 王启要, 等.大菱鲆产业发展报告[J].中国水产, 2021(1):22-35.GUAN C T, YANG Z Y, WANG Q Y, et al.Report on the development of turbot industry[J].Aquarium, 2021(1):22-35.
[4] 岑剑伟. 冰温气调结合高压静电场对罗非鱼片保鲜及其机理研究[D].广州:华南农业大学, 2016.CEN J W.Effect of high voltage electrostatic field combined with modified atmosphere packaging and controlled freezing-point storage on the quality of Tilapia fillet and its mechanism research[D].Guangzhou:South China Agricultural University, 2016.
[5] BANERJEE R, MAHESWARAPPA N B.Superchilling of muscle foods:Potential alternative for chilling and freezing[J].Critical Reviews in Food Science and Nutrition, 2019, 59(8):1256-1263.
[6] 刘锋, 梅俊, 谢晶.不同贮藏温度下大菱鲆品质变化及货架期预测模型的建立[J].渔业现代化, 2019, 46(4):61-68.LIU F, MEI J, XIE J.Establishment of prediction model for quality change and shelf life of Scophthalmus maximus at different storage temperatures[J].Fishery Modernization, 2019, 46(4):61-68.
[7] LU H, LIU X C, ZHANG Y M, et al.Effects of chilling and partial freezing on rigor mortis changes of bighead carp (Aristichthys nobilis) fillets:Cathepsin activity, protein degradation and microstructure of myofibrils[J].Journal of Food Science, 2015, 80(12):C2725-C2731.
[8] 胡玥, 杨水兵, 余海霞, 等.微冻保鲜方法对带鱼品质及组织结构的影响[J].食品科学, 2016, 37(18):290-297.HU Y, YANG S B, YU H X, et al.Effect of superchilling on the quality and muscle tissue structure of Trichiurus haumela[J].Food Science, 2016, 37(18):290-297.
[9] ELIASSON S, ARASON S, MARGEIRSSON B, et al.The effects of superchilling on shelf-life and quality indicators of whole Atlantic cod and fillets[J].LWT, 2019, 100:426-434.[10] BAO Y L, ZHU S C, LUO Y K, et al.Comparison of postmortem changes in blunt-snout bream (Megalobrama amblycephala) during short-term storage at chilled and partial freezing temperatures[J].Journal of Aquatic Food Product Technology, 2015, 24(8):752-761.
[11] MOZURAITYTE R, STANDAL I B, CROPOTOVA J, et al.Superchilled, chilled and frozen storage of Atlantic mackerel (Scomber scombrus)-effect on lipids and low molecular weight metabolites[J].International Journal of Food Science &Technology, 2021, 56(4):1918-1928.
[12] 郑稳, 庄文静, 宫萱,等.冷藏和微冻贮藏对大口黑鲈鱼品质的影响[J].食品与发酵工业, 2024,50(5):218-225.ZHENG W, ZHUANG W J, GONG X, et al.Effect of chilling and superchilling storage on quality of Micropterus salmoides[J].Food and Fermentation Industries, 2024,50(5):218-225.
[13] ZHOU Q Q, LI P Y, FANG S Y, et al.Preservative effects of gelatin active coating containing eugenol and higher CO2 concentration modified atmosphere packaging on Chinese Sea bass (Lateolabrax maculatus) during superchilling (-0.9 ℃) storage[J].Molecules, 2020, 25(4):871.
[14] NEIRA L M, AGUSTINELLI S P, RUSECKAITE R A, et al.Shelf life extension of refrigerated breaded hake medallions packed into active edible fish gelatin films[J].Packaging Technology and Science, 2019, 32(9):471-480.
[15] ZHANG J Y, SUN L, CUI P B, et al.Effects of combined treatment of electrolytic water and chitosan on the quality and proteome of large yellow croaker (Pseudosciaena crocea) during refrigerated storage[J].Food Chemistry, 2023, 406:135062.
[16] 蓝蔚青, 张炳杰, 周大鹏, 等.超声联合微酸性电解水处理对真空包装海鲈鱼冷藏期间品质变化的影响[J].食品科学, 2022, 43(5):62-68.LAN W Q, ZHANG B J, ZHOU D P, et al.Effect of ultrasonic combined with slightly acidic electrolyzed water treatment on quality changes of vacuum-packaged sea bass(Lateolabrax japonicas) during refrigerated storage[J].Food Science, 2022, 43(5):62-68.
[17] XU Y X, LI T, ZHANG C M, et al.Protein degradation of olive flounder (Paralichthys olivaceus) muscle after postmortem superchilled and refrigerated storage[J].International Journal of Food Properties, 2018, 21(1):1911-1922.
[18] HAO R Y, LIU Y, SUN L M, et al.Sodium alginate coating with plant extract affected microbial communities, biogenic amine formation and quality properties of abalone (Haliotis discus Hannai Ino) during chill storage[J].LWT-Food Science and Technology, 2017, 81:1-9.
[19] JIANG Q Q, NAKAZAWA N, HU Y Q, et al.Changes in quality properties and tissue histology of lightly salted tuna meat subjected to multiple freeze-thaw cycles[J].Food Chemistry, 2019, 293:178-186.
[20] KAALE L D, EIKEVIK T M.The development of ice crystals in food products during the superchilling process and following storage, a review[J].Trends in Food Science &Technology, 2014, 39(2):91-103.
[21] LAN Y, SHANG Y B, SONG Y, et al.Changes in the quality of superchilled rabbit meat stored at different temperatures[J].Meat Science, 2016, 117:173-181.
[22] 林建城, 方静, 吕田星,等.不同温度贮藏对黄鳍鲷鱼肉鲜度与品质的影响[J].食品研究与开发, 2022, 43(24):102-109.LIN J C, FANG J,LYU T X, et al.Effects of storage temperature on the freshness and quality of yellowfin seabream Acanthopagrus latus[J].Food Research and Development,2022,43(24):102-109.
[23] BU Y, HAN M L, TAN G Z, et al.Changes in quality characteristics of southern bluefin tuna (Thunnus maccoyii) during refrigerated storage and their correlation with color stability[J].LWT, 2022, 154:112715.
[24] 相悦, 孙承锋, 李来好,等.琼胶寡糖及EGCG对冰藏花鲈鱼片新鲜度与蛋白质生化特性的影响[J].水产学报, 2021, 45(7):1007-1020.XIANG Y, SUN C F, LI L H, et al.Effects of agar-oligosaccharides and EGCG on the freshness and protein biochemical change of sea bass(Lateolabrax japonicus) fillets during ice storage[J].Journal of Fisheries of China, 2021, 45(7):1007-1020.
[25] 相悦, 孙承锋, 李来好,等.花鲈冰藏过程中肌原纤维蛋白生化特性与新鲜度变化的相关性[J].水产学报, 2021, 45(2):283-295. XIANG Y, SUN C F, LI L H, et al.Correlation between changes in freshness and protein biochemical properties of Lateolabrax japonicas during iced storage[J].Journal of Fisheries of China, 2021, 45(2):283-295.
[26] 李婷婷, 刘剑侠, 徐永霞,等.大菱鲆微冻贮藏过程中的品质变化规律[J].中国食品学报, 2014, 14(7):95-102.LI T T, LIU J X, XU Y X, et al.Quality changes of Scophthalmus maximus during mini-freezing storage[J].Journal of Chinese Institute of Food Science and Technology, 2014, 14(7):95-102.
[27] 刘剑侠, 李婷婷, 密娜, 等.超高压处理对大菱鲆品质的影响[J].食品工业科技, 2013, 34(20):102-106.LIU J X, LI T T, MI N, et al.Effect of ultra-high pressure treatment on quality of Scophthalmus maximus[J].Science and Technology of Food Industry, 2013, 34(20):102-106.
[28] GAO S, LIU Y Y, FU Z X, et al.Uncovering quality changes of salted bighead carp fillets during frozen storage:The potential role of time-dependent protein denaturation and oxidation[J].Food Chemistry, 2023, 414:135714.
[29] YANG F, JIA S N, LIU J X, et al.The relationship between degradation of myofibrillar structural proteins and texture of superchilled grass carp (Ctenopharyngodon idella) fillet[J].Food Chemistry, 2019, 301:125278.
[30] LU X, ZHANG Y M, XU B C, et al.Protein degradation and structure changes of beef muscle during superchilled storage[J].Meat Science, 2020, 168:108180.
[31] 李立杰. 南美白对虾贮藏时质构和色差的变化研究[D].天津:天津商业大学, 2014.LI L J.Study on texture and color of Penaeus vannamei Bonne during storage[D].Tianjin:Tianjin University of Commerce, 2014.
[32] 刘彩华, 邱恒恒, 朱新荣, 等.冷藏温度对白斑狗鱼肌肉质构特性的影响[J].食品与发酵工业, 2017, 43(12):137-143.LIU C H, QIU H H, ZHU X R, et al.Effect of different refrigeration temperature on textural properties of Esox lucius muscle[J].Food and Fermentation Industries, 2017, 43(12):137-143.
[33] 王晓君, 沈秋霞, 卢朝婷等.南方大口鲶在微冻和冻藏条件下鲜度及品质的变化[J].食品工业科技, 2018, 39(231):300-304;311.WANG X J, SHEN Q X, LU C T, et al.Changes in the quality and freshness of Silurus meridionalis Chen under partial freezing and frozen conditions[J].Science and Technology of Food Industry, 2018, 39(23):300-304;311.
[34] BEKHIT A E D A, HOLMAN B W B, GITERU S G, et al.Total volatile basic nitrogen (TVB-N) and its role in meat spoilage:A review[J].Trends in Food Science &Technology, 2021, 109:280-302.
[35] LU H, LUO Y K, ZHOU Z Y, et al.The quality changes of songpu mirror carp (Cyprinus carpio) during partial freezing and chilled storage[J].Journal of Food Processing and Preservation, 2014, 38(3):948-954.
[36] MIKLOS R, MORA-GALLEGO H, LARSEN F H, et al.Influence of lipid type on water and fat mobility in fermented sausages studied by low-field NMR[J].Meat Science, 2014, 96(1):617-622.
[37] 张楠楠. 复合生物保鲜剂结合真空包装对冰鲜大黄鱼品质及腐败菌作用机制的影响[D].上海:上海海洋大学2019.ZHANG N N.Effects of complex bio-preservatives combined with vacuum packaging treatment on the quality of large yellow croaker during iced storage and its antibacterial mechanism[D].Shanghai:Shanghai Ocean University, 2019.
[38] 刘欣荣. 不同贮藏方式对红鳍东方鲀品质的影响研究[D].保定:河北农业大学, 2020.LIU X R.Study on the effects of different storage methods on the quality of Takifugu rubripes[D].Baoding:Hebei Agricultural University, 2020.