青梅又名果梅、酸梅、干枝梅,是蔷薇科植物。我国是青梅的原产地,也是世界上适合生产青梅地域最广的国家[1]。目前,青梅除少量鲜食外,一般加工成咸水梅、梅坯、果脯蜜饯、饮料、果酱和青梅酒等产品[2-4]。然而,这些加工过程中产生了大量废弃核仁,其含油率约为24.6%~55.3%[5],具有巨大的开发前景。因此,找到一种适合的提取方法对拓展青梅核仁油的应用具有重要意义。
目前,提取植物油脂的方法主要有有机溶剂提取法、压榨法、超临界二氧化碳萃取法和水酶法等。传统的有机溶剂提取法提取率高,是油脂行业常用的加工方法,将其用于青梅核仁油的提取时,青梅核仁油得率约为40.12%(提取得到的青梅核仁油的质量占用于提取的青梅核仁粉质量的百分比)[6]。但是该法使用的有机溶剂对环境有污染且需后续去除增加了提油成![]() 等[8]研究发现,冷榨法提取李子核仁油时虽然能够提高油脂的品质,但是油脂提取率仅为71%左右(含油率约为35.8%)。VLADI
等[8]研究发现,冷榨法提取李子核仁油时虽然能够提高油脂的品质,但是油脂提取率仅为71%左右(含油率约为35.8%)。VLADI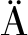 等[9]比较了超临界二氧化碳萃取法和冷榨法对李子核仁油提取率的影响,结果表明与冷榨法相比,超临界二氧化碳法使李子核仁油的提取率显著增加,但该法工艺复杂,仪器成本和提油成本较高,无法实现大规模使用。因此,基于环保、工艺难易程度和成本等因素考虑,水剂法提取油脂是关注的热点之一[10-12]。传统水剂法是一种工艺简单无污染的提取方法,将其用于李子核仁油的提取时油脂提取率约为70%,提取所得油脂品质较好[13]。传统水剂法[液固比大于1(mL∶g)]提取油脂的工艺简单,设备要求低,但提取时加入了大量的水,油脂产生严重的乳化现象,降低了油脂提取率[14]。近年来,具有低液固比特点的新型水剂法在油脂的提取中备受重视[15]。低液固比的水剂法只用少量的水[液固比值小于0.2(mL∶g)],在提取过程中,加入的水与油料中的非油固体(蛋白质、碳水化合物等)通过氢键结合,降低了非油固体与油脂间的乳化作用,从而提高油脂提取率。将低液固比水剂法用于含油高(含油率为47.34%~66.51%)的植物油料(花生、葵花籽、核桃等)时,其提取率可达94%~97%[16-18];用于低含油率的大豆(含油率为20.73%)时,该法提取率亦可达到81%[19]。付家园等[20]利用微波处理和高温烘烤对油料进行预处理,与高温烘烤(94.13%)相比,微波处理后油脂的提取率(95.51%)和品质均有所提高。然而,微波辅助低液固比的水剂法对青梅核仁油的提取效果及其油脂品质的影响尚不清楚。
等[9]比较了超临界二氧化碳萃取法和冷榨法对李子核仁油提取率的影响,结果表明与冷榨法相比,超临界二氧化碳法使李子核仁油的提取率显著增加,但该法工艺复杂,仪器成本和提油成本较高,无法实现大规模使用。因此,基于环保、工艺难易程度和成本等因素考虑,水剂法提取油脂是关注的热点之一[10-12]。传统水剂法是一种工艺简单无污染的提取方法,将其用于李子核仁油的提取时油脂提取率约为70%,提取所得油脂品质较好[13]。传统水剂法[液固比大于1(mL∶g)]提取油脂的工艺简单,设备要求低,但提取时加入了大量的水,油脂产生严重的乳化现象,降低了油脂提取率[14]。近年来,具有低液固比特点的新型水剂法在油脂的提取中备受重视[15]。低液固比的水剂法只用少量的水[液固比值小于0.2(mL∶g)],在提取过程中,加入的水与油料中的非油固体(蛋白质、碳水化合物等)通过氢键结合,降低了非油固体与油脂间的乳化作用,从而提高油脂提取率。将低液固比水剂法用于含油高(含油率为47.34%~66.51%)的植物油料(花生、葵花籽、核桃等)时,其提取率可达94%~97%[16-18];用于低含油率的大豆(含油率为20.73%)时,该法提取率亦可达到81%[19]。付家园等[20]利用微波处理和高温烘烤对油料进行预处理,与高温烘烤(94.13%)相比,微波处理后油脂的提取率(95.51%)和品质均有所提高。然而,微波辅助低液固比的水剂法对青梅核仁油的提取效果及其油脂品质的影响尚不清楚。
因此,本研究以青梅核仁为原料,研究微波辅助低液固比的水剂法提取工艺中液固比值、NaCl的质量浓度、微波预处理功率和时间因素对青梅核仁油提取率的影响,并探究其对青梅核仁油的理化性质的影响。研究结果为提高青梅核仁的利用奠定基础,并为拓展微波辅助低液固比水剂法在油脂提取中的应用提供一定参考。
1 材料与方法
1.1 材料与试剂
青梅核仁,重庆江记酒庄有限公司;乙醚、正己烷、甲醇、氢氧化钾、盐酸、氢氧化钠、氯化钠、石油醚、DPPH等试剂(均为分析纯),成都市科龙化工试剂厂;超纯水,由YSL-RO-T10L/H超纯水系统(Ashland公司)制备。
1.2 仪器与设备
UltraScan PRO型测色仪,美国Hunter Lab公司;气相色谱仪,日本京都岛津公司;TGL-16G台式离心机,上海安亭科学仪器厂;多功能粉碎机,杭州九阳生活电器有限公司;微波炉,松下电器有限公司;电热鼓风干燥箱,上海一恒科学仪器厂。
1.3 实验方法
1.3.1 微波辅助低液固比水剂法提取青梅核仁油
参照付家园等[20]和李可等[21]的方法先用微波预处理油料再采用低液固比水剂法提取青梅核仁油。将去皮的青梅核仁用0.3%的盐酸浸泡2 d后,在室温(25 ℃)下放置2 h晾干水分。然后,将其经不同微波时间(0、20、40、60、80、100、120、140 s)和微波功率(0、120、240、420、560 W)处理后放入50 ℃的烘箱中7 h,粉碎后过40目筛即可得到青梅核仁粉。取上述青梅核仁粉10 g于离心管中,并加入超纯水(超纯水与青梅核仁粉液固比(mL∶g)为0、0.08、0.12、0.13、0.14、0.15、0.16、0.2、1)和NaCl(NaCl质量浓度为0、0.04、0.06、0.08、0.10 g/mL)在30 ℃、600 r/min搅拌10 min,并离心(1 550×g,30 min,3次),收集油脂和沉淀,微波辅助低液固比水剂法的提取率的计算如公式(1)所示:
油脂提取率![]()
(1)
式中:m1为加入青梅核仁粉、NaCl、超纯水和离心管的总质量,g;m2为提取油脂后离心管剩余总质量,g;m0为称取青梅核仁粉的质量,g;w为索氏提取法测得青梅核仁的油脂含量,%。
1.3.2 有机溶剂提取法提取青梅核仁油
将去皮的青梅核仁用0.3%的盐酸浸泡2 d,晾干放入50 ℃的烘箱中7 h,粉碎后过40目筛即可得到青梅核仁粉。准确称取上述青梅核仁粉10 g于提取瓶中并加入石油醚70 mL(沸程60~90 ℃),并于60 ℃的水浴中搅拌浸提1.5 h(搅拌速度300 r/min),经过滤离心(6 201×g,3 min)后得到上清液。除去上清液中的有机溶剂,有机溶剂提取法提取率的计算如公式(2)所示:
油脂提取率![]()
(2)
式中:m1为加入青梅核仁粉的总质量,g;m2为提取得到的青梅核仁油的质量,g;w为索氏提取法测得青梅核仁的脂肪含量,%。
1.3.3 青梅核仁油的脂肪酸组成分析
脂肪酸甲酯化:将约10 μL油样溶于2 mL正己烷中并加入2 mL KOH甲醇溶液(0.5 mol/L),涡旋5 min。样品静置5 min后,加入6 mL饱和NaCl充分混合。离心(520×g,5 min)后,将1 mL上层相转移至2 mL小瓶中进行气相色谱分析。
气相色谱检测条件:DB-23石英毛细管柱(60 m×0.25 mm×0.25 μm);升温程序:以4 ℃/min的速率将柱温从60 ℃升高至220 ℃,并保持35 min;注射器和检测器的温度分别为250 ℃和280 ℃。以氮气为载气,流速为1.0 mL/min,分流比为50∶1。
1.3.4 青梅核仁油色泽测定
用测色仪对装入1 cm石英比色皿中油样品进行颜色测定,以白板为色差测定参比,依次读取a*值和b*值,平行测量8次,取平均值。a*值表示从负到正(绿色到红色)的变化,b*值表示从负到正(从蓝色到黄色)的变化。
1.3.5 青梅核仁油DPPH自由基清除率的测定
使用DPPH测定法,对2种提取方法获得的青梅核仁油的抗氧化活性进行了测定。将0.2 mL的每种油样品与10 mL甲醇剧烈混合1 min后离心(1 000×g,3 min)。取0.6 mL上清液与2 mL新制备的0.1 mmol/L的DPPH甲醇溶液混合摇匀,于黑暗中静置1 h。并使用紫外分光光度计在517 nm处测量混合液的吸光度。青梅核仁油的抗氧化活性表示为DPPH自由基的清除能力,其计算如公式(3)所示:
DPPH自由基清除率![]()
(3)
式中:Abs标样为未加入油样品的DPPH甲醇溶液在517 nm处测得的吸光值;Abs样品为加入油样后的DPPH甲醇溶液在517 nm处测得的吸光值。
1.3.6 过氧化值测定
采用过氧化值评价油脂的初级氧化产物(主要为氢过氧化物),具体方法参照GB 5009.227—2023《食品安全国家标准 食品中过氧化值的测定》进行。
1.3.7 酸价测定
酸价的测定参考GB 5009.229—2016《食品安全国家标准 食品中酸价的测定》的方法进行。
1.3.8 硫代巴比妥酸值测定
硫代巴比妥酸值的测定参考GB/T 35252—2017《食品安全国家标准 动植物油脂2-硫代巴比妥酸值的测定》的方法进行。
1.3.9 皂化值的测定
皂化值的测定参考GB/T 5534—2008《动植物油脂 皂化值的测定》的方法进行。
1.4 数据处理
各试验重复2次,各样品的指标至少进行3次平行测定,以平均值±标准偏差表示结果。使用统计软件SPSS(version 18.0;SPSS Inc., Chicago, IL, USA)进行单因素方差分析(P<0.05时为差异显著),之后采用S-N-K检验(假设方差相等)或Dunnett T3检验(变量论证后不假设方差相等)。
2 结果与分析
2.1 液固比对青梅核仁油提取率的影响
如图1-A所示,青梅核仁油的提取率随液固比的增加呈现先增大再减小的趋势。当液固比(mL∶g)从0增加到0.14时,青梅核仁油提取率从10.28%显著增加至83.00%。这可能是由于加入的水与油料中的亲水性物质通过氢键作用聚合成团,增加了表面张力,从而使游离的油排出[16],提高油脂的提取率。然而,当液固比(mL∶g)从0.14增加至0.2,青梅核仁油的提取率降低了7.5%。此外,微波辅助低液固比水剂法对青梅核仁油的提取率显著高于传统水剂法(液固比值为1)的提取率(61.71%)(P<0.05),这可能是因为过多的水会溶解表面活性剂(磷脂、蛋白质等),从而形成水包油乳液,降低油的提取率[16](图1-B和图1-C)。由此可见,在一定范围内增加液固比值可以增加青梅核仁油的提取率,且低液固比水剂法的青梅核仁油提取率高于传统水剂法。
A-不同液固比的青梅核仁油提取率;B-低液固比水剂法;C-传统水剂法
图1 不同液固比的青梅核仁油提取率和提取后混合物
Fig.1 Effect of liquid-solid ratio on the extraction yield of green plum kernel oil and the picture of the mixture after extraction
注:不同字母表示差异显著(P<0.05)(下同)。
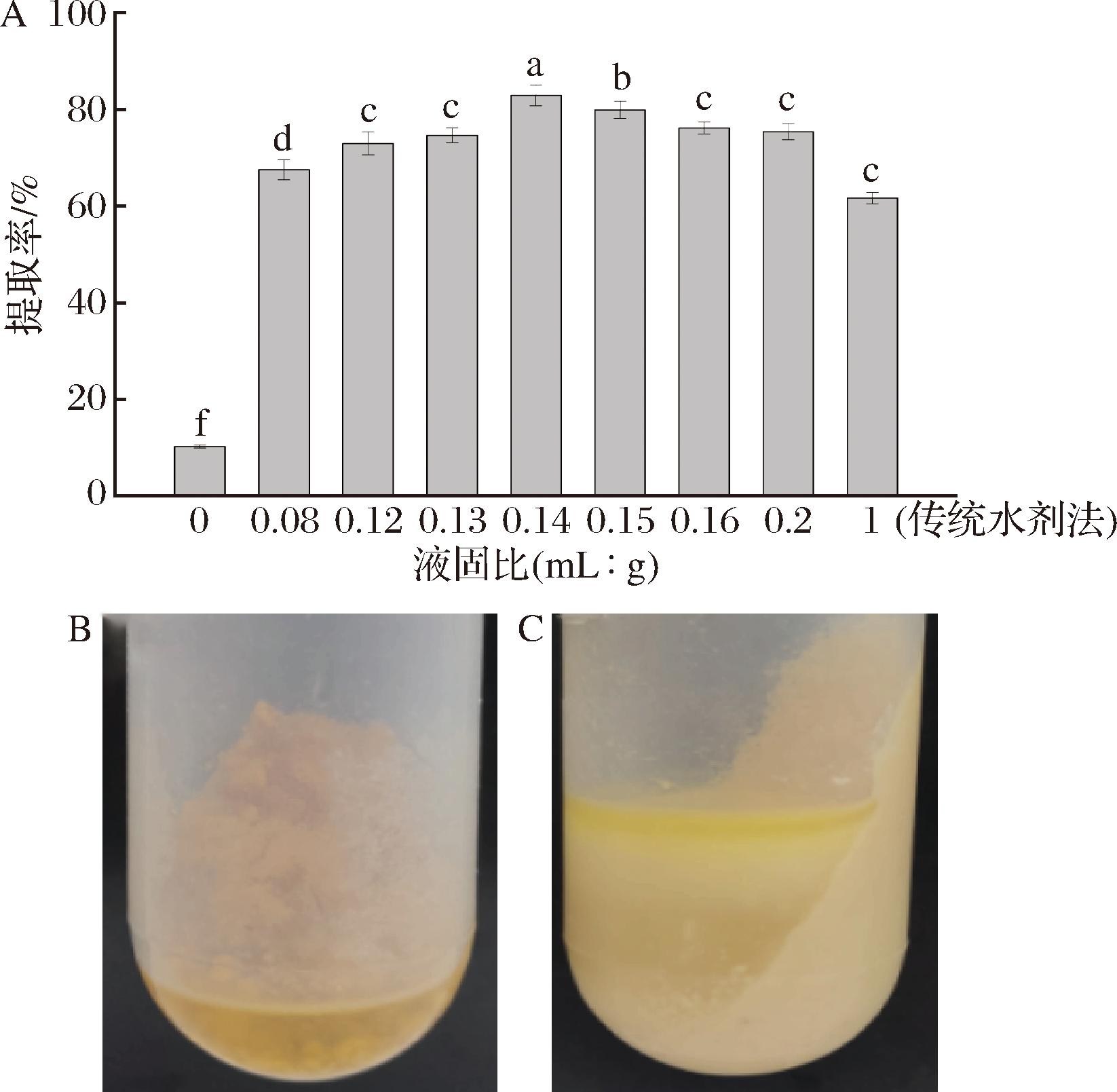
2.2 NaCl质量浓度对青梅核仁油提取率的影响
图2反映了NaCl质量浓度对青梅核仁油提取率的影响。随着NaCl质量浓度从0增加到0.08 g/mL,青梅核仁油提取率从80.33%显著增加至87.31%。这可能是由于NaCl的加入使油料中蛋白质氨基酸侧链的亲水基团暴露,增加其亲水性,从而使水和蛋白质的结合更紧密,进而将油从聚集的聚合物中挤出来[21-22]。此外,NaCl还可以增大含水沉积物与上清油的密度差,从而促进油的分离[22]。然而,当NaCl水溶液质量浓度超过0.08 g/mL时,随着NaCl质量浓度继续增加至0.10 g/mL,青梅核仁油提取率反而下降至84.51%。这可能是因为过多的NaCl会与亲水性基团竞争水,抑制亲水性基团与水形成氢键,从而降低油的提取率。
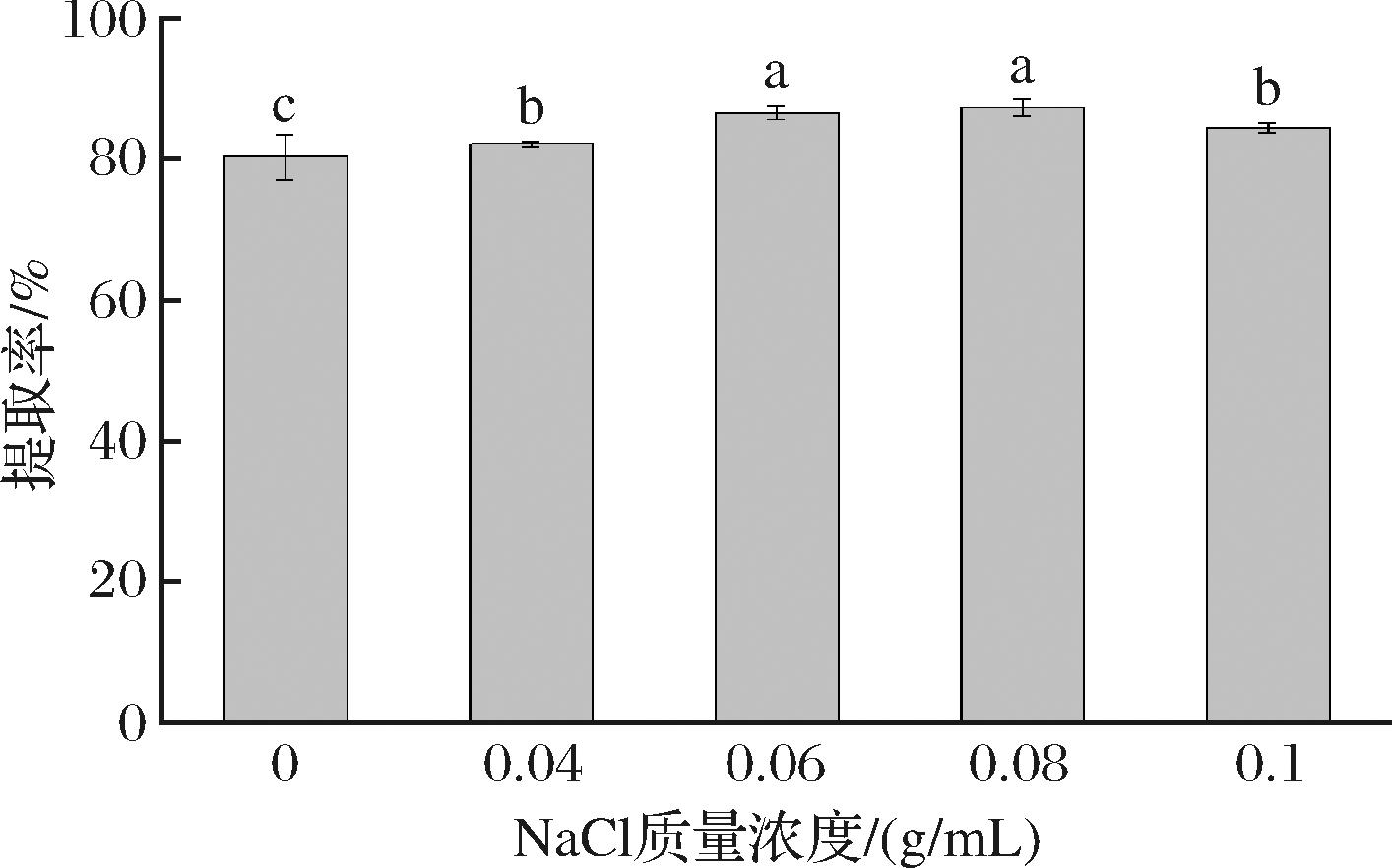
图2 不同NaCl质量浓度下的青梅核仁油提取率
Fig.2 Effect of NaCl concentration on extraction yield of green plum kernel oil
2.3 微波时间和微波功率对青梅核仁油提取率的影响
图3为不同微波功率和微波时间对青梅核仁油提取率的影响。如图3-A所示,当微波功率固定在420 W时,随着微波时间的延长,青梅核仁油的提取率呈现先增大再减小的趋势,并在80 s时达到最高提取率(88.27%)。此外,提取率随微波功率的变化趋势与微波时间相似。当微波时间固定在80 s时,随着微波功率从0增加至420 W,青梅核仁油的提取率由76.93%提高至88.16%(图3-B)。这可能是由于微波处理破坏了油体膜,使大部分油体聚合起来,使油更容易释放[23],从而提高青梅核仁油的提取率。然而,当微波功率大于420 W,微波时间大于80 s时,随着微波功率的增加和微波时间的延长,青梅核仁油提取率反而降低。这可能是由于微波功率过大或者微波时间变长使油料颗粒中非油固体物质(蛋白质、糖类等)的结构发生改变,增加其与油结合的能力,从而使提取率降低[15,20]。结果表明,在一定范围内增加微波功率和延长微波时间能提高青梅核仁油的提取率,但过度的微波处理则会降低其提取率。
A-微波时间;B-微波功率
图3 微波时间和微波功率对青梅核仁油提取率的影响
Fig.3 Effect of microwave time and microwave power on extraction yield of green plum kernel oil
2.4 两种提取方法对青梅核仁油提取率和基本理化性质的影响
由于有机溶剂提取法是工业上常用的提油方法,因此以有机溶剂提取法作为微波辅助低液固比水剂法的对照试验,对2种不同提油方法的提取率以及质量方面进行比较。由表1可知,与有机溶剂提取法(95.12%)相比,微波辅助低液固比水剂法的青梅核仁油提取率(88.27%)有所降低。但是,与有机溶剂提取法相比,微波辅助低液固比水剂法提取的青梅核仁油具有更低的酸价(2.22 mg/g)、硫代巴比妥酸值(0.014 mg/kg)和过氧化值(0.17 mmol/kg),这可能是由于有机溶剂提取法在浸提过程中油脂在60 ℃下加热1.5 h,使中性油发生水解,游离脂肪酸的含量会增加,而且该条件下油脂发生氧化反应,从而影响油脂的品质、稳定性和营养价值[24]。此外,与有机溶剂提取法(178.27 mg/g)相比,该低液固比水剂法的皂化价(179.82 mg/g)略有提高。由此可见,微波辅助低液固比水剂法提取的油脂基本理化性质优于有机溶剂提取法。综上所述,微波辅助低液固比水剂法对油的提取率比有机溶剂提取法低6.85%,但在提高油脂基本理化性质等方面具有更大的优势,因此更适用于提取青梅核仁油。而且,微波辅助低液固比水剂法避免了有机溶剂(石油醚)的使用,是更环保的提油技术。
表1 微波辅助低液固比水剂法与有机溶剂提取法提取青梅核仁油的提取率及其理化性质的比较
Table 1 Comparison of the extraction yield and physicochemical properties of green plum kernel oil obtained by microwave-assisted low liquid-solid ratio aqueous and organic solvent extraction methods
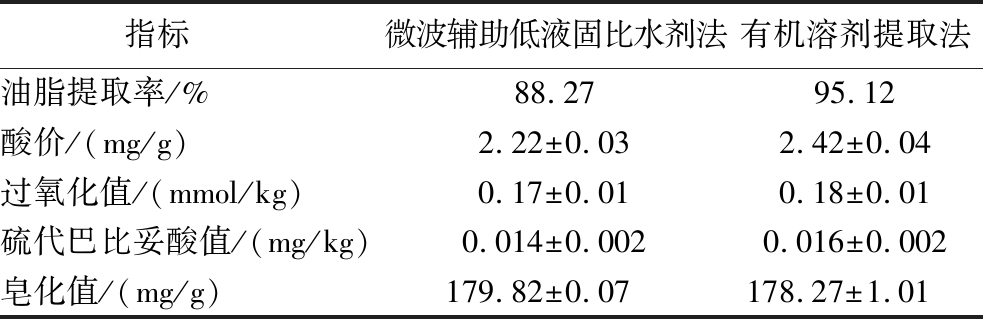
指标 微波辅助低液固比水剂法有机溶剂提取法油脂提取率/%88.2795.12酸价/(mg/g)2.22±0.032.42±0.04过氧化值/(mmol/kg)0.17±0.010.18±0.01硫代巴比妥酸值/(mg/kg)0.014±0.0020.016±0.002皂化值/(mg/g)179.82±0.07 178.27±1.01
2.5 两种提取方法下的青梅核仁油脂肪酸组成
表2为不同提取方法获得的油脂的脂肪酸组成。青梅核仁油以油酸(57.19%~57.98%),亚油酸(30.27%~31.07%)和棕榈酸(8.03%~8.14%)为主要脂肪酸;此外,含有少量硬脂酸(1.60%~1.62%)和α-亚麻酸(0.10%)。然而,这2种提取方法获得的青梅核仁油的脂肪酸组成和含量没有显著性差异(P>0.05)。由此可见,与有机溶剂法相比,微波辅助低液固比水剂法没有改变青梅核仁油的脂肪酸组成。由于油酸和棕榈酸的含量较高且具有高氧化稳定性,可将青梅核仁油作为油炸用油[25-26];亚油酸是人体的必需脂肪酸,具有抗氧化、抗癌和提高免疫力等功能[27],表明青梅核仁油具有广阔的应用前景。
表2 两种提取技术获得的青梅核仁油的脂肪酸组成 单位:%
Table 2 Fatty acid composition of green plum kernel oil obtained by two extraction techniques
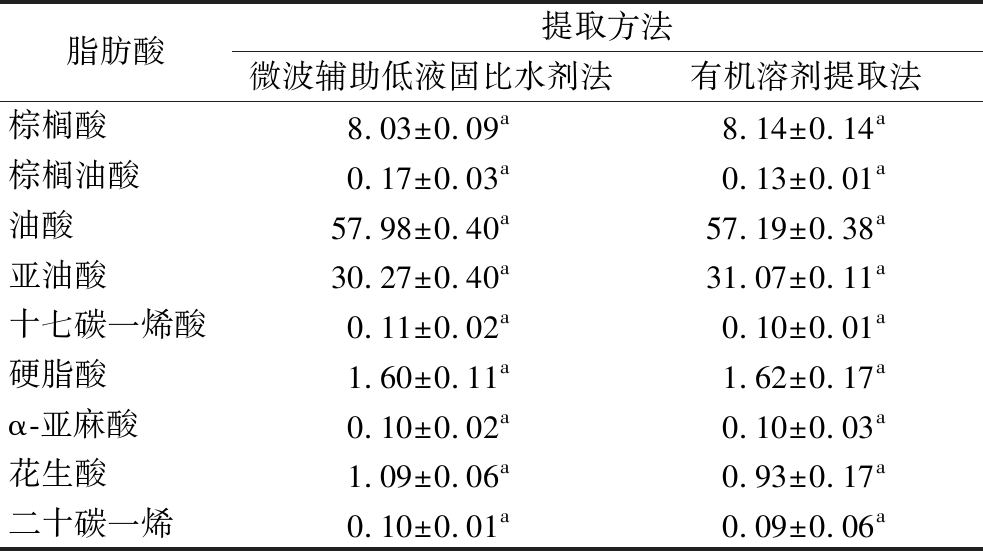
脂肪酸提取方法微波辅助低液固比水剂法有机溶剂提取法棕榈酸8.03±0.09a8.14±0.14a棕榈油酸0.17±0.03a0.13±0.01a油酸57.98±0.40a57.19±0.38a亚油酸30.27±0.40a31.07±0.11a十七碳一烯酸0.11±0.02a0.10±0.01a硬脂酸1.60±0.11a1.62±0.17aα-亚麻酸0.10±0.02a0.10±0.03a花生酸1.09±0.06a0.93±0.17a二十碳一烯0.10±0.01a0.09±0.06a
2.6 两种油脂提取方法对青梅核仁油色泽的影响
颜色是油脂质量的基本参数之一,并影响油脂的视觉接受度。图4为2种不同提取方法获得的青梅核仁油的L*、a*和b*值。2种提取方法提取的青梅核仁油的L*、a*和b*值均没有显著差异(P>0.05)。此外,有研究发现将微波加热用于提高油脂提取率时,随着加热时间从10 min延长到15 min,油脂的颜色可能会发生改变,色值会显著增加[28]。而青梅核仁在420 W、80 s的条件下进行微波预处理后通过低液固比水剂法提取得到的青梅核仁油颜色对比有机溶剂提取法得到的油颜色无明显变化,说明利用较短时间的微波辅助提取青梅核仁油时,不会影响提取油脂的色泽品质。
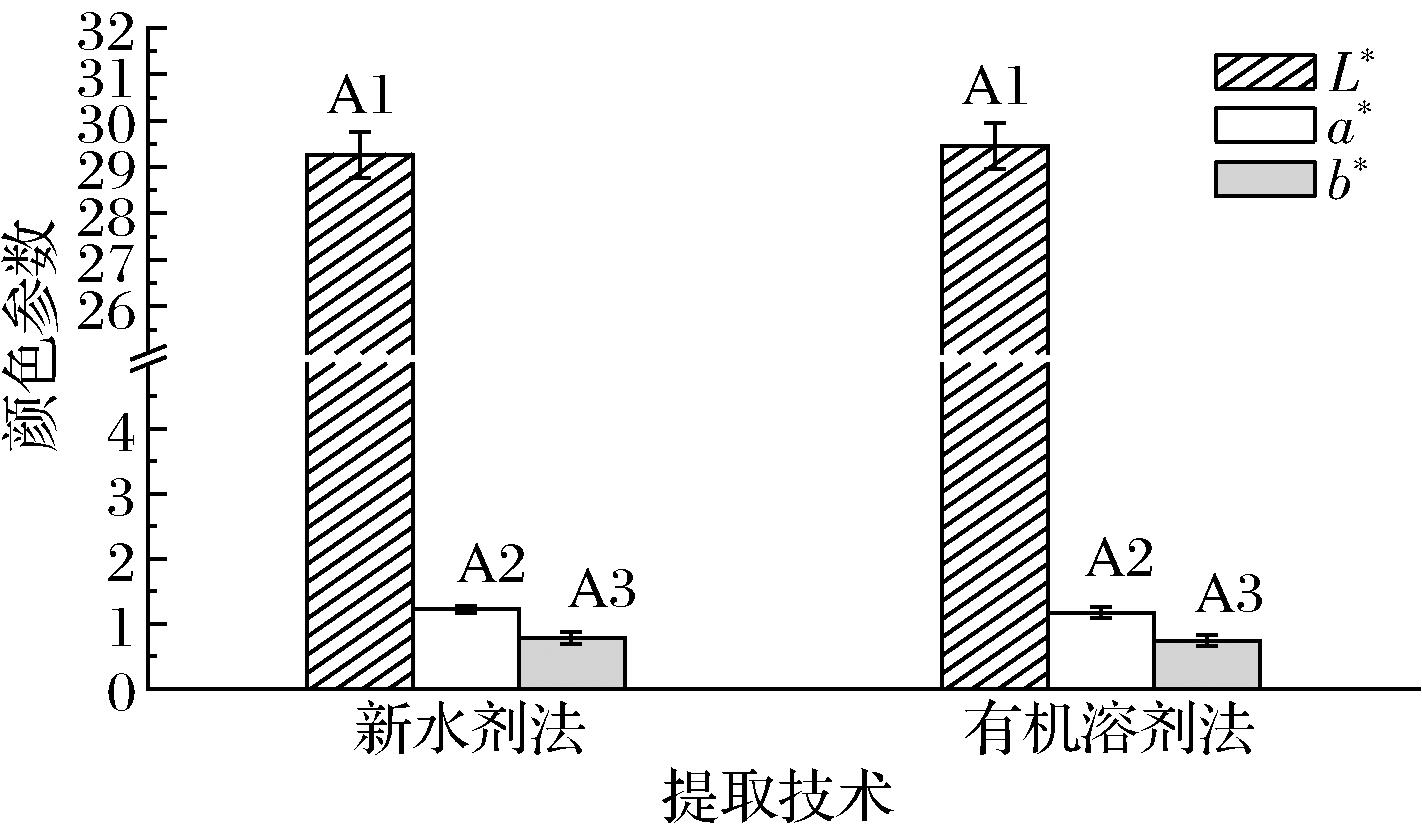
图4 通过2种提取技术获得的油的颜色
Fig.4 The color of the oil obtained by two extraction techniques
注:图中同一字母的A1、A2、A3分别表示不同提取方法下L*、a*、b*的差异不显著性(P>0.05)。
2.7 两种提取方法对青梅核仁油DPPH自由基清除率的影响
图5为不同提取方法对青梅核仁油DPPH自由基清除率的影响,油脂的DPPH自由基清除率一定程度上反映了油脂抗氧化能力。由图5可知,2种提取方法得到油脂均具有一定的DPPH自由基清除能力,这与油脂中的α-生育酚含量有关[29]。并且,与有机溶剂提取法相比,微波辅助低液固比水剂法提取的油脂的DPPH自由基清除率从6.18%提高至7.27%。表明在微波功率420 W、微波时间80 s的条件下,有利于α-生育酚等抗氧化活性物质的溶出,但差异不显著(P>0.05)。
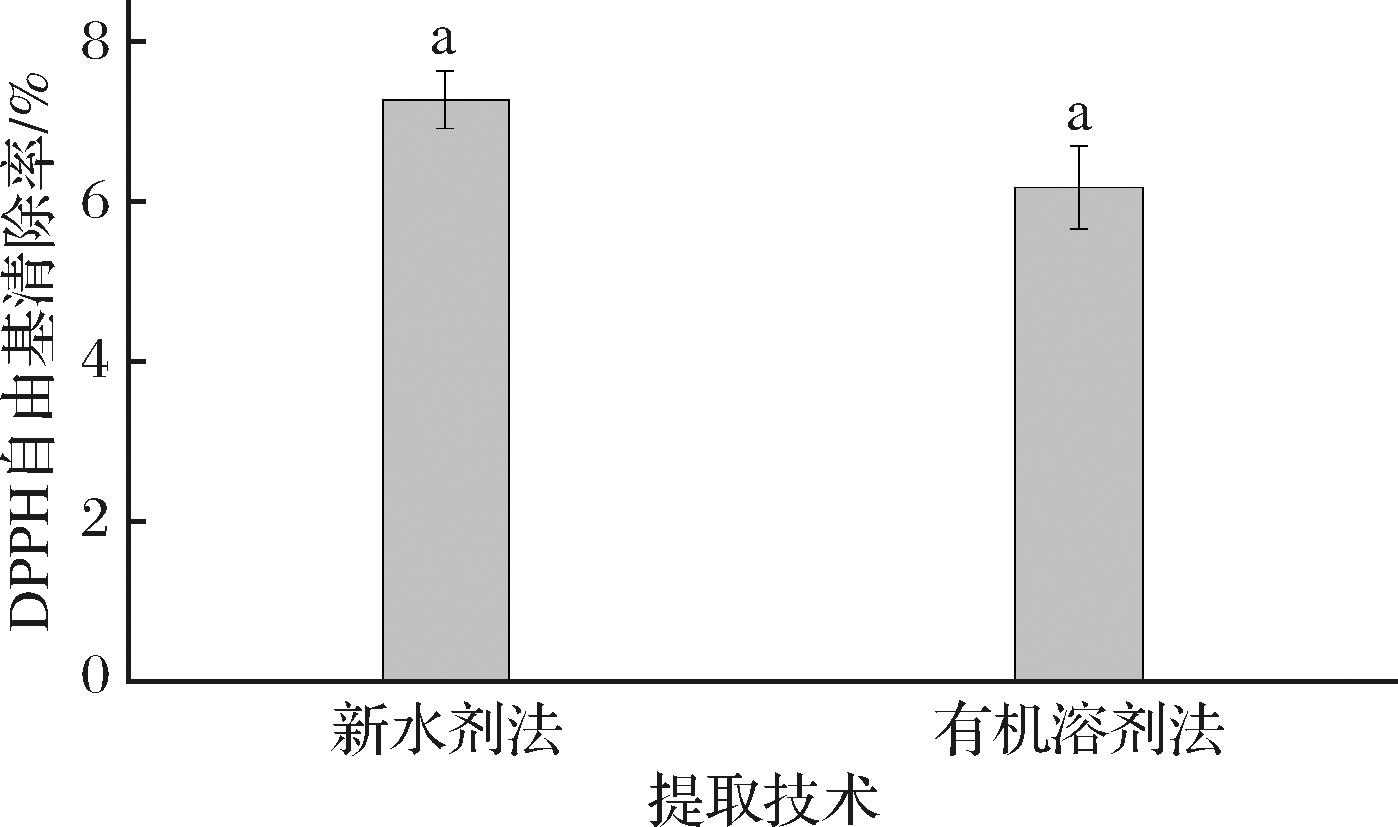
图5 由2种提取方法获得的DPPH自由基清除率
Fig.5 DPPH free radical scavenging rate obtained by the two extraction techniques
3 结论
本文探究了微波辅助低液固比水剂法提取青梅核仁油的影响因素及其对油脂理化性质的影响。在低液固比(mL∶g)0.14时,油提取率最高(83.00%),是高液固比(mL∶g)1(传统水剂法)的1.34倍;青梅核仁粉在420 W的微波功率下预处理80 s后,青梅核仁油的提取率提高了11.34%,同时在NaCl质量浓度为0.08 g/mL时达到最大提取率(88.27%)。此外,与有机溶剂提取法相比,微波辅助低液固比水剂法提取得到的青梅核仁油具有更低的酸价(2.22 mg/g)、硫代巴比妥酸值(0.014 mg/kg)和过氧化值(0.17 mmol/kg)。这些结果表明微波辅助低液固比水剂法能够有效的提取青梅核仁油,并在一定程度上提高青梅核仁油的品质,为微波辅助低液固比水剂法在油脂提取中的应用提供了一定的理论参考。
[1] 蒋维, 舒晓燕, 王玉霞, 等.四川主产区不同品种青梅果实品质分析[J].食品工业科技, 2023,44(16):321-330.JIANG W, SHU X Y, WANG Y X, et al.Analysis on fruit quality of different varieties of Prunus mume in Sichuan[J].Science and Technology of Food Industry, 2023,44(16):321-330.
[2] 洪佳敏, 吴水金, 吴妙鸿, 等.青梅加工研究进展[J].粮食与油脂, 2022, 35(10):9-12.HONG J M, WU S J, WU M H, et al.Research processing in the processing of green plum[J].Cereals &Oils, 2022, 35(10):9-12.
[3] 彭家伟, 曹荣冰, 刘幼强.青梅酒加工工艺及相关技术研究进展[J].酿酒科技, 2022, 336(6):94-98.PENG J W, CAO R B, LIU Y Q.Research progress in the production technology of greengage wine[J].Liquor-Making Science &Technology, 2022, 336(6):94-98.
[4] 余洋洋, 徐玉娟, 余元善, 等.青梅的营养健康效应研究进展[J].现代农业科技, 2020, 781(23):215-218.YU Y Y, XU Y J, YU Y S, et al.Research progress on nutritional and health effects of Prunus mume[J].Modern Agricultural Sciences and Technology, 2020(23):215-218.
[5] 文慧依, 张鹰, 王琴, 等.青梅核仁毛油精炼工艺及脂肪酸组成成分的综合研究[J].食品科技, 2017, 42(11):206-210.WEN H Y, ZHANG Y, WANG Q, et al.Research of plum kernel oil refining process and its fatty acid composition[J].Food Science and Technology, 2017, 42(11):206-210.
[6] 吴群中. 青梅核仁油提取工艺及理化特性的研究[D].福州:福建农林大学, 2010.WU Q Z.Study on extraction technology and physical-chemical characteristics of plum kernel oil [D].Fuzhou:Fujian Agriculture and Forestry University, 2010.
[7] ESMAEILZ ADEH KENARI R, DEHGHAN B.Optimization of ultrasound-assisted solvent extraction of hemp (Cannabis sativa L.) seed oil using RSM:Evaluation of oxidative stability and physicochemical properties of oil[J].Food Science &Nutrition, 2020, 8(9):4976-4986.
[8] ![]() M D,
M D, ![]() N M, et al.Optimization and kinetic modeling of esterification of the oil obtained from waste plum stones as a pretreatment step in biodiesel production[J].Waste Management, 2016, 48:619-629.
N M, et al.Optimization and kinetic modeling of esterification of the oil obtained from waste plum stones as a pretreatment step in biodiesel production[J].Waste Management, 2016, 48:619-629.
[9] VLADI J, GAVARI
J, GAVARI A, JOKI
A, JOKI S, et al.Alternative to conventional edible oil sources:Cold pressing and supercritical CO2 extraction of plum (Prunus domestica L.) kernel seed[J].Acta Chimica Slovenica, 2020, 67(3):778-784.[10] MATYUSOFF M, GORDON M H, NIRANJAN K.Aqueous enzyme assisted oil extraction from oilseeds and emulsion de-emulsifying methods:A review[J].Trends in Food Science &Technology, 2015, 41(1):60-82.
S, et al.Alternative to conventional edible oil sources:Cold pressing and supercritical CO2 extraction of plum (Prunus domestica L.) kernel seed[J].Acta Chimica Slovenica, 2020, 67(3):778-784.[10] MATYUSOFF M, GORDON M H, NIRANJAN K.Aqueous enzyme assisted oil extraction from oilseeds and emulsion de-emulsifying methods:A review[J].Trends in Food Science &Technology, 2015, 41(1):60-82.
[11] LI X J, LI Z G, WANG X, et al.Application of cavitation system to accelerate aqueous enzymatic extraction of seed oil from Cucurbita pepo L.and evaluation of hypoglycemic effect[J].Food Chemistry, 2016, 212:403-410.
[12] JIAO J, LI Z G, GAI Q Y, et al.Microwave-assisted aqueous enzymatic extraction of oil from pumpkin seeds and evaluation of its physicochemical properties, fatty acid compositions and antioxidant activities[J].Food Chemistry, 2014, 147:17-24.
[13] PICURIC-JOVANOVIC K, VRBASKI Z, MILOVANOVIC M.Influence of the aqueous-enzymatic method on the oxidative stability of plum kernel oil[J].Lipid-Fett, 1999, 101(3):109-112.
[14] 钟俊桢, 顿儒艳, 胡旭涛, 等.水剂法提取腰果油工艺条件研究[J].中国粮油学报, 2016, 31(1):31-35;42.ZHONG J Z, DUN R Y, HU X T, et al.Extraction of cashew nuts oil and its physicochemical properties[J].Journal of the Chinese Cereals and Oils Association, 2016, 31(1):31-35;42.
[15] LYU M, WU W B.An advanced aqueous method of extracting rapeseed oil with high quality[J].Journal of Food Process Engineering, 2019, 42(2):e12957.
[16] TU J C, WU W B, YANG J F, et al.A method of producing edible oils with high quality by water[J].Journal of Food Processing and Preservation, 2017, 41(6):e13280.
[17] TU J C, WU W B.Critical functional properties of defatted peanut meal produced by aqueous extraction and conventional methods[J].Journal of Food Science and Technology, 2019, 56(10):4722-4731.
[18] FU S T, WU W B.Optimization of conditions for producing high-quality oil and de-oiled meal from almond seeds by water[J].Journal of Food Processing and Preservation, 2019, 43(8):e14050.
[19] TU J, WU W.Establishment of an aqueous method for extracting soybean oils assisted by adding free oil[J].Grasas y Aceites, 2019, 70(3):313.
[20] 付家园, 吴文标.微波与烤箱烘烤灭酶对新水剂法提取南瓜籽油的影响[J].中国油脂, 2022, 47(1):4-9.FU J Y, WU W B.Effect of microwave and oven baking to inactivate enzyme on the extraction of pumpkin seed oil with new aqueous method[J].China Oils and Fats, 2022, 47(1):4-9.
[21] 李可, 赵颖颖, 康壮丽, 等.NaCl对猪肉糜加工特性和蛋白质二级结构的影响[J].食品科学, 2017, 38(15):77-81.LI K, ZHAO Y Y, KANG Z L, et al.Effect of NaCl on processing characteristics and protein secondary structures in pork meat batters[J].Food Science, 2017, 38(15):77-81.
[22] LYU M, WU W.Development of a new aqueous procedure for efficiently extracting high quality Camellia oleifera oil[J].Industrial Crops and Products, 2019, 138:111583.
[23] MAHESHWARI P N, STANLEY D W, VANDEVOORT F R, et al.Effect of microwave treatment on the microstructure of dehulled rapeseed[J].Cereal Chemistry, 1981, 58(5):381-384.
[24] PATEL A, MIKES F, MATSAKAS L.An overview of current pretreatment methods used to improve lipid extraction from oleaginous microorganisms[J].Molecules, 2018, 23(7):1562.
[25] ROMAN O, HEYD B, BROYART B, et al.Oxidative reactivity of unsaturated fatty acids from sunflower, high oleic sunflower and rapeseed oils subjected to heat treatment, under controlled conditions[J].LWT-Food Science and Technology, 2013, 52(1):49-59.
[26] ZRIBI A, JABEUR H, MATTH US B, et al.Quality control of refined oils mixed with palm oil during repeated deep-frying using FT-NIRS, GC, HPLC, and multivariate analysis[J].European Journal of Lipid Science and Technology, 2016, 118(4):512-523.
US B, et al.Quality control of refined oils mixed with palm oil during repeated deep-frying using FT-NIRS, GC, HPLC, and multivariate analysis[J].European Journal of Lipid Science and Technology, 2016, 118(4):512-523.
[27] 陈俊龙, 崔雨同, 郑娱洁, 等.不同提取方法对栀子籽油品质的影响[J].中国粮油学报, 2022, 37(1):96-100.CHEN J L, CUI Y T, ZHENG Y J, et al.Effects of different extraction methods on quality of Gardenia seed oil[J].Journal of the Chinese Cereals and Oils Association, 2022, 37(1):96-100.
[28] ANJUM F, ANWAR F, JAMIL A, et al.Microwave roasting effects on the physico-chemical composition and oxidative stability of sunflower seed oil[J].Journal of the American Oil Chemists Society, 2006, 83(9):777-784.
[29] RUTTARATTANAMONGKOL K, SIEBENHANDL-EHN S, SCHREINER M, et al.Pilot-scale supercritical carbon dioxide extraction, physico-chemical properties and profile characterization of Moringa oleifera seed oil in comparison with conventional extraction methods[J].Industrial Crops and Products, 2014, 58:68-77.