纳米氧化锌(zinc oxide nanoparticles, ZnONPs)是一种粒径为1~100 nm的纳米材料,以低剂量应用于畜牧生产中,既可以解决动物体对锌的需求量,也可以抑制有害微生物[1]。考虑到生产成本等因素,商业多采用直接沉淀法制备ZnONPs,但产品存在易团聚、结构与形态可控性较差、粒径大且分布较宽、价值较低等问题[2]。大量研究表明,表面活性剂在纳米材料制备中可以起到稳定剂、分散剂的作用,对产品的尺寸、形貌、分散性等特征具有积极影响[3-4]。目前,已有研究人员将鼠李糖脂[5]、槐糖脂[6]、蔗糖酯[7]等糖脂类表面活性剂用于纳米颗粒的合成修饰,发现其可以提高产品的溶解度和分散性[8]。甘露糖赤藓糖醇脂(mannosylerythritol lipids, MELs)是一种绿色、安全的糖脂类生物表面活性剂,常分为A、B、C、D 4种构型,其中MEL-A是多数MELs生产菌合成的主要产物,具有表面和界面活性强[9]、抗菌活性[10]等多种优良特性,在抗菌纳米颗粒合成中初步应用研究并取得良好效果。WU等[11]以MELs作为乳化剂用于包埋香椿精油的壳聚糖纳米颗粒合成,BAKUR等[12]用MELs绿色合成了纳米金,均对多种革兰氏阳性菌及革兰氏阴性菌表现出较好的抗菌活性。然而,目前关于MEL-A在纳米氧化锌合成中的应用研究较少。
金黄色葡萄球菌(Staphylococcus aureus)及大肠杆菌(Escherichia coli)是常见的人畜共患条件致病菌,可通过产生毒素污染食品、饲料等引起食物中毒或机体感染,常作为评价食品、饲料卫生质量的指示菌。目前,传统的有害微生物防控技术存在一定局限性,如物理性防控技术要求高、能耗成本较大、且对食品品质存在损害等,而传统化学防腐剂的应用存在易在食品中残留、引入新的食品安全风险等问题[13]。因此,开发具有绿色、安全、高效等特点的新型防控技术并在食品、饲料等产品中应用成为当前的需求和发展趋势。
本文将MEL-A用于ZnONPs的制备中,利用紫外/红外光谱、X射线衍射、纳米粒度、Zeta电位和透射电镜-能谱等方法对合成的ZnONPs进行表征,以金黄色葡萄球菌和大肠杆菌为试验菌株,评价制备ZnONPs的抗菌活性。以期拓宽MEL-A的应用范围,为MEL-A利用空间位阻效应解决抑制ZnONPs粘连多、易团聚、分散性差等问题提供参考,为提高ZnONPs复合材料的抗菌活性和应用价值提供可能。
1 材料与方法
1.1 材料
六水合硝酸锌,天津市风船化学试剂科技有限公司;氢氧化钠、蛋白胨、牛肉膏、氯化钠,北京奥博星生物技术有限责任公司;以上试剂均为分析纯。
实验菌株:金黄色葡萄球菌(Staphylococcus aureus ATCC 6538),大肠杆菌(Escherichia coli ATCC 25922),北京保藏生物科技有限公司。
营养肉汤培养基配方(g/L):蛋白胨3.0、牛肉膏5.0、氯化钠3.0,pH 7.0。
1.2 仪器与设备
85-2数显恒温磁力搅拌器,华峰仪器有限公司;SPARK酶标仪,澳大利亚Tecan公司;ZQZY-C8振荡培养箱,上海知楚仪器有限公司;JEM 100F透射电子显微镜,日本JEOL公司;Nicolet6700傅里叶变换红外仪,美国Thermlo Fisher Scientific公司;Minifle×600 X射线衍射仪,日本理学公司;BeNano 90 Zeta纳米粒度及Zeta电位分析仪,丹东百特仪器有限公司;UV-2550紫外分光光度计,日本岛津公司。
1.3 MEL-A和ZnONPs的制备
1.3.1 MEL-A的制备
利用蚜虫莫氏黑粉菌(Moesziomyces aphidis)发酵合成MEL-A,发酵培养基配方为:KH2PO4 0.3 g,酵母提取粉1.0 g,NaNO33.0 g,Fe2SO4·7H2O 81.0 mg,大豆油80.0 mL,去离子水1 L[14]。发酵10 d后,用等体积乙酸乙酯与发酵液混合进行萃取,4 000 r/min离心5 min分离有机层,旋蒸后得MEL-A粗产物,再用V(甲醇)∶V(环己烷)=1∶1洗涤粗产物2次,取甲醇相进行旋蒸后,得MEL-A产物[15]。
1.3.2 ZnONPs的制备
参考SINGH等[16]的方法并做出改进,将浓度为0、0.062 5、0.125、0.250、0.500、1.000 mmol/L的MEL-A水溶液分别与0.1 mol/L的硝酸锌溶液以1∶1(体积比)混匀,在80 ℃下剧烈搅拌30 min,逐滴加入1.0 mol/L NaOH溶液,直至出现白色絮状物。5 000 r/min离心10 min,用超纯水和无水乙醇分别洗涤3次,60 ℃真空烘箱下干燥过夜,研磨后于500 ℃下煅烧2 h,得到淡黄色纳米氧化锌粉末,未添加MEL-A制备样品为对照组,命名为N-ZnONPs;添加MEL-A制备样品命名为nMEL-A-ZnONPs,其中n为MEL-A添加浓度(mmol/L);上述样品均属于ZnONPs。
1.4 纳米氧化锌的表征
1.4.1 紫外可见光谱测定
将制备得到的ZnONPs粉末用蒸馏水稀释至0.1 g/L,测定其在200~800 nm下的吸光度。
1.4.2 X-射线衍射测定
将ZnONPs样品充分研磨,用X射线衍射仪在40 kV和40 mA的Cu-Kα辐射下,以2°/min的扫描速度从20°~80°的衍射角(2θ)进行样品粉末的结晶度及结构测量。
1.4.3 傅里叶红外光谱测定
用溴化钾压片法,将制备的ZnONPs与溴化钾以1∶100的质量比混合,并在高压下制成圆盘,于400~4 000 cm-1的波数下进行扫描。
1.4.4 粒径、多分散系数(polydispersity index,PDI)及Zeta电位测定
将制备好的ZnONPs用蒸馏水稀释至0.1 g/L,超声10 min后用纳米粒度及Zeta电位分析仪进行测定。
1.4.5 透射电子显微镜及X射线能谱分析
称取一定量ZnONPs粉末,以水和乙醇的混合液(体积比1∶1)作为溶剂,超声后取1~2滴于铜网支持的碳膜上,挥发后用透射电子显微镜进行形貌及粒径观察和测定,并用能谱点扫分析样品中元素组成及含量。
1.5 ZnONPs的抗菌活性评价
1.5.1 最低抑菌浓度及最小杀菌浓度的测定
采用二倍稀释法测定ZnONPs的最小抑菌浓度(minimum inhibitory concentration, MIC)及最小杀菌浓度(minimum bactericidal concentration, MBC)[17]。分别配制ZnONPs终浓度为0.0、2.0、4.0、8.0、12.0、16.0、20.0、24.0、28.0、32.0、48.0、64.0 mg/L的营养肉汤培养基,按1%(体积分数)接种金黄色葡萄球菌、大肠杆菌的菌悬液(OD600值约为0.70,菌体浓度约为1.0×106 CFU/mL),于37 ℃、180 r/min培养24 h,测定OD600,定义与初始OD600相比变化<5%的实验组中ZnONPs浓度为MIC,其中不含ZnONPs为对照组。将MIC测定所用培养后的菌液分别取100.0 μL 进行平板涂布和计数,定义菌落总数降低3个数量级(即杀灭菌体99.9%以上)的实验组(与对照组相比)对应ZnONPs浓度为MBC。
1.5.2 生长曲线的绘制
分别配制添加已选定ZnONPs的液体培养基,浓度分别为0(对照)、1/2MIC、MIC和MBC,接种菌液终浓度为1.0×106CFU/mL,37 ℃条件下培养,每隔2 h测定OD600,绘制24 h内的生长曲线。
1.5.3 牛津杯抑菌实验
采用牛津杯法评价ZnONPs对金黄色葡萄球菌、大肠杆菌的抑菌效果[18]。吸取100.0 μL菌悬液(1.0×106 CFU/mL)均匀涂布于固体平板上,将已灭菌的空牛津杯放置在培养基表面,加入200.0 μL浓度为1/2 MIC、MIC、MBC的ZnONPs溶液,以无菌水作为对照组,37 ℃培养24 h后,用游标卡尺测量抑菌圈直径。
1.6 数据处理与统计分析
采用Origin 2022 软件(OriginLab Corporation,USA)绘制曲线图,SPSS Statistics 20.0软件(IBM Corp, USA)进行单因素方差分析,P<0.05,差异显著。以上实验均为平行3次结果,用平均值±标准误差表示。
2 结果与分析
2.1 ZnONPs的表征
2.1.1 紫外可见光谱分析
对添加不同浓度MEL-A制备的ZnONPs进行紫外可见光谱扫描,结果见图1。可以看出,随MEL-A添加浓度的提高,合成产物最大吸收峰分别为384.58、382.34、380.78、380.78、382.34、385.45 nm,与文献报道结果接近,具有ZnONPs特征峰[19],说明合成产物为ZnONPs。根据量子限域效应可知,纳米颗粒粒径变小时,能量向高能方向转化,即发生蓝移现象。从图1可知,添加不同浓度MEL-A修饰制备的ZnONPs等离子共振吸收峰位均发生了一定程度的蓝移,且蓝移程度随MEL-A添加浓度增高呈现先增强后减弱的趋势,可以间接反映出ZnONPs粒径呈现出先降低后升高的趋势。
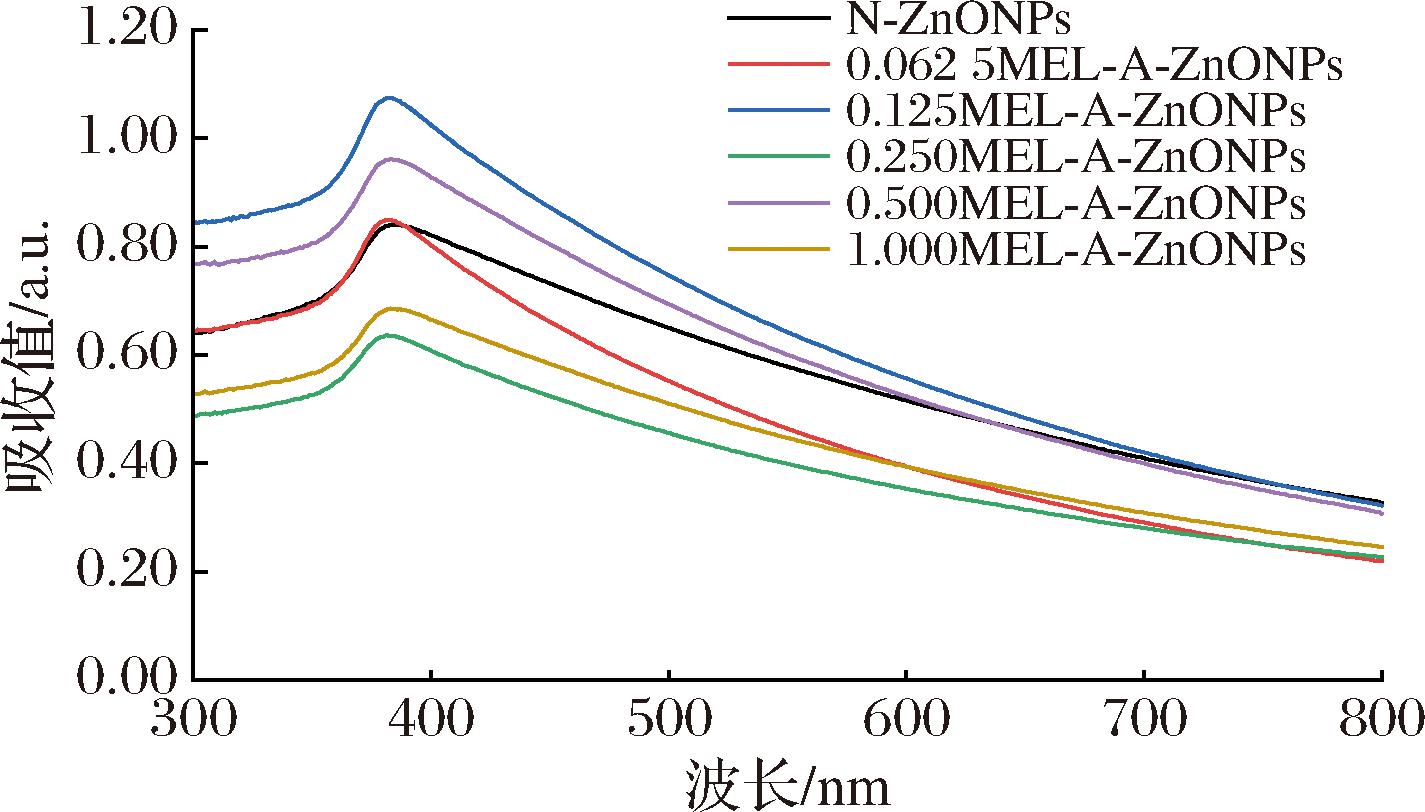
图1 不同MEL-A添加量制备ZnONPs的紫外可见光谱图
Fig.1 The UV-Vis spectrum of ZnONPs with different MEL-A additions
2.1.2 X-射线衍射分析
利用X-射线衍射仪对制备的样品进行分析,发现与JCPDS#99-0111标准图谱一致(图2),表明制备的ZnONPs为稳定性最强的六方纤锌矿结构,空间群归属为P63mc,晶格常数a=b=0.325 nm,c=0.521 nm,α=β=90°,γ=120°。ZnONPs图谱整体峰较为尖锐且无杂峰,说明制备的样品纯度较高,具有较大的晶体尺寸[20]。随着粒径减小,样品的XRD衍射峰变宽,强度减小,可能是晶粒尺寸减小到纳米尺度时,纳米晶体中的缺陷相对增加,点阵间距发生变化,晶体结晶度下降[7]。由图2-b局部角度放大图可知,随着MEL-A添加浓度的增大,衍射峰向大角度方向移动,晶面间距的降低,进一步说明了ZnONPs颗粒间聚集性降低。

a-全角度衍射图;b-局部角度放大图
图2 不同MEL-A添加量制备ZnONPs的XRD图谱
Fig.2 X-ray diffraction of ZnONPs with different MEL-A additions
2.1.3 傅里叶红外光谱分析
傅里叶红外光谱用于表征产物中官能团的变化情况结果见图3。MEL-A的红外谱图在3 009 cm-1的吸收峰归因于不饱和C—H伸缩振动,2 923.13 cm-1及2 853.65 cm-1处的吸收峰分别代表C—H不对称伸缩振动及亚甲基的对称伸缩振动,1 744.14 cm-1的吸收峰表示酯羰基伸缩振动,与MEL-A末端乙酰基相对应,1 463.57 cm-1处的吸收峰可能是由于C—H变形振动,1 377.75 cm-1的吸收峰表示—OH的面内变形振动,1 168.58 cm-1的吸收峰表示C—O伸缩振动,与MEL-A脂肪酸链末端羟基的结构一致[21]。经MEL-A修饰的纳米氧化锌其位于3 367.03 cm-1处有吸收峰,归因于—OH伸缩振动,1 394.05 cm-1处的吸收峰表示—OH的面内变形振动,1 041.00 cm-1处的吸收峰表示C—O伸缩振动,表明MEL-A对ZnONPs进行了成功修饰。此外,样品均在482.00 cm-1附近有吸收峰,是Zn—O的特征吸收峰,因此说明了ZnONPs的成功制备。对ZnONPs的特征图谱进行局部放大(图3-b),观察到482.00 cm-1处特征峰透过率随MEL-A添加浓度增大而逐步降低,可能是由于MEL-A分子内基团较大,分子结构中存在空间障碍,共轭受到限制,产生了空间位阻效应,导致透过率降低[22]。孙萍等[23]研究发现尺寸分布效应会使颗粒大小呈高斯分布,各个粒子表面张力不同,晶格膨胀程度不同,因此导致吸收峰宽化。
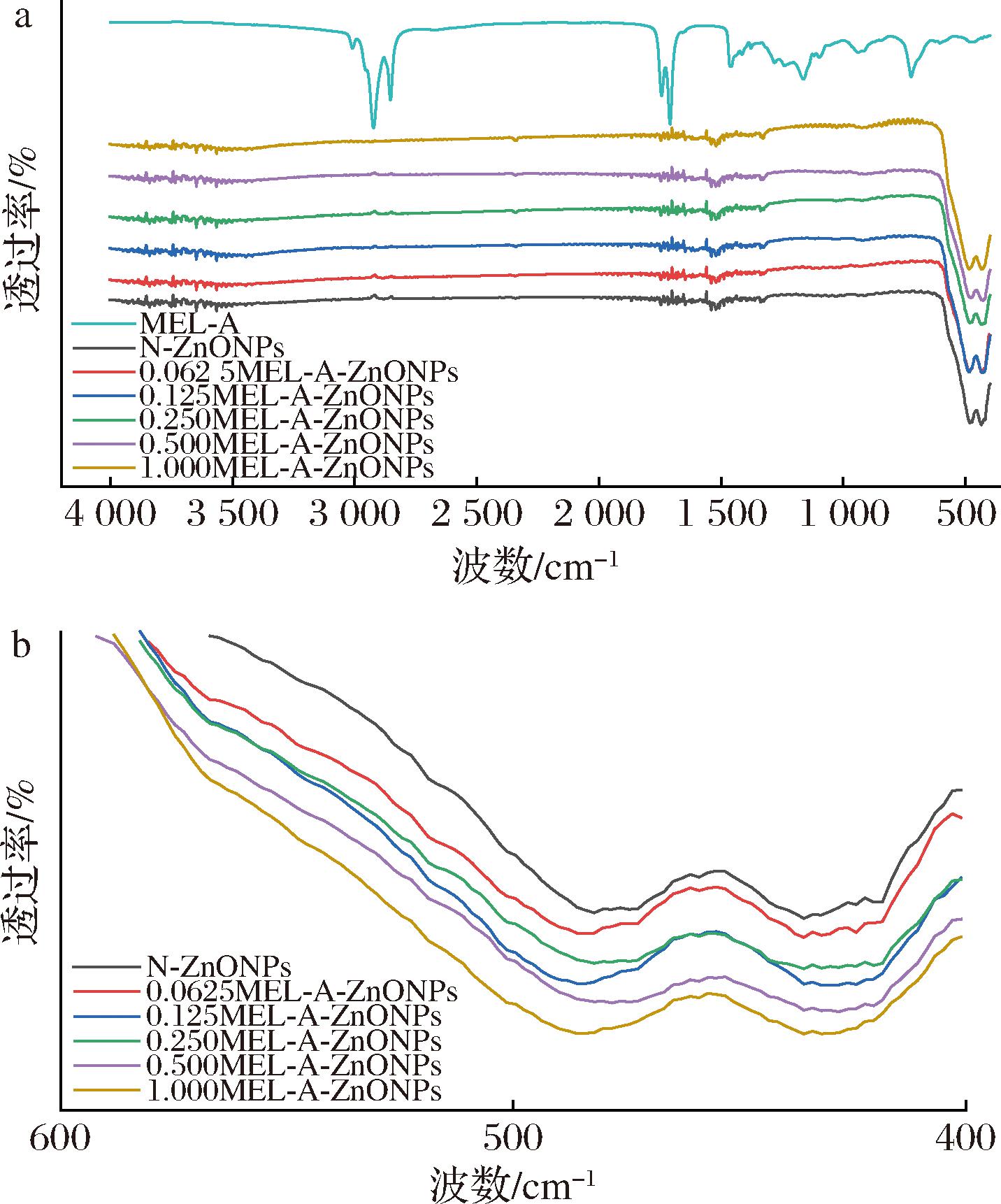
a-全波数红外图;b-局部波数放大图
图3 不同MEL-A添加量制备ZnONPs的傅里叶红外光谱图
Fig.3 Fourier transform infrared spectroscopy of ZnONPs with different MEL-A additions
2.1.4 粒径及Zeta电位分析
利用纳米粒度和Zeta电位分析仪表征所制备ZnONPs的颗粒大小、聚集状态及稳定性。由图4可知,随着MEL-A添加量的增加,ZnONPs的平均粒径表现为先减小后增大的趋势,但均显著低于对照组(P<0.05)。其中,0.125MEL-A-ZnONPs的平均粒径达到最小值(442.44±1.77) nm,其次0.250MEL-A-ZnONPs的平均粒径为(458.29±11.85) nm,但两者无显著性差异(P>0.05)。MEL-A是一种非离子表面活性剂,分子链通过化学键或物理吸附于ZnONPs表面,当颗粒相互接近时,分子链势能增大,可起到空间位阻效应,进而抑制ZnONPs微晶生长并起到稳定作用。但添加浓度过量时,反应体系黏度增大,不易完全洗脱,导致ZnONPs团聚性增大,造成溶液中测定的平均粒径增大。
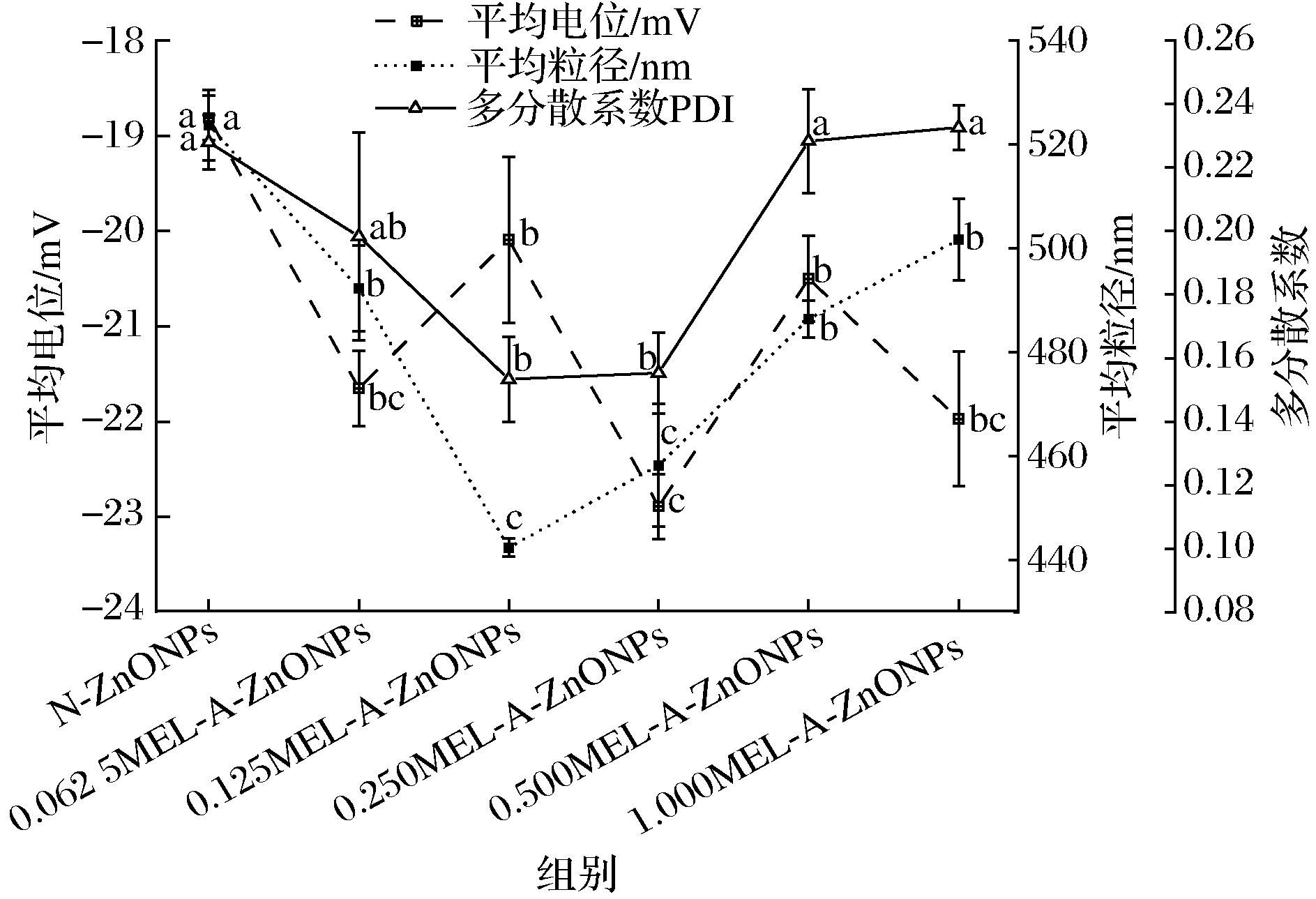
图4 MEL-A添加量对ZnONPs平均粒径、平均电位及多分散系数的影响
Fig.4 Effects of different MEL-A additions on the average size, average Zeta potential, and PDI of ZnONPs
注:不同小写字母代表差异显著(P<0.05)(下同)。
PDI的值越小表明纳米颗粒分散性越好[12]。随着MEL-A添加量的增大,ZnONPs的PDI值呈现出先降低后上升的趋势。当MEL-A添加量为0.250 mmol/L时,PDI达到最小值0.155,说明此时ZnONPs颗粒的分散性最好。
Zeta电位可反映粒子周围双层相关的表面电荷大小和性质,是纳米颗粒分散稳定性的关键指标[24]。较高Zeta电位表明颗粒间相互作用力较强,体系比较稳定,较低Zeta电位的颗粒易团聚,体系稳定性差。与空白组相比,添加MEL-A制备的ZnONPs平均电位绝对值均显著升高,其中0.250MEL-A-ZnONPs平均电位绝对值提高了21.69%,说明MEL-A修饰后可以提高ZnONPs溶液体系的稳定性,与粒径变化一致。
2.1.5 透射电子显微镜及能量色散X射线能谱(energy dispersive spectroscopy,EDS)分析
未加MEL-A修饰的N-ZnONPs为近球形颗粒,大小不均一,整体表现出较严重的团聚现象(图5),EDS分析发现制备的ZnONPs仅由Zn、O两种元素组成,且元素比为1∶1,与X射线洐射分析结果一致。通过软件分析ZnONPs的整体粒径分布位于50~250 nm,在125 nm处相对频率最高,平均粒径为(138.28±37.54) nm。利用透射电镜观察0.250MEL-A-ZnONPs(图5),发现颗粒呈近球形,整体粒径减小,分布为20~180 nm,在70 nm处相对频率最高,平均粒径为(78.25±27.26) nm,颗粒分散程度提高。因此,0.250 mmol/L MEL-A可以对ZnONPs起到修饰作用,有效改善ZnONPs的分散性,并减小产品的平均粒径。
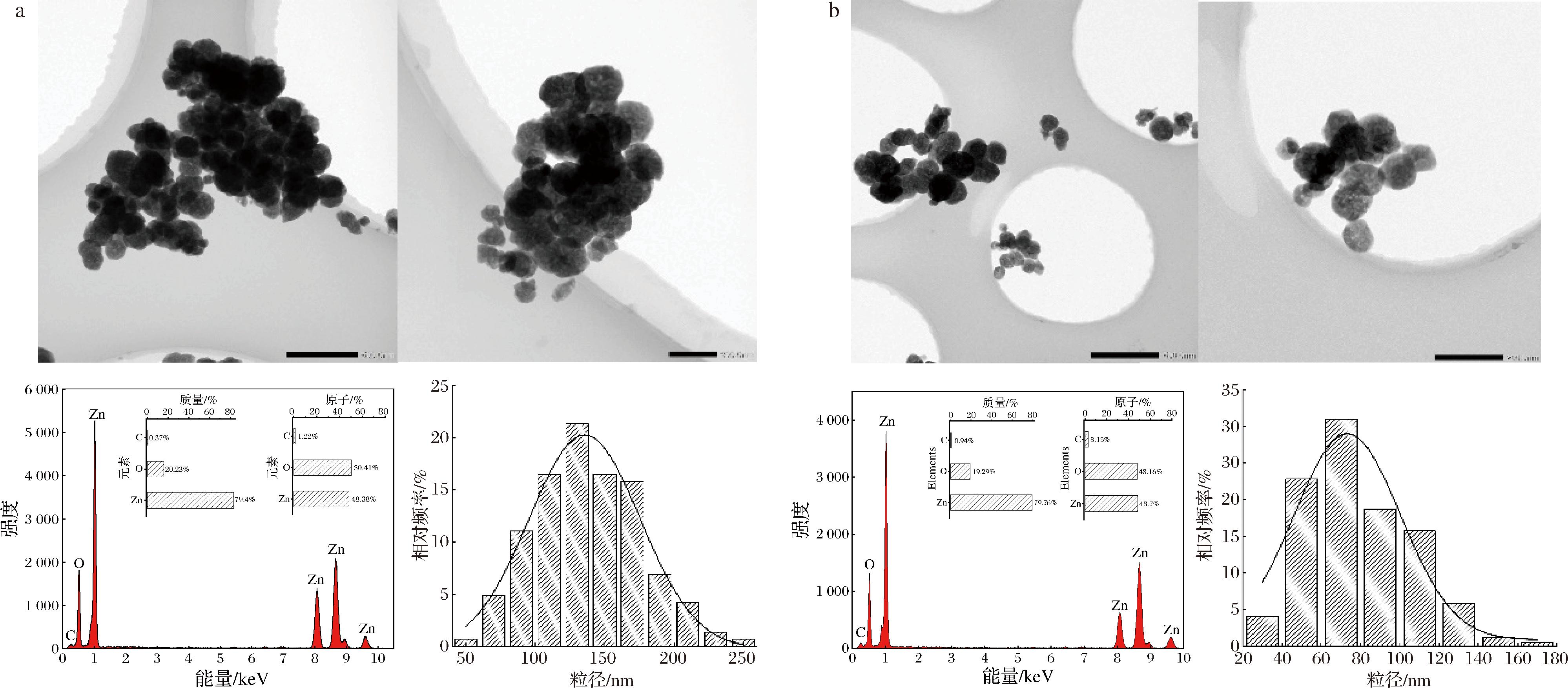
a-N-ZnONPs;b-0.250MEL-A-ZnONPs
图5 N-ZnONPs和0.250MEL-A-ZnONPs的透射电镜、EDS及粒径分布图
Fig.5 Transmission electron microscopy, EDS, and particle size distribution of N-ZnONPs and 0.250MEL-A-ZnONPs
2.2 ZnONPs对金黄色葡萄球菌和大肠杆菌的抗菌活性
2.2.1 MIC和MBC
由图6-a、图6-b可知,随着N-ZnONPs和0.250MEL-A-ZnONPs添加浓度的升高,OD600显著降低,添加量≥12.0 mg/L时,培养24 h后的OD600与初始值相比均无明显变化,表明N-ZnONPs与0.250MEL-A-ZnONPs对金黄色葡萄球菌的MIC均为12.0 mg/L。有文献报道蔗糖酯修饰合成的ZnONPs对金黄色葡萄球菌的MIC为0.3 g/L[25],说明MEL-A-ZnONPs对金黄色葡萄球菌具有更好的抗菌活性。由图6-c可知,随着N-ZnONPs及0.250MEL-A-ZnONPs处理组添加浓度的升高,OD600呈现出阶梯式降低的趋势,N-ZnONPs与0.250MEL-A-ZnONPs对大肠杆菌的MIC分别为24.0 mg/L和20.0 mg/L。

a、b-金黄色葡萄球菌;c、d-大肠杆菌
图6 N-ZnONPs和0.250MEL-A-ZnONPs对金黄色葡萄球菌、大肠杆菌的最小抑菌浓度
Fig.6 The minimal inhibitory concentrations of N-ZnONPs and 0.250MEL-A-ZnONPs against Staphylococcus aureus and Escherichia coli
不同浓度N-ZnONPs或0.250MEL-A-ZnONPs培养后的菌液平板计数结果见表1。未添加N-ZnONPs或0.250MEL-A-ZnONPs组中的金黄色葡萄球菌的菌落总数为(8.89±0.33) lg CFU/mL,N-ZnONPs添加量为24.0 mg/L时,0.250MEL-A-ZnONPs添加量为16.0 mg/L时,菌落总数分别降至(4.97±0.08) lg CFU/mL和(5.51±0.82) lg CFU/mL,均降低了3个数量级(即活菌数减少99.9%以上),表明N-ZnONPs和0.250MEL-A-ZnONPs对金黄色葡萄球菌的MBC分别为24.0 mg/L和16.0 mg/L。空白组中大肠杆菌的菌落总数为(9.50±0.07) lg CFU/mL,当N-ZnONPs添加量为32.0 mg/L时,0.250MEL-A-ZnONPs添加量为24.0 mg/L时,菌落总数分别降至(5.05±0.04) lg CFU/mL和(5.23±0.03) lg CFU/mL,表明N-ZnONPs和0.250MEL-A-ZnONPs对大肠杆菌的MBC分别为32.0 mg/L和24.0 mg/L。可见,0.250MEL-A-ZnONPs对金黄色葡萄球菌、大肠杆菌均表现出更强的杀菌活性,且对金黄色葡萄球菌的杀菌效果更好。
表1 N-ZnONPs和0.250MEL-A-ZnONPs对金黄色葡萄球菌、大肠杆菌的杀菌效果
Table 1 The sterilization of N-ZnONPs and 0.250MEL-A-ZnONPs on Staphylococcus aureus and Escherichia coli
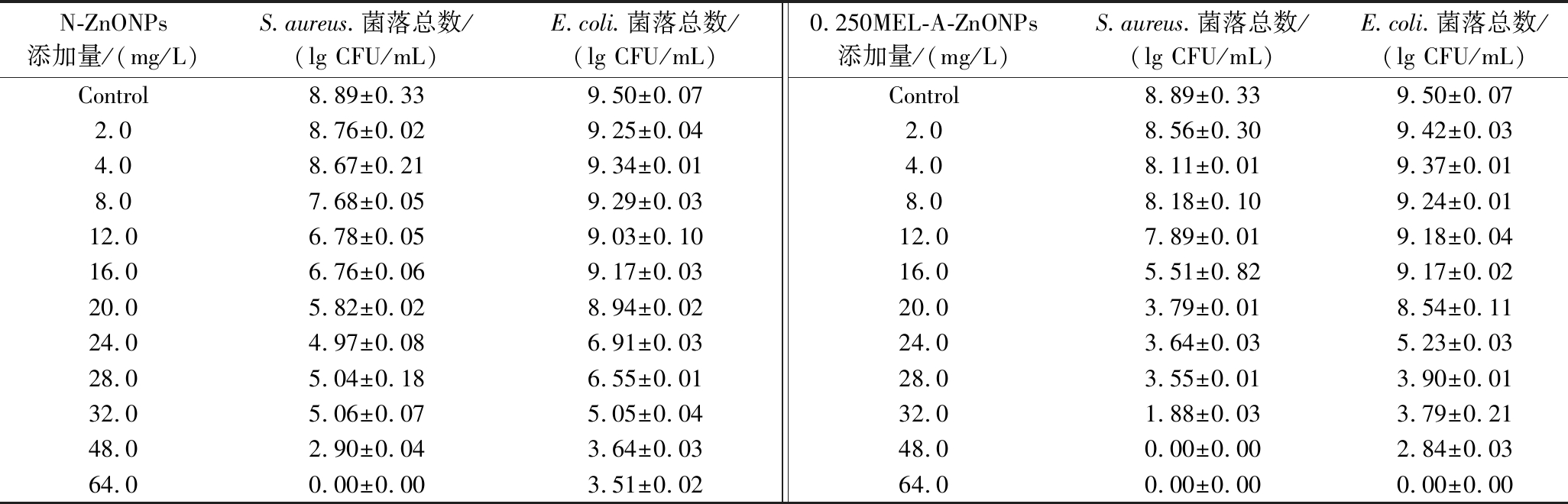
N-ZnONPs添加量/(mg/L)S.aureus.菌落总数/(lg CFU/mL)E.coli.菌落总数/(lg CFU/mL)0.250MEL-A-ZnONPs添加量/(mg/L)S.aureus.菌落总数/(lg CFU/mL)E.coli.菌落总数/(lg CFU/mL)Control8.89±0.339.50±0.07Control8.89±0.339.50±0.072.08.76±0.029.25±0.042.08.56±0.309.42±0.034.08.67±0.219.34±0.014.08.11±0.019.37±0.018.07.68±0.059.29±0.038.08.18±0.109.24±0.0112.06.78±0.059.03±0.1012.07.89±0.019.18±0.0416.06.76±0.069.17±0.0316.05.51±0.829.17±0.0220.05.82±0.028.94±0.0220.03.79±0.018.54±0.1124.04.97±0.086.91±0.0324.03.64±0.035.23±0.0328.05.04±0.186.55±0.0128.03.55±0.013.90±0.0132.05.06±0.075.05±0.0432.01.88±0.033.79±0.2148.02.90±0.043.64±0.0348.00.00±0.002.84±0.0364.00.00±0.003.51±0.0264.00.00±0.000.00±0.00
2.2.2 对菌体生长的影响
测定添加不同浓度N-ZnONPs或0.250MEL-A-ZnONPs时金黄色葡萄球菌及大肠杆菌的生长曲线,结果见图7。可以看出,2个实验菌株的生长曲线相近,空白组接种后的金黄色葡萄球菌及大肠杆菌0~4 h生长缓慢,属于生长延滞期,4 h后进入对数生长期,金黄色葡萄球菌持续到约14 h,大肠杆菌对数生长期持续时间到16 h,随后处于稳定生长期。加入1/2 MIC N-ZnONPs或0.250MEL-A-ZnONPs时,菌体生长受到显著抑制且具有相似的生长趋势,即8 h后进入对数生长期,持续到约20 h,随后进入稳定期,此时OD600均显著低于空白组,且0.250MEL-A-ZnONPs处理组的OD600更小,说明0.250MEL-A-ZnONPs的抗菌活性更高。而加入N-ZnONPs或0.250MEL-A-ZnONPs的MIC组培养基未出现浑浊现象,且OD600与0 h相比未见显著变化,说明金黄色葡萄球菌及大肠杆菌在此时间段内的生长受到完全抑制。

a-金黄色葡萄球菌;b-大肠杆菌
图7 N-ZnONPs和0.250MEL-A-ZnONPs对金黄色葡萄球菌、大肠杆菌生长的影响
Fig.7 The effects of N-ZnONPs and 0.250MEL-A-ZnONPs on the growth of Staphylococcus aureus and Escherichia coli
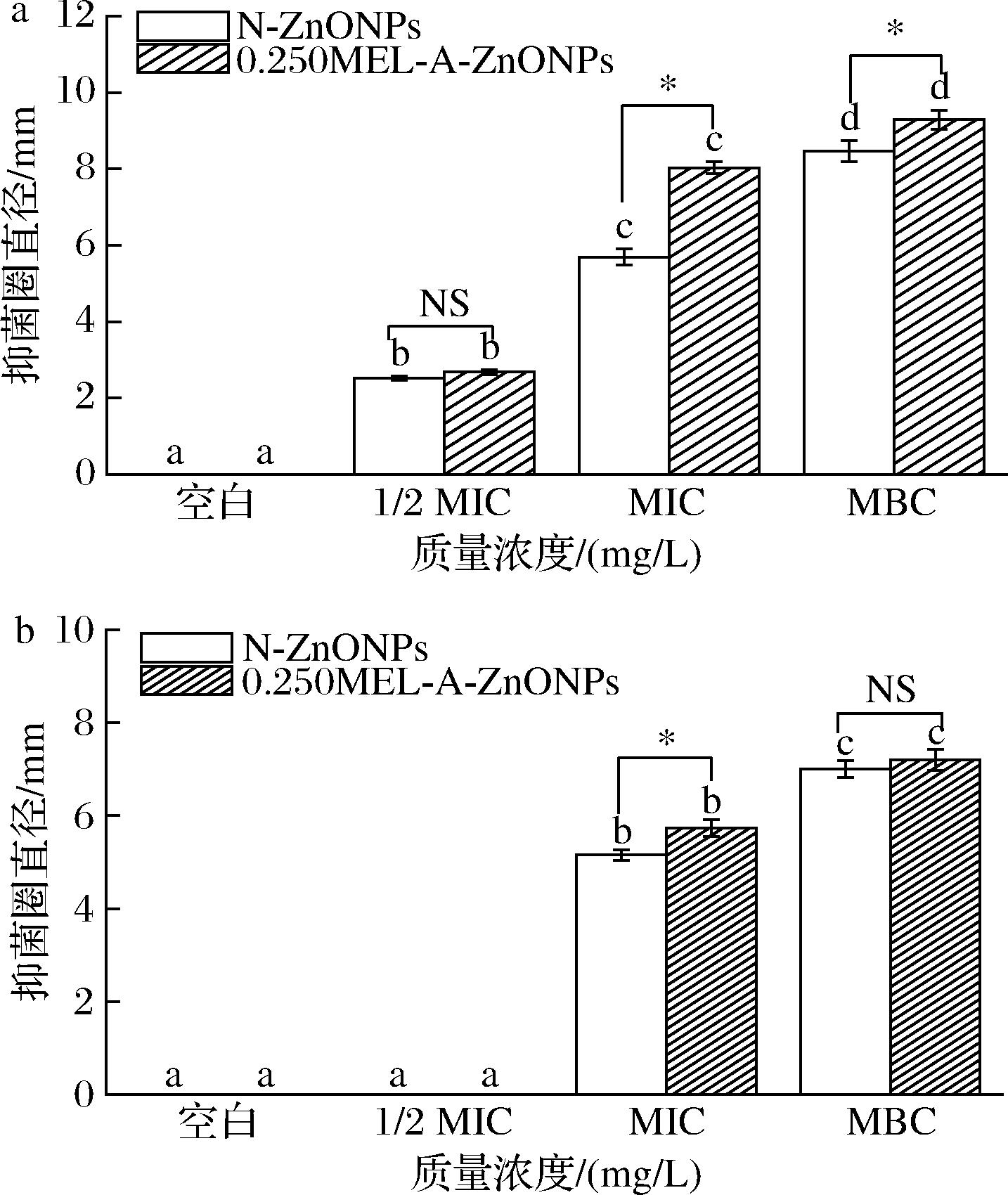
a-金黄色葡萄球菌;b-大肠杆菌
图8 N-ZnONPs和0.250MEL-A-ZnONPs对金黄色葡萄球菌、大肠杆菌的抑菌圈直径
Fig.8 The diameter of inhibition zone of N-ZnONPs and 0.250MEL-A-ZnONPs against S.aureus and E.coli
注:不同字母表示同处理不同浓度间存在显著差异。*表示同浓度不同处理存在显著差异(P<0.05),NS表示无显著性差异。
2.2.3 抑菌圈实验
由图8可知,空白组未出现明显的抑菌圈,抑菌圈直径随N-ZnONPs、0.250MEL-A-ZnONPs添加量增高而显著增大(P<0.05),说明制备的N-ZnONPs和0.250MEL-A-ZnONPs对固体培养基表面生长的金黄色葡萄球菌及大肠杆菌菌落也具有良好抗菌活性,且0.250MEL-A-ZnONPs的抗菌效果更佳。
3 结论
将MEL-A用于ZnONPs的制备中,获得N-ZnONPs和MEL-A-ZnONPs,并进行结构、粒径和稳定性表征。结果表明,MEL-A可以实现对ZnONPs的修饰。低浓度MEL-A(<0.500 mmol/L)可以降低ZnONPs粒径,并提高其稳定性和分散性,而高浓度MEL-A(≥0.500 mmol/L)的作用相反。添加0.250 mmol/L的MEL-A时,测得的MEL-A-ZnONPs平均粒径达到最小为(78.25±27.26) nm,分散性和稳定性最好。进行金黄色葡萄球菌和大肠杆菌的抗菌活性评价,发现N-ZnONPs和MEL-A-ZnONPs对金黄色葡萄球菌的MIC均为12.0 mg/L,MBC分别为24.0 mg/L和16.0 mg/L,对大肠杆菌的MIC分别为24.0 mg/L和20.0 mg/L,MBC分别为32.0 mg/L和24.0 mg/L。本研究为解决ZnONPs易团聚问题提供一种新选择,也为糖脂应用于纳米抗菌材料的绿色合成中提供参考,但MEL-A-ZnONPs的抗菌机制及实际应用仍需进一步研究。
[1] 李海东, 田冰, 宋杨, 等.金属氧化物纳米颗粒在食品中的应用及安全性研究[J].食品与发酵工业, 2022, 48(24):312-318.LI H D, TIAN B, SONG Y, et al.Research on the application and safety of metal oxide nanoparticles in food[J].Food and Fermentation Industries, 2022, 48(24):312-318.
[2] 马梦婷. 绿色合成氧化锌/凹凸棒石纳米复合材料的抗菌性能及机制研究[D].兰州:兰州大学, 2022.MA M T.Study on antibacterial properties and mechanism of green synthetic zinc oxide/attapulgite nanocomposites[D].Lanzhou:Lanzhou University, 2022.
[3] GAYATHIRI E, PRAKASH P, KARMEGAM N, et al.Biosurfactants:Potential and eco-friendly material for sustainable agriculture and environmental safety-A review[J].Agronomy, 2022, 12(3):662.
[4] BRADY N G, O′LEARY S L, MOORMANN G C, et al.Mycosynthesis of zinc oxide nanoparticles exhibits fungal species dependent morphological preference[J].Small, 2023, 19(15):2370101.
[5] MALAKAR C, PATOWARY K, DEKA S, et al.Synthesis, characterization, and evaluation of antibacterial efficacy of rhamnolipid-coated zinc oxide nanoparticles against Staphylococcus aureus[J].World Journal of Microbiology &Biotechnology, 2021, 37(11):193.
[6] KASTURE M B, PATEL P, PRABHUNE A A, et al.Synthesis of silver nanoparticles by sophorolipids:Effect of temperature and sophorolipid structure on the size of particles[J].Journal of Chemical Sciences, 2008, 120(6):515-520.
[7] 韦巧艳. 蔗糖酯—纳米ZnO的制备及其应用研究[D].南宁:广西大学, 2012.WEI Q Y.Study on preparation and application of sucrose ester-nano-ZnO[D].Nanning:Guangxi University, 2012.
[8] KITAMOTO D, AKIBA S, HIOKI C, et al.Extracellular accumulation of mannosylerythritol lipids by a strain of Candida antarctica[J].Agricultural and Biological Chemistry, 1990, 54(1):31-36.
[9] 朱文昌, 陈坚, 华兆哲, 等.甘露赤藓糖醇脂的微生物生产[J].工业微生物, 1998, 28(1):32-37.ZHU W C, CHEN J, HUA Z Z, et al.Microbial production of mannose erythritol[J].Industrial Microbiology, 1998, 28(1):32-37.
[10] TAKAHASHI M, MORITA T, FUKUOKA T, et al.Glycolipid biosurfactants, mannosylerythritol lipids, show antioxidant and protective effects against H2O2-induced oxidative stress in cultured human skin fibroblasts[J].Journal of Oleo Science, 2012, 61(8):457-464.
[11] WU J N, SHU Q, NIU Y W, et al.Preparation, characterization, and antibacterial effects of chitosan nanoparticles embedded with essential oils synthesized in an ionic liquid containing system[J].Journal of Agricultural and Food Chemistry, 2018, 66(27):7006-7014.
[12] BAKUR A, NIU Y W, KUANG H, et al.Synthesis of gold nanoparticles derived from mannosylerythritol lipid and evaluation of their bioactivities[J].AMB Express, 2019, 9(1):62.
[13] 徐重新, 陈蔚, 谢雅晶, 等.食品中金黄色葡萄球菌检测及防控技术研究[J].农产品质量与安全, 2019(3):49-56.XU C X, CHEN W, XIE Y J, et al.Detection and prevention and control technology on Staphylococcus aureus in food[J].Quality and Safety of Agro-Products, 2019(3):49-56.
[14] 牛永武. 蚜虫莫氏黑粉菌发酵产甘露糖赤藓糖醇脂的代谢调控及其群体感应机理研究[D].杭州:浙江大学, 2019.NIU Y W.Metabolic regulation and quorum sensing mechanism of mannose erythritol produced by Myzus molitor, an aphid[D].Hangzhou:Zhejiang University, 2019.
[15] FAN L L, LI H J, NIU Y W, et al.Characterization and inducing melanoma cell apoptosis activity of mannosylerythritol lipids-A produced from Pseudozyma aphidis[J].PLoS One, 2016, 11(2):e0148198.
[16] SINGH B N, RAWAT A K S, KHAN W, et al.Biosynthesis of stable antioxidant ZnO nanoparticles by Pseudomonas aeruginosa rhamnolipids[J].PLoS One, 2014, 9(9):e106937.
[17] BALOUIRI M, SADIKI M, IBNSOUDA S K.Methods for in vitro evaluating antimicrobial activity:A review[J].Journal of Pharmaceutical Analysis, 2016, 6(2):71-79.
[18] HITCHCOCK D J.The inhibition of bacteria by the metabolic products of trichomonads[J].The Journal of Parasitology, 1948, 34(2):114-118.
[19] ABDELSATTAR A S, KAMEL A G, HUSSEIN A H, et al.The promising antibacterial and anticancer activity of green synthesized zinc nanoparticles in combination with silver and gold nanoparticles[J].Journal of Inorganic and Organometallic Polymers and Materials, 2023, 33(7):1868-1881.
[20] ARCINIEGAS-GRIJALBA P A, PATI O-PORTELA M C, MOSQUERA-S
O-PORTELA M C, MOSQUERA-S NCHEZ L P, et al.ZnO-based nanofungicides:Synthesis, characterization and their effect on the coffee fungi Mycena citricolor and Colletotrichum sp[J].Materials Science and Engineering:C, 2019, 98:808-825.
NCHEZ L P, et al.ZnO-based nanofungicides:Synthesis, characterization and their effect on the coffee fungi Mycena citricolor and Colletotrichum sp[J].Materials Science and Engineering:C, 2019, 98:808-825.
[21] BAKUR A, ELSHAARANI T, NIU Y W, et al.Comparative study of antidiabetic, bactericidal, and antitumor activities of MEL-AgNPs, MEL-ZnONPs, and Ag-ZnO/MEL/GA nanocomposites prepared by using MEL and gum arabic[J].RSC Advances, 2019, 9(17):9745-9754.
[22] 常建华,董绮功.波谱原理及解析 (第二版)[M].北京:科学出版社:2005:88-92.CHANG J H, DONG Q G.Principle and Analysis of Spectrum (2nd Ed)[M].Beijing:Science Press:2005:88-92.
[23] 孙萍, 熊波, 张国青, 等.氧化锌纳米晶体的光谱分析[J].光谱学与光谱分析, 2007, 27(1):143-146.SUN P, XIONG B, ZHANG G Q, et al.Spectral analysis of ZnO nanocrystals[J].Spectroscopy and Spectral Analysis, 2007, 27(1):143-146.
[24] DURVAL I J B, MEIRA H M, DE VERAS B O, et al.Green synthesis of silver nanoparticles using a biosurfactant from Bacillus cereus UCP 1615 as stabilizing agent and its application as an antifungal agent[J].Fermentation, 2021, 7(4):233.
[25] 廖文敏, 李坚斌, 韦巧艳, 等.蔗糖酯-纳米氧化锌的抑菌性能研究[J].食品工业, 2015, 36(10):8-11.LIAO W M, LI J B, WEI Q Y, et al.Study on the antibacterial effect of sucrose ester-ZnO nanoparticles[J].The Food Industry, 2015, 36(10):8-11.