冷鲜肉在贮运、售卖过程中因为蛋白质分解、微生物、脂肪氧化等原因导致腐坏后,很多消费者单从外观难以区分冷鲜肉是否腐败变质。冷鲜肉在腐坏过程中会产生挥发性氨及胺类物质[1],因此包装顶空的pH值上升,根据这一条件大量研究者制备出实时响应的肉类新鲜度指示材料,但是应用形式多为使用颜色变化表示肉类中含氮化合物的含量变化。荧光传感器由于灵敏度高、选择性好而受到越来越多的关注,常见的荧光材料有鲁米诺[2]、异硫氰酸荧光素[3]等。
鲁米诺(3-氨基-邻苯二甲酰肼,Luminol),也称发光氨,具有较高的荧光量子产率、良好的水溶性等特点。鲁米诺荧光体系能被某些化合物线性催化或者抑制荧光强度,使得体系的发光强度增强或减弱,因此其在化学发光检测领域中成为应用十分广泛的一种荧光试剂[4-5],鲁米诺溶液的荧光强度具有pH依赖性,在不同pH溶液中荧光强度会产生变化,但是荧光强度变化幅度过小[6]。并且固体状态的鲁米诺粉末具有聚集诱导猝灭效应(aggregation-caused quenching,ACQ),需要经过共混或共聚进行分散后才能产生较强荧光。
碱性环境下,鲁米诺溶液在滴加过氧化氢后会发生荧光增强现象[7],这可以增强不同pH下鲁米诺溶液的荧光强度变化幅度,易于观察。但是固体不具有酸碱性,因此即使冷鲜肉发生腐坏后,氨气这类碱性气体的含量增加,固体鲁米诺荧光比色片在滴加过氧化氢后荧光强度也不会发生变化。然而葡聚糖具有很强的吸湿性[8],与鲁米诺粉末共混压片后,有助于固体的β葡聚糖(β glucan,βGlu)鲁米诺荧光比色片吸收冷鲜肉因汁液流失率丢失的水分,使得比色片成为湿润的半固体状态。因此冷鲜猪肉腐坏后产生的氨气可以使比色片的pH值升高,从而改变比色片的荧光强度。基于此想法,本研究将鲁米诺以10%、15%、20%(质量分数)3种比例添加到β葡聚糖中,再进行压片,制得直径1 cm的荧光比色片,将其应用到冷鲜猪肉的新鲜度监测中。
1 材料与方法
1.1 材料与试剂
新鲜猪肉(里脊肉),呼和浩特市东瓦窑批发市场;β葡聚糖(99%),沐凡生物;鲁米诺(98%)、氨水、过氧化氢、氧化镁、硼酸、溴甲酚绿、甲基红等(分析纯),罗恩试剂。
1.2 仪器与设备
IRAffinity-1型红外光谱仪、UV-2450型紫外可见分光光度计,日本岛津公司;LE438型pH计,瑞士梅特勒公司;SC-300型立式冷藏柜,海尔集团有限公司;CR-20型色差仪,日本柯尼卡;HR-40-ⅡA2型生物安全柜,青岛海尔特种电器有限公司;SELP1650型相机,日本索尼。
1.3 实验方法
1.3.1 荧光比色片的制备
采用红外压片模具制备荧光比色片,取100、90、85、80 mg葡聚糖粉末与鲁米诺(0、10、15、20 mg)制作不同比例的荧光比色片,红外压片机压力为10 MPa,制得荧光比色片后分别记作Glu/L0、Glu/L10、Glu/L15、Glu/L20。
1.3.2 材料的表征
1.3.2.1 傅里叶变换红外光谱分析
称取经烘箱充分干燥后的溴化钾0.1 g与荧光比色片材料2 mg,通过红外压片机以10 MPa的压力压片后进行测试,以纯KBr为背景。条件设置为分辨率4 cm-1,波数700~4 000 cm-1,扫描次数64次。
1.3.2.2 荧光光谱分析
将待测样品均匀铺满在样品池中,测试样品的发射和激发光谱。
1.3.2.3 荧光比色片的pH荧光响应能力
用浓度为0.01 mol/L HCl和NaOH溶液调节pH值, 配制pH 8~14的溶液。分别给荧光比色片滴加不同pH的溶液,在365 nm紫外线下第一次拍照记录,滴加过氧化氢后在365 nm紫外线下第二次拍照记录。
1.3.2.4荧光比色片对挥发氨的响应能力
荧光比色片对挥发氨的响应测试以 CHEN等[9]的方法为基础,稍加修改。将80 mL四种浓度氨水(0.08、0.16、0.64、0.80 mol/L) 以及蒸馏水组加入到100 mL锥形瓶中,荧光比色片置于液面上方3 cm处。纯葡聚糖压片为对照组,蒸馏水组为CK组。在25 ℃下,在第0、60 min时在365 nm紫外灯照射下拍照,60 min时使用针管滴加0.25 mL过氧化氢后进行一组拍照。
1.3.2.5 实物图与荧光变化
使用索尼相机在365 nm紫外线照射下拍照,用Snipaste软件提取图片中的B值。
1.3.3 猪肉的新鲜度监测
1.3.3.1 猪肉的应用
新鲜猪里脊肉置于4 ℃恒温恒湿箱中预冷2 h排酸。在无菌超净台中将里脊肉的脂肪及筋膜去除,切成每块约100 g,放于10 cm×10 cm的塑料托盘中,使用高阻隔PA/PE袋包装,将荧光比色片固定于包装袋内但不与肉接触,并用热封机封口,之后置于4 ℃的恒温恒湿箱中贮藏。
1.3.3.2 理化指标测试
参照GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》测定菌落总数(total viable count,TVC);参照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》中半微量定氮法测定挥发性盐基氮(total volatile basic nitrogen,TVB-N);参照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》测定pH值。按照如下方法测定汁液流失率,将猪肉从包装袋中取出, 定性滤纸吸干样品表面的汁液, 称量现质量并与初始质量相比较,2 d测试1次,计算如公式(1)所示:
汁液流失率![]()
(1)
式中:m1为样品贮藏前质量,g;m2为样品贮藏后质量,g。
1.4 统计分析
实验设置3组平行,使用SPSS 27分析数据,ANOVA分析显著性(P<0.05)。
2 结果与分析
2.1 红外光谱分析
由图1可知,βGlu在3 000~3 600 cm-1处出现的宽峰归因于羟基(O—H)的伸缩振动,在2 918 cm-1出现的吸收峰是由于多糖甲基和亚甲基中C—H的伸缩振动,在1 004 cm-1处吸收峰是βGlu中C—O糖苷键伸缩振动引起的[10]。鲁米诺中芳胺的N—H键伸缩振动特征峰位于3 414 cm-1,酰胺C![]() O键的伸缩振动特征峰位于1 653 cm-1,酰胺的N—H键伸缩振动特征峰位于3 009 cm-1。Glu/L10、Glu/L15、Glu/L20在3 000~3 600 cm-1和1 004 cm-1是βGlu羟基(O—H)特征峰,峰强度随βGlu含量的减少而降低。Glu/L10、Glu/L15、Glu/L20在3 414 cm-1出现了鲁米诺中芳胺的N—H键伸缩振动特征峰,在3 009 cm-1和1 653 cm-1出现了酰胺的N—H键和C
O键的伸缩振动特征峰位于1 653 cm-1,酰胺的N—H键伸缩振动特征峰位于3 009 cm-1。Glu/L10、Glu/L15、Glu/L20在3 000~3 600 cm-1和1 004 cm-1是βGlu羟基(O—H)特征峰,峰强度随βGlu含量的减少而降低。Glu/L10、Glu/L15、Glu/L20在3 414 cm-1出现了鲁米诺中芳胺的N—H键伸缩振动特征峰,在3 009 cm-1和1 653 cm-1出现了酰胺的N—H键和C![]() O键的伸缩振动特征峰[11-12]。
O键的伸缩振动特征峰[11-12]。
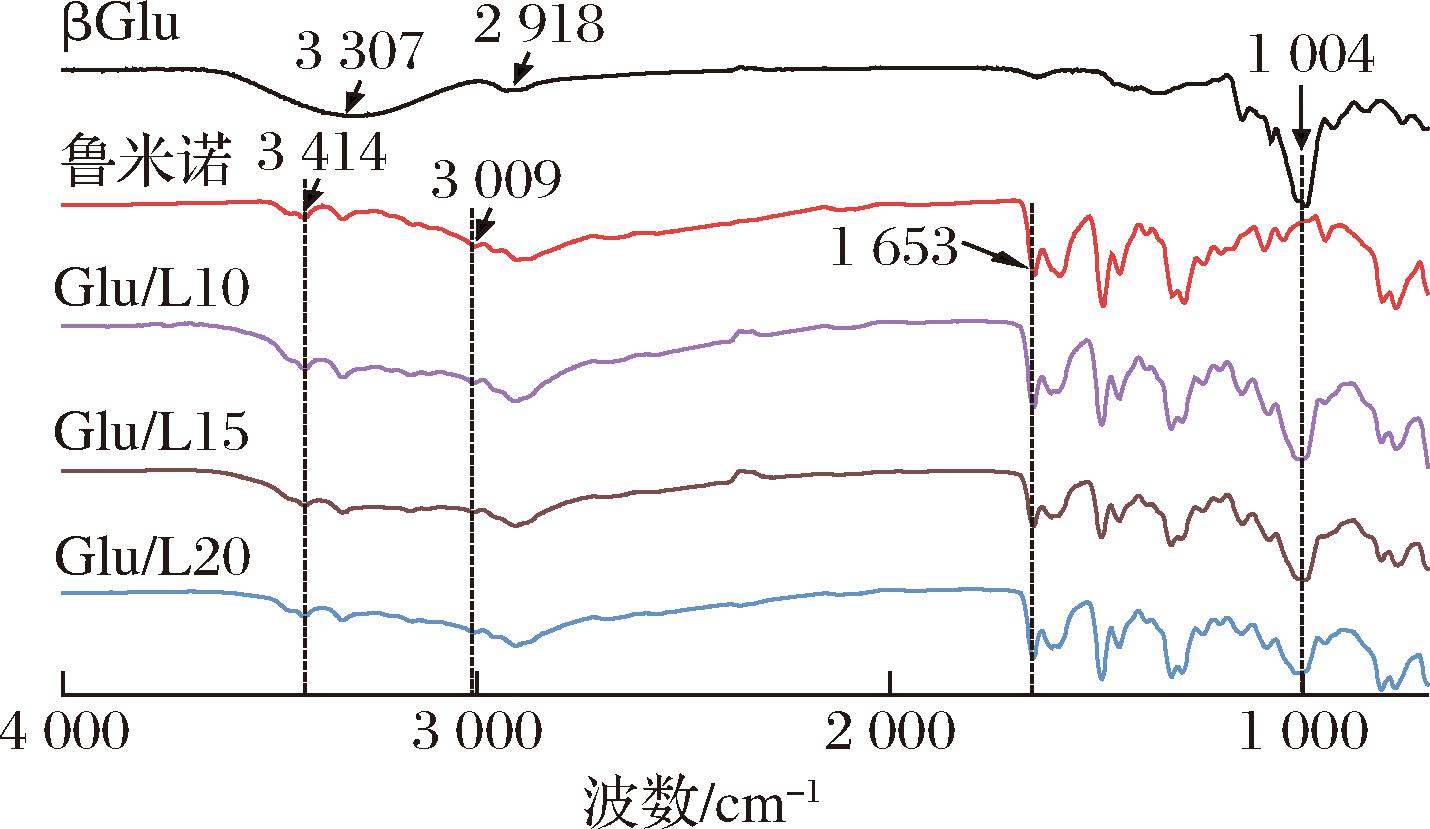
图1 βGlu、鲁米诺、不同比例荧光比色片的红外光谱图
Fig.1 FTIR spectrum of βGlu, Luminol, and fluorescence colorimetric tablets with different ratios
2.2 荧光光谱分析
如图2所示,βGlu的发射峰位在391 nm处,但是人眼可感知的波长为400~760 nm[13],因此结合峰的位置,βGlu中实际可感知的范围为发射峰的右半部分即400~500 nm,人眼观察到的颜色为靛蓝。鲁米诺的发射峰位在446 nm处,对应颜色为蓝色。Glu/L10、Glu/L15、Glu/L20三组的发射峰位置非常接近,都在455 nm处。这是由于βGlu是一种聚集诱导发光分子,在聚集态时分子链内与链间相互作用会产生荧光[14],因此葡聚糖的聚集状态如果被破坏,会导致分子链逐渐松散,分子链之间的相互作用力减弱,构象刚硬化程度减弱,非辐射跃迁增加,从而使荧光强度明显降低[15]。鲁米诺的添加导致葡聚糖致密的结构发生了变化,荧光也被减弱,因此荧光比色片发射峰位置更接近纯鲁米诺。
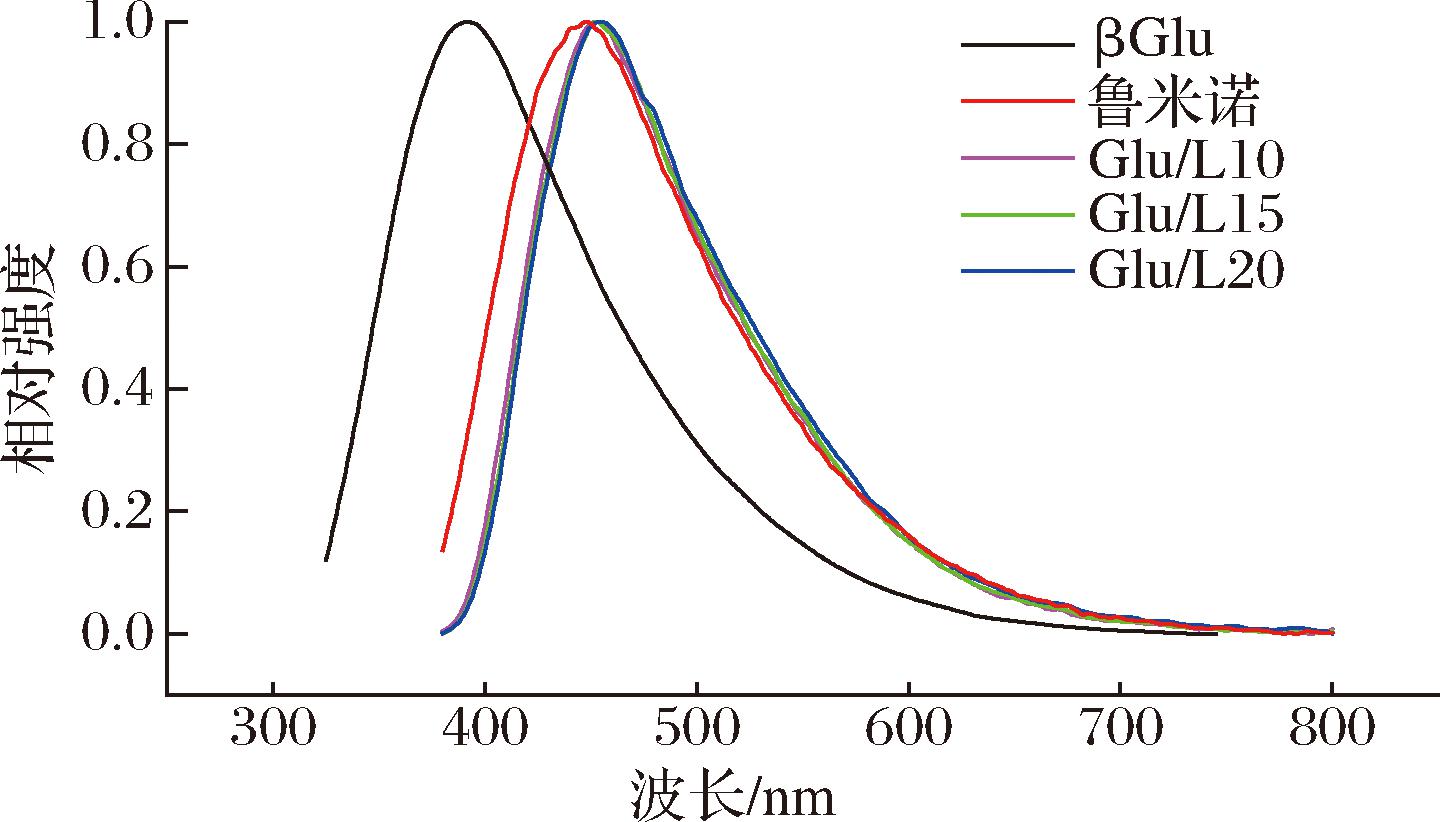
图2 βGlu、鲁米诺及不同比例荧光比色片在激发波长为365 nm下的发射光谱
Fig.2 Emission spectra of βGlu, Luminol, and fluorescence colorimetric tablets with different ratios at an excitation wavelength of 365 nm
荧光比色片在激发波长为365 nm下的发射图谱中表现出近乎一致的455 nm发射峰,因此激发图谱的发射波长选择为455 nm。由图3可知βGlu和鲁米诺的最强激发波段分别为400 nm和380 nm,而Glu/L10、Glu/L15、Glu/L20 3组的最强激发波段为383 nm,与βGlu表现出差异,3组更接近于纯鲁米诺的最强激发波段。
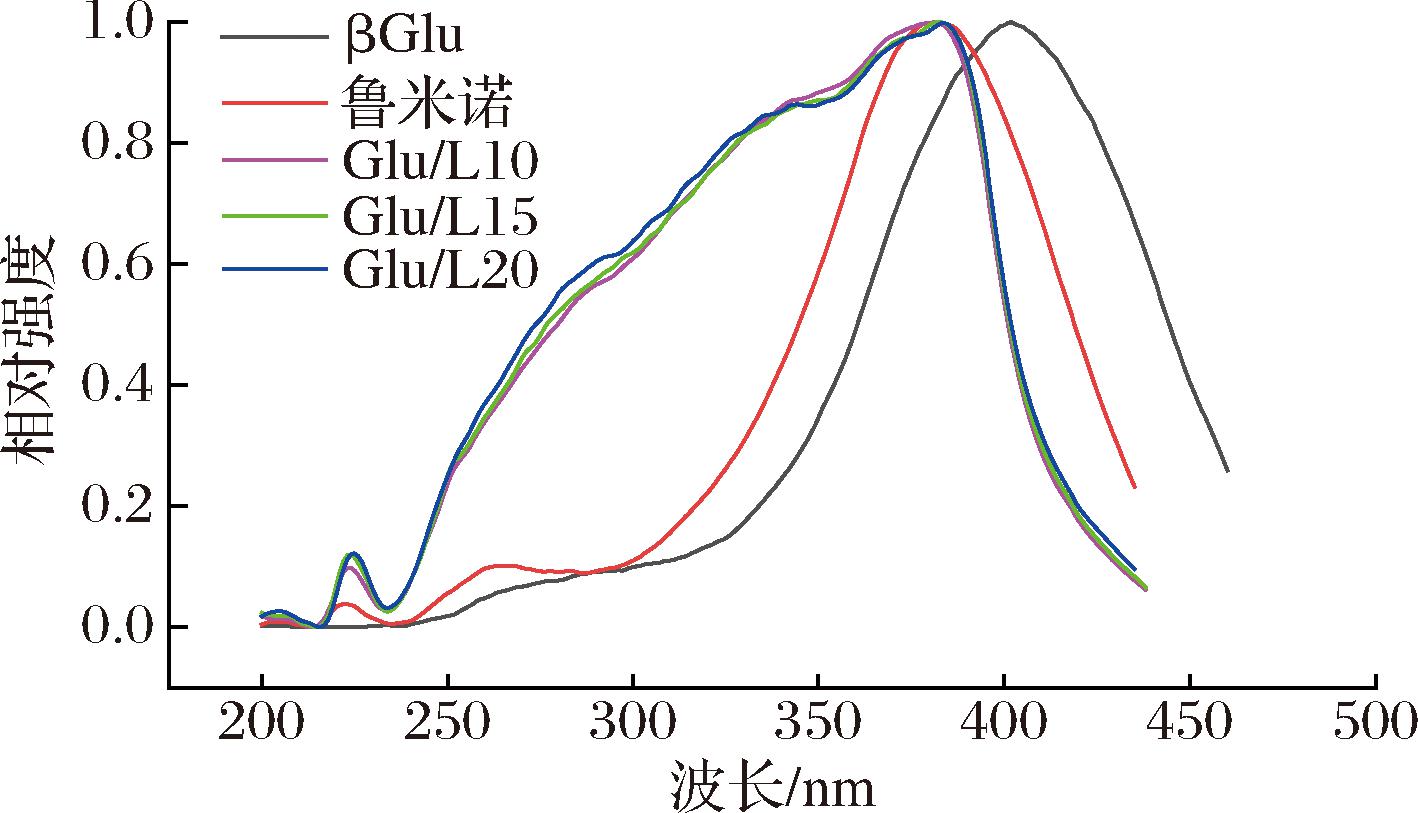
图3 βGlu、鲁米诺及不同比例荧光比色片在发射波长为455 nm下的激发光谱
Fig.3 Excitation spectra of βGlu, Luminol, and fluorescence colorimetric tablets with different proportions at emission wavelength of 455 nm
2.3 荧光比色片的pH荧光响应能力
鲁米诺分子中存在氨基,对质子化和去质子化更敏感,因此赋予鲁米诺pH响应特性。图4是荧光比色片在日光和365 nm紫外线照射下的实物图,日光下为灰绿色,紫外线下发出蓝色荧光。如图5-a所示,荧光比色片在弱碱性(pH 8~9)下荧光强度高于滴加碱性溶液前,蓝色荧光随pH的增加逐渐减弱,在pH≥11后发生了荧光猝灭现象。荧光比色片对不同pH具有响应能力,但是对于pH≥11的强碱无法通过荧光进行判断。如图6-b所示,在碱性条件和过氧化氢分子存在下,鲁米诺会产生激发态3-氨基邻苯二甲酸二价阴离子(3-APA*),激发态的 3-氨基邻苯二甲酸二价阴离子(3-APA*)由激发态回到基态,产生蓝色荧光[16]。如图5-b所示,不同pH的荧光比色片在滴加过氧化氢后荧光强度得到了显著的增强,pH 8~14间荧光逐渐减弱,并且在pH 14时才发生了荧光猝灭,这有助于增加荧光比色片对不同pH的响应能力。

a-日光照射;b-365 nm紫外线照射
图4 荧光比色片日光和365 nm紫外线照射图
Fig.4 Fluorescence colorimetric tablets sunlight and 365 nm ultraviolet light irradiation diagram

a-荧光比色片滴加不同pH溶液后的图;b-a图滴加过氧化氢后的的图
图5 滴加不同pH溶液和滴加过氧化氢后的荧光比色片
Fig.5 The picture of fluorescence colorimetric tablets after adding different pH solution and hydrogen peroxide
注:均为365 nm紫外线照射下。
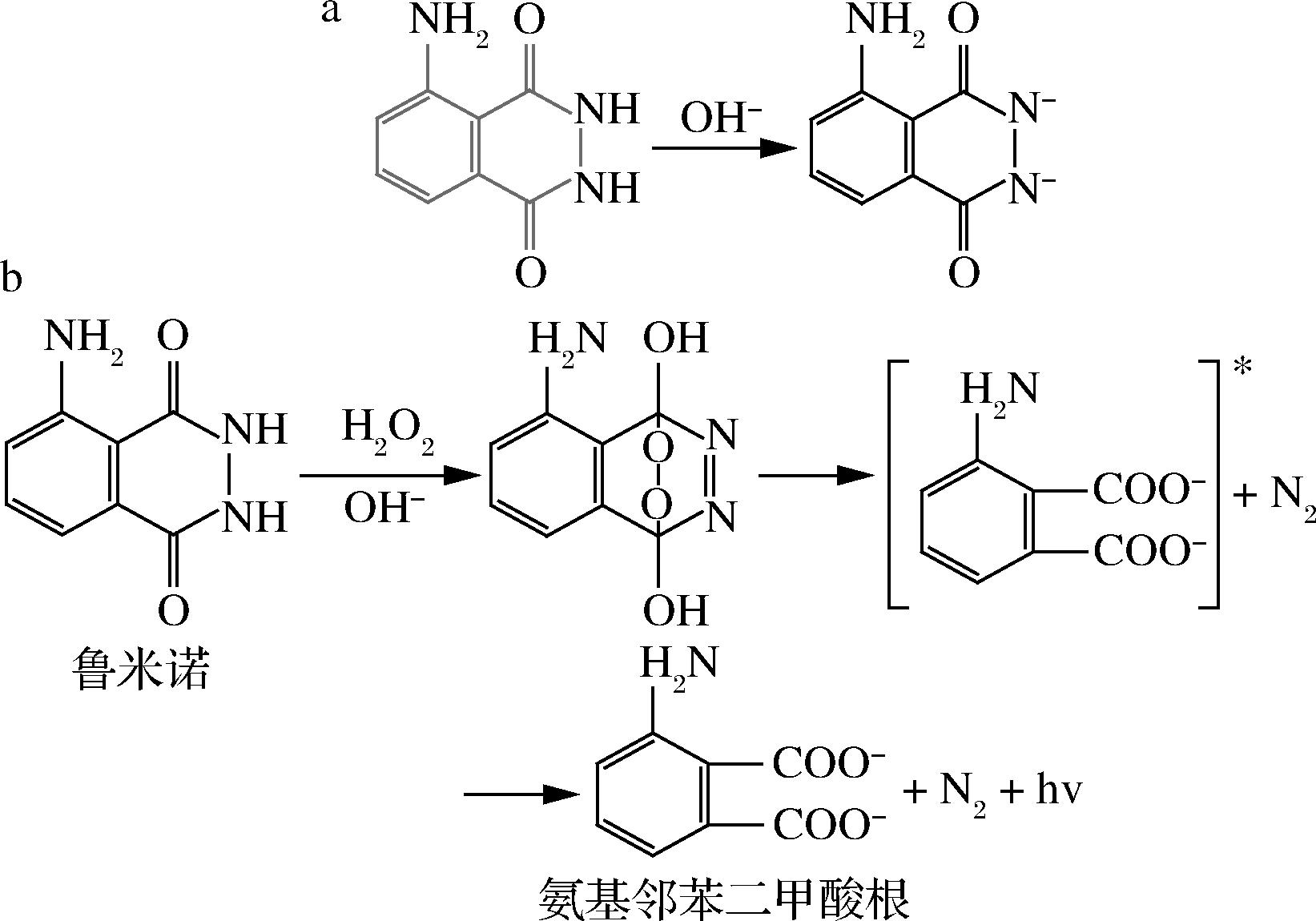
a-鲁米诺在碱性环境中的去质子化;b-滴加过氧化氢后的发光原理
图6 鲁米诺在碱性环境中的去质子化图和滴加过氧化氢后的发光原理
Fig.6 Deprotonation of Luminol in alkaline environment and luminescence schematic diagram after dripping hydrogen peroxide
2.4 荧光比色片对挥发氨的响应能力
肉类在腐坏过程中会释放出氨气等挥发性碱性物质,可以通过不同的浓度的氨气来模拟冷鲜肉的腐坏进程。冷鲜肉腐坏过程中因汁液流失会让气态水分子弥漫在包装袋内,而葡聚糖具有很强的吸湿性,这为比色片的响应机制提供了条件。响应机制是水分子(H2O)和氨气(NH3)两者间结合,水解反应生成氢氧根离子(OH-)与铵根离子![]() 包装环境为碱性,会使荧光比色片的荧光强度降低。R、G、B值是一种通用的颜色评价标准,其分别代表红、绿、蓝3个通道的颜色,最低值0时,表现为黑色[17]。本研究中荧光变化为蓝色荧光的变化,因此也可以通过B值表示蓝色荧光的变化情况。由图7-a和图7-c可知,Glu/L0为纯葡聚糖压片,葡聚糖具有聚集诱导发光效应,聚集态时分子链内与链间相互作用会产生荧光,在经过压片后,葡聚糖分子链之间的排布更加紧密,非辐射跃迁行为减少,这有利于增强荧光,因此初始荧光强度高于实验组。Glu/L0经过60 min水组和不同浓度氨水组熏蒸后,水组和氨气组荧光强度无区别,这是由于葡聚糖对氨气无响应能力。加入鲁米诺制作荧光比色片后,Glu/L10、Glu/L15和Glu/L20的水组和0.08 mol/L组荧光几乎无差异,B值无显著变化(P>0.05),Glu/L10和Glu/L20在被0.80 mol/L氨水熏蒸后出现明显的荧光强度降低的现象,并且B值显著降低(P<0.05)。Glu/L20在被0.64、0.80 mol/L氨水熏蒸后出现明显的荧光亮度降低的现象,这是由于荧光比色片经过氨水熏蒸后pH升高,处于碱性状态,而碱性状态的鲁米诺荧光亮度降低。但是冷鲜肉腐坏过程中很难释放出达到0.80 mol/L氨水所释放出的氨气浓度,因此需要提高荧光比色片对氨气的敏感度,增强响应能力。
包装环境为碱性,会使荧光比色片的荧光强度降低。R、G、B值是一种通用的颜色评价标准,其分别代表红、绿、蓝3个通道的颜色,最低值0时,表现为黑色[17]。本研究中荧光变化为蓝色荧光的变化,因此也可以通过B值表示蓝色荧光的变化情况。由图7-a和图7-c可知,Glu/L0为纯葡聚糖压片,葡聚糖具有聚集诱导发光效应,聚集态时分子链内与链间相互作用会产生荧光,在经过压片后,葡聚糖分子链之间的排布更加紧密,非辐射跃迁行为减少,这有利于增强荧光,因此初始荧光强度高于实验组。Glu/L0经过60 min水组和不同浓度氨水组熏蒸后,水组和氨气组荧光强度无区别,这是由于葡聚糖对氨气无响应能力。加入鲁米诺制作荧光比色片后,Glu/L10、Glu/L15和Glu/L20的水组和0.08 mol/L组荧光几乎无差异,B值无显著变化(P>0.05),Glu/L10和Glu/L20在被0.80 mol/L氨水熏蒸后出现明显的荧光强度降低的现象,并且B值显著降低(P<0.05)。Glu/L20在被0.64、0.80 mol/L氨水熏蒸后出现明显的荧光亮度降低的现象,这是由于荧光比色片经过氨水熏蒸后pH升高,处于碱性状态,而碱性状态的鲁米诺荧光亮度降低。但是冷鲜肉腐坏过程中很难释放出达到0.80 mol/L氨水所释放出的氨气浓度,因此需要提高荧光比色片对氨气的敏感度,增强响应能力。
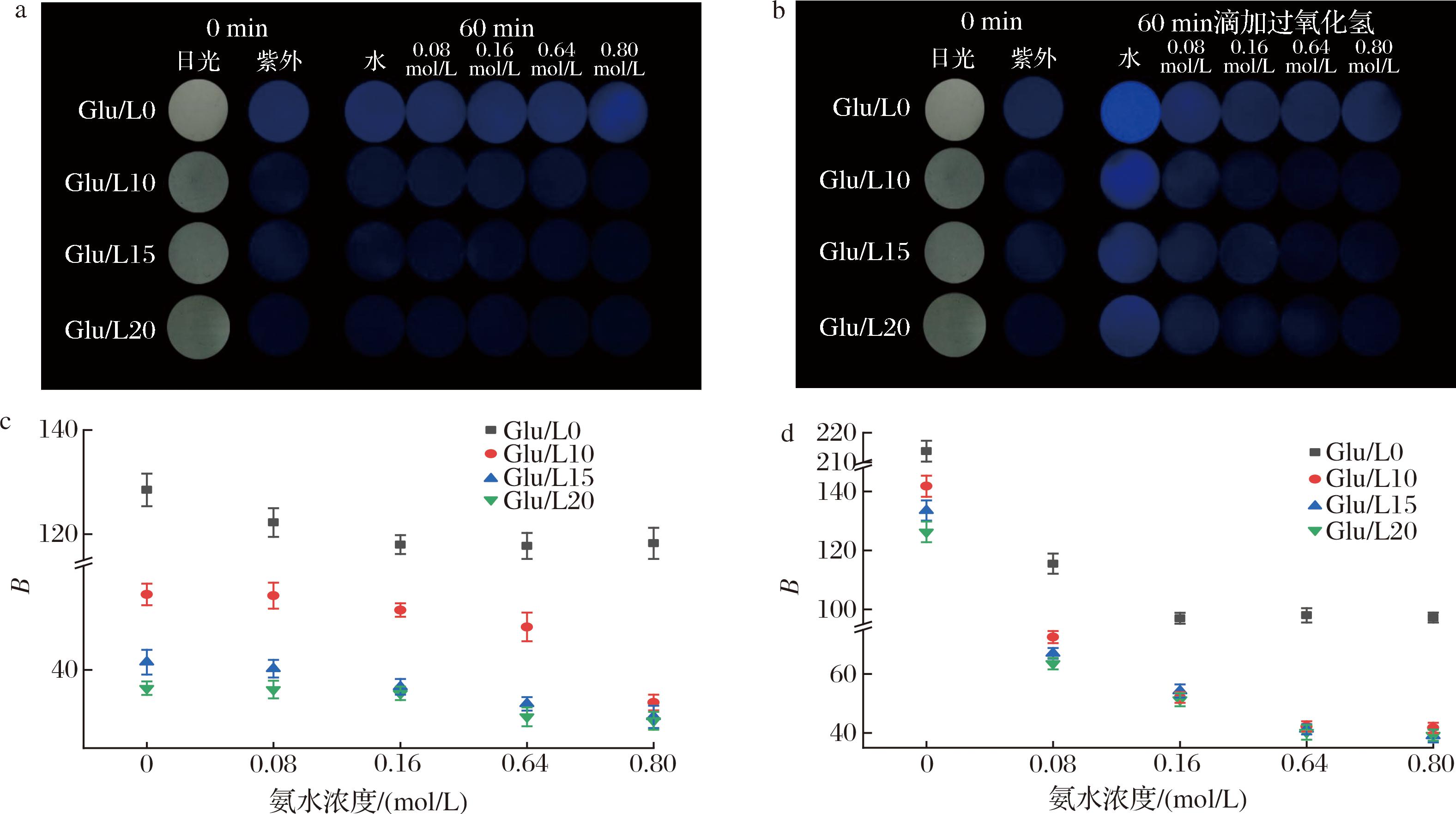
a-365 nm紫外线照射下荧光比色片在不同浓度氨气下的变化;b-a图滴加过氧化氢的变化;c-a图响应后的B值(蓝色)变化;d-b图响应后的B值(蓝色)变化
图7 紫外线照射下荧光比色片的变化及B值(蓝色)变化
Fig.7 The change of fluorescence colorimetric tablets under ultraviolet irradiation and B value (blue) change
由图7-b和图7-d可知,60 min时,使用针管滴加过氧化氢,Glu/L0组氨气熏蒸组荧光亮度和B值明显低于水熏蒸组,这是由于氨水熏蒸后比色片变为碱性,而碱性环境会破坏葡聚糖这类多糖的结构[18],降低其分子质量,分子链之间的排布稀疏,构像刚硬化程度迅速减弱,因此荧光亮度降低。但是0.16~0.80 mol/L氨水熏蒸组荧光亮度一致,B值无显著变化(P>0.05),说明其不具有氨气响应能力。滴加过氧化氢后,Glu/L10~Glu/L20三组的氨气熏蒸组荧光亮度皆明显低于水熏蒸组,同时B值从140~125降低至39~42,具有显著变化(P<0.05),这说明滴加过氧化氢后的葡聚糖-鲁米诺荧光比色片对氨气有高灵敏度,同时随着氨水浓度的上升,荧光亮度逐渐降低至肉眼难以观察的程度。上述结果表明荧光比色片对氨气也具有荧光减弱或猝灭的响应性能,具有应用在肉类食品新鲜度监测中的能力。
2.5 猪肉新鲜度的监测
评价冷鲜猪肉新鲜程度的指标有TVC、TVB-N、pH等。TVC评价标准:新鲜肉<4 lg CFU/g,次鲜肉4~6 lg CFU/g,腐败肉>6 lg CFU/g;TVB-N评价标准:新鲜肉<15 mg/100 g,次鲜肉为15~20 mg/100 g,腐败肉>20 mg/100 g;pH评价标准:新鲜肉5.6~6.2, 次鲜肉6.3~6.6,腐败肉>6.7[19]。
初始TVC为3.16 lg CFU/g,处于新鲜程度;贮藏2 d时TVC为3.86 lg CFU/g,仍处于新鲜状态;贮藏4 d时TVC为4.90 lg CFU/g处于次鲜肉状态。贮藏6 d时TVC为5.95 lg CFU/g,处在腐败边缘;贮藏8 d时TVC为7.07 lg CFU/g,已经腐败。TVC的变化与TVB-N含量的变化有较为密切的关系,贮藏4~8 d,随着TVC的迅速增加,TVB-N的含量也出现了较贮藏前期快速的增长,这与细菌分解肉中蛋白质导致TVB-N升高有关[20]。肉中TVB-N含量的升高也是因为挥发性碱性含氮化合物的产生及积累,初始TVB-N为11.0 mg/100 g,贮藏2 d时为14.2 mg/100 g,皆为新鲜级。贮藏4 d和6 d时为15.0、18.5 mg/100 g处于次鲜肉状态,贮藏8 d 时为23.6 mg/100 g,已经腐败。由图8-c可知,冷鲜猪肉pH值在贮藏期间,呈现先下降后上升的趋势。猪肉初始pH值为5.98,属于新鲜肉,贮藏2 d 后pH值降为5.74,屠宰后的动物乳酸堆积[21],并且肌肉组织中的兼性厌氧菌如乳酸菌会产生酸性代谢物,因此pH降低。贮藏后期pH上升,第6天pH值为6.31,贮藏第8天为6.52,都属于次鲜级。pH的上升是因为在细菌和酶的共同作用下,冷鲜猪肉中的蛋白质与氨基酸降解,产生胺类等碱性含氮化合物。肉类的汁液流失率与菌落总数等有关,贮藏过程中细菌的生长繁殖会对肌肉组织进行破坏,也会使肉类的保水能力下降。冷鲜肉的汁液流失率随贮藏时间的延长而增加,贮藏第2天汁液流失率就达到了3%,贮藏第8天汁液流失率为5.7%,这也为荧光比色片吸湿后的pH响应提供了条件。
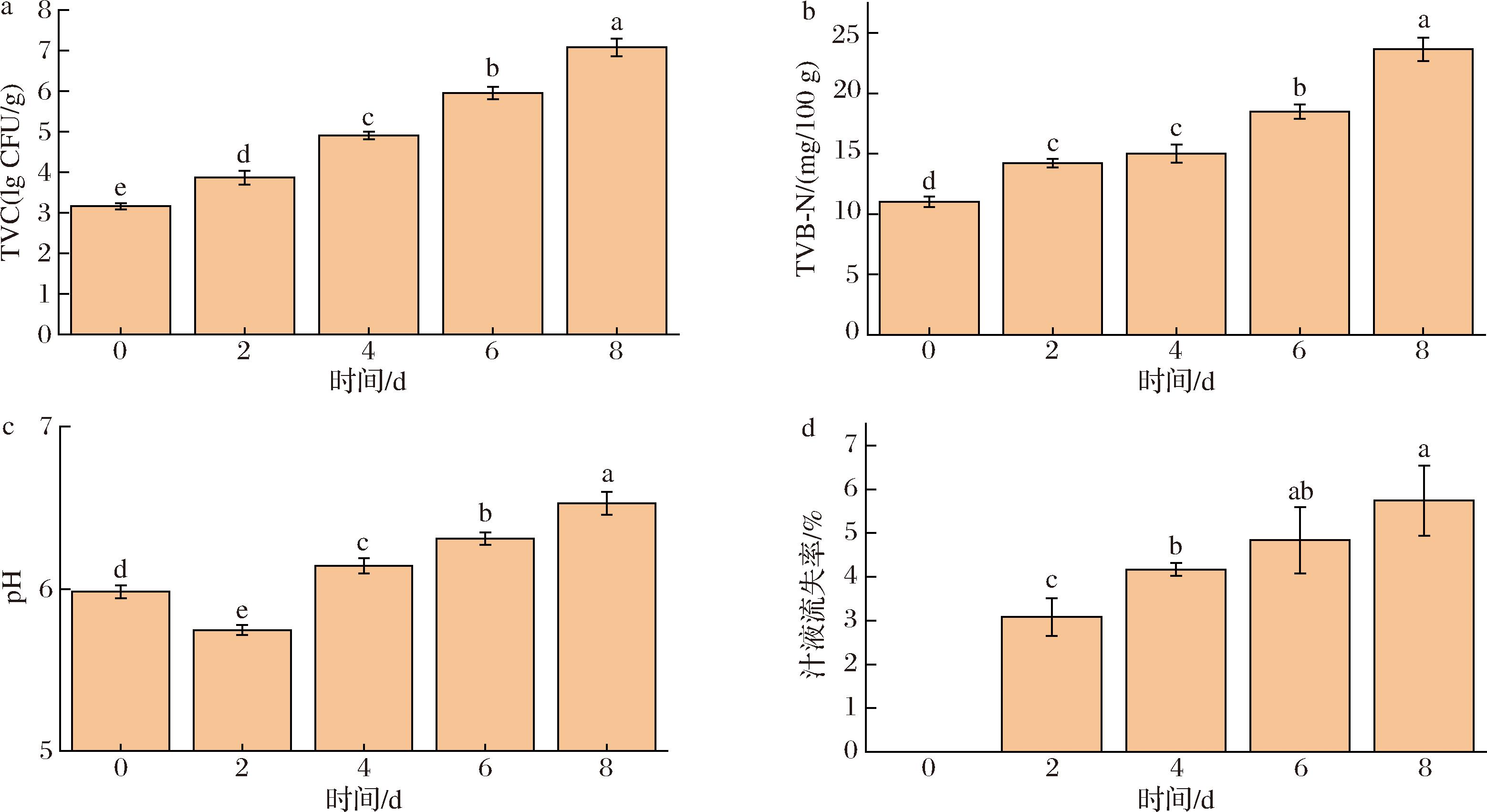
a-冷鲜猪肉贮藏过程中的TVC变化;b-冷鲜猪肉贮藏过程中的TVB-N变化;c-冷鲜猪肉贮藏过程中的pH变化;d-冷鲜猪肉贮藏过程中的汁液流失率变化
图8 冷鲜猪肉贮藏过程中的TVC、TVB-N、pH、汁液流失率的变化
Fig.8 Changes of TVC, TVB-N, pH, and juice loss rate of chilled pork during storage
注:图中不同小写字母表示差异显著(P<0.05)。
2.6 猪肉新鲜度的指示
图9-a为荧光比色片在贮藏过程中的荧光亮度的变化图,图9-b为贮藏期间荧光比色片B值的变化图。在0~8 d中,Glu/L0荧光亮度无明显变化,但是从第2天开始出现荧光不均匀的现象,这是由于纯葡聚糖具有很强的吸湿性,而如图8-d中所示,冷鲜猪肉贮藏第2天汁液流失率就达到3%,包装袋内存在大量水分,吸湿后葡聚糖固体出现部分融化现象导致比色片荧光不均匀,图9-b中6~8 d的Glu/L0 B值的误差也随发光不均匀而迅速增大,因此Glu/L0的荧光亮度无明显变化说明Glu/L0不具有荧光响应能力。贮藏期间,Glu/L10、Glu/L15、Glu/L20 3组荧光比色片在0~2 d内无明显变化,贮藏第4天Glu/L20荧光亮度相比第2天略微降低,Glu/L10、Glu/L15无明显变化,B值无显著变化(P>0.05)。贮藏第6天Glu/L10、Glu/L15、Glu/L20 B值显著降低(P<0.05),其中Glu/L20 B值降低幅度最大。如图8-b所示,贮藏第6天时冷鲜猪肉挥发性盐基氮含量已达到18.5 mg/100 g,属于次鲜肉,这也说明包装内氨气浓度较高,因此在贮藏第6天Glu/L10、Glu/L15、Glu/L20 3组荧光比色片相较于第4天皆出现了荧光亮度降低的现象。贮藏第8天3组的荧光亮度继续降低,其中Glu/L15、Glu/L20呈现出黑蓝色荧光,Glu/L20在贮藏0~8 d中B值一直显著降低(P<0.05),并且Glu/L20在第8天B值降低至57.3。
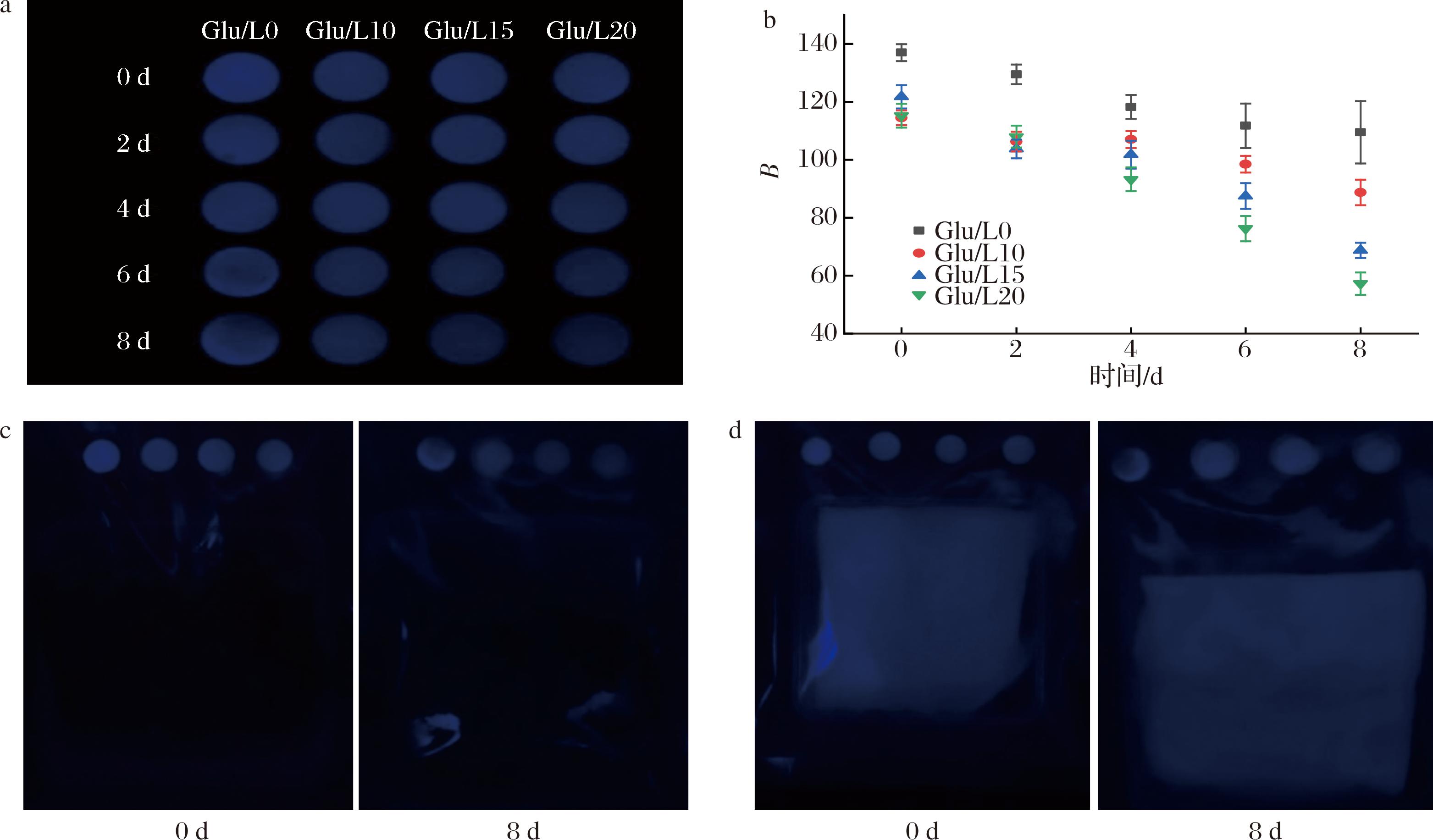
a-冷鲜猪肉贮藏0、2、4、6、8 d后滴加过氧化氢的荧光比色片的变化;b-贮藏期间荧光比色片B值(蓝色)的变化;c-冷鲜猪肉贮藏第0天、第8天后滴加过氧化氢的实物;d-湿纸巾(空白对照组)贮藏0、8 d后滴加过氧化氢的的实物
图9 冷鲜猪肉贮藏期间荧光比色片和B值的变化及对照组变化
Fig.9 The change of fluorescence colorimetric tablets and B value of chilled pork during storage and the control group
由于4组荧光比色片在同一包装环境内,冷鲜肉腐坏时产生的碱性气体是有限的,且会被4组荧光比色片同时吸收,但最终这些荧光比色片荧光的变化结果和挥发性氨测试得到的结果类似。图9-d是湿纸巾(空白对照组)贮藏0、8 d后滴加过氧化氢的的实物图,由图可知Glu/L0组由于葡聚糖吸湿后出现部分融化现象导致荧光不均匀,Glu/L10、Glu/L15、Glu/L20 3组在贮藏8 d后没有出现荧光减弱现象,说明实验组只有在氨气存在情况下才能发生荧光减弱现象。
根据Glu/L15与Glu/L20两组荧光比色片的荧光变化和表1可将冷鲜肉分为2个阶段,即蓝色、淡蓝色荧光为新鲜级和次鲜级,其B值>70;黑蓝色荧光为腐败级,B值<70。根据荧光变化程度看,冷鲜肉腐败后,Glu/L10组从蓝色荧光变为淡蓝色荧光,荧光变化不明显,不利于反映冷鲜肉新鲜度;而Glu/L15与Glu/L20两组荧光比色片由于鲁米诺含量高,从蓝色荧光变为黑蓝色荧光,B值下降速度也更快,相较于Glu/L10组,能反映出冷鲜肉新鲜度。
表1 贮藏期间荧光比色片的B值(蓝色)的变化
Table 1 The change of B value(blue) of fluorescent colorimetric tablets during storage
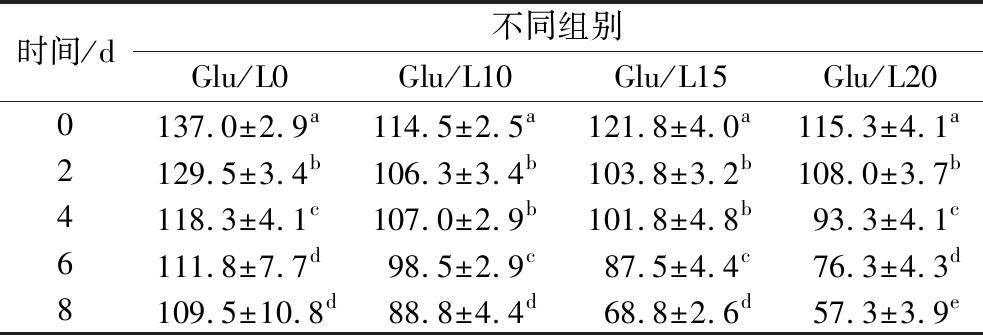
注:表中组间不同小写字母表示差异显著(P<0.05)。
时间/d不同组别Glu/L0Glu/L10Glu/L15Glu/L200137.0±2.9a114.5±2.5a121.8±4.0a115.3±4.1a2129.5±3.4b106.3±3.4b103.8±3.2b108.0±3.7b4118.3±4.1c107.0±2.9b101.8±4.8b93.3±4.1c6111.8±7.7d98.5±2.9c87.5±4.4c76.3±4.3d8109.5±10.8d88.8±4.4d68.8±2.6d57.3±3.9e
3 结论与讨论
本文中主要通过将不同比例鲁米诺添加到β葡聚糖中进行共混,并使用红外压片机制成直径1 cm的圆形荧光比色片。通过荧光光谱仪、FTIR表征葡聚糖-鲁米诺荧光比色片的荧光性质及结构。荧光比色片对4种不同浓度的氨气都有荧光减弱的响应能力,且在pH 8~14时滴加过氧化氢后荧光逐渐减弱至猝灭。使用荧光比色片指示冷鲜猪肉新鲜度,当猪肉腐败变质时,荧光比色片从初始的蓝色荧光变成了黑蓝色荧光,B值显著降低(P<0.05),荧光几乎猝灭。荧光比色片的荧光变化与TVC、TVB-N、pH等建立了联系。结果表明,荧光比色片能用于指示肉类新鲜度,在智能包装中具有应用前景。
[1] ![]() A, KAYAARDI S.Influence of storage period and packaging methods on quality attributes of fresh beef steaks[J].CyTA-Journal of Food, 2015, 13(1):124-133.
A, KAYAARDI S.Influence of storage period and packaging methods on quality attributes of fresh beef steaks[J].CyTA-Journal of Food, 2015, 13(1):124-133.
[2] BELOTTI M, EL-TAHAWY M M T, DARWISH N, et al.Electrochemically generated luminescence of luminol and luciferin in ionic liquids[J].ChemElectroChem, 2023, 10(1):e202201033.
[3] 杨步高, 赵一, 韦晓菲, 等.一种基于异硫氰酸荧光素的pH纳米传感器制备[J].发光学报, 2020, 41(6):729-733.YANG B G, ZHAO Y, WEI X F, et al.Preparation of fluorescent pH nanosensor based on flourescein isothiocyanate[J].Chinese Journal of Luminescence, 2020, 41(6):729-733.
[4] 仝坤, 张以河, 谢加才, 等.提高稠油废水可生化性的研究进展[J].化工环保, 2011, 31(5):423-426.TONG K, ZHANG Y H, XIE J C, et al.Research progresses in biodegradability improvement of viscous oil wastewater[J].Environmental Protection of Chemical Industry, 2011, 31(5):423-426.
[5] 张红莲, 夏立群, 段东霞, 等.含油废水中絮凝剂产生菌DX-3的分离鉴定及特性研究[J].化学与生物工程, 2011, 28(11):22-26.ZHANG H L, XIA L Q, DUAN D X, et al.Study on isolation, identification and characteristics of a flocculant-producing bacterium DX-3 from oil-containing wastewater[J].Chemistry &Bioengineering, 2011, 28(11):22-26.
[6] NAWAZ H, CHEN S, ZHANG X, et al.Cellulose-based fluorescent material for extreme pH sensing and smart printing applications[J].ACS Nano, 2023, 17(4):3996-4008.
[7] YUAN S J, YU R, TU Y, et al.An enhanced chemiluminescence hybrids of luminol by sulfonated polyaniline decorated copper-based metal organic frame composite applicable to the measurement of hydrogen peroxide in a wide pH range[J].Talanta, 2023, 254:124183.
[8] WANG L, YE F Y, LI S, et al.Effects of oat β-glucan incorporation on the gelatinization, flowability and moisture sorption of wheat flour[J].Powder Technology, 2017, 315:430-437.
[9] CHEN H Z, ZHANG M, BHANDARI B, et al.Novel pH-sensitive films containing curcumin and anthocyanins to monitor fish freshness[J].Food Hydrocolloids, 2020, 100:105438.[10] XU L F, CAO J G, ZHONG S L, et al.Seeking aggregation-induced emission materials in food:Oat β-glucan and its diverse applications[J].Journal of Agricultural and Food Chemistry, 2021, 69(27):7680-7686.
[11] HALLAJ T, AMJADI M, MIRBIRANG F.S, N-doped carbon quantum dots enhanced Luminol-Mn (Ⅳ) chemiluminescence reaction for detection of uric acid in biological fluids[J].Microchemical Journal, 2020, 156:104841.
[12] 张一平, 邓昆月, 赵博轩, 等.鲁米诺的合成与振荡化学发光[J].大学化学, 2022, 37(5):222-232.ZHANG Y P, DENG K Y, ZHAO B X, et al.Synthesis of luminol and chemiluminescence oscillation[J].University Chemistry, 2022, 37(5):222-232.
[13] 王杨, 隆海燕, 贾曦然.基于人眼色彩差异化感知的图像质量评价研究[J].计算机工程与科学, 2023, 45(2):295-303.WANG Y, LONG H Y, JIA X R.Research on image quality evaluation based on color differential perception of human eye[J].Computer Engineering &Science, 2023, 45(2):295-303.
[14] 许利峰. 新型天然化合物的发光性能研究[D].长春:吉林大学, 2022.XU L F.Exploring of luminescence properties of novel natural compounds[D].Changchun:Jilin University, 2022.
[15] 张永芝, 王倩, 赵子豪, 等.葡聚糖的光致发光性质及机理研究[J].高分子学报, 2022, 53(8):906-912.ZHANG Y Z, WANG Q, ZHAO Z H, et al.Photoluminescence and luminescent mechanism of dextran[J].Acta Polymerica Sinica, 2022, 53(8):906-912.
[16] GIUSSANI A, FARAHANI P, MART NEZ-MU
NEZ-MU OZ D, et al.Molecular basis of the chemiluminescence mechanism of luminol[J].Chemistry A European Journal, 2019, 25(20):5202-5213.
OZ D, et al.Molecular basis of the chemiluminescence mechanism of luminol[J].Chemistry A European Journal, 2019, 25(20):5202-5213.
[17] YUSUFU D, MILLS A.Spectrophotometric and digital colour colourimetric (DCC) analysis of colour-based indicators[J].Sensors and Actuators B:Chemical, 2018, 273:1187-1194.
[18] 谭婉碧, 王琴飞, 余厚美, 等.植物源功能活性多糖的提取及其研究进展[J].热带农业科学, 2022, 42(7):90-98.TAN W B, WANG Q F, YU H M, et al.Research progress, extraction and functional activity of plant polysaccharides[J].Chinese Journal of Tropical Agriculture, 2022, 42(7):90-98.
[19] CUI H, DONG Y, LU T H, et al.Effect of ethanolic extract from Morus alba L.leaves on the quality and sensory aspects of chilled pork under retail conditions[J].Meat Science, 2021, 172:108368.
[20] NER N C, TOVAR L, DJENANE D, et al.Stabilization of beef meat by a new active packaging containing natural antioxidants[J].Journal of Agricultural and Food Chemistry, 2006, 54(20):7840-7846.
N C, TOVAR L, DJENANE D, et al.Stabilization of beef meat by a new active packaging containing natural antioxidants[J].Journal of Agricultural and Food Chemistry, 2006, 54(20):7840-7846.
[21] 尹爱武, 高鹏飞, 蒋佳洁.刺儿茶多酚对冷却猪肉保鲜效果的研究[J].湖南工程学院学报(自然科学版), 2017, 27(2):47-52.YIN A W, GAO P F, JIANG J J.Fresh-keeping effect of thorn tea polyphenols on chilled pork[J].Journal of Hunan Institute of Engineering(Natural Science Edition), 2017, 27(2):47-52.