为了预防和控制食品中的致病微生物,避免食品在长期贮存过程中发生腐败变质现象,多数食品需要添加食品防腐剂以保证食品品质[1]。被病原体污染的食品不仅会导致食品质量下降,还会引发疾病和食物中毒[2]。金黄色葡萄球菌 (Staphylococcus aureus)是世界第三大食源性微生物,被认为是导致食物中毒的主要危险致病菌。目前,化学食品防腐剂被用于控制食品相关微生物的生长和食物中毒的发生率。然而,人们越来越重视化学食品防腐剂对人类健康的不良影响,如食用大量含苯甲酸和苯甲酸钠将会影响肝脏酶对脂肪酸的作用,其次苯甲酸钠中过量的钠对人体血压、心脏、肾功能也会形成影响[3],因此研究人员致力于开发天然、安全和有效的食品防腐剂。近年来,许多研究表明,植物提取物,如酚类和黄酮类化合物,对细菌具有良好的抗菌活性[4]。因此,开发具有抗菌活性的植物提取物是解决当前问题的途径之一。
甘草是一种药食同源的多年生草本植物,具有消炎、抗菌、抗病毒、抗癌、抗高血脂以及增强细胞免疫等多种药理活性,素有“十方九草”之称。研究表明,甘草水提取液、乙醇提取液和超临界流体提取液对金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌、白色念珠菌和枯草芽孢杆菌等革兰氏阳性菌和革兰氏阴性菌具有明显的抑制作用[5]。其中主要抑菌成分是甘草总黄酮中的甘草素和甘草查尔酮[6]。然而,甘草提取物抗菌机理的研究还不十分清楚,这限制了其应用。
为了甘草提取物在食品中的进一步应用提供理论基础,本研究从细胞壁膜、蛋白质和核酸几方面系统地评估了甘草提取物对S.aureus的抗菌机制,为甘草在食品防腐中的应用提供借鉴。
1 材料与方法
1.1 材料与试剂
金黄色葡萄球菌(ATCC6538),由本实验室保存;甘草,北京同仁堂药店;氯化碘硝基四唑紫,北京索莱宝科技有限公司;总ATPase试剂盒、SDH试剂盒,中国南京建城生物工程研究所;无水乙醇,北京化工厂;营养肉汤、营养琼脂、胰蛋白大豆琼脂培养基,Aobox;二甲基亚砜(dimethyl sulfoxide,DMSO),Biotopped;氯化钠,西陇化工股份有限公司;细胞培养96孔板,Corning。
1.2 仪器与设备
高压蒸汽灭菌锅,上海博讯实业有限公司;摇床振荡培养箱,上海福玛公司;生化培养箱,上海森信实验仪器有限公司;infinite pro200酶标仪,美国赛默飞世尔科技公司。
1.3 实验方法
1.3.1 甘草提取物的制备
将甘草干燥后粉碎过筛,用无水乙醇浸泡30 min后75 ℃下提取60 min,过滤、浓缩为原体积的30%甘草醇提物后存放在4 ℃冰箱备用。
1.3.2 细菌的活化和培养
将-80 ℃冻存的S.aureus接种在适量的肉汤中,并置于37 ℃,120 r/min摇床中培养12 h。将活化好的菌液通过平板划线在TSA板于37 ℃培养箱进行分离培养24 h后,挑取单菌落接种于适量营养肉汤进行过夜培养至对数生长期后存在冰箱保鲜层备用。
1.3.3 最低抑菌浓度(minimal inhibit concentration,MIC)的测定
采用液体倍比稀释法测定提取液对S.aureus的MIC值[7]。将处于对数生长期的S.aureus接种到营养肉汤培养基中(细菌悬浮液浓度为1×106 CFU/mL)。将甘草提取物添加到营养肉汤培养基中,最终质量浓度为0.16~50 mg/mL,不含甘草提取物的S.aureus培养物为对照。
1.3.4 生长曲线
细菌生长曲线实验参照Araya-Contreras等方法[8],在100 mL营养肉汤中接种1 mL的S.aureus菌悬液(1×108 CFU/mL),再分别加入适量甘草提取物使其终浓度为1 MIC,同时设置1 mL生理盐水的阴性对照、1%无水乙醇做溶剂对照。将各反应体系于37 ℃,120 r/min的摇床培养,每隔2 h取出样品用酶标仪测定吸光度值(OD625nm),绘制吸光度随时间变化的曲线即为该菌的生长曲线。
1.3.5 氧化损伤实验测定
细菌胞内活性氧(reactive oxygen speices,ROS)检测参照GOEL等[9]方法,菌种活化及定浓度步骤同1.3.2节。取10 mL无菌EP管加入适量2,7-二氯荧光素二乙酸酯(2′,7′-dichlorodihydrofluorescein diacetate,DCFH-DA)(终浓度为2×10-5 mol/L)与10 mL菌悬液(终浓度为1×108 CFU/mL),在37 ℃水浴锅中孵育1 h。在冷冻离心机中以8 000 r/min离心5 min收集菌体,去除细胞外多余的DCFH-DA后,加入适量甘草提取物(终浓度为1 MIC,菌终浓度1×106 CFU/mL)在37 ℃水浴锅中孵育12 h,以生理盐水为阴性对照,稀释500倍后用酶标仪测定荧光强度。
1.3.6 细菌胞外核酸泄漏量测定
实验方法参照XIANG等[10]方法并略加改进,菌悬液终浓度OD625nm=0.5,抑菌剂终浓度1 MIC,用1%生理盐水做阴性对照。将各反应体系置于37 ℃,120 r/min摇床中振荡培养,每2 h取1 mL 菌悬液离心(10 000 r/min,5 min,4 ℃)后用NanoDrop One测定上清液核酸含量。
1.3.7 植物抑菌剂对细菌总蛋白合成的影响
实验方法参照文献[11]并稍加改进。取适量活化好的菌悬液离心(5 000 r/min,4 min)后溶于1 mL生理盐水,并接种于100 mL无菌营养肉汤中,然后加入终浓度为1 MIC的各种抑菌剂(体积不超过总体积1%),1%生理盐水做阴性对照。将各反应体系在37 ℃,120 r/min摇床中振荡培养12 h后,5 000 r/min 离心4 min后重悬至 OD625nm=0.3。用超声破碎机破碎(超声总时间为15 min,功率设定为15%,超声时间3 s,间歇时间2 s)后采用考马斯亮蓝法测定破碎液中蛋白质含量。
1.3.8 细菌细胞代谢活力影响
实验方法参照文献[12]并稍加改进。菌种活化及重悬参照1.3.2节得到OD625 nm=0.5菌悬液,加入1%体积甘草提取物使其终浓度为1 MIC,置于37 ℃,150 r/min摇床中振荡培养2 h后用8 000 r/min的冷冻离心机离心5 min,收集菌体再次重悬至OD625nm=0.5,设置1%生理盐水为阴性对照组。取适量菌悬液加入氯化碘硝基四唑紫溶液(终浓度为1 mmol/L)后置于37 ℃水浴锅孵育30 min,用酶标仪在OD630nm处测量吸光度值。
1.3.9 能量代谢酶活力的影响
实验方法参照文献[13]并稍加改进。菌体菌悬液制备同1.3.2节得到OD625nm=0.3,将菌悬液分装在灭菌 EP 管并加入适量甘草提取物(终浓度1 MIC),1%的生理盐水为阴性对照,并设置10 mg/mL 的溶菌酶,将各反应体系置于37 ℃,120 r/min摇床中振荡培养6 h。然后按照总ATPase 试剂盒、琥珀酸脱氢酶(succinate dehydrogenase,SDH)试剂盒要求进行酶活力测定。
1.3.10 细菌DNA的提取
菌种活化及重悬参照1.3.2节得到1×108 CFU/mL 的菌悬液后,采用CTAB法提取DNA,但是需要将其中使用的溶菌酶替换为溶葡萄菌酶。最后适量TE溶解DNA,测定值OD260nm和OD280nm确定DNA 含量和纯度,-20 ℃保藏备用。
1.3.11 菌体DNA对甘草提取物紫外光谱影响
实验方法参照WU等[14]并稍加改进。取100 μL浓度为1 MIC的甘草提取物,然后加入100 μL浓度为0.5 mg/mL的S.aureus基因组DNA,于37 ℃水浴锅温育3 h,用酶标仪进行紫外扫描,紫外光扫描范围230~450 nm。
1.3.12 溴化乙锭(ethidium bromide,EB)竞争性荧光光谱分析
实验方法参照 HEGDE等[15]并稍加改进。含0.2 μg/mL EB的DNA溶液(1 mg/mL)中加入等体积不同浓度的甘草提取物(终浓度分别为1/2 MIC、1 MIC),均匀混合各反应体系后置于37 ℃水浴锅温育3 h,用酶标仪进行荧光扫描。实验组的激发波长为380 nm,扫描波长为420~770 nm。
1.3.13 DAPI竞争性荧光光谱分析
实验方法参照LYU等[16]并稍加改进。含0.2 μg/mL DAPI的DNA溶液(1 mg/mL)中加入等体积不同浓度的甘草提取物(终浓度分别为1/2 MIC、1 MIC),均匀混合各反应体系后置于37 ℃水浴锅温育3 h,用酶标仪进行荧光扫描。甘草提取物的激发波长为300 nm;扫描波长为380~700 nm。
1.4 数据分析
采用IBM SPSS Statistics 26软件对实验所得原始数据进行统计学处理,两组间采用独立样本t检验;多组间比较采用单因素分析中事后多重比较(Duncan)。实验数据用平均值±标准差表示,其中P<0.05表示两组间有显著性差异。
2 结果与分析
2.1 甘草提取物对S.aureus的MIC及对菌体生长的影响
通过倍比稀释法得到甘草提取物对S.aureus的MIC为10.44 mg/mL,表明较低浓度的甘草提取物可以抑制S.aureus的生长,具有良好的抑菌活性。
如图1所示,由图中阴性对照可知,S.aureus在6 h前为生长停滞期,6~16 h处于对数生长期,16~24 h处于平缓期;为探讨甘草醇提取液中无水乙醇对S.aureus 生长的影响,在菌悬液中加入无水乙醇,使其终浓度为1%作为溶剂对照组;实验结果表明1%无水乙醇加入对细菌生长的影响较小;1 MIC的甘草提取物在生长停滞期几乎完全抑制了S.aureus的生长。
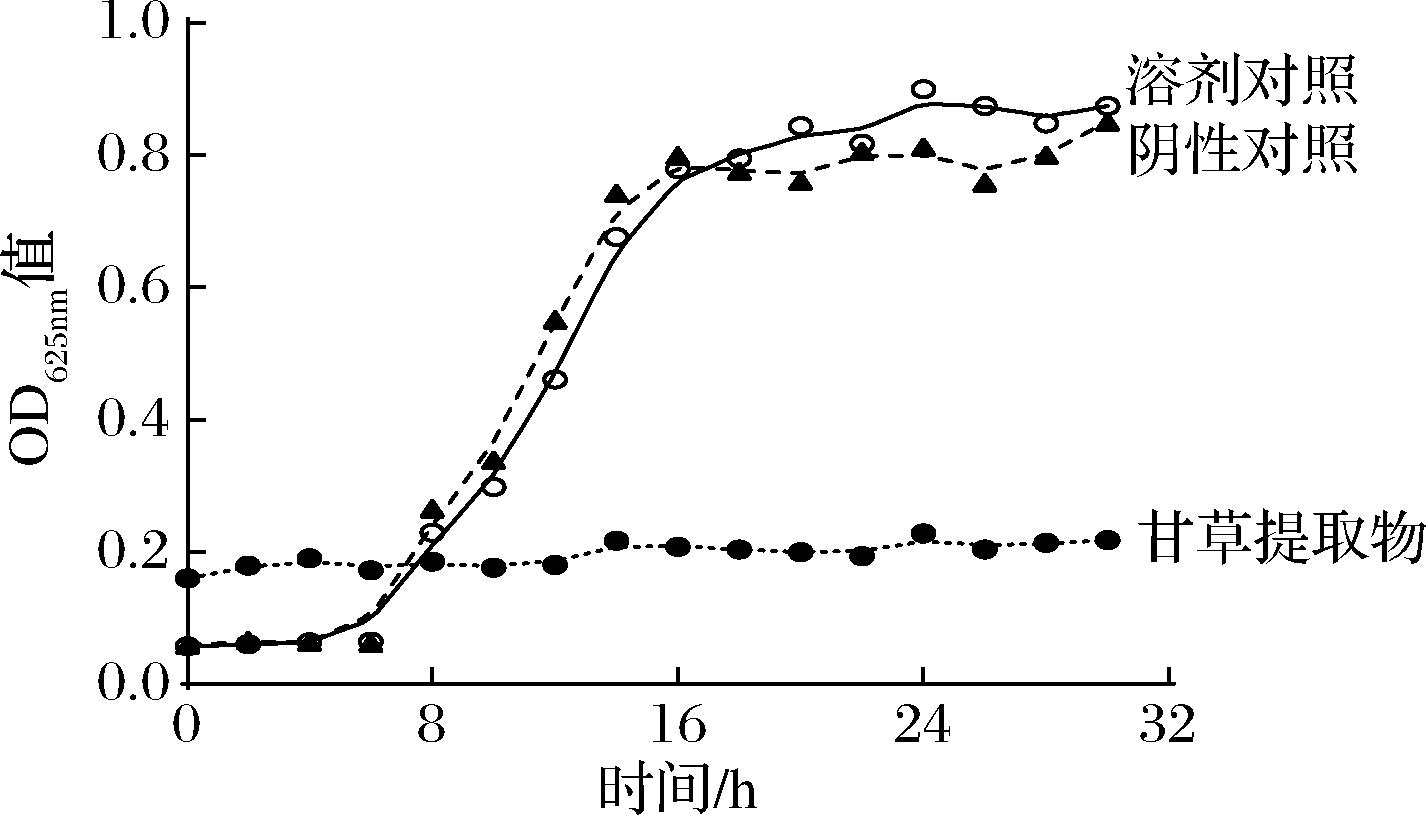
图1 甘草提取物对S.aureus作用后的生长曲线
Fig.1 Kinetic growth profile of S.aureus upon exposure to licorice extract
2.2 甘草提取物对S.aureus胞内ROS的影响
ROS是超氧阴离子、过氧化氢、羟自由基的总称,参与细胞内的生化反应,ROS水平升高会使细胞氧化应激能力发生变化导致系列机能障碍[17]。DCFH-DA是一种荧光探针,它可以自由穿过细胞膜且被胞内酯酶氧化成DCFH(DCFH不能穿透细胞膜),同时DCFH可以被胞内活性氧氧化成二氯荧光素DCF,因此DCF的荧光强度可以用来推测细菌胞内ROS水平[18]。
甘草提取物对S.aureus胞内ROS积累水平的影响如图2所示。与阴性对照相比,甘草提取物处理组细胞DCF荧光强度增强,达到了(3 845±1.55)%,并有显著性差异(P≤0.05)。实验结果表明甘草提取物可以刺激胞内的ROS过度产生,大量ROS攻击生物膜中多聚不饱和脂肪酸引起脂质过氧化作用,形成脂质过氧化物,降低膜的流动性,使膜的通透性增加,抑制电子传递和氧化磷酸化,引起能量代谢障碍。
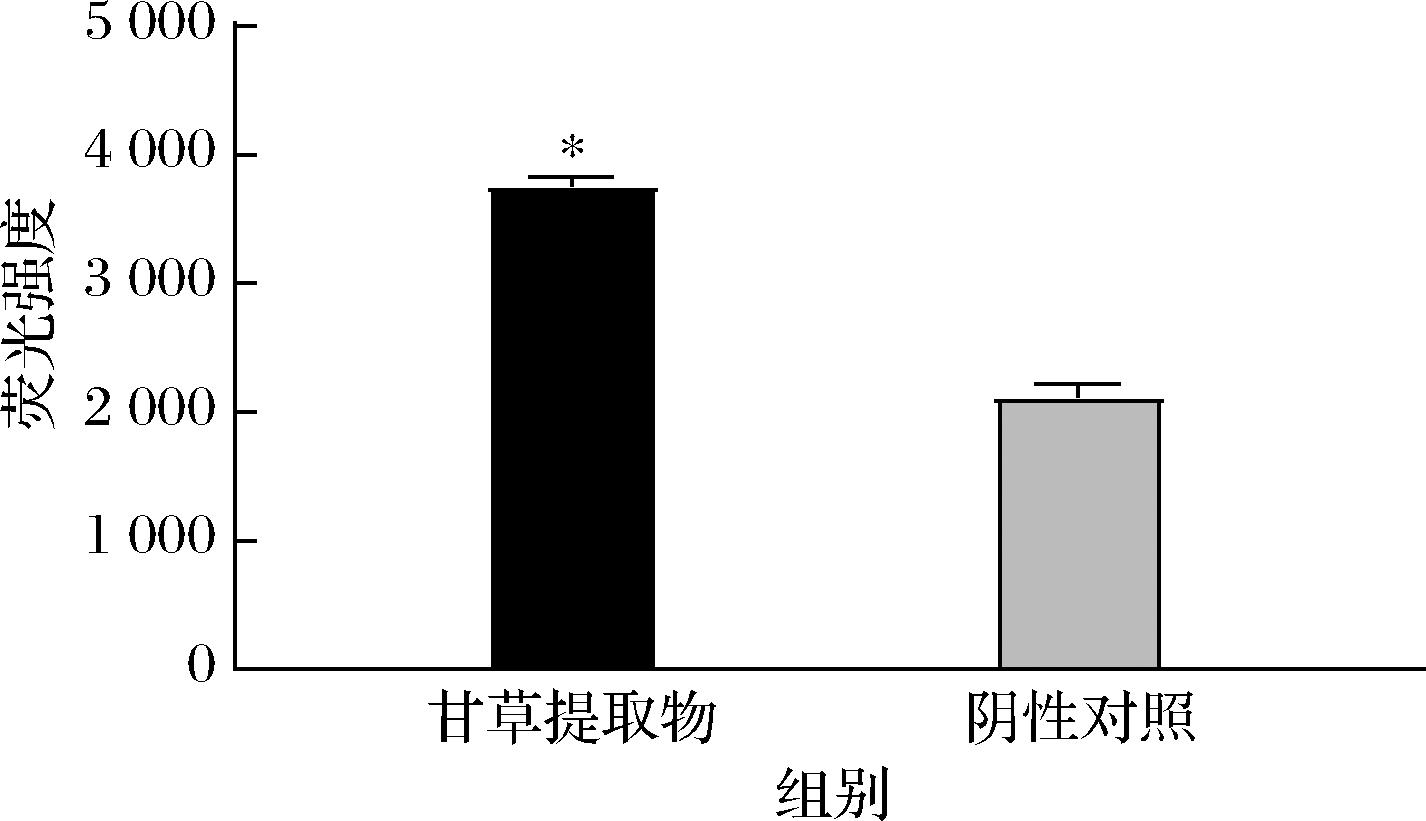
图2 甘草提取物对S.aureus产生活性氧的影响
Fig.2 Impact of licorice extract on the generation of ROS in S.aureus
注:*表示P<0.05,**表示P<0.01,***表示P<0.001,ns表示无显著差异(下同)。
2.3 对S.aureus细胞壁膜作用研究—胞外核酸泄漏量结果
核酸作为细胞内重要的大分子物质,正常状态下不能透过细胞膜释放出胞外,当菌体细胞膜完整性受到破坏时,核酸可泄漏到菌悬液中,由于核酸在260 nm处有强吸收,所以可通过检测菌悬液中核酸泄漏(260 nm处吸光度)的变化来评价细胞膜是否完整[19]。
甘草提取物作用于S.aureus后的核酸泄露量结果如图3所示。阴性对照组的菌悬液中核酸浓度随时间延长呈缓慢增加趋势;甘草提取物处理组的菌悬液胞外核酸浓度在0~10 h内逐渐增长,且最大泄露量为(22.10±0.80) ng/μL。与对照组相比,甘草提取物处理组2 h核酸泄漏量呈现出现极显著增加(P≤0.01),后期增加程度变缓。上述结果表明,甘草提取物可以在早期通过破坏S.aureus细胞膜的完整性,致使其通透性增加,引起胞内核酸的渗漏。
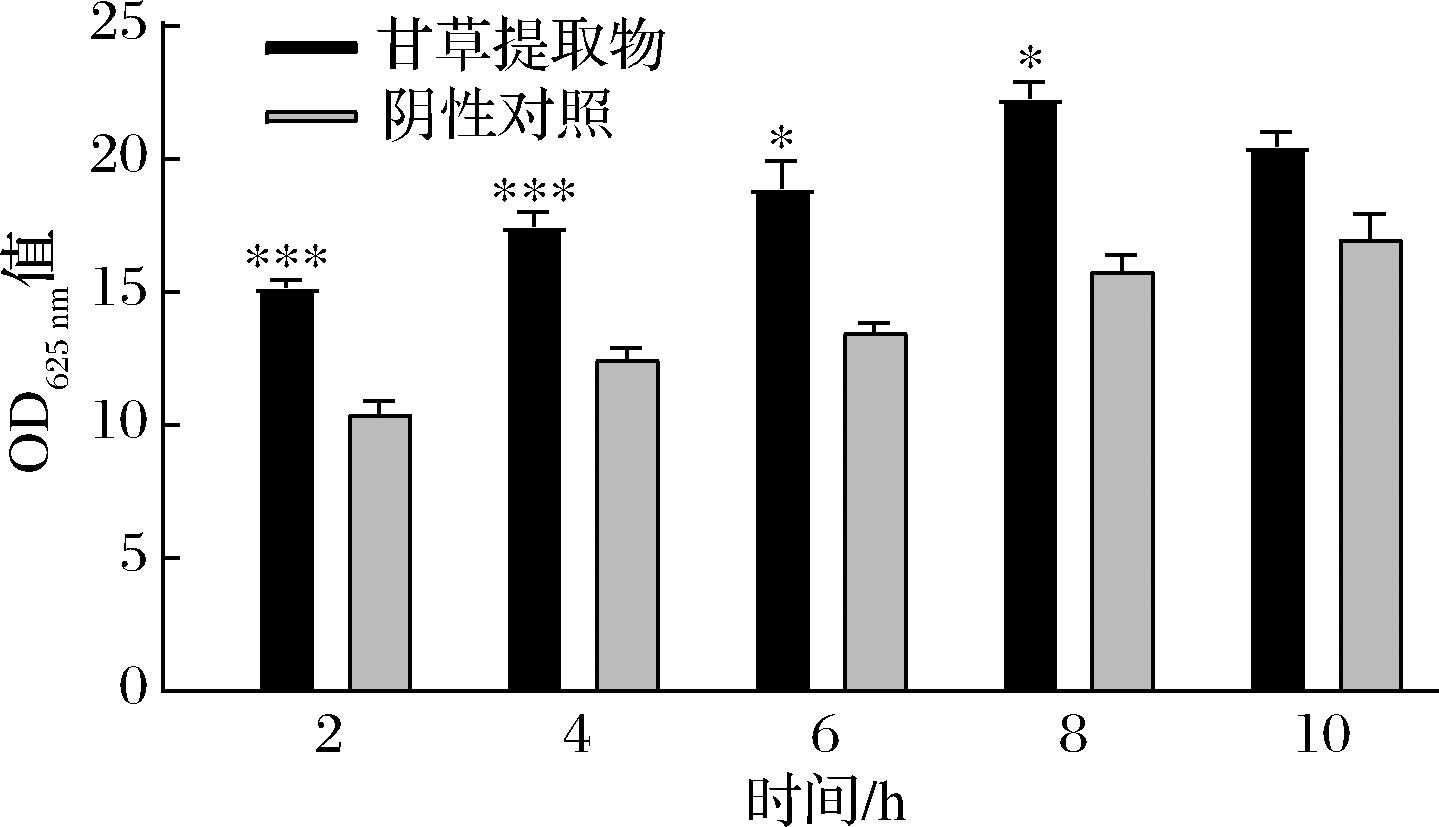
图3 甘草提取物作用于S.aureus后的核酸泄露量变化结果
Fig.3 Alterations in nucleic acid leakage from S.aureus post-exposure to licorice extract
2.4 对S.aureus胞内蛋白作用研究
2.4.1 甘草提取物对S.aureus总蛋白合成影响
能量代谢关键酶、组织蛋白、细胞质膜蛋白及受体蛋白等主要化学组成为蛋白质,胞内蛋白质合成水平关系到菌体细胞健康状态,监测胞内蛋白质合成水平可表征菌体生存状态[20]。
甘草提取物作用于S.aureus后的总蛋白合成量变化结果如图4所示。阴性对照组总蛋白合成量为(2.53±0.17) mg/mL,甘草提取物处理组总蛋白合成量为(2.40±0.16) mg/mL,与阴性对照相比实验组蛋白合成量下降了5.1%,具有显著性差异(P<0.05),该结果表明,甘草提取物对S.aureus的总蛋白合成有一定抑制作用,但是抑制程度较小。
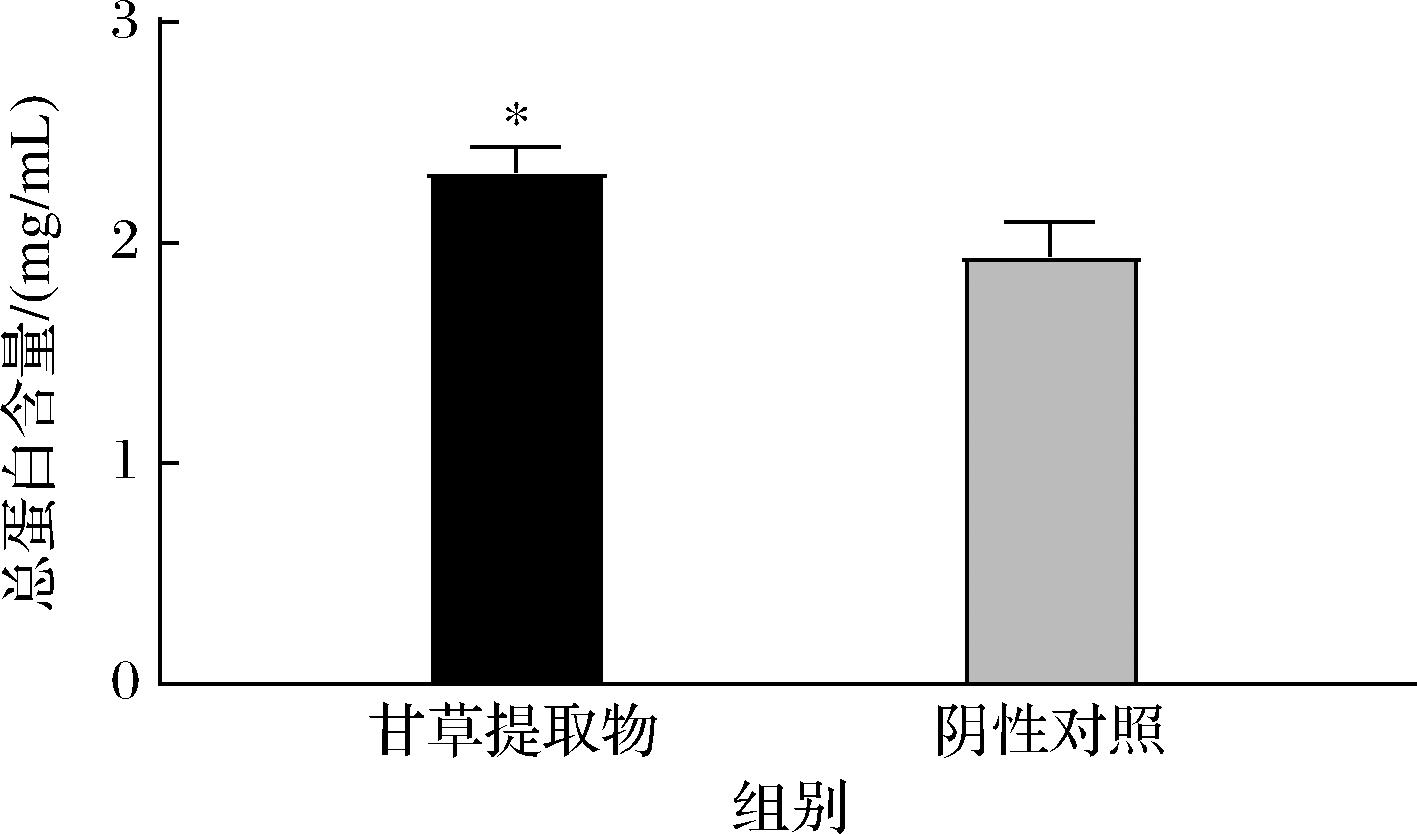
图4 细胞内总蛋白含量检测结果
Fig.4 Results from the total intracellular protein content assay
2.4.2 甘草提取物对S.aureus细胞代谢活力影响
有研究表明微生物细胞壁膜被破坏后,依赖于膜完整性的代谢系统也会受到影响[21],因而本研究测定了S.aureus细胞的代谢活力和2种能量代谢酶的变化。活细菌在脱氢酶作用下能产生氢离子将氯化碘硝基四唑紫活化成甲瓒,且生成量与细菌代谢活力成正相关,因此可以通过甲瓒的生成速率检测细菌的代谢活力[22]。
甘草提取物作用于S.aureus后的细胞代谢活力变化结果如图5所示。阴性对照组细胞相对代谢活力为(1.91±0.02),实验组细胞相对代谢活力分别是(0.17±0.00),经甘草提取物处理后的菌体新陈代谢活力下降了90.86%,具有极显著差异(P≤0.01)。甘草提取物可能破坏了S.aureus菌体细胞壁膜结构,增强细胞壁膜通透性,同时,甘草提取物还可导致细胞壁膜氧化损伤并诱导氧化应激产生过量自由基,从而破坏细胞壁膜结构与功能。S.aureus新陈代谢过程中,为其传递能量的电子传递链主要位于细胞质膜内表面,当菌体细胞质膜受到甘草提取物刺激与破坏之后,可能丧失为新陈代谢传递能量的功能,因此,菌体代谢活力显著降低。
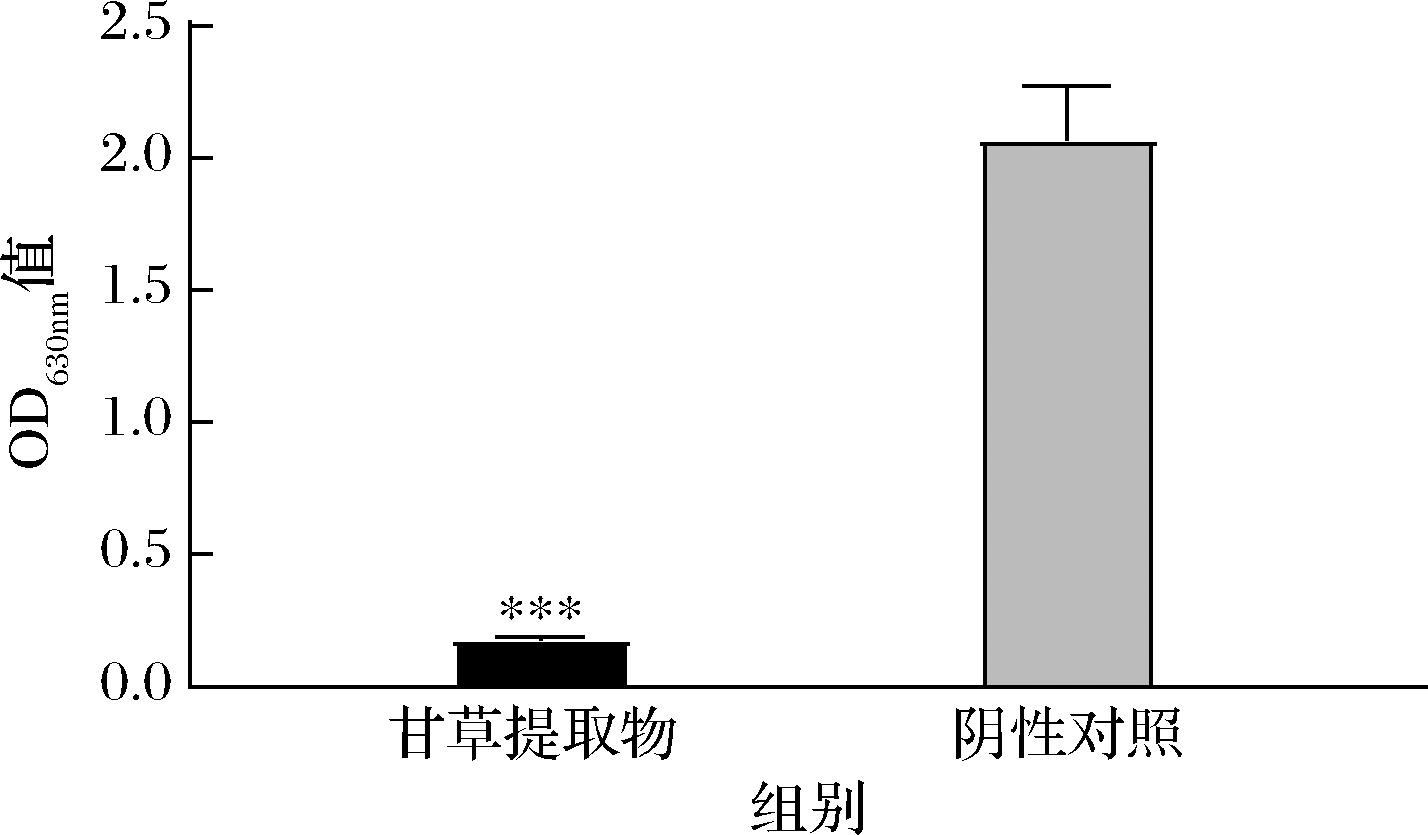
图5 细胞代谢活力检测结果
Fig.5 Cellular metabolic viability assay results
2.4.3 甘草提取物对S.aureus两种代谢酶活力影响
SDH是细胞膜中唯一参与氧化磷酸化的多亚基酶,是三羟酸循环中电子传递的枢纽之一,其在细胞代谢能力中起着重要作用[23]。ATPase活力下降及合成量降低会造成胞内离子浓度降低及胞外离子分布异常等情况进而影响菌体的物质运输、代谢等[24]。有报道显示,微生物细胞壁、膜被破坏,依赖于膜结构完整性的能量代谢系统及细胞对物质的选择透过性也会遭到破坏,使营养物质以及代谢产物无法穿过细胞膜,使微生物生长停滞,因此设置溶菌酶处理组作为实验对照组。
甘草提取物作用于S.aureus后胞内总 ATPase 活力变化结果如图6-a所示,溶菌酶处理组与阴性实验组总ATPase活力分别为(0.04±0.01)、(0.81±0.12) U/ mL,甘草提取物处理组总ATPase活力为(0.098±0.01) U/mL,与阴性对照组相比总ATPase活力下降了87.9%,存在显著差异(P<0.05)。
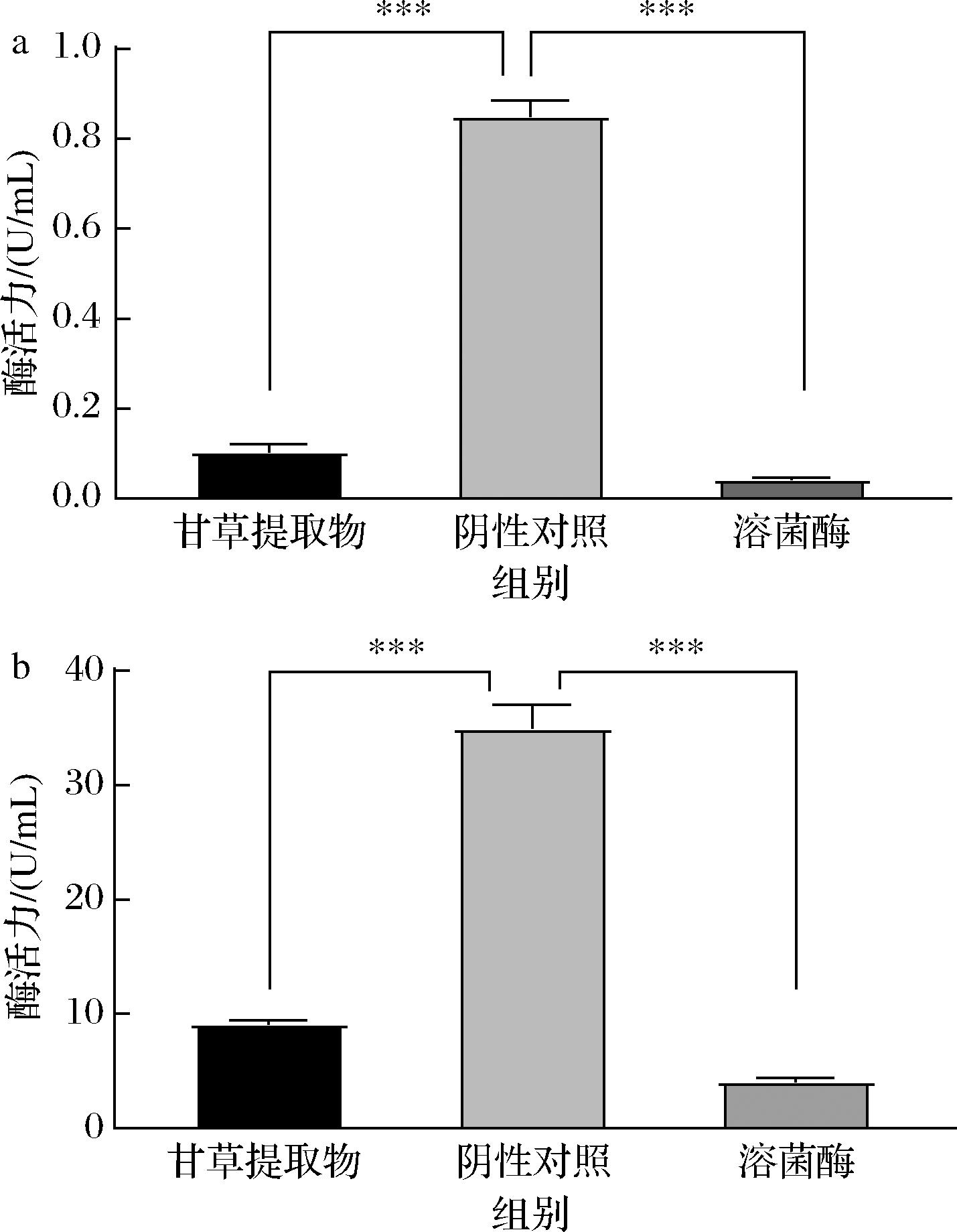
a- ATPase酶活力变化;b-SDH酶活力变化
图6 细胞酶活性的变化
Fig.6 Variations in cellular enzymatic activity
甘草提取物作用于S.aureus后胞内SDH活力变化结果如图6-b所示。阳性对照与阴性实验组SDH活力分别为(4±0.1)、(37±1) U/mL,甘草提取物处理组SDH活力为(9.5±0.5) U/mL,与阴性对照组相比下降了74.32%,存在显著差异(P<0.05)。实验结果表明,甘草提取物处理后,胞内2种细胞代谢活力关键酶活力明显降低,可能与细胞质膜结构受损导致细胞质膜锚锭的能量代谢酶功能受损有关[25]。
2.5 甘草提取物与S.aureus基因组DNA的作用方式
DNA是携带生物遗传信息的重要生物大分子物质,抑菌剂破坏壁膜进入细胞内部后可能会与其进一步作用,导致其结构、功能的变化而影响细菌生存,例如DNA损伤或突变可导致细菌的损伤或死亡,因此与DNA结合也是抑菌剂作用靶点之一[26]。已有研究表明,抑菌剂小分子可以以不同方式与DNA结合,主要包括在相邻的碱基对之间插入的嵌插结合、侵入次要凹槽和主要凹槽的沟槽结合以及静电相互作用,其中嵌入和沟槽结合是小分子的主要DNA 结合模式,而阳离子物质和带负电荷的DNA磷酸骨架之间的静电相互作用通常发生在螺旋的外部[27]。
2.5.1 与S.aureus基因组DNA结合紫外光谱分析
小分子物质与DNA发生以非共价键结合为主要特征的静电结合和沟槽结合时,加入DNA后的紫外吸收光谱会发生增色效应,或者很小的红移与不明显减色效应;当发生嵌插结合时,光谱将发生明显减色效应与红移,减色效应越显著说明小分子物质的嵌插效果越强[26]。
紫外扫描得到了细菌基因组 DNA 与各抑菌剂作用下的吸收光谱图(图7)。加入0.5 mg/mL细菌基因组DNA后甘草提取物的紫外吸收强度产生明显增色效应,达到了原来的140.09%,且最大波长从320 nm红移至330 nm,推测其与DNA之间存在静电或沟槽结合。

图7 甘草提取物与S.aureus DNA紫外光谱结果
Fig.7 Ultraviolet spectroscopy results of the interaction between licorice extract and S.aureus DNA
2.5.2 与S.aureus基因组DNA竞争性荧光光谱分析
荧光淬灭指由于荧光物质分子与其他溶剂分子相互作用引起的荧光强度降低的现象。DNA本身荧光很弱,因此,在DNA与小分子的研究中,可借助荧光探针来修饰DNA,从而达到间接研究的目的。常用的荧光探针分子有,吖啶橙、EB、DAPI、中性红等。本研究以甘草提取物本身荧光和2种荧光探针(EB、DAPI)探究甘草提取物与S.aureus基因组DNA的作用方式。
EB是一种灵敏度高,选择性强的DNA荧光探针,结构中含有一个可嵌入DNA碱基平面的三环平面基团,可通过静电吸附与DNA磷酸骨架结合,或以嵌入方式插入双链DNA碱基平面[27],此时其荧光性质不变;当甘草提取物与EB竞争性共存并结合DNA时,EB-DNA体系荧光强度会减弱,说明甘草提取物以类似EB嵌插方式与DNA结合。DAPI是一种典型的与DNA双螺旋的小沟处相互作用的荧光剂,若甘草提取物竞争DAPI在DNA小沟处作用的结合位点,那么DAPI-DNA复合物的荧光强度将会发生明显的降低[16]。
2.5.2.1 EB竞争性结合DNA荧光光谱分析
甘草提取物对EB-DNA体系荧光强度的影响由图8-a所示,EB-DNA复合物特征性荧光吸收峰在440 nm处,最强荧光强度为(3 866±15)%;实验组在460 nm处有明显吸收峰,且随甘草提取物浓度增加荧光强度分别增加为144.58%、529.02%;复合物发射峰特征性光谱位置发生明显红移,说明甘草提取物添加后对EB-DNA体系微环境造成一定影响,但并未竞争性将EB从基因组DNA碱基平面替换下来。由此可说明,甘草提取物与S.aureus基因组DNA部分发生了静电结合,并未发生嵌插结合。
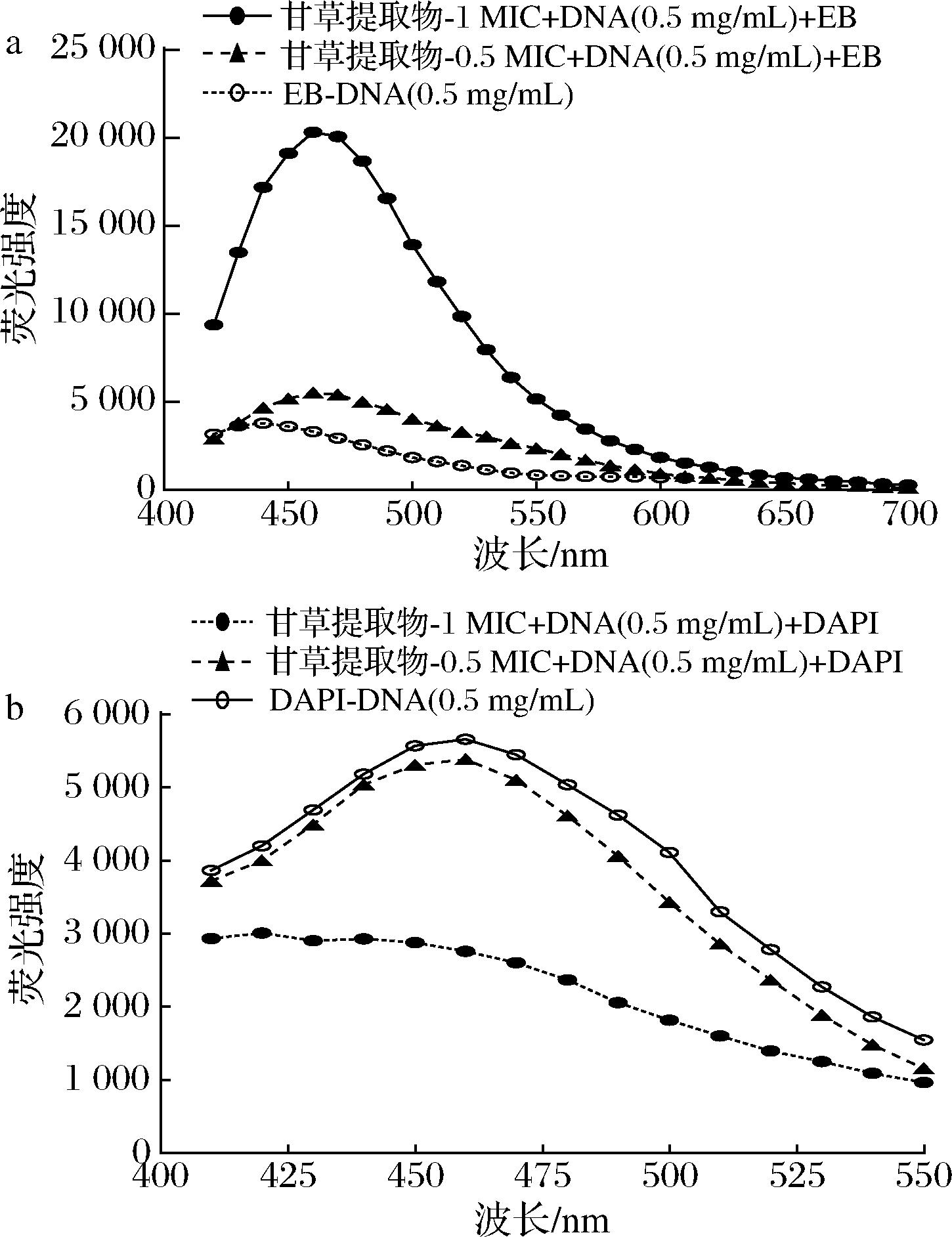
a-甘草提取物与S.aureus DNA EB-竞争性荧光光谱结果;b-甘草提取物与S.aureus DNA DAPI-竞争性荧光光谱结果
图8 甘草提取物与S.aureus DNA竞争性荧光光谱结果
Fig.8 Competitive fluorescence spectroscopy results of licorice extract with S.aureus DNA
2.5.2.2 DAPI竞争性结合DNA荧光光谱分析
甘草提取物对 DAPI-DNA 体系荧光强度的影响见图8-b。实验组在460 nm处有明显吸收峰,且随着甘草提取物浓度增加荧光强度分别降低为95.13%、53.28%;实验结果表明,甘草提取物对DAPI-DNA体系荧光有猝灭作用,因此推测甘草提取物与S.aureus基因组DNA发生沟槽结合。
以上紫外与荧光竞争性分析结果表明,甘草提取物与S.aureus基因组DNA存在相互作用,其可能通过静电或者沟槽结合的方式发生作用。
综合上述实验结果,推测甘草提取物的抑菌机理为通过增加胞内ROS含量,其有效成分的亲脂部分作用于细胞磷脂双分子层等破坏细胞膜结构和功能、进而破坏依赖于膜完整性的代谢系统,从而抑制菌体增殖。
3 结论与讨论
本研究结果表明,甘草提取物对S.aureus具有良好的抗菌活性,其MIC为10.44 mg/mL。通过对甘草提取物处理后的S.aureus进行了生长曲线、ROS水平、细胞壁膜泄露、蛋白质总合成量、代谢活力和DNA光谱分析,以探究甘草提取物对S.aureus的抑菌机制。研究结果表明,甘草提取物增加了S.aureus细胞膜通透性,并以静电和沟槽两种方式与DNA结合。SINGH等[28]的研究指出甘草黄酮能够诱导金黄色葡萄球菌氧化应激,这与本研究甘草提取物对S.aureus胞内ROS影响的实验结果一致。HARAGUCHI等[29]发现甘草查尔酮通过抑制电子呼吸链干扰细菌能量代谢,本研究结果进一步表明经甘草提取物处理后的S.aureus菌体的新陈代谢活力下降了90.86%。此外本研究还发现2种代谢关节酶活力也显著下降,与阴性对照组相比总ATPase活力下降了87.9%,SDH活力与阴性对照组相比下降了74.32%。甘草提取物能明显的干扰S.aureus能量代谢体系,降低能量代谢过程中SDH和总ATPase活力。因此,甘草提取物导致了微生物菌体能量代谢受阻,能量供应不足,新陈代谢速度变慢。本实验证实了甘草提取物对S.aureus具有显著地抑制活性,并阐述了其抑菌机理。实验结果可为甘草提取物作为植物源食品防腐剂应用于食品安全领域提供理论参考。
[1] DE JESUS J H F, SZILáGYI I M, REGDON G Jr, et al. Thermal behavior of food preservative sorbic acid and its derivates[J]. Food Chemistry, 2021, 337:127770.
[2] ALMADIY A A, NENAAH G E, AL ASSIUTY B A, et al. Chemical composition and antibacterial activity of essential oils and major fractions of four Achillea species and their nanoemulsions against foodborne bacteria[J]. LWT-Food Science and Technology, 2016, 69:529-537.
[3] 黄艳娥, 刘海波. 食品防腐剂对人体健康的影响及发展趋势[J]. 化工中间体, 2005(7):1-6.HUANG Y E, LIU H B. The affect of food preservatives on human health and the future development[J]. Chemincal Intermediate, 2005(7):1-6.
[4] WAKABAYASHI Y, UMEDA K, YONOGI S, et al. Staphylococcal food poisoning caused by Staphylococcus argenteus harboring staphylococcal enterotoxin genes[J]. International Journal of Food Microbiology, 2018, 265:23-29.
[5] 王彩君, 翟宇. 甘草的生物功能及其在畜禽生产中的应用[J]. 饲料研究, 2023, 46(8):135-139.WANG C J, ZHAI Y. Biological function of licorice and its application in livestock and poultry production[J]. Feed Research, 2023, 46(8):135-139.
[6] JU J, YAO W R, SUN S L, et al. Assessment of the antibacterial activity and the main bacteriostatic components from bayberry fruit extract[J]. International Journal of Food Properties, 2018, 21(1):1043-1051.
[7] ARAYA-CONTRERAS T, VEAS R, ESCOBAR C A, et al. Antibacterial effect ofLuma apiculata(DC.) burret extracts in clinically important bacteria[J]. International Journal of Microbiology, 2019, 2019:7803726.
[8] GOEL S, MISHRA P. Thymoquinone inhibits biofilm formation and has selective antibacterial activity due to ROS generation[J]. Applied Microbiology and Biotechnology, 2018, 102(4):1955-1967.
[9] MORIN M P, BEDRAN T B L, FOURNIER-LARENTE J, et al. Green tea extract and its major constituent epigallocatechin-3-gallate inhibit growth and halitosis-related properties of Solobacterium moorei[J]. BMC Complementary and Alternative Medicine, 2015, 15:48.
[10] XIANG Q S, KANG C D, NIU L Y, et al. Antibacterial activity and a membrane damage mechanism of plasma-activated water against Pseudomonas deceptionensis CM2[J]. LWT, 2018, 96:395-401.
[11] LIU G R, SONG Z Q, YANG X L, et al. Antibacterial mechanism of bifidocin A, a novel broad-spectrum bacteriocin produced by Bifidobacterium animalis BB04[J]. Food Control, 2016, 62:309-316.
[12] 刁明明. 半乳糖基月桂酸甘油单酯的抑菌活性及机理的研究[D]. 南京: 南京农业大学, 2016.DIAO M M. Antibacterial Activity and Mechanism of Monolauroyl-Galactosylglycerol against Bacterial[D]. Nanjing: Nanjing Agricultural University, 2016.
[13] GUO Y R, LIU Y, ZHANG Z H, et al. The antibacterial activity and mechanism of action of luteolin against Trueperella pyogenes[J]. Infection and Drug Resistance, 2020, 13:1697-1711.
[14] WU Y P, BAI J R, ZHONG K, et al. A dual antibacterial mechanism involved in membrane disruption and DNA binding of 2R, 3R-dihydromyricetin from pine needles of Cedrus deodara against Staphylococcus aureus[J]. Food Chemistry, 2017, 218:463-470.
[15] HEGDE A H, PRASHANTH S N, SEETHARAMAPPA J. Interaction of antioxidant flavonoids with calf thymus DNA analyzed by spectroscopic and electrochemical methods[J]. Journal of Pharmaceutical and Biomedical Analysis, 2012, 63:40-46.
[16] LYU M X, WANG M W, LU K, et al. DNA/Lysozyme-binding affinity study of novel peptides from TAT (47-57) and BRCA1 (782-786) in vitro by spectroscopic analysis[J]. Spectrochimica Acta. Part A, Molecular and Biomolecular Spectroscopy, 2019, 209:109-117.
[17] DWYER D J, BELENKY P A, YANG J H, et al. Antibiotics induce redox-related physiological alterations as part of their lethality[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(20): E2100-E2109.
[18] GOSWAMI M, MANGOLI S H, JAWALI N. Involvement of reactive oxygen species in the action of ciprofloxacin against Escherichia coli[J]. Antimicrobial Agents and Chemotherapy, 2006, 50(3):949-954.
[19] YUN J, LEE H, KO H J, et al. Fungicidal effect of isoquercitrin via inducing membrane disturbance[J]. Biochimica et Biophysica Acta, 2015, 1848(2):695-701.
[20] ZHU Y L, ZHANG S. Antibacterial activity and mechanism of lacidophilin from Lactobacillus pentosus against Staphylococcus aureus and Escherichia coli[J]. Frontiers in Microbiology, 2020, 11:582349.
[21] 彭勇. 可食性壳聚糖活性包装膜成膜组分研究[D]. 上海: 上海交通大学, 2014.PENG Y. Study on film-forming components of edible chitosan active packaging film[D].Shanghai: Shanghai Jiao Tong University, 2014.
[22] STENDEL R, BIEFER H R C, DÉK NY G M, et al. The antibacterial substance taurolidine exhibits anti-neoplastic action based on a mixed type of programmed cell death[J]. Autophagy, 2009, 5(2):194-210.
NY G M, et al. The antibacterial substance taurolidine exhibits anti-neoplastic action based on a mixed type of programmed cell death[J]. Autophagy, 2009, 5(2):194-210.
[23] SHU H Z, CHEN H M, WANG X L, et al. Antimicrobial activity and proposed action mechanism of 3-carene against Brochothrix thermosphacta and Pseudomonas fluorescens[J]. Molecules, 2019, 24(18):3246.
[24] GULCAN H, OZTURK I C, ARSLAN S. Alterations in antioxidant enzyme activities in cerebrospinal fluid related with severity of hypoxic ischemic encephalopathy in newborns[J]. Biology of the Neonate, 2005, 88(2):87-91.
[25] 张丽, 高健, 刘长青, 等. 耐受性工程调控微生物细胞工厂胁迫抗性[J]. 生物工程学报, 2022, 38(4):1373-1389.ZHANG L, GAO J, LIU C Q, et al. Tolerance engineering regulates stress resistance of microbial cell factory[J]. Chinese Journal of Biotechnology, 2022, 38(4):1373-1389.
[26] LIU B M, BAI C L, ZHANG J, et al. In vitro study on the interaction of 4, 4-dimethylcurcumin with calf thymus DNA[J]. Journal of Luminescence, 2015, 166:48-53.
[27] PRABHAKARAN V, JEYASUNDARI J, VASANTHA V S, et al. Interaction of two flavonoids with calf thymus dna: A multi-spectroscopic, electrochemical and molecular modelling approach[J]. European Chemical Bulletin, 2018, 7(1):10.
[28] SINGH V, PAL A, DAROKAR M P. A polyphenolic flavonoid glabridin: Oxidative stress response in multidrug-resistant Staphylococcus aureus[J]. Free Radical Biology &Medicine, 2015, 87:48-57.
[29] HARAGUCHI H, TANIMOTO K, TAMURA Y, et al. Mode of antibacterial action of retrochalcones from Glycyrrhiza inflata[J]. Phytochemistry, 1998, 48(1):125-129.