溃疡性结肠炎(ulcerative colitis, UC)是一种常见的慢性炎症性肠病 (inflammatory bowel disease, IBD),病灶区域大多在直肠,也可进一步扩散至整个结肠,常伴随有黏膜下层充血水肿、糜烂性溃疡等症状[1]。UC的发病率逐年增加,并在世界范围内呈现出年轻化的趋势[2]。临床上通常使用氨基水杨酸制剂、免疫调节剂、糖皮质激素和微生物制剂等药物治疗UC,但长期服用上述药物可能诱发不良反应,导致患者生活质量降低,增加患者经济负担[3]。
肠道菌群参与人体营养物质的吸收和代谢,维持肠道的动态平衡和生理功能,在调节免疫、神经和内分泌系统中起着重要作用[4]。肠道菌群在UC的发生发展及治疗中起着重要作用[5],基于肠道菌群的治疗UC的疗法,如粪便移植[6]、复合益生元[7]等,正逐步投入临床。近年来天然产物因其高效和安全性逐步成为治疗UC的替代策略。岩藻多糖是一类主要来源于褐藻细胞间组织及分泌的黏液中的天然硫酸化多糖[8]。岩藻多糖具有多种活性功能,如抗肿瘤[9]、抗氧化[10]和增强机体免疫[11]等。作为一类具有调控肠道微生态功能的益生元,岩藻多糖不仅能够重塑肠道菌群结构,还能有效地保护肠道屏障,促进肠道黏膜的健康恢复[12]。目前有关岩藻多糖对UC的作用研究相对较少,本研究采用3%(质量分数,下同)葡聚糖硫酸钠盐(dextran sulfate sodium salt,DSS)诱导建立UC小鼠模型,通过16S RNA基因测序探究岩藻多糖对DSS诱导UC小鼠肠道菌群的影响,以揭示岩藻多糖缓解UC的潜在机制。
1 材料与方法
1.1 材料与试剂
DSS,美国MP生物医疗公司;岩藻多糖,青岛明月海藻集团有限公司;美沙拉嗪缓释颗粒,上海爱的发制药有限公司;白细胞介素-1β (interleukin 1β, IL-1β)、白细胞介素-6 (interleukin 6, IL-6)、肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α) ELISA试剂盒,上海恒远生物科技有限公司。
1.2 仪器与设备
Multiskan SkyHigh全波长酶标仪,美国赛默飞世尔科技公司;Centrifuge 5418 R微量离心机,德国Eppendorf公司;SKGZ混合型碾磨仪,上海必横生物科技有限公司;ADNP-9162电热恒温培养箱,上海精宏实验设备有限公司;DM6 B正置生物显微镜,德国徕卡公司。
1.3 实验动物
40只雄性C57BL/6小鼠,SPF级,6周龄,体重18~20 g,上海灵畅生物科技有限公司购入,生产许可证号:SCXK(沪)2013-0018。饲养环境要求为温度保持22~25 ℃,相对湿度保持55%~65%,12 h明亮/12 h 黑暗交替。本研究中所有动物实验均符合《赫尔辛基宣言》的原则。
1.4 实验方法
1.4.1 模型建立及分组给药
将40只雄性C57BL/6小鼠适应性饲养3 d后,随机分成4组(n=10):对照组、模型组、美沙拉嗪组和岩藻多糖组。第1~7天,对照组小鼠正常饮水,其余各小组小鼠饮用3% DSS溶液。自造模第1天起进行持续9 d的药物干预:美沙拉嗪组、岩藻多糖组小鼠按10 mg/kg的剂量灌胃相应药物,对照组和模型组小鼠给予同体积生理盐水,每天1次。给药期间,每日观察小鼠一般情况、体质量变化、粪便黏稠程度、便血程度,并对其进行记录和评分,其中粪便特征的评分标准如表1所示。
表1 粪便特征的评分标准
Table 1 Criteria for scoring stool characteristics

评分/分粪便状态便血情况0正常无便血1介于正常与松散之间介于无便血与隐血之间2松散隐血3介于松散与稀便之间介于隐血与肉眼便血之间4稀便肉眼便血
1.4.2 样品采集与处理
给药结束后,将各组小鼠脱颈处死,剖取收集全结肠组织,测量结肠长度。沿肠管方向剖开整段结肠,将结肠内容物存放于冻存管中,用液氮快速冷却,然后放入-80 ℃的冰箱保存。用4 ℃预冷PBS清洗结肠,取约1 cm远端结肠 (近肛门段)置于4%(体积分数)多聚甲醛溶液中,于室温下过夜固定。取中间段结肠保存于-20 ℃冰箱中,用于后续炎症因子检测。
1.4.3 结肠病理组织学观察及评分
取4%多聚甲醛固定的各组小鼠病灶部位的结肠组织,进行常规石蜡包埋切片,苏木精-伊红染色法(hematoxylin-eosin staining,HE染色)于显微镜下观察结肠病变情况并评分。参考Geboes评分标准[13]根据黏膜结构变化、炎症细胞浸润等情况进行阅片评分,评分结果取均值。
1.4.4 结肠组织炎症因子检测
取中间段结肠组织,按料液比1∶5(g∶mL)加入生理盐水后于低温研磨仪中匀浆。将匀浆液于4 ℃条件下,3 000 r/min离心10 min,取上清液。利用ELISA试剂盒检测结肠组织中炎症因子IL-1β、IL-6、TNF-α的分泌情况。
1.4.5 粪便中细菌DNA的提取及测序
小鼠粪便中细菌DNA的提取及测序由联川生物技术股份有限公司进行。
1.5 数据统计学处理
采用 Graphpad Prism 9软件对数据进行统计分析。使用t检验比较组间数据,使用单因素方差分析比较多组数据,使用Tukey′s multiple comparisons test进行事后检验。以P<0.05表示差异有统计学意义。
2 结果与分析
2.1 岩藻多糖对UC小鼠体重变化率、粪便粘稠度及便血程度的影响
小鼠体质量变化如图1所示,自实验第6天起,模型组小鼠体质量与对照组相比呈现显著下降(P<0.01);美沙拉嗪组、岩藻多糖组小鼠的体质量与对照组相比出现下降但与模型组相比下降幅度降低且有显著性差异(P<0.05);岩藻多糖组小鼠的体质量变化与美沙拉嗪组相当。如图2所示,自造模第3天起,模型组小鼠粪便状态出现异常变化,稀便、血便症状日渐严重。在美沙拉嗪及岩藻多糖的干预后,小鼠粪便状态和便血情况均有所改善,且岩藻多糖组小鼠的便血情况的改善优于美沙拉嗪组。结果表明,岩藻多糖可以减缓UC小鼠体重的下降,改善UC小鼠的粪便状态及便血情况。
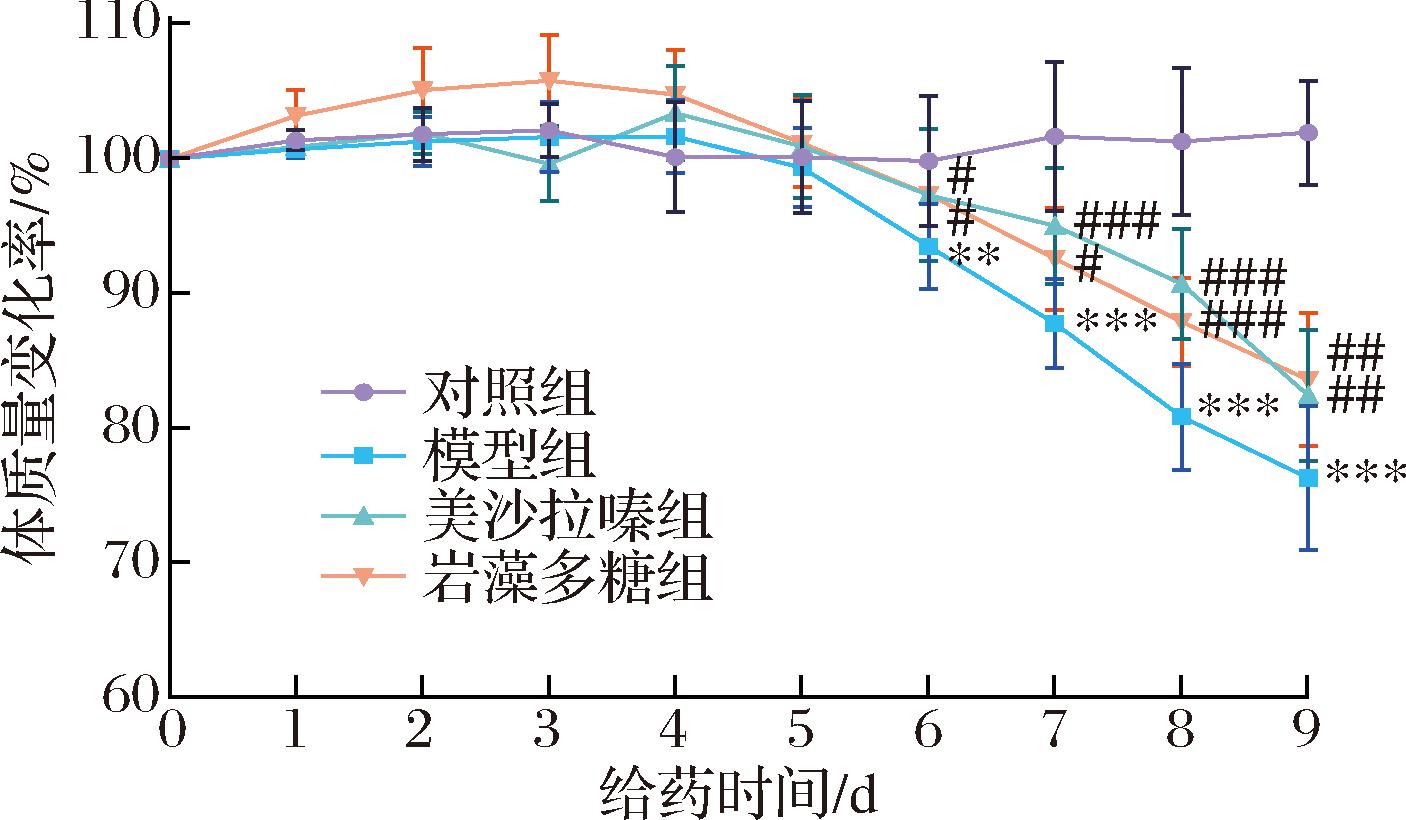
图1 岩藻多糖对DSS诱导的小鼠体质量的影响
Fig.1 Effect of fucoidan on body mass induced by DSS
注:与对照组相比**P<0.01,***P< 0.001;与模型组相比#P<0.05,##P<0.01,###P<0.001(下同)。

a-粪便黏稠度;b-便血程度
图2 岩藻多糖对DSS诱导的小鼠粪便黏稠度及便血程度的影响
Fig.2 Effects of fucoidan on fecal viscosity and degree of stool blood induced by DSS in mice
2.2 岩藻多糖对UC小鼠结肠长度及病理组织学的影响
UC小鼠会发生结肠长度缩短、结肠组织损伤等。如图3-a所示,对照组小鼠的结肠长度(6.92 cm)与模型组(4.39 cm)存在显著差异(P<0.001);与对照组相比,美沙拉嗪组(4.86 cm)和岩藻多糖组(5.49 cm)小鼠的结肠长度均缩短,且岩藻多糖组小鼠的结肠长度较模型组相比显著增加(P<0.001)。结果表明,岩藻多糖能改善UC小鼠结肠长度减少的现象。
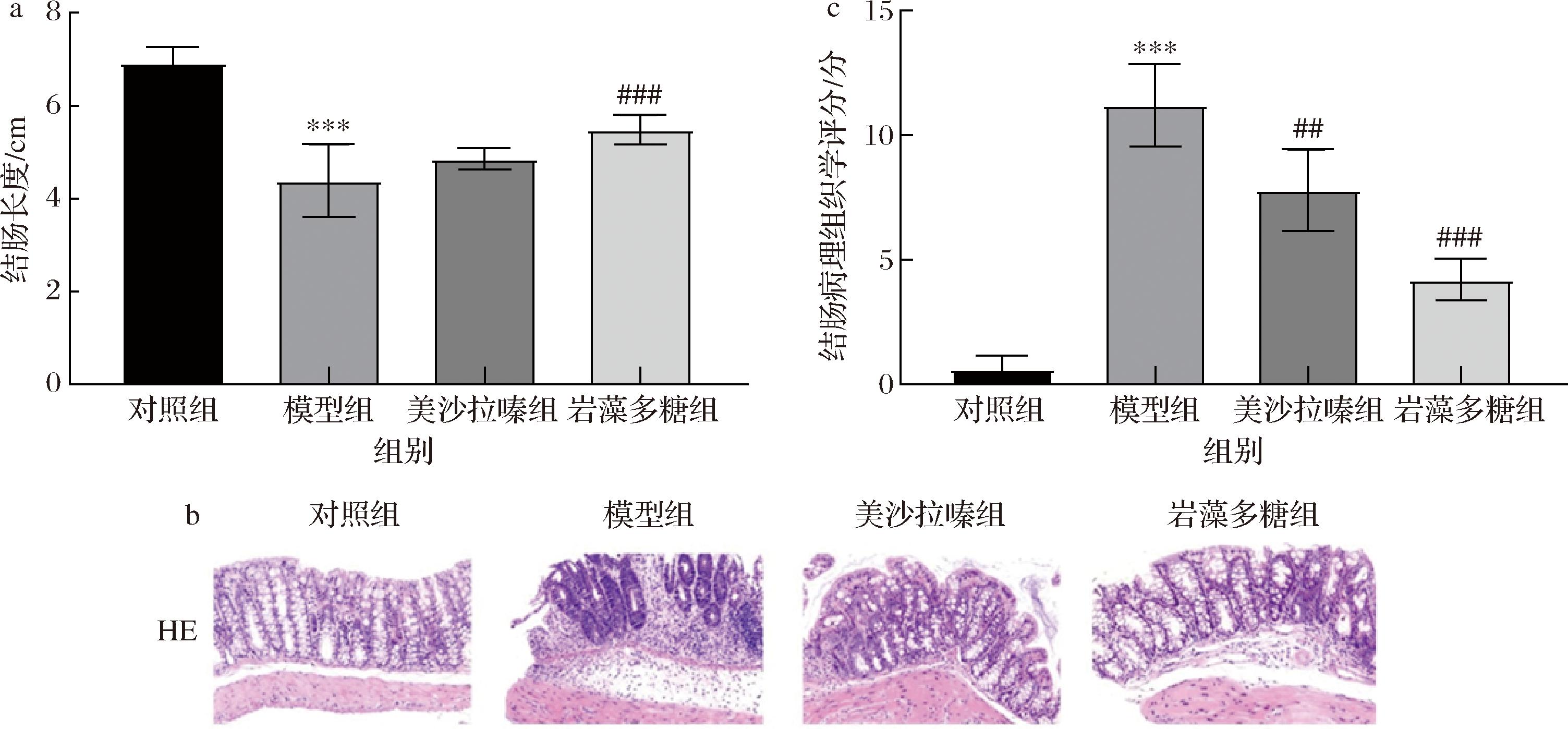
a-结肠长度;b-HE染色;c-结肠病理损伤评分
图3 岩藻多糖对DSS诱导的小鼠结肠长度及组织病理损伤的影响
Fig.3 Effect of fucoidan on colon length and histopathological induced by DSS in mice
结肠组织HE染色结果,如图3-b所示,对照组小鼠的结肠组织结构完整形态正常,具有排列整齐的隐窝,无炎症细胞浸润;模型组小鼠的结肠组织结构损伤明显,隐窝结构大量缺失,大量炎症细胞浸入黏膜层;美沙拉嗪组和岩藻多糖组小鼠的结肠虽有炎症细胞浸润但较模型组减少,且结肠组织结构的完整性得到了改善。结果表明,岩藻多糖对UC小鼠结肠结构有一定的改善作用,可减轻UC小鼠结肠部位病变损伤、保护肠道黏膜。
2.3 岩藻多糖对UC小鼠结肠组织炎症因子释放的影响
各组小鼠的结肠组织中的炎症因子IL-1β、IL-6、TNF-α的分泌情况如图4所示。与对照组相比,模型组小鼠结肠组织中的炎症因子IL-1β、IL-6和TNF-α的分泌均出现显著增加(P<0.001);与模型组相比,经岩藻多糖干预后的小鼠结肠组织中的炎症因子IL-1β(P<0.01)、IL-6(P<0.001)和TNF-α(P<0.001)的分泌均出现显著降低。结果表明,岩藻多糖能够减少UC小鼠的结肠组织中的炎症因子的分泌,具有一定的抗炎作用。
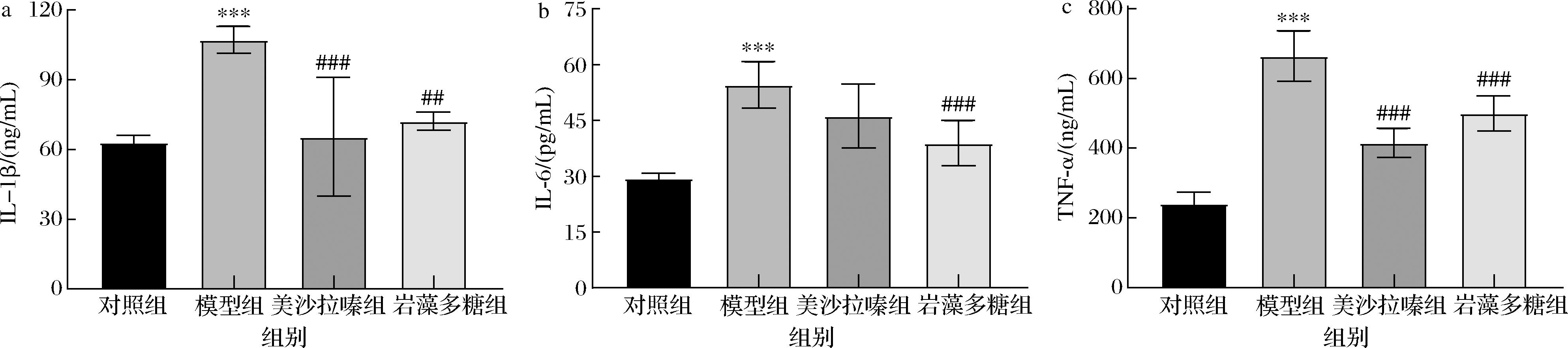
a-IL-1β;b-IL-6;c-TNF-α
图4 岩藻多糖对DSS诱导的小鼠结肠组织中IL-1β、IL-6及TNF-α分泌的影响
Fig.4 Effects of fucoidan on the secretion of IL-1β, IL-6, and TNF-α in colon tissue induced by DSS in mice

a-小鼠结肠肠道菌群的α多样性;b-小鼠结肠肠道菌群的β多样性
图5 岩藻多糖对DSS诱导的小鼠结肠肠道菌群物种多样性的影响
Fig.5 Effect of fucoidan on colon intestinal flora species diversity induced by DSS in mice
2.4 岩藻多糖对UC小鼠肠道菌群的影响
单个样品中微生物群落的丰度和多样性可通过α多样性表达。图5-a结果表明,与对照组比较,模型组小鼠的肠道内微生物群落丰富度显著下降(P<0.001),多样性降低(P<0.01);在岩藻多糖的干预后,小鼠肠道内微生物群落的丰富度和多样性均得到提高。β多样性是评价不同样品之间的菌群结构相似度的主要标志,主坐标分析(principal coordinates analysis,PCoA)可以较好地体现出个体之间的菌群结构的差异大小。如图5-b所示,模型组与对照组之间相距较远;岩藻多糖组与对照组及美沙拉嗪组之间相距较近,与模型组之间相距较远。结果表明,岩藻多糖能够提高UC小鼠肠道菌群的丰富度及多样性,改善菌群结构使其与对照组相似。
各组小鼠肠道菌群结构如图6所示。在门水平上,与对照组相比,模型组小鼠的肠道菌群中的厚壁菌门、Epsilonbacteraeota和变形菌门相对丰度显著上调,拟杆菌门相对丰度显著下调;与模型组相比,美沙拉嗪组和岩藻多糖组小鼠的肠道菌群中的厚壁菌门、Epsilonbacteraeota和变形菌门相对丰度显著下调,拟杆菌门相对丰度显著上调。在属水平上,与对照组相比,模型组小鼠肠道菌群中的Muribaculaceae_unclassified、Alistipes、Alloprevotella、Muribaculum相对丰度显著减少,幽门螺杆菌显著增加;与模型组相比,岩藻多糖组Muribaculaceae_unclassified、Alistipes、Alloprevotella相对丰度显著增加,幽门螺杆菌显著减少。结果表明,岩藻多糖对UC小鼠肠道菌群组成的改变有一定影响。
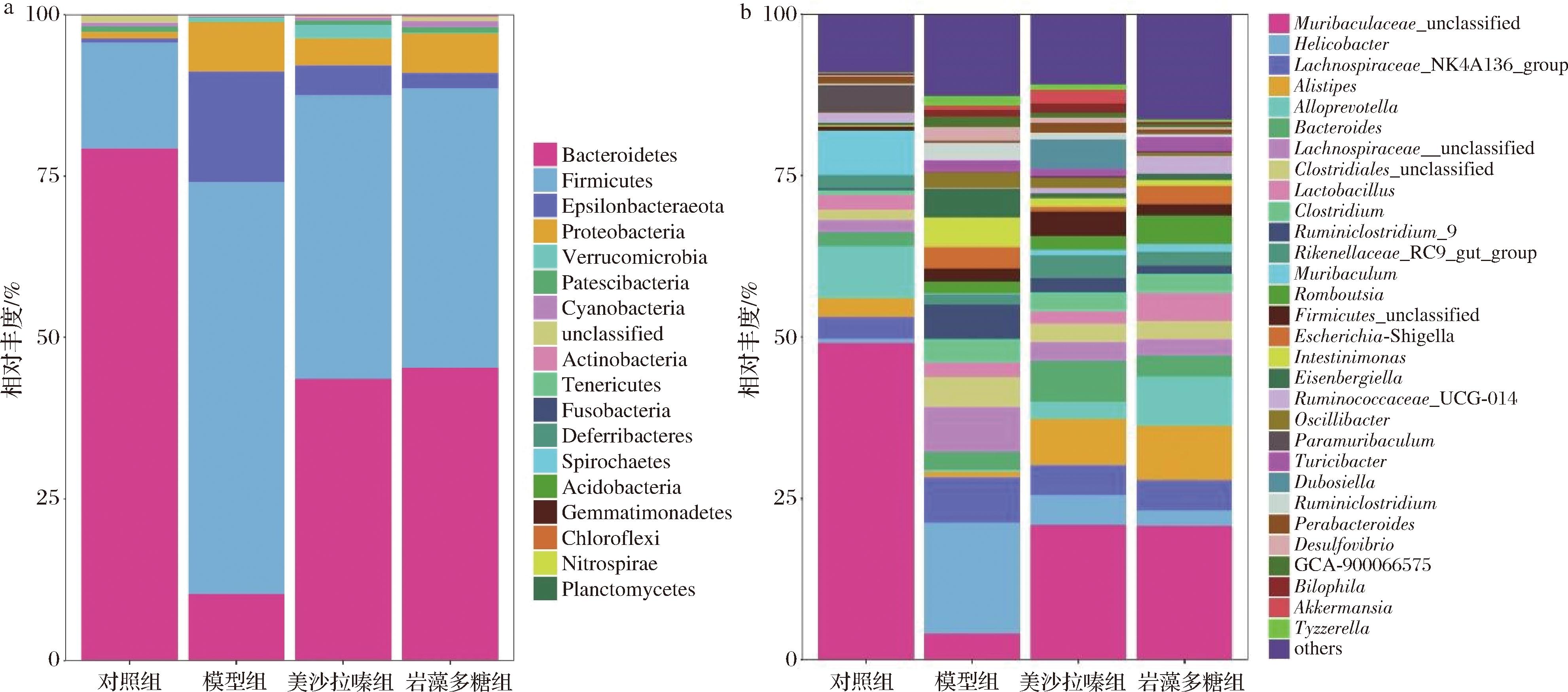
a-门水平;b-属水平
图6 岩藻多糖对DSS诱导的小鼠结肠肠道菌群结构的影响
Fig.6 Effect of fucoidan polysaccharide on colon intestinal flora structure induced by DSS in mice
2.5 岩藻多糖的对UC小鼠影响的相关性分析
为了进一步确定岩藻多糖对UC小鼠治疗的主要途径,将所有指标进行可视化处理,如图7所示。模型组、美沙拉嗪组、岩藻多糖组位于同一簇,且美沙拉嗪组与岩藻多糖组位于同一小簇,表明岩藻多糖组的干预结果和美沙拉嗪组具有相似性,且模型组与其他组间具有差异。所有指标聚成了2个大簇, 幽门螺杆菌、Clostridium与UC主要病理指标 (粪便黏稠度、便血程度、结肠组织病变、IL-1β、IL-6和TNF-α等) 聚集在同一大簇中,表明幽门螺杆菌、Clostridium丰度的变化可能与UC的形成相关。
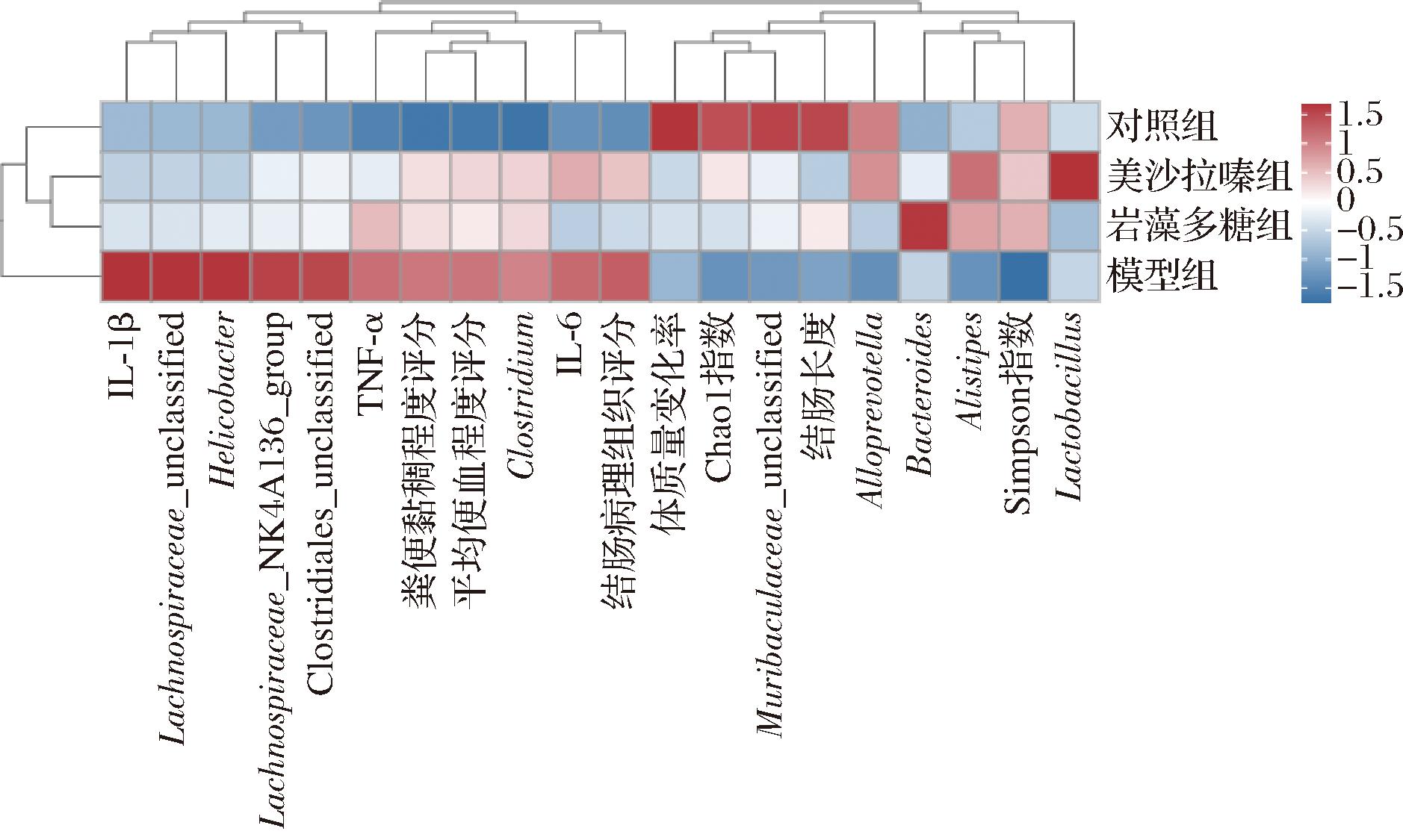
图7 各指标可视化结果
Fig.7 The visualization of indicators
将UC相关生理指标与炎症因子进行Pearson相关性分析,如图8-a所示,体质量变化率、结肠长度与炎症因子间具有显著负相关性,粪便黏稠程度评分、平均便血程度评分和结肠病理组织评分与炎症因子间呈现显著的正相关。因此,炎症因子的产生将加重UC小鼠的病症。将炎症因子与肠道菌群的丰度及多样性指标进行Pearson相关性分析,如图8-b所示,炎症因子与肠道菌群的丰度及多样性间具有显著负相关,即肠道菌群的丰度及多样性的降低将促进炎症因子的释放,加重肠道炎症。
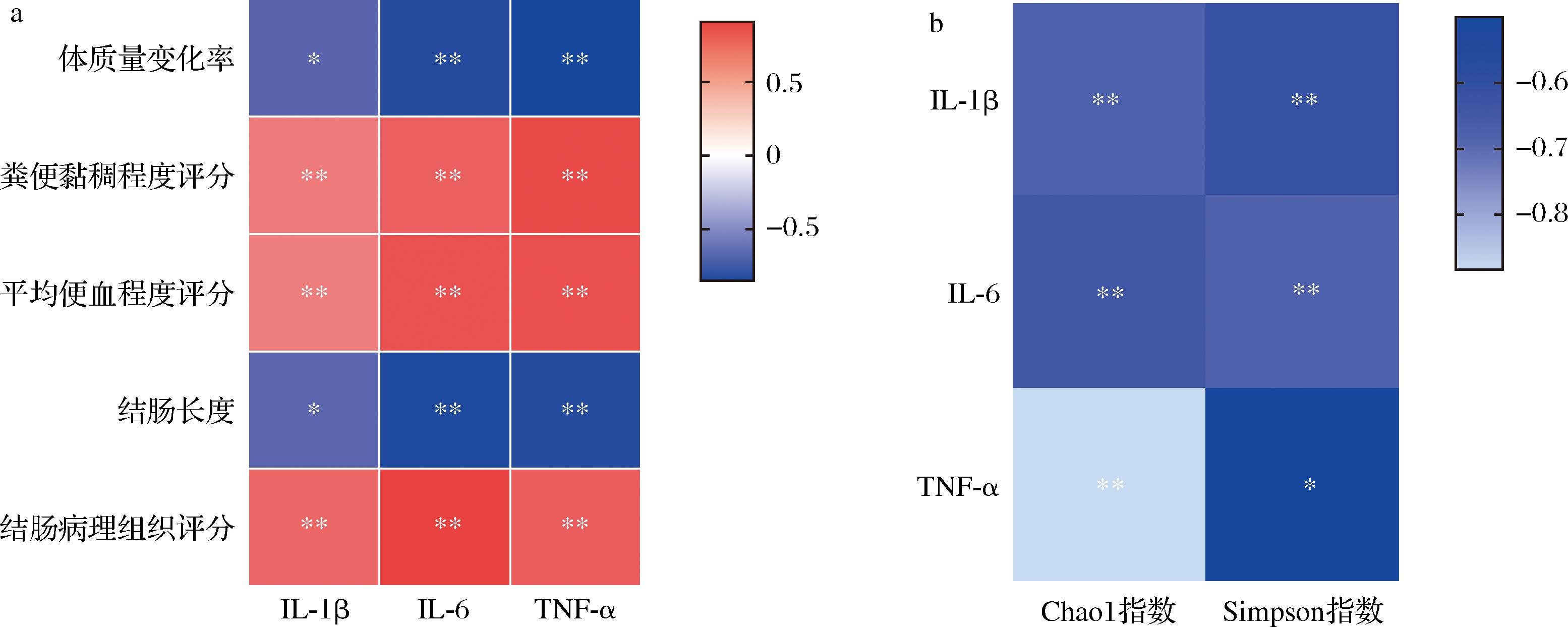
a-生理指标与炎症因子相关性分析;b-炎症因子与肠道菌群的丰度及多样性相关性分析
图8 各指标间相关性分析
Fig.8 Correlation analysis among indicators
3 结论与讨论
岩藻多糖是一种具有多种生物活性的功能性食品。多项研究表明,岩藻多糖可改善UC患者的腹泻和结肠炎相关临床指标[14],且岩藻多糖能增加肠道菌群的多样性,改变肠道菌群的组成[15]。因此,本研究采用3% DSS诱导建立小鼠UC模型,研究岩藻多糖对UC小鼠的治疗效果,并通过16S rRNA高通量测序分析岩藻多糖对UC小鼠肠道菌群的影响。实验结果表明,与对照组相比,模型组小鼠体质量显著降低,水便、血便等症状加重;结肠长度明显缩短;结肠组织受到严重破坏,大量的炎性细胞浸润。经美沙拉嗪、岩藻多糖干预后,UC小鼠疾病情况得到了显著改善,炎症因子 TNF-α、IL-1β 和 IL-6降低。因此,岩藻多糖治疗UC具有潜在的应用前景。
多项研究表明,肠道菌群在UC的形成和治疗中起着不可忽视的作用[16],肠道菌群的组成和代谢产物,都不同程度地影响着肠道健康。肠道菌群紊乱会导致肠道黏膜屏障受损,大量病原微生物入侵,进而引发强烈的肠道免疫反应造成肠道炎症的产生。宿主会加强免疫防线以抵抗异物的入侵,这一过程将进一步加剧肠道菌群的紊乱,给机体带来更大的损伤,并最终促使UC产生[17]。在本研究中,模型组小鼠肠道菌群α多样性显著降低,厚壁菌门相对丰度显著上调,拟杆菌门相对丰度显著下调。经岩藻多糖干预后,α多样性和β多样性均有显著改善,且厚壁菌/拟杆菌的比例显著降低。在属水平上,岩藻多糖显著降低了幽门螺杆菌的相对丰度,同时增加了Muribaculaceae_unclassified、Alistipes和Alloprevotella相对丰度。Muribaculaceae被认为是健康肠道微生物组的生物标志物,它能够编码黏蛋白上去除 O-聚糖末端唾液酸和硫酸盐残基所需的酶,在肠道黏蛋白的降解过程中发挥重要作用[18],黏蛋白的减少会导致肠道通透性提高,破坏肠道屏障功能[19]。Alistipes和 Alloprevotella都属于革兰氏阴性、专性厌氧型的肠道共生菌,它们能够合成短链脂肪酸[20-21],可以直接或间接地发挥抗炎作用,保护肠道屏障,调节免疫力[22]。与美沙拉嗪组相比,岩藻多糖组幽门螺杆菌丰度下降更明显,这与众多岩藻多糖抗幽门螺杆菌[23-25]相关研究的结果相符。幽门螺杆菌的感染可能会导致消化性溃疡、胃癌或黏膜相关淋巴瘤等多种胃肠道疾病[26]。GUO等[27]研究发现幽门螺杆菌细胞毒素相关蛋白A能够损害结肠粘膜屏障,促进结肠上皮的破坏。这可能是岩藻多糖改善结肠组织损伤优于美沙拉嗪的原因。因此,岩藻多糖可通过促进肠道有益菌的增殖,抑制肠道致病菌特别是幽门螺杆菌的增殖来改善肠道屏障损伤,从而发挥对UC小鼠的治疗作用。
综上所述,岩藻多糖可以缓解由DSS诱导引起的体重减轻、腹泻、便血、结肠组织损伤及炎症反应等UC相关病症。其作用机制可能是通过提高肠道菌群的多样性及丰度、恢复肠道菌群的组成结构、增加有益菌、减少病原菌等多层次调节肠道菌群。本研究有助于岩藻多糖的开发与利用,同时为UC的防治提供了新思路。
[1] 杨小冰, 金明玉, 吴小禾, 等.膳食营养素与炎症性肠病关系研究进展[J].食品科学, 2019, 40(9):309-315.YANG X B, JIN M Y, WU X H, et al.Progress in understanding the relationship between dietary nutrients and inflammatory bowel disease[J].Food Science, 2019, 40(9):309-315.
[2] NG S C, SHI H Y, HAMIDI N, et al.Worldwide incidence and prevalence of inflammatory bowel disease in the 21 st century:A systematic review of population-based studies[J].Lancet, 2017, 390(10114):2769-2778.
[3] KAWALEC P.Indirect costs of inflammatory bowel diseases:Crohn′s disease and ulcerative colitis.A systematic review[J].Archives of Medical Science:AMS, 2016, 12(2):295-302.
[4] ZHANG L, WANG X Z, ZHANG X.Modulation of intestinal flora by dietary polysaccharides:A novel approach for the treatment and prevention of metabolic disorders[J].Foods, 2022, 11(19):2961.
[5] FARRELL R J, PEPPERCORN M A.Ulcerative colitis[J].The Lancet, 2002, 359(9303):331-340.
[6] ZHOU H Y, GUO B, LUFUMPA E, et al.Comparative of the effectiveness and safety of biological agents, tofacitinib, and fecal microbiota transplantation in ulcerative colitis:Systematic review and network meta-analysis[J].Immunological Investigations, 2021, 50(4):323-337.
[7] CONG J, WANG P, GAI H R, et al.Effects of compound prebiotics as prophylactic and therapeutic supplementation in a mouse model of acute colitis[J].Applied Microbiology and Biotechnology, 2023, 107(7-8):2597-2609.
[8] WANG Y, XING M C, CAO Q, et al.Biological activities of fucoidan and the factors mediating its therapeutic effects:A review of recent studies[J].Marine Drugs, 2019, 17(3):183.
[9] 王祺瑶, 卢畅, 彭婵妮, 等.海藻岩藻多糖抗肿瘤活性研究新进展[J].食品安全质量检测学报, 2022, 13(7):2043-2050.WANG Q Y, LU C, PENG C N, et al.Recent progress on the antitumor activity of fucoidan[J].Journal of Food Safety and Quality, 2022, 13(7):2043-2050.
[10] HUSNI A, IZMI N, AYUNANI F Z, et al.Characteristics and antioxidant activity of fucoidan from Sargassum hystrix:Effect of extraction method[J].International Journal of Food Science, 2022, 2022:3689724.
[11] KIM H I, KIM D S, JUNG Y, et al.Immune-enhancing effect of sargassum horneri on cyclophosphamide-induced immunosuppression in BALB/c mice and primary cultured splenocytes[J].Molecules, 2022, 27(23):8253.
[12] LIU X X, ZHANG Y H, LI W H, et al.Fucoidan ameliorated dextran sulfate sodium-induced ulcerative colitis by modulating gut microbiota and bile acid metabolism[J].Journal of Agricultural and Food Chemistry, 2022, 70(47):14864-14876.
[13] VESPA E, D′AMICO F, SOLLAI M, et al.Histological scores in patients with inflammatory bowel diseases:The state of the art[J].Journal of Clinical Medicine, 2022, 11(4):939.
[14] O′SHEA C J, O′DOHERTY J V, CALLANAN J J, et al.The effect of algal polysaccharides laminarin and fucoidan on colonic pathology, cytokine gene expression and Enterobacteriaceae in a dextran sodium sulfate-challenged porcine model[J].Journal of Nutritional Science, 2016, 5:e15-e15.
[15] 黄金莉, 黄娟, 李瑶, 等.岩藻多糖对代谢性疾病及肠道菌群调节作用研究进展[J].现代预防医学, 2021, 48(16):3017-3023;3028.HUANG J L, HUANG J, LI Y, et al.Advances in research of fucoidan on metabolic diseases and gut microbiota[J].Modern Preventive Medicine, 2021, 48(16):3 017-3023;3028.
[16] EOM T, KIM Y S, CHOI C H, et al.Current understanding of microbiota- and dietary-therapies for treating inflammatory bowel disease[J].Journal of Microbiology, 2018, 56(3):189-198.
[17] SCHROEDER B O, BIRCHENOUGH G M H, STÅHLMAN M, et al.Bifidobacteria or fiber protects against diet-induced microbiota-mediated colonic mucus deterioration[J].Cell Host &Microbe, 2018, 23(1):27-40e7.
[18] PEREIRA F C, WASMUND K, COBANKOVIC I, et al.Rational design of a microbial consortium of mucosal sugar utilizers reduces clostridiodes difficile colonization[J].Nature Communications, 2020, 11(1):5104.
[19] ROBERT H, PAYROS D, PINTON P, et al.Impact of mycotoxins on the intestine:Are mucus and microbiota new targets?[J].Journal of Toxicology and Environmental Health.Part B,Critical Reviews, 2017, 20(5):249-275.
[20] PARKER B J, WEARSCH P A, VELOO A C M, et al.The genusalistipes:Gut bacteria with emerging implications to inflammation, cancer, and mental health[J].Frontiers in Immunology, 2020, 11:906.
[21] MEI F F, DUAN Z W, CHEN M X, et al.Effect of a high-collagen peptide diet on the gut microbiota and short-chain fatty acid metabolism[J].Journal of Functional Foods, 2020, 75:104278.
[22] XU Y Q, ZHU Y, LI X T, et al.Dynamic balancing of intestinal short-chain fatty acids:The crucial role of bacterial metabolism[J].Trends in Food Science &Technology, 2020, 100:118-130.
[23] PALACIOS-GORBA C, PINA R, TORTAJADA-GIRBÉS M, et al.Caenorhabditis elegans as an in vivo model to assess fucoidan bioactivity preventing Helicobacter pylori infection[J].Food &Function, 2020, 11(5):4525-4534.
[24] LIN Y, QI X S, LIU H J, et al.The anti-cancer effects of fucoidan:A review of both in vivo and in vitro investigations[J].Cancer Cell International, 2020, 20:154.
[25] TOMORI M, NAGAMINE T, IHA M.Are Helicobacter pylori infection and fucoidan consumption associated with fucoidan absorption?[J].Marine Drugs, 2020, 18(5):235.
[26] 蒋彬, 程译文, 凌宗欣.幽门螺杆菌感染对正常胃部菌群多样性和组成的影响[J].中国微生态学杂志, 2020, 32(10):1145-1149. JIANG B, CHENG Y W, LING Z X.Effects of Helicobacter pylori on the composition of normal gastric microbiota[J].Chinese Journal of Microecology, 2020, 32(10):1145-1149.
[27] GUO Y J, XU C X, GONG R J, et al.Exosomal CaGa from Helicobacter pylori aggravates intestinal epithelium barrier dysfunction in chronic colitis by facilitating Claudin-2 expression[J].Gut Pathogens, 2022, 14(1):13.