双酚A(bisphenol A,BPA)是生产聚碳酸酯、环氧树脂等高分子材料的必不可少的化工原料,也作为最常见的塑化剂之一,被广泛应用在食品包装材料和容器内部涂层中[1]。BPA通过包装材料和食品产生直接接触,在生产、运输、贮存等过程中迁移到食品中,有研究表明BPA对人体的危害有拟雌激素性、内分泌干扰性、致癌性和遗传毒性等,在日本、美国等地对含有BPA的奶瓶严禁销售[2-4]。由于双酚S(bisphenol S,BPS)是由BPA分子中的丙烷基被砜基取代形成的衍生物,双酚F(bisphenol F,BPF)是由BPA分子中的丙烷基取代成甲基,BPS和BPF在结构上与BPA相似(分子结构式如图1),常作为BPA的替代品[5-6],但研究表明BPS和BPF同样对人体可产生类似雌激素干扰的不良影响[7-8]。目前,国内外已出台相关标准严格明确限量要求,如欧盟规定双酚S在塑料中的特定迁移量不得超过0.05 mg/kg,我国国家标准GB 9685—2016《食品安全国家标准 食品接触材料及制品用添加剂使用标准》规定BPA、BPS的特定迁移限量分别不超过0.6 mg/kg和0.5 mg/kg[9]。
a-BPA;b-BPF;c-BPS
图1 BPA、BPF、BPS分子结构式
Fig.1 The molecular structures of BPA, BPF, and BPS
白酒生产环节复杂,在发酵、勾贮、包装等生产过程中常会接触到塑料管、瓶盖等塑料制品,在与塑料制品接触的过程中可能会将其中的双酚类化合物等有害物质迁移入酒,存在一定的食品安全风险,如刘敏等[10]研究发现市售桶装白酒普遍含有BPA,部分样品中BPA含量已超过国家标准限量,因此要关注白酒接触材料中的双酚类化合物。目前对于白酒及白酒接触材料中双酚类化合物的研究较少,刘露等[11]采用同位素内标-超高效液相色谱-串联质谱法评估白酒包装内塞中双酚A/S的迁移风险,由于国家标准中已明确对BPA和BPS做出限量规定,BPF常作为BPA或BPS的替代品来使得包装材料符合标准要求,BPF也具有内分泌干扰、影响胎儿生长发育等危害[12-13],故BPF也是需要重点关注的一种双酚类化合物,但对于检测白酒接触材料中常见的BPA、BPF、BPS的同时测定方法未见报道。因此建立高效灵敏的BPA、BPF、BPS的同时测定方法具有重要意义。
双酚类化合物的检测方法有液相色谱法[14]、液相色谱-质谱法[15]、气相色谱法[16]、气相色谱-质谱法[17]、酶联免疫吸附测定法[18]、毛细管电泳法[19]等。液相色谱法灵敏度较低,无法满足准确定性要求,气相或气相色谱质谱法样品则需要衍生化处理,操作繁琐,液相色谱-质谱法无需衍生化、定性准确。但目前研究多集中在采用液相色谱-质谱联用法测定BPA或BPS,对BPF的检测报道较少。该研究建立超高效液相色谱-串联静电场轨道阱高分辨质谱(ultra performance liquid chromatography-tandem high-resolution mass spectrometry of an electrostatic field orbital well,UPLC-Q-Orbitrap HRMS)同时测定白酒接触材料中BPA、BPF和BPS的检测方法,并对市售白酒接触材料开展检测分析,为白酒接触塑料制品中双酚类化合物BPA、BPF和BPS的定性定量分析提供方法依据,以便于评估白酒塑化剂的食品安全风险进而开展科学有效监管。
1 材料与方法
1.1 材料与试剂
白酒瓶盖,市购;BPA、BPF、BPS标准品(纯度>99%),德国Dr.Ehrenstorfer GmbH公司;乙醇(分析纯),国药集团化学试剂有限公司;甲醇(色谱级),德国Merck公司;氨水(色谱级),美国Fisher公司;实验用水为艾科普纯水仪制备的超纯水(18.2 MΩ/cm)。
1.2 仪器与设备
UltiMate 3000高效液相色谱仪,美国Dionex公司;Q Exactive Focus高分辨质谱仪,美国Themo Fisher Scientific公司;AR2140万分之一天平,梅特勒-托利多仪器(上海)有限公司;QT-1旋涡混合器,上海琪特分析仪器有限公司;艾科普超纯水机,美国Millipore公司。
1.3 实验方法
1.3.1 标准溶液的配制
标准储备液的配制:称量各标准品50 mg(精确至0.01 mg)置于50 mL容量瓶中用甲醇定容至刻度,分别配成质量浓度为1 000 mg/L的单标储备液,于-18 ℃冰箱保存。
混合标准中间液的配制:准确吸取适量的3种单标储备液于同一容量瓶中,配制成质量浓度为1 mg/L的混合标准溶液,贮存于4 ℃冰箱备用。
标准工作系列溶液的配制:准确吸取适量混合标准中间液,配制成2.50~500 μg/L系列溶剂标准工作液。
1.3.2 仪器条件
a)色谱条件
色谱柱:Accucore C18色谱柱(150 mm×2.1 mm,2.6 μm);柱温40 ℃;进样量10 μL;流速0.3 mL/min;流动相:A相为0.1%氨水溶液,B相为纯甲醇,梯度洗脱程序:0~2.0 min,30% B;2.0~6.0 min,70% B;6.0~7.0 min,100% B;8.0~11.0 min,30% B。
b)质谱条件
离子源:加热电喷雾电离源(heated electrospray ionization,HESI);扫描模式:负离子模式;采集模式:Full MS/ddMS2;鞘气流速40 arb;辅助气流速15 arb;离子源温度350 ℃;毛细管温度200 ℃;喷雾电压-3.7 kV;一级扫描范围m/z 100~300;碰撞能量CE值为45;一级质谱扫描分辨率70 000;二级质谱扫描分辨率:17 500。
1.3.3 样品前处理
按照GB 31604.1—2015《食品安全国家标准 食品接触材料及制品迁移试验通则》要求,当食品乙醇含量>50%(体积分数)时,可选用实际浓度的乙醇作为食品模拟物,由于此处以酒精度为53%vol酱香型白酒接触材料开展实验,因此选用53%(体积分数)乙醇作为食品模拟液,按照GB 5009.156—2016《食品安全国家标准 食品接触材料及制品迁移试验预处理方法通则》的规定,采用全浸没法,将样品全部浸没在食品模拟液中,置于60 ℃贮存10 d开展迁移实验。
1.4 数据处理
采用仪器自带的数据软件Xcalibur定性定量分析软件处理实验数据,使用Microsoft Excel 2010进行统计分析,使用Origin 8.6软件作图。
2 结果与分析
2.1 质谱参数优化
先分别将质量浓度为500 μg/L单一待测化合物标准溶液直接注入高分辨质谱仪中,利用Full MS模式对目标化合物进行分子离子全扫描,在正、负离子2种模式下分别进行参数优化,根据目标化合物的理论精确分子质量,得出分子离子峰为[M-H]-,实验表明,3种双酚类化合物在负离子模式下质谱响应较高,因此,采用负离子扫描模式。对待测化合物的分子离子采用Full MS/dd-MS2扫描模式进行二级质谱全扫描,当选择碰撞能量为45 eV时,二级子离子的相对丰度较高。得到质谱参数优化结果如表1所示,对应的分子离子质谱图如图2所示。
表1 三种待测化合物的质谱参数
Table 1 Mass spectrum parameters of 3 compounds to be measured
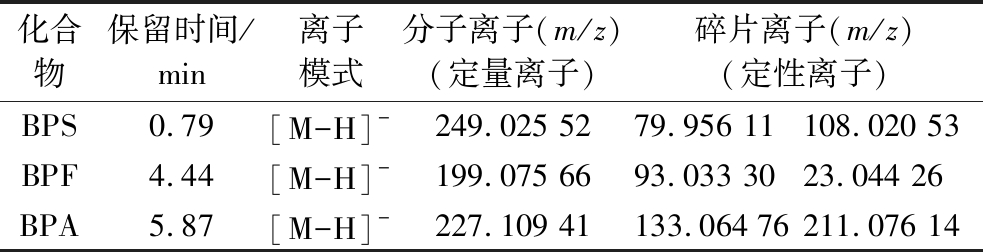
化合物保留时间/min离子模式分子离子(m/z)(定量离子)碎片离子(m/z)(定性离子)BPS0.79[M-H]-249.025 5279.956 11108.020 53BPF4.44[M-H]-199.075 6693.033 3023.044 26BPA5.87[M-H]-227.109 41133.064 76211.076 14

a-BPS;b-BPF;c-BPA
图2 三种待测化合物在Full MS模式下的分子离子质谱图
Fig.2 Mass spectra of three compounds under Full MS mode
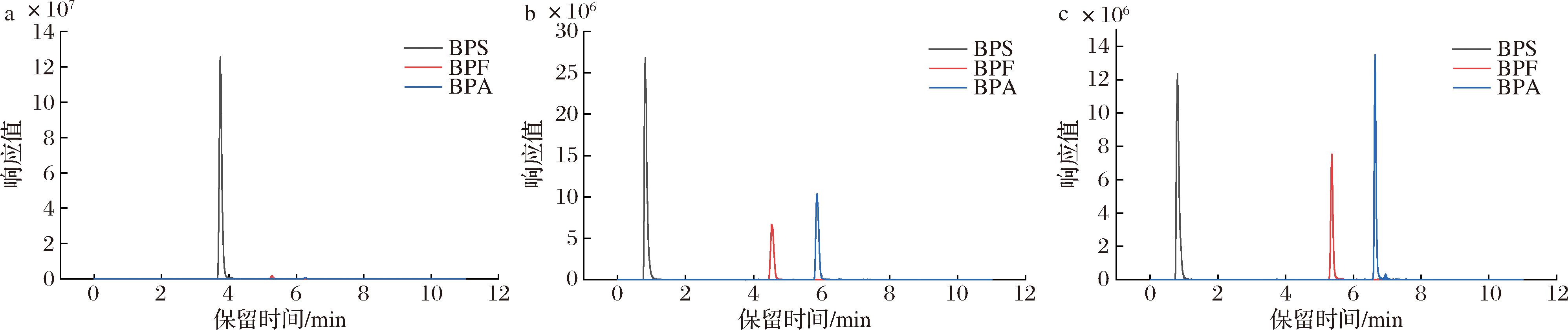
a-aQ色谱柱;b-Accucore C18柱;c-Hypersic Gold C18柱
图3 三种色谱柱下的色谱图
Fig.3 The extraction ion-flow chromatograms of three chromatographic columns
2.2 色谱参数优化
2.2.1 色谱柱的选择
采用Hypersic Gold C18柱(150 mm×2.1 mm,1.9 μm)、Accucore aQ(150 mm×2.1 mm,2.6 μm)和Accucore C18(150 mm×2.1 mm,2.6 μm)3种液相色谱柱对双酚类化合物进行优化,由图2可知,结合色谱图的峰形、响应值及峰面积分析,aQ柱下3种待测物的响应值不均衡,BPA的响应值为7.58×105,而BPS的响应值为1.26×108,同时绘制标准曲线时无法呈现出线性,在Hypersic Gold C18柱和Accucore C18柱的出峰时间和响应值相接近,但结合峰面积和标曲线性关系发现Accucore C18柱能够对3种目标化合物进行有效分离且线性良好,因此,采用Accucore C18(150 mm×2.1 mm,2.6 μm)色谱柱为分离待测化合物的最佳液相色谱柱。
2.2.2 流动相的选择
通过考察5 mmol/L乙酸铵水溶液-甲醇、纯水-甲醇、0.1%氨水-甲醇3种流动相体系下BPS、BPF、BPA的色谱分离效果,实验结果如图4所示,研究表明在前2种流动相体系下,出峰时间在3~6 min,但BPS峰形出现前驼峰,故不能满足实验要求,当流动相为0.1%氨水-甲醇能够实现峰形良好、响应值较高,达到目标物有效分离的目的,故选用0.1%氨水-甲醇作为流动相。
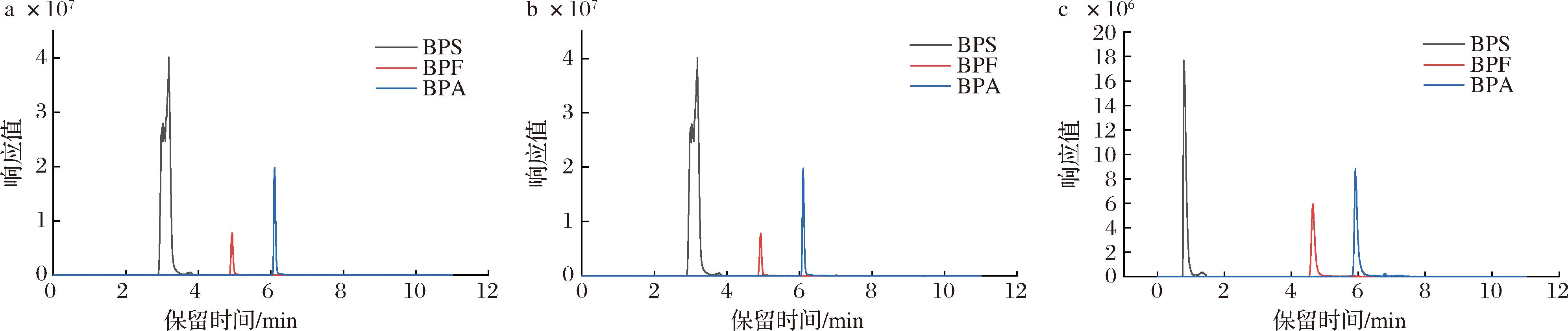
a-5 mmol/L乙酸铵-甲醇体系;b-纯水-甲醇体系;c-0.1%氨水-甲醇
图4 不同流动相下的色谱图
Fig.4 Ion flow diagram of different mobile phases
2.3 前处理优化
双酚类化合物在不同食品接触材料及食品中的迁移提取溶剂有所区别,通常选用甲醇、乙醇、乙腈等有机溶剂为提取溶剂。张慧等[20]采用乙腈-甲醇、乙腈、甲醇、正己烷等溶液提取奶油中的双酚类化合物,结果表明乙腈-甲醇为最佳提取溶剂。杨金泉等[21]研究了HLB小柱萃取饮用水中BPA、BPS,比较得出了甲醇对BPA、BPS的洗脱效果更优。本实验考察了迁移液直接上机处理以及添加不同体积甲醇后对3种待测物回收率的影响,如图5、图6所示。当迁移液直接上机时,其中BPS的加标回收率在65.19%~150.96%,不符合加标回收率的范围要求,故迁移液需进一步添加甲醇提高萃取率和稳定性。当甲醇添加体积为5 mL时,BPS、BPF、BPA的回收率分别在106.61%~109.29%、100.74%~111.13%、89.93%~103.77%,能够较好地消除其他杂质的干扰,因此选择最佳提取体积为5 mL。
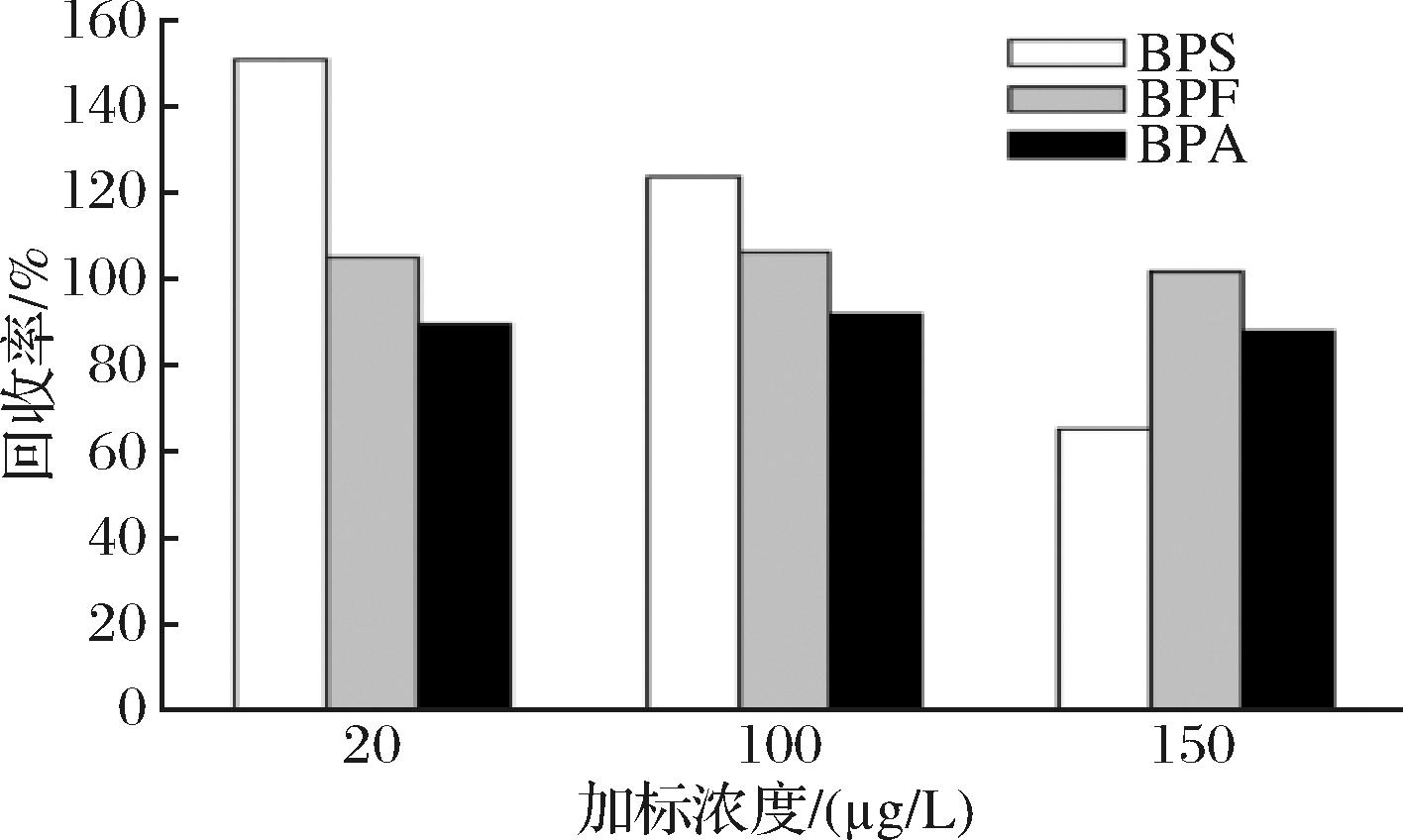
图5 迁移液直接上机对回收率的影响
Fig.5 Effect of migration solution on recovery
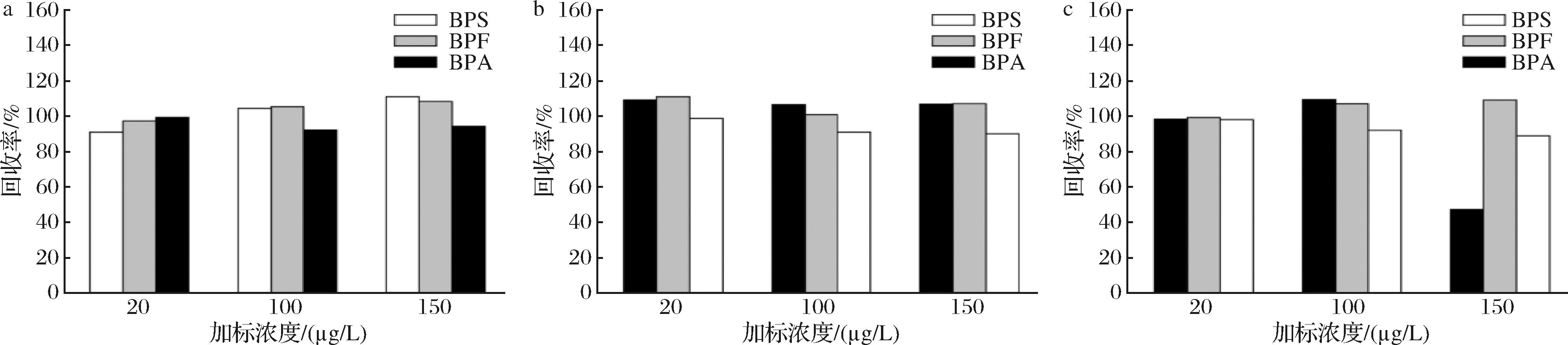
a-提取体积1 mL对回收率的影响;b-提取体积5 mL对回收率的影响;c-提取体积10 mL对回收率的影响
图6 不同提取体积下对回收率的影响
Fig.6 Effect of different extraction volumes on recovery
2.4 基质效应评价
当基质较为复杂时,对待测目标化合物的检测信号发生干扰,从而产生基质效应。去除基质效应通常采用校正标准曲线法,本实验采用以空白基质液稀释系列标准溶液获得基质标准曲线斜率与溶剂标准曲线斜率的比值,评价基质效应的影响程度。当斜率k<0.8时表明有抑制作用,当0.8<k<1.2时表明无基质效应,当k>1.2时表明有增强作用。实验结果如表2所示,结果表明在3种不同基质模拟液下获得的斜率k值为0.89~1.03,表明基质效应不明显。因此可采用溶剂配制标准曲线。
表2 不同基质下的3种待测化合物的基质效应
Table 2 Matrix effects of 3 compounds under different substrates
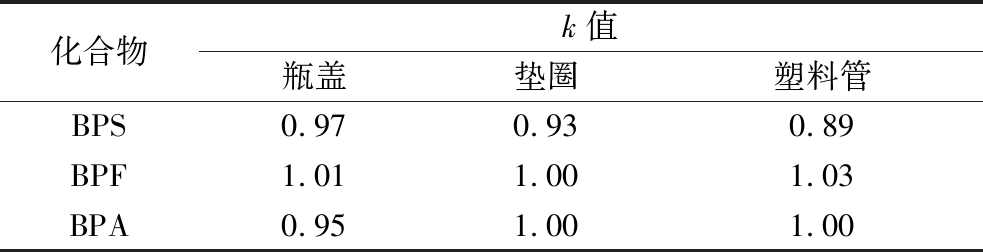
化合物k值瓶盖垫圈塑料管BPS0.970.930.89BPF1.011.001.03BPA0.951.001.00
2.5 线性范围、方法检出限及定量限
将空白模拟液作为溶剂加入3种混标溶液,配制成质量浓度为2.5、5、10、20、50、100、200、500 μg/L的标准系列工作曲线,以质量浓度为横坐标,以定量离子的峰面积为纵坐标,绘制标准曲线并得到线性方程和相关系数,以3倍信噪比和10倍信噪比分别确定待测化合物的检出限和定量限,结果如表3所示。由表可知,3种待测物的线性相关系数为0.990~0.998,线性关系良好。
表3 三种待测化合物的线性方程、相关系数、检出限和定量限
Table 3 Linear range and equation, R2, limit of detection and limit of quantitation of 3 compounds

化合物线性范围/(μg/L)线性方程相关系数检出限定量限BPS2.5~500Y=1.776 15e+006+264 442X0.9900.983.26BPF2.5~500Y=44 011.8+76 345.1X0.9961.063.53BPA2.5~500Y=398 101+78 649.9X0.9981.123.73
2.6 回收率与精密度
对空白样品分别添加低、中、高3个水平的混合标准溶液开展加标回收实验,每个水平重复3个平行实验,结果如表4所示,待测物的平均回收率为95.70%~117.53%,相对标准偏差为1.00%~3.55%。
表4 三种待测化合物的回收率和精密度
Table 4 Recoveries and relative standard deviation of 3 compounds
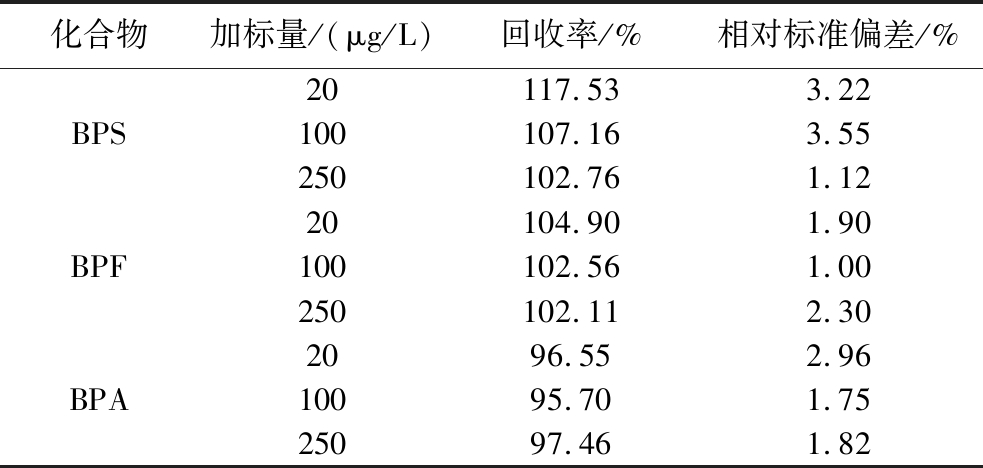
化合物加标量/(μg/L)回收率/%相对标准偏差/%20117.533.22BPS100107.163.55250102.761.1220104.901.90BPF100102.561.00250102.112.302096.552.96BPA10095.701.7525097.461.82
2.7 样品的测定
选取市售的白酒包装材料酒瓶瓶盖7种以及在白酒生产过程用到的薄膜、塑料管、垫圈3种塑料制品,采用该测定方法开展迁移量的测定,结果表明所有样品中未检出3种双酚类化合物。
3 结论
本实验建立了超高效液相色谱串联高分辨质谱法测定白酒接触塑料中双酚S、双酚F、双酚A迁移量的检测方法。结果表明,3种双酚类化合物在2.5~500 μg/L质量浓度范围内线性系数均大于0.990,线性关系良好,加标平均回收率在95.70%~117.53%,相对标准偏差1.00%~3.55%。该检测方法的样品前处理简单、准确性和重复性良好,能够快速检测白酒接触塑料制品中的3种双酚类化合物含量,为白酒中双酚类化合物的风险评估提供有效的技术支持,对酒类食品安全监管和开展深入研究具有十分重要的指导意义。
[1] 唐吉旺, 袁列江, 肖泳, 等.高效液相色谱-串联质谱法测定食品塑料包装材料中双酚A和壬基酚[J].食品与机械, 2023, 39(1):37-41.TANG J W, YUAN L J, XIAO Y, et al.Determination of bisphenol A and nonylphenol in food packaging material by high performance liquid chromatography-tandem mass spectrometry[J].Food &Machinery, 2023, 39(1):37-41.
[2] BANG D Y, KYUNG M, KIM M J, et al.Human risk assessment of endocrine-disrupting chemicals derived from plastic food containers[J].Comprehensive Reviews in Food Science &Food Safety, 2012, 11(5):453-470.
[3] 生吉萍, 宿文凡, 张靖宇.食品接触材料中双酚A暴露风险及风险管理[J].食品科学技术学报, 2022, 40(1):167-174.SHENG J P, SU W F, ZHANG J Y.Risk analysis and management of dietary exposure to bisphenol A from food contact materials[J].Journal of Food Science and Technology, 2022, 40(1):167-174.
[4] POUOKAM G B, AJAEZI G C, MANTOVANI A, et al.Use of bisphenol A-containing baby bottles in Cameroon and Nigeria and possible risk management and mitigation measures:community as milestone for prevention[J].The Science of the Total Environment, 2014, 481:296-302.
[5] 刘思尚宇. BPA及其替代物BPS暴露对前脂肪细胞分化影响的脂质组学研究[D].厦门:集美大学, 2020.LIU S S Y.Lipidome disturbances in preadipocyte differentiation associated with bisphenol A and replacement bisphenol S exposure[D].Xiamen:Jimei University, 2020.
[6] 虞婕. 双酚A及其替代物的内分泌干扰与代谢扰动效应研究[D].杭州:浙江工业大学, 2019.YU J.Endocrine and metabolic disrupting effects of bisphenol A and its substitutes[D].Hangzhou:Zhejiang University of Technology, 2019.
[7] JI K, HONG S, KHO Y, et al.Effects of bisphenol S exposure on endocrine functions and reproduction of zebrafish[J].Environmental Science &Technology, 2013, 47(15):8793-8800.
[8] GU J, WU J, XU S Q, et al.Bisphenol F exposure impairs neurodevelopment in zebrafish larvae (Danio rerio)[J].Ecotoxicology and Environmental Safety, 2020, 188:109870.
[9] 胡雪,张志伟,梁建英,等.食品接触材料中几种有害物质限量标准和检测方法的研究进展[J].食品安全质量检测学报,2020,11(13):4158-4164.HU X, ZHANG Z W, LIANG J Y, et al. Research progress of limit standards and detection methods for several hazardous substances in food contact materials[J]. Journal of Food Safety and Quality, 2020,11(13):4158-4164.
[10] 刘敏, 尹龙龙, 赵雪桢, 等.泰安市塑料桶装白酒中双酚A含量检测及居民膳食风险评估[J].食品安全质量检测学报, 2018, 9(10):2564-2568.LIU M, YIN L L, ZHAO X Z, et al.Determination of bisphenol A in plastic bottled spirits and risk assessment for the population in Taian city[J].Journal of Food Safety and Quality, 2018, 9(10):2564-2568.
[11] 刘露, 吴文睿, 方颂平, 等.同位素内标-UPLC-MS/MS法评估白酒包装内塞中双酚A/S的迁移风险[J].安徽科技学院学报, 2021, 35(4):62-69.LIU L, WU W R,FANG S P, et al.Isotope internal standard-UPLC-MS/MS method to assess the risk of bisphenol A and bisphenol S migration from the inner plug of liquor packaging to liquor[J].Journal of Anhui Science and Technology University, 2021, 35(4):62-69.
[12] 沈杰, 刘建超, 陆光华, 等.双酚S和双酚F在水环境中的分布、毒理效应及其生态风险研究进展[J].生态毒理学报, 2018, 13(5):37-48.SHEN J, LIU J C, LU G H, et al.A review of the occurrence, toxicology and ecological risk assessment of bisphenol S and F in aquatic environment[J].Asian Journal of Ecotoxicology, 2018, 13(5):37-48.
[13] WINKLER J, LIU P Y, PHONG K, et al.Bisphenol A replacement chemicals, BPF and BPS, induce protumorigenic changes in human mammary gland organoid morphology and proteome[J].Proceedings of the National Academy of Sciences of the United States of America, 2022, 119(11):e2115308119.
[14] 杨永超, 杜宇, 于艳军, 等.高效液相色谱法测定纸质食品接触材料中双酚A和双酚S的含量[J].食品研究与开发, 2021, 42(17):137-142.YANG Y C, DU Y, YU Y J, et al.Quantitative detection of bisphenol A and bisphenol S in food packaging papers by high performance liquid chromatography[J].Food Research and Development, 2021, 42(17):137-142.
[15] 谢景千, 杨俊, 黎永乐.液相色谱-串联质谱法测定食品接触材料中双酚F和双酚S的迁移量[J].食品安全质量检测学报, 2020, 11(24):9100-9107.XIE J Q, YANG J, LI Y L.Determination on migration of bisphenol F and bisphenol S in food contact materials by liquid chromatography-tandem mass spectrometry[J].Journal of Food Safety and Quality, 2020, 11(24):9100-9107.
[16] 唐熙, 陈高群, 梁鸣, 等.气相色谱法测定塑料奶瓶中迁移出的双酚A[J].福建分析测试, 2010, 19(4):13-17.TANG X, CHEN G Q, LIANG M, et al.Determination of the migration of bisphenol A from plastic nursing bottle by GC[J].Fujian Analysis &Testing, 2010, 19(4):13-17.
[17] JUREK A, LEITNER E.Analytical determination of bisphenol A(BPA) and bisphenol analogues in paper products by GC-MS/MS[J].Food Additives and Contaminants. Part A, Chemistry, Analysis, Control, Exposure &Risk Assessment, 2017, 34(7):1225-1238.
[18] 许龙, 章英, 朱立鑫, 等.酶联免疫吸附法测定儿童血清中双酚A含量[J].中国公共卫生, 2018, 34(4):593-596.XU L, ZHANG Y, ZHU L X, et al.Detection of serum bisphenol A with enzyme-linked immunosorbent assay among children[J].Chinese Journal of Public Health, 2018, 34(4):593-596.
[19] 卢丹, 薛丰, 薛勇, 等.高效毛细管电泳-紫外检测法测定饮料等包装材料中的双酚A[J].分析试验室, 2011, 30(9):112-115.LU D, XUE F, XUE Y, et al.Determination of bisphenol a in beverage packing materials by high performance capillary electrophoresis with UV detection[J].Chinese Journal of Analysis Laboratory, 2011, 30(9):112-115.
[20] 张慧, 曹慧, 姜侃, 等.高效液相色谱-三重四极杆串联质谱法研究塑料接触材料中酚类化合物向奶油中的迁移[J].食品科学, 2022, 43(18):339-345.ZHANG H, CAO H, JIANG K, et al.Migration of phenolic compounds from plastic contact materials into cream by high performance liquid chromatography-tandem mass spectrometry[J].Food Science, 2022, 43(18):339-345.
[21] 杨金泉, 贺小敏, 施敏芳, 等.固相萃取-超高效液相色谱-串联质谱法测定饮用水中双酚A和双酚S[J].食品科学, 2019, 40(20):332-337.YANG J Q, HE X M, SHI M F, et al.Determination of bisphenol A and bisphenol S in drinking water by ultra performance liquid chromatography tandem mass spectrometry with solid-phase extraction[J].Food Science, 2019, 40(20):332-337.