油料作物是全球生产、交易和消费的最大商品群体之一。2021~2022年间,全球油籽产量超过6亿t,植物油产量已超过2亿t/年[1]。油料种籽中富含油脂和蛋白质。传统的植物油脂的制备方法包括压榨法或有机溶剂法。压榨法[2]能使油脂保留良好的风味,但会导致植物油脂中生物活性物质(甾醇、多酚类物质和类胡萝卜素等)含量明显减少,同时粕中残油率较高。有机溶剂提取法极易使溶剂残留在提取的油脂和脱脂粕中,对环境造成污染,不利于对脱脂粕的继续加工利用[3]。同时,在加工过程中,由于加热等因素的影响,使蛋白质变性,从而造成了蛋白质资源的巨大浪费。因此,亟需开发环境友好型植物油脂加工关键技术,保障油料加工过程及产品的安全和健康。
20世纪50年代,NATHAN[4]首次提出水代法提油,该法是以水为溶剂,利用油脂和蛋白质对水相亲和力的差异,以及密度差,对油脂和蛋白质进行同时分离,其操作简便,环境相容性好,提取出的油可直接作为最终产品。但存在着提油率与蛋白回收率较低、得到的粕中脂肪残留量较高等难以克服的问题。20世纪90年代以来,随着生物技术的迅速发展以及商业酶的大量应用,有关酶法提取植物油脂的研究不断增多。1972年,RHEE等[5]对水酶法同时分离花生油和蛋白的工艺条件进行了改进,与水代法比较,提油率有了很大的提高,但是仍然没有解决蛋白质残油率高的问题。在水酶法提油技术发展的同时,酶用量大、酶解时间长[6]等技术瓶颈制约着该技术的进一步发展。
物理场与水酶法提油技术结合,通过促使油料中原本排列致密的细胞变得疏松、打破细胞壁多糖屏障[7]、破坏细胞膜的结构[8],将油料细胞内与其他大分子物质紧密结合的油脂更易被释放出来,油脂产率得到提高。同时,适宜的工艺条件能改善油料中蛋白质的特性,提高油料提油副产物的利用率。本文就物理场耦合水酶法提油的原理及优势进行了阐述,综述了该技术释放油脂的研究进展,并对物理场耦合水酶法对油料中蛋白特性的影响进行详细综述,以期对该技术的进一步研究与应用提供参考。
1 油料细胞结构及油脂和蛋白分布
细胞是生命活动的基本组织单元和功能单元。其他有机体同样,油料种籽也由大量细胞组成。其中,花生、大豆、蓖麻籽的细胞较大,棉籽、亚麻籽的细胞较小。不同的油料,其细胞形态、大小各不相同,但其构造大致可分为两部分:细胞壁和细胞壁内的原生质体。如图1所示,细胞壁的主要成分为纤维素、半纤维素、果胶等物质,其结构具有一定硬度,能够维持细胞形态稳定并保护细胞内部组织[9-10]。成熟油料种籽细胞中的原生质体是由细胞膜、细胞质、细胞核、细胞器等构成的,在这些原生质体中存在着大量的油脂及其他均匀分布的营养物质,比如蛋白质和淀粉等,而油脂和蛋白大部分贮藏在油脂体和蛋白体中。油脂体是植物种子中主要的油脂贮藏亚细胞器,直径通常为0.5~2.5 μm;蛋白质存在于直径2~10 μm的蛋白体亚细胞器中[11]。研究者对花生、大豆、油菜等油料作物进行显微观察[12],发现油料细胞中的蛋白体围绕着细胞核,排列疏松。以花生细胞为例,由图1可知,花生油脂体紧密围绕在蛋白体周围,在细胞壁边缘也有分布[13-14]。20世纪末,TENZ等[15]提出了油脂体结构模型,认为液态的三酰基甘油(triacylglycerols,TAG)充实在油脂体内部,而磷脂单分子层及其镶嵌蛋白共同组成的半单位膜将液态三酰基甘油包裹在内,从而形成完整的圆球状油脂体,半单位膜的基本单位是13个磷脂分子和1个油体蛋白分子。油体蛋白分子中大部分是油素蛋白(oleosin),油素蛋白分子中2/5为疏水区域,形状为11 nm的柄状结构,伸入油脂体内部,其余的3/5则覆盖于油脂体表面,用以阻止外部的磷脂酶对磷脂半单位膜进行作用,油素蛋白的存在被认为是维持油脂体结构稳定的重要原因之一。因此,对油料作物的细胞结构以及油脂体进行破坏,可将油脂和蛋白等有效成分分离出来。
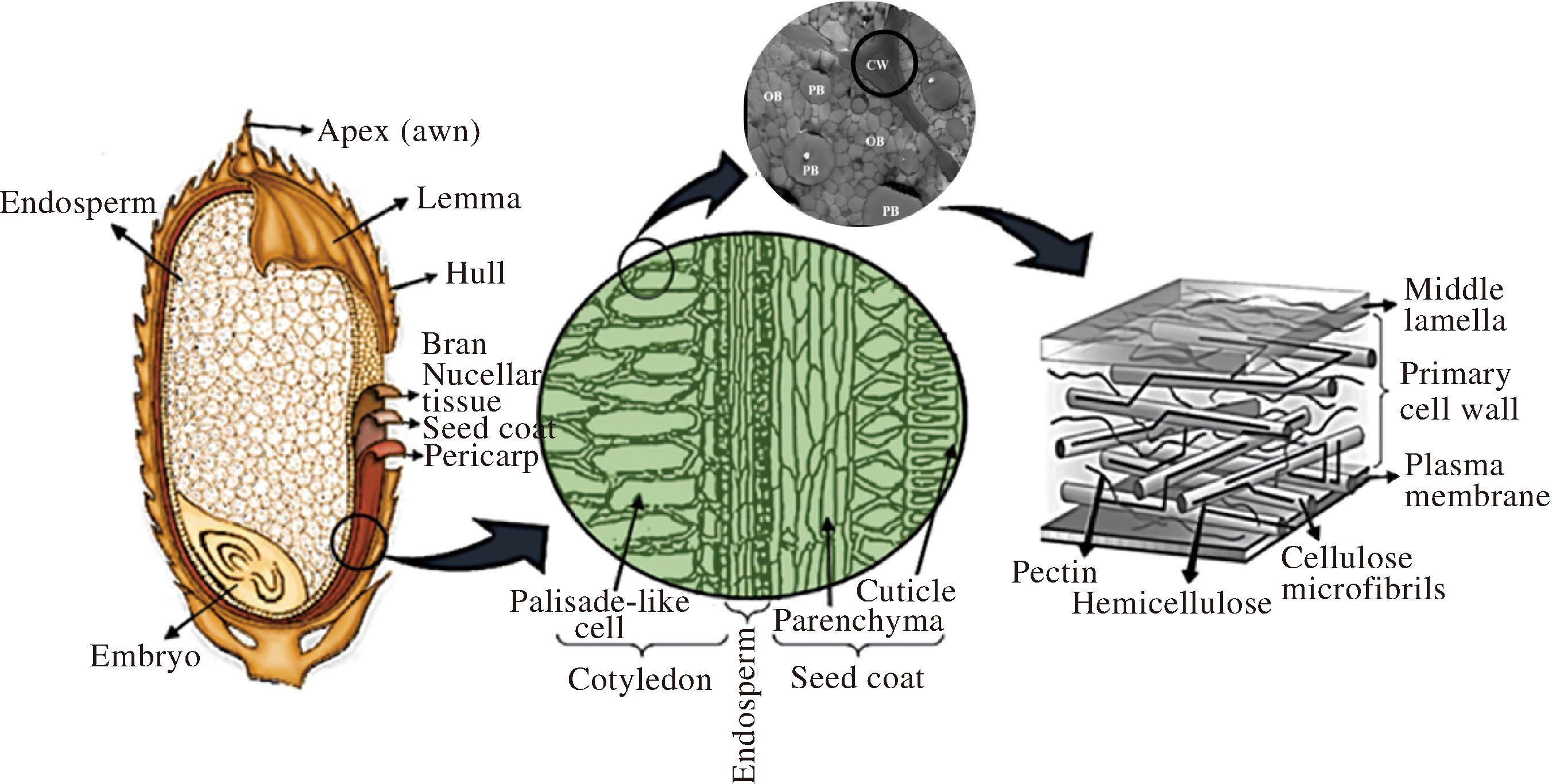
图1 油料细胞结构及细胞壁结构[10,13-14]
Fig.1 Cell structure and cell wall structure of oil plants[10,13-14]
注:Endosperm:胚乳;Apex:顶部;Hull:外壳:Bran:麸皮;Nucellar tissue:珠心组织;Seed coat:种皮;Pericarp:果皮;Embryo:胚芽;Palisade-like cell:栅栏样细胞;Cuticle:外皮;Parenchyma:薄壁组织;Middle lamella:中间薄片;Primary cell wall:初级细胞壁;Plasma membrane :质膜;Cellulose microfibrils:纤维素微纤维;Hemicellulose:半纤维素;Pectin:果胶;CW:细胞壁;PB:蛋白体;OB:油脂体。
2 物理场耦合水酶法同步释放植物油和蛋白的原理
在植物油料中,油脂存在于细胞质中,通常与蛋白质、碳水化合物等大分子结合形成脂蛋白、脂多糖等油脂复合体[6],而植物油料细胞表面的细胞壁(由纤维素、半纤维素、果胶等组成)对细胞具有保护和支撑的作用,同时也对细胞内油脂和蛋白的提取构成微观结构障碍。因此,对油料细胞壁结构、油脂复合体进行破坏,可使油脂从细胞中游离出来。如图2所示,水酶法同步释放植物油脂和蛋白质首先利用机械力对油料种子进行破碎,初步破坏细胞结构,在此基础上向反应体系中加入蛋白酶、纤维素酶、半纤维素酶、果胶酶等生物酶,降解细胞壁、分解油脂复合体,再利用各非油组分(蛋白质和碳水化合物)对油水亲和力的差异及油水密度不同而将油和蛋白质等成分分离,其中酶制剂的选择取决于油料自身结构与细胞壁组成。此外,油料在研磨过程中会形成一层脂蛋白膜,将油滴包裹在其中,而生物酶可将其降解、破碎,从而降低乳状液的稳定性,从而提高油脂得率。
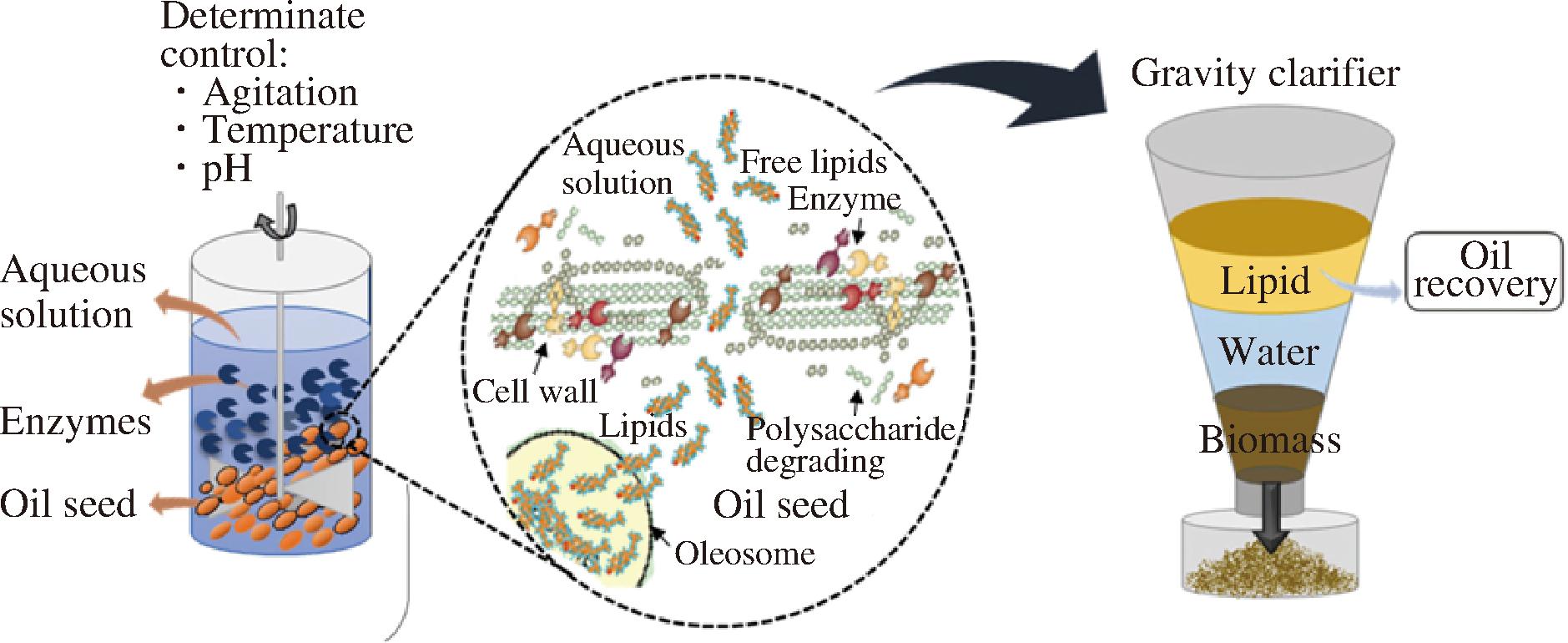
图2 酶法提油过程及酶对细胞壁作用[14]
Fig.2 Schematic diagram of enzymatic oil extraction process and enzyme action on cell wall[14]
注:Aqueous solution:水溶液;Enzymes:酶;Oil seed:油籽;Determinate control:决定性控制;Agitation:搅拌;Temperature:温度;Free lipids:游离脂质;Cell wall:细胞壁;Polysaccharide degrading:多糖降解Oleosome:油脂体;Gravity clarifier:重力澄清器;Oil recovery:采油;Water:水相; Biomass:生物质。
水酶法同步分离油脂和蛋白具有如下的优势:与油脂萃取方法相比,水酶法提油工艺中使用水为介质而无需添加溶剂等,更加经济环保、绿色安全[16];反应条件温和,无高温处理,能源消耗低;得到的油脂品质良好,无需进一步精炼,同时完整保留油料中蛋白质、碳水化合物等有效成分,提高油料作物综合利用率[17]。尽管水酶法提油工艺具有诸多优势,但酶用量大、处理时间长、油脂提取率低等是限制其发展的主要瓶颈问题。
物理场技术(电场、超声场、力场、电磁场、温度场等)由于其具有绿色、安全、高效的优势,在食品研究和有效物质提取方面的应用日趋广泛[18]。研究者将物理场技术与水酶法联用,探索和优化物理场强度与影响酶活力的工艺参数,以期更好地软化和促进油籽细胞壁骨架结构降解,改善酶与底物的作用环境,增加酶与底物的接触面积,使酶解时间缩短,从而提高细胞解离效率,获得目标产物,同时有效保留更多活性成分。多项研究表明,将热处理、超声波、微波等技术作为酶解油料的预处理步骤,可有效打开细胞通道,为酶制剂的萃取提供便利。
3 物理场耦合水酶法释放植物油脂的研究
3.1 热处理
热处理是水酶法提油工艺中常见的物理辅助手段,传统的热处理方式一般为烘烤和蒸煮,其基于热传导和热对流的共同作用,由于水的相变,蒸汽发生冷凝从而实现外部环境到油籽细胞的热量传递。油料经过热处理后,细胞内的可溶性物质如蛋白质、淀粉等成分溶解进入介质,油脂与蛋白的结合程度降低,油脂呈游离态;与此同时细胞结构更为疏松,渗透性增加[19],有利于酶进入细胞内进行酶解作用,并且热处理可以有效减少油料中过氧化物酶、脂肪酶等的不良影响[20]。
热处理对油籽细胞细胞壁、细胞膜以及细胞孔隙产生影响,便于脂质的流出。研究者[21]探究了高温蒸煮对花生、油菜籽等油料种籽微观结构的影响,各油料呈现出相似的变化,油料中原本紧密的细胞结构变得疏松、细胞壁结构被破坏,细胞内油脂体发生聚结现象,这是因为在高温蒸煮或浸泡加热的过程中,水作为极性分子提高了传热速率,油籽中含水量的增加导致单个油体周围的油蛋白膜受到明显破坏,油体稳定性下降,从而使油滴发生聚结,有利于油脂通过细胞壁进入介质中。
热处理与水酶法耦合作用于油料,处理温度为70~120 ℃,提油率通常在59.02%~89.8%[22-24],任健[25]对比了有无热处理对水酶法提取葵花籽油的影响,结果表明经过热处理后油脂提取率提高了约20%。DE AQUINO等[26]采用Alcalase 2.4L提取葵花籽油,将原料烘烤后进行酶解,缩短了酶解时间,并且烘烤处理对葵花籽油的甾醇含量影响不大,而对脂肪酸、生育酚含量和氧化稳定性无影响。在提升酶解效率、提高提油率的同时,热处理还会影响乳状液的稳定性,研究者[27]探讨了烘烤条件对水酶法提油过程中乳状液的粒径,电位产生的影响,发现烘烤温度为90 ℃时,乳状液粒径远大于花生油脂体粒径,Zeta电位绝对值较小,表明带电粒子间相互作用较弱、乳液稳定性差,易于破乳,此时含油乳状层得率最高达48.15%。目前热处理作为一种简易高效的辅助提油方式已被广泛应用于多种油料中。
热处理条件不当如过长的加热时间和过高的加热温度则对油脂的品质产生负面影响,同时导致疏水氨基酸的暴露,使蛋白质更好地吸附在油水界面,乳化现象严重,乳状液稳定性增强,阻碍油脂的进一步分离,并且容易导致热敏性成分被破坏。因此,对热处理条件的探索完善,有助于将其更好地应用在生物酶提油技术中,提高油脂得率。
3.2 超声波
超声波是一种新兴的绿色非热提取技术,在对油脂和其他生物活性物质的提取方面具有很好的延展性,应用前景广阔。如图3所示,超声波技术是基于空化效应发挥作用,超声波在液体介质中传播时会产生大量的空化气泡,空化气泡不断增长至内爆,产生巨大的能量,引起介质间发生物理化学效应。同时,在介质中形成高速微射流,直接作用于材料表面,对细胞壁造成破坏,伴随着机械振动和热效应等作用,导致分子键断裂、分子扩散加剧、反应速度增加,促进物料中有效成分的溶出[28]。
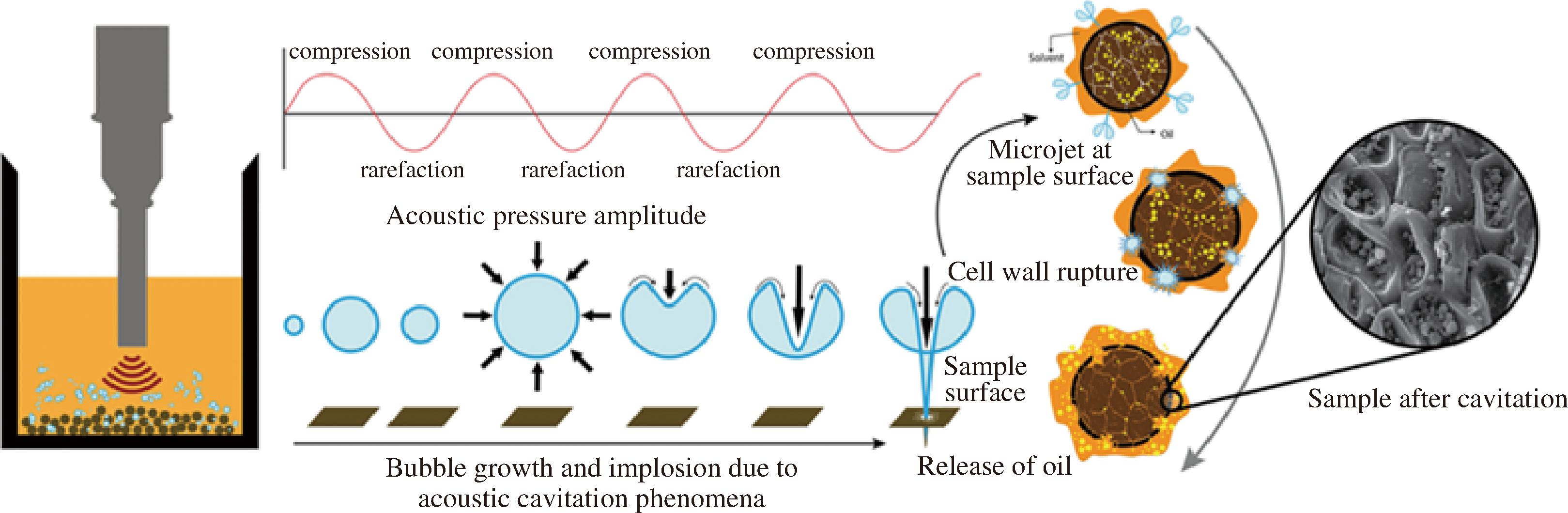
图3 超声波辅助提取植物油脂的作用机理[29]
Fig.3 Mechanism of ultrasound assisted extraction of vegetable oils[29]
注:compression:压缩;rarefaction:稀薄;Acoustic pressure amplitude:声压振幅;Sample surface:样品的表面;Microjet at sample surface:样品表面的微射流;Cell wall rupture:细胞壁破裂;Release of oil:油脂释放;Sample after cavitation:空化后的样品;Bubble growth and implosion due to acoustic cavitation phenomena:声空化现象导致的气泡增长和内爆。
在生物酶和油料的水基混合体系中,生物酶通过对油料细胞壁、脂蛋白复合体的降解达到释放油脂的目的,超声的空化作用可以辅助酶解,增强传质。经研究表明,由于超声和生物酶处理的协同作用,可加快酶解反应速率,提高油脂提取效率[30]。LIU等[31]将超声波辅助水酶法技术应用于山核桃仁油的提取,结果表明,超声辅助水酶法的提油率比传统的机械压榨法高出22.0%,大大提高了提取效率。超声辅助水酶法提油技术已被应用于花生[32]、大豆、菜籽、芝麻等油料作物,超声时间为20~60 min,油脂提取率为72.87%~95.50%。
与压榨法、溶剂浸出法相比,采用超声辅助水酶法技术提取的油脂酸价较低、碘值较高,并且能保留少量有效成分如总酚类物质、植物甾醇等[33-34]。WEI等[35]对超声辅助水酶法提取香樟籽油技术进行了工艺的优化。在超声功率220 W、提取时间1.4 h的条件下,香樟籽油提取率可以达到80.12%,营养特性分析结果表明,与溶剂萃取法相比,采用超声辅助水酶法制备的香樟籽油具有显著的生物活性,能够抗动脉粥样硬化、降低胆固醇。研究[36]报道了超声辅助酶法从玉米胚芽中提取油脂,实验结果表明,超声辅助水酶法提取的玉米胚芽油具有良好的品质,抗氧化活性优异、稳定性好,可用于作为食品或其他行业的自由基清除剂。综上所述,超声波辅助水酶法能显著提升细胞解离效率、较好保留有益成分,对生态友好、有工业应用潜力[37],但目前的研究集中在工艺条件的优化,缺乏对其作用机制进行系统深入的探索。
3.3 微波
微波是一种电磁波,波长为1 mm~1 m,频率为300 MHz~300 GHz。微波发生器产生的微波能量通过对酶与油料的混合体系进行辐射,使油料细胞内部温度升高,导致水蒸汽的形成和电穿孔效应,细胞内压力增大从而胀破细胞壁[38-39],在细胞表面形成通道,利于油脂的释放。由于微波辐射清洁、便利,具有显著的传质效果,将其与生物酶技术结合,可提高油脂提取效率、生产高品质油脂。
微波已经被证明对食品和化学加工行业中各种过程的反应速率有着显著的影响[40],特别是在油脂提取方面。目前微波辅助水酶法提取植物油脂的研究主要集中在工艺参数的优化和油脂品质的提高,通常是将微波作为油料酶解之前的预处理技术[41],ARROYO等[42]发现经微波-酶解处理后,叉叶木果籽油的提取率比传统的溶剂浸提法高出33.7%。研究者首先采用微波对香榧籽进行预处理(微波功率700 W、时间120 s),随后调节料液比(1∶5,g∶mL)、pH值(9.5)和温度(45 ℃),加入碱性蛋白酶(添加量为0.8%)酶解4 h,香榧籽油提取率最高可达94.54%[40]。研究酶解后微波处理澳洲坚果提取油脂[43],结果表明,在最优的工艺参数下油脂提取率为58.09%。此外,该技术在芝麻等多种油料中均有应用。
研究者通过对油脂进行品质分析,与传统的加热和提取技术相比,微波辅助水酶法能有效保留油脂风味物质成分,提取的油脂品质较好。研究报道采用微波辅助水酶法从文冠果[44]、南瓜籽[45]中提取的油脂,具有良好的抗氧化活性。ABD RASHIDS等[46]以棕榈果皮为原料,在850 W条件下微波处理1 min后,添加2%混合酶(果胶酶、纤维素酶、半纤维素酶、磷脂酶),酶解4 h,最终制得富含角鲨烯的棕榈油[(961.77±53.16) mg/100 g]。
通过对微波处理后油籽的微观形态进行观察可知,微波处理导致油料细胞迅速发生显著的形变、破裂,还可能使单个油脂体周围的脂蛋白膜发生破裂[39]。说明微波处理可以有效破坏细胞壁从而增加油料与生物酶的接触面积,从而加速酶解反应。微波处理有着诸多优势,但也存在着加热不均匀的缺点,这是因为微波处理时电磁波能量发生积聚,温度分布不均,从而出现油料非均匀(局部过热,局部加热不足)加热的现象[47]。因此,对微波处理的条件进行探索控制,使其能更好地与水酶法技术耦合,从而实现油脂的高效提取仍有必要。
3.4 其他辅助方法
超声波和微波因其能强化传质过程、具有较好的渗透性、有效破坏细胞结构等优势,在辅助生物酶技术提取植物油脂的领域有较好前景。同时,超声波和微波技术分别存在着热效应较弱、加热不均匀的缺陷,限制了酶法提油技术的进一步升级。研究者尝试将这2种技术结合起来有效破壁,改善生物酶提油技术油脂提取率低、酶解时间长的问题。HU等[48]研究从油莎豆中提取油脂的酶法工艺,工艺流程分为超声-微波联合处理和酶解两部分,经过优化超声-微波处理的最佳工艺条件为调节微波、超声功率分别为300、460 W,40 ℃下辐射30 min再进行酶解,最终油莎豆油的提取率达到85.23%。此外,研究者[49]采用超声和微波辅助水酶法从樱桃籽中提取油脂,樱桃籽粉碎后调节料液比为1∶12(g∶mL),超声-微波联合作用38 min,随后在细胞壁降解酶作用下酶解4 h,此时樱桃籽油的提取率为83.85%,且品质优良、生物活性成分含量高。由图3可以看出,超声的空化作用、微波产生的辐射和酶制剂产生协同作用,对油莎豆、樱桃籽细胞结构造成严重破坏。超声处理与高温蒸煮[50]、匀浆循环[51]等技术结合与酶法共同应用于植物油料的油脂提取成为新的研究热点。
高压、短波红外、脉冲电场等也被用于水酶法辅助提油。DENG等[52]将花生在150 ℃条件下进行短波红外辐射处理55 min后酶解,结果显示,与对照组相比,花生油的提取率提高8.74%,花生油中多酚类物质比对照组高出62.21%、具有更好的风味和稳定性。通过对复合酶(纤维素酶、果胶酶)提取葵花籽油的条件优化[53],葵花籽油提取率约为23.70%,研究者发现加入脉冲电场预处理后(场强为1.2 kV/cm),提取率可提高18.60%,生育酚含量提高。因此,物理场技术可与水酶法的结合能够突破传统油脂提取方法的局限性,发挥协同优势,提取植物油脂。
4 物理场耦合水酶法对蛋白特性影响的研究
物理场耦合水酶法在提取油脂的同时可同步释放蛋白质,研究者希望通过超声、高压、微波等技术对油料进行预处理以促进蛋白产量提高的同时改善油料中蛋白特性。大豆、花生、油菜籽等是高蛋白含量的油料作物,优化超声辅助水酶法提取的工艺条件,可使蛋白提取率达到89%以上。研究人员[54]优化微波辅助酶提取酸樱桃籽蛋白的工艺参数后,酸樱桃籽蛋白提取率可达94.5%,且酸樱桃籽蛋白对肿瘤细胞具有一定的毒性。WANG等[55]采用超声辅助水酶法提取山核桃蛋白并改善其功能性质,在最佳的工艺条件下,蛋白质得率最高可达25.51%;并且制备得到的山核桃蛋白粒径小、分散性好,乳化性和溶解性都得到提高。在酶法提油前采用红外、烘箱和微波对花生进行适度预烘烤,结果发现,预烘烤使花生蛋白的溶解性、乳化性和乳化稳定性得到明显提高,其中微波预烘烤效果最显著,与其他对照组相比,分别增加了18.57%、24.66%和455.97%[56]。
超声、微波等物理技术与水酶法技术的结合在提高蛋白得率的同时也改善了油料中蛋白的功能特性。超声波对蛋白质功能特性的改善是通过机械振动效应产生的,在超声作用的过程中蛋白质聚集体发生解离,大量空化气泡使体系内压力和温度升高,导致蛋白质结构展开,产生更多亲水氨基酸,蛋白质-水相互作用增强,蛋白质溶解性增加;而乳化性的增强是由于超声和酶解的协同效应使更多的内部疏水基团暴露,促进蛋白质、油脂间互相作用,蛋白质乳化性提高。微波电场中存在“冷点”,将油料置于微波场中处理时,产生过度烘烤的现象,使得蛋白解聚更加充分,内部疏水性氨基酸暴露,疏水性提高,从而改善了油料中蛋白质的乳化特性。
空化射流技术是一项将高速冲击、高频振动、高速剪切、超微粉碎、瞬时压降结合在一起的新型物理改性技术。李杨等[57]经过研究发现,利用空化射流处理技术可有效提高酶法制油豆渣中可溶性蛋白含量,豆渣蛋白溶解性、起泡性及乳化性均得到改善,这是因为空化射流处理产生的空穴效应使蛋白质分子发生解折叠,结构展开,亲水性提高,疏水基团暴露;另一方面,空化射流的剪切作用可使豆渣蛋白粒径减小,蛋白比表面积增加,从而提高了蛋白质与水分子之间的相互作用,改善豆渣蛋白溶解性;溶解性提高、分子交联程度增加使豆渣蛋白的起泡性增强。但随着物理场技术强度越大、处理时间越长,蛋白的溶解性等会降低,继续探索适宜的物理耦合酶技术强度对蛋白特性的影响仍有必要。
5 总结与展望
物理场耦合水酶法提取植物油脂和蛋白的技术具有工艺温和、绿色环保、省时高效、操作简便的优势,能够克服传统植物油脂提取方法的缺点,实现技术升级,生产的油脂产品品质优良,且无需过多精炼,此外还能最大限度地保留有益成分,能满足消费者对健康营养商品的追求。
目前,物理场耦合水酶法同步分离油和蛋白技术虽能协同增效,改善水酶法提油技术中因酶促反应缓慢导致的处理时间长、提油率低的瓶颈问题,提高油脂和蛋白的提取率,但由于其协同作用机制尚不明确,制约了该技术的进一步发展,并且使用额外的反应设备,使成本和能耗提高。因此,仍停留在实验室阶段,今后的研究中仍然要对物理场耦合水酶法的技术进行改进,不影响产品得率与品质的前提下克服物理场技术在目前工业应用中存在的短板,并将其对油料细胞的协同解离机制、同步高效释放油脂和蛋白的核心规律进行发掘与论证,使该技术能早日应用于植物油脂生产行业。同时,根据油料本身特点针对性选取物理技术耦合酶解、选择合适的酶解环境、借助生物工程技术开发新型酶、探索新型破乳工艺、提高出油率等均有助于水酶法技术进一步完善,助力工业化生产,促进油料利用行业产业升级。
[1] DUNFORD N T.Enzyme-aided oil and oilseed processing:Opportunities and challenges[J].Current Opinion in Food Science, 2022, 48:100943.
[2] WEN C T, SHEN M Y, LIU G Y, et al.Edible vegetable oils from oil crops:Preparation, refining, authenticity identification and application[J].Process Biochemistry, 2023, 124:168-179.
[3] CHEN X D, HUANG WW, WANG L.Process optimization in the extract of perilla seed oil with plant protein hydrolysate complex enzyme[J].Food Science &Technology, 2022, 42: e54722.
[4] NATHAN S.Process for simultaneously extracting oil and protein from oleaginous materials:US18747350A[P]. 1956-09-11.
[5] RHEE K C, CATER C M, MATTIL K F.Simultaneous recovery of protein and oil from raw peanuts in an aqueous system[J].Journal of Food Science, 1972, 37(1): 90-93.
[6] LI G H, MA L, YAN Z P, et al.Extraction of oils and phytochemicals from Camellia oleifera seeds:Trends, challenges, and innovations[J].Processes, 2022, 10(8): 1489.
[7] XUE F, LI C.Effects of ultrasound assisted cell wall disruption on physicochemical properties of camellia bee pollen protein isolates[J]. Ultrasonics Sonochemistry, 2023, 92: 106249.
[8] D AZ-SU
AZ-SU REZ P, ROSALES-QUINTERO A, FERNANDEZ-LAFUENTE R, et al.Aqueous enzymatic extraction of Ricinus communis seeds oil using Viscozyme L[J].Industrial Crops and Products, 2021, 170: 113811.
REZ P, ROSALES-QUINTERO A, FERNANDEZ-LAFUENTE R, et al.Aqueous enzymatic extraction of Ricinus communis seeds oil using Viscozyme L[J].Industrial Crops and Products, 2021, 170: 113811.
[9] STEINBRUCH E, WISE J, LEVKOV K, et al.Enzymatic cell wall degradation combined with pulsed electric fields increases yields of water-soluble-protein extraction from the green marine macroalga Ulva sp.[J].Innovative Food Science &Emerging Technologies, 2023, 84: 103231.
[10] ROSENTHAL A,PYLE D L,NIRANJAN K.Aqueous and enzymatic processes for edible oil extraction[J].Enzyme and Microbial Technology, 1996, 19(6): 402-420.
[11] NTONE E, VAN WESEL T, SAGIS L M C, et al.Adsorption of rapeseed proteins at oil/water interfaces.Janus-like napins dominate the interface[J].Journal of Colloid and Interface Science,2021, 583: 459-469.
[12] 郭华, 罗军武,周建平,等.几种油料的子叶细胞形态与主要化学成分分析[J]. 现代食品科技, 2006,22(4): 33-36.GUO H, LUO J W, ZHOU J P, et al. The morphology of Cotyledon cells and chemical components of some oil raw stuff[J].Modern Food Science and Technology,2006,22(4):33-36.
[13] 刘晨.水酶法提取花生油过程中油体组成、结构及稳定机制研究[D].郑州:河南工业大学, 2022.LIU C.Study on composition, structure, and stability mechanism of OB during aqueous enzymatic extraction of peanutoil[D]. Zhengzhou:Henan University of Technology, 2022.
[14] VALLADARES-DIESTRA K, DE SOUZA VANDENBERGHE L P, SOCCOL C R.Oilseed enzymatic pretreatment for efficient oil recovery in biodiesel production industry:A review[J].BioEnergy Research, 2020,13(4): 1016-1030.
[15] TZEN J T, HUANG A H.Surface structure and properties of plant seed oil bodies[J].The Journal of cell biology, 1992, 117(2): 327-325.
[16] DOS SANTOS W O, DA CRUZ RODRIGUES A M, DA SILVA L H M.Chemical properties of the pulp oil of tucumã-i-da-várzea(Astrocaryum giganteum Barb.Rodr.) obtained by enzymatic aqueous extraction[J].LWT, 2022, 163: 113534.
[17] ZHENG X, JUAN M, KOU X H, et al.Investigation on the emulsification mechanism in aqueous enzymatic extraction of edible oil from Schizoc hytrium sp.[J].Journal of the Science of Food and Agriculture, 2023, 103(6): 2904-2913.
[18] YU Q, ZHANG M, JU R H, et al. Advances in prepared dish processing using efficient physical fields:A review[J].Critical Reviews in Food Science and Nutrition,2022:1-15.
[19] 王宇凡.火麻籽酸浸超声预处理与水酶法加工工艺研究[D].无锡:江南大学, 2021.WANG Y F. Study on enzyme-assisted aqueous extraction processing of hempseed with ultrasound-assisted acid immersion pretreatment[D]. Wuxi:Jiangnan University, 2021.
[20] VELDSINK J W, MUUSE B G, MEIJER M M T, et al.Heat pretreatment of oilseeds:Effect on oil quality[J].Lipid-Fett, 1999,101(7): 244-248.
[21] YAMAMOTO N,TAMURA S.Textural properties, microstructure and sensory evaluation of cooked peanut compared with cooked soybean and kidney bean[J].Journal of Home Economics of Japan, 1999, 50(4):313-321.
[22] 程雪, 张秀玲, 孙瑞瑞, 等. 热处理辅助水酶法提取紫苏籽油的工艺优化[J]. 食品工业科技, 2016, 37(2):223-227;351.CHENG X, ZHANG X L, SUN R R, et al.Optimizing techniques of Perilla seed oil by aqueous enzymatic extraction assisted with heat treatment[J].Science and Technology of Food Industry, 2016, 37(2):223-227;351.
[23] 归艳,刘佳林,廖培龙,等.热处理辅助水酶法提取芝麻油的工艺[J]. 食品工业, 2021, 42(3): 82-87.GUI Y, LIU J L, LIAO P L, et al.The process of heat treatment assisted aqueous enzymatic extraction of sesame oil[J].The Food Industry,2021,42(3): 82-87.
[24] DICKEY L C, KURANTZ M J, PARRIS N. Oil separation from wet-milled corn germ dispersions by aqueous oil extraction and aqueous enzymatic oil extraction[J].Industrial Crops and Products,2008, 27(3): 303-307.
[25] 任健.葵花籽水酶法取油及蛋白质利用研究[D].无锡:江南大学,2008.REN J.Study on aqueous enzymatic extraction of oil and the utilization of protein from sunflower seed[D].Wuxi:Jiangnan University, 2008.
[26] DE AQUINO D S, FANHANI A, STEVANATO N, et al.Sunflower oil from enzymatic aqueous extraction process:Maximization of free oil yield and oil characterization[J].Journal of Food Process Engineering, 2019, 42(6): e13169.
[27] 刘晨,李宇健,陈复生,等.烘烤对水酶法提取花生油品质及乳状液稳定性的影响[J]. 中国油脂, 2020, 45(6): 1-5.LIU C, LI Y J, CHEN F S, et al.Effect of roasting on quality of peanut oil extracted by aqueous enzymatic method and emulsion stability[J].China Oils And Fats, 2020, 45(6): 1-5.
[28] TIWARI B K.Ultrasound:A clean, green extraction technology[J].TrAC Trends in Analytical Chemistry, 2015(71):100-109.
[29] SENRAYAN J, VENKATACHALAM S.Ultrasonic acoustic-cavitation as a novel and emerging energy efficient technique for oil extraction from kapok seeds[J].Innovative Food Science and Emerging Technologies,2020,62: 102347.
[30] UMEGO E C, HE R H, REN W B, et al.Ultrasonic-assisted enzymolysis:Principle and applications[J].Process Biochemistry, 2021, 100: 59-68.
[31] LIU A N,JING H J,DU X J, et al. Efficient ultrasonic-assisted aqueous enzymatic method for pecan nut kernel oil extraction with quality analysis[J]. Journal of Oleo Science, 2022, 71(12): 1749-1760.
[32] 李杨, 江连洲, 齐宝坤, 等. 超声波辅助水酶法提取花生油工艺[J]. 大豆科技, 2019(S1): 238-240;246.LI Y, JIANG L Z, QI B K, et al.Ultrasonic-assisted aqueous enzymatic extraction of peanut oil[J].Soybean Science &Technology, 2019(S1): 238-240;246.
[33] LI Y, ZHANG Y,SUI X N, et al.Ultrasound-assisted aqueous enzymatic extraction of oil from Perilla (Perilla frutescensL.) seeds[J].CyTA-Journal of Food, 2013, 12(1):1-6.
[34] WANG D L, YUAN Y W, XIE T F, et al.Ultrasound-assisted aqueous enzymatic extraction of Gardenia fruits (Gardenia jasminoides Ellis) oil: Optimization and quality evaluation[J].Industrial Crops and Products, 2023, 191: 116021.
[35] WEI C, XIAO K, LI H L, et al.Optimization of ultrasound assisted aqueous enzymatic extraction of oil from Cinnamomum camphora seeds[J].LWT, 2022, 164: 113689.
[36] HAN C P, LIU Q G, JING Y Q, et al.Ultrasound-assisted aqueous enzymatic extraction of corn germ oil:Analysis of quality and antioxidant activity[J].Journal of Oleo Science, 2018, 67(6): 745-754.
[37] LIU Z Z, GUI M L, XU T T, et al.Efficient aqueous enzymatic-ultrasonication extraction of oil from Sapindus mukorossi seed kernels[J].Industrial Crops and Products, 2019, 134: 124-133.
[38] CHEN Y, XU F X, PANG M M, et al.Microwave-assisted hydrodistil lation extraction based on microwave-assisted preparation of deep eutectic solvents coupled with GC-MS for analysis of essential oils from clove buds[J]. Sustainable Chemistry and Pharmacy, 2022, 27: 100695.
[39] KASEKE T, OPARA U L, FAWOLE O A.Effect of microwave pretreatment of seeds on the quality and antioxidant capacity of pomegranate seed oil[J].Foods, 2020,9(9): 1287.
[40] CHEMAT F, ABERT VIAN M, RAVI H K, et al.Review of alternative solvents for green extraction of food and natural products:Panorama, principles, applications and prospects[J]. Molecules,2019, 24(16): 3007.
[41] WEN S S, LU Y C, YU N X, et al.Microwave pre-treatment aqueous enzymatic extraction (MPAEE):A case study on the Torreya grandis seed kernels oil[J].Journal of Food Processing and Preservation, 2022, 46(11): e17115.
[42] ARROYO B Y N, CHAC N S L O, TACIAS-PASCACIO V G, et al.Aqueous enzymatic extraction of oil from microwave-pretreated Jicaro seeds[J].Current Biochemical Engineering, 2019, 5(1):42-49.
N S L O, TACIAS-PASCACIO V G, et al.Aqueous enzymatic extraction of oil from microwave-pretreated Jicaro seeds[J].Current Biochemical Engineering, 2019, 5(1):42-49.
[43] MA F Y, WEI Z F, ZHANG M, et al.Optimization of aqueous enzymatic microwave assisted extraction of macadamia oil and evaluation of Its chemical composition, physicochemical properties, and antioxidant activities[J].European Journal of Lipid Science and Technology, 2022, 124(1): 2100079.
[44] LI J, ZU Y G, LUO M, et al.Aqueous enzymatic process assisted by microwave extraction of oil from yellow horn (Xanthoceras sorbifolia Bunge.) seed kernels and its quality evaluation[J].Food Chemistry, 2013, 138(4): 2152-2158.
[45] JIAO J, LI Z G, GAI Q Y,et al. Microwave-assisted aqueous enzymatic extraction of oil from pumpkin seeds and evaluation of its physico chemical properties, fatty acid compositions and antioxidant activities[J].Food Chemistry, 2014, 147: 17-24.
[46] ABD RASHID S N A, LEONG H Y, CHENG K K, et al.Squalene rich virgin palm oil by microwave-assisted enzyme aqueous extraction from palm mesocarp[J].Biocatalysis and Agricultural Biotechnology, 2023, 47: 102568.
[47] PITCHAI K, CHEN J, BIRLA S, et al.A microwave heat transfer model for a rotating multi-component meal in a domestic oven:Development and validation[J].Journal of Food Engineering,2014, 128: 60-71.
[48] HU B, LI Y, SONG J X, et al.Oil extraction from tiger nut (Cyperus esculentus L.) using the combination of microwave-ultrasonic assisted aqueous enzymatic method-design, optimization and quality evaluation[J].Journal of Chromatography.A, 2020, 1627: 461380.
[49] HU B, WANG H Y, HE L F, et al.A method for extracting oil from cherry seed by ultrasonic-microwave assisted aqueous enzymatic process and evaluation of its quality[J]. Journal of Chromatography A, 2019, 1587: 50-60.
[50] AMIGH S, TAGHIAN DINANI S.Combination of ultrasound-assisted aqueous enzymatic extraction and cooking pretreatment for date seed oil recovery[J].Heat and Mass Transfer, 2020,56(8): 2345-2354.
[51] CHEN F L, ZHANG Q, GU H Y, et al.An approach for extraction of kernel oil from Pinus pumila using homogenate-circulating ultrasound in combination with an aqueous enzymatic process and evaluation of its antioxidant activity[J]. Journal of Chromatography A, 2016, 1471: 68-79.
[52] DENG B X, LI B, LI X D, et al.Using short-wave infrared radiation to improve aqueous enzymatic extraction of peanut oil:evaluation of peanut Cotyledon microstructure and oil quality[J].European Journal of Lipid Science and Technology, 2018, 120(2): 1700285.
[53] MORADI N, RAHIMI M.Effect of ultrasound- and pulsed electric field-assisted enzymatic treatment on the recovery and quality of sunflower oil[J].Separation Science and Technology, 2019,54(6): 1043-1054.
[54] BA
![]() B,
B, ![]() E, et al.Functional characterization of high-yield plant protein powder valorized from de-oiled sour cherry seed using microwave-assisted enzymatic extraction followed by spray- and freeze-drying[J].Biomass Conversion and Biorefinery, 2023,13(16): 14657-14671.
E, et al.Functional characterization of high-yield plant protein powder valorized from de-oiled sour cherry seed using microwave-assisted enzymatic extraction followed by spray- and freeze-drying[J].Biomass Conversion and Biorefinery, 2023,13(16): 14657-14671.
[55] WANG Q, WANG Y, HUANG M G, et al.Ultrasound-assisted alkaline proteinase extraction enhances the yield of pecan protein and modifies its functional properties[J].Ultrasonics Sonochemistry, 2021, 80: 105789.
[56] 邓博心.预烘烤对花生水酶法制油油脂释放行为及品质的影响[D].无锡:江南大学, 2018.DENG B X. Effects of pre-roasting on the release behavior and quality of peanut oil during the enzymatic aqueous extraction process[D].Wuxi:Jiangnan University, 2018.
[57] 李杨, 和铭钰, 吴长玲, 等.空化射流条件下酶法制油豆渣蛋白结构与理化特性研究[J]. 农业机械学报, 2020, 51(12): 332-340.LI Y, HE M Y, WU C L, et al. Effect of cavitation jet on structure and physicochemical properties of soybean residue protein produced by enzymatic oil production[J].Transactions of the Chinese Society for Agricultural Machinery, 2020, 51(12): 332-340.