硒是人体必须的微量元素,发挥着重要的生物学功能[1]。人体中的硒主要是通过摄入的食物获得,但是该途径摄入硒的含量远达不到膳食硒推荐摄入量(55 ug/d)[2-3]。因此,选择富硒食品来改善人体低硒状态仍然是目前最主要的手段之一[4]。根据硒盐的毒理性表明,有机硒的毒性远低于无机硒,且生物利用率更高[5-6]。研究证明,细菌、酵母、霉菌和蕈菌等微生物能够将无机硒转化为有利于人体吸收的有机硒以及硒单质[7]。选用何种微生物能够廉价且高效的富集有机硒已成为当今的研究热点。
目前微生物转化有机硒主要集中于富硒酵母与富硒乳酸菌。2017年SAINI等[8]发现发酵乳杆菌(Lactobacillus fermentum) NCDC 77具有高硒富集能力。对于富硒乳酸菌的研究,PESCUMA等[9]将无机硒添加到嗜酸乳杆菌(Lactobacillus acidophilus) CRL 636和路氏乳杆菌(Lactobacillus reuteri) CRL 1101的培养基中,发现2种菌株均合成了SeCys和SeMet。为了得到富硒能力较强的乳酸菌,易鑫等[10]利用不同浓度亚硒酸钠筛选出一株植物乳杆菌(Lactobacillus plantarum),优化后最佳富硒率为84.26%。但是乳酸菌并不是传统模式生物菌,其富硒机制尚不清楚,对于亚硒酸钠的耐受性远低于富硒酵母,直接影响菌株对于有机硒的富集。研究表明,酵母是良好的富硒载体[11],通过酵母的硒磷酸合酶(selenophosphate synthetase,SPS)催化,将无机硒转化为硒磷酸(SeP),进而合成硒蛋白[12-13]。富硒酵母与其他富硒微生物相比具有更高的硒转化效率,RAJASHREE等[14]利用富硒酵母分批补料发酵,得到硒含量为(3 758±6.5) mg/L,干酵母生物量为32.09 g/L。涂青等[15]以富硒酿酒酵母(Saccharomyces cerevisiae)SY 2为发酵菌种,利用5 L发酵罐培养富硒酵母,其硒含量为1 759.5 μg/L,硒转化率为90.1%。酵母菌主要将无机硒转化为SeMet,并将其插入合成硒蛋白,其硒蛋白含量可以达到总硒量的90%以上,且SeMet占比为70%左右,因此工业生产中常以SeMet作为酵母硒产品的质控标准[16-17]。另外,富硒酵母还用于家畜的饲养,以便提高肉的品质与有机硒的积累[18]。近年来,越来越多的研究将富硒酵母应用于食品发酵来满足人们日常的硒摄入量[19]。
国内外对于富硒酵母的研究十分广泛,常见的育种方式有自然育种、杂交育种和基因工程育种,前者存在过程繁琐、效率不高等缺点,后者虽然可以定向修饰优化菌株,但是技术要求难度大、操作复杂,且容易对生态环境造成威胁。由清华大学与天木生物科技有限公司合作研发的常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变采用氦气为工作气体,其活性粒子能够改变微生物细胞膜的结构及通透性,并引起基因损伤。与传统诱变和分子操作相比,ARTP具有操作简便、突变率高、诱变时效快且对环境无污染等优点,已被广泛应用到各类微生物菌种选育过程中。
本文以啤酒酵母为实验菌,利用高浓度亚硒酸钠(120 mg/L)YPD液体培养基进行初筛。在此基础上,通过ARTP诱变以及分析其在不同浓度亚硒酸钠平板上的耐受性,选育出富硒优势酵母菌株,并利用氢化物发生原子荧光光谱法探究啤酒酵母富硒后有机硒的含量,结合扫描电镜与傅里叶红外分析仪等方法分析,以期获得富硒酵母的相关数据,从而为后续研究富硒酵母的性能优化以及食品发酵提供实验数据支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
啤酒酵母,本实验材料取自实验室保藏菌种WX-01。
有机硒标品,上海源叶生物科技有限公司;甲苯、浓硝酸、EDTA-2 Na、过氧化氢、邻苯二胺等化学试剂均为国产分析纯。
1.2 仪器与设备
ARTP诱变系统,无锡源清天木生物科技公司;氢化物发生原子荧光光谱仪,北京金索坤公司;可见光分光光度计,上海元析公司;酶标仪、pH仪,上海佑科。
1.3 实验方法
1.3.1 菌种活化初筛与生长曲线的测定
将WX-01从保种管接种到配制好的YPD液体选择培养基(含亚硒酸钠120 mg/L)中活化初筛。取活化后的菌液转接于含50 mL YPD液体培养基中振荡培养。每隔4 h取待测液200 μL,稀释至适宜浓度后测定OD600值,以空白培养基为对照,绘制菌种生长曲线图。
1.3.2 ARTP诱变条件确定以及操作
将选育的耐硒菌株培养至对数生长期,稀释菌液至适宜浓度备用。本试验设置照射距离2 mm,气流量10 L/min,功率100 W[20],诱变时间分别为30、45、60、75、90、105、120 s。
1.3.3 ARTP致死率
将诱变后的菌悬液放入振荡培养箱培养0.5 h恢复培养,稀释至10-6后再涂布到亚硒酸钠(30 mg/L)抗性平板,28 ℃培养36 h。通过平板的菌落数,来计算菌株的致死率,并绘出致死率曲线。
1.3.4 耐硒菌株的筛选
确定以90 s为最佳诱变时间,选取生长状态最佳的诱变单菌落,编号并转接至斜面,同时确定最佳硒添加浓度。将菌悬液稀释至10-5,吸取100 μL菌悬液涂布至含有不同质量浓度亚硒酸钠抗性(0、30、60、90、120 mg/L)的平板上,28 ℃培养24 h,观察菌株的硒耐受状态。选取生长速率较快且菌落较大的菌株。
同时诱变菌接种到含亚硒酸钠(30 mg/L)的YPD液体培养基中发酵,28 ℃培养36 h,测量生物量,结合梯度平板筛选综合分析选取最佳诱变菌株。
1.3.5 硒含量的测定方法
原理:邻苯二胺在酸性条件下与硒(Ⅳ)形成具有配位饱和结构的络合物,在334 nm处有最大吸收峰,因此选择334 nm为测定波长[15]。
1.3.6 酵母生物量与硒含量测定
取活化的原始菌种、选育的诱变菌种摇瓶发酵培养36 h,硒添加质量浓度35 mg/L,8 000 r/min离心10 min,弃去上清液,并使用去离子水反复离心清洗沉淀3次。菌体放入60 ℃烘箱烘干至恒重,记录其生物量。保留干燥后的菌体,用于测定硒含量。
1.4 氢化物发生原子荧光光谱分析
硒以有机硒与无机硒的形式存在于酵母中,样品中无机硒经过6 mo1/L盐酸水浴提取,再使用环己烷萃取,用氢化物发生原子荧光光谱法测定提取液中无机硒的含量。硒总含量按GB 5009.93《第一法 氢化物原子荧光光谱法》测定。有机硒含量为硒总含量与无机硒含量的差值。
1.5 酵母菌富硒条件优化
1.5.1 硒添加浓度对酵母硒富集的影响
在摇瓶发酵培养(36 h,28 ℃,180 r/min),并向其中添加终质量浓度为0、25、30、35、40 mg/L亚硒酸钠溶液(220 μm水系滤膜过滤除菌),8 000 r/min离心10 min收集菌体,测定生物量与硒含量。
1.5.2 硒添加时间对酵母硒富集的影响
摇瓶发酵培养(36 h,28 ℃,180 r/min),分别在发酵的0、4、8 h添加终质量浓度为35 mg/L的亚硒酸钠溶液(220 μm水系滤膜过滤除菌),8 000 r/min离心10 min收集菌体,测定生物量与硒含量。
1.5.3 发酵时间对酵母硒富集的影响
摇瓶发酵培养(28 ℃,180 r/min),在8 h添加终质量浓度为35 mg/L亚硒酸钠溶液(220 μm水系滤膜过滤除菌),分别在24、36、48 h离心收集菌体(8 000 r/min,10 min),测定其生物量与硒含量。
1.6 表征
1.6.1 扫描电镜分析富硒酵母菌表观结构
样品处理[21-22]:将WX-1菌体分别接种到不含硒和含30 mg/L Na2SeO3 YPD液体培养基中培养。空白组于36 h取样。实验组分别在培养8、36、48 h取样。将富硒酵母菌体8 000 r/min 离心10 min去上清液,加入2.5%(体积分数)戊二醛4 ℃固定,离心去上清液。PBS缓冲液清洗冲洗2次,乙醇梯度洗脱,离心去上清液再用丙酮置换乙醇,反复2次,各持续20 min。随后冷冻干燥。最后,样品喷金后进行扫描电镜分析。
1.6.2 红外光谱法
样品制备[23]:将溴化钾粉末与冷冻干燥后的菌体粉末混合研磨,使用液压机将混合粉末制备成透明片状。以KBr作为空白样品组,以硒代氨基酸和富硒酵母为实验组。利用傅里叶红外光谱分析仪(Fourier transform infrared spectroscopy,FTIR)进行光谱检测。
2 结果与分析
2.1 酵母菌生长曲线测定
对出发菌株WX-01进行的生长曲线测定结果如图1所示。在0~8 h,菌株生长缓慢处于生长迟缓期;在8~20 h,菌株生长迅速处于对数生长期;随后菌体浓度保持稳定进入生长稳定期。由于菌株在对数生长期代谢旺盛,对外界环境敏感,容易发生突变,因此选择培养8 h的菌悬液作为ARTP诱变的生物材料。
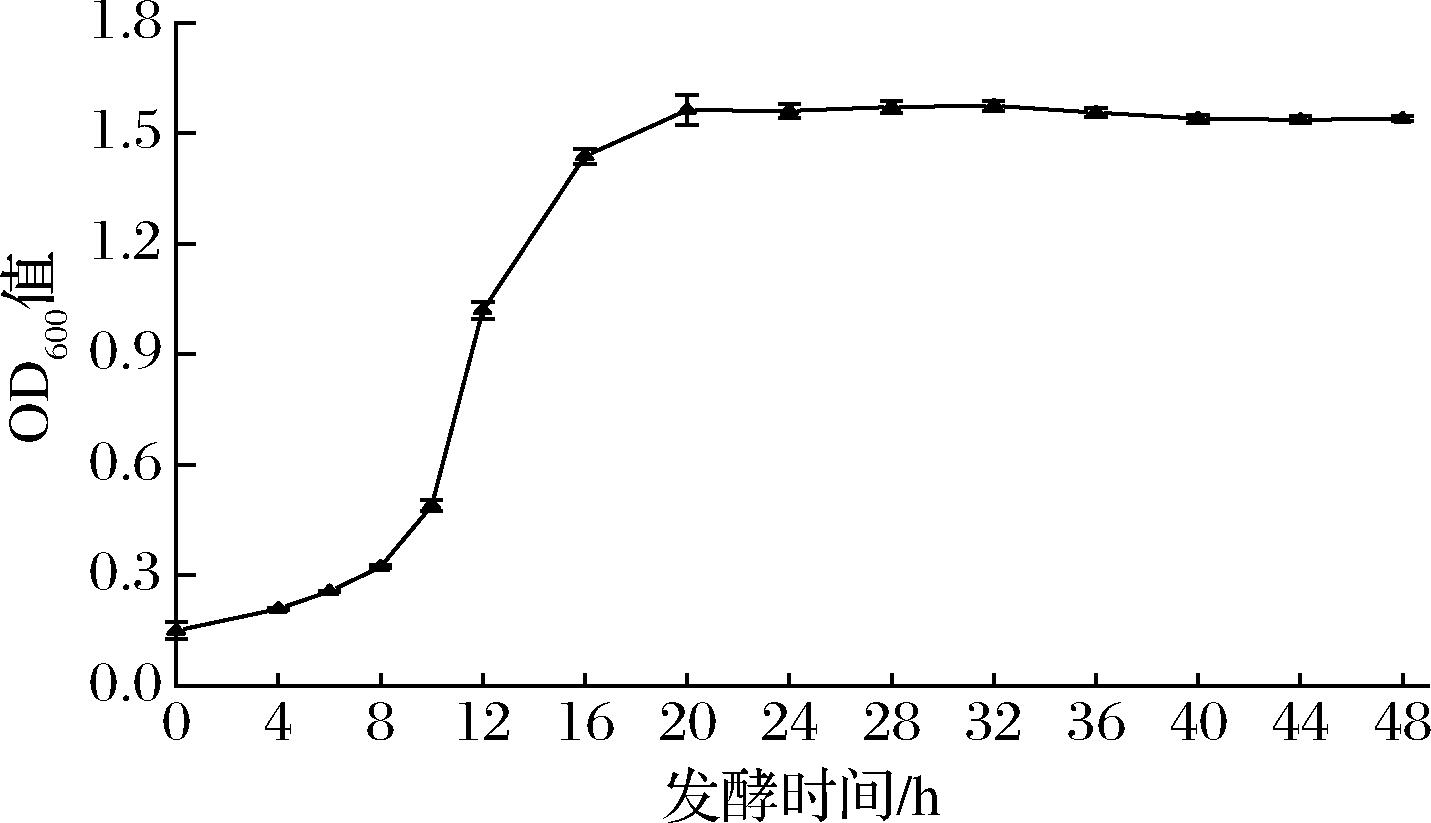
图1 WX-01生长曲线图
Fig.1 Growth graph of WX-01
2.2 致死率曲线
ARTP诱变后,取诱变液稀释至10-6后涂布于亚硒酸钠(30 mg/L)抗性的平板。WX-01的致死率随着诱变时间逐步升高,120 s诱变达到100%。根据文献报道,致死率在80%~90%,更有利于后续的筛选工作[24]。为此考虑到后续筛选效率,本实验选择90 s作为后期诱变的最佳处理时间。
2.3 耐硒菌株筛选结果分析
通过ARTP诱变,筛选出了6株酵母(命名为WX-1、WX-2、WX-3、WX-5、WX-6和WX-8),其中WX-1和WX-2在普通平板上呈现乳白色菌落,在低浓度下亚硒酸钠抗性平板呈现零星的淡红色,随着浓度的提高,红色菌落逐渐增多。2株诱变菌生长状态良好,菌落形态均一,平均菌落数均>50,表明它们具备良好的硒代谢能力。
通过液体培养基培养,对各菌株的生物量进行测定。在相同条件下,WX-1、WX-3和WX-5三株诱变菌均比出发菌WX-01的生物量高,分别高230%,270%和216%,并且WX-3酵母的生物量最高,为6 380 mg/L,WX-1与WX-5其次,分别为5 693 mg/L和5 403 mg/L。通过结合出发菌WX-01与诱变菌株平板筛选结果分析,选用WX-1作为后续富硒的试验菌株。
2.4 酵母生物量与硒含量测定
如图2所示,原始菌株WX-01的生物量为1 722 mg/L,硒含量为543 μg/g。WX-1、WX-2、WX-3、WX-5、WX-6和WX-8的生物量为5 093、2 180、6 380、6 003、3 890、923 mg/L,硒含量分别为1 673、1 522、401.7、944.5、444.2 μg/g。WX-1,WX-3与WX-5诱变菌的生物量比出发菌株WX-01高。WX-2与WX-1的硒含量比出发菌高。综合分析,WX-1为最佳诱变菌,生物量提高了2.44倍,硒含量提高了2.11倍。后续优化实验以WX-1为目的菌株。
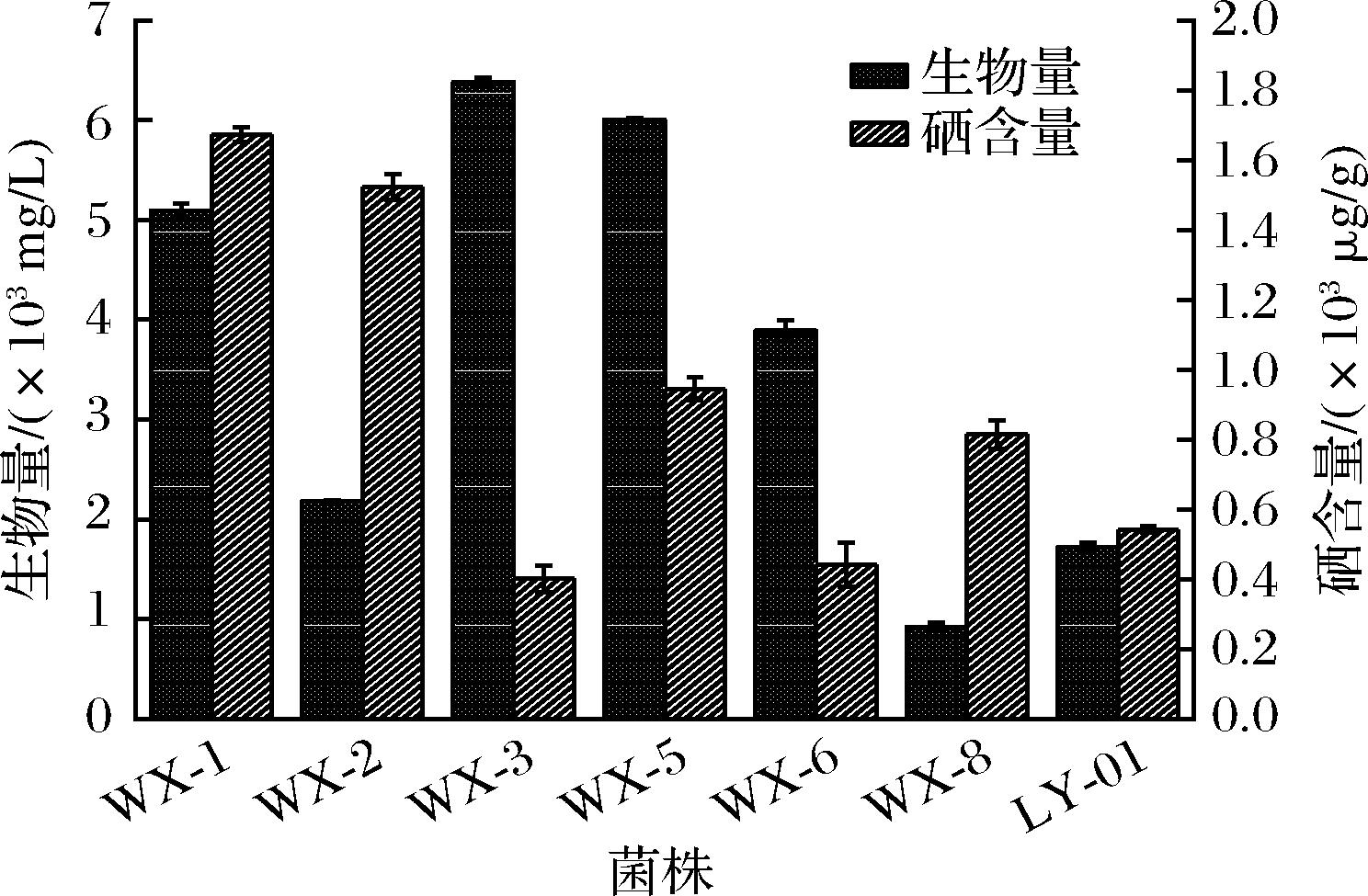
图2 诱变菌生物量与硒含量
Fig.2 Biomass and selenium content of mutagenic bacteria
2.5 氢化物发生原子荧光光谱法测定酵母硒含量
2.5.1 硒添加浓度对酵母硒富集的影响
如图3-a所示,硒的添加量为0 mg/L时,WX-1的生物量为8 630 mg/L,随着添加量逐渐增大到40 mg/L时,其生物量降低到4 685 mg/L。
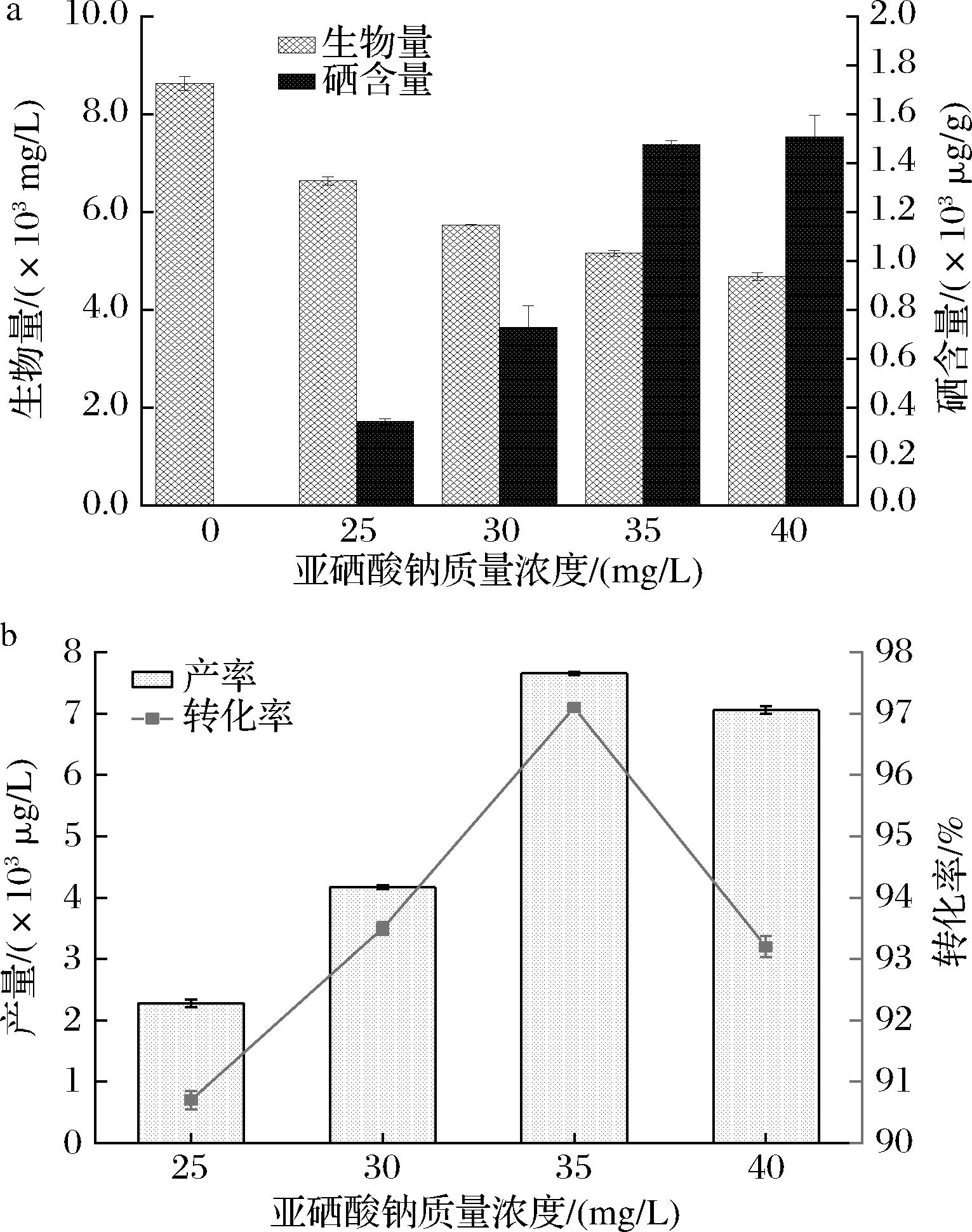
a-不同添加浓度对酵母生物量与硒含量的影响;b-不同添加浓度对酵母产量与转化率的影响
图3 不同培养浓度对酵母硒含量的影响
Fig.3 Effect of different culture concentrations on the selenium content of yeast
不同浓度的亚硒酸钠对于酵母有机硒的产量和转化率影响很大。根据图3-b的结果显示,当添加质量浓度低于35 mg/L时,随着浓度增大,产量和转化率呈现递增趋势。添加质量浓度为25 mg/L时,产量为2 277 μg/L,转化率为90.7%,添加质量浓度达30 mg/L时,产量为4 171 μg/L,转化率为93.5%。添加质量浓度在35 mg/L时达到最大值,此时产量为7 658 μg/L,转化率为97.1%。尽管在添加质量浓度为40 mg/L时,酵母硒含量能够达到1 507 μg/g,略高于添加质量浓度在30 mg/L时的硒含量(1 475 μg/g)。但在高浓度亚硒酸钠环境中,其生物量会降低,有机硒的转化率减小(93.2%),随之产量也会更低,为7 060 μg/L,因此最佳质量浓度选择是35 mg/L。
2.5.2 硒添加时间对酵母硒富集的影响
由图4-a可知,0~8 h酵母生物积累量依次为5 015、4 980、5 192 mg/L,而硒含量呈现先增后减的趋势,依次为940、1 320、1 475 μg/g。硒添加时间对于WX-1的生物量影响甚微,而对于酵母的富硒量有一定影响,在8 h后添加硒,其硒含量最大。因为8 h是WX-1菌对数生长期的开始,生长旺盛,适应外界不良环境的能力比较强,此时添加亚硒酸钠对于菌株的伤害最小,有利于硒的生物转化。而超过8 h,酵母相对硒代谢时间将大大减少,不利于酵母的富硒作用。
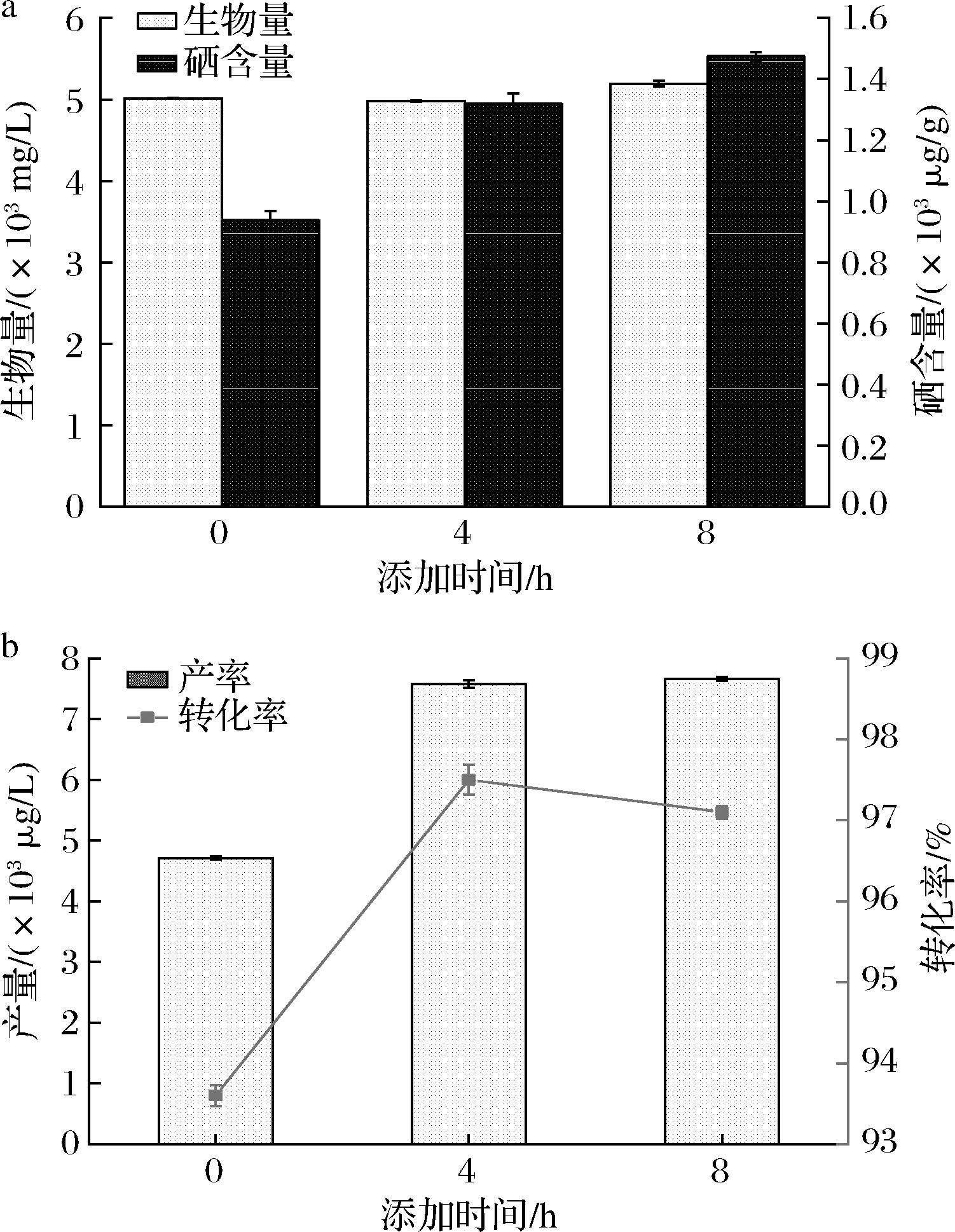
a-不同添加时间对酵母生物量与硒含量的影响;b-不同添加时间对酵母产量与转化率的影响
图4 不同添加时间对酵母硒含量的影响
Fig.4 Effect of different addition times on the selenium content of yeast
在不同时间段添加亚硒酸钠对于酵母的产量和转化率的影响主要取决于培养基中菌体代谢能力。如图4-b所示,在0 h添加,由于酵母菌浓过低,对于外界环境的抗逆能力较弱,导致酵母代谢能力下降,转化率降低,为93.6%,此时产量为4 714 μg/L。在4 h添加亚硒酸钠,酵母浓度足以抵抗亚硒酸钠的毒性,此时酵母的转化率为97.5%,与8 h添加时的转化率基本保持一致,其产量为7 574 μg/L,略低于8 h添加的产量。由于8 h是酵母的对数生长期,菌体代谢旺盛,代谢能力最强,对于外界环境的抗逆性最强,故最佳的添加时间为8 h。
2.5.3 发酵时间对酵母硒富集的影响
如图5-a所示,在发酵时间为24~48 h时,WX-1菌株的生物量与硒含量依次为3 886 mg/L和630 μg/g、5 192 mg/L和1 457 μg/g、4 303 mg/L和567 μg/g。随着发酵时间的增加,酵母的生物量与硒含量均呈现先增后减趋势。在36 h时,WX-1菌株的生物量与硒含量达到最高。在24~36 h时,菌株进入平缓期。超过36 h后,部分菌株进入衰亡期,同时酵母菌株应对代谢后期的环境压力,自发产生自噬调节[25]。

a-不同发酵时间对酵母生物量与硒含量的影响;b-不同发酵时间对酵母产量与转化率的影响
图5 不同发酵时间对酵母硒含量的影响
Fig.5 Effect of different fermentation times on the selenium content of yeast
由图5-b可知,培养24 h时,由于时间过短,生物积累量不够,有机硒的转化率也相对较低,为94.8%,产量为2 483 μg/L。培养48 h时,由于培养时间过长导致大量酵母细胞死亡,生物量下降,转化率降低,仅有92.9%,产量为2 483 μg/L。因此最佳的培养时间为36 h。
2.5.4 氢化物发生原子荧光光谱法测定酵母硒含量
通过酵母富硒条件优化,确定最佳的硒添加质量浓度为35 mg/L,加硒时间为8 h,培养时间为36 h。以氢化物发生原子荧光光谱法测定相同培养条件下WX-1与WX-01菌株的硒含量。如表1所示,出发菌WX-01培养后的生物量为1 722 mg/L,有机硒含量为343 μg/g。
表1 酵母硒含量数据
Table 1 Yeast selenium content data

原始编号生物量/(mg/L)样品中无机硒含量/(μg/g)硒含量/(μg/g)有机硒含量/(μg/g)WX-15 192431 5181 475WX-011 72235378343
酵母WX-1通过相同培养条件得到的生物量提高到5 192 mg/L,较原始菌株WX-01提高了2.01倍,硒含量达到1 475 μg/g,较原始菌株提高了3.3倍。由此可见,通过ARTP诱变和后期的发酵优化显著提高了菌株的硒富集水平。
2.6 表征结果分析
2.6.1 扫描电镜分析结果
富硒酵母WX-1的扫描电镜照片如图6所示。空白组图6-a、图6-e未添加硒,细胞形态完整,表面光滑。而在实验组图6-b、图6-f中,经过8 h的加硒培养,未在菌体表面清晰观察到硒单质沉淀物[26]。实验组图6-c图6-g与图6-d、图6-h分别培养了36 h和48 h,能够清晰观察到菌体表面吸附的硒单质沉淀,随着发酵时间的推移,实验组培养48 h呈现出部分菌体死亡状态,说明发酵36 h比48 h更佳。

a-酵母对照组(7.5 mm×5.00 k);b-酵母加硒培养8 h(7.5 mm×5.00 k);c-酵母加硒培养36 h(7.5 mm×5.00 k);d-酵母加硒培养48 h(7.5 mm×5.00 k);e-酵母对照组(7.5 mm×12.0 k);f-酵母加硒培养8 h(7.5 mm×12.0 k);g-酵母加硒培养36 h(7.5 mm×12.0 k);h-酵母加硒培养48 h(7.5 mm×12.0 k)
图6 WX-1菌株扫描电镜照片
Fig.6 Scanning electron micrograph of strain WX-1
2.6.2 红外结果分析
根据图7-a的红外光谱,探究酵母细胞表面与转运相关的特异性官能基团变化。实验以硒代半胱氨酸、甲基硒代半胱氨酸和硒代蛋氨酸为研究对象,其红外光谱显示在1 077 cm-1和526 cm-1处的相对吸收峰对应于硒蛋白中H—Se键和Se![]() O键的拉伸振动。
O键的拉伸振动。

a-硒代氨基酸红外图;b-富硒酵母红外图
图7 WX-1菌株硒富集培养的红外光谱图
Fig.7 Infrared spectra of selenium-enriched cultures of strain WX-1
对比图7-b的结果,以未加硒的酵母为对照组,3组红外光谱的峰基本保持不变,仅有少部分峰发生偏移。磷酸基团的图谱分布在1 300~800 cm-1,1 242 cm-1处的吸收峰表示P![]() O基团,这种峰的微弱偏移意味着在培养过程中细胞膜上磷酸蛋白可能参与了硒转运过程[13]。1 539 cm-1代表蛋白质酰胺Ⅱ的N—H基团与— CN拉伸振动的结合运动,在富集硒后分别移动到1 543 cm-1和1 546 cm-1[27]。1 456 cm-1代表CH3的C—H基团的伸缩振动,宽频带偏移到1 455 cm-1和1 456 cm-1。1 077 cm-1处和532 cm-1的吸收峰分别由H—Se键和Se
O基团,这种峰的微弱偏移意味着在培养过程中细胞膜上磷酸蛋白可能参与了硒转运过程[13]。1 539 cm-1代表蛋白质酰胺Ⅱ的N—H基团与— CN拉伸振动的结合运动,在富集硒后分别移动到1 543 cm-1和1 546 cm-1[27]。1 456 cm-1代表CH3的C—H基团的伸缩振动,宽频带偏移到1 455 cm-1和1 456 cm-1。1 077 cm-1处和532 cm-1的吸收峰分别由H—Se键和Se![]() O振动引起[28]。本实验研究表明硒参与酵母蛋白的合成,使得酵母蛋白发生结构性改变,导致富硒酵母与未富硒酵母在部分区域出现了强度不同的吸收峰。
O振动引起[28]。本实验研究表明硒参与酵母蛋白的合成,使得酵母蛋白发生结构性改变,导致富硒酵母与未富硒酵母在部分区域出现了强度不同的吸收峰。
3 结论与讨论
本实验以一株具有天然耐硒能力的啤酒酵母为出发菌,通过ARTP诱导酵母突变以及利用不同浓度亚硒酸钠抗性平板,选育具有优良硒富集性能的正突变菌株WX-1。进一步优化富硒条件,确定WX-1最佳富硒条件为亚硒酸钠添加质量浓度35 mg/L,添加时间8 h,经过摇瓶发酵36 h。通过氢化物发生原子荧光光谱测定,最终生物量提高到(5 192±36) mg/L,较原始菌株WX-01提高了201%,硒含量达到(1 475±33) μg/g,提高了330%。
从扫描电镜结果分析,该条件下富硒酵母与未富硒酵母表面差异明显,经富硒后表面有单质硒沉淀物附着现象。通过红外光谱探究了硒代半胱氨酸、甲基硒代半胱氨酸和硒代蛋氨酸中H—Se键和Se![]() O键的拉伸振动,来比较富硒酵母相同位置的键位振动。实验结果表明硒参与了酵母细胞的代谢过程。
O键的拉伸振动,来比较富硒酵母相同位置的键位振动。实验结果表明硒参与了酵母细胞的代谢过程。
[1] PAPADOMICHELAKIS G, ZOIDIS E, PAPPAS A C, et al.Dietary organic selenium addition and accumulation of toxic and essential trace elements in liver and meat of growing rabbits[J].Meat Science, 2018, 145:383-388.
[2] COLLINS R, BURROWS T, DONNELLY H, et al.Macronutrient and micronutrient intake of individuals with diabetic foot ulceration:A short report[J].Journal of Human Nutrition and Dietetics, 2022, 35(5):786-790.
[3] SCHIAVON M, PILON-SMITS E A H.Selenium biofortification and phytoremediation phytotechnologies:A review[J].Journal of Environmental Quality, 2017, 46(1):10-19.
[4] MEHDI Y, HORNICK J L, ISTASSE L, et al.Selenium in the environment, metabolism and involvement in body functions[J].Molecules, 2013, 18(3):3292-3311.
[5] KIE CZYKOWSKA M, KOCOT J,
CZYKOWSKA M, KOCOT J, ![]() M, et al.Selenium-a fascinating antioxidant of protective properties[J].Advances in Clinical and Experimental Medicine, 2018, 27(2):245-255.
M, et al.Selenium-a fascinating antioxidant of protective properties[J].Advances in Clinical and Experimental Medicine, 2018, 27(2):245-255.
[6] MÉPLAN C.Trace elements and ageing, a genomic perspective using selenium as an example[J].Journal of Trace Elements in Medicine and Biology, 2011, 25:S11-S16.
[7] XU X X, BAO Y J, WU B B, et al.Chemical analysis and flavor properties of blended orange, carrot, apple and Chinese jujube juice fermented by selenium-enriched probiotics[J].Food Chemistry, 2019, 289:250-258.
[8] SAINI K, TOMAR S K.In vitro evaluation of probiotic potential of Lactobacillus cultures of human origin capable of selenium bioaccumulation[J].LWT-Food Science and Technology, 2017, 84:497-504.
[9] PESCUMA M, GOMEZ-GOMEZ B, PEREZ-CORONA T, et al.Food prospects of selenium enriched-Lactobacillus acidophilus CRL 636 and Lactobacillus reuteri CRL 1101[J].Journal of Functional Foods, 2017, 35:466-473.
[10] 易鑫, 周琦, 欧阳祝, 等.乳酸菌富硒优化及其活性评价[J].食品与发酵工业, 2020, 46(8):179-186.YI X, ZHOU Q, OUYANG Z, et al.Selenium enrichment optimization of lactic acid bacteria and evaluation of its activity[J].Food and Fermentation Industries, 2020, 46(8):179-186.
[11] YANG J J, HUANG K H, QIN S Y, et al.Antibacterial action of selenium-enriched probiotics against pathogenic Escherichia coli[J].Digestive Diseases and Sciences, 2009, 54(2):246-254.
[12] PEREZ M B, LIPINSKI V M, FILLIPINI M F, et al.Distribution, accumulation and speciation of selenium at the different growth stages of four garlic clones[J].Food Additives and Contaminants Part A-Chemistry Analysis Control Exposure &Risk Assessment, 2021, 38(9):1506-1519.
[13] YE S H, SHEN F J, JIAO L Y, et al.Biosynthesis of selenoproteins by Saccharomyces cerevisiae and characterization of its antioxidant activities[J].International Journal of Biological Macromolecules, 2020, 164:3438-3445.
[14] RAJASHREE K, MUTHUKUMAR T.Preparation of organic selenium yeast by fed-batch fermentation[J].International Journal of Food and Fermentation Technology, 2013, 3(2):135-142.
[15] 涂青, 杨双全, 章之柱, 等.富硒酵母发酵工艺的优化[J].中国酿造, 2022, 41(10):140-145.TU Q, YANG S Q, ZHANG Z Z, et al.Optimization of fermentation technology of selenium-riched yeast[J].China Brewing, 2022, 41(10):140-145.
[16] GU X, GAO C Q.New horizons for selenium in animal nutrition and functional foods[J].Animal Nutrition, 2022, 11:80-86.
[17] ZHU H, BIERLA K, JIN X L, et al.Identification of γ-glutamyl-selenomethionine as the principal selenium metabolite in a selenium-enriched probiotic, Bifidobacterium longum, by two-dimensional HPLC-ICP MS and HPLC-ESI orbitrap MS[J].Journal of Agricultural and Food Chemistry, 2022, 70(22):6726-6736.
[18] ZHU C, YANG J S, NIE X Y, et al.Influences of dietary vitamin e, selenium-enriched yeast, and soy isoflavone supplementation on growth performance, antioxidant capacity, carcass traits, meat quality and gut microbiota in finishing pigs[J].Antioxidants, 2022, 11(8):1510.
[19] ALZATE A, PÉREZ-CONDE M C, GUTIÉRREZ A M, et al.Selenium-enriched fermented milk:A suitable dairy product to improve selenium intake in humans[J].International Dairy Journal, 2010, 20(11):761-769.
[20] XIAO B H, HU Y Y, FENG X Q, et al.Breeding of new strains of Gracilariopsis lemaneiformis with high agar content by ARTP mutagenesis and high osmotic pressure screening[J].Marine Biotechnology, 2023, 25(1):100-108.
[21] 张亚玲, 宋靖靖, 刘涵, 等.弗氏柠檬酸杆菌富硒发酵工艺优化[J].食品科技, 2023, 48(2):21-28.ZHANG Y L, SONG J J, LIU H, et al.Optimization of selenium-enriched fermentation by Citrobacter freundii[J].Food Science and Technology, 2023, 48(2):21-28.
[22] DE ALMEIDA F P, FREIRE D M G, LINS U, et al.Surface imaging of the filamentous fungus Penicillium simplicissimum growing in a solid-state fermentation system[J].Micron, 2017, 99:19-25.
[23] RUTHERFORD S H, GREETHAM G M, TOWRIE M, et al.Detection of paracetamol binding to albumin in blood serum using 2 D-IR spectroscopy[J].The Analyst, 2022, 147(15):3464-3469.
[24] 凌思雨. 谷胱甘肽高产菌的诱变选育及其发酵条件优化[D].芜湖:安徽工程大学, 2022.LING S Y.Mutagenesis and breeding of glutathione high-yielding bacteria and optimization of fermentation conditions[D].Wuhu:Anhui University of Technology, 2022.
[25] YANG Y, GATICA D, LIU X, et al.Upstream open reading frames mediate autophagy-related protein translation[J].Autophagy, 2023, 19(2):457-473.
[26] 车林. 细菌合成硒基纳米材料的特性及其光催化/光热转化活性[D].大连:大连理工大学, 2018.CHE L.Characterization and photocatalytic/photothermal conversion activity of selene-based nanomaterials synthesized by bacteria[D] Dalian:Dalian University of Technology, 2018.
[27] XU X J, XIA L, HUANG Q Y, et al.Biosorption of cadmium by a metal-resistant filamentous fungus isolated from chicken manure compost[J].Environmental Technology, 2012, 33(14):1661-1670.
[28] 刘金凤. 富硒酵母的制备及在刺参养殖中的应用[D].大连:大连工业大学, 2016.LIU J F.Preparation of selenium-rich yeast and its application in the culture of stichopus japonicus[D].Dalian:Dalian Polytechnic University, 2016.