由天然大分子构成的水凝胶是一类重要的营养物质递送系统,具有pH响应性和可控释放等优点[1-2]。但是由单一多糖形成的水凝胶存在着内部网孔大、机械性能较差以及极性大等缺点,对于活性物质荷载以及释放方面效果不理想[3-4]。最近,由多糖凝胶基质和蛋白纤维形成的多糖-蛋白纤维复合凝胶因具诸多优点而广受关注[5-6]。一方面,多糖-蛋白纤维复合凝胶制备通常通过物理交联形成,没有添加化学交联剂,这使得复合凝胶具有优异的生物相容性。另一方面,多糖和蛋白纤维的组合可以有效改善多糖水凝胶的机械强度和极性,并在疏水性活性物质递送方面具有优越性[7]。
黄原胶(xanthan gum,XG)是一种高分子质量的水溶性胞外阴离子型多糖。由于分子链上羟基和羧基基团分子内和分子间氢键的相互作用,XG在一定浓度下可以使得分子链呈单螺旋或双螺旋构象并具有较弱的凝胶状性质[8]。在研究初期发现在XG含量高于15 mg/g时可以形成稳定的水凝胶。蛋白纤维通常是蛋白质溶液在低pH、加热条件下自组装形成的纤维状热聚集体[9]。蛋白纤维具有较高的长径比和各向异性,这是形成的多糖-蛋白纤维水凝胶具有较高机械性能的前提条件[10]。姜黄素(curcumin,Cur)是一种从姜黄根茎中提取的酚类成分,由于其促进健康的特性,如抗炎、抗肿瘤、抗菌和抗氧化活性,在许多领域引起了广泛关注[11]。然而,Cur作为功能性成分在食品中的应用因其水溶性低和化学稳定性差而受到限制[12]。蛋白纤维具有强表面疏水性,是潜在的疏水性活性物质良载体[7,13]。通过蛋白纤维与Cur络合从而增加姜黄素的水分散性是一种可行的方法[14]。
本研究以XG 和β-乳球蛋白纤维(β-lactoglobulin fiber,Fblg)作为原料来制备XG-Fblg复合凝胶。研究了XG-Fblg复合凝胶的凝胶特性,如微观结构、流变学和质构性能等。研究了Fblg含量对XG-Fblg凝胶性能的影响。最后,XG-Fblg凝胶被用作Cur的递送载体,并检测了Cur在模拟胃肠道的释放情况。本研究旨在为多糖-蛋白纤维复合凝胶的制备和应用提供新的见解。
1 材料与方法
1.1 实验材料
黄原胶,中国中轩生物有限公司;葡萄糖酸内脂(glucono delta-lactone,GDL),阿拉丁试剂公司;新鲜牛奶,武汉新东杨畜牧养殖专业合作社;姜黄素,上海麦克林生化科技有限公司。
1.2 仪器与设备
TU-1900紫外可见光分光光度计,北京普析通用仪器有限责任公司;Zetasizer Nano-ZS纳米粒度及电位分析仪,英国Malvern公司;JSM-6390LV场发射电子扫描显微镜,美国FEI公司;Haake RheoStress 6000旋转流变仪,美国Thermo Fisher公司;TA.XT.Plus质构分析仪,北京乐顿科技有限公司;Dimension Icon原子力显微镜,美国Bruker公司。
1.3 实验方法
1.3.1 Fblg的制备
参考胡静等[15]的方法提取β-乳球蛋白。新鲜牛奶在不同的pH下离心多次除去乳脂、酪蛋白、α-乳白蛋白,再通过透析除去乳糖、离子等小分子杂质,冷冻干燥得到纯度约为96%的天然β-乳球蛋白粉末。将β-乳球蛋白溶于超纯水中配制成质量浓度为2%的蛋白溶液,搅拌溶解过夜使蛋白充分溶解。将2.0%的蛋白溶液在pH 2.0和85 ℃下加热16 h,加热完成后立即用冰水浴冷却20 min后得到Fblg悬浮液,使用MWCO=100 kDa的透析袋,将Fblg悬浮液在pH 2.0的水中透析72 h(每隔12 h换1次水)。透析后的纤维溶液利用真空冷冻干燥机冻干后低温保存。
1.3.2 XG-Fblg样品溶液的制备
取0.5 g的XG,在60 ℃恒温搅拌30 min下溶于50 g水中配制成质量分数为1%的XG溶液,用1 mol/L NaOH调整XG溶液pH为7.0。取1 g冻干后的Fblg溶于50 g水中配制成2%的Fblg溶液,调节Fblg溶液pH为7.0。然后按一定比例混合2种溶液和超纯水配制成质量分数为0.5%XG-0.25%Fblg、0.5%XG-0.5%Fblg和0.5%XG-1%Fblg的复合溶液。向不同复合溶液中加入0.05% NaN3用来抑制细菌生长并贮存在4 ℃冰箱备用。
1.3.3 XG-Fblg复合凝胶的制备
配制好1.3.2节制备的不同混合样品,将GDL在恒定搅拌(100 r/min)下缓慢添加到混合样品中,使其分布均匀,然后在25 ℃下酸化(不搅拌和不干扰)24 h调控混合样品pH值为4.0。采用小瓶倒置法检验凝胶的成功形成。将小瓶倒置,在25 ℃下不流动24 h的样品视为稳定的水凝胶。作为对照,取0.75 g XG粉末,在60 ℃恒温搅拌30 min下加到50 g 去离子水中配制成质量分数1.5%的XG凝胶,在搅拌过程中同样加入GDL,然后在25 ℃下酸化24 h。
1.3.4 XG-Fblg体系的电位测定
为了了解Fblg和XG之间的相互作用,在(25±0.1) ℃下,使用纳米粒度及电位分析仪测量Fblg、XG和不同质量比(XG/Fblg)的XG-Fblg复合物在质量分数为0.1%下的Zeta电位。用适当浓度的NaOH和HCl调节不同溶液pH为(7.0~2.0),检测器的光散射检测角度为173°,He/Ne气体激光器波长633 nm,激光器功率4 mW。每个样品测量3次,取平均值。
1.3.5 XG-Fblg体系的浊度分析
使用紫外-可见分光光度计在波长500 nm处测量Fblg、XG和不同质量比的XG-Fblg复合溶液在pH 4.0和pH 7.0下的浊度。所有测量均使用1 cm路径长度的石英池,用含有去离子水的石英池作为参考空白。对至少3个样本重复的浊度值进行了分析,并以平均值表示。
1.3.6 原子力显微镜(atomic force microscope,AFM)表征XG-Fblg样品微观形貌
将Fblg溶液、XG溶液和XG与Fblg的复合溶液(质量比1∶2)的复合溶液分别用超纯水稀释至质量浓度为0.03%,用1 mol/L的NaOH和HCl溶液分别将不同溶液调节至pH 7.0和pH 4.0两种情况,取10 μL滴于新切割的云母片上,然后静置干燥过夜。选择AFM智能扫描模式对每个样品进行多次扫描测量样品形貌。选用的探针型号为布鲁克ScanAsyst-Air,其弹性系数为0.4 N/m,驱动频率为70 kHz。
1.3.7 扫描电子显微镜(scanning electron microscope,SEM)
将不同凝胶放在液氮中快速冷冻10 min,冷冻后利用真空冷冻干燥机冻干去除水分。使用医用超薄刀片切开露出截面并利用导电胶粘在样品台上进行喷金处理。用场发射扫描电镜对0.5%XG-0.25%Fblg、0.5%XG-0.5%Fblg、0.5%XG-1%Fblg以及1.5%XG凝胶的微观结构进行表征。
1.3.8 流变实验
1.5%(质量分数)XG 凝胶和不同比例XG-Fblg 复合凝胶的流变特性使用旋转流变仪进行表征。在 25 ℃下,将不同凝胶样品沉积到流变仪平行板上,平行板为P35 TiL型(直径 25 mm,间隙 1 mm),然后放置 5 min以达到平衡。在0.2%的固定应变幅度(线性黏弹性区域内)下进行动态频率扫描测试,扫描频率范围为0.01~1 Hz,以对数模式采集数据点。
1.3.9 质构分析
1.5%(质量分数)XG 凝胶和不同比例XG-Fblg 复合凝胶的机械性能使用质构分析仪进行测量。复合凝胶在室温下放置1 h,然后通过P/0.5探针进行分析。条件为:压缩模式,测试前速度:1 mm/s,测试速度:0.5 mm/s,测试后速度:1 mm/s,压缩比为25%,触发力为5 g。不同类型凝胶平行测试5次。
1.3.10 体外释放实验
配制质量分数为0.5%XG、1.5%Fblg和0.5%XG-1%Fblg的溶液各10 mL,调制溶液pH为7.0。向不同溶液中加入2 mg 姜黄素,避光搅拌0.5 h,离心(8 000 r/min,10 min)以去除游离的姜黄素。用甲醇稀释上清液并在 425 nm 处用分光光度法测量其吸光度。用姜黄素标准曲线确定上清液中姜黄素的浓度[7]。将含有Cur的0.5%XG溶液的上清液加入适量XG粉末加热溶解使其质量分数达到1.5%后形成凝胶,含有Cur的0.5%XG-1%Fblg溶液的上清液按照1.3.3节方式处理形成凝胶。
体外释放实验参考F RT
RT N等[16]的方法并稍作修改。将5 g荷载了Cur的不同样品加入到30 mL模拟胃液(simulated gastric fluid,SGF,含有 2 g/L NaCl和1.6 g/L 胃蛋白酶,pH 2.0)中,并在 37 ℃下以100 r/min的速度振荡释放2 h。然后将30 mL模拟肠液(simulated intestinal fluid,SIF,含有6.8 g/L KH2PO4和1%胰酶,pH 7.4)添加到SGF中并调节pH至7.4后继续释放4 h。收集特定时间的释放介质,补充等量新鲜介质,在425 nm处根据姜黄素的标准曲线分析姜黄素的释放量。
N等[16]的方法并稍作修改。将5 g荷载了Cur的不同样品加入到30 mL模拟胃液(simulated gastric fluid,SGF,含有 2 g/L NaCl和1.6 g/L 胃蛋白酶,pH 2.0)中,并在 37 ℃下以100 r/min的速度振荡释放2 h。然后将30 mL模拟肠液(simulated intestinal fluid,SIF,含有6.8 g/L KH2PO4和1%胰酶,pH 7.4)添加到SGF中并调节pH至7.4后继续释放4 h。收集特定时间的释放介质,补充等量新鲜介质,在425 nm处根据姜黄素的标准曲线分析姜黄素的释放量。
2 结果与分析
2.1 不同XG-Fblg 混合比例体系的电位及浊度随pH变化
不同比例的XG-Fblg复合溶液的电位和浊度随pH变化如图1所示。由图1-a可知,Fblg溶液的等电点(isoelectric point,pI)在5.2附近,在pH小于pI时Fblg带正电荷,pH大于pI时Fblg带负电荷。这与胡静[15]研究结果一致。由于XG侧链中葡萄糖醛酸的存在,XG溶液在pH(7.0~2.0)下均带负电荷。XG和Fblg在pH=7.0时带相同电荷,在pH=4.0时带相反电荷,因此选择pH=4.0和7.0进行浊度测试。浊度是由于体系中的粒子对光发生散射而导致透射光的损失引起的,浊度值的大小反映了XG和Fblg的络合程度[17]。为了更好地理解 XG和 Fblg之间的络合,用 XG或 Fblg 的浊度作为对照。如图1-b所示,在pH=7.0时,不同 XG-Fblg 混合物的浊度几乎与单独的 XG相同,表明 Fblg与 XG在 pH 7.0时没有络合物产生,这时Fblg和XG分子都带较高的负电荷相互排斥,可能处于共溶状态;在pH=4.0时随着Fblg含量的增加,XG-Fblg复合物的浊度逐渐增加,当XG与Fblg的质量比为1∶2时,XG-Fblg复合物的浊度增加到最大。这表明带负电荷的XG分子与带正电荷的Fblg静电相互吸引形成络合物,络合程度随Fblg占比的增加而增加。
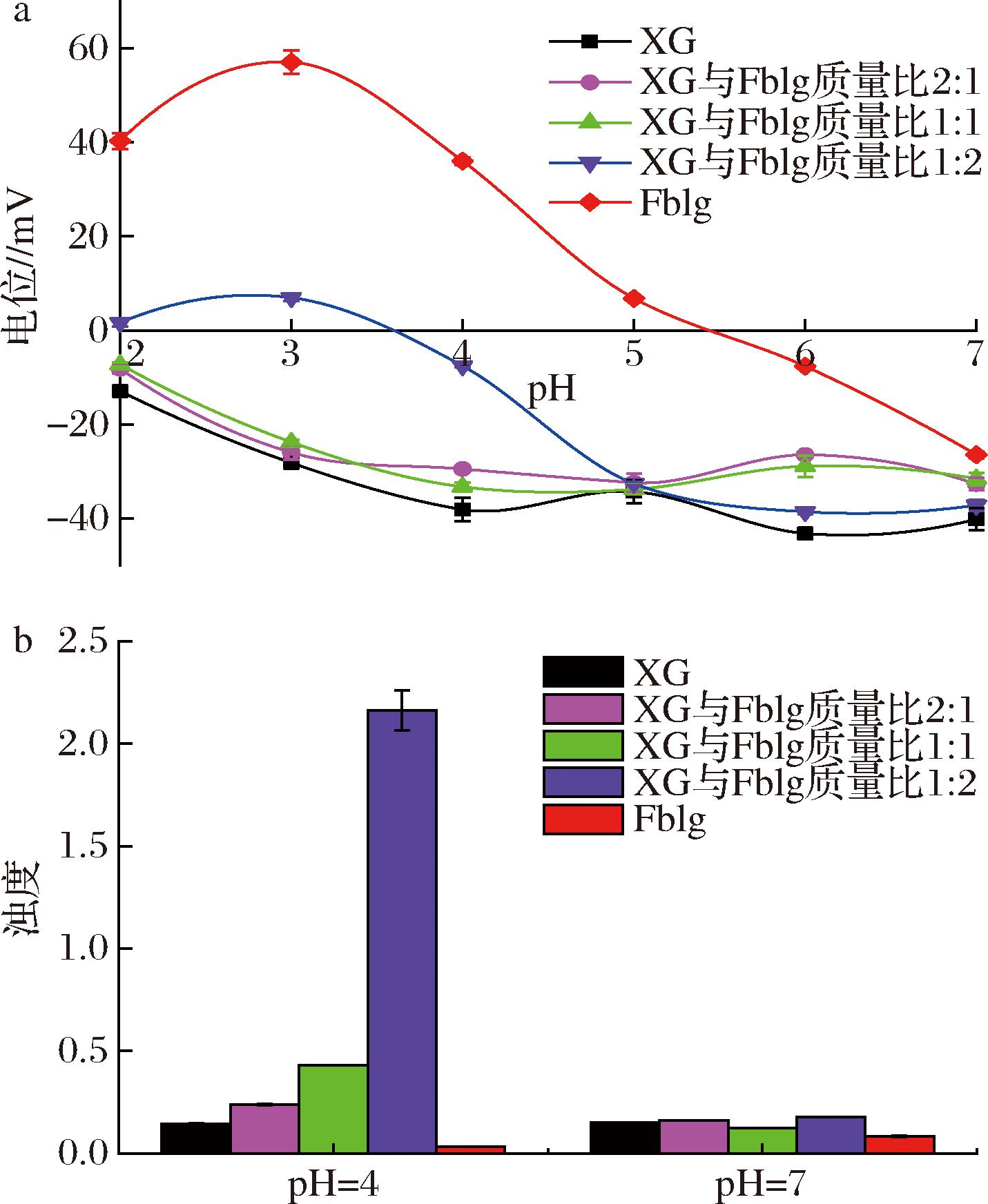
a-电位图;b-浊度图
图1 不同质量比(XG/Fblg)的复合溶液电位图和浊度图
Fig.1 Zeta-potential and turbidities of XG-Fblg system with different mixing ratio
2.2 AFM表征XG-Fblg体系微观形貌
利用AFM来研究Fblg、XG和XG-Fblg(质量比为1∶2)复合物的微观形貌。如图2 所示,Fblg是一种具有高长径比和高各向异性的一维结构,直径约为 5~10 nm,长度分布为700~3 500 nm,大多数长度在1 000 nm以上(图2-a)。黄原胶一种高分子质量的多糖,有着较长的分子链,长度为200~350 nm。在低质量浓度下,XG分子链由于分子链间强的空间位阻和静电排斥作用,有着良好的分散性且分子链可以自然舒展(图2-b)。为了探究静电相互作用对XG和Fblg分子链的影响,分别在pH=7.0和pH=4.0下观察XG-Fblg复合物的界面形貌。在pH=7.0下,XG和Fblg分子链均带负电荷不发生静电相互作用,XG和Fblg的分子链结构不发生改变,分子链间互不影响(图2-c)。在pH=4.0下,XG和Fblg分子链带相反电荷,此时在静电作用下相互吸引,XG与Fblg进行络合发生聚集(图2-d)。
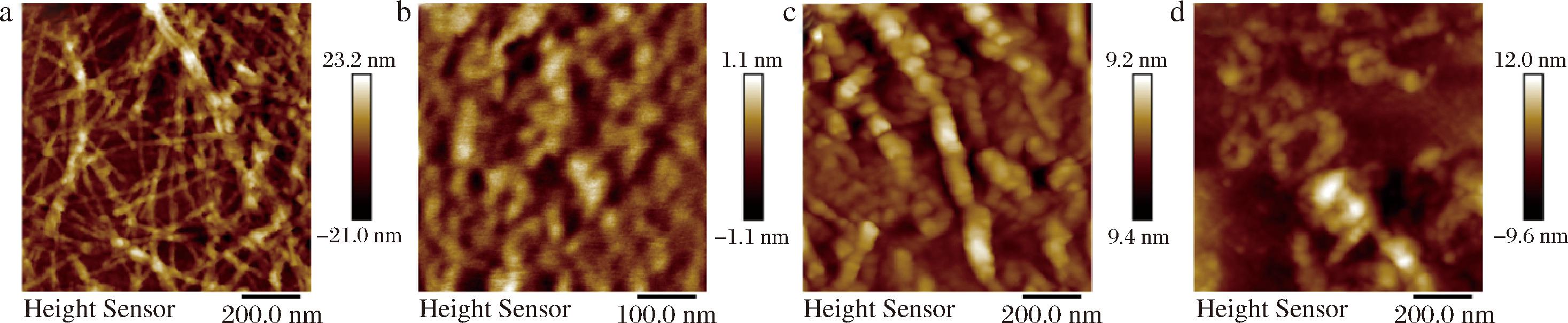
a-Fblg;b-XG;c-XG-Fblg-pH 7.0;d-XG-Fblg-pH 4.0
图2 Fblg、XG和 XG-Fblg复合物的AFM图像
Fig.2 AFM images of Fblg, XG, and XG-Fblg complexes
2.3 宏观图
XG凝胶和XG-Fblg凝胶成功形成后,在应用前有必要对其进行系统表征。在实验中发现XG可以在高质量分数(≥1.5%)下形成水凝胶,且其形成条件不受环境pH的影响;而在XG质量分数低至0.5%时,无法通过自身形成凝胶(图3-a)。为了进行合理比较,XG质量分数固定在1.5%以便保持总聚合物量与0.5%XG-1%Fblg凝胶一致,且可以形成XG凝胶。XG-Fblg凝胶中的XG质量分数固定为0.5%以便形成溶液与Fblg混合。如图3-a和图3-b所示,在pH=7.0的条件下,不同XG-Fblg复合溶液没有形成凝胶,在使用GDL酸化后,不同XG-Fblg复合溶液均可以凝胶化,并在倒置24 h后保持稳定。根据图1和图2合理推断Fblg和XG可以通过静电相互作用协同凝胶化。

a-0.5%XG溶液和1.5%XG凝胶;b-未用GDL酸化前的样品;c-GDL酸化后的样品
图3 将小瓶倒置24 h后的不同样品照片
Fig.3 Photographs of different samples after inverting the vials for 24 h
2.4 微观结构
利用SEM观察了XG凝胶和XG-Fblg凝胶的表面和截面的微观结构,如图4所示。XG凝胶的表面相对粗糙,随着Fblg的增加,XG-Fblg凝胶表面变得更为光滑。XG凝胶在横截面方向上具有规则的层状结构,而XG-Fblg凝胶则形成了精细的微米级多孔网络结构。随着Fblg的增加,网孔尺寸缩小,在相同范围内,凝胶内部可以排列更多紧密有序三维网孔。黄原胶的凝胶化是通过分子内外氢键形成。由于黄原胶自身带较高的电荷量,在低浓度时由于静电排斥作用,分子链与分子链间距离较远,超过了分子外氢键形成的半径;在高浓度时,虽然存在静电排斥作用,但由于分子链的增多,分子链与分子链间距离减小可以形成分子外氢键。而根据实验结果,可以合理推测黄原胶和蛋白纤维形成凝胶是通过氢键和静电效应共同作用的结果,蛋白纤维分子链可以作为黄原胶不同分子链间的桥梁,降低了不同分子链间距离的同时与黄原胶分子链共同形成三维网络结构。

图4 XG凝胶和不同类型XG-Fblg凝胶的表面和截面SEM图
Fig.4 SEM images of the surface and cross-section of XG gels and different types of XG-Fblg gels
注:标尺为100 μm。
2.5 流变和质构实验
流变性能对水凝胶的物理化学稳定性、加工和应用具有重要的影响[18-19],因此对XG凝胶和XG-Fblg复合凝胶的流变性能进行了研究。如图5-a所示,XG凝胶和不同XG-Fblg凝胶的储能模量G′均显著高于损耗模量G″,这表明形成的凝胶结构很稳定。XG-Fblg凝胶的储能模量G′高于XG凝胶,说明XG-Fblg凝胶的凝胶强度高于XG凝胶。随着XG-Fblg凝胶中Fblg含量的增加,储能模量G′和损耗模量G″逐渐增加。在频率为1 Hz的条件下,0.5%XG-1%Fblg的G′和G″分别是1.5%XG凝胶的5.7和6.2倍。显然Fblg和XG可以通过静电络合形成强度更高的凝胶。
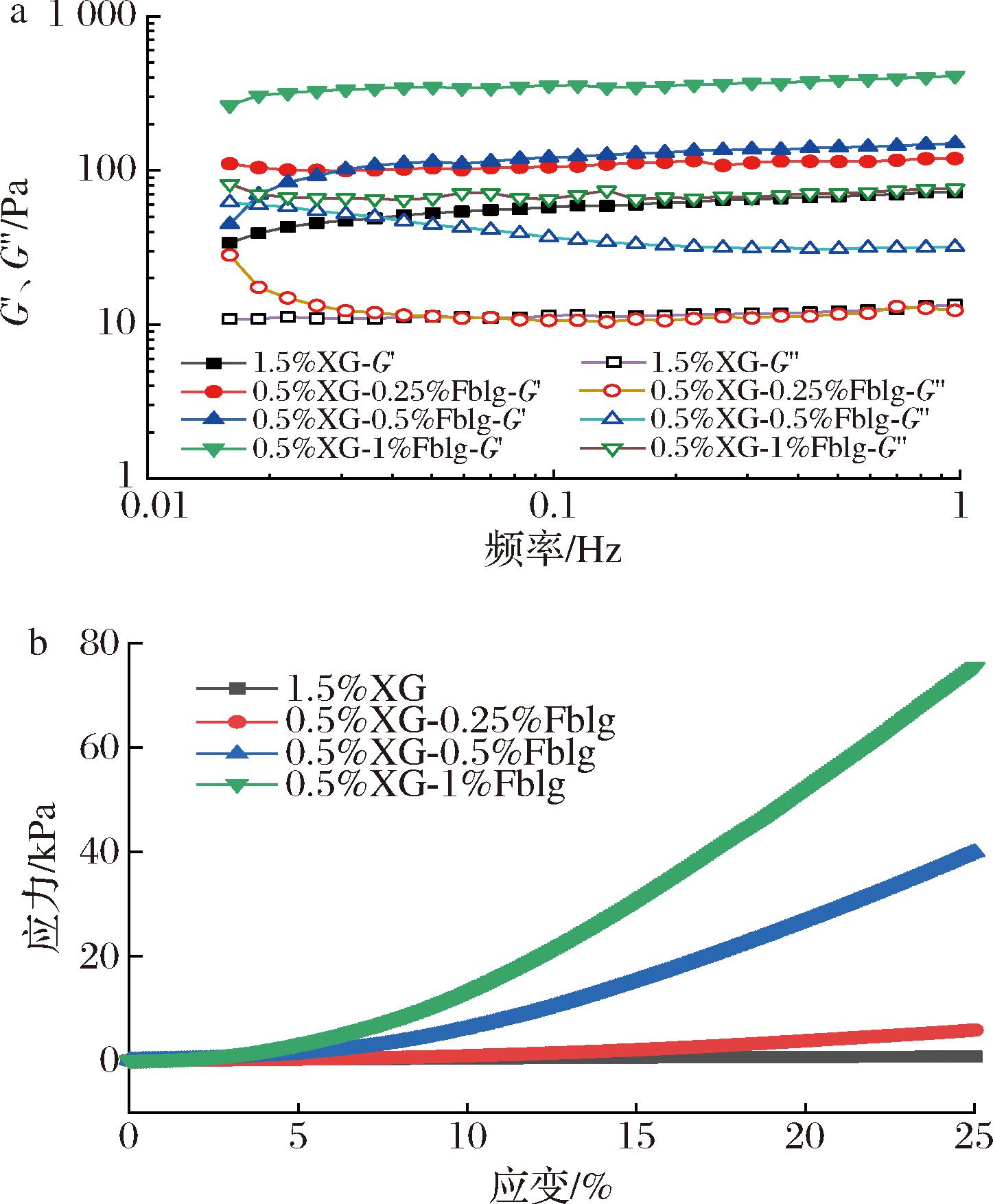
a-流变图;b-质构图
图5 XG凝胶和不同类型XG-Fblg凝胶的流变特性和质构测量
Fig.5 The rheological and texture properties of XG gels and different types of XG-Fblg gels
水凝胶的抗压能力是许多应用的重要特性。优异的抗压能力能避免水凝胶在生理条件下即在机械力(如咀嚼和胃蠕动的动态机械力)存在时凝胶结构不被破坏[17]。XG凝胶和XG-Fblg凝胶的压缩应力-应变曲线如图5-b所示。XG凝胶是通过分子间氢键形成的一种弱凝胶,在压缩实验中表现出较弱的机械强度;相反,XG和Fblg通过静电协同作用形成的凝胶具有较强的机械强度,并随着蛋白纤维含量的增加显著升高。在形变量达到25%时,0.5%XG-1%Fblg凝胶的应力为1.5%XG凝胶的115倍。XG-Fblg凝胶机械强度的增加可能与XG和Fblg之间的络合程度有关,通过前面的浊度实验可知,当XG与Fblg的质量比为1∶2时,XG-Fblg复合物的络合程度最大。这些结果表明蛋白纤维的加入可以和黄原胶形成机械强度和力学性能更好的复合凝胶,并可以通过蛋白纤维的含量进行调控。结合图4,XG-Fblg复合凝胶的机械强度的增强可能是由于凝胶内部的多孔结构的形成。多孔结构的形成增加了凝胶内部的比表面积,比表面积的增加可以使水凝胶承受更强的压缩力[20]。
2.6 姜黄素体外释放性能研究
荷载量是活性物质释放研究的一个重要参数,因为它决定了活性物质的释放快慢以及释放量的理论极限[20]。Cur在不同溶液的溶解程度如图6-a所示,在实验中测得5 g 1.5%XG凝胶、1.5%Fblg和0.5%XG-1%Fblg凝胶中姜黄素的荷载量分别为0.24、0.85和0.75 mg。姜黄素荷载量的增加与蛋白纤维有关,通过观察Fblg-Cur络合物的AFM图片(图6-b),Cur可以通过疏水作用与Fblg表面的疏水基团结合且不影响蛋白纤维的形态。这一结果与HU等[7]的研究一致。

a-Cur在不同溶液离心后的外观;b-Fblg-Cur络合物的AFM图像;c-Cur的释放曲线
图6 Cur在不同溶液离心后的外观图、Fblg-Cur络合物的AFM图像、释放曲线
Fig.6 The appearance of Cur after centrifugation in different solutions, the AFM image of the Fblg-Cur complex, and the release curve
Cur的释放曲线如图6-c所示,在SGF中释放2 h后,XG凝胶、Fblg、XG-Fblg凝胶姜黄素的释放百分比分别约为56.1%、24.7%和9.7%,显然XG-Fblg和Fblg在胃液的低释放率为姜黄素在肠道中进一步释放提供了机会。在SIF作用4 h后,上述复合物的姜黄素累积释放率分别约为74.2%、51.9%、40.8%。这一结果表明,无论是在SGF中还是在SIF中,Fblg溶液和XG-Fblg凝胶中姜黄素的释放速率都是缓慢非爆发性的。需要指出的是,XG-Fblg凝胶降低了胃液中的释放,肠道总释放率也偏低了。但是XG-Fblg凝胶相比于Fblg溶液可以在肠道释放更多的姜黄素(XG-Fblg凝胶和Fblg溶液在模拟肠道的释放量分别为31.1%和27.2%)。XG-Fblg凝胶更适合作为姜黄素的胃肠道递送载体。姜黄素在XG凝胶中的低载药量导致其在短时间内有高累积释放率。释放机制研究对于递送载体的构建以及达到理想的释放速率非常重要。可以通过Korsmeyer-Peppas模型的拟合来分析凝胶的释放机制[22],如公式(1)所示:
Mt/M∞=ktn
(1)
式中:Mt是时间t时释放的 Cur量,M∞是释放的Cur总量,k是释放常数,n是扩散指数(无量纲)。
扩散指数n反映了凝胶的释放机制:n≤0.43 表示 Fick扩散,0.43<n<0.89 表示Fick扩散和凝胶溶蚀共同作用,n≥0.89表示凝胶溶蚀作用。XG凝胶的拟合释放曲线扩散指数n 为0.28,说明Cur在XG凝胶的释放机制为Fick 扩散;Fblg的扩散指数n为0.76,这说明Cur的释放是扩散效应和纤维水解共同作用的效果;XG-Fblg凝胶的扩散指数n为0.92,这表明Cur的释放机制主要为凝胶降解引起。引起XG-Fblg凝胶降解的原因可能有以下几点:首先,模拟胃肠液中蛋白酶的存在可能导致XG-Fblg中Fblg被水解[23];第二,在模拟肠液中环境pH为7.4,这导致了XG和Fblg间的静电作用被破坏。这些因素共同导致了XG-Fblg凝胶的降解。
3 结论与讨论
本研究用XG和Fblg制备了多糖-蛋白纤维复合凝胶,XG-Fblg复合溶液在GDL酸化调控pH为4.0时可以形成稳定的XG-Fblg复合凝胶。XG和Fblg之间的静电相互作用力是XG-Fblg复合凝胶形成的主要驱动力。扫描电子显微镜显示XG-Fblg凝胶形成三维网孔结构并随Fblg的增加而变得更致密。流变和质构测试显示XG-Fblg凝胶的弹性性能和抗压能力随Fblg的含量增加而增强。0.5%XG-1%Fblg复合凝胶的凝胶强度显著高于1.5%XG凝胶。Cur可以通过疏水作用吸附在Fblg分子链上,因此Cur在XG-Fblg凝胶的荷载量明显增加。采用体外胃肠道释放实验研究Cur的释放行为,XG-Fblg凝胶比XG凝胶和Fblg更适合作为Cur肠道递送的载体,在肠道的Cur释放量最多,Cur的释放主要通过凝胶降解控制。本研究结果可为多糖-蛋白纤维复合凝胶的制备以及合理设计水凝胶作为营养物质递送载体提供新的思路。
[1] CAI R, PAN S Y, LI R X, et al.Curcumin loading and colon release of pectin gel beads:Effect of different de-esterification method[J].Food Chemistry, 2022, 389:133130.
[2] SAVIC GAJIC I M, SAVIC I M, SKRBA M, et al.Food additive based on the encapsulated pot marigold (Calendula officinalis L.) flowers extract in calcium alginate microparticles[J].Journal of Food Processing and Preservation, 2022, 46(10):e15792.
[3] WANG Y L, HU J J.Sub-100-micron calcium-alginate microspheres:Preparation by nitrogen flow focusing, dependence of spherical shape on gas streams and a drug carrier using acetaminophen as a model drug[J].Carbohydrate Polymers, 2021, 269:118262.
[4] AHMADY A R, RAZMJOOEE K, NAZAR V, et al.Alginate carrier as a controlled thymol delivery system:Effect of particle size[J].Materials Chemistry and Physics, 2023, 294:126982.
[5] KHALESI H, LU W, NISHINARI K, et al.Fundamentals of composites containing fibrous materials and hydrogels:A review on design and development for food applications[J].Food Chemistry, 2021, 364:130329.
[6] VAN DOORN J M, LAGESCHAAR L, SPRAKEL J, et al.Criticality and mechanical enhancement in composite fiber networks[J].Physical Review. E, 2017, 95:042503.
[7] HU Y, HE C X, JIANG C J, et al.Complexation with whey protein fibrils and chitosan:A potential vehicle for curcumin with improved aqueous dispersion stability and enhanced antioxidant activity[J].Food Hydrocolloids, 2020, 104:105729.
[8] NSENGIYUMVA M E, ALEXANDRIDIS P.Xanthan gum in aqueous solutions:Fundamentals and applications[J].International Journal of Biological Macromolecules, 2022, 216:583-604.
[9] JANSENS K J A, ROMBOUTS I, GROOTAERT C, et al.Rational design of amyloid-like fibrillary structures for tailoring food protein techno-functionality and their potential health implications[J].Comprehensive Reviews in Food Science and Food Safety, 2019, 18(1):84-105.[10] ADAMCIK J, BERQUAND A, MEZZENGA R.Single-step direct measurement of amyloid fibrils stiffness by peak force quantitative nanomechanical atomic force microscopy[J].Applied Physics Letters, 2011, 98(19):193701.
[11] PENG S F, LI Z L, ZOU L Q, et al.Enhancement of curcumin bioavailability by encapsulation in sophorolipid-coated nanoparticles:An in vitro and in vivo study[J].Journal of Agricultural and Food Chemistry, 2018, 66(6):1488-1497.
[12] ZHENG B J, PENG S F, ZHANG X Y, et al.Impact of delivery system type on curcumin bioaccessibility:Comparison of curcumin-loaded nanoemulsions with commercial curcumin supplements[J].Journal of Agricultural and Food Chemistry, 2018, 66(41):10816-10826.
[13] SHEN Y, POSAVEC L, BOLISETTY S, et al.Amyloid fibril systems reduce, stabilize and deliver bioavailable nanosized iron[J].Nature Nanotechnology, 2017, 12(7):642-647.
[14] MOHAMMADIAN M, SALAMI M, MOMEN S M, et al.Enhancing the aqueous solubility of curcumin at acidic condition through the complexation with whey protein nanofibrils[J].Food Hydrocolloids, 2019, 87:902-914.
[15] 胡静. 蛋白质聚集状态影响蛋白质/多糖静电复合及其食品功能特性研究[D].武汉:湖北工业大学, 2019.HU J.Effects of Protein assemblies on protein/polysaccharide electrostatic complexation and its functional properties[D].Wuhan:Hubei University of Technology, 2019.
[16] F RT
RT N B, YENIPAZAR H, SAYGÜN A, et al.Encapsulation of chia seed oil with curcumin and investigation of release behaivour &antioxidant properties of microcapsules during in vitro digestion studies[J].LWT-Food Science and Technology, 2020, 134:109947.
N B, YENIPAZAR H, SAYGÜN A, et al.Encapsulation of chia seed oil with curcumin and investigation of release behaivour &antioxidant properties of microcapsules during in vitro digestion studies[J].LWT-Food Science and Technology, 2020, 134:109947.
[17] RU Q M, WANG Y W, LEE J, et al.Turbidity and rheological properties of bovine serum albumin/pectin coacervates:Effect of salt concentration and initial protein/polysaccharide ratio[J].Carbohydrate Polymers, 2012, 88(3):838-846.
[18] WU B C, MCCLEMENTS D J.Functional hydrogel microspheres:Parameters affecting electrostatic assembly of biopolymer particles fabricated from gelatin and pectin[J].Food Research International, 2015, 72:231-240.
[19] LIPAROTI S, SPERANZA V, MARRA F.Alginate hydrogel:The influence of the hardening on the rheological behaviour[J].Journal of the Mechanical Behavior of Biomedical Materials, 2021, 116(3):104341.
[20] BIAN H Y, WEI L Q, LIN C X, et al.Lignin-containing cellulose nanofibril-reinforced polyvinyl alcohol hydrogels[J].ACS Sustainable Chemistry &Engineering, 2018,6(4):4821-4828.
[21] AGARWAL T, NARAYANA S N G H, PAL K, et al.Calcium alginate-carboxymethyl cellulose beads for colon-targeted drug delivery[J].International Journal of Biological Macromolecules, 2015, 75:409-417.
[22] YANG C, WANG Y X, CHEN L Y.Fabrication, characterization and controlled release properties of oat protein gels with percolating structure induced by cold gelation[J].Food Hydrocolloids, 2017, 62:21-34.
[23] WEI Z H, CHEN Y S, WIJAYA W, et al.Hydrogels assembled from ovotransferrin fibrils and xanthan gum as dihydromyricetin delivery vehicles[J].Food &Function, 2020, 11(2):1478-1488.