麦醇溶蛋白(gliadin, Gli)属于脯胺类型的蛋白质,是一种生物聚合物,其特点是可用性强,可生物降解性强,成本低[1-2]。Gli天然易溶于乙醇不溶于水,因此麦醇溶蛋白纳米颗粒(gliadin nanoparticles, GNPs)可以通过纳米沉淀(反溶剂沉淀)技术得到[3-4],将Gli在乙醇溶液中溶解[5],在持续搅拌下加入非溶剂(比如水)会使得蛋白以纳米颗粒形式析出[5],随后使用旋转蒸发仪去除乙醇。GNPs特别适合用于口服载体体系[6]。研究人员对GNPs载体包埋亲脂性成分咔唑的药代动力学进行研究,表明了GNPs可使咔唑的生物利用度提高40%以上[7]。在另一项研究中,研究人员发现经口服的GNPs中有72%的蛋白颗粒与胃黏膜有很强的黏附性,与样品制备过程中添加的营养成分质量相比,在胃黏膜中滞留的营养成分超过60%[8]。
虽然旋转蒸发仪可以有效去除乙醇得到GNPs,但这种方法会使纳米系统的粒径显著增加[9-10],影响纳米系统的稳定性。研究者发现添加表面活性剂可以消除这种现象,还可以通过静电或空间斥力促进纳米系统稳定[6]。多糖作为一种天然食品材料,具有良好的乳化特性,在食品行业被广泛应用[11-16]。WU等[17]研究发现,使纳米系统的pH接近蛋白质的等电点(isoelectric point, pI=6.5),由于纳米颗粒之间极其微弱的静电斥力[18],这一范围通常会导致纳米颗粒广泛聚集,使用阿拉伯胶稳定GNPs后,纳米系统表现出显著的盐离子浓度和温度稳定性[17]。
本研究采用Gli和银耳多糖(Tremella fuciformis polysaccharides, TFPs),通过反溶剂沉淀法形成麦醇溶蛋白-银耳多糖复合载体颗粒(gliadin-Tremella fuciformis polysaccharides composite carrier nanoparticles, G/T NPs),比较TFPs添加量对GNPs在不同pH、不同温度下的稳定性的影响,并通过傅里叶变换红外吸收光谱和热场发射扫描电镜对G/T NPs的相互作用及微观结构进行分析,为醇溶蛋白和水溶性多糖在复合载体方面的应用提供了理论依据。
1 材料与方法
1.1 材料与试剂
麦醇溶蛋白,上海源叶生物科技有限公司;银耳多糖(质量分数70%),西安圣青生物科技有限公司;无水乙醇,上海泰坦科技股份有限公司;氢氧化钠、盐酸,上海凌峰化学试剂有限公司。
1.2 仪器与设备
PSH-2F pH计,上海欧史拓尔实业有限公司;ZEN3600纳米粒度仪,英国Malvern公司;85-2恒温磁力搅拌器,上海司乐仪器有限公司;H1650离心机,湘仪离心机仪器有限公司;BSA224S电子分析天平,上海舜宇恒平科学仪器有限公司;Nicolet iS10 Thermo傅里叶变换红外光谱仪,苏州安原仪器有限公司;日立SU5000热场发射扫描电镜,上海维翰光电科技有限公司。
1.3 实验方法
1.3.1 G/T NPs溶液的制备和表征
1.3.1.1 Gli乙醇溶液和TFPs水溶液的制备
将5.0 g Gli加入100 mL 70%(体积分数)乙醇溶液中,室温(25 ℃),500 r/min磁搅拌至完全溶解,得到质量浓度为50 mg/mL的Gli乙醇溶液。TFPs原液分别为1.0、2.5、5.0、10.0 mg/mL。TFPs原液以500 r/min和70 ℃磁搅拌1 h,并在4 ℃水化过夜。然后用1 mol/L HCl或1 mol/L NaOH调整溶液的pH值至4.0[19]。
1.3.1.2 G/T NPs溶液的制备
根据之前的一项研究[20],制备了G/T NPs。将10 mL Gli乙醇溶液滴加入50 mL TFPs原液(或50 mL pH为4的去离子水)中,500 r/min持续搅拌30 min。在55 ℃水浴和-0.1 MPa下旋转蒸发除去乙醇,得到粗溶液。用离心机将粗溶液以5 000 r/min离心,弃去沉淀。用1 mol/L HCl或1 mol/L NaOH调节溶液pH为4,得到GNPs、G/T10∶1 NPs、G/T4∶1 NPs、G/T2∶1 NPs和G/T1∶1 NPs溶液。
1.3.2 G/T NPs的红外光谱分析
将G/T NPs放置在真空冷冻干燥机中在-80 ℃下进行冷冻干燥48 h。冻干后的样品用于傅里叶变换红外光谱仪检测分析。测定GNPs和G/T NPs的红外光谱图。光谱记录范围为600~4 000 cm-1。
1.3.3 G/T NPs粒度和电位测定
GNPs、G/T10∶1 NPs、G/T4∶1 NPs、G/T2∶1 NPs和G/T1∶1 NPs溶液的平均粒径、多分散指数(polydispersity index, PDI)和ζ-电位,使用ZEN3600纳米粒度仪测定。在测量之前,将分散液稀释至合适的浓度,稀释液pH值为4。重复测定3次。
1.3.4 G/T NPs的稳定性分析
1.3.4.1 贮藏稳定性
为了考察G/T NPs的贮藏稳定性,将新鲜制备的G/T NPs置于4 ℃下贮存30 d,观察在0、3、6、12、18、24、30 d时乳液的平均粒径和电位变化,每个样品测定3次。
1.3.4.2 pH稳定性
首先制备1 mol/L的NaOH溶液和1 mol/L的HCl溶液。随后用pH计将G/T NPs溶液的pH分别调节至3、4、5、6、7、8、9,在室温下静置30 min,弃去沉淀,测定不同pH环境下G/T NPs的平均粒径、PDI和ζ-电位,每个样品重复测定3次。
1.3.4.3 复溶稳定性
将新鲜制备的样品放置在-80 ℃的真空冷冻干燥机中,48 h后取出样品,将样品溶解于pH为4的去离子水中,测定冻干后复溶的样品的平均粒径、PDI和ζ-电位,每个样品测定3次以减小误差。
1.3.5 G/T NPs微观结构观察
将G/T NPs样品放置在真空冷冻干燥机中在-80 ℃下进行冷冻干燥48 h。在铜片上贴好导电胶,用镊子将冻干后的样品固定在导电胶上,喷金后使用热场发射扫描电子显微镜观察G/T NPs的形貌,并对其进行形貌分析。
1.4 数据处理
实验数据为平行3次测定所得的平均值,通过SPSS软件进行显著性分析,P<0.05表示显著,P>0.05表示不显著。
2 结果与分析
2.1 G/T NPs的直观图
从G/T NPs的直观图(图1)可以看出,多糖的添加量对载体颗粒溶液的表观状态没有明显影响。

a-GNPs溶液样品图;b-G/T10∶1 NPs溶液样品图;c-G/T4∶1 NPs溶液样品图;d-G/T2∶1 NPs溶液样品图;e-G/T1∶1 NPs溶液样品图
图1 G/T NPs溶液的样品图
Fig.1 The visual observation of G/T NPs solution
2.2 G/T NPs的粒径和电位分析
在对G/T NPs溶液的评价中,粒径的分析尤为必要。表1显示了不同TFPs添加量下的G/T NPs的平均粒径和PDI。可以看出,TFPs溶液的平均粒径为(864.0±10.9) nm,PDI为0.747±0.013,粒径分布不均匀。在pH为4的条件下,GNPs平均粒径为(252.4±9.5) nm,PDI为0.495±0.002,添加TFPs之后,G/T10∶1 NPs和G/T4∶1 NPs溶液的粒径与GNPs相比显著降低,这是由于银耳多糖作为一种表面活性剂,通过静电或空间斥力减少了GNPs在旋转蒸发过程中的团聚[6],从而得到粒径更小,分布更集中的G/T10∶1 NPs和G/T4∶1 NPs溶液。而G/T2∶1 NPs和G/T1∶1 NPs溶液的粒径显著增加,推测可能原因是TFPs过饱和,导致G/T NPs之间粘连和GNPs被多层TFPs包裹,进而导致粒径增加。由此可以得出,TFPs的添加可以在一定程度上减小GNPs的平均粒径,也可以使得溶液中粒径分布更均匀。而在G/T2∶1 NPs和G/T1∶1 NPs的复合载体溶液中虽然粒径有所增大,但溶液中颗粒的粒径小于500 nm,PDI也小于0.5,可以看出溶液是稳定的。
表1 TFPs对G/T NPs的平均粒径、PDI和ζ-电位的影响
Table 1 Effect of TFPs on Z-Average, PDI, and ζ- potential of G/T NPs
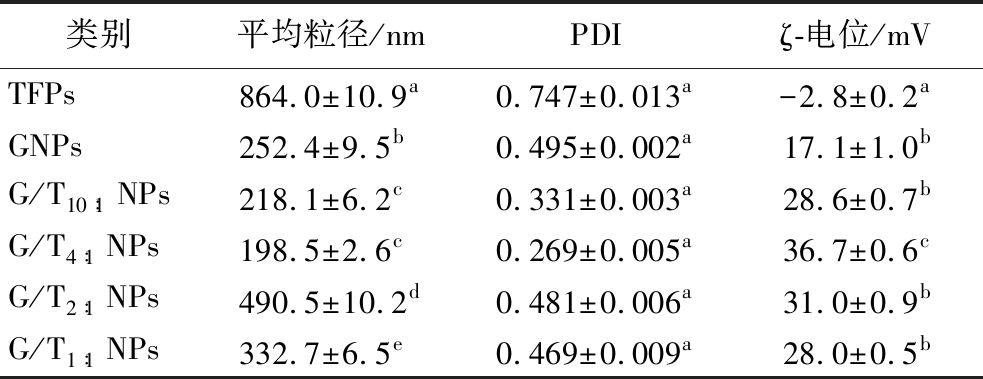
注:同列不同小写字母表示同列之间的差异具有统计学意义(P<0.05)。
类别平均粒径/nmPDIζ-电位/mVTFPs864.0±10.9a0.747±0.013a-2.8±0.2aGNPs252.4±9.5b0.495±0.002a17.1±1.0bG/T10∶1 NPs218.1±6.2c0.331±0.003a28.6±0.7bG/T4∶1 NPs198.5±2.6c0.269±0.005a36.7±0.6cG/T2∶1 NPs490.5±10.2d0.481±0.006a31.0±0.9bG/T1∶1 NPs332.7±6.5e0.469±0.009a28.0±0.5b
ζ-电位是粒子表面电荷的表面电位,可以反映粒子在液体中的稳定性。ζ-电位的绝对值越高,粒子之间的静电斥力越大,粒子越稳定;相反,如果ζ-电位的绝对值越小,粒子之间的静电斥力越小,粒子越容易发生聚集,溶液越不稳定。并且从表1可以看出,TFPs 的ζ-电位为(-2.8±0.2) mV,GNPs的ζ-电位为(17.1±1.0) mV。由于蛋白质和多糖在溶液中主要以带电分子的形式存在,在大多数情况下,蛋白质-多糖的非共价相互作用是由静电相互作用引起的[21]。当带有相反电荷的蛋白质和多糖分子之间存在相对较强的吸引力时,两者之间通过静电络合形成可溶性复合物并形成均相[22]。TFPs和GNPs表面所带的电荷相反,通过静电相互作用形成可溶性复合物形成均相。G/T10∶1 NPs、G/T4∶1 NPs、G/T2∶1 NPs、G/T1∶1 NPs的ζ-电位分别为(28.6±0.7)、(36.7±0.6)、(31.0±0.9)、(28.0±0.5) mV。添加TFPs后,溶液中粒子的ζ-电位显著增高,特别是G/T4∶1 NPs溶液,ζ-电位显著高于其他组,表明在pH为4的环境中G/T NPs溶液增强了GNPs颗粒之间的静电斥力,提高了溶液的稳定性,且G/T4∶1 NPs溶液粒子间的静电斥力更强,溶液状态也更稳定。
2.3 G/T NPs的稳定性分析
2.3.1 G/T NPs的贮藏稳定性分析
为了研究G/T NPs的贮藏期,将新鲜制备的G/T NPs放在4 ℃冷藏环境中,在0、3、6、12、18、24、30 d时使用纳米粒度仪测定G/T NPs溶液的粒径和电位变化。由图2-a可以看出,在贮藏3 d内,G/T NPs的粒径保持在600 nm以下,而在3 d之后G/T2∶1 NPs和G/T1∶1 NPs粒径超过600 nm,溶液不稳定,G/T NPs在不同pH下的PDI变化图(图2-b)中,同样可以看出在第6天时G/T2∶1 NPs和G/T1∶1 NPs溶液的PDI超过0.6,乳液状态不稳定,颗粒发生聚集。GNPs在30 d内溶液一直保持稳定状态,粒径在400 nm以下,PDI低于0.7,且在30 d的贮藏时间内,G/T10∶1 NPs和G/T4∶1 NPs溶液的ζ-电位一直高于GNPs溶液。这一结果表明,G/T10∶1 NPs和G/T4∶1 NPs在一定程度上增强了GNPs的ζ-电位,使得颗粒之间的静电斥力增强,从而增强了GNPs的稳定性。

a-G/T NPs的平均粒径;b-G/T NPs的PDI;c-G/T NPs的ζ-电位
图2 G/T NPs溶液的贮存时间稳定性
Fig.2 The stability of G/T NPs solution over storage time
2.3.2 G/T NPs在不同pH环境下的稳定性分析
由于在大多数情况下,蛋白-多糖之间的非共价结合是通过静电作用实现的,这就表明了蛋白和多糖分子的表面电位对蛋白-多糖的结合起到很大作用,而pH对分子表面电位的影响很大,所以在G/T NPs溶液的稳定性分析中,pH稳定性尤为重要,如图3所示。当溶液的pH<4时,GNPs的表面电荷为正,TFPs的表面电荷为负,二者通过静电作用可以很好地结合,由图3-d也可以看出,pH为3和4时,溶液没有出现浑浊。而当溶液的酸碱度逐渐接近Gli的等电点(pI=6.5)时,溶液中颗粒的ζ-电荷逐渐接近于0 mV(图3-c),静电斥力消失,开始发生团聚、絮凝和沉淀,溶液中粒径的PDI增大(图3-b)。随着pH继续增加,与TFPs之间的结合被打破,在pH为7时,载体颗粒的粒径表现出GNPs和TFPs的粒径值(图3-a),溶液中的大颗粒出现聚集进而形成沉淀而被弃去,因此溶液中颗粒的PDI降低(图3-b)。由图3-d可以看出,G/T NPs溶液pH>6时,溶液出现明显浑浊,而GNPs溶液在pH为5时溶液的稳定状态就已经被打破。静置30 min之后,在pH为7的条件下,GNPs溶液中大颗粒聚集形成沉淀被去除,而G/T NPs溶液出现浑浊,但沉淀现象不明显。当溶液处于pH>7的碱性条件下,GNPs溶液出现大量颗粒聚集现象,溶液浑浊,并且在30 min内,没有完全沉淀,G/T NPs溶液也出现了明显浑浊,但没有沉淀出现。这一结果表明了TFPs提高了GNPs在水溶液中的溶解性,且G/T NPs具有很好的pH响应性。
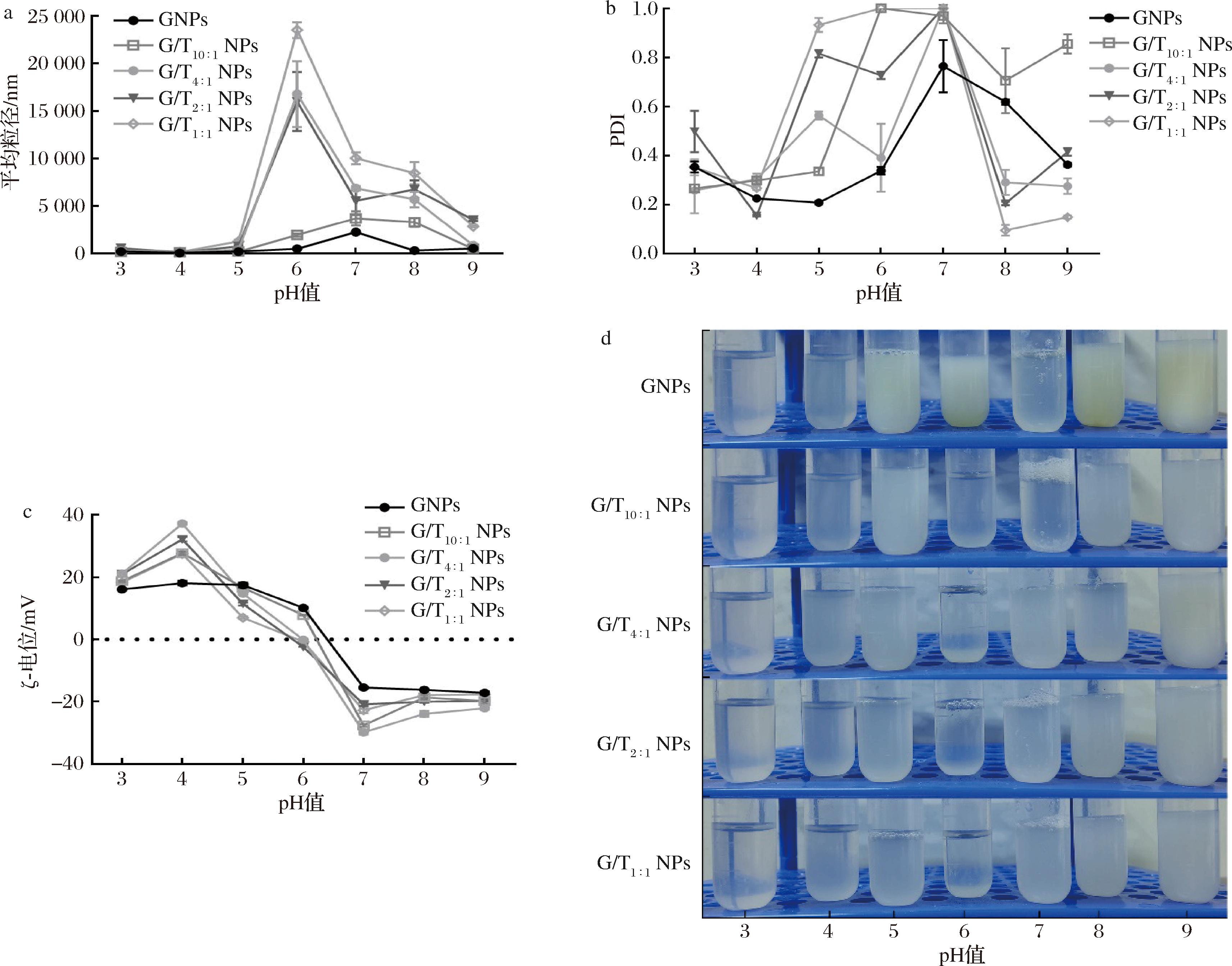
a-pH对G/T NPs溶液粒径的影响;b-pH对G/T NPs溶液PDI的影响;c-pH对G/T NPs溶液ζ-电位的影响;d-pH对G/T NPs溶液影响的直观图
图3 pH对G/T NPs溶液的影响
Fig.3 Effect of pH on G/T NPs solutions
2.3.3 G/T NPs的复溶稳定性分析
为了探究G/T NPs冻干后的复溶性,将新鲜制备的G/T NPs放在-80 ℃的真空冷冻干燥机中冷冻干燥48 h,取出后,将冻干后的样品重新溶解于pH为4的去离子水中,用纳米粒度仪测定复溶后样品溶液的粒径,PDI和ζ-电位的变化。
由图4-a可以看出,GNPs颗粒冻干后复溶的颗粒粒径显著增大,PDI和ζ-电位冻干前后略有差异,但不显著;G/T10∶1 NPs溶液冻干后复溶的载体颗粒粒径显著减小,但PDI和ζ-电位的差异不显著;G/T4∶1 NPs的粒径,PDI和ζ-电位冻干前和复溶后的差异不大;G/T2∶1 NPs和冻干后复溶的载体颗粒粒径显著增大,同时,PDI也增大且差异显著,而ζ-电位的变化差异不显著;G/T1∶1 NPs溶液在冻干后复溶粒径减小,ζ-电位也显著增大,乳液的稳定性增强,但同时PDI也有显著变大,这可能是因为多糖的添加量比较大,在复溶时,部分载体颗粒表面附着的多糖分子之间出现粘连,使得粒径分布不均匀,PDI增大。结果表明,TFPs对GNPs的复溶稳定性有很大影响,TFPs的添加可以减少冻干复溶对GNPs的影响,尤其是G/T4∶1 NPs溶液,冻干前和复溶后的颗粒在粒径、PDI和ζ-电位的评价水平上均没有显著变化。
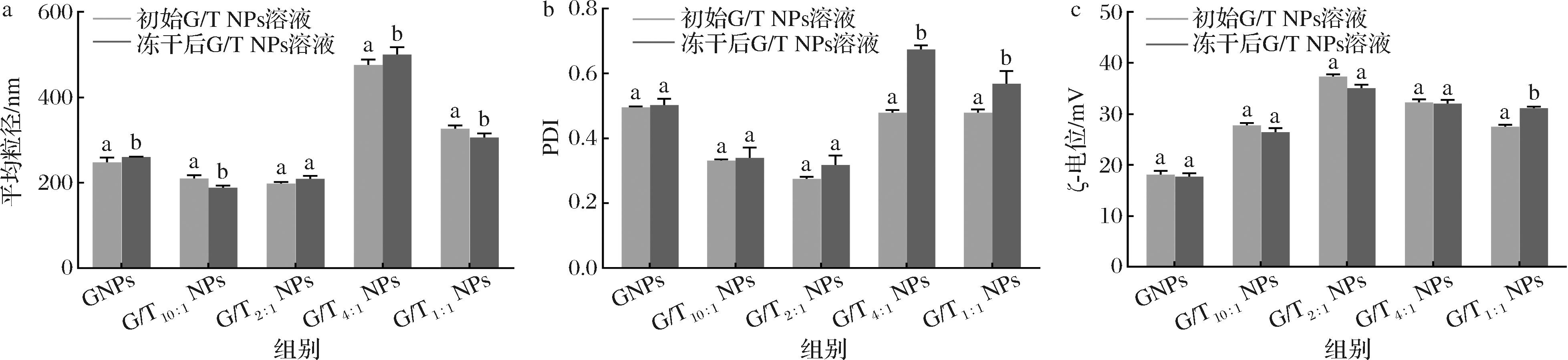
a-冻干后复溶对G/T NPs平均粒径的影响;b-冻干后复溶对G/T NPs PDI的影响;c-冻干后复溶对G/T NPs ζ-电位的影响
图4 冻干后复溶对G/T NPs稳定性的影响
Fig.4 Effect of resolution after lyophilization on the stability of G/T NPs
注:同组不同小写表示差异显著(P<0.05)。
2.4 G/T NPs的红外光谱分析
为了进一步探究Gli和TFPs分子之间的作用力,采用红外光谱对Gli与TFPs的相互作用进行了表征。图5为TFPs、GNPs、G/T10∶1 NPs、G/T4∶1 NPs、G/T2∶1 NPs和G/T1∶1 NPs的红外光谱图。在红外吸收光谱中,3 700~3 000 cm-1的宽峰表明氢键相互作用。GNPs的氢键带位于3 265.5 cm-1。添加TFPs后,G/T10∶1 NPs、G/T4∶1 NPs、G/T2∶1 NPs和G/T1∶1 NPs的光谱峰分别移至3 271.4、3 283.0、3 283.0、3 283.0 cm-1。氢键的形成主要是与蛋白质中的谷氨酰胺基团和多糖中的羟基基团有关,氢键带由3 265.5 cm-1变为3 283.0 cm-1,表明TFPs与Gli之间可能形成了较强的氢键。酰胺键峰值区域为1 700~1 600 cm-1。如图5所示,GNPs的酰胺峰与G/T10∶1 NPs、G/T4∶1 NPs、G/T2∶1 NPs、G/T1∶1 NPs之间存在一定差异,这说明Gli与TFPs之间存在静电相互作用。这与2.2节中ζ-电位的结果分析一致,在pH为4的溶液环境下GNPs的ζ-电位为正,而TFPs的ζ-电位为负,Gli和TFPs分子之间在pH为4的溶液环境中存在静电相互作用,而且ζ-电位随着多糖的加入而发生显著变化。因此,G/T NPs的形成应该是氢键相互作用和静电相互作用的结果。
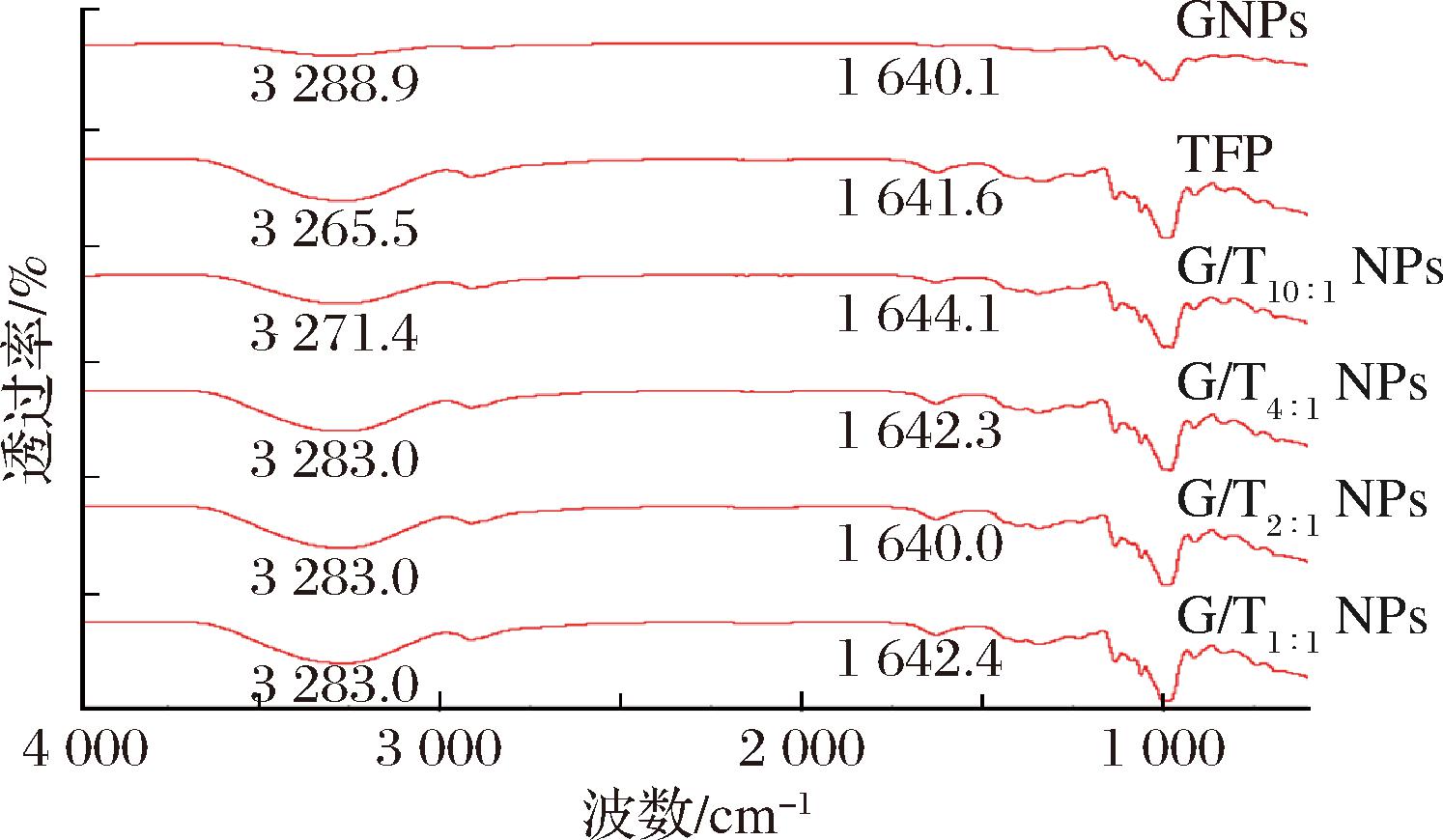
图5 G/T NPs的红外吸收光谱图
Fig.5 Infrared absorption spectrum of G/T NPs
2.5 G/T NPs的热场发射扫描电镜图分析
为了更好地观察G/T NPs的微观结构,将新鲜制备的样品在-80 ℃的真空冷冻干燥机中冷冻干燥48 h,之后取出样品。在铜片上贴好导电胶,用镊子将冻干后的样品固定在导电胶上,喷金后使用热场发射扫描电子显微镜观察G/T NPs的形貌,并对其进行形貌分析。图6-a~图6-d分别为TFPs,GNPs,G/T2∶1 NPs和G/T1∶1 NPs的热场发射扫描电镜图。由图6-a可以看出,TFPs是片状结构的多糖,不存在颗粒结构;图6-b中GNPs颗粒结构非常清晰明显;从G/T2∶1 NPs的扫描电镜图可以看出,GNPs被TFPs的片状结构包裹形成复合载体颗粒;当TFPs和Gli达到1∶1时,TFPs完全将GNPs包裹,而且颗粒与颗粒之间通过多糖的结构发生粘连,因此在粒径上表现为粒径增大,PDI增大。因此推测G/T NPs是TFPs附着在GNPs表面的结构,其内部是由Gli疏水基团组成的疏水内核,为G/T NPs在疏水营养成分的包埋和递送上的应用提供了一种新的可能性。

a-TFPs扫描电镜图;b-GNPs扫描电镜图;c-G/T2∶1 NPs扫描电镜图;d-G/T1∶1 NPs扫描电镜图
图6 G/T NPs的热场发射扫描电镜图
Fig.6 Thermal field emission scanning electron microscopy of G/T NPs
3 结论
本研究利用Gli和TFPs研究醇溶蛋白与水溶性多糖在水相中的相互作用,制备出一种新型的复合载体颗粒。通过对GNPs,G/T10∶1 NPs,G/T4∶1 NPs,G/T2∶1 NPs,G/T1∶1 NPs的贮藏稳定性、pH稳定性、冻干复溶稳定性等的研究探讨了TFPs对G/T NPs的影响。用傅里叶红外光谱仪对复合载体之间的作用力进行分析,以及使用热场发射扫描电镜对G/T NPs的微观结构进行观察。结果表明:在pH为4的水环境中,TFPs和Gli分子通过氢键相互作用和静电相互作用结合形成G/T NPs;与GNPs相比,G/T NPs在粒径、ζ-电位以及稳定性方面都有很好的提高,特别是G/T4∶1 NPs,粒径为(198.5±2.6) nm,PDI<0.3,ζ-电位为(36.7±0.6) mV。在进行pH稳定性分析时发现G/T NPs具有pH响应性,酸性环境中,G/T NPs更稳定,当溶液的酸碱度逐渐接近Gli的等电点时,载体颗粒之间发生团聚,粒径增大,ζ-电位接近于0,溶液变浑浊。且由热场发射扫描电镜分析结果推测G/T NPs是TFPs附着在GNPs周围的复合颗粒结构,其内部是由Gli的疏水基团组成的疏水内核,在运载疏水食品营养成分上应用可能会更有优势,研究结果为后续构建疏水的食品营养成分的包埋和运载体系奠定了基础。
[1] CASTRO-ENR QUEZ D, RODR
QUEZ D, RODR GUEZ-FÉLIX F, RAM
GUEZ-FÉLIX F, RAM REZ-WONG B, et al.Preparation, characterization and release of urea from wheat gluten electrospun membranes[J].Materials, 2012, 5(12):2903-2916.
REZ-WONG B, et al.Preparation, characterization and release of urea from wheat gluten electrospun membranes[J].Materials, 2012, 5(12):2903-2916.
[2] CHEN L H, REDDY N, WU X Y, et al.Thermoplastic films from wheat proteins[J].Industrial Crops and Products, 2012, 35(1):70-76.
[3] MILADI K, SFAR S, FESSI H, et al.Nanoprecipitation Process:From Particle Preparation to In Vivo Applications[M].Cham:Springer,2016:17-53.
[4] SADEGHI R, MEHRYAR L, KARIMI M, et al.Nanocapsule Formation by Individual Biopolymer Nanoparticles[M].Amsterdem:Elsevier,2017:404-446.
[5] FATHI M, DONSI F, MCCLEMENTS D J.Protein-based delivery systems for the nanoencapsulation of food ingredients[J].Comprehensive Reviews in Food Science and Food Safety, 2018, 17(4):920-936.
[6] VOCI S, FRESTA M, COSCO D.Gliadins as versatile biomaterials for drug delivery applications[J].Journal of Controlled Release, 2021, 329:385-400.
[7] ARANGOA M A, CAMPANERO M A, RENEDO M J, et al.Gliadin nanoparticles as carriers for the oral administration of lipophilic drugs.Relationships between bioadhesion and pharmacokinetics[J].Pharmaceutical Research, 2001, 18(11):1521-1527.
[8] UMAMAHESHWARI R B, RAMTEKE S, JAIN N K.Anti-Helicobacter pylori effect of mucoadhesive nanoparticles bearing amoxicillin in experimental gerbils model[J].AAPS PharmSciTech, 2004, 5(2):1-9.
[9] DUCLAIROIR C, NAKACHE E, MARCHAIS H, et al.Formation of gliadin nanoparticles:Influence of the solubility parameter of the protein solvent[J].Colloid and Polymer Science, 2014, 276(4):321-327.[10] KEUM C G, NOH Y W, BAEK J S, et al.Practical preparation procedures for docetaxel-loaded nanoparticles using polylactic acid-co-glycolic acid[J].International Journal of Nanomedicine, 2011, 6:2225-2234.
[11] 章智. 3种提取方法对重瓣栀子花果胶结构、流变和乳化性质的影响研究[D].杭州:浙江农林大学, 2022.ZHANG Z.The research of the influence of three extraction methods on the structural, rheological and emulsifying characterization of pectins from Gardenia jasminodes var.fortuniana[D].Hangzhou:Zhejiang A&F University, 2022.
[12] 缪雨雁, 曹燕, 立静芝, 等.不同黏度多糖阿拉伯胶和瓜尔胶对肌原纤维蛋白乳化性质的影响[J].食品科学, 2023, 44(6):57-64.MIAO Y Y, CAO Y, LI J Z, et al.Effects of arabic gum and guar guam, polysaccharides with different viscosity, on the emulsifying properties of myofibrillar protein[J].Food Science, 2023, 44(6):57-64.
[13] 吴星会, 夏明杰, 杨立娜.膜分离大豆皮多糖的乳化特性[C].中国食品科学技术学会第十九届年会论文摘要集.北京:中国食品科学技术学会, 2022.WU X H, XIA M J, YANG L N.The emulsifying properties of soybean peel polysaccharides by membrane separation[C].Abstracts of the 19th annual conference of Chinese Institute of Food Science and Technology.Beijing:Chinese Institute of Food Science and Technology, 2022.
[14] 李让, 翁翔, 李泉晓, 等.栽培一枝蒿粗多糖混合口蹄疫疫苗乳化方法及稳定性分析[J].畜牧兽医学报, 2023, 54(4):1608-1615.LI R, WENG X, LI Q X, et al.Analysis of emulsifying method and stability of foot-and-mouth disease vaccine combined with crude polysaccharide from cultivated Artemisia rupestris L.[J].Acta Veterinaria et Zootechnica Sinica, 2023, 54(4):1608-1615.
[15] 王君文. 银耳多糖为乳化剂的槲皮素微乳制备及固化研究[D].上海:上海海洋大学, 2021.WANG J W.Study on preparation and solidification of quercetin microemulsion with Tremella polysaccharide as emulsifier[D].Shanghai:Shanghai Ocean University, 2021.
[16] 王君文, 尹启蒙, 李学艳, 等.银耳多糖为乳化剂制备槲皮素微乳研究[J].中草药, 2021, 52(2):378-385.WNAG J W, YIN Q M, LI X Y,et al.Preparation of quercetin microemulsion with Tremella fuciformis polysaccharide as emulsifier[J].Chinese Traditional and Herbal Drugs, 2021, 52(2):378-385.
[17] WU W H, KONG X Z, ZHANG C M, et al.Improving the stability of wheat gliadin nanoparticles-Effect of gum arabic addition[J].Food Hydrocolloids, 2018, 80:78-87.
[18] KOGAN M J, L PEZ O, COCERA M, et al.Exploring the interaction of the surfactant N-terminal domain of gamma-Zein with soybean phosphatidylcholine liposomes[J].Biopolymers, 2004, 73(2):258-268.
PEZ O, COCERA M, et al.Exploring the interaction of the surfactant N-terminal domain of gamma-Zein with soybean phosphatidylcholine liposomes[J].Biopolymers, 2004, 73(2):258-268.
[19] LI H, WANG D F, LIU C Z, et al.Fabrication of stable zein nanoparticles coated with soluble soybean polysaccharide for encapsulation of quercetin[J].Food Hydrocolloids, 2019, 87:342-351.
[20] YUE M, HUANG M Y, ZHU Z S, et al.Effect of ultrasound assisted emulsification in the production of Pickering emulsion formulated with chitosan self-assembled particles:Stability, macro, and micro rheological properties[J].LWT, 2022, 154:112595.
[21] GENTILE L.Protein-polysaccharide interactions and aggregates in food formulations[J].Current Opinion in Colloid &Interface Science, 2020, 48:18-27.
[22] MATALANIS A, JONES O G, MCCLEMENTS D J.Structured biopolymer-based delivery systems for encapsulation, protection, and release of lipophilic compounds[J].Food Hydrocolloids, 2011, 25(8):1865-1880.