生物反应器中的搅拌桨对好氧发酵过程具有重要影响,不同搅拌桨组合对反应器中流体流速流向分布、气体分布和剪切速率等有重要影响[1],直接影响发酵生产成本与发酵效率。发酵设备的放大过程一般基于实验室发酵罐数据,以影响发酵过程关键参数为基准[2],确定放大后发酵罐各部分尺寸,这种方式将发酵罐看成一个均匀体系与实际情况存在一定的差异。随着流体力学计算软件的进步和完善[3],通过计算流体动力学(computational fluid dynamics,CFD)模拟发酵罐中流场分布的研究越发成熟。CFD模拟可对发酵过程的优化提供多方面的作用,如优化发酵设备结构,张博等[4]使用欧拉多相流模型对大型发酵罐的气体分布进行了模拟,通过改进搅拌桨结构解决了局部气含率较低的问题,谈亚丽等[5]通过CFD技术优化了50 L生物反应器的气体分布器结构,使发酵液中菌体量提高9.89%;CFD模拟可以为发酵设备放大提供理论模型数据,MORCHAIN等[6]通过模拟实验室用70 L和工业70 m3通风发酵罐,对发酵罐放大设计中吸收速率和生长速率产生的局部不平衡提供了理论依据,NADAL-REY等[7]对3种形式的工业生物反应器进行了模拟,收集了不同体积和操作条件下的流动与混合数据,CAPPELLO等[8]对里氏木霉发酵生产酶的二氧化碳发酵罐放大进行了CFD验证,研究了放大过程对氧气培养基摄取率的影响。
高黏度发酵物料的模拟需要考虑流体黏度对发酵的影响,SHU等[9]对不同发酵阶段的普鲁兰糖发酵液进行模拟,对比了不同黏度下不同搅拌桨的流场,优化了普鲁兰糖的发酵条件,董淑浩等[10]通过CFD模拟不同搅拌桨组合下流动特性,改进威兰胶发酵罐,使威兰胶产量提高了13%,顾小华等[11]通过模拟实验室5 L透明质酸发酵罐并改进了搅拌桨组合,使产品分子质量提高了23.9 %。
透明质酸[12](hyaluronic acid,HA)是葡萄糖醛酸和N-乙酰葡萄糖胺组成的双糖单位糖胺聚糖,其具有良好的保湿性、润滑性和组织相容性被广泛应用于化妆品[13]、保健食品[14]和医药[15-18]领域。近年来,通过兽疫链球菌(Streptococcus equi subsp.Zooepidimicus)[19]发酵生产透明质酸的工艺逐渐成熟[20-22],但发酵罐规模一般在30~50 m3,生产成本相对较高,为了设计更大规模的透明质酸合成生物反应器,本文基于上述CFD技术辅助大型发酵罐的设计,对200 m3透明质酸发酵罐进行设计建模,对不同搅拌器组合下的流场进行模拟,在进行发酵试生产基础上,确定了生产效率较高的搅拌器组合形式,并将其用于指导发酵罐设计。
1 材料与方法
1.1 实验材料
本研究所用CFD计算软件为ANSYS Fluent 2021R1,发酵所用菌株为马疫链球菌兽疫亚种(Streptococcus equi subsp.Zooepidemicus) ATCC 35246。种子培养基(g/L):葡萄糖2,牛肉膏10,聚蛋白胨20,酵母粉5,NaCl 2, Na2HPO4·12H2O 1, KH2PO4 0.12, pH 7.0~7.2。发酵培养基(g/L):葡萄糖40, 聚蛋白胨20, 酵母粉10, MgSO4·7H2O 1, K2HPO4 2.5, NaCl 2, pH 7.0~7.2。本研究使用的透明质酸生产种子罐,发酵罐均在企业现有发酵罐基础上设计改造。
1.2 模型建立与模拟方法
1.2.1 发酵罐结构尺寸与操作条件
如图1所示,本文所选用的生物反应器为200 m3搅拌通风发酵罐,用于大型高黏物料的发酵。为了提高搅拌效果以及延长气体停留时间,一般使用大高径比,因此罐体高径比H/T=3.14,即直径T=4.3 m,高度H=13.5 m,底部为蝶形封头。桨叶共有4层,每层间距C2=2.8 m,底层桨叶离底高度C1=1.5 m,空气分布器离底高度0.3 m。发酵罐装液高度为10.8 m,转速为120 r/min,通气量0.5 vvm。发酵液为8 g/L的透明质酸溶液,密度为1 050 kg/m3。
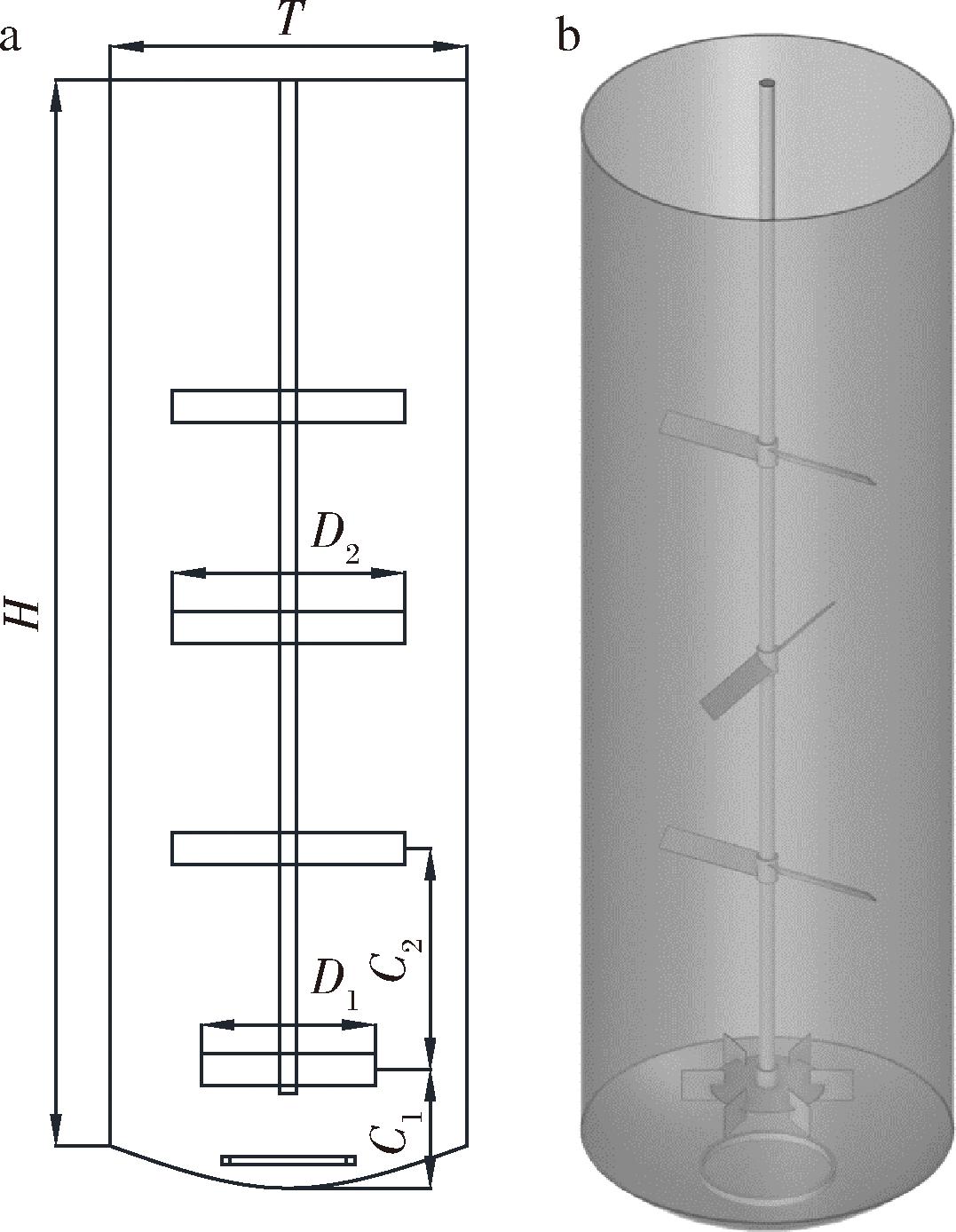
a-发酵罐尺寸图;b-发酵罐结构图
图1 发酵罐结构示意图
Fig.1 Schematic diagram of bioreactor
1.2.2 桨叶组合
发酵罐的桨叶一般为轴流式搅拌桨和径流式搅拌桨组合使用,本文选择了3种桨式搅拌器作为上三层搅拌桨,分别为二斜叶桨式搅拌器(图2-a)、二折叶桨式搅拌器(图2-b)和三折叶桨式搅拌器(图2-c),桨径D2=2T/3;选择六直叶圆盘涡轮搅拌器(图2-d)和六弧叶圆盘涡轮搅拌器(图2-e)作为底层搅拌桨,桨径D1=T/2。
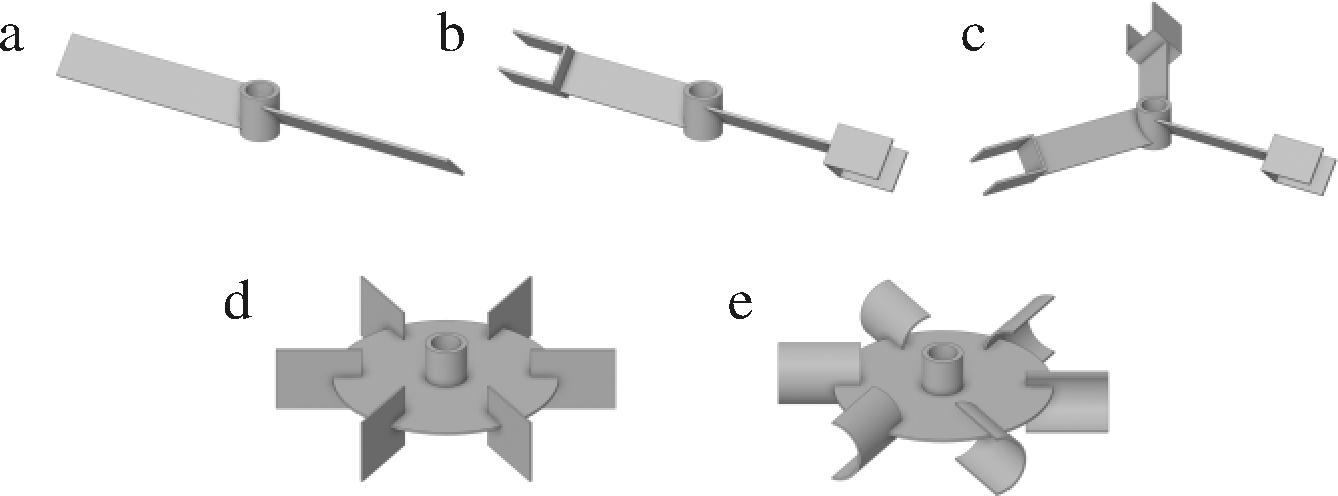
图2 搅拌桨结构示意图
Fig.2 Schematic diagram of impellers
根据所选择搅拌桨类型,使用图3所示组合模拟不同搅拌器对发酵罐内流动情况的影响,组合1:三层斜叶桨式搅拌器+六直叶圆盘涡轮搅拌器;组合2:三层二折叶桨式搅拌器+六直叶圆盘涡轮搅拌器;组合3:三层二折叶桨式搅拌器+六弧叶圆盘涡轮搅拌器;组合4:三层三折叶桨式搅拌器+六弧叶圆盘涡轮搅拌器。

a-组合1;b-组合2;c-组合3;d-组合4
图3 搅拌桨组合
Fig.3 Impeller combinations
1.2.3 网格划分
如图4所示,使用Spaceclaim软件建立发酵罐流体区域模型,流体区域选择液面以下部分,并将流体模型分为搅拌区域和非搅拌区域。将模型导入Ansys meshing选择网格类型为四面体网格,进行网格划分,并对搅拌桨区域进行加密处理,最终网格数为170万。
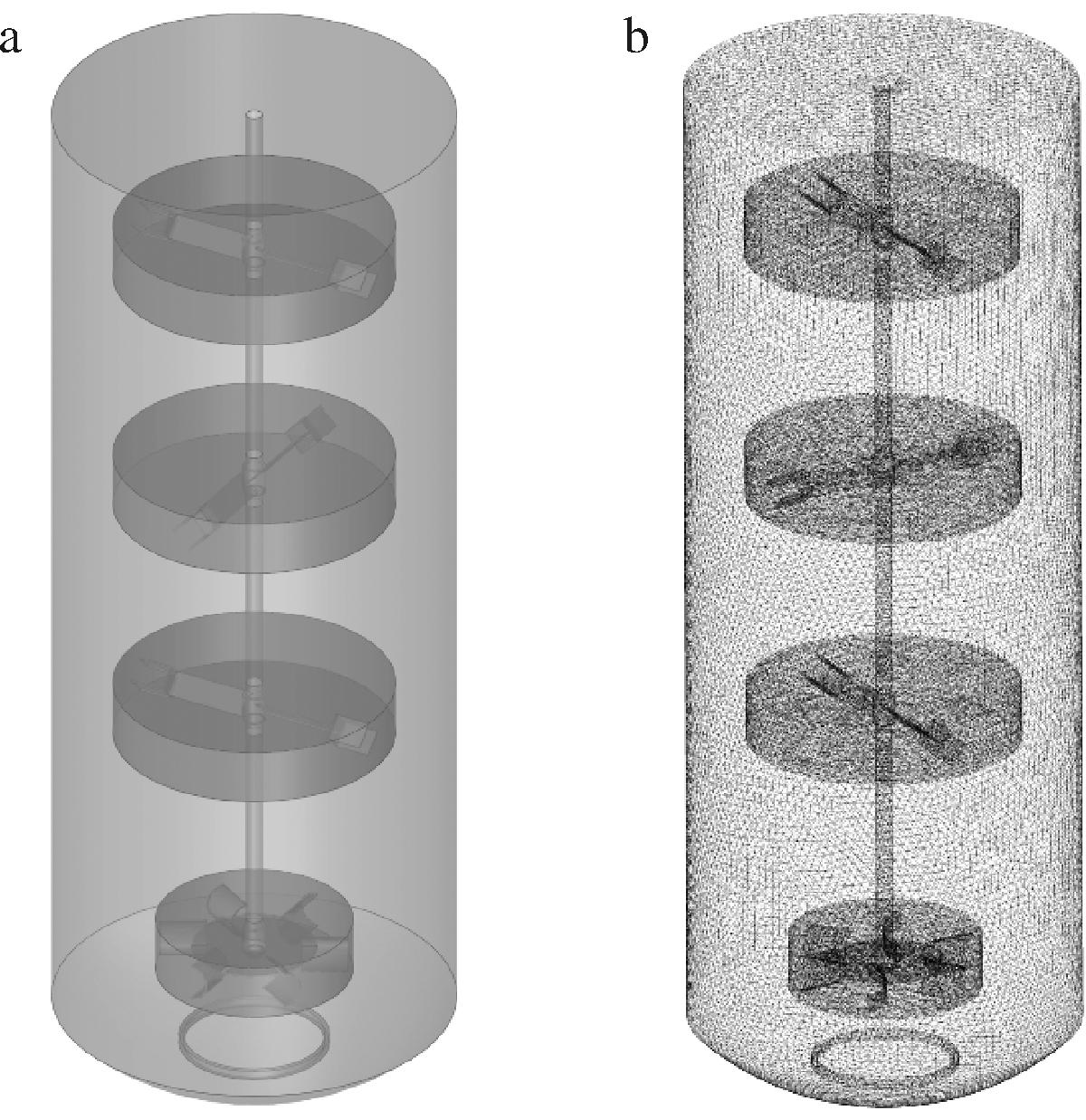
a-流体模型;b-模型网格
图4 流体模型和网格
Fig.4 Fluid flow area model and computational grid
1.2.4 模拟方法
发酵罐流体模型采用稳态计算,考虑重力。流体为透明质酸溶液,设定为非牛顿流体,其表观黏度ma计算如公式(1)所示:
μa=Kγn-1
(1)
式中:K为流体的稠度系数,n为流变系数,γ为剪切速率。湍流模型使用剪切应力输运(SST-k-w)模型。搅拌桨附近区域采用旋转坐标系(MRF),其他区域采用静止坐标系。搅拌桨与罐体壁面均设定为无滑移壁面,差分格式采用二阶迎风格式。
1.3 发酵试生产
通过流场分布,剪切速率和黏度分布选择最佳的桨叶组合,对企业现有一台200 m3黄原胶发酵罐进行改造,使用相同发酵工艺进行试生产,测定不同时间发酵液的OD值和透明质酸含量。
2 结果与分析
2.1 流场分布
如图5所示,发酵罐中流体流动整体呈轴向循环,底部搅拌桨处为径向流,将流场分割为罐底的小循环和上方的大循环,其中组合1、2的底层搅拌桨叶尖处流体流向相比组合3、4较为分散(图5-a),流体在受到叶片作用沿径向向外部流动的同时,受重力与上方轴向搅拌桨产生的向下的轴向流的共同影响使得流动方向向下偏移,组合3、4底部搅拌桨叶片呈半管状,在搅拌时一定程度上对流体流向有约束作用,所以其流动方向更加集中。上三层搅拌桨处均存在一个环形流场(图5-b),其中组合1的叶片平直,在搅拌过程中对流体产生向下的作用力,流体同时受到下压力和离心力,流向向下同时向外,最终与罐壁附近向上的轴向流碰撞,部分流体继续向下流动至下一层搅拌桨,另一部分流体与外侧流体一同向上流动形成桨叶处的环流,由于大部分流体在通过桨叶后产生向外流动的流向,在叶片下方靠近搅拌轴处产生了流动死区。组合2、3、4的叶片末端结构的倾斜方向与内部相反,搅拌过程中对流体产生向上的作用力,同时内侧叶片产生的径向速度较高的流体流向改变为向上,与罐壁附近向上的轴向流汇合,在桨叶上方形成一个大的环流,减少了对外部轴向流的破坏,同时由于流体径向流动减少,桨叶下方的死区减少,同一层搅拌桨叶片间的流体流动状况与叶片处基本相同,组合4的叶片数较多,叶片末端将外部流体吸引,在附近的罐壁处产生了微小的环流(图5-c)。
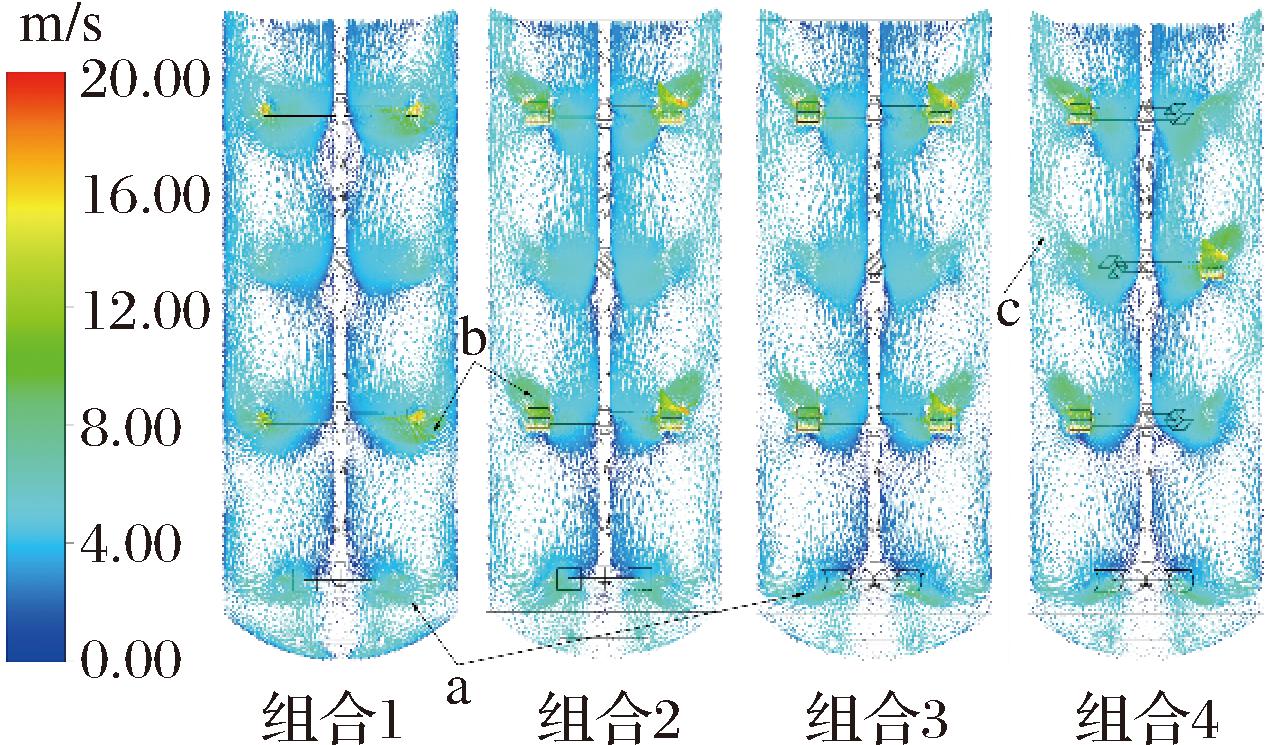
图5 速度矢量图
Fig.5 Vector of velocity magnitude
如图6所示,组合1流速较高的区域集中于叶片下方与叶尖处的圆形范围,由于不同流向的流体碰撞导致距离搅拌桨较远的区域流速降低,搅拌轴附近存在较多的流动死区(图6-a),流体平均流速为3.88 m/s, 组合2流速较高的区域沿叶尖处向外向上延伸,由于流动方向相近,提高了罐壁附近流体的流速,流体平均流速为4.02 m/s。组合4的叶片数更多,平均流速为4.24 m/s。底层搅拌桨对气体分散起到重要作用[23],组合3、4由于其流动方向集中,速度较高的区域更集中向外分布,组合1、2则是呈扇形向外向下分布(图6-b)。
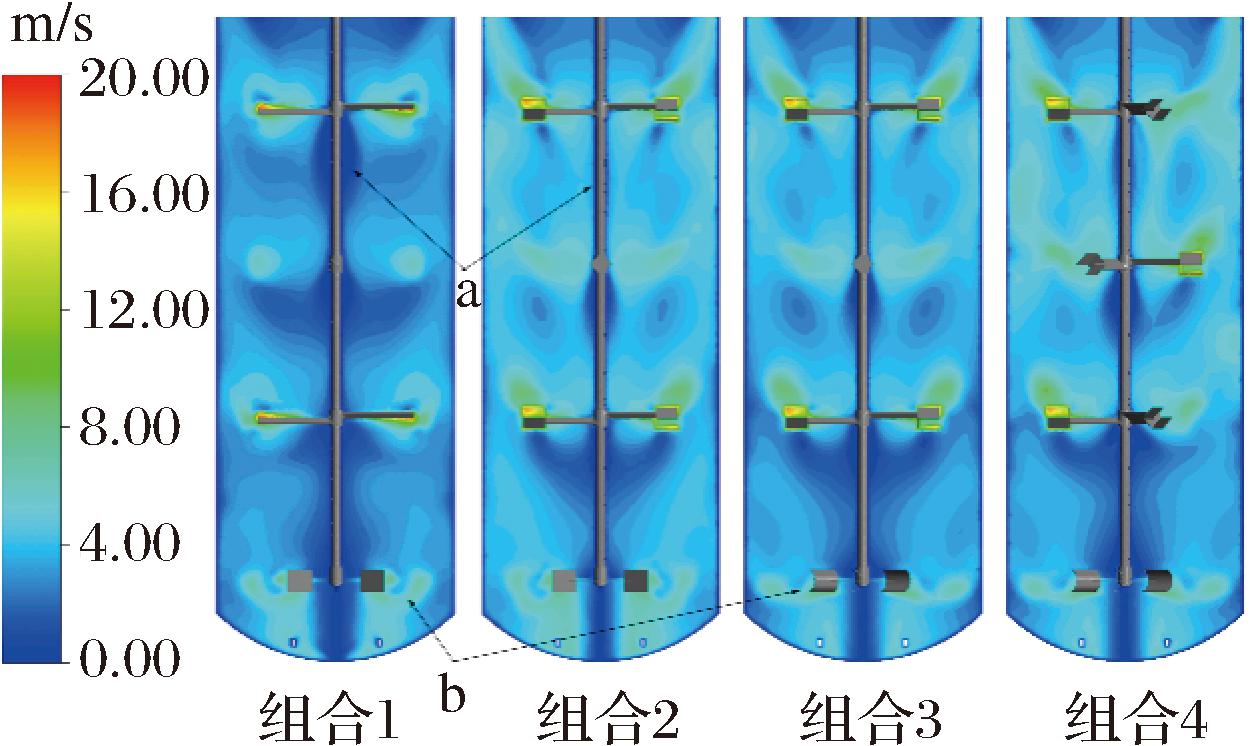
图6 轴向截面的速度分布云图
Fig.6 Contour of velocity magnitude on axial direction
如图7所示,底层搅拌桨在径向上的速度分布趋势基本相同,组合1、2的流速略高于组合3、4,组合3、4流速较高的区域沿叶尖处向外延伸至罐壁,组合1、2在叶尖处存在集中的高速区域(图7-a),这一区域易产生气穴,不利于气体分散。
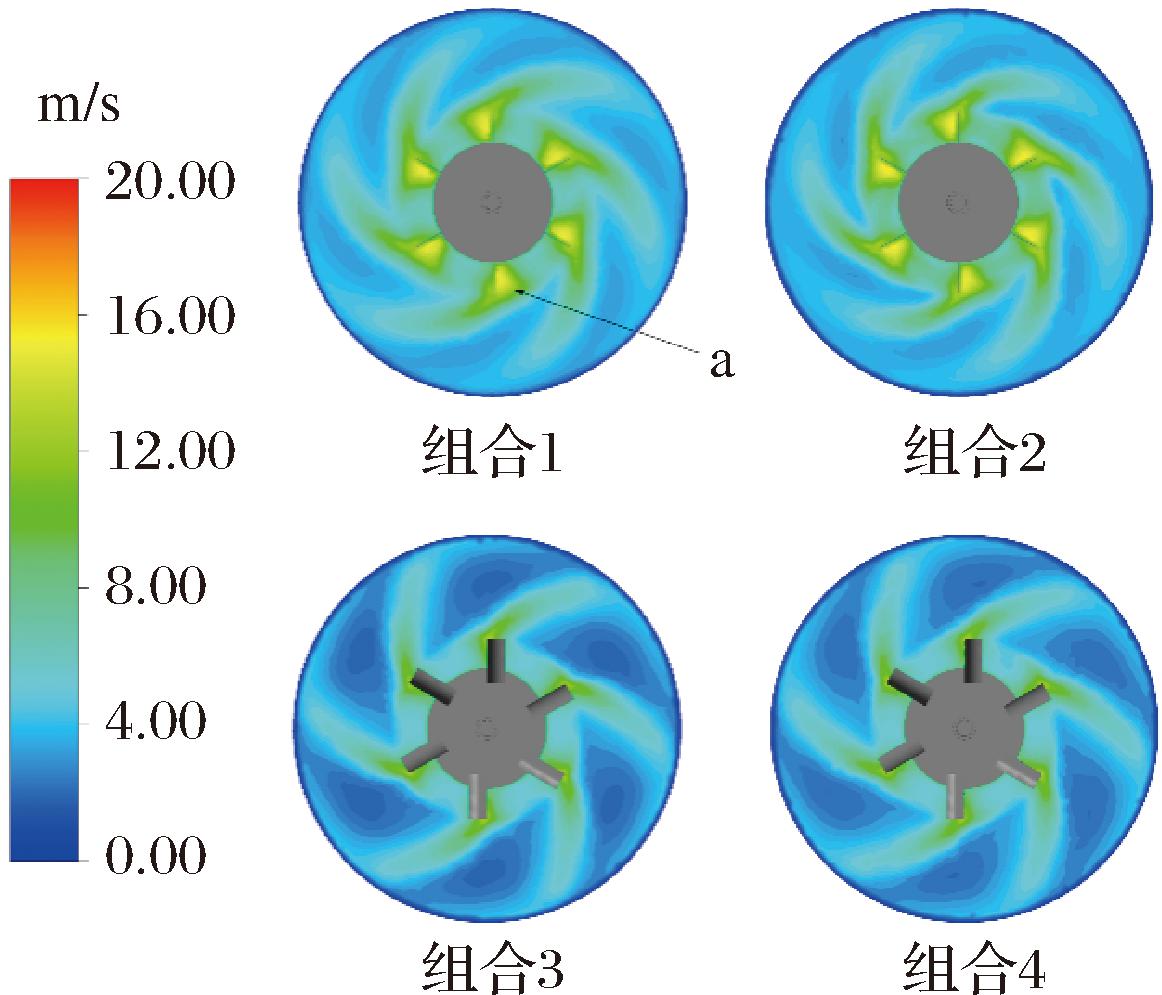
图7 底层搅拌桨处径向截面的速度分布云图
Fig.7 Contour of velocity magnitude on radial direction at bottom impellers
2.2 表观黏度分布
假塑性流体具有剪切稀化的流变学性质,其黏度与流体的剪切速率相关,剪切速率越大,流体黏度越低。如图8所示,流体剪切速率分布于发酵罐各壁面附近,剪切速率较大的区域主要为搅拌桨桨叶附近,其分布与流场中高流速区域分布一致。
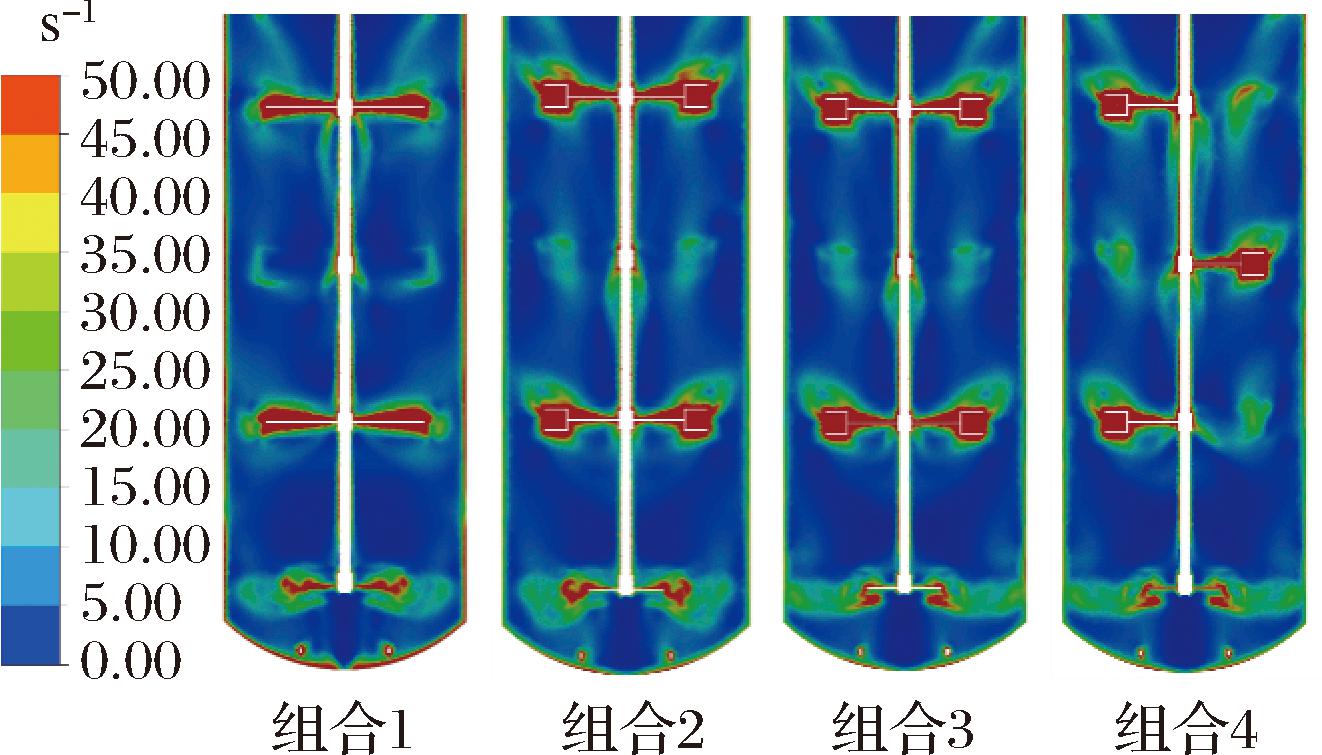
图8 剪切速率云图
Fig.8 Contour of shear strain rate
如图9所示,流体黏度的分布与剪切速率分布正好相反,在剪切速率较高的区域,流体黏度相应降低。组合1的上三层桨叶平直,所产生的速度梯度均匀,剪切作用范围也较小,低黏度区域也较小,组合2、3上三层桨叶使流体产生了不同流向,流动状况更复杂,其作用范围更大,低黏度区域大于组合1(图9-a),组合4叶片数更多,剪切作用范围最大,低黏度区域最大。底桨处与流场分布相对应,组合1、2其剪切作用范围也向外向下发展,组合3、4的剪切作用集中向外发展,流体的低黏度区域直到罐壁处,更有利于气体在此处的破碎分散(图9-b)。
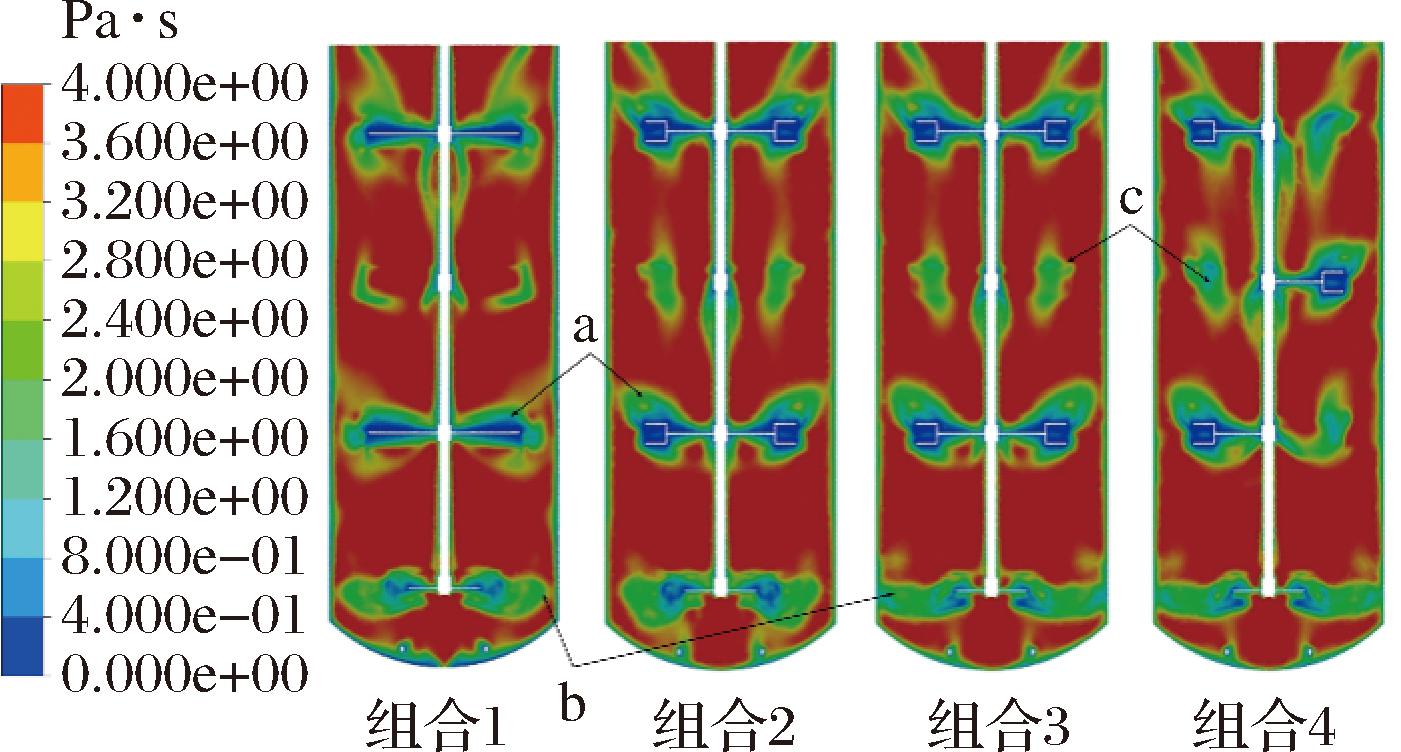
图9 表观黏度云图
Fig.9 Contour of apparent viscosity
2.3 搅拌功率
如表1所示,轴功率与桨叶面积成正比,使用斜叶桨式搅拌器的组合1,上三层搅拌桨功耗最低,组合4桨叶数多,所需功耗最大。使用直叶圆盘涡轮搅拌器的组合1、2底桨功耗大于使用弧叶圆盘涡轮搅拌器的组合3、4。总功耗组合4最大,组合1最小。
表1 搅拌轴功率
Table 1 Stirring power
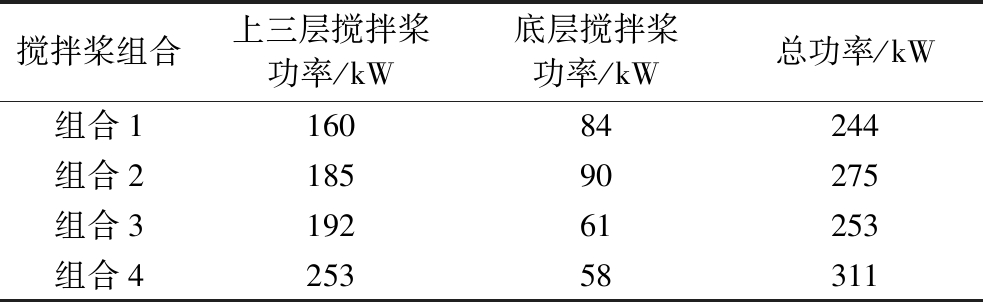
搅拌桨组合上三层搅拌桨功率/kW底层搅拌桨功率/kW总功率/kW组合116084244组合218590275组合319261253组合425358311
2.4 发酵试生产
综合流场和表观黏度分布的模拟结果,使用组合4的桨叶组合对200 m3发酵罐进行改造并进行试生产。如图10所示,经过24 h,发酵液OD值达到33.45,其中8~14 h为对数生长期,透明质酸的含量达到12.53 g/L,产物主要积累时间在12~16 h。
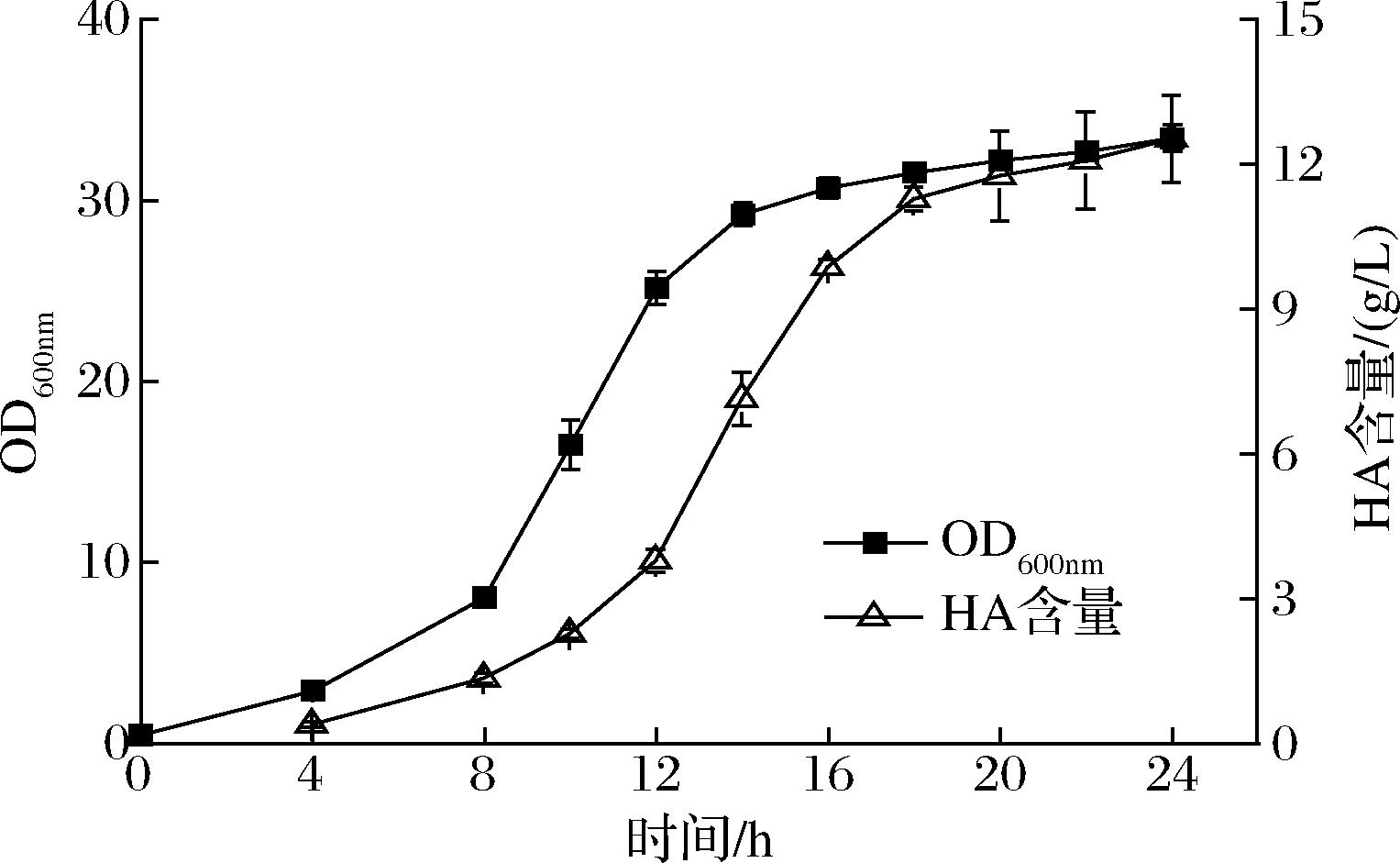
图10 200 m3发酵罐发酵过程曲线
Fig.10 Time courses of fermentation in a 200 m3 bioreactor
3 结论与讨论
本文建立了200 m3透明质酸生物反应器模型,考虑到高黏度流体流动时受剪切作用影响,使用SST-k-w模型代替常用的k-e模型,模拟了不同搅拌组合下发酵罐的流场。在120 r/min的工作条件下,使用三折叶桨式搅拌器作为上三层搅拌桨,流体流速最高,流体黏度降低最大,功耗最高;使用弧叶圆盘涡轮搅拌器作为底层搅拌桨,产生的径向流更加均匀,功耗比直叶圆盘涡轮搅拌器更低。与k-e模型相比,SST-k-w模型对高黏度流体的模拟结果更接近流体的真实流动状况。使用三层三折叶桨式搅拌器+弧叶圆盘涡轮搅拌器组合改造200 m3发酵罐并进行试生产,透明质酸产量达到12.53 g/L,产量达到预期水平。
通过对大型透明质酸生物反应器的模拟,为未来扩大透明质酸生产规模提供了一定的理论基础,同时为高黏度物料发酵的设计提供了思路。气体流动对流场也存在很大的影响,此处应进一步研究,为大型发酵设备的设计提供更完善的理论模型。
[1] KAWASE Y, MOO-YOUNG M.Mixing time in bioreactors[J].Journal of Chemical Technology &Biotechnology, 1989, 44(1):63-75.
[2] GARCIA-OCHOA F, GOMEZ E.Bioreactor scale-up and oxygen transfer rate in microbial processes:An overview[J].Biotechnology Advances, 2009, 27(2):153-176.
[3] 钟英杰, 都晋燕, 张雪梅.CFD技术及在现代工业中的应用[J].浙江工业大学学报, 2003, 31(3):284-289.ZHONG Y J, DU J Y, ZHANG X M.CFD technology and application in modern industry[J].Journal of Zhejiang University of Technology, 2003, 31(3):284-289.
[4] 张博, 于洪杰, 钱才富.大型发酵罐内流场模拟及局部改善[J].化工机械, 2022, 49(6):893-900.ZHANG B, YU H J, QIAN C F. Flow field simulation and local improvement within large fermentation tank[J].Chemical Engineering & Machinery, 2022, 49(6):893-900.
[5] 谈亚丽,李啸,张小龙, 等.基于CFD技术优化50 L发酵罐空气分布器实现马克斯克鲁维酵母高密度发酵[J].食品安全导刊,2021(27):117-120.TAN Y L, LI X, ZHANG X L, et al.Optimization of air distributor in 50 L fermentor based on CFD technology to realize high-density fermentation of Kluyveromyces max[J].China Food Safety Magazine, 2021(27):117-120.
[6] MORCHAIN J, GABELLE J C, COCKX A.A coupled population balance model and CFD approach for the simulation of mixing issues in lab-scale and industrial bioreactors[J].AIChE Journal, 2014, 60(1):27-40.
[7] NADAL-REY G, MCCLURE D D, KAVANAGH J M, et al.Computational fluid dynamics modelling of hydrodynamics, mixing and oxygen transfer in industrial bioreactors with Newtonian broths[J].Biochemical Engineering Journal, 2022, 177:108265.
[8] CAPPELLO V, PLAIS C, VIAL C, et al.Scale-up of aerated bioreactors:CFD validation and application to the enzyme production by Trichoderma reesei[J].Chemical Engineering Science, 2021, 229:116033.
[9] SHU L, YANG M J, ZHAO H, et al.Process optimization in a stirred tank bioreactor based on CFD-Taguchi method:A case study[J].Journal of Cleaner Production, 2019, 230:1074-1084.
[10] 董淑浩, 朱萍, 徐晓滢,等.高粘发酵体系不同搅拌桨的CFD模拟及发酵验证[J].生物工程学报, 2015, 31(7):1099-1107.DONG S H, ZHU P, XU X Y, et al.Computational fluid dynamics simulation of different impeller combinations in high viscosity fermentation and its application[J].Chinese Journal of Biotechnology, 2015, 31(7):1099-1107.
[11] 顾小华, 段须杰, 谭文松,等.采用计算流体力学技术研究搅拌对兽疫链球菌发酵生产透明质酸的影响[J].生物工程学报, 2009, 25(11):1671-1678.GU X H, DUAN X J, TAN W S, et al.Effect of agitation on hyaluronic acid produced by Streptococcus zooepidemicus by using computational fluid dynamics[J].Chinese Journal of Biotechnology, 2009, 25(11):1671-1678.
[12] MEYER K, PALMER J W.The polysaccharide of the vitreous humor[J].Journal of Biological Chemistry, 1934, 107(3):629-634.
[13] JUNCAN A M, MOIS D G, SANTINI A, et al.Advantages of hyaluronic acid and its combination with other bioactive ingredients in cosmeceuticals[J].Molecules, 2021, 26(15):4429.
D G, SANTINI A, et al.Advantages of hyaluronic acid and its combination with other bioactive ingredients in cosmeceuticals[J].Molecules, 2021, 26(15):4429.
[14] 郭学平, 贺艳丽, 孙茂利,等.透明质酸在保健品中的应用[J].中国生化药物杂志, 2002, 22(1):49-51.GUO X P, HE Y L, SUN M L, et al.The application of hyaluronic acid in health care[J].Chinese Journal of Biochemical Pharmaceutics, 2002, 22(1):49-51.
[15] DOVEDYTIS M, LIU Z J, BARTLETT S.Hyaluronic acid and its biomedical applications:A review[J].Engineered Regeneration, 2020, 1:102-113.
[16] TEZEL A, FREDRICKSON G H.The science of hyaluronic acid dermal fillers[J].Journal of Cosmetic and Laser Therapy, 2008, 10(1):35-42.
[17] BARBUCCI R, LAMPONI S, BORZACCHIELLO A, et al.Hyaluronic acid hydrogel in the treatment of osteoarthritis[J].Biomaterials, 2002, 23(23):4503-4513.
[18] MALTESE A, BORZACCHIELLO A, MAYOL L, et al.Novel polysaccharides-based viscoelastic formulations for ophthalmic surgery:Rheological characterization[J].Biomaterials, 2006, 27(29):5134-5142.
[19] FONG CHONG B, NIELSEN L K.Aerobic cultivation of Streptococcus zooepidemicus and the role of NADH oxidase[J].Biochemical Engineering Journal, 2003, 16(2):153-162.
[20] KRAHULEC J, KRAHULCOV J.Increase in hyaluronic acid production by Streptococcus equi subsp.zooepidemicus strain deficient in β-glucuronidase in laboratory conditions[J].Applied Microbiology and Biotechnology, 2006, 71(4):415-422.
J.Increase in hyaluronic acid production by Streptococcus equi subsp.zooepidemicus strain deficient in β-glucuronidase in laboratory conditions[J].Applied Microbiology and Biotechnology, 2006, 71(4):415-422.
[21] LIU L, SUN J, XU W B, et al.Modeling and optimization of microbial hyaluronic acid production by Streptococcus zooepidemicus using radial basis function neural network coupling quantum-behaved particle swarm optimization algorithm[J].Biotechnology Progress, 2009, 25(6):1819-1825.
[22] JOHNS M R, GOH L T, OEGGERLI A.Effect of pH, agitation and aeration on hyaluronic acid production by Streptococcus zooepidemicus[J].Biotechnology Letters, 1994, 16(5):507-512.
[23] LANE G L, SCHWARZ M P, EVANS G M.Numerical modelling of gas-liquid flow in stirred tanks[J].Chemical Engineering Science, 2005, 60(8-9):2203-2214.