水产养殖业作为最重要的农业部门之一,为人类提供了大量的食物资源。然而,大多数水产品易腐烂[1],即使有了较为完善的现代技术,每年仍有超过20%的产量被浪费[2]。因此,开发有效的水产品保鲜技术,对水产养殖业的发展具有关键作用[3-5]。
保鲜包装是水产品贮藏保鲜的重要手段,因其使用简单、成本低廉、效果显著而备受关注。随着人们的环保意识和食品安全意识的提高,使用保鲜效果好、无毒、可降解的复合材料,构建食品贮藏保鲜包装,已成为学者们的研究热点。一些技术成熟的商业高聚物,如聚乙烯(polyethylene, PE)、聚氯乙烯polyvinyl chloride, PVC)、聚砜(polysulfone, PSF)、聚醚砜(polyethersulfone, PES)等,因其性能优异、易于加工改性和具有良好的耐化学耐药性等优点,被广泛地应用于食品保鲜包装[6]。这其中,PES是一种性质优良的特种工程塑料,由于具有π-π共轭体系和砜基形成的刚性结构,而表现出良好的热稳定性和力学性能,常被用于临床血液透析[7]、血浆分离[8]、工业废水处理[9]、油水分离[10]、精炼食用油[11]等领域。
近年来,将银纳米颗粒(silver nanoparticles, AgNPs)引入PES制取抗菌材料已见报道,其产品显示出出色的使用性能和广泛的应用前景[12-14]。然而,目前制取的材料仍存在移植量低、银释放量高、抗菌时间短等缺陷[15-16]。为了解决这些问题,本研究旨在通过磺化将—SO3H基团接枝于PES分子主链,提升材料的亲水性以及表面活性,并将AgNPs引入其中,制取磺化聚醚砜-银纳米颗粒(sulfonated polyethersulfone-silver nanoparticles, SPES-AgNPs)抗菌膜,为对控制食品腐败变质的抑菌保鲜膜的研发提供新思路。结果表明,所制备的SPES-AgNPs膜能够有效解决上述问题,并且具备显著的抗菌以及保鲜性能,在水产品保鲜领域具有良好的应用前景。
1 材料与方法
1.1 材料与试剂
PES(RADEL;A-300),美国Amoco化学公司;硫酸(质量分数98%)、N, N-二甲基甲酰胺(N,N-dimethylformamide, DMF),中国东红化工厂;硝酸银(分析级),中国国家制药集团;微生物琼脂,中国万凯微生物公司;大肠杆菌、铜绿假单胞菌、李斯特菌、小肠结肠炎耶尔森菌、金黄色葡萄球菌,中国广东省细菌采集中心。
1.2 仪器与设备
Vector 33型傅里叶红外光谱仪分析仪,德国Brucker公司;Q500型热重分析仪,美国TA公司;OCA15型接触角测角仪,德国Dataphysics公司;Nova Nano 450型扫描电子显微镜,美国FEI公司;Multimode 8型原子力显微镜,德国Brucker公司;D8 Advance型X射线衍射仪,德国Bruker公司;JPS-9000SX型X射线光电子分光光度计,日本JEOL公司;Z-2000型原子吸收光谱仪,日本Hitachi公司;BCD-235 NCQE型冷冻箱,中国Lejin公司;KDY-9820型氧化镁仪器,中国KDY Co.;ZL-ZT-25型过滤器,中国Zhongli Co.;LC-20AT型高效液相色谱分析仪,日本Shimadzu Co.。
1.3 实验方法
1.3.1 PES的磺化和表征
磺化过程是在专业实验室进行的,并有必要的安全预防措施。10 g PES在120 ℃下干燥过夜,然后浸入200 mL浓硫酸(质量分数98%),磁性搅拌60 ℃。经过一段时间的反应后,将得到的混合物缓慢注入冰水中,获得粗SPES沉淀。用去离子水将沉淀物彻底清洗至pH接近7,在60 ℃的真空下干燥过夜[17]。
通过H+释放量测定所制备SPES材料的离子交换容量(ion exchange capacity, IEC)和磺化度。0.5 g的SPES材料被切碎,加入50 mL 2 mol/L的氯化钠溶液中浸没24 h,然后用以酚酞为指示剂,用0.1 mol/L的氢氧化钠溶液滴定。IEC[18]的计算如公式(1)所示:
(1)
式中:VNaOH和VNaCl分别为使用的氢氧化钠和氯化钠的体积;Wdry为干PES的质量。
所制备的SPES材料的磺化程度(degree of sulfonation, DS)[18]的计算如公式(2)所示:
(2)
式中:M0(232 g/mol)和MSO3 Na(103 g/mol)分别为初始聚合物和—SO3Na基团的摩尔质量。
利用傅里叶红外光谱仪(Fourier transform infrared spectrometer, FTIR)分析仪研究了制备的SPES材料的傅里叶变换红外光谱。测量范围为600~4 000 cm。
使用热重(thermal analysis, TG)分析仪测定了制备的SPES材料的热重性能。温度范围控制为100~700 ℃。
使用接触角(contact angle, CA)测角仪测定了所制备的SPES材料的亲水性,每个膜重复测定3次[19]。
1.3.2 膜的制备与表征
1.3.2.1 膜的制备
将SPES材料溶解在DMF(质量分数15%)中,60 ℃搅拌至完全溶解,4 000 r/min离心3 min,制成铸膜液。然后,在约21 ℃,75%相对湿度条件下,使用刮膜刀将得到的铸膜液在透明玻璃板上涂膜(约40 μm厚度)。将涂好铸膜液的玻璃板浸入21 ℃水浴中24 h,形成膜。得到的膜用乙醇洗涤,在室温(21 ℃)下风干24 h[17]。
制好的SPES膜在2.5 g/L的硝酸银水溶液中浸泡2 h后捞出,去除表面残留的溶剂。然后,将膜在0.25 mol/L的维生素C水溶液中浸泡15 min制取SPES-AgNPs膜,用去离子水洗涤膜,随后在约室温(21 ℃)下风干24 h。
1.3.2.2 膜的微观形态观测
在20 kV和80 mA的条件下,使用扫描电子显微镜(scanning electron microscope, SEM)观察所制备的膜的微观结构。并利用能量色散X射线光谱法(energy dispersive X-ray spectroscopy, EDS)粗略地测定其表面主要元素组成(C、S、O和Ag)[20]。利用原子力显微镜(atomic force microscope, AFM)对制备的膜的表面拓扑结构进行表征[21]。
1.3.2.3 银的释放
使用配备Cu-Ka X射线辐射的XRD仪器记录膜的X射线衍射(X-ray diffraction, XRD)模式[22],验证膜上Ag元素。使用X射线光电子分光光度计(X-ray photoelectron spectrophotometer, XPS)在Mg-Kα辐射源(1 253.6 eV)下进一步分析膜上Ag元素的形态[23]。
通过在过滤试验中测定Ag的浓度来检测其释放量。每个膜(100 cm2)均用于水过滤,在室温下(20 ℃)的通量为100 L/(m2·h)。每隔2 h,从渗透侧获得一些水样,并使用原子吸收光谱仪(atomic absorption spectrometer, AAS)分析其中的银浓度[23]。
1.3.2.4 膜的抗菌性能
使用3种革兰氏阴性菌,即大肠杆菌(Escherichia coli)、小肠结肠炎耶尔森菌(Yersinia enterocolitica)和铜绿假单胞菌(Pseudomonas aeruginosa),以及2种革兰氏阳性菌,即金黄色葡萄球菌(Staphylococcus aureus)和单核球增多性李斯特菌(Listeria monocytogenes)进行抗菌试验。取0.5 g膜材料,浸入10 mL 108 CFU/mL的菌悬液中,在台式浓缩器中振荡,以37 ℃培养2 h。随后,用无菌水将菌悬液稀释至合适的浓度,接种在LB固体培养基上,37 ℃培养24 h。抗菌率的计算如公式(3)所示:
(3)
式中:G为抗菌率;Nm和N0分别为含膜盘和不含膜盘的菌悬液的菌落计数。每个膜重复3次[24-25]。
1.3.3 罗非鱼的贮藏保鲜
1.3.3.1 罗非鱼的处理与贮存
新鲜罗非鱼样品(466±29) g,中国广东省广州联丰水产养殖基地。将其处理并加工成蝴蝶状的鱼片[26],用稀释的氯化钠溶液清洗后分为4组。其中,对照组样本无需额外处理,直接放入冷冻箱中保藏,其余3组分别用SPES-AgNPs膜、SPES和PE膜严密包裹。所有样本均在(1±0.1) ℃的冷冻箱中保存18 d。每隔3 d,从冷冻箱中提取一些样本进行新鲜度分析[27]。每次测量在3个不同的样本中至少重复3次,结果取平均。
1.3.3.2 整体新鲜度评价
感官分析由10名训练有素的实验室工作人员进行评估[28],每组使用3个具有代表性的鱼样本。小组成员使用5分制(0表示彻底无法接受,5表示非常好)对每个样本的颜色、气味、质地、味道、煮汤和一般的可接受性进行盲评。
1.3.3.3 微生物分析
5 g鱼肉与45 mL无菌生理盐水混合均匀。用9 mL无菌生理盐水连续稀释后进行细菌学分析。在15 ℃孵育72 h后,使用1%氯化钠的铁琼脂分散平板上测定菌落总数(total colony count, TCC)。用平板计数琼脂在铺板上测定厌氧菌落总数(total anaerobic bacterial count, TAC)。在7 ℃孵育10 d后,在平板计数琼脂上测定嗜冷菌总数(psychrotrophic count, PC)[29-30]。
1.3.3.4 化学指标分析
挥发性盐基总氮(total volatile basic nitrogen, TVB-N)根据半微量Kjeldahl法进行测定[31]。将10 g 碎肉与50 mL蒸馏水混合,搅拌30 min获得鱼肉匀浆。随后,过滤掉鱼肉残渣获得上清液,并用10%的氧化镁悬浮液碱化。通过氧化镁仪器中的酸接收器将挥发性碱组分吸收,并用0.01 mol/L标准盐酸溶液滴定测定鱼样TVB-N,做3次平行,结果取平均值。
k值的测定参照YANG等[32]的方法,并稍作修改。取2 g碎肉用2 mL 5%高氯酸混匀,以3 600 r/min离心3 min获得上清液,并用0.45 μm膜过滤器进行过滤。将滤液注入配备VP-ODS C18柱(4.6 mm×250 mm,5 μm)的高效液相色谱(high performance liquid chromatography, HPLC)分析仪,并在254 nm处检测其峰值。k值根据ATP关联化合物的总量进行计算。
2 结果与分析
2.1 PES的磺化和表征
PES磺化过程可以看作硫酸基团(—SO3H)取代—H的过程[30]。起初由于有大量的—H取代位点,因此IEC和DS的增长趋势较快(图1)。随着反应时间的延长,大部分—H被取代,因此IES和DS的反应趋势逐渐减慢,并逐渐趋于平衡。因此H+释放量可以衡量SPES材料的离子交换容量。由于DS和IES呈正相关,虽然较高的DS提高了SPES材料的性能,但是较高的DS意味着磺化过程难度更大。此外,当SPES的DS大于0.4时会部分溶解在水中,不利于膜的制备[33]。因此,在性能与成本的综合考虑下,选择DS为0.317的SPES材料作为膜材料。
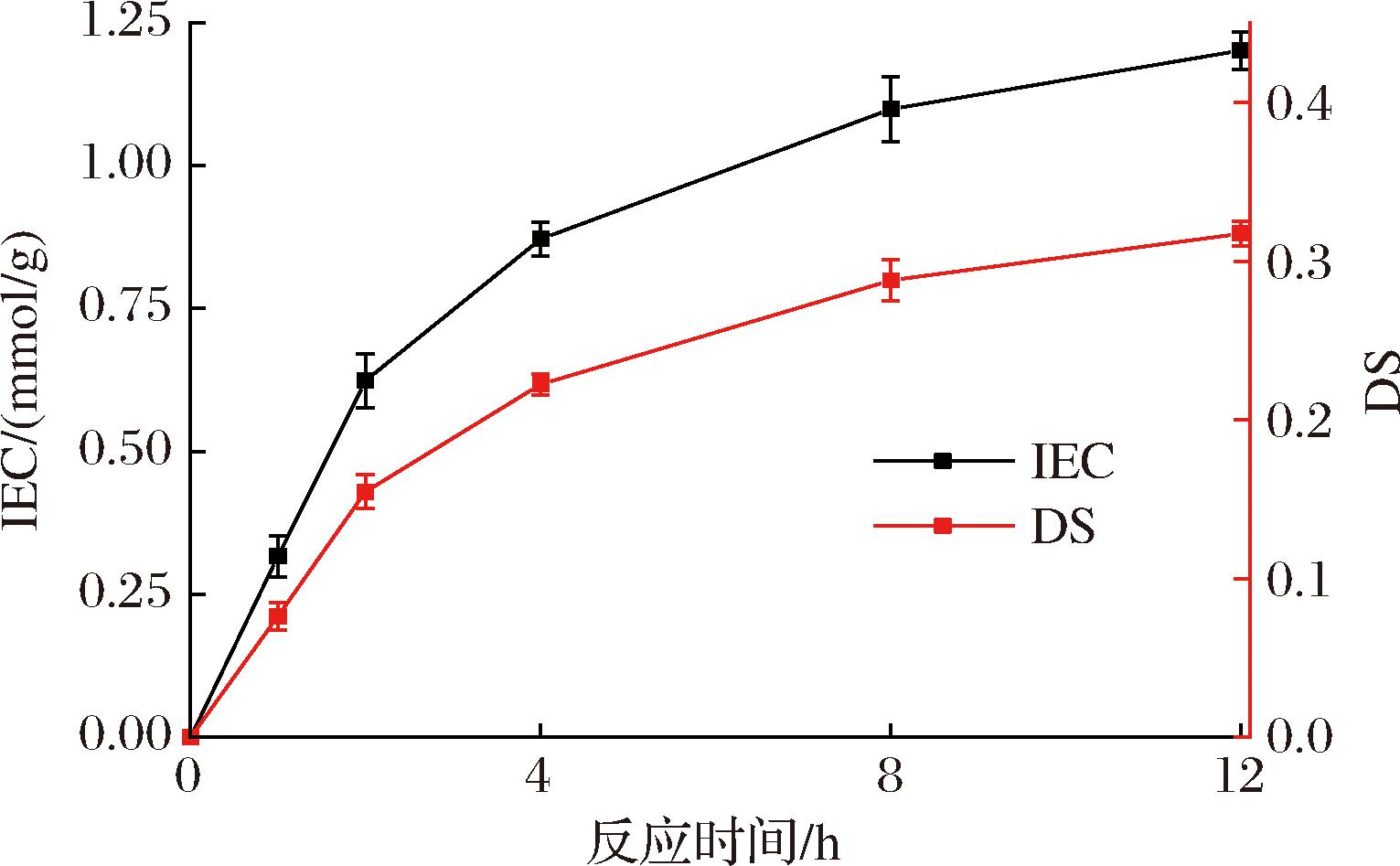
图1 PES的磺化性能IEC和DS
Fig.1 Sulfonation performance IEC and DS of PES
FTIR结果如图2所示。在SPES曲线约1 100 cm-1和3 200 cm-1处分别为—SO3H和—OH的特征吸收峰[34]。其中,—OH的存在是水合作用的标志,进一步表明SPES具有显著的亲水性[34]。此外,由于O原子具有较高的电负性,因此—OH的存在更有利于SPES材料与AgNPs发生聚合,从而提高Ag的移植量。
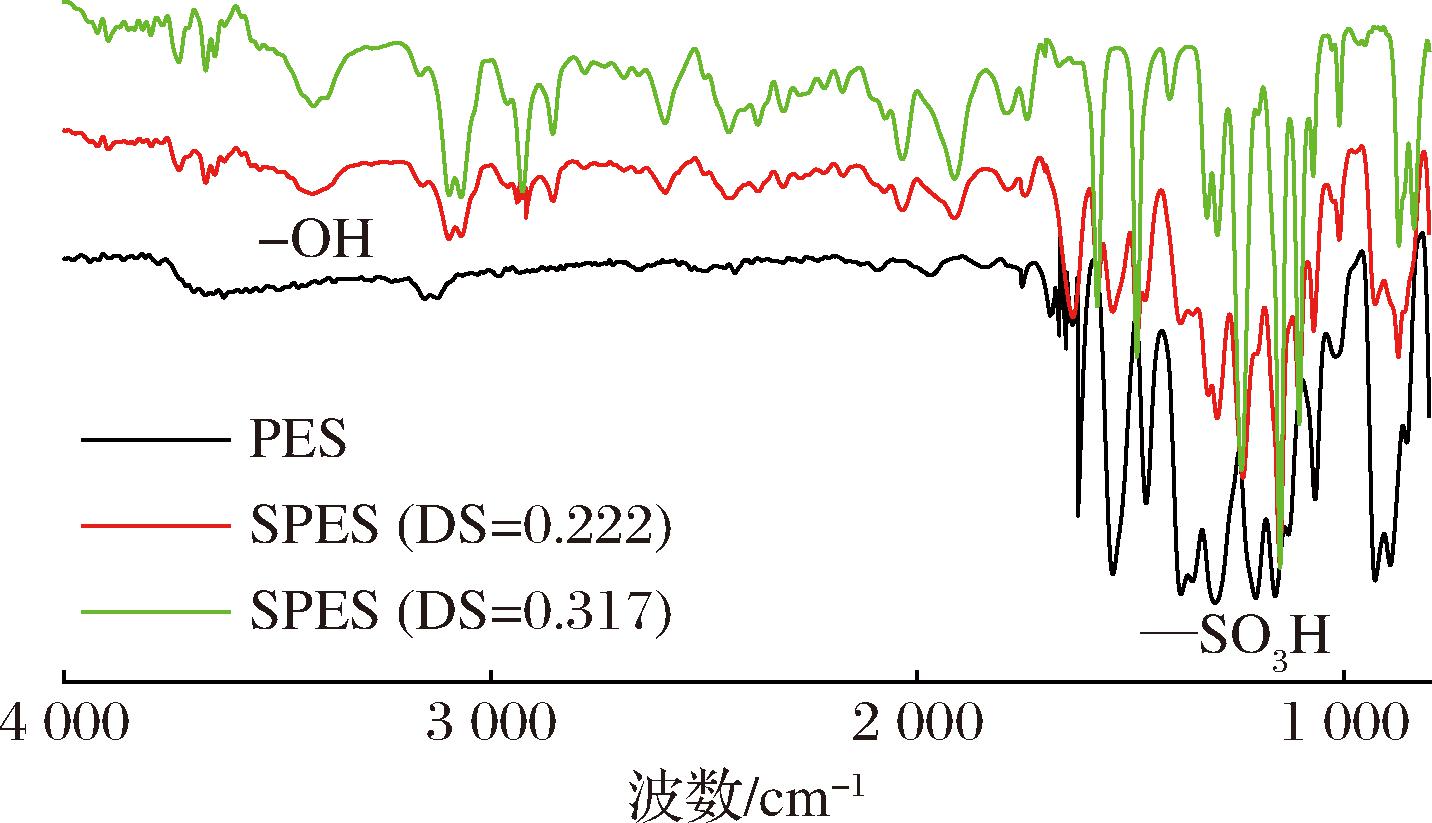
图2 PES和SPES的FTIR光谱
Fig.2 FTIR spectra of PES and SPES
TG结果如图3所示。当温度小于200 ℃时,各材料均无明显失重现象。当温度为200~450 ℃时,由于磺酸基团的分解,SPES材料的质量略有下降[35]。当温度升高到450~600 ℃时,由于形成膜骨架的PES链断裂,因此PES和SPES均明显失重40%~60%。
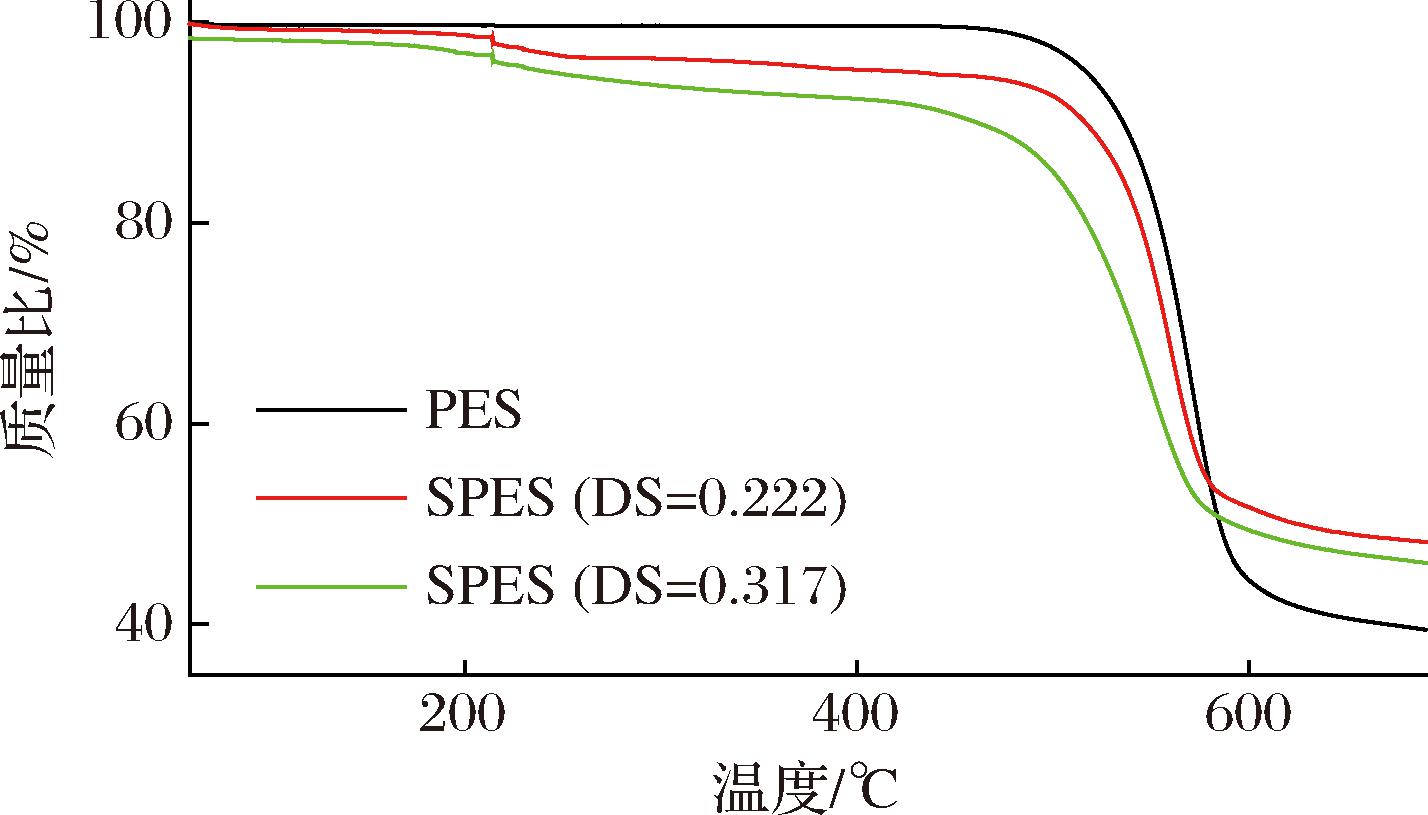
图3 PES和SPES的TG曲线
Fig.3 TG curve of PES and SPES
液体在固体薄膜表面上的水滴接触角是衡量表面润湿性能的重要参数,本文测量了PES和SPES薄膜的静态水滴接触角,结果如图4所示。PES薄膜的CA值为(64.3±3.2)°,而SPES薄膜的CA小于50°,这是由于薄膜内—SO3H基团的存在增强了SPES的亲水性。PES的磺化使得薄膜的润湿性显著增强,因此能够有效抑制微生物的黏附聚集,从而提高了膜的抗菌性能[35]。

a-PES;b-SPES(DS=2.222);c-SPES(DS=0.317)
图4 PES和SPES薄膜CA
Fig.4 CA of PES and SPES film

a-SPES膜的SEM结果;b-SPES膜的AFM结果;c-SPES-AgNPs膜的SEM结果;d-SPES-AgNPs膜的AFM结果
图5 SPES膜和SPES-AgNPs膜的SEM和AFM结果
Fig.5 SEM and AFM results of SPES membrane and SPES-AgNPs membrane
2.2 微观结构观测
使用SEM和AFM对所制备的薄膜的表面形貌进行观察。如图5-a所示,SPES薄膜的表面可见不规则的孔隙。经过粗略估计,它们的尺寸约10~100 nm,表明制备的SPES薄膜可能属于超滤(ultrafiltration, UF)膜。在SPES-AgNPs薄膜可见AgNPs均匀分散在表面(图5-c),说明纳米银颗粒在制备复合膜的过程中保持稳定分散,未发生聚集,尺寸约10~100 nm。通过EDS对4种元素(C、O、S和Ag)量化分析说明—SO3H的引入能够提高Ag在SPES-AgNPs膜上的移植量。
AFM的结果显示了膜表面的拓扑结构。其中,SPES薄膜的表面相对光滑,高度为45.3 nm。由于AgNPs的引入,使得SPES-AgNPs薄膜的高度增加到93.9 nm。
2.3 负载银后膜的性能和抗菌活性
如图6所示,采用XRD分析的方法描述了银的负载状态。纯SPES材料为典型的非晶结构,在2θ值为22°~26°处有一系列特征峰,而当2θ值为38.2°、43.8°、64.7°和77.2°时,为Ag的4个典型衍射峰[36]。SPES-AgNPs膜均具有Ag元素的显著特征峰,这也进一步证明了AgNPs成功与材料发生聚合。
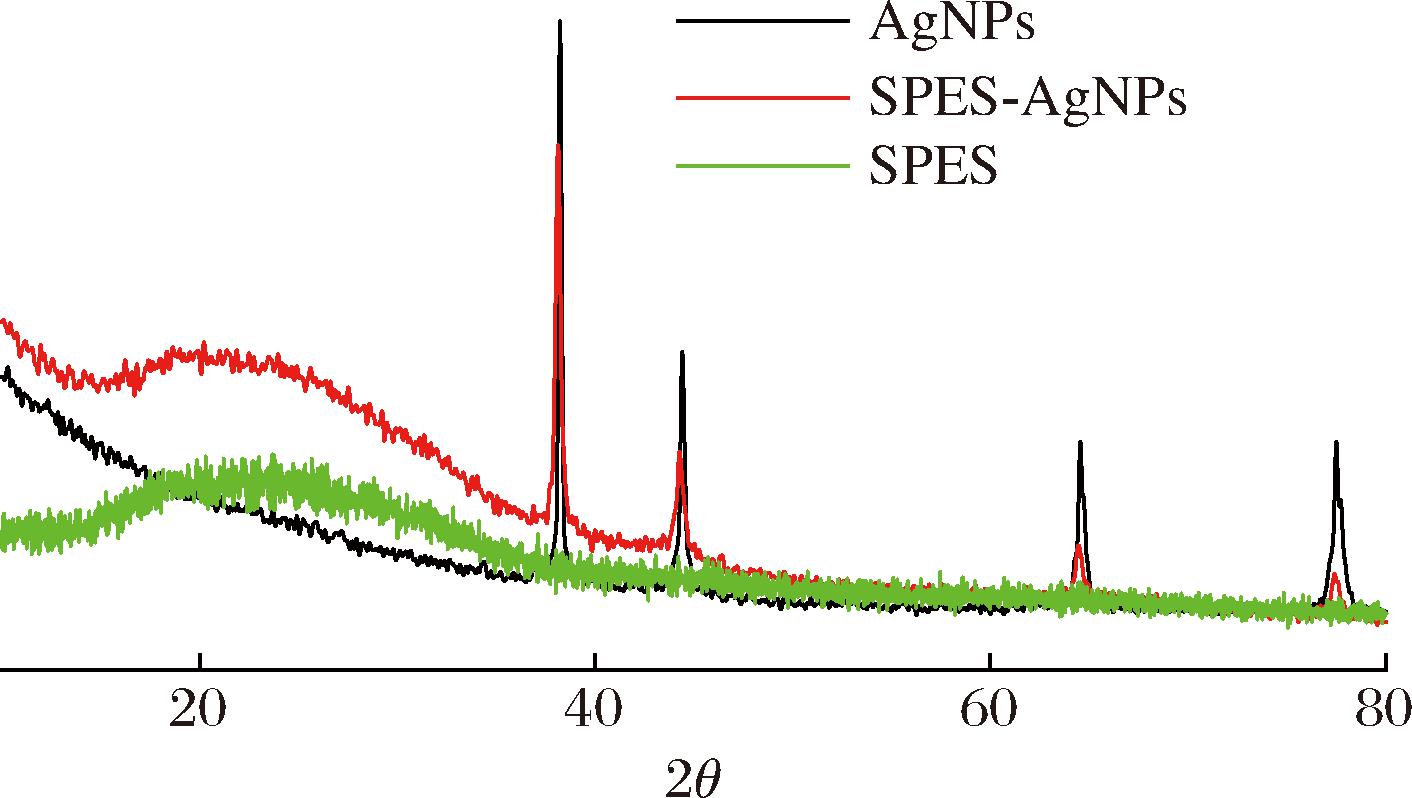
图6 负载AgNPs材料的XRD图
Fig.6 XRD diagram of loaded AgNPs material
图7-a为SPES单体与AgNPs相互作用形成的聚合物分子结构式[37]。其中,Ag0原子容易失去电子并转变为Ag+,而SPES材料中的O原子(1 s2 2 s2 2p4)有2个孤对电子,可以与Ag+形成配位键。此外,由于—SO3基团中的S5+有较强的电子吸引力,—SO3基团中的O原子更容易吸引Ag+,并且相对于主链中的苯基氧具有更强的吸引力[37]。图7-b所示的Ag释放结果可以看出,SPES-AgNPs膜的下降趋势明显平缓。与世界卫生组织报告的饮用水安全标准(100 μg/L)相比[38],SPES-AgNPs膜使用时释放的Ag+始终保持在安全范围内。
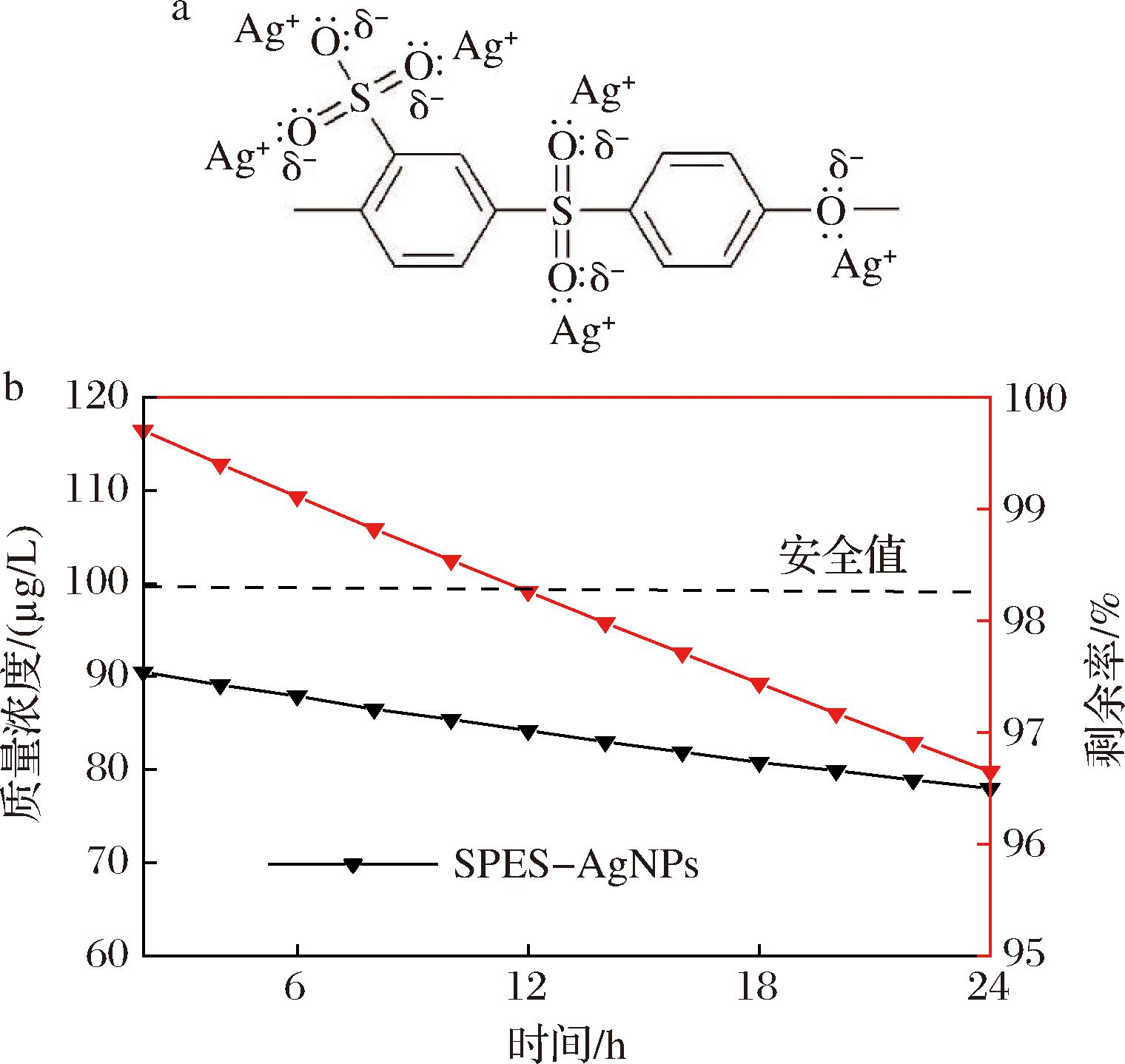
a-SPES-AgNPs结构式;b-Ag释放图
图7 SPES-AgNPs结构式和Ag释放
Fig.7 Structural formula and Ag release of SPES-AgNPs
各材料膜的抑菌性能见图8。SPES-AgNPs和SPES膜对铜绿假单胞菌、金黄色葡萄球菌、李斯特菌、小肠结肠炎耶尔森菌和大肠杆菌表现出了不同程度的抑菌活性。纯SPES膜的抗菌性可能是由于—SO3H基团具有强氧化性,但其抑菌效果较弱。相比之下,SPES-AgNPs膜具有显著的抗菌活性,这是因为AgNPs是一种优秀的抗菌剂[39],能够持续从膜释放出Ag。如图8所示,SPES膜的抑制作用小于25%,而SPES-AgNPs膜对5种菌株的平均抑制率大于85%。对于不同微生物菌株的抑制作用从强到弱的排名如下:李斯特菌>铜绿假单胞菌>金黄色葡萄球菌>大肠杆菌>小肠结肠炎耶尔森菌。
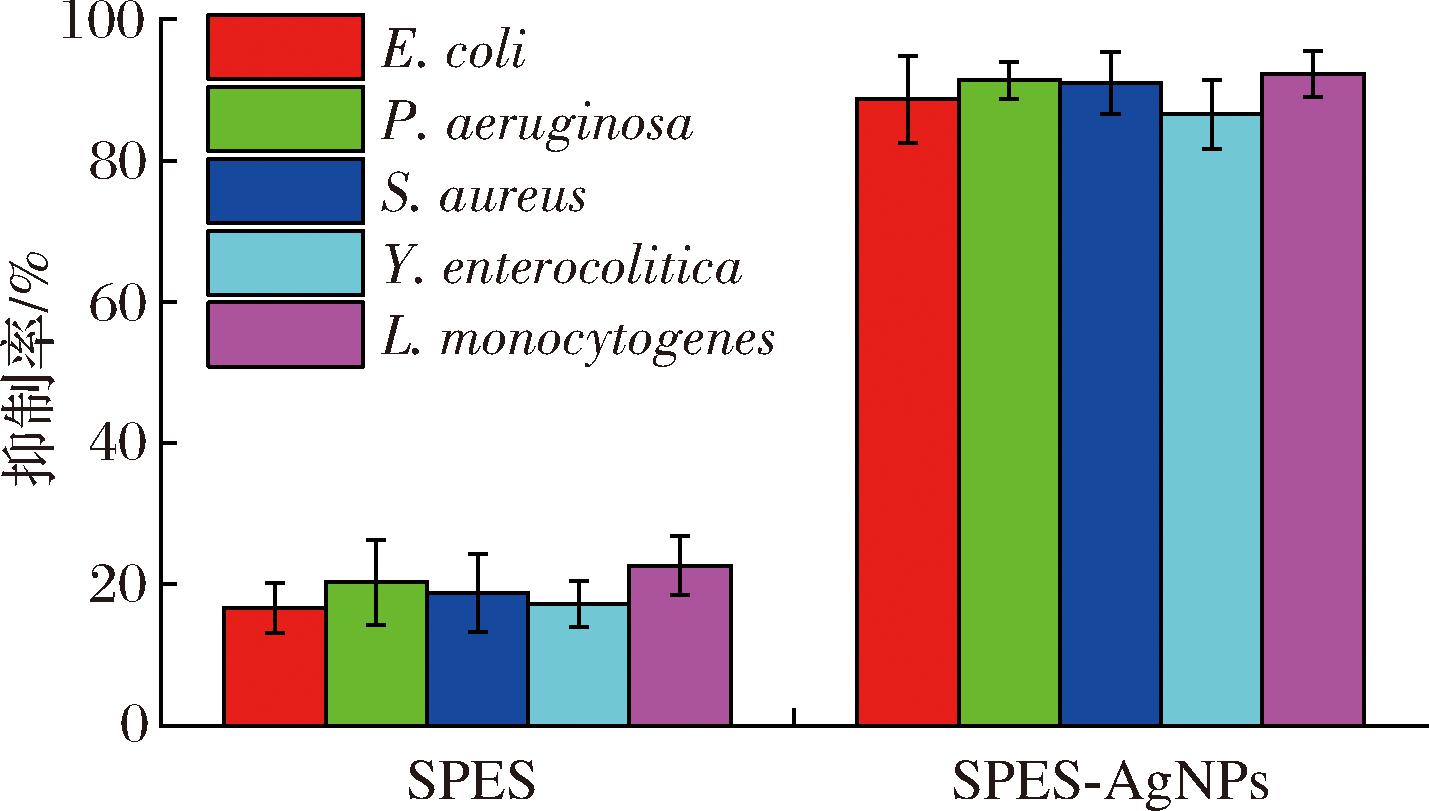
图8 SPES-AgNPs和SPES膜的悬浮液抑制率
Fig.8 Suspension inhibition rate of SPES-AgNPs and SPES membranes
2.4 不同膜材料膜对罗非鱼保鲜的影响
2.4.1 罗非鱼样品的整体新鲜度
图9为18 d贮藏罗非鱼样品的整体新鲜度感官评价结果。最初的罗非鱼样本具有良好的感官特性,气味新鲜,形态紧密和弹性肌肉,因此各指数的得分接近于5。长期的冷藏过程,会导致鱼肉样品迅速变质,鲜味消失,形态松散,硬度和弹性下降[40],可通过感官评分的降低来定量表示。如图9所示,对照组、PE组、SPES组和SPES-AgNPs组罗非鱼的感官评分随着时间的延长均呈现下降趋势。其中,对照组在贮藏第15天明显出现腐烂气味,随着时间延长肉质劣变更为明显。鱼肉贮藏的18 d内,对照组样品感官评分从5到1.8,PE组和SPES组样品分别降至2.5和2.9,而SPES-AgNPs组样品降至3.6。由此可见,用SPES-AgNPs薄膜包裹鱼肉能够显著延缓感官评分的下降速率。另一个值得注意的点是,本文所制备的SPES-AgNPs抗菌保鲜膜相比于目前市面上最常用的商业PE保鲜膜,能够长时间持续释放抗菌物质,从而减缓罗非鱼样品的腐败变质,有效延长罗非鱼的货架期,并且制备简便,具备较好的卫生安全性,是具有良好的应用前景的水产品包装材料。
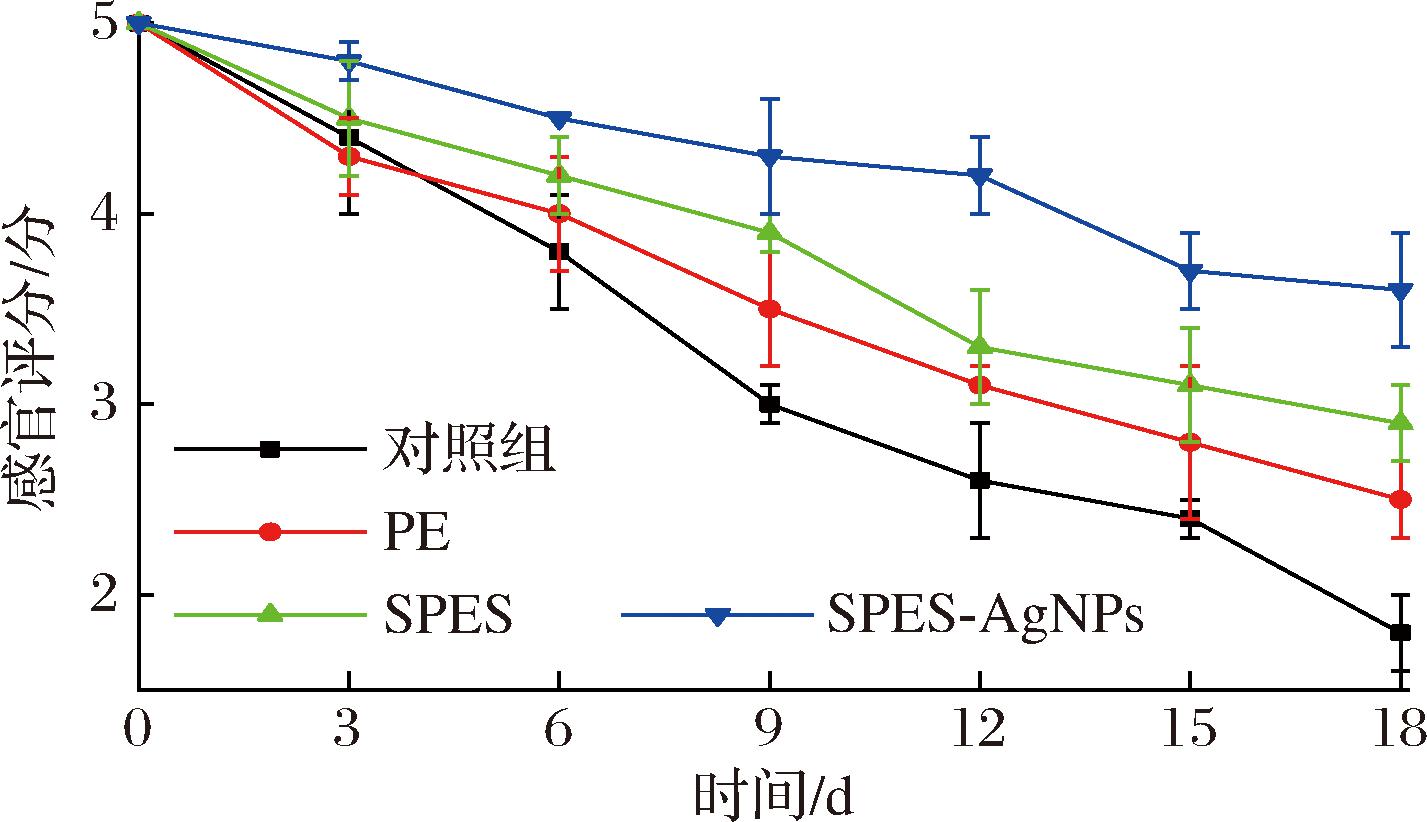
图9 罗非鱼贮藏18 d整体新鲜度感官评价结果图
Fig.9 The sensory evaluation results of the overall freshness of tilapia after 18 days of storage
注:每个值是至少3个样本±s.e.m.的平均值(下同)。
2.4.2 罗非鱼样品贮藏的微生物指标
TCC是衡量水产品在贮存过程中腐烂程度的重要生物指标。然而,由于某些细菌如美国乳酸细菌,会在厌氧环境中产生天然防腐剂,因此此类细菌数量较多时可能会导致食品贮存品质偏高[41],从而产生误差。因此,选择TAC作为另一个评价指标来避免这类影响。此外,由于该研究在冷藏温度下进行,因此对PC也进行了研究。如图10所示,在鱼肉贮藏期间,4组鱼肉样品的TCC、TAC和PC均随着时间的延长而增加。对照组样品相对于保鲜膜包裹鱼肉的其他组样品,细菌繁殖速率明显加快。贮藏18 d后,对照组样品中TCC、TAC和PC的值分别为11.5 lg CFU/g、7.0 lg CFU/g和8.6 lg CFU/g。SPES和PE组样品的TCC、TAC和PC分别为7.3 lg CFU/g和9.8 lg CFU/g、5.9 lg CFU/g和7.3 lg CFU/g、6.6 lg CFU/g和7.9 lg CFU/g。其中,抑菌薄膜SPES-AgNPs包裹的鱼肉在贮藏期间,其菌落生长速率明显小于其余3组样品,样品的TCC、TAC和PC仅为5.6 lg CFU/g、3.5 lg CFU/g和4.7 lg CFU/g。这说明抑菌剂AgNPs的添加对细菌的生长繁殖起到了抑制作用。抑菌薄膜SPES-AgNPs相比于商业纯PE保鲜膜因为具有抑菌成分,能够通过分子迁移杀灭包装内的细菌微生物,因此其对鱼肉的保鲜效果更为明显,可以有效延长了罗非鱼样品的货架期。

a-TCC图;b-TAC图;c-PC图
图10 样品贮藏18 d的微生物指标TCC、PC和TAC
Fig.10 Microbiological index TCC, PC, and TAC of samples stored for 18 days
2.4.3 罗非鱼样品贮藏的化学指标
TVB-N是在贮藏期间蛋白质被微生物分解所产生的氨和以及胺类等碱性含氮物质,是判断水产品新鲜程度的一项重要指标。当TVB-N值超过30 mg/100 g时可以认为完全腐败。如图11-a所示,贮存18 d后,除了SPES-AgNPs膜组样品未超过30 mg/100 g,其余3组鱼肉均超过此值。其中,对照组样品TVB-N值从最初的5.9 mg N/100 g增加到47.3 mg N/100 g。PE和SPES组样品的TVB-N值分别为43.7 mg N/100 g和33.1 mg N/100 g。可以发现在相同的贮藏环境下,SPES-AgNPs膜的保鲜效果最佳,TVB-N值仅为18.2 mg N/100 g,鱼肉仍具有较高的新鲜度。罗非鱼样品的TVB-N值的变化,间接反映出3种膜的抑菌保鲜性能。结果表明,SPES-AgNPs膜具有明显的抑菌性,原因是SPES-AgNPs膜可以持续抑制腐败细菌的生长[42-43],使得TVB-N值能够长时间维持在较低水平,从而保持鱼肉新鲜不腐败。
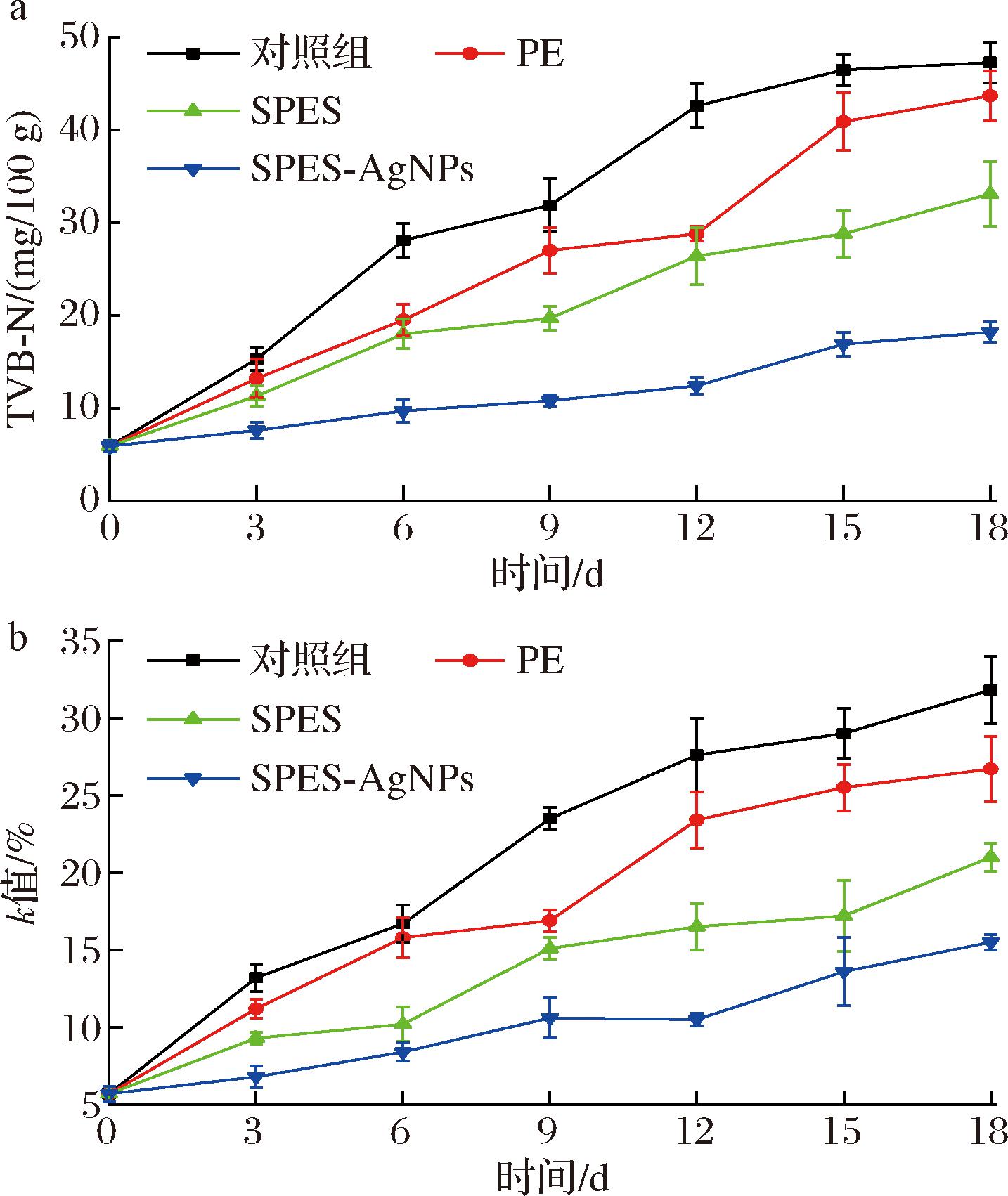
a-TVB-N图;b-k值图
图11 罗非鱼样品贮藏18 d的化学指标 TVB-N和k值
Fig.11 Chemical index TVB-N and k value of tilapia samples stored for 18 days
k值表示ATP降解的程度,是鱼类前期新鲜度的评价的重要指标。随着贮藏时间的延长,4组鱼肉样品的k值的均呈现出持续上升的趋势。如图11-b所示,每个样品的初始k值为5.7%。贮藏18 d后,对照组样品的k值为31.8%,PE组和SPES组样品k值分别为26.7%和21.0%。其中,SPES-AgNPs膜处理的样品k值仅为15.5%。说明SPES-AgNPs膜处理鱼肉样品能够有效减缓ATP降解产生肌苷和次黄嘌呤,从而使鱼肉贮藏18 d后的仍维持在较为新鲜的程度。k值的变化规律同样说明了与TVB-N值相似的结论。
4 结论
本研究通过磺化使PES材料表面活化,将—SO3H基团接枝于PES分子主链,制得SPES膜,并通过控制磺化反应时间控制膜的磺化度。FTIR、TG和接触角CA结果表明,改性后膜的亲水性和表面活性得到显著提高。在此基础上接枝AgNPs,电镜扫描和AFM图显示所制备的膜表面AgNPs均匀分布,表面颗粒的平均高度约为100 nm。XRD和抗菌分析显示所制备的SPES-AgNPs膜在Ag安全范围内对不同的微生物菌株具有显著的抗菌活性。将SPES-AgNPs膜应用于罗非鱼的保鲜。结果表明,用SPES-AgNPs抗菌保鲜膜包裹的鱼肉样品可以有效抑制鱼样本中菌落总数、厌氧菌落总数、嗜冷菌落总数、TVB-N值、k值以及感官评价的变化。这些结果揭示了SPES-AgNPs膜在水产品保鲜领域具有广阔的应用前景。
[1] YU D W, REGENSTEIN J M, XIA W S.Bio-based edible coatings for the preservation of fishery products:A review[J].Critical Reviews in Food Science and Nutrition, 2019, 59(15):2481-2493.
[2] ALI A, WEI S, ALI A, et al.Research progress on nutritional value, preservation and processing of fish—A review[J].Foods, 2022, 11(22):3669.
[3] QIU L Q, ZHANG M, BHANDARI B, et al.Shelf life extension of aquatic products by applying nanotechnology:A review[J].Critical Reviews in Food Science and Nutrition, 2022, 62(6):1521-1535.
[4] DONG H N, GAI Y M, FU S P, et al.Application of biotechnology in specific spoilage organisms of aquatic products[J].Frontiers in Bioengineering and Biotechnology, 2022, 10:895283.
[5] ÇIÇEK S, ![]() F.Nanotechnology-based preservation approaches for aquatic food products:A review with the current knowledge[J].Critical Reviews in Food Science and Nutrition, 2023, 63(19):3255-3278.
F.Nanotechnology-based preservation approaches for aquatic food products:A review with the current knowledge[J].Critical Reviews in Food Science and Nutrition, 2023, 63(19):3255-3278.
[6] SUSANTO H, STAHRA N, ULBRICHT M.High performance polyethersulfone microfiltration membranes having high flux and stable hydrophilic property[J].Journal of Membrane Science, 2009, 342(1-2):153-164.
[7] IRFAN M, IDRIS A. Overview of PES biocompatible/hemodialysis membranes: PES-blood interactions and modification techniques[J]. Materials Science &Engineering. C, Materials for Biological Applications, 2015, 56:574-592.
[8] DEHGHAN R, BARZIN J.Development of a polysulfone membrane with explicit characteristics for separation of low density lipoprotein from blood plasma[J].Polymer Testing, 2020, 85:106438.
[9] SHAMAEI L, KHORSHIDI B, ISLAM M A, et al.Industrial waste lignin as an antifouling coating for the treatment of oily wastewater:Creating wealth from waste[J].Journal of Cleaner Production, 2020, 256:120304.[10] KALLEM P, OTHMAN I, OUDA M, et al.Polyethersulfone hybrid ultrafiltration membranes fabricated with polydopamine modified ZnFe2O4nanocomposites:Applications in humic acid removal and oil/water emulsion separation[J].Process Safety and Environmental Protection, 2021, 148:813-824.
[11] ABDORREZAEE Z, RAISI A.A hybrid ultrafiltration/nanofiltration/pervaporation membrane process for intensifying the refining of crude canola oil and solvent recovery[J].Chemical Engineering and Processing-Process Intensification, 2021, 169:108598.
[12] EL-GENDI A, GHANEM A F, YASSIN M A, et al.Antifouling and antimicrobial polyethersulfone/hyperbranched polyester-amide/Ag composite[J].RSC Advances, 2020, 10(41):24169-24175.
[13] FAHRINA A, ARAHMAN N, APRILIA S, et al.Functionalization of PEG-AgNPs hybrid material to alleviate biofouling tendency of polyethersulfone membrane[J].Polymers (Basel), 2022, 14(9):1908.
[14] RIBEIRO A I, SHVALYA V, CVELBAR U, et al.Stabilization of silver nanoparticles on polyester fabric using organo-matrices for controlled antimicrobial performance[J].Polymers, 2022, 14(6):1138.
[15] HAIDER M S, SHAO G N, IMRAN S M, et al.Aminated polyethersulfone-silver nanoparticles (AgNPs-APES) composite membranes with controlled silver ion release for antibacterial and water treatment applications[J].Materials Science and Engineering.C, Materials for Biological Applications, 2016, 62:732-745.
[16] BISWAS P, BANDYOPADHYAYA R.Biofouling prevention using silver nanoparticle impregnated polyethersulfone (PES) membrane:E.coli cell-killing in a continuous cross-flow membrane module[J].Journal of Colloid and Interface Science, 2017, 491:13-26.
[17] KUMAR M, SREEDHAR N, JAOUDE M A, et al.High-flux, antifouling hydrophilized ultrafiltration membranes with tunable charge density combining sulfonated poly(ether sulfone) and aminated graphene oxide nanohybrid[J].ACS Applied Materials &Interfaces, 2020, 12(1):1617-1627.
[18] RAHIMPOUR A, MADAENI S S, GHORBANI S, et al.The influence of sulfonated polyethersulfone (SPES) on surface nano-morphology and performance of polyethersulfone (PES) membrane[J].Applied Surface Science, 2010, 256(6):1825-1831.
[19] FANG C, JING Y, LIN Z X.The application research of environment-friendly reactive surfactants in acrylate emulsion pressure sensitive adhesives[J].International Journal of Adhesion and Adhesives, 2017, 73:1-7.
[20] KEMPASIDDAIAH M, KANDATHIL V, DATEER R B, et al.Efficient and recyclable palladium enriched magnetic nanocatalyst for reduction of toxic environmental pollutants[J].Journal of Environmental Sciences, 2021, 101:189-204.
[21] SONG J, OH T, KO E K, et al.Higher harmonics in planar hall effect induced by cluster magnetic multipoles[J].Nature Communications, 2022, 13(1):6501.
[22] BEN HAMMOUDA S, ADHOUM N, MONSER L.Chemical oxidation of a malodorous compound, indole, using iron entrapped in calcium alginate beads[J].Journal of Hazardous Materials, 2016, 301:350-361.
[23] 肖凯军, 代佳丽, 何其, 等.非离子表面活性剂作用下纳米铁的制备及其表征[J].现代食品科技, 2015, 31(9):138-144.XIAO K J, DAI J L, HE Q, et al.Characterization of iron nanoparticles prepared with non-ionic surfactants[J].Modern Food Science and Technology, 2015, 31(9):138-144.
[24] XIAO L Q, KANG S, LAPU M, et al.Preparation and characterization of chitosan/pullulan film loading carvacrol for targeted antibacterial packaging of chilled meat[J].International Journal of Biological Macromolecules, 2022, 211:140-149.
[25] WU F Q, ZHOU Z G, LI N N, et al.Development of poly(vinyl alcohol)/starch/ethyl lauroyl arginate blend films with enhanced antimicrobial and physical properties for active packaging[J].International Journal of Biological Macromolecules, 2021, 192:389-397.
[26] WEI P Y, ZHU K X, CAO J, et al.The inhibition mechanism of the texture deterioration of tilapia fillets during partial freezing after treatment with polyphenols[J].Food Chemistry, 2021, 335:127647.
[27] HE Q, YANG Z, GONG B, et al.Quality evaluation focusing on tissue fractal dimension and chemical changes for frozen tilapia with treatment by tangerine peel extract[J].Scientific Reports, 2017, 7:42202.
[28] DULAL M A, JAHAN I, RASUL M G, et al.Antioxidant and antimicrobial potential of water lily extracts and their effects on the quality of frozen nile tilapia (Oreochromis niloticus) fillets[J].Food Science &Nutrition, 2023, 11(1):535-544.
[29] ZHANG L N, LI X, LU W, et al.Quality predictive models of grass carp (Ctenopharyngodon idellus) at different temperatures during storage[J].Food Control, 2011, 22(8):1197-1202.
[30] BERBERT, QUEIROZ D M, MELO E C.AOAC.2005.Official Methods of Analysis of AOAC International[M].18th ed.Washington, 2005.
[31] SK RNISD
RNISD TTIR S, KNOBLOCH S, LAUZON H L, et al.Impact of onboard chitosan treatment of whole cod (Gadus morhua) on the shelf life and spoilage bacteria of loins stored superchilled under different atmospheres[J].Food Microbiology, 2021, 97:103723.
TTIR S, KNOBLOCH S, LAUZON H L, et al.Impact of onboard chitosan treatment of whole cod (Gadus morhua) on the shelf life and spoilage bacteria of loins stored superchilled under different atmospheres[J].Food Microbiology, 2021, 97:103723.
[32] YANG X L, ZHOU Y H, WANG B, et al.Tartary buckwheat extract and chitosan coated tilapia (oreochromis niloticus) fillets determine their shelf life[J].Journal of Food Science, 2019, 84(6):1288-1296.
[33] KIM S, HOEK E M V.Interactions controlling biopolymer fouling of reverse osmosis membranes[J].Desalination, 2007, 202(1-3):333-342.
[34] PARK C, LEI J, KIM J O.Mitigation of biofouling with co-deposition of polydopamine and curcumin on the surface of a thin-film composite membrane[J].Chemosphere, 2023, 310:136910.
[35] AKIN O, TEMELLI F.Probing the hydrophobicity of commercial reverse osmosis membranes produced by interfacial polymerization using contact angle, XPS, FTIR, FE-SEM and AFM[J].Desalination, 2011, 278(1-3):387-396.
[36] ANDRADE P F, DE FARIA A F, OLIVEIRA S R, et al.Improved antibacterial activity of nanofiltration polysulfone membranes modified with silver nanoparticles[J].Water Research, 2015, 81:333-342.
[37] BASRI H, ISMAIL A F, AZIZ M.Microstructure and anti-adhesion properties of PES/TAP/Ag hybrid ultrafiltration membrane[J].Desalination, 2012, 287:71-77.
[38] ZHANG M Y, FIELD R W, ZHANG K S.Biogenic silver nanocomposite polyethersulfone UF membranes with antifouling properties[J].Journal of Membrane Science, 2014, 471:274-284.
[39] ALAVI M, ASHENGROPH M.Mycosynthesis of AgNPs:Mechanisms of nanoparticle formation and antimicrobial activities[J].Expert Review of Anti-Infective Therapy, 2023, 21(4):355-363.
[40] PRABHAKAR P K, VATSA S, SRIVASTAV P P, et al.A comprehensive review on freshness of fish and assessment:Analytical methods and recent innovations[J].Food Research International, 2020, 133:109157.
[41] FERN NDEZ-SEGOVIA I, ESCRICHE I, FUENTES A, et al.Microbial and sensory changes during refrigerated storage of desalted cod (Gadus morhua) preserved by combined methods[J].International Journal of Food Microbiology, 2007, 116(1):64-72.
NDEZ-SEGOVIA I, ESCRICHE I, FUENTES A, et al.Microbial and sensory changes during refrigerated storage of desalted cod (Gadus morhua) preserved by combined methods[J].International Journal of Food Microbiology, 2007, 116(1):64-72.
[42] EL-GENDI A, GHANEM A F, YASSIN M A, et al.Antifouling and antimicrobial polyethersulfone/hyperbranched polyester-amide/Ag composite[J].RSC Advances, 2020, 10(41):24169-24175.
[43] CHUKWUATI C N, MOUTLOALI R M.Antibacterial studies of Ag@HPEI@GO nanocomposites and their effects on fouling and dye rejection in PES UF membranes[J].Heliyon, 2022, 8(11):e11825.