高血压是心血管疾病的首要危险因素,容易引发许多的并发症如冠心病、心肌梗死和失明等疾病[1]。目前高血压人数不断增加,且高血压的人群逐渐年轻化[2]。高血压无根治手段,一旦患上高血压,需要终身服药[3]。血管紧张转化酶(angiotensin-converting enzyme,ACE)在血压调控机制步骤中是关键的催化剂,它将血管紧张素I催化转化为血管紧张素Ⅱ,使血压收缩压升高,同时它会引起缓激肽的失活,使血管不能扩张无法降低血压[4]。由于ACE抑制剂在治疗高血压、心力衰竭等心血管疾病中的重要性,研究人员在对该酶的研究和寻找其抑制剂方面不断更新[5-6]。因此ACE的分离纯化对研发新降压药物具有重要意义。
ACE广泛存在于动物体内各个组织器官,尤其以肺组织含量最高。从兔肺、猪肺、鼠肺和羊肺中提取ACE均有报道[7-8]。ACE纯化仍主要采用盐析、透析、离子交换、凝胶色谱以及超滤等多步分离,纯化过程冗长耗时,所以每一步纯化过程的优化对提高ACE回收率均有重要意义。
除了从食源蛋白中筛选的ACE抑制肽对ACE活性起抑制作用外,一些临床研究表明,抗氧化化合物如还原型谷胱甘肽(reduced glutathione,GSH)、α脂肪酸、维生素A、维生素E、维生素C和辅酶Q10可治疗高血压并预防氧化应激[9-10],尽管也有报道表明GSH对ACE活性具有抑制作用,但对不同来源ACE的抑制作用仍存在差异,GSH对猪肺提取的ACE的抑制作用尚无报道。
本文以新鲜猪肺为原料,通过对盐析、阴离子交换层析和超滤等步骤进行优化提取纯化ACE,并以ACE抑制肽Ala-Gly-Pro(AGP)为对照组,研究GSH对猪肺纯化的ACE的抑制作用。
1 材料与方法
1.1 材料与试剂
新鲜猪肺购于当地市场。牛血清白蛋白(bovine serum albumin,BSA)、马尿酸(hippuric acid,HA)和马尿酰-组氨酰-亮氨酸(hippuryl-histaminoyl-leucine,HHL)(BR),美国Sigma公司;五水硼砂(AR),上海麦克林生化科技有限公司;硼酸、氯化钠、硫酸铵、蔗糖、氢氧化钠和三氟乙酸(AR),上海国药集团试剂有限公司;甲醇、HPLC,Thermo Fisher Scientific公司;DEAE-琼脂糖凝胶(BR),Pharmacia公司;十二烷基硫酸钠、丙烯酰胺、无水乙醇和醋酸(AR),四川成都科隆有限公司;Marker蛋白(20~200 kDa),北京全式金生物技术有限公司;AGP(BR),上海吉尔生化公司;GSH(BR),阿拉丁试剂上海有限公司。
1.2 仪器与设备
Agilent1200高效液相色谱仪,美国安捷伦公司;UV2550紫外可见光分度计,日本岛津公司;JRJ-300-T剪切乳化搅拌机,上海标本模型厂;Avanti J-26XP高速冷冻离心机,美国贝克曼公司;14 000±2 000透析袋,上海喜润化学工业有限公司;AKTA Pure蛋白纯化仪,美国GE公司;100 kDa超滤膜包,德国赛多利斯公司;DYY-6C电泳仪,北京六一仪器厂。
1.3 实验方法
1.3.1 原料预处理
将新鲜猪肺清洗干净,并在低温条件下去除猪肺中的非肌肉组织后切成小块,并放入含0.25 mol/L蔗糖的硼酸缓冲溶液中(boric acid buffer solution,BBS,0.1 mol/L,pH值为8.3,下同),用剪切乳化搅拌机匀浆过滤得到匀浆液(A)。
1.3.2 ACE盐析优化
将A的蛋白质量浓度稀释至20~60 mg/mL,在A中加入固体硫酸铵使其浓度为1.6 mol/L后静置盐析4 h,离心后得到一级上清液(B1)和一级沉淀。向B1加入固体硫酸铵至浓度为3.6 mol/L进行二次盐析,静置4 h后离心得到二级沉淀(B2)。往B2中加入少量BBS缓冲溶液溶解B2,再用14 kDa的透析袋在BBS缓冲溶液中透析直到完全除去硫酸根离子后得到ACE粗提液(C)。分别测定A、B1、B2、C中ACE比活并计算酶活回收率。
1.3.3 阴离子交换层析
选用DEAE-Sepharose-FF阴离子交换自装柱(Φ3.0 cm×25 cm),用BBS缓冲溶液将层析柱平衡后取质量浓度为0.32 mg/mL的透析酶液2 mL上样,分别使用含0、0.12、0.17 mol/L NaCl的BBS缓冲溶液洗脱,每个盐浓度的洗脱体积为1.5倍柱体积,洗脱流速为2.5 mL/min,洗脱结束后使用2 mol/L NaCl和超纯水将填料重生清洗。收集洗脱目标峰下的层析液(D),测定层析液D的比活并计算酶活回收率。
1.3.4 超滤
采用超滤膜包在4 ℃条件下将层析液进一步纯化。取100 mL的D以一定的流速经过100 kDa的膜包,考察超滤过程中进样流速对酶回收率的影响,收集超滤截留液(E),测定E的比活和酶活回收率。
1.3.5 ACE分子质量测定
使用凝胶电泳法(SDS-PAGE)分析从猪肺中提取纯化的ACE纯度,并测定其分子质量[11]。浓缩胶和分离胶的丙烯酰胺质量浓度分别为40 g/L和100 g/L,在浓缩胶和分离胶中同时加入0.4%(质量分数)的十二烷基硫酸钠。凝胶在0.025%(质量分数)考马斯亮蓝R-250[含有40%(体积分数)甲醇、7%醋酸和蒸馏水]中染色完毕后用含有30%无水乙醇、10%醋酸和60%蒸馏水脱色液洗涤脱色。将获得的marker蛋白和ACE条带进行拍照分析。
1.3.6 猪肺ACE的酶学性质
a)最适反应温度的确定:纯化后的ACE使用BBS缓冲溶液配制得到质量浓度为0.36 mg/mL的ACE酶液,加入底物HHL分别在17、22、27、32、37、42、47、52、57 ℃中进行酶促反应测其酶活力,以高酶活力值为100%,其余酶活力值相对于最高酶活力进行计算分析确定最适反应温度。
b)最适反应pH的确定:纯化后的ACE分别使用pH值为4.5、5.5、6.5、7.5、8.5、9.5、10.5、11.5的BBS缓冲溶液配制得到0.36 mg/mL的ACE酶液,加入底物HHL在37 ℃中进行酶促反应后测其酶活力。以最高酶活力值为100%,其余酶活力值相对最高酶活力进行计算确定其最适反应pH值。
c)ACE反应动力学参数的测定:以浓度为1.56、3.12、1.56、5.46、7.18、10.2、13.1 mmol/L的HHL作为底物与纯化后的ACE进行酶促反应。根据米氏方程双倒数法绘制Lineweaver-Burk曲线图,计算其米氏常数Km和最大反应速率Vmax。
1.3.7 AGP及GSH对ACE体外活性的影响
以ACE抑制肽AGP为对照品,研究了ACE抑制肽AGP和GSH对猪肺ACE的活性影响。分别将不同浓度的AGP和GSH与底物HHL反应后测定ACE活性。分别绘制不同浓度的AGP和GSH抑制ACE活性的曲线图,计算AGP和GSH对ACE活性IC50常数。分别测定当不同浓度的AGP、GSH存在时ACE与底物HHL(1.56~13.1 mmol/L)的酶促反应,根据酶促反应结果绘制Lineweaver-Burk曲线图,确定AGP和GSH的抑制类型和抑制常数Ki。
1.4 分析方法
1.4.1 蛋白质标准曲线
采用紫外分光光度计以BSA作为标准蛋白样品来测定溶液中蛋白质含量[12]。分别测定质量浓度为0.1~1.0 mg/mL的BSA溶液在波长为280 nm处的吸光度。以BSA溶液浓度为横坐标,对应的吸光度为纵坐标绘制蛋白标准曲线,得到蛋白质标准曲线方程:y=0.615 0x-0.000 1,相关系数R2=0.999 8。
1.4.2 ACE活性检测
ACE可以与底物HHL反应生产HA,酶促反应参考徐晓晴[13]的方法,采用高效液相色谱法测定产物HA的含量,并计算ACE的酶活力。色谱条件:色谱柱为SB-C18(150 mm×4.6 mm),流动相为V(甲醇)∶V(纯水)(含0.1%三氟乙酸)=85∶15,流速为1.0 mL/min,VWD检测器,检测波长228 nm,进样量为20 μL。
酶活力定义:单位时间(min)内催化HHL产生1 μmol HA所需的酶量(U)为1 U。每毫克蛋白中所含的酶活力(U/mg)为比活。
HA标准曲线:利用高效液相色谱仪测定含量为0.1~1.5 μg HA对应的峰面积,以HA含量为横坐标,以峰面积为纵坐标,得到HA标准曲线方程:y=5 284x-49.78,线性相关系数R2=0.999 9。
酶活回收率的计算如公式(1)所示:
酶活回收率![]()
(1)
式中:λ1,λ2分别为分离前后的酶比活,U/mg;Pr1,Pr2分别为分离前后的总蛋白,mg。
酶活抑制率的计算如公式(2)所示:
酶活抑制率![]()
(2)
式中:H0,不加抑制剂下ACE的酶活力,U;H,加了抑制剂下ACE的酶活力,U。
1.5 数据处理
每组实验进行3次重复,实验测得数据采用ExceL 2021和Origin 9.8进行处理分析以及绘制图表。
2 结果与分析
2.1 匀浆液蛋白浓度对盐析过程的影响
盐析广泛用于蛋白质分离和结晶。考察不同蛋白浓度的A在盐析过程中的酶比活及酶活回收率的变化规律,结果如图1所示。
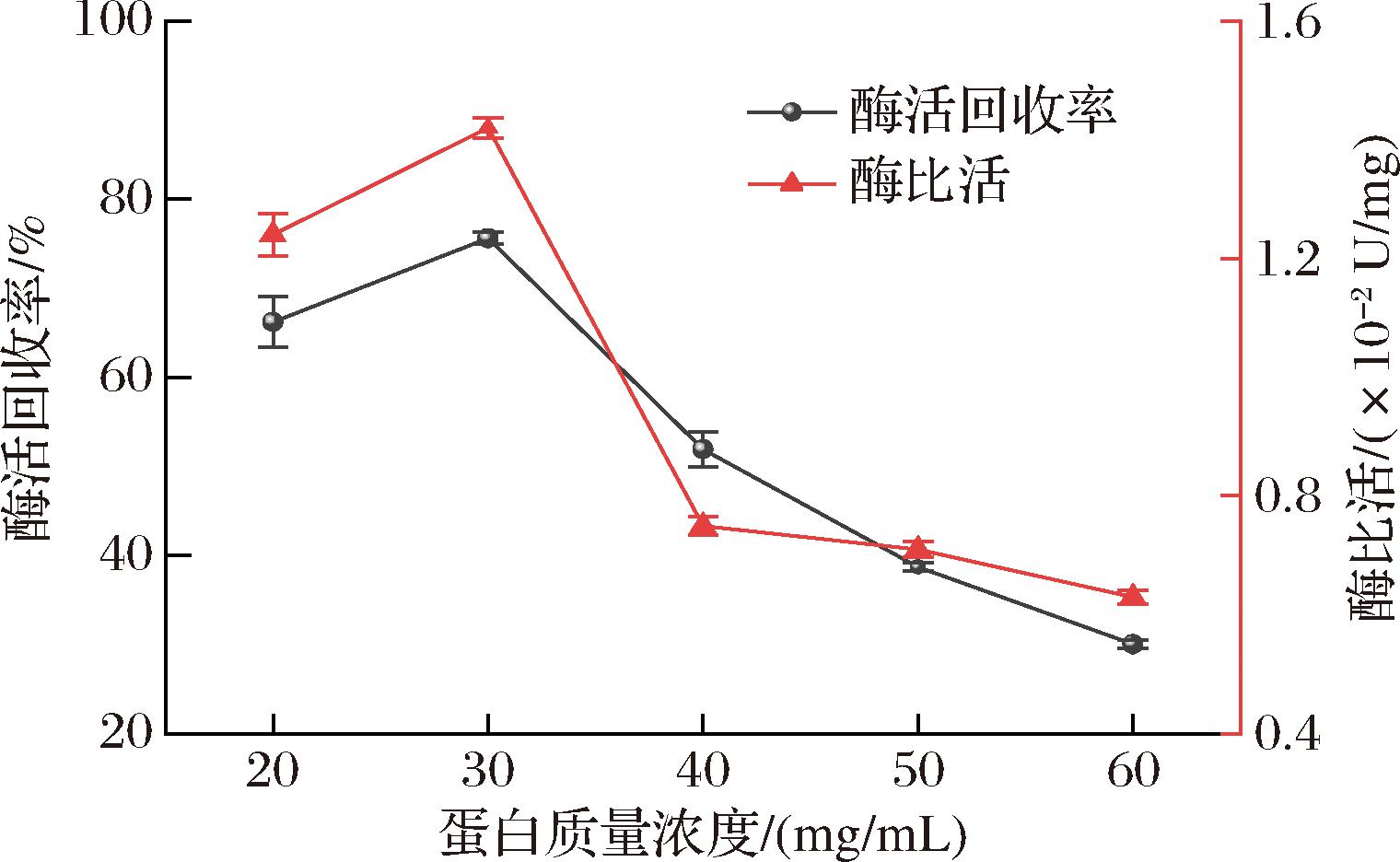
图1 不同质量浓度的蛋白匀浆液盐析结果
Fig.1 Salting out results of protein homogenates of different mass concentrations
由图1可知,不同蛋白浓度的匀浆液盐析后的酶活回收率差别较大。高蛋白浓度的匀浆液在低温时溶液黏度大,当硫酸铵加入后ACE与杂蛋白质极易聚集产生共沉淀,导致ACE随杂蛋白沉淀流失,当匀浆液蛋白质量浓度为40~60 mg/mL时,酶活回收率不超过55%。随着匀浆液蛋白浓度降低,ACE与杂蛋白聚集程度减弱,盐析时共沉淀现象得到改善,酶活回收率逐渐升高。当匀浆液蛋白质量浓度接近30 mg/mL时,匀浆液的酶活回收率提升至75.6%,且比活也明显提高。因此选择匀浆液质量浓度为30 mg/mL。
2.2 DEAE-Sepharose-FF阴离子交换层析优化
经过粗分离得到的ACE纯度较低,柱层析法是能够纯化ACE的关键步骤。本实验选择DEAE-Sepharose-FF阴离子填料自装柱以纯化ACE[14],采用不同盐浓度缓冲溶液进行洗脱,洗脱谱图如图2-a所示。流动相温度会影响离子交换层析柱的保留时间,从而影响分离度[15-16],考察了不同温度下洗脱ACE比活及回收率(图2-b)。随着温度逐渐升高,ACE的比活及酶活回收率呈现先升高后下降的趋势,这是因为随着流动相的温度升高导致固定相中填料颗粒的内传质阻力减小,此时离子扩散速度变快,从而提高了离子交换柱的分离效率[17],同时温度也影响了ACE的活性。当层析温度为35 ℃,此时ACE比活为0.74 U/mg,酶活回收率达到了59.3%。
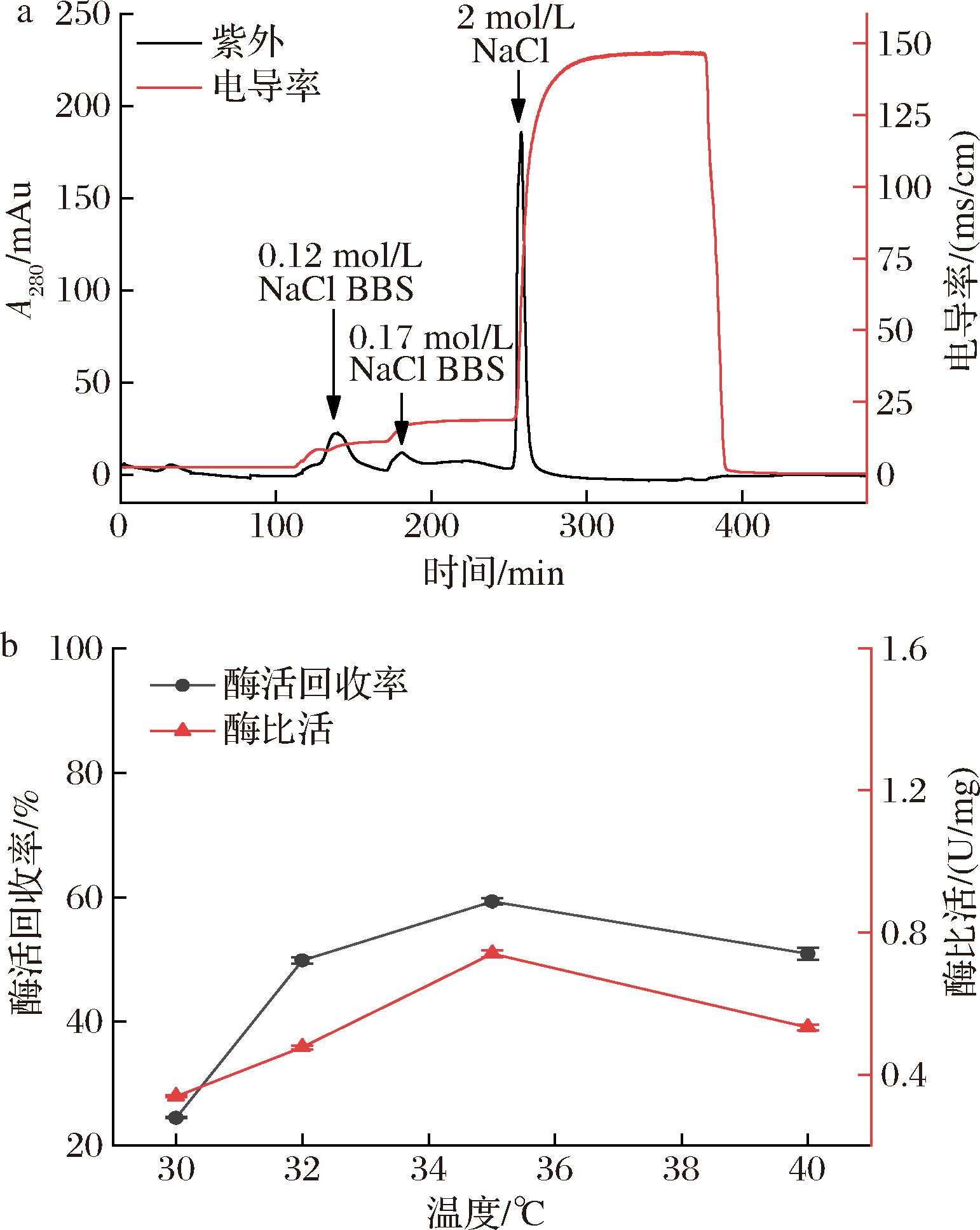
a-DEAE离子交换洗脱谱图;b-温度对DEAE离子交换纯化效果的影响
图2 DEAE离子交换层析
Fig.2 DEAE ion exchange chromatography
2.3 超滤纯化ACE
ACE的分子质量约为140~200 kDa[18],因此选用100 kDa的超滤膜包对D进行超滤进一步纯化。分别以3.0、5.0、7.0 mL/min体积进行超滤,结果如图3所示。
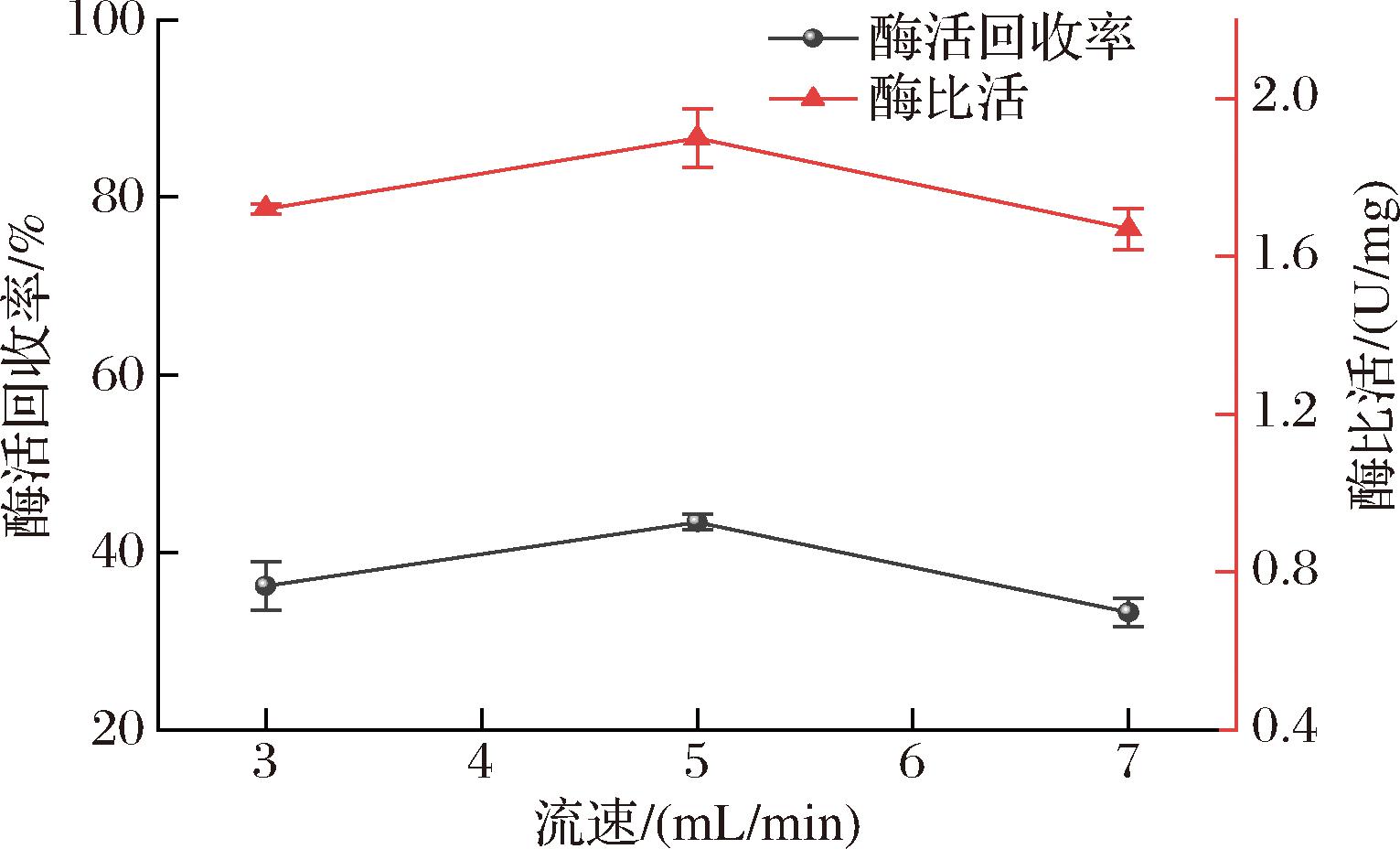
图3 不同进样流速下超滤结果
Fig.3 Ultrafiltration results at different injection flow rates
结果表明,当流速为5.0 mL/min时,ACE酶液的比活和酶活回收率最大,原因是当流速增加时,跨膜压差也随着增大,加快了分离速度。但当流速进一步增加时意味着会以更高的跨膜压力操作,此时料液中的部分微生物细胞或蛋白等可能有机会沉积在膜表面上加速膜污染[19],降低分离效率。
经过盐析、层析和超滤等条件优化后,从猪肺中分离纯化ACE的结果如表1所示。
表1 猪肺ACE分离纯化总表
Table 1 Summary table of ACE isolation and purification of pig lung
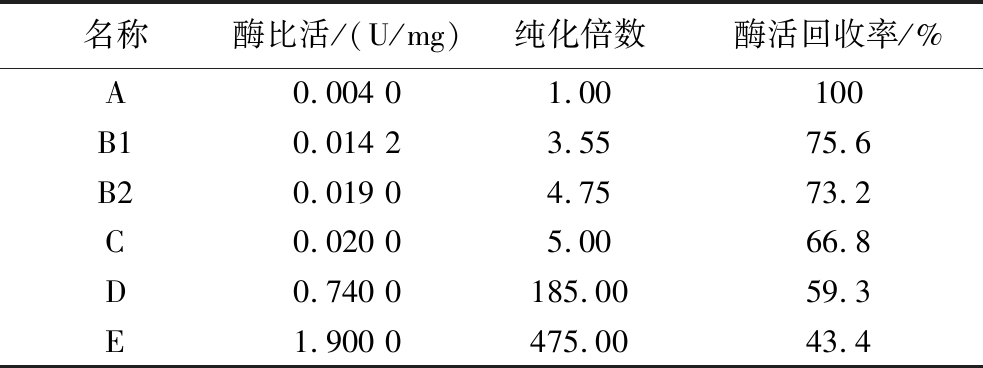
名称酶比活/(U/mg)纯化倍数酶活回收率/%A0.004 01.00100B10.014 23.5575.6B20.019 04.7573.2C0.020 05.0066.8D0.740 0185.0059.3E1.900 0475.0043.4
从表1可知经过优化后ACE的纯化效果得到了较为明显的提高。
2.4 ACE分子质量和纯度检测
采用SDS-PAGE法检测从猪肺提取的ACE分子质量及纯度,结果如图4所示。
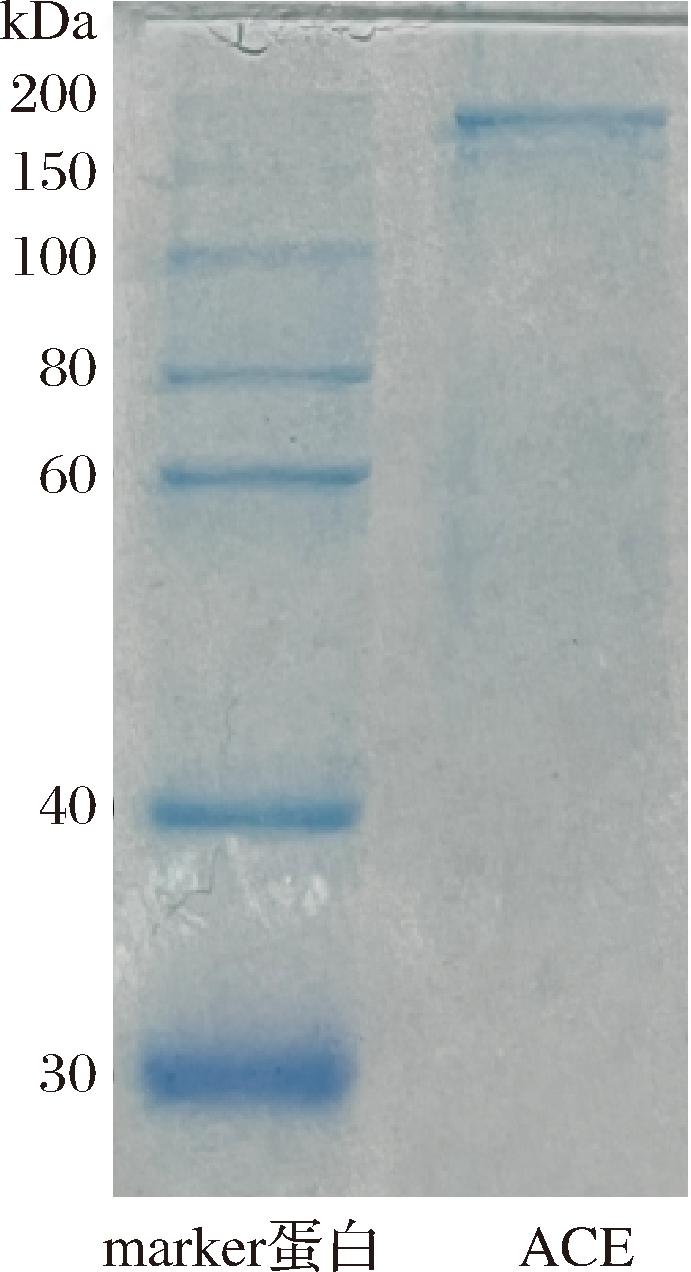
图4 纯化后ACE SDS-PAGE电泳图
Fig.4 SDS-PAGE analysis of purified ACE
根据marker蛋白的分子质量和相对迁移率,经过计算后得目标蛋白的分子质量在160 kDa,并且从图4中可以看出纯化后的蛋白仅有一条分子带,说明ACE纯度高。
2.5 ACE酶学性质
2.5.1 最适反应温度
温度会影响底物和酶的结合,影响反应速率。ACE的最适反应温度结果如图5所示,在37 ℃中进行酶促反应的酶活力是最高的,此ACE酶促反应的最适温度为37 ℃。
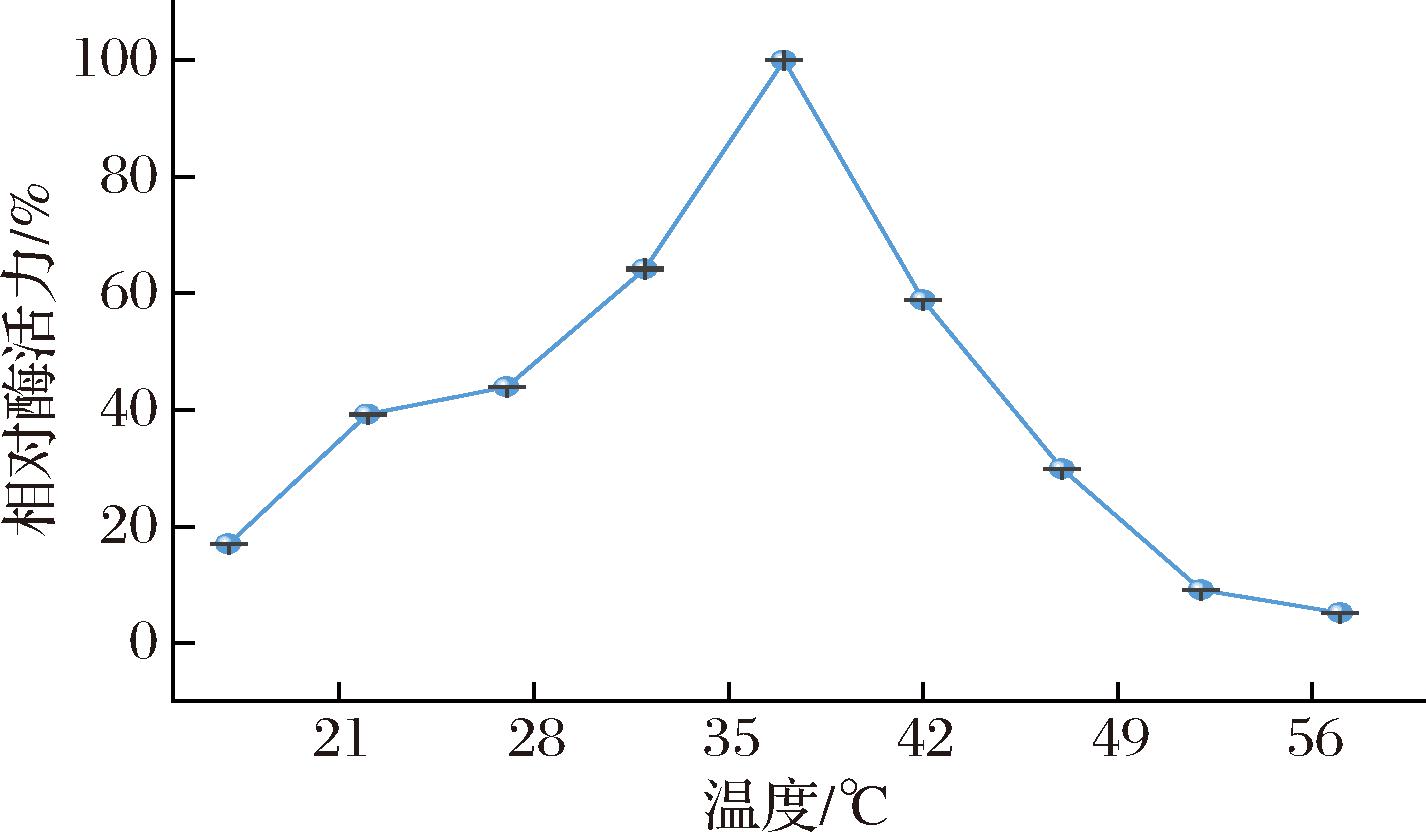
图5 温度对ACE活力的影响
Fig.5 Effect of temperature on the activity of ACE
2.5.2 最适反应pH值
pH可影响酶空间构象,改变底物的解离状态,这些均会影响酶与底物的结合。不同的pH对ACE酶促反应的影响如图6所示。在pH值为7.5时进行反应相对酶活力最高,而在pH值为8.5时的相对酶活力为90.8%,因此ACE酶促反应的pH应为中性或者弱碱性。
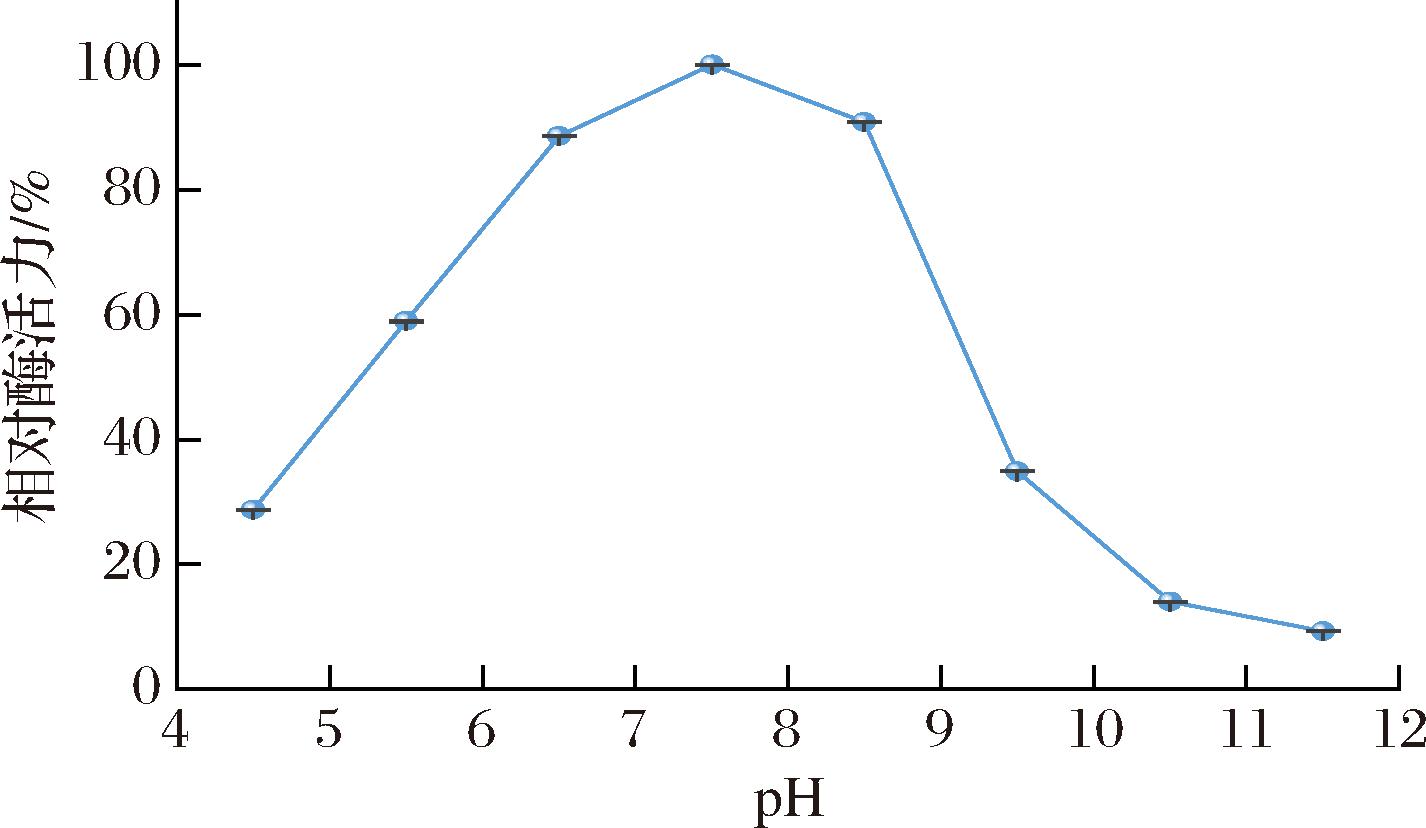
图6 pH对ACE活力的影响
Fig.6 Effect of pH on the activity of ACE
2.5.3 AE酶促反应动力学
图7为ACE与不同浓度的底物HHL反应的动力学图。根据双倒数方程可以计算得到纯化后ACE的米氏常数Km为2.05 mmol/L,最大反应速率Vmax为4.64 nmol/L。
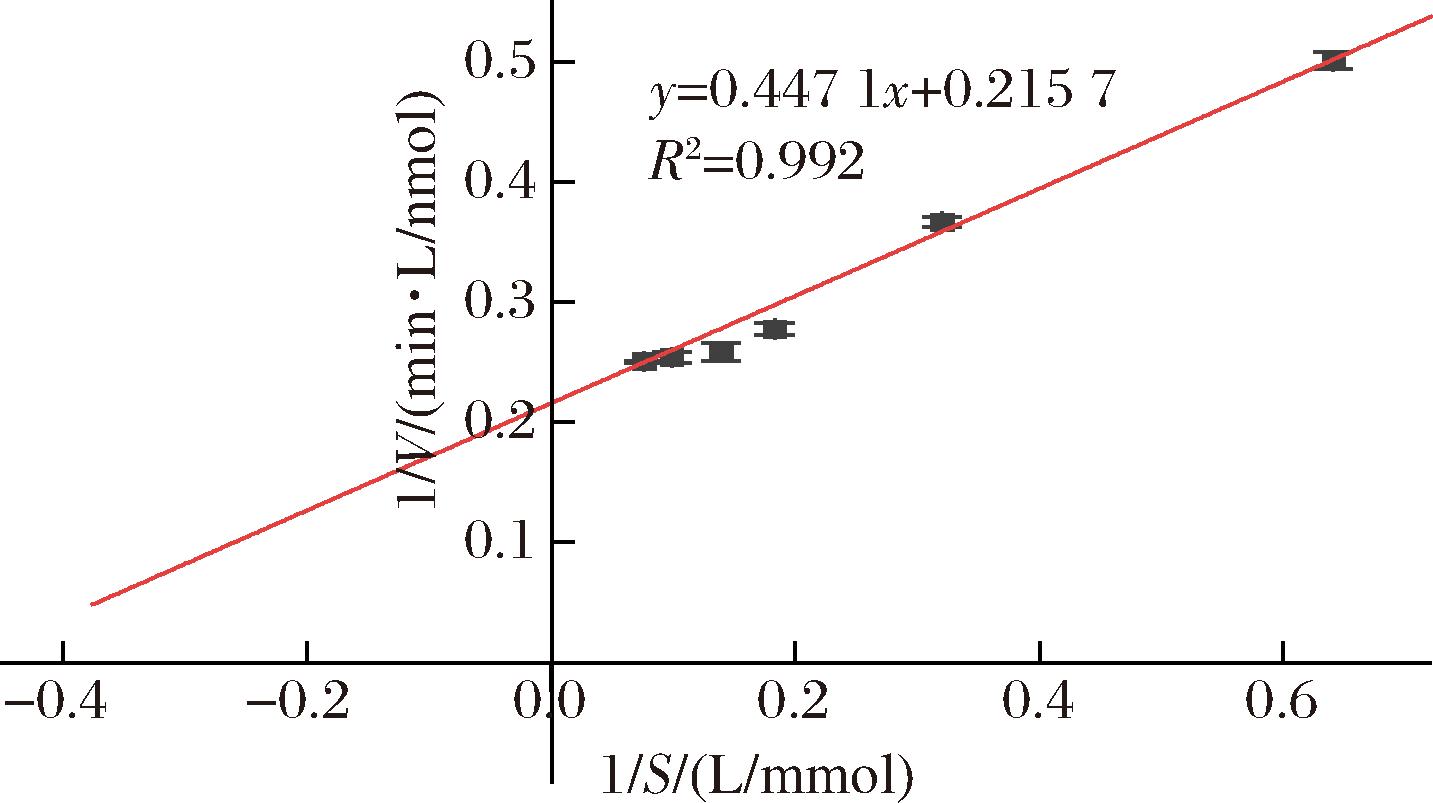
图7 ACE酶促反应动力学Lineweaver-Burk图
Fig.7 ACE enzymatic reaction kinetics Lineweaver-Burke diagram
2.6 AGP和GSH对猪肺ACE活性的影响
AGP是已知从鱼露中鉴定的ACE抑制肽[20],分别检测了AGP和GSH对猪肺ACE活性的抑制效果。如图8所示,AGP和GHS均可以抑制ACE的活性。根据公式(2)计算结果可得AGP和GSH分别对ACE的IC50值为564.0 μmol/L和26.2 μmol/L。从图9可以看出,AGP的抑制类型是可逆的竞争型,而GSH的抑制类型是可逆的非竞争型,根据图9计算出AGP和GSH的抑制常数Ki分别为127.0、15.5 μmol/L。表2为AGP和GSH的研究结果汇总,由此可见,GSH对不同来源的ACE的活性均具有抑制作用,其IC50值为7.6~32.4 μmol/L,Ki值为6.7~49.2 μmol/L,GSH对猪肺ACE抑制活性更接近于人血浆来源ACE的活性抑制效果,这一结果表明GSH可能对高血压具有积极辅助治疗作用。
表2 ACE抑制剂的IC50和Ki值比较
Table 2 Comparison of IC50 and Ki values of ACE inhibitors
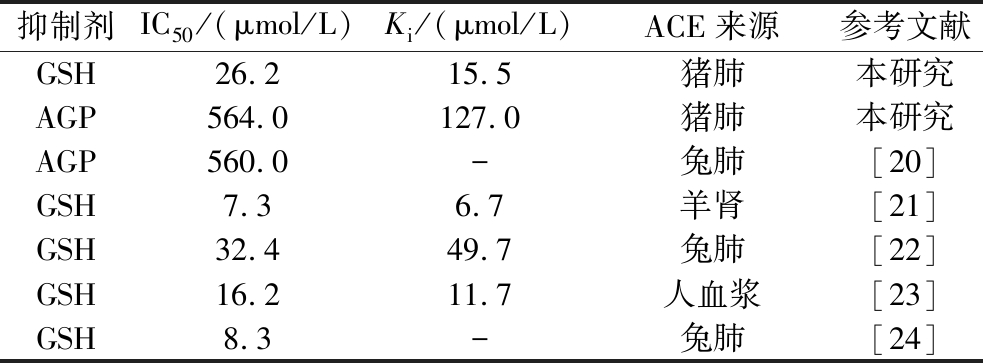
抑制剂IC50/(μmol/L)Ki/(μmol/L)ACE来源参考文献GSH26.2 15.5 猪肺本研究AGP564.0 127.0 猪肺本研究AGP560.0 -兔肺[20]GSH7.3 6.7 羊肾[21]GSH32.4 49.7 兔肺[22]GSH16.2 11.7 人血浆[23]GSH8.3 -兔肺[24]
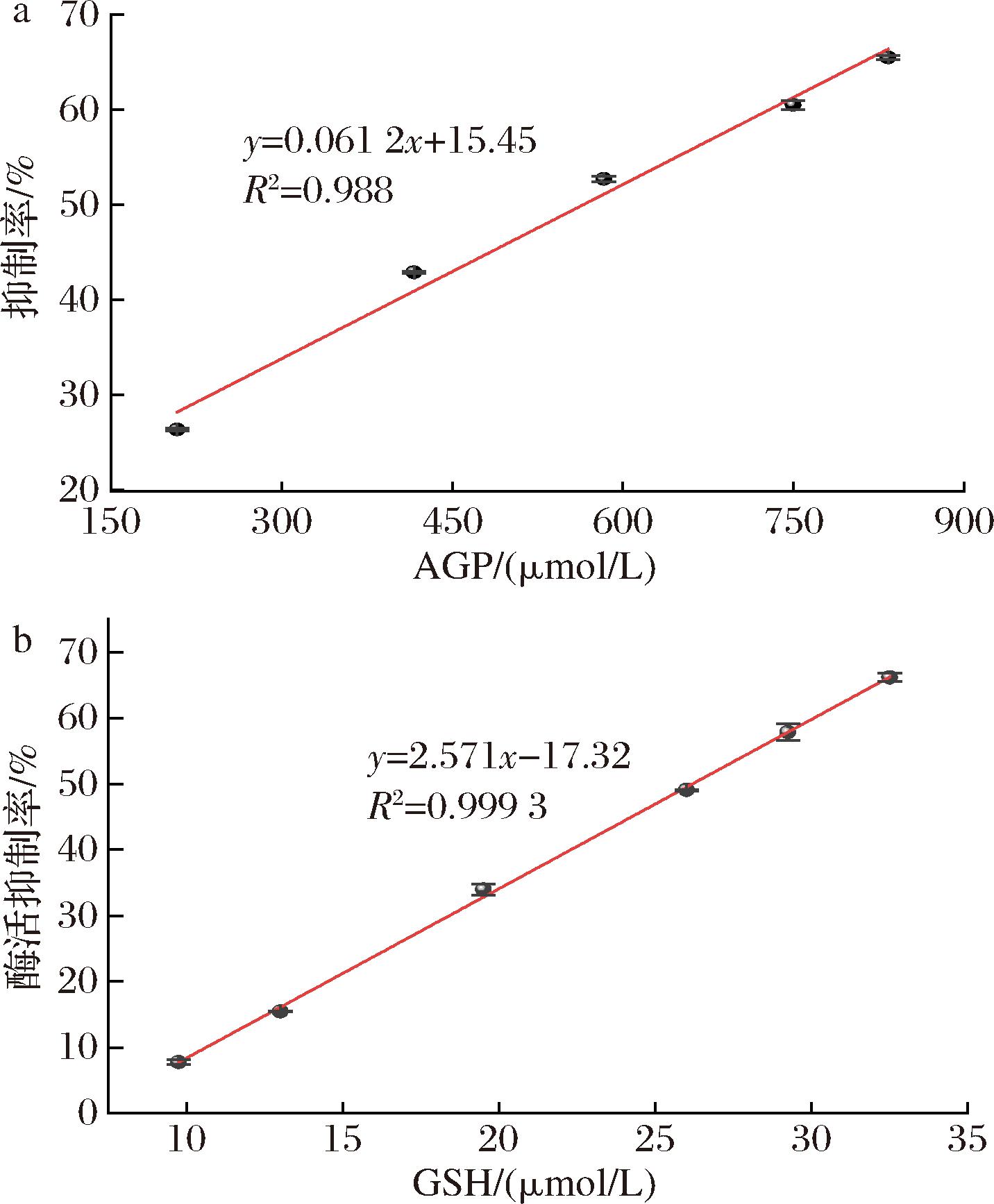
a-不同浓度AGP(200~850 μmol/L);b-不同浓度GSH(9.75~32.5 μmol/L)
图8 AGP和GSH对ACE的抑制率图
Fig.8 Plots of the inhibition rates of AGP and GSH on ACE
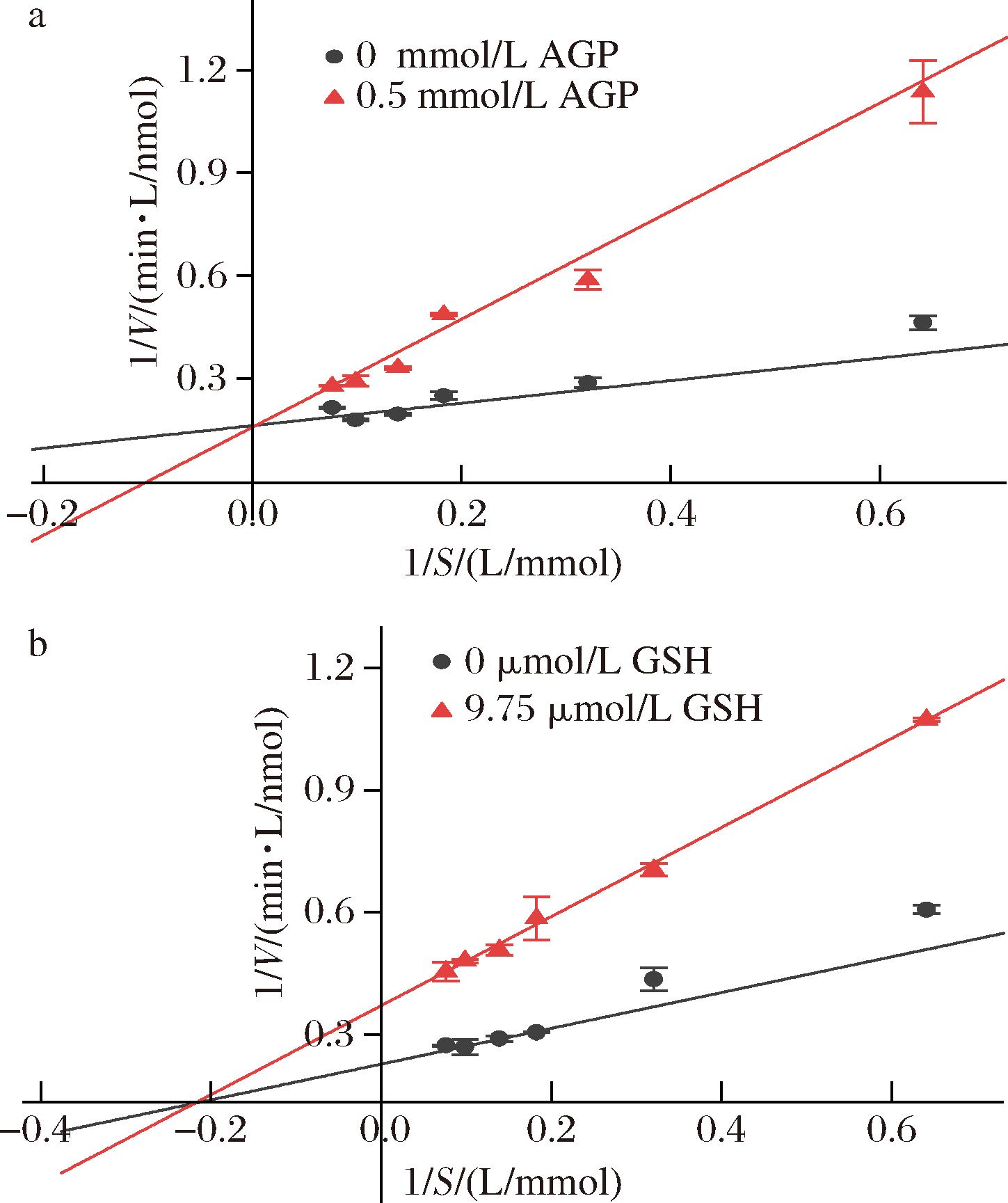
a-AGP;b-GSH
图9 抑制剂存在时ACE与底物HHL(1.56~13.1 mmol/L)反应的Lineweaver-Burk图
Fig.9 Lineweaver-Burk plots of the reaction of ACE with the substrate HHL(1.56-13.1 mmol/L) in the presence of inhibitors
3 结论
本研究通过优化ACE纯化过程盐析,离子交换层析及超滤的条件,得到ACE比活为1.9 U/mg,酶活回收率达到43.3%,纯化倍数提高至475倍。SDS-PAGE结果表明ACE的分子质量为160 kDa,ACE纯度达到电泳级别。纯化后ACE的最适反应温度为37 ℃,最适反应pH值为7.5,测定ACE的动力学参数Km为2.05 mmol/L,Vmax为4.64 nmol/L。以ACE抑制肽AGP为对照组,研究了抗氧化肽GSH对ACE活性的抑制作用,ACE抑制肽AGP和抗氧化肽GSH能够抑制ACE的活性,其对ACE的IC50值分别564.0 μmol/L和26.2 μmol/L,Ki值分别为127.0、15.5 μmol/L,抑制竞争类型分别为竞争性和非竞争性抑制。与其他来源ACE相比,GSH对猪肺ACE抑制活性更接近于人血浆来源ACE的活性抑制效果,研究表明GSH可能是一种对高血压具有积极辅助治疗作用的抗氧化多功能肽。
[1] 李国境. 老年高血压患者的临床特征和并发症分析[J].中国冶金工业医学杂志, 2023, 40(2):148-150.LI G J.Clinical characteristics and complications of elderly patients with hypertension[J].Chinese Medical Journal of Metallurgical Industry, 2023, 40(2):148-150.
[2] 张记收, 王梦龙, 刘剑芳, 等.基于2019年全球疾病负担研究数据分析1990—2019年中国高血压心脏病疾病负担变化趋势[J].中华高血压杂志, 2023, 31(2):141-149.ZHANG J S, WANG M L, LIU J F, et al.The 1990—2019 trends in the burden of hypertensive heart disease in China based on data from the Global Burden of Disease Study 2019[J].Chinese Journal of Hypertension, 2023, 31(2):141-149.
[3] CAREY R M, MORAN A E, WHELTON P K.Treatment of hypertension:A review[J].The Journal of the American Medical Association, 2022, 328(18):1849-1861.
[4] KHURANA V, GOSWAMI B.Angiotensin converting enzyme (ACE)[J].Clinica Chimica Acta, 2022, 524:113-122.
[5] FENG X Z, LIAO D K, SUN L X, et al.Affinity purification of angiotensin converting enzyme inhibitory peptides from wakame (Undaria pinnatifida) using immobilized ACE on magnetic metal organic frameworks[J].Marine Drugs, 2021, 19(3):177.
[6] 管骁, 彭剑秋, 金周筠, 等.食源性血管紧张素转化酶抑制肽的研究进展[J].食品与发酵工业, 2011, 37(7):135-141.GUAN X, PENG J Q, JIN Z Y, et al.Studies on ACE inhibitory peptide derived from food protein[J].Food and Fermentation Industries, 2011, 37(7):135-141.
[7] ABDULAZEEZ M A, KURFI B G.Isolation, partial purification and characterization of angiotensin converting enzyme from rat (Rattus norvegicus) lungs[J].Bayero Journal of Pure and Applied Sciences, 2017, 9(2):24.
[8] NGUYEN V M, TRAN T T, VO H N.The study of angiotensin converting enzyme isolation from crossbred rabbit lung and enzyme storage capacity in frozen conditions[J].Food Research, 2020, 4(4):1082-1088.
[9] RODRIGO R, PRAT H, PASSALACQUA W, et al.Decrease in oxidative stress through supplementation of vitamins C and E is associated with a reduction in blood pressure in patients with essential hypertension[J].Clinical Science, 2008, 114(10):625-634.[10] CHENG S B, LIU H T, CHEN S Y, et al.Changes of oxidative stress, glutathione, and its dependent antioxidant enzyme activities in patients with hepatocellular carcinoma before and after tumor resection[J].PLoS One, 2017, 12(1):e0170016.
[11] 周利琴, 廖丹葵, 孙建华, 等.猪肺血管紧张素转化酶的提取与纯化[J].南方农业学报, 2014, 45(4):639-642.ZHOU L Q, LIAO D K, SUN J H, et al.Extraction and purification of angiotensin converting enzyme from fresh hog lung[J].Journal of Southern Agriculture, 2014,45(4):639-642.
[12] REINMUTH-SELZLE K, TCHIPILOV T, BACKES A T, et al.Determination of the protein content of complex samples by aromatic amino acid analysis, liquid chromatography-UV absorbance, and colorimetry[J].Analytical and Bioanalytical Chemistry, 2022, 414(15):4457-4470.
[13] 徐晓晴. 血管紧张素转化酶与其抑制肽Leu-Lys-Pro(LKP)作用机理的研究[D].南宁:广西大学, 2021.XU X Q.Study on the inhibition mechanism of angiotensin conversion enzyme with inhibitor peptide Leu-Lys-Pro(LKP)[D].Nanning:Guangxi University, 2021.
[14] 廖丹葵, 熊珍爱, 周利琴, 等.猪肺血管紧张素转化酶纯化工艺中试放大研究[J].食品工业科技, 2018, 39(12):185-188.LIAO D K, XIONG Z A, ZHOU L Q, et al.Pilot-scale study on purification of angiotensin converting enzyme (ACE) from pig lung[J].Science and Technology of Food Industry, 2018, 39(12):185-188.
[15] YOSHIMOTO N, YADA T, YAMAMOTO S.A simple method for predicting the adsorption performance of capture chromatography of proteins[J].Japan Journal of Food Engineering, 2016, 17(3):95-98.
[16] KO K Y, KIM I H.The effect of pH and temperature on lysozyme separation in ion-exchange chromatography[J].Korean Chemical Engineering Research, 2014, 52(1):98-105.
[17] ![]()
 ,
, ![]() P, et al, et al.Effect of temperature on the equilibrium and kinetics of galactose, glucose, and lactose adsorption on a cation exchanger[J].Chemical Papers, 2014, 68(12):1649-1655.
P, et al, et al.Effect of temperature on the equilibrium and kinetics of galactose, glucose, and lactose adsorption on a cation exchanger[J].Chemical Papers, 2014, 68(12):1649-1655.
[18] GRÖNHAGEN-RISKA C, FYHRQUIST F.Purification of human lung angiotensin-converting enzyme[J].Scandinavian Journal of Clinical and Laboratory Investigation, 1980, 40(8):711-719.
[19] HWANG K J, WU R M.Use of models in the design of cross-flow microfilters for the purification of protein from bio-mixtures[J].Journal of the Chinese Institute of Chemical Engineers, 2007, 38(2):125-133.
[20] ICHIMURA T, HU J N, AITA D Q, et al.Angiotensin I-converting enzyme inhibitory activity and insulin secretion stimulative activity of fermented fish sauce[J].Journal of Bioscience and Bioengineering, 2003, 96(5):496-499.
[21] BAS Z.Inhibition effect of nicotinamide (vitamin B3) and reduced glutathione (GSH) peptide on angiotensin-converting enzyme activity purified from sheep kidney[J].International Journal of Biological Macromolecules, 2021, 189:65-71.
[22] HOU W C, CHEN H J, LIN Y H.Antioxidant peptides with angiotensin converting enzyme inhibitory activities and applications for angiotensin converting enzyme purification[J] Journal of Agricultural and Food Chemistry, 2003, 51(6):1706-1709.
[23] BASI Z, TVRKOGLU B.In vitro effect of oxidized and reduced glutathione peptides on angiotensin converting enzyme purified from human plasma[J].Journal of Chromatography B, 2019,1104:190-195.
[24] OKAJIMA C, IMAKAWA N, NAGANO K, et al.Inhibitory activity and proposed binding model of γ-glutamyl cysteine, the precursor of glutathione, on angiotensin converting enzyme:report[J].BPB Reports, 2021, 4(4):116-119.