黄曲霉(Aspergillus flavus)是一种广泛生存于土壤中的曲霉属真菌,其代谢产生的黄曲霉毒素已被世界卫生组织划定为Ⅰ类致癌物,其中以黄曲霉毒素B1毒性最强,其半数致死量为0.36 mg/kg体重。由于黄曲霉通常侵染于牧草、坚果等植物导致肉类、油类以及奶制品极易受到黄曲霉毒素污染。因此,着力减少黄曲霉毒素污染,降低环境中黄曲霉产毒菌的丰度已经成为当前食品安全领域亟待解决的问题。
生防菌(biocontrol bacteria)指能够抑制或消除病原微生物,降低植物病害发生的有益微生物。相比于利用化学及物理方式控制黄曲霉产毒菌污染,借助生防菌阻控具有绿色、高效等优势。郑爱芳等[1]研究发现,贝莱斯芽孢杆菌(Bacillus velezensis)B419能够通过抑制黄曲霉的孢子萌发率并抑制其生长进而对采后花生籽粒中黄曲霉进行有效防控。杜瑞焕等[2]通过分离河北省多地花生果实内生菌,获得一株具有较强阻控功能的解淀粉芽孢杆菌(Bacillus amyloliquefaciens)B25-5,其对黄曲霉生长抑制率可达95.5%,但其抑菌机制尚不明确。姚彦坡等[3]通过采集河北、山东、山西等地的玉米种子,分离其中内生菌,得到一株能够显著抑制玉米籽粒中黄曲霉污染的解淀粉芽孢杆菌,其抑毒率可达75.5%。此外,田间实验表明,该菌株还对玉米植株具有较好的促生效果,应用潜力极高。然而,当前筛选黄曲霉阻控细菌的工作已经取得一定的进展,但关于生防菌抑制黄曲霉生长或产毒机制仍需要更多深入的研究。
蜡样芽孢杆菌(Bacillus cereus)是一类植物促生菌,陈兰等[4]研究表明,蜡样芽胞杆菌具有促进苜蓿等植物生长、耐盐碱环境以及提升植株固氮能力等功能。同时大量研究也表明,该菌亦存在较大的生防潜力。周瑚等[5]的研究表明,蜡样芽胞杆菌菌株YN917能够抑制稻瘟病菌菌丝的发育,其代谢产物对稻瘟病的防止效果可达65.61%~68.51%。此外,王卓妮等[6]的研究表明,蜡样芽胞杆菌菌株G3-17能够显著抑制草莓褐色叶斑病病原菌(Pilidium concavum)、灰葡萄孢菌(Botrytis cinerea)、尖孢镰刀菌(Fusarium oxysporum)、链格孢菌(Alternaria alternate)等病原菌,从而减少草莓叶斑病的发生。类似的研究也在猕猴桃[7]、番茄[8]、苹果等植物病害的防控研究中有过报道。截止目前,部分证据显示,蜡样芽胞杆菌对黄曲霉同样存在较好的抑制效果[9]。然而,对于该菌抑制黄曲霉生长并阻控其污染的相关机制研究尚鲜有报道。
基于上述现状,本研究拟采用一株分离自田间花生植株且具有较好抑菌效果的蜡样芽孢杆菌AR1002为材料,用其代谢物处理,对黄曲霉进行液体和固体培养,通过对其抑菌表型以及显微结构观察并结合转录组学分析。对该菌株抑制黄曲霉生长的生理及分子机制进行探索,以期为蜡样芽胞杆菌应用于阻控黄曲霉及黄曲霉毒素污染的后续研究与应用提供理论基础及参考依据。
1 材料与方法
1.1 材料
黄曲霉(Aspergillus flavus)NRRL3357来自本实验室保存菌种,蜡样芽胞杆菌(Bacillus cereus)AR1002,中国典型培养物保藏中心(CCTCC)M 20231596。
1.2 培养基
LB培养基(g/L):胰蛋白胨10.0,酵母提取物5.0,NaCl 10.0,调节pH值至7.0。液体沙氏(Sabouraud dextrose broth, SDB)培养基(g/L):蛋白胨10.0,葡萄糖40.0。DG18琼脂培养基(g/L):酪蛋白胨 5.0,无水葡萄糖10.0,KH2PO4 1.0 g,MgSO4·H2O 0.5 g,氯硝胺0.002,无水甘油200,琼脂 15,氯霉素 0.1。
1.3 蜡样芽胞杆菌AR1002代谢产物的获取
将保存菌种以1%接种量接到LB液体培养基中活化至第三代。28 ℃,150 r/min扩大培养38 h。12 000 r/min离心获取上清液,以0.22 μm水相滤膜过滤除菌,冷冻干燥至粉末状,收集备用。
1.4 固体培养条件下AR1002代谢产物抑菌及产孢能力测定
以黄曲霉为指示菌,90 mm培养皿中导入DG18培养基7 mL,处理组待凝固前加入200 μL AR1002代谢物溶液(根据前期预实验结果20 mg/mL浓度抑菌效果最为显著),对照组以等量超纯水代替。培养基凝固后将直径为0.7 cm,浸有106浓度黄曲霉孢子液的滤纸片置于培养皿中心,37 ℃培养3 d。以直尺测量黄曲霉菌圈直径,并置于光学显微镜下拍照。后以0.1%(体积分数)的吐温-80溶液洗脱平板内黄曲霉孢子,以血球计数板测定孢子数量。对照组及处理组各设置3个生物学重复。
1.5 液体培养条件下黄曲霉菌丝干物质测定及转录组样品的获取
于150 mL锥形瓶中加入50 mL SDB培养基,其中处理组含1 mL AR1002代谢物溶液(10 mg/mL),对照组以等量超纯水代替。于无菌环境下接种106黄曲霉孢子液100 μL,于37 ℃,150 r/min摇培60 h,纱布过滤,拧干。对照组和处理组各设置10个生物学重复。其中3个生物学重复冻干后用电子天平测定干物质。其余生物学重复以液氮淬灭,保存于-80 ℃条件下,用以进行转录组学测序。
1.6 AR1002代谢产物处理下黄曲霉转录组学的测定及分析
转录组学数据送交深圳华大科技服务有限公司。质控合格的RNA及mRNA用于后续建库并进行转录组测序,测序结果的原始数据经进一步过滤后得到Clean Reads。将Clean Reads与参考基因组进行比对并获得用于后续分析的mapped data(reads)。基于负二项分布的DESeq2软件进行统计分析,以|log2(Fold Change)|≥1.5且P<0.05为筛选标准,以获得显著差异表达基因并进行后续分析。
2 结果与分析
2.1 蜡样芽孢杆菌代谢产物对黄曲霉生长抑制表型
AR1002代谢产物在固体及液体培养条件下均能够产生较好的抑制黄曲霉效果。相比于对照组,处理组较对照组菌圈直径(图1-a)、菌丝干物质(图1-b)以及孢子数(图2)分别降低了24.73%、65.00%以及98.80%。表明AR1002代谢产物能够显著抑制黄曲霉的营养菌丝、气生菌丝生长并极大程度减少孢子萌发。
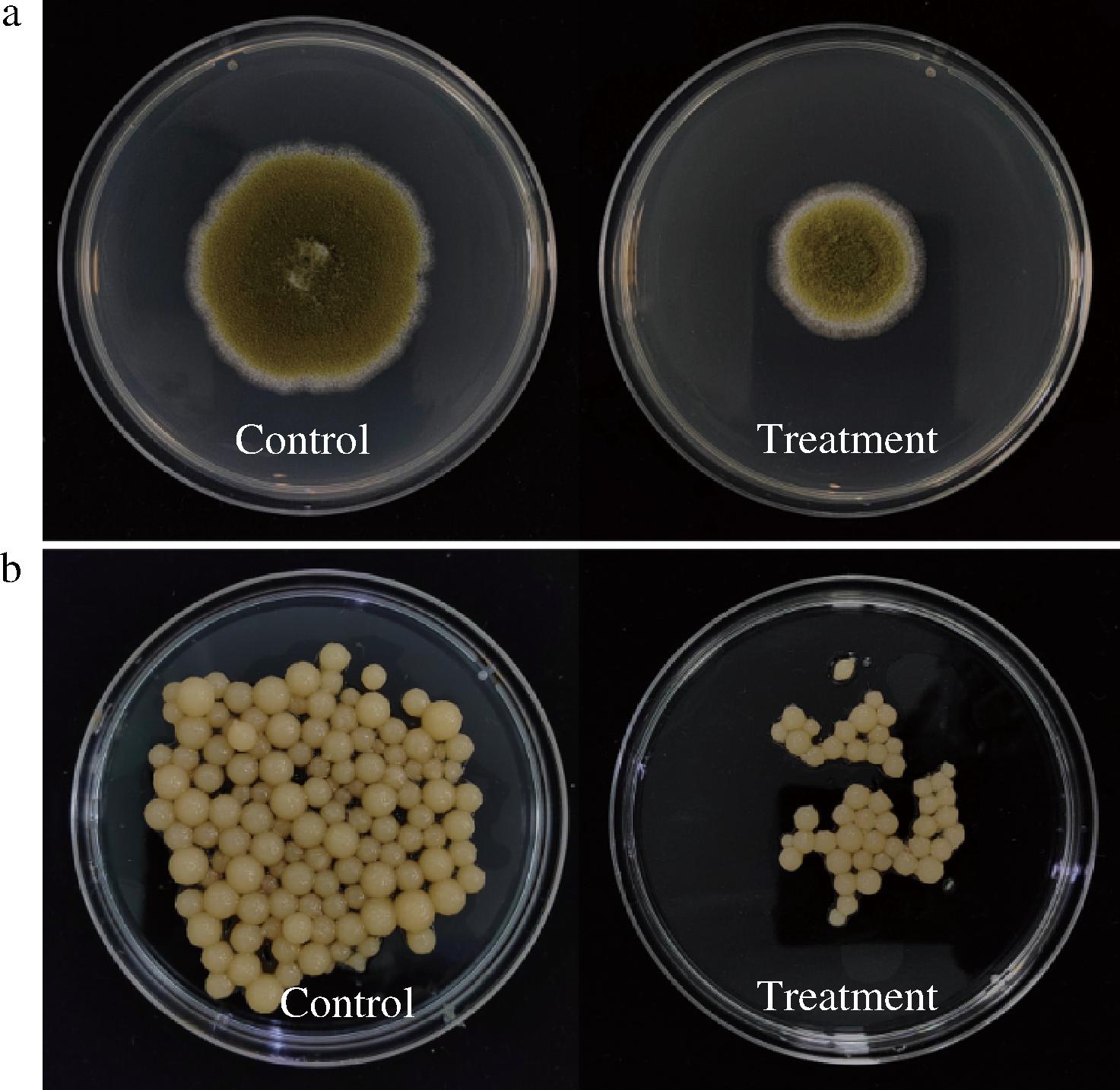
a-固体;b-液体
图1 固体及液体培养下AR1002代谢物的抑菌表型
Fig.1 Inhibitory phenotypes of AR1002 metabolites in solid and liquid cultures
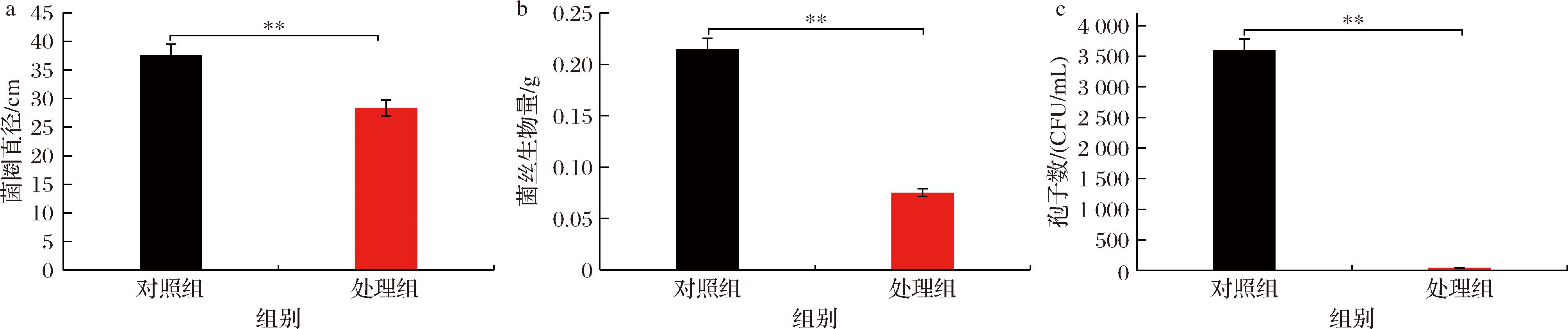
a-菌圈直径;b-菌丝生物量;c-孢子数
图2 AR1002对黄曲霉菌圈生长直径、菌丝生物量积累以及产孢的影响
Fig.2 Effects of AR1002 on growth diameter, mycelial biomass accumulation and spore production of Aspergillus flavus
注:**表示P≤0.01水平差异显著。
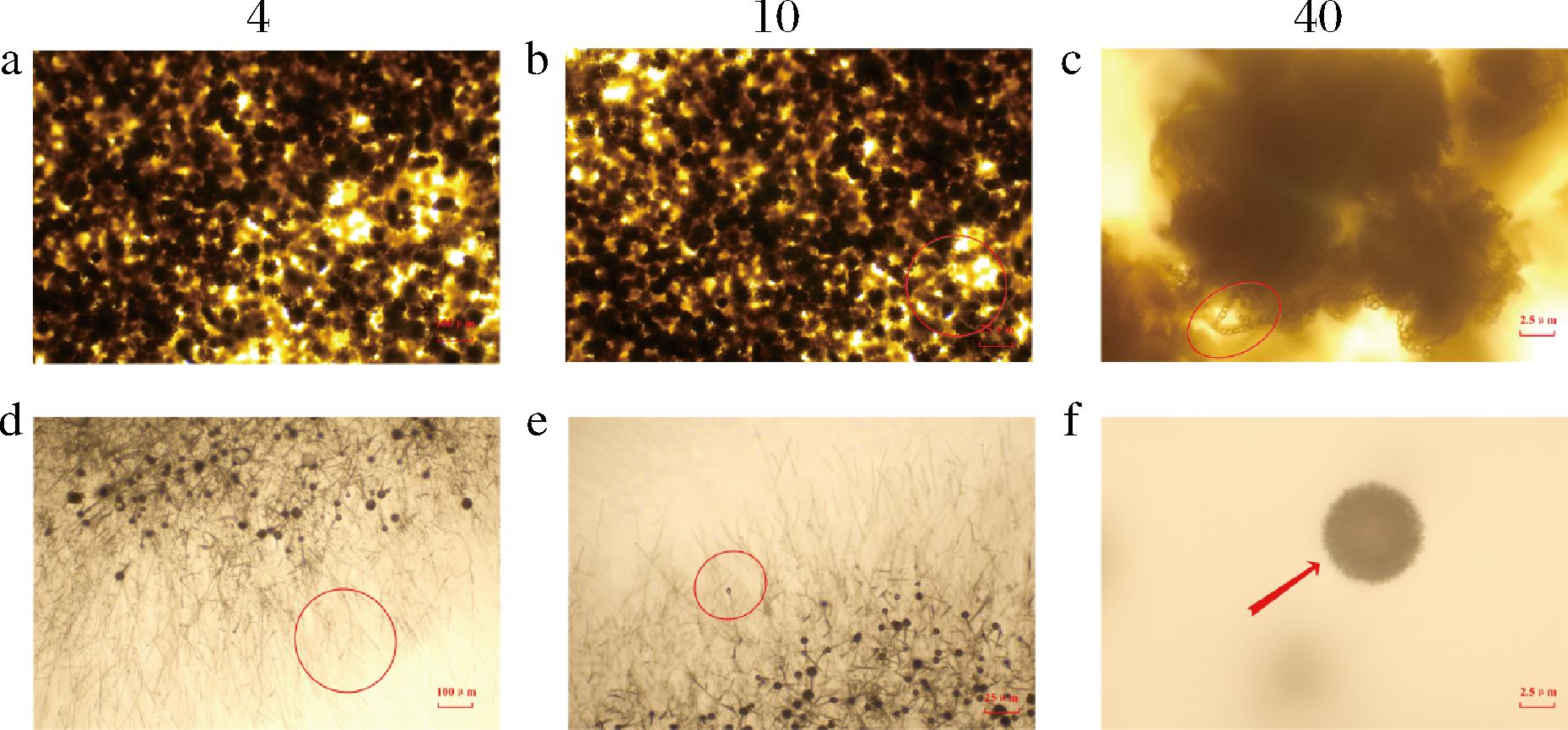
a-对照组(4×);b-对照组(10×);c-对照组(40×);d-处理组(4×);e-处理组(10×);f-处理组(40×)
图3 AR1002对黄曲霉孢子形态显微结构的影响
Fig.3 Effect of AR1002 on morphology and microstructure of A. flavus spores
2.2 蜡样芽孢杆菌代谢产物处理下黄曲霉菌丝及孢子显微结构分析
如图3所示,该图为4、10以及40倍光学显微镜下AR1002及对照组固体平板菌丝生长及孢子萌发情况的显微结构。如图3-a和图3-d所示,相比于对照组,处理组孢子数量显著降低,且图中清晰可见大量未现孢子数的菌丝。这说明AR1002能够明显抑制黄曲霉菌丝发育形成孢子束。如图3-b和图3-e所示,相比对照组,处理组孢子束形态欠佳。孢子梗发育明显受到抑制。图3-c和图3-f也进一步表明,相比对照组,处理组孢子束发育不良,孢子梗短小且孢子量显著减少。这说明AR1002代谢物能够显著抑制黄曲霉孢束的形成以及孢子梗的发育进而显著减少孢子数量。
2.3 转录组学测序结果分析
样品RNA经过测序共得到原始数据(Raw readers)、过滤后纯净数据(clean readers)、高质量纯净碱基数(clean bases)等数据质量信息如表1所示。综合评定后,本次实验获得数据质量良好,可用于后续研究分析。
表1 转录组数据质量分析
Table 1 Transcriptome data quality analysis
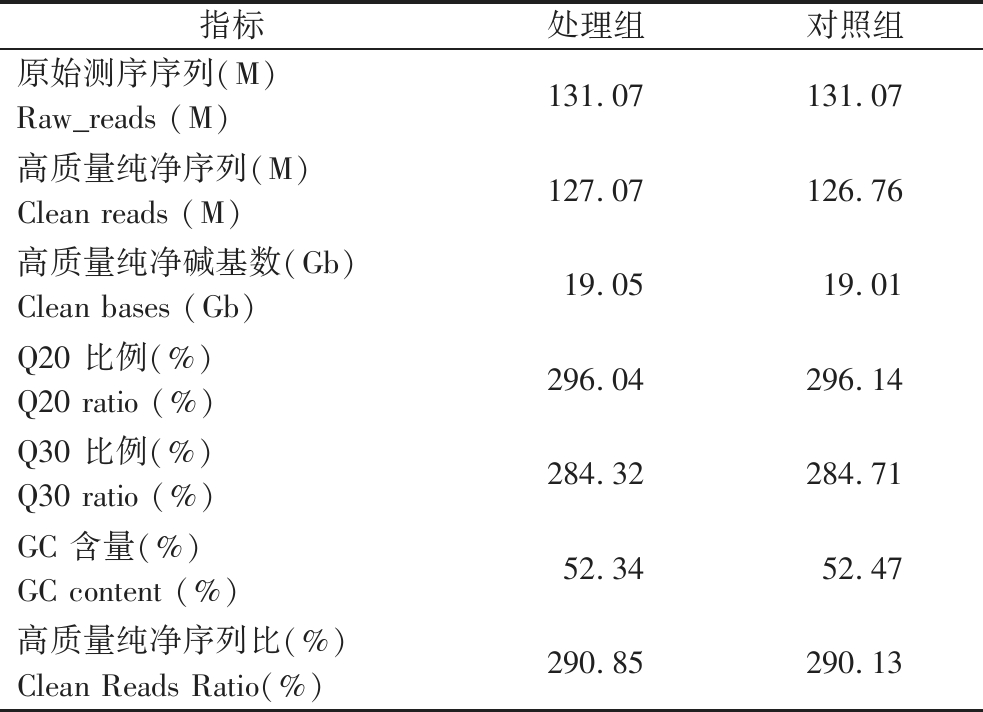
指标 处理组对照组原始测序序列(M)Raw_reads (M)131.07131.07高质量纯净序列(M)Clean reads (M)127.07126.76高质量纯净碱基数(Gb)Clean bases (Gb)19.0519.01Q20 比例(%)Q20 ratio (%)296.04296.14Q30 比例(%)Q30 ratio (%)284.32284.71GC 含量(%)GC content (%)52.3452.47高质量纯净序列比(%)Clean Reads Ratio(%)290.85290.13
以|log2(Fold Change)|>1、padj<0.05为标准进行筛选,共得到474个差异表达基因。其中,相比对照组,上调320个,下调154个(图4 -a)。GO分类显示,差异基因分为生物过程:信号功能,应激反应,生殖过程,繁殖,代谢过程,局部化,发育过程,解毒作用以及细胞过程;细胞组分本体共包含蛋白质复合物以及细胞结构体;分子功能本体则包括转运活性,翻译调节活性,转录调节活性,结构分子活性,分子传感器活性,分子功能调节剂以及催化活性(图4-b)。差异基因GO功能富集分析表明,差异基因主要富集于黄曲霉毒素生物合成及代谢、活性氧代谢以及有机杂五环化合物的生物合成及代谢和硫化物代谢等生物过程。

a-差异表达基因火山图;b-差异基因GO注释分类结果;c-差异基因GO富集
图4 差异表达基因火山图、差异基因GO注释分类结果、差异基因GO富集结果
Fig.4 Volcano map of differentially expressed genes,differential gene GO annotation classification results,and differential gene GO enrichment results
差异表达基因KEGG通路富集分析表明,差异表达基因主要富集于甘油磷脂代谢、内质网蛋白质加工以及抗坏血酸与醛酸盐代谢等通路中。甘油磷脂是生物膜的重要组分,参与膜与蛋白间的识别并执行信号转导功能[10]。甘油磷脂代谢通路中,共富集到23个差异表达基因,上调16个,下调7个。其中编码甘油-3-磷酸脱氢酶和1-酰基甘油磷酸还原酶相关基因(glpA和AYR1)全部下调。内质网对蛋白质的加工和修饰是保障蛋白能够被正确识别和执行相应功能的关键步骤[11]。本研究中,内质网蛋白质加工通路共富集到16个差异表达基因,其中上调12个下调4个,编码蛋白质转运蛋白SEC61亚基α、UV切除修复蛋白RAD23、锰转运p型ATP酶以及泛素偶联酶E2 G2基因(SEC61A、RAD23、ATP13A1、UBE2G2)均显著下调。同源重组过程是真核生物最基本的遗传物质交换行为[12],转录组分析表明,该通路下共富集到9个差异表达基因,其中上调5个下调4个,编码DNA修复蛋白RAD51以及DNA修复与重组蛋白RAD54B的相关基因RAD51和RAD54B均显著下调,这很可能是黄曲霉生殖菌丝生长以及产孢能力下降的主要原因。
综合KEGG及GO分析结果不难发现,差异基因主要集中于执行逆境胁迫的响应、生物毒素的代谢、能量代谢、细胞膜组分代谢以及繁殖等生命活动。与对照组相比,AR1002代谢产物能够显著扰动黄曲霉生长过程中的上述生理活动。AR1002很有可能是通过破坏黄曲霉的细胞膜组分,干扰跨膜物质转运进而扰乱细胞内环境稳态,对菌丝生长及繁殖产生了胁迫,最终达到了抑制黄曲霉菌丝生长及产孢的效果。
此外,转录组学分析共检测了不同处理中的五类可变剪切事件。对比发现,相比于对照组AR1002代谢产物处理后的黄曲霉菌体中Skipped Exon(SE)提升了17.09%;Mutually exclusive exons(MXE)提升了21.13%。此外,Alternative 5′ Splicing Site(A5SS)、Alternative 3′ Splicing Site(A3SS)以及Retained Intron(RI)较对照组分别降低了7.54%、8.00%以及8.03%。这意味着AR1002代谢产物处理对黄曲霉菌体的表观遗传层面的转录调控造成较大的影响,这很可能也是黄曲霉生长受到抑制的原因之一。
3 讨论
黄曲霉毒素污染已成为当前广受关注的食品安全问题,以生防菌为手段阻控黄曲霉生长及其毒素污染已成为当前研究的热点。前人发现,蜡样芽胞杆菌能够对玉米茎基腐病菌、禾谷镰孢菌,及玉米南方锈病菌具有显著的抑制效果[13-14]。付克剑等[15]也在对烟草的研究中发现,蜡样芽胞杆菌能够抑制黄曲霉的生长,这与我们的研究结果基本一致。然而,截止目前,有关于蜡样芽胞杆菌抑制黄曲霉生长的生理机制尚不明确。本研究通过表型鉴定试验、显微结构分析以及转录组学分析对蜡样芽胞杆菌抑制黄曲霉生长及产孢的生理及分子机制进行了初步探索,以期为今后该菌株应用于生物防治领域提供参考。
赵帅等[16]的研究表明生防菌HD-087能够产生抗菌物质对黄瓜枯萎病菌菌丝的细胞膜造成损伤,进而对病菌的生长造成抑制。李珅瑀等[17]的研究表明,贝莱斯芽孢杆菌(Bacillus velezensis)菌株5-8能够通过产生脂肽类抗生素-伊枯草菌素对稻瘟病菌的膜结构造成破坏,进而减少病原菌的定植并减轻水稻的发病率。然而,有关与蜡样芽胞杆菌代谢物破坏真菌膜结构的研究较少。本研究表明蜡样芽胞杆菌代谢产物能够通过抑制glpA和AYR1等关键基因表达,进而对黄曲霉菌丝细胞膜主要成分甘油磷脂的代谢通路进行扰动。张丽娜等[18]的研究表明,蜡样芽胞杆菌能够产生脂肽类抗生素并具有显著的抑菌效果。细胞膜结构式抗菌肽的主要作用靶位,其通过膜上正负点位吸附聚集于膜表层,以其疏水部位与磷脂层相互作用进而对细胞膜进行破坏,最后达到抑制或杀死病原菌的效果[19]。这很可能是本研究中黄曲霉生长受到抑制的主要原因之一。
高等生物具有2种主要的DNA断裂修复机制,即同源重组机制以及非同源末端连接机制。其对细胞的生存、繁殖起到了至关重要的作用[20]。然而,到目前为止,在真菌中有关于DNA修复机制的相关研究较少。本研究发现,AR1002代谢产物处理会对黄曲霉菌体中上述2种修复机制产生较大扰动。大量研究显示,此类机制的阻断会致使DNA双链断裂后无法得到高保真修复,产生致命性DNA损伤,导致染色体异常融合及移位导致细胞凋亡[21]。此外,该通路的扰动还会触发激活代偿性聚ADP-核糖聚合酶活性提升以及调控表观遗学层面染色质重塑因子的产生和染色质修饰的动态变化[22],上述因素均有可能是本研究中黄曲霉孢子数量减少的原因。此外,对细胞膜组分的破坏同样会影响分生孢子梗的形成。这也可能对孢子的形成产生一定抑制。
内质网的蛋白质加工过程主要涉及蛋白质的折叠以及修饰等过程[23]。本研究表明AR1002代谢产物处理会对黄曲霉菌体细胞中内质网对蛋白质的加工过程造成较大干预。进而导致编码部分蛋白质转运蛋白、微量元素转运酶以及泛素化相关酶的关键基因表达受到抑制。这也意味着,真菌在对膜外蛋白及小分子的转运以及表观遗传学的调控方面受到较大影响[24]。上述观点能够从可变剪切事件比例的变化(图6)以及氨基酸和氮代谢通路(图5)的扰动中得到支撑。内质网接收来自核糖体加工后的蛋白并对其进行修饰和再加工,对该过程的影响很可能导致跨膜运输通道的阻断、控制细胞稳态相关因子的紊乱以及影响蛋白质修饰的进行[25]。这些因素对于细胞执行正常的生命代谢活动均会产生致命的影响。由此可见,AR1002代谢产物对内质网蛋白加工的影响很有可能是本研究中黄曲霉菌丝生长受阻的主要原因之一。
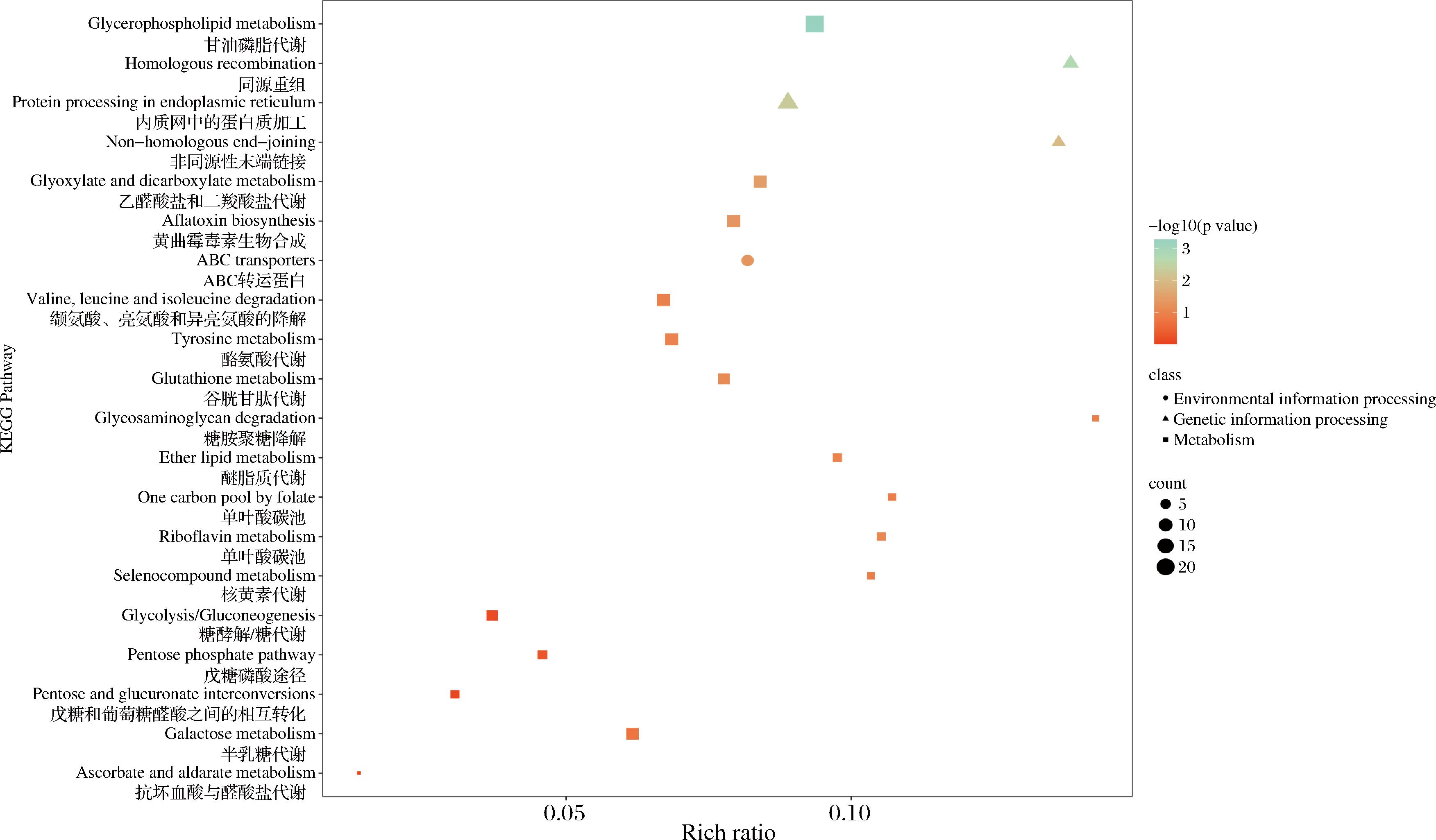
图5 差异基因KEGG通路富集分析及分类
Fig.5 Enrichment analysis and classification of KEGG pathway of differential genes
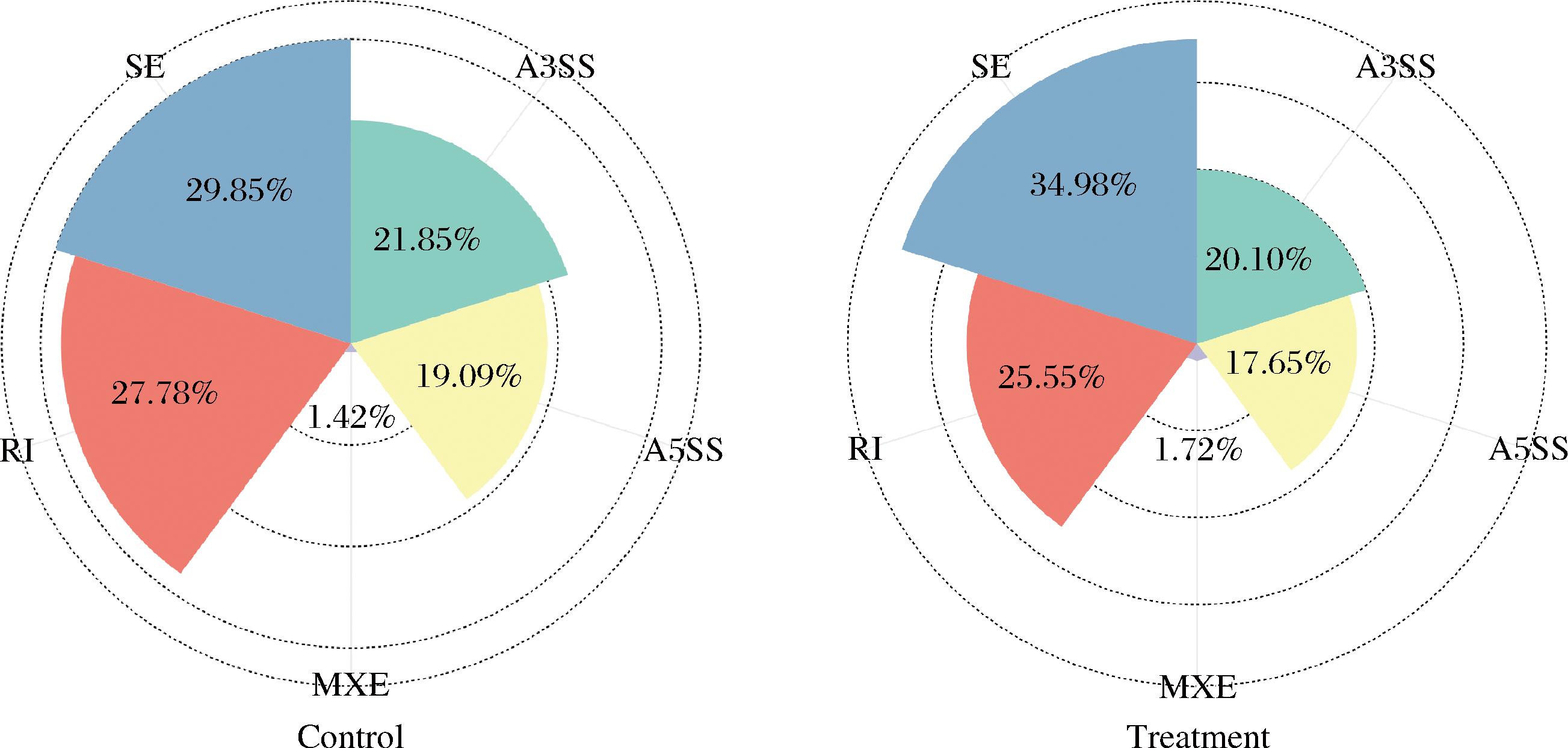
图6 转录组学可变剪切事件检测
Fig.6 Transcriptomic variable shear event detection
4 结论
蜡样芽胞杆菌AR1002代谢产物会对黄曲霉的生长、干物质积累以及孢子数量造成显著抑制,其抑制率分别可达24.73%、65.00%以及98.80%。
蜡样芽胞杆菌AR1002代谢产物会强烈扰动黄曲霉菌丝中甘油磷脂代谢通路,抑制glpA和AYR1等编码编码甘油-3-磷酸脱氢酶和1-酰基甘油磷酸还原酶的关键基因表达。
蜡样芽胞杆菌AR1002代谢产物会对内质网蛋白质加工通路造成显著影响,抑制SEC61A、RAD23、ATP13A1、UBE2G2等关键基因的表达。
蜡样芽胞杆菌AR1002代谢产物能够通过下调RAD51和RAD54B等DNA修复机制相关的关键基因,对黄曲霉同源重组及非同源性末端连接造成影响。
综上,本研究表明,蜡样芽胞杆菌AR1002代谢产物很可能通过破坏黄曲霉菌丝细胞膜、阻断物质转运通道以及DNA双链修复机制,进而显著抑制黄曲霉的生长及产孢以达到阻控黄曲霉污染的目的。
[1] 郑爱芳, 何欢, 高晔, 等.一株防治花生采后黄曲霉污染的拮抗菌的筛选及其防控效果[J].中国油脂, 2024, 49(2):56-62.
ZHENG A F, HE H, GAO Y, et al.Screening of biocontrol bacteria against peanut postharvest Aspergillus flavus contamination and its prevention effect[J].China Oils and Fats, 2024, 49(2):56-62.
[2] 杜瑞焕, 高素艳, 张谊, 等.花生黄曲霉毒素污染拮抗菌B25-5的筛选、鉴定及控制效果[J].中国粮油学报, 2018, 33(8):64-68.
DU R H, GAO S Y, ZHANG Y, et al.Screening, identification and control effect of aflatoxin antagonistic bacteria B25-5 in peanut[J].Journal of the Chinese Cereals and Oils Association, 2018, 33(8):64-68.
[3] 姚彦坡, 丁丹, 张友青, 等.玉米黄曲霉毒素污染生防菌筛选及菌株B42-3抗菌活性研究[J].中国粮油学报, 2018, 33(3):84-88.
YAO Y P, DING D, ZHANG Y Q, et al.Screening of maize endophytic antagonists against Aspergillus flavus and activities research of antagonistic strain B42-3[J].Journal of the Chinese Cereals and Oils Association, 2018, 33(3):84-88.
[4] 陈兰, 谢永丽, 吴晓晖, 等.4株促紫花苜蓿生长的芽孢杆菌分子鉴定及其生物活性分析[J].西北农业学报, 2023, 32(2):212-221.
CHEN L, XIE Y L, WU X H, et al.Molecular identification and bioactivity analysis of four Bacillus strains promoting the growth of alfalfa[J].Acta Agriculturae Boreali-occidentalis Sinica, 2023, 32(2):212-221.
[5] 周瑚, 刘剑波, 谭陈勇, 等.蜡样芽孢杆菌YN917对水稻稻瘟病菌的拮抗机理及应用[J].农药, 2023, 62(3):213-216.
ZHOU H, LIU J B, TAN C Y, et al.Antagonistic mechanisms and biocontrol effect of Bacillus cereus strain YN917 upon Magnaporthe oryzae[J].Agrochemicals, 2023, 62(3):213-216.
[6] 王卓妮, 覃艮红, 王丽, 等.草莓病害拮抗细菌的筛选及其对草莓褐色叶斑病的防效[J].中国蔬菜, 2023(2):63-71.
WANG Z N, QIN G H, WANG L, et al.Screening of antagonistic bacteria from strawberry and their biocontrol effect against tan-brown leaf spot of strawberry[J].China Vegetables, 2023(2):63-71.
[7] 朱海云, 马瑜, 柯杨, 等.抗猕猴桃细菌性溃疡病蜡样芽孢杆菌MA23培养基及发酵条件优化[J].中国农学通报, 2021, 37(7):112-118.
ZHU H Y, MA Y, KE Y, et al.Optimization of culture medium and fermentation parameters of Bacillus cereus MA23 antagonistic to kiwifruit canker[J].Chinese Agricultural Science Bulletin, 2021, 37(7):112-118.
[8] 潘晓梅, 李昭煜, 石晓玲, 等.番茄灰霉生防菌XF的筛选、鉴定及生防因子的初步探索[J].西北农业学报, 2019, 28(11):1888-1895.
PAN X M, LI Z Y, SHI X L, et al.Screening, identification and biocontrol effects of antagonistic bacterial strain XF and preliminary exploration of biocontrol factors[J].Acta Agriculturae Boreali-occidentalis Sinica, 2019, 28(11):1888-1895.
[9] 王明清, 张初署, 于丽娜, 等.降解黄曲霉毒素B1芽孢杆菌的筛选与鉴定[J].山东农业科学, 2018, 50(11):71-75.
WANG M Q, ZHANG C S, YU L N, et al.Screening and identification of Bacillus strain for degradation of aflatoxin B1[J].Shandong Agricultural Sciences, 2018, 50(11):71-75.
[10] 王英, 黄旭辉, 李冬梅, 等.磷脂氧化降解机制及调控技术研究进展[J/OL].食品科学, 2023:1-16.(2023-10-11).https://kns.cnki.net/kcms/detail/11.2206.TS.20231010.0914.020.html.
WANG Y, HUANG X H, LI D M, et al.Research progress on the mechanism and regulation technology of phospholipid oxidative degradation[J/OL].Food Science, 2023:1-16.(2023-10-11).https://kns.cnki.net/kcms/detail/11.2206.TS.20231010.0914.020.html.
[11] 牟亚豪, 刘帼芬, 孙艺菲, 等.内质网蛋白加工通路关键信号分子在镉致胰岛β细胞凋亡过程中的变化研究[J].现代预防医学, 2022, 49(4):711-714;732.
MOU Y H, LIU G F, SUN Y F, et al.Changes in key molecules of protein processing in endoplasmic reticulum during cadmium-induced apoptosis in pancreatic β-cells[J].Modern Preventive Medicine, 2022, 49(4):711-714;732.
[12] 耿喜宁, 芦特, 杜康, 等.不同基因型毛白杨同源重组变异研究[J].遗传, 2021, 43(2):182-199.
GENG X N, LU T, DU K, et al.Variation of homologous recombination in Populus tomentosa with different genotypes[J].Hereditas(Beijing), 2021, 43(2):182-199.
[13] 杨冰娟, 陶睿泽, 林丽, 等.芽孢杆菌抑制玉米茎腐病菌禾谷镰孢菌和拟轮枝镰孢菌的研究进展[J].江苏农业科学, 2023, 51(12):42-49.
YANG B J, TAO R Z, LIN L, et al.Research progress on inhibition effects of Bacillus spp.against maize stalk rot pathogen (Fusarium graminearum &F.verticillioides)[J].Jiangsu Agricultural Sciences, 2023, 51(12):42-49.
[14] 赵晨晨, 焦铸锦, 庞发虎, 等.生防菌R-4的鉴定及其对玉米南方锈病的防效[J].玉米科学, 2017, 25(2):136-141.
ZHAO C C, JIAO Z J, PANG F H, et al.Identification of biocontrol strain R-4 and its efficacy in controlling southern corn rust[J].Journal of Maize Sciences, 2017, 25(2):136-141.
[15] 付克剑, 宋学茹, 杨芳, 等.玉溪雪茄烟发酵霉变病原菌鉴定及生防菌筛选[J].中国烟草科学, 2023, 44(4):41-48.
FU K J, SONG X R, YANG F, et al.Identification of pathogenic fungi and screening for biocontrol bacteria during fermentation of Yuxi cigars[J].Chinese Tobacco Science, 2023, 44(4):41-48.
[16] 赵帅, 田长彦, 史应武, 等.黄瓜枯萎病生防菌HD-087产抗菌物质条件的优化及抑菌作用初探[J].微生物学通报, 2013, 40(5):802-811.
ZHAO S, TIAN C Y, SHI Y W, et al.Fermentation conditions for the biocontrol strain HD-087 against cucumber Fusarium wilt and it’s antibacterial effect[J].Microbiology China, 2013, 40(5):802-811.
[17] 李珅瑀, 贾祥子, 郭君陶, 等.水稻稻瘟病生防细菌5-8的鉴定及其生防机制研究[J].北方农业学报, 2021, 49(3):74-81.
LI S Y, JIA X Z, GUO J T, et al.Identification of rice blast control bacteria 5-8 and its biocontrol mechanism[J].Journal of Northern Agriculture, 2021, 49(3):74-81.
[18] 张立娜. 一株蜡样芽孢杆菌的鉴定及其抑菌物质的分离纯化与性质的研究[D].广州:华南理工大学, 2012.
ZHANG L N.Identiifcation of a Bacillus cereus and isolation and study on its antimicrobial substance[D].Guangzhou:South China University of Technology, 2012.
[19] 张良, 潘滢浩, 袁瑜, 等.基于细胞膜损伤机制的抗菌肽结构优化研究进展[J].中国抗生素杂志, 2023, 48(7):721-727.
ZHANG L, PAN Y H, YUAN Y, et al.Research progress on structure modification of antimicrobial peptides targeting membrane disruption[J].Chinese Journal of Antibiotics, 2023, 48(7):721-727.
[20] 钟振兴, 彭鑫, 孔德新.靶向同源重组修复的抗肿瘤研究进展[J].药学学报, 2020, 55(11):2535-2548.
ZHONG Z X, PENG X, KONG D X.Research progress in targeting homologous recombination repair for tumor therapy[J].Acta Pharmaceutica Sinica, 2020, 55(11):2535-2548.
[21] ASHWORTH A, LORD C J.Synthetic lethal therapies for cancer:What’s next after PARP inhibitors?[J].Nature Reviews.Clinical Oncology, 2018, 15(9):564-576.
[22] KLINAKIS A, KARAGIANNIS D, RAMPIAS T.Targeting DNA repair in cancer:Current state and novel approaches[J].Cellular and Molecular Life Sciences:CMLS, 2020, 77(4):677-703.
[23] 魏雯帆, 郑碧玉, 符传孩.内质网与线粒体接触复合物ERMES在真菌中的结构组成和功能[J].中国科学(生命科学), 2022, 52(1):67-75.
WEI W F, ZHENG B Y, FU C H.The structural organization and functions of the ERMES complex in fungi[J].Scientia Sinica (Vitae), 2022, 52(1):67-75.
[24] 李贞, 陈伟琴.自噬与念珠菌致病及耐药的相关性[J].中国医药导报, 2023, 20(14):43-46;51.
LI Z, CHEN W Q.Correlation between autophagy and Candida pathogenicity and drug resistance[J].China Medical Herald, 2023, 20(14):43-46;51.
[25] 周娜娜, 王禄山, 公维丽, 等.丝状真菌胞外蛋白高效分泌机制的研究进展[J].生物化学与生物物理进展, 2016, 43(1):44-54.
ZHOU N N, WANG L S, GONG W L, et al.Research progress on the efficient secretion mechanism of extracellular proteins in filamentous fungi[J].Progress in Biochemistry and Biophysics, 2016, 43(1):44-54.