纳米乳液具有封装、运输和释放功能性成分并提高脂溶性功能成分的生物可及度和溶解度等作用。因其粒径小于100 nm,能减小重力对乳液的不利影响,降低沉淀或絮凝的可能,被广泛应用于食品和医药领域中功能成分的输送[1]。然而由于纳米乳液是不稳定两相体系,在贮藏过程中易发生相分离。此外纳米乳液相较于普通乳液粒径更小,油水接触面积大,内部油相成分更易氧化降解,这在一定程度上限制了纳米乳液在食品和医药等领域的应用[2]。GUO等[3]研究发现在纳米乳液中添加生育酚和芝麻酚可以延缓脂质氧化。DARIO等[4]研究发现槲皮素与油水界面表面活性剂间的相互作用在稳定纳米乳液液滴中发挥了关键作用。因此,通过添加天然抗氧化剂来解决纳米乳液稳定性差、油脂易氧化等问题并探索抗氧化剂对纳米乳液中脂质氧化的影响规律,对延长纳米乳液储存期和提高稳定性具有重要意义。
γ-谷维素(γ-oryzanol,GO)是由阿魏酸与三萜醇或甾醇酯化而成的一种天然物质,在米糠油中含量丰富,约为0.9%~2.9%[5]。GO因具有抗氧化、抗炎、抗糖尿病和降低胆固醇等多种作用[6],被广泛用于医药、食品和化妆品领域。GO作为一种天然抗氧化物质,其抗氧化活性约为维生素E的4倍,且耐热性更好,在食品中作为天然抗氧化剂用以延缓食品的氧化变质方面具有潜在应用价值。KIM等[7]的研究表明相较于合成酚类化合物,GO在水包油乳液中具有更好的抗氧化效果。ZHONG等[8]通过低能乳化法生产的GO纳米乳液在5、23、37 ℃下贮藏18 d内能保持较好的理化稳定性。因此,将GO应用于纳米乳液中有望提高乳液稳定性并延缓油脂氧化。然而,目前的研究主要从粒径、ζ-电位、过氧化值(peroxide value,PV)等宏观实验指标分析了GO对纳米乳液理化性质的影响,从分子间相互作用的微观层面研究GO对纳米乳液的氧化稳定性影响机制亟待加强。分子动力学模拟和独立梯度模型(independent gradient model,IGM)等理论计算方法因其能直接揭示分子或原子间的相互作用、提供相互作用类型和结构变化等微观信息,而被广泛应用于分子相互作用的研究[9-10]。因此,通过理论计算的方法阐明GO与纳米乳液中主要组分的相互作用规律,有望为GO对纳米乳液氧化稳定性的影响做进一步的分析和支撑。
本研究将实验和理论计算相结合,探究GO添加量对辛烯基琥珀酸淀粉酯(octenyl succinic anhydride modified starch,OSAS)-磷脂(phosphatidylcholine,PC)纳米乳液的氧化稳定性的影响机制。首先,采用实验手段考察了GO浓度对OSAS-PC纳米乳液理化性质的影响。其次,利用分子动力学模拟和IGM探究GO与OSAS-PC纳米乳液中的PC、甘油三酯(triacylglycerol,TAG)、OSAS这3种主要组分之间的相互作用。本研究为扩大GO在纳米乳液中的应用,提高纳米乳液的氧化稳定性提供理论依据。
1 材料与方法
1.1 材料与试剂
GO(CAS 11042-64-1,纯度>98%),大连美伦生物技术有限公司;大豆卵磷脂(CAS 8002-43-5),合肥博美生物科技有限公司;OSAS(CAS 26544-38-7,取代度2%~3%),上海国民淀粉有限公司;亚麻籽油,陕西关中油坊有限公司;其他试剂均为分析纯。
1.2 仪器与设备
Topolino型磁力搅拌器、T18 ULTRA-TURRAX型高速均质机,德国IKA公司;HH-6D型恒温水浴振荡器,惠州市宏业仪器有限公司;UV-2450型紫外分光光度计,日本岛津公司;Zetasizer Nano ZS 90型粒径分析仪,英国Malvern公司。
1.3 实验方法
1.3.1 OSAS-PC复合物分散液的制备
将一定质量的OSAS加入磷酸钠缓冲液(10 mmol/L,pH 7.0)中,水浴搅拌30 min(80 ℃,500 r/min),冷却至25 ℃得到OSAS悬浮液。然后按OSAS∶PC=3∶7(质量比)将PC加入到OSAS悬浮液中,水浴搅拌30 min(50 ℃,500 r/min)得到总质量分数为7%的OSAS-PC复合物分散液。
1.3.2 含不同浓度GO的OSAS-PC纳米乳液制备
将不同质量的GO分别加入到亚麻籽油中,搅拌(30 ℃,500 r/min)的同时将OSAS-PC复合物分散液逐滴滴入油相中,连续搅拌30 min得到粗乳液。然后用高速均质机均质(20 000 r/min,2 min),得到含不同质量浓度(12.5、25.0、37.5、50.0和75.0 mg/L)GO的OSAS-PC纳米乳液。
1.3.3 包埋率的测定
将15 mg的GO标准样品溶解于无水乙醇中,转移至50 mL容量瓶进行定容,得到标准液。分别准确量取0、1.0、1.5、2.0、2.5、3.0 mL标准液于50 mL容量瓶中,用无水乙醇定容。接着,利用紫外分光光度计测定吸光值,测定波长327 nm,得到吸光值随GO浓度变化的标准曲线(y=0.034 3x-0.003 9,R2=0.999 2)。
参考FENG等[11]的方法,并稍做修改。取10 mL含GO的乳液样品,离心(6 201×g,10 min),上清液用10 mL乙醇萃取,充分振荡30 min后离心(6 201×g,5 min),得到乙醇相。萃取重复2次,合并萃取液。将萃取液用乙醇适当稀释,在327 nm处测吸光值。根据公式(1)计算GO的包埋率。
包埋率![]()
(1)
式中:m1,上清液中的GO质量,mg;m2,添加GO的总质量,mg。
1.3.4 乳液的外观观察
将未添加GO和含不同质量浓度GO(12.5、25.0、37.5 mg/L)的OSAS-PC纳米乳液置于密封的透明玻璃瓶中,在25 ℃和4 ℃下恒温贮藏4周,目测观察并拍照记录贮藏过程中纳米乳液的相分离情况。
1.3.5 乳液的粒径和ζ-电位测定
采用纳米粒径电位分析仪测定纳米乳液的粒径和ζ-电位。为避免多重光散射效应,样品测定前用超纯水稀释1 000倍。水相溶液的黏度和折射率分别为0.887 2 cP和1.33,测试温度25 ℃,平衡时间120 s。对每个样品平行测定3组,对每组进行3次测定,取平均值作为每次的测量值。
1.3.6 DPPH自由基清除率的测定
参考LOTFY等[12]的方法,并稍作修改。取0.1 mL新制备的乳液样品和3.0 mL浓度为0.1 mmol/mL的DPPH乙醇溶液混合均匀后在室温下避光反应30 min。将反应溶液离心(6 201×g,10 min),测定上清液在517 nm处的吸光值。同时用无水乙醇代替DPPH乙醇溶液,用等体积无水乙醇代替乳液样品测定其吸光值,用等体积水和乙醇溶液调零。根据公式(2)计算样品的DPPH自由基清除率。
DPPH自由基清除率![]()
(2)
式中:A0,等体积无水乙醇代替样品溶液的吸光值;A1,等体积无水乙醇代替DPPH乙醇溶液的吸光值;A2,样品溶液与DPPH乙醇溶液的吸光值。
1.3.7 PV的测定
参考ZHONG等[8]的方法,并稍作修改。将0.36 mL的乳液样品与1.8 mL异辛烷和2-丙醇(3∶1,体积比)的混合溶液涡旋10 s,重复4次。混合均匀后离心(6 201×g,10 min),取0.6 mL上层清液加入8.4 mL甲醇和丁醇(2∶1,体积比)的混合溶液中,然后添加45 μL硫氰酸铵(3.94 mol/L)和45 μL新制备的Fe2+溶液,涡旋10 s。在室温下避光放置20 min。以异辛烷作为空白参比,于510 nm波长处测定溶液的吸光值。异辛烷和2-丙醇(3∶1,体积比)的混合溶液代替纳米乳液提取物作为阴性对照。使用由Fe3+制备的标准曲线,根据公式(3)计算PV。
(3)
式中:A,样品吸光值;a,标准曲线的斜率;b,标准曲线的截距;56,Fe3+的摩尔质量,g/mol;2,Fe3+与氢过氧化物的摩尔比;9.09,样品反应的体积,mL。
1.3.8 分子动力学模拟
从Pubchem(https://pubchem.ncbi.nlm.nih.gov)数据库中获得GO分子结构,在BioTopics.co.uk (http://www.biotopics.co.uk/jsmol)数据库中获得淀粉和PC的分子结构。亚麻籽油中的甘油三酯(triacylglycerol,TAG)主要为1-油酸-2,3-二亚麻酸甘油三酯,约占亚麻籽油TAG总量的29.40%[13]。因此选用1-油酸-2,3-二亚麻酸甘油三酯作为分子动力学模拟中TAG的结构,利用GaussView 5.0.9软件构建所需TAG分子结构。本研究中使用的淀粉酯为OSAS(取代度为2%~3%),因此,同样采用GaussView 5.0.9软件用一个辛烯基取代含有24个葡萄糖单元的淀粉分子中吡喃糖环上的第二个羟基以获得OSAS分子结构。
为阐明GO与OSAS-PC纳米乳液中主要组分(PC、TAG、OSAS)之间的相互作用,并研究GO的数量对GO与TAG相互作用的影响。使用YASARA(版本号:20.12.24)[14]软件进行分子动力学模拟,模拟过程中GO和TAG使用GAFF力场[15],PC和OSAS使用GLYCAM06力场[16]。首先,分别对GO、PC、TAG和OSAS的结构进行能量最小化。接着,利用周期性边界条件,将GO分别与PC、TAG、OSAS放入一个立方体盒子中,盒子边缘与复合物表面的最小距离为10 Å。然后加入TIP3P模型水,通过加入Na+或Cl-以中和系统中的电荷。设置pH值为7.4,模拟温度为298 K。随后,对整个系统进行能量最小化处理。然后进行分子动力学模拟,运行20 ns,时间步长2 fs[17]。最后,使用YASARA软件中自带的计算工具对模拟轨迹进行分析。根据YASARA软件自带工具计算后输出文件中的能量,按照公式(4)和公式(5)计算复合物的结合能、范德华势能、静电势能和内能。
ΔE=ΔEelec+ΔEvdw+ΔEinter
(4)
ΔEinter=ΔEbond+ΔEangle+ΔEdihedral+ΔEplanarity
(5)
式中:ΔE,结合能,kJ/mol;ΔEelec,静电势能,kJ/mol;ΔEvdw,范德华势能,kJ/mol;ΔEinter,内能,kJ/mol;ΔEbond,键拉伸能量,kJ/mol;ΔEangle,角度弯曲能量,kJ/mol;ΔEdihedral,扭转能量,kJ/mol;ΔEplanarity,平面能量,kJ/mol。
1.3.9 IGM
利用IGM分析GO与OSAS-PC纳米乳液中主要组分(PC、TAG、OSAS)之间的非共价相互作用[18]。基于MD结果,选择20 ns时的稳定构象用于IGM分析。将结构文件导入Multiwfn3.8[19]中选择高等质量格点(约1 728 000个点)进行IGM分析。基于亲分子密度计算每个点的原子梯度密度(δg)、电子密度(ρ)和拉普拉斯符号中第二个Hessian特征值的sign(λ2)。获得的δg包括δgintra和δginter,它们分别代表原子对之间的片段内和片段间相互作用。最后,将结果导入VMD(version 1.9.3)软件[20]中进行可视化分析。
1.4 数据处理
样品平行测定2次,实验指标平行测定3次,结果均以平均值±标准差表示。使用SPSS 18.0进行单因素ANOVA分析(P<0.05时为差异显著),采用Waller-Duncan检验进行两两比较。
2 结果与分析
2.1 OSAS-PC纳米乳液对不同浓度GO的包埋率
图1为不同浓度GO在OSAS-PC纳米乳液中的包埋率。当GO质量浓度由12.5 mg/L增加至75.0 mg/L时,OSAS-PC纳米乳液对GO的包埋率由84.4%升高至91.9%。表明OSAS-PC纳米乳液对GO具有较好的包埋效果,这是由于水包油纳米乳液中油相作为载体能有效包埋脂溶性物质,是输送脂溶性生物活性组分的有效方法[8]。然而,当GO浓度达到50.0 mg/L后,浓度的增加对包埋率没有显著影响,OSAS-PC纳米乳液对GO的包埋率趋于稳定。这主要是由于添加量在50.0 mg/L时,亚麻籽油对GO的溶解已趋近饱和。
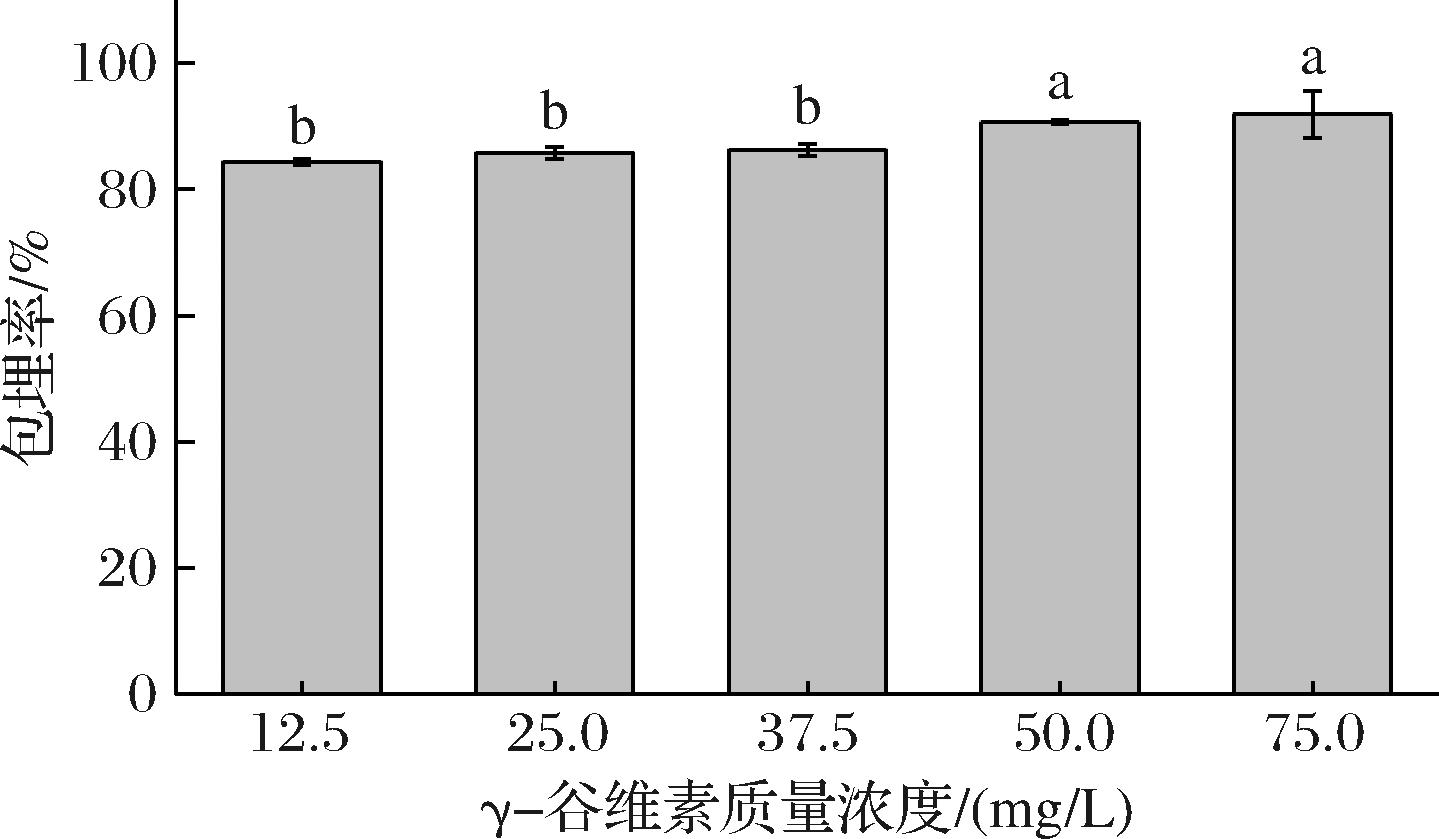
图1 OSAS-PC纳米乳液对γ-谷维素的包埋率
Fig.1 Encapsulation efficiency of γ-oryzanol by OSAS-PC nanoemulsion
注:小写字母不同表示差异显著(P<0.05)。
2.2 GO浓度对OSAS-PC纳米乳液物理稳定性的影响
2.2.1 粒径和ζ-电位
图2为未添加GO和含不同质量浓度GO(12.5、25.0、37.5 mg/L)的OSAS-PC纳米乳液的粒径分布及ζ-电位。由图2-a可知,所有OSAS-PC纳米乳液的粒径均呈单峰分布,表明乳液均一性较好[1]。未添加GO的纳米乳液和GO质量浓度为12.5、25.0、37.5 mg/L的纳米乳液粒径分布在28.2~712.0 nm,且在220 nm左右达到最大强度。上述结果表明GO浓度对OSAS-PC纳米乳液粒径分布没有显著影响。
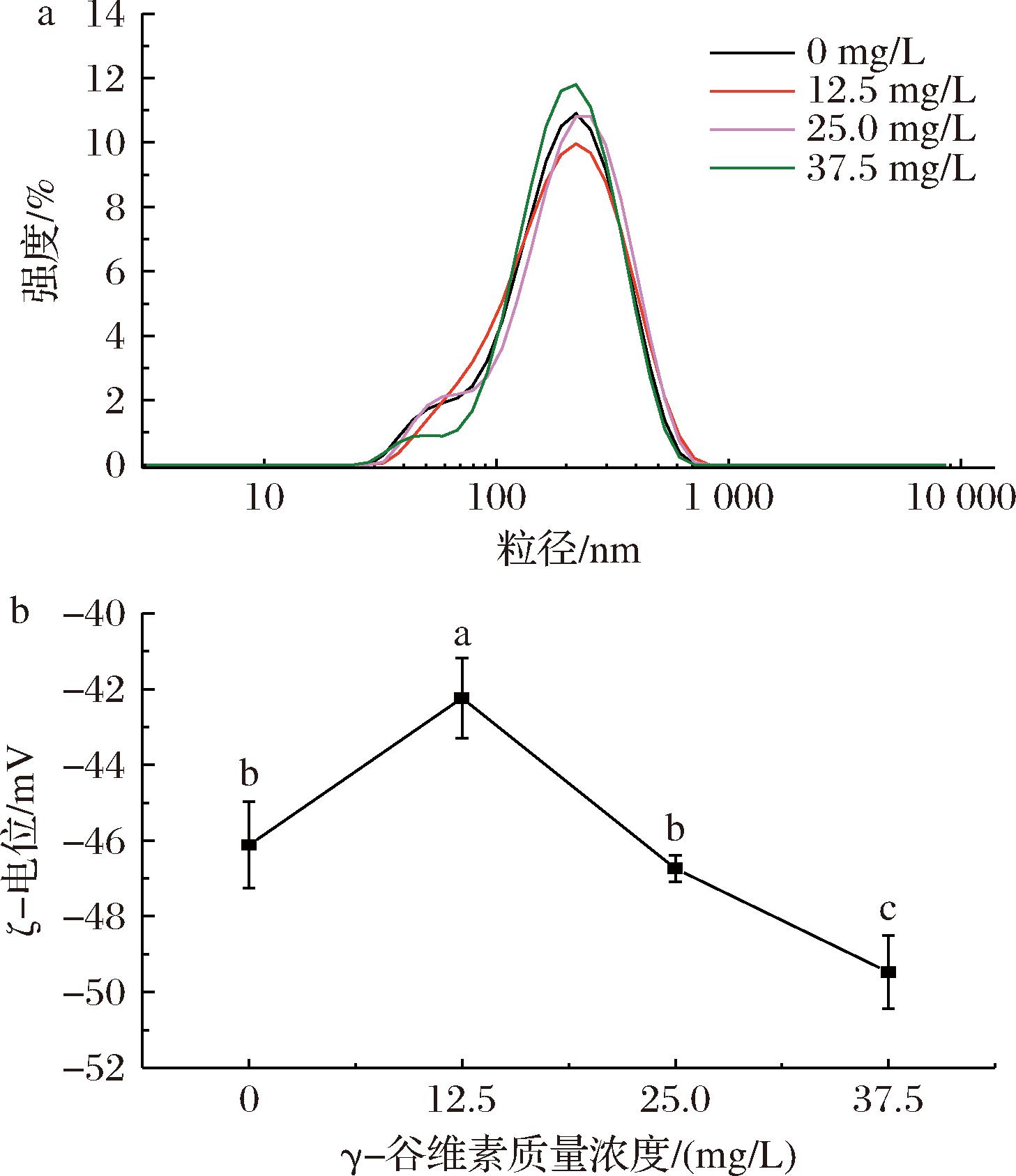
a-粒径分布;b-ζ-电位
图2 GO浓度对纳米乳液粒径分布及ζ-电位的影响
Fig.2 Effect of GO concentration on the particle size distribution and ζ-potential of nanoemulsions
注:小写字母不同表示差异显著(P<0.05)。
ζ-电位是反映乳液物理稳定性的一个重要指标,电位绝对值越大,乳液液滴间的静电排斥力越强,可抑制液滴聚集而获得更加稳定的乳液[21]。由图2-b可知,GO质量浓度为12.5 mg/L的纳米乳液ζ-电位绝对值(42.24 mV)与未添加GO(46.12 mV)时相比减小了3.88 mV,但高于30 mV临界绝对电位值,对纳米乳液的稳定性无显著影响[22]。电位绝对值的降低可能是因为PC的磷酸头部与GO的苯酚基团之间氢键的形成对液滴表面电荷产生了影响[23]。当GO质量浓度为37.5 mg/L时,纳米乳液的ζ-电位绝对值升高至49.47 mV。这可能是GO阿魏酸基团上的羟基解离所致[24]。综上所述,GO的加入对OSAS-PC纳米乳液的ζ-电位绝对值有显著影响,较高浓度的GO可使ζ-电位绝对值增大,对增强纳米乳液的物理稳定性有一定积极作用。
2.2.2 纳米乳液外观
图3为未添加GO和含不同质量浓度GO(12.5、25.0、37.5 mg/L)的新制OSAS-PC纳米乳液和在25 ℃和4 ℃下贮藏4周后的乳液外观图。观察纳米乳液未发现分层、絮凝等现象,所有乳液在贮藏前后均为均一的乳白色流体。这是由于以OSAS-PC复合物作为乳化剂的乳液具有较大的ζ-电位绝对值(大于40 mV,图2-b),较强的静电排斥力能够抑制液滴聚集从而提高纳米乳液的物理稳定性[25]。综上,GO的加入对纳米乳液贮藏4周后的外观没有显著影响。

a-新制;b-25 ℃贮藏4周;c-4 ℃贮藏4周
图3 未添加GO和含不同浓度GO的纳米乳液外观
Fig.3 The appearance of nanoemulsions without GO and with different concentrations of GO
2.3 GO浓度对OSAS-PC纳米乳液氧化稳定性的影响
2.3.1 DPPH自由基清除率
GO的抗氧化性来源于其分子结构中阿魏酸基团上的酚羟基[26]。由图4可知,在不同温度(25 ℃和4 ℃)下贮藏4周的过程中,含GO的OSAS-PC纳米乳液DPPH自由基清除率均高于未添加GO的纳米乳液,表明GO的加入能提高DPPH自由基清除率,增强OSAS-PC纳米乳液抗氧化能力[27]。在贮藏的初始阶段(0~2周),纳米乳液的DPPH自由基清除率随浓度增加而增大。在第2~4周贮藏期间纳米乳液的DPPH自由基清除率呈降低趋势,这可能是由于贮藏过程中GO降解,浓度降低所致[28]。在25 ℃的贮藏条件下,从第2周到第4周,质量浓度为12.5、25.0、37.5 mg/L的纳米乳液DPPH自由基清除率分别降低0.63%、6.86%和4.69%,GO质量浓度为12.5 mg/L的纳米乳液在贮藏结束时(第4周)具有最大的DPPH自由基清除率(53.68%)。在4 ℃下贮藏4周的纳米乳液中,GO质量浓度为12.5 mg/L的纳米乳液DPPH自由基清除率(55.16%)也为最大,表明GO质量浓度为12.5 mg/L时在贮藏后期可能具有更好的抗氧化效果。
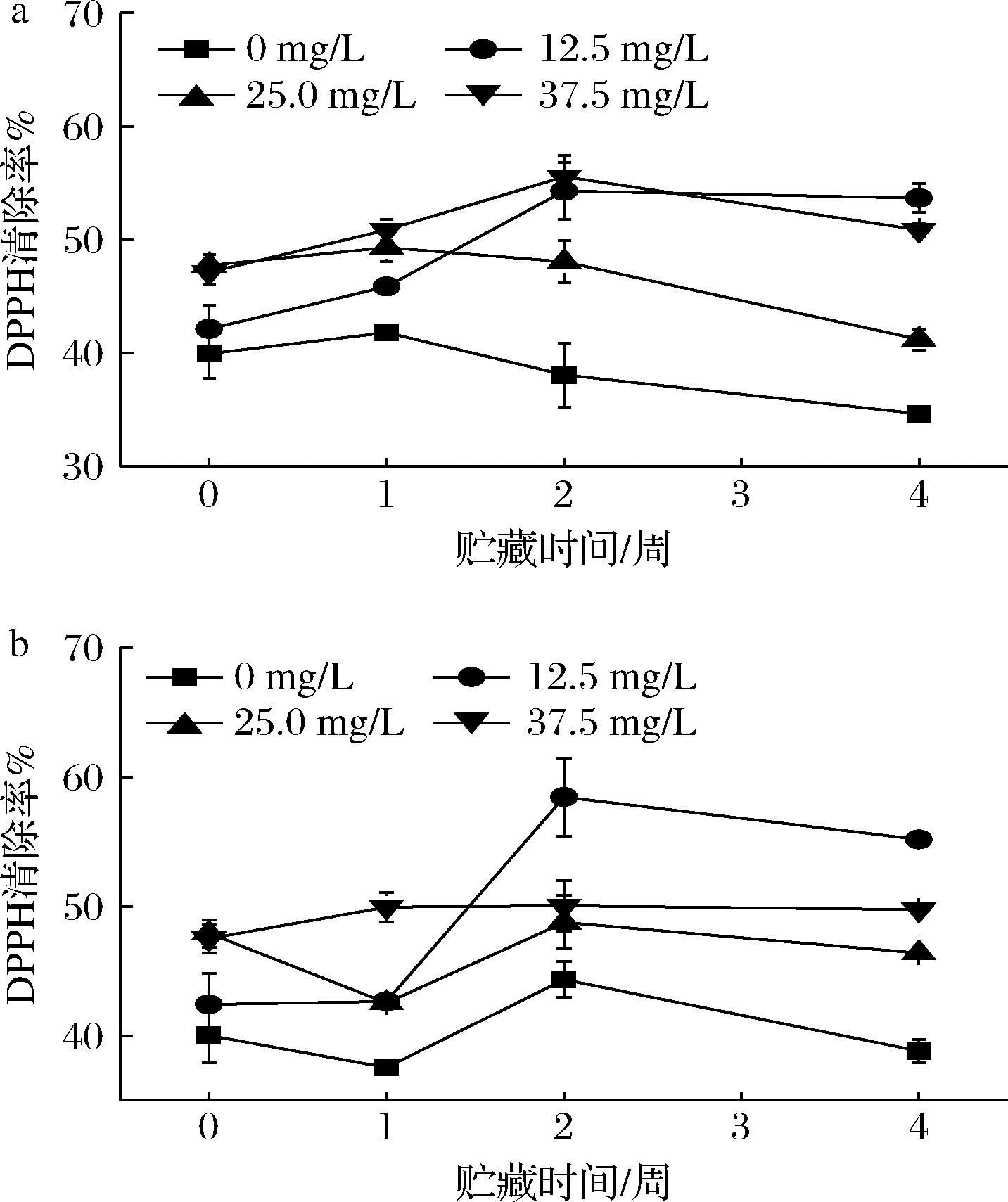
a-25 ℃;b-4 ℃
图4 含不同浓度GO纳米乳液在25 ℃和4 ℃下贮藏4周的DPPH自由基清除能力变化情况
Fig.4 Changes in DPPH scavenging ability of nanoemulsions embedded with different concentrations of γ-oryzanol stored at 25 ℃ and 4 ℃ for four weeks
2.3.2 PV
PV是油脂氧化过程中的初级产物,常用于评价油脂的氧化程度。由图5可知,OSAS-PC纳米乳液的PV均随贮藏时间的延长呈逐渐增加的趋势。4 ℃下贮藏4周的纳米乳液PV增加不明显,这是因为低温能够抑制乳液氧化。在25 ℃下贮藏4周后的纳米乳液,未添加GO和含不同质量浓度GO(12.5、25.0、37.5 mg/L)的纳米乳液与对应的初始(第0周)纳米乳液相比PV分别增加了3.44、3.19、3.12、3.41 mmol/L,表明GO的加入能够延缓纳米乳液的氧化。这是由于GO阿魏酸基团中的酚羟基和共轭体系能够形成较稳定的自由基并阻止油脂氧化过程中自由基的链式传递[29],同时GO的加入能够提高纳米乳液的DPPH清除率(图4),抑制乳液氧化产生过氧化物。因此GO的加入能够提高OSAS-PC纳米乳液的氧化稳定性。
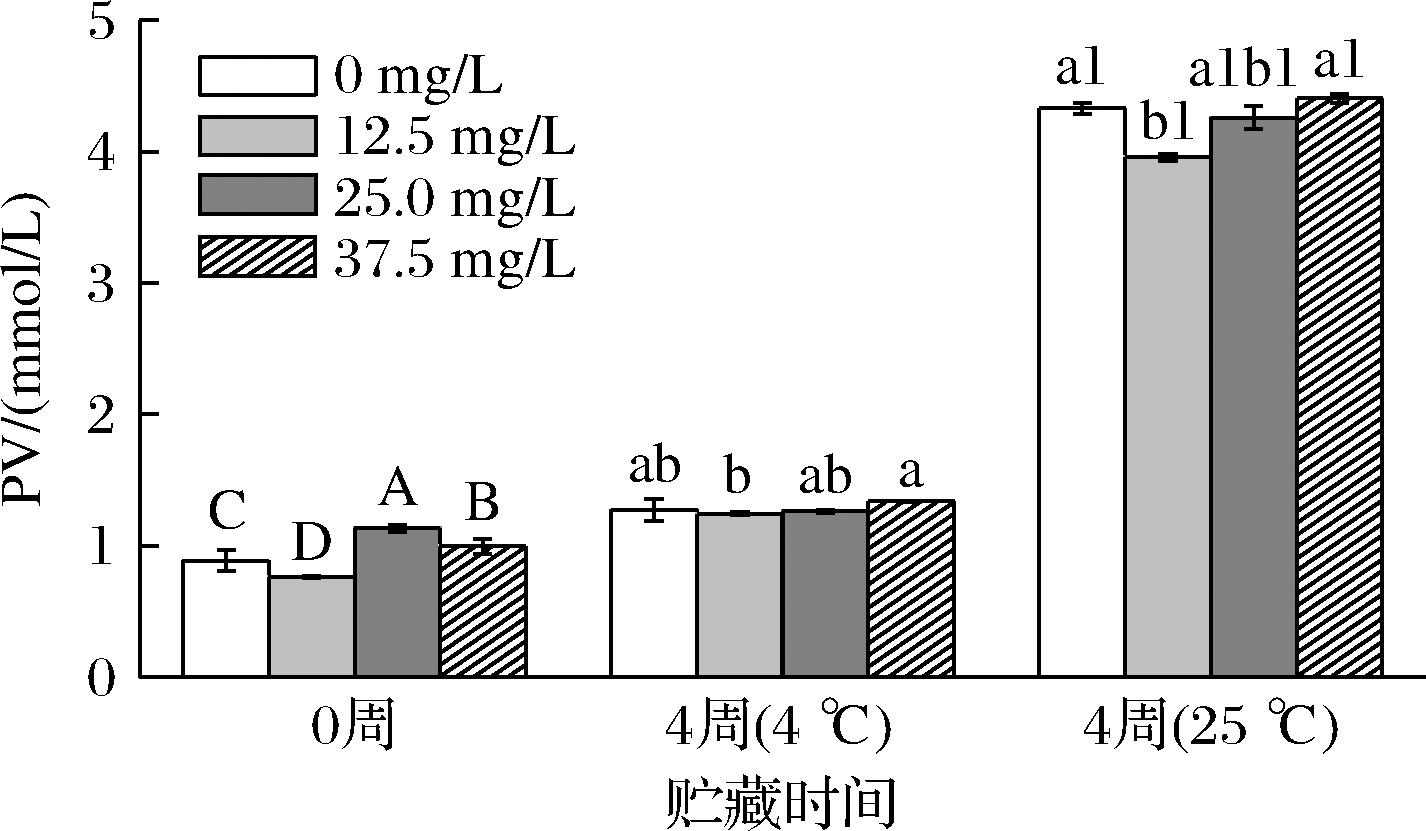
图5 含不同浓度GO的纳米乳液在4 ℃和25 ℃贮藏28天PV的变化情况
Fig.5 Changes of PV in nanoemulsions containing different concentrations of GO during storage at 4 ℃ and 25 ℃ for 28 days
注:同一条件下不同浓度间字母不同表示差异显著(P<0.05)。
2.4 GO与OSAS-PC纳米乳液中主要组分的相互作用
2.4.1 结合能分析
图6为GO与OSAS-PC纳米乳液中主要组分(PC、TAG、OSAS)以及不同数量GO与TAG作用时各项能量的贡献情况。由图6-a可知,GO与OSAS-PC纳米乳液中主要组分间的范德华势能和内能均为正值,且对结合能的贡献较小。静电势能呈现负值,且对结合能的贡献最大,表明静电相互作用主导了GO与OSAS-PC纳米乳液中主要组分间的结合。GO与OSAS-PC纳米乳液的主要组分之间产生的较强静电相互作用可能有利于OSAS-PC纳米乳液的物理稳定性[30](图3)。同时,PC-GO(-1.67×105 kJ/mol)和TAG-GO(-1.66×105 kJ/mol)的结合能显著低于OSAS-GO的结合能(-1.56×105 kJ/mol),表明GO更倾向于与PC、TAG形成稳定的复合物,分布于OSAS-PC纳米乳液的分散相中并靠近油水界面处。而研究表明,水包油乳液中的脂质氧化主要发生在油水界面处[31]。因此,GO在纳米乳液中的分布有利于阻止TAG在油水界面处发生氧化,同时GO本身的自由基清除能力也可以抑制纳米乳液中油脂的氧化,降低PV的增长速度(图5),从而提高纳米乳液的氧化稳定性。
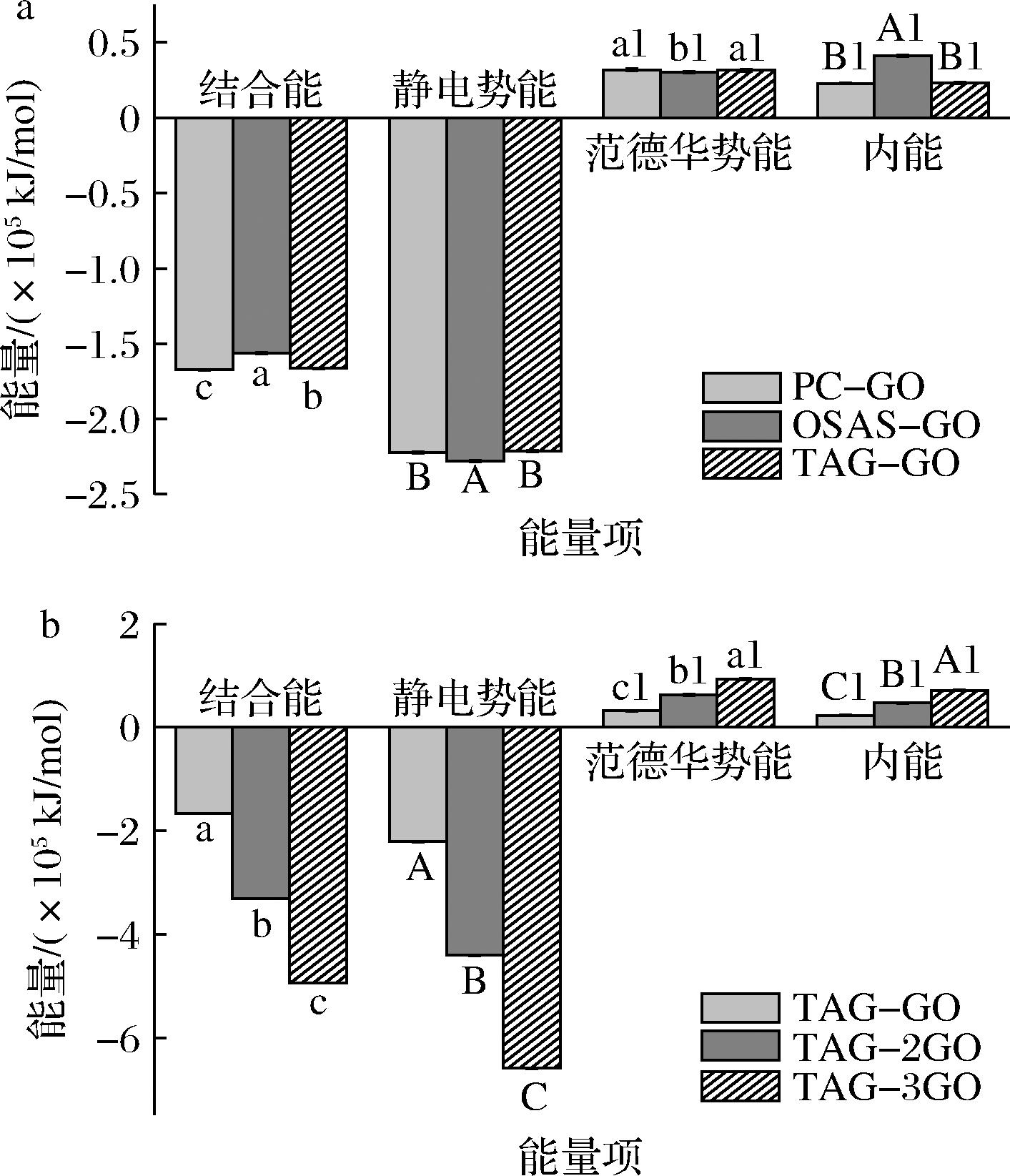
a-GO与PC、TAG、OSAS作用的能量贡献情况;b-TAG与不同数量GO作用的能量贡献情况
图6 GO与PC、TAG、OSAS以及TAG与不同数量GO作用的能量贡献情况
Fig.6 The energy contribution of GO with PC, TAG, OSAS and TAG with different amounts of GO
注:同一能量项间不同字母表示差异显著(P<0.05)。
由于TAG是纳米乳液中发生氧化的主要物质,因此通过探究GO数量对GO与TAG结合能的影响以解释GO浓度对纳米乳液氧化稳定性的影响。由图6-b可知,GO与TAG间结合能随GO数量的增加而减小,当GO的数量由1增加至3时,GO与TAG间的结合能由-1.66×105 kJ/mol 减小至-4.94×105 kJ/mol。表明GO数量在一定范围内时,体系中GO与TAG的结合能随GO数量的增加而减小,形成更加稳定的复合物,从而在一定程度上降低OSAS-PC纳米乳液贮藏过程中的PV,提高纳米乳液的氧化稳定性(图5)。
2.4.2 IGM分析
基于分子动力学模拟的结果,选择具有稳定构象的复合物结构(20 ns)进行IGM分析,来说明GO与OSAS-PC纳米乳液中主要组分(PC、TAG、OSAS)之间的非共价相互作用。将 sign(λ2)ρ函数通过不同颜色投影到δg等值面上可清楚地分辨弱相互作用的类型和强度,等值面中蓝色、绿色和红色区域依次代表氢键、范德华相互作用和排斥相互作用[32]。由图7可知,PC-GO、TAG-GO和OSAS-GO均在一定范围内出现了蓝色、绿色和红色,表明GO与OSAS-PC纳米乳液中主要组分间均存在一定的氢键作用、范德华相互作用以及排斥相互作用。PC-GO、TAG-GO和OSAS-GO复合物的δginter vs.sign(λ2)ρ散点图中起稳定作用所对应的负侧峰比不稳定作用对应的正侧峰更强,有利于复合物的形成[33]。

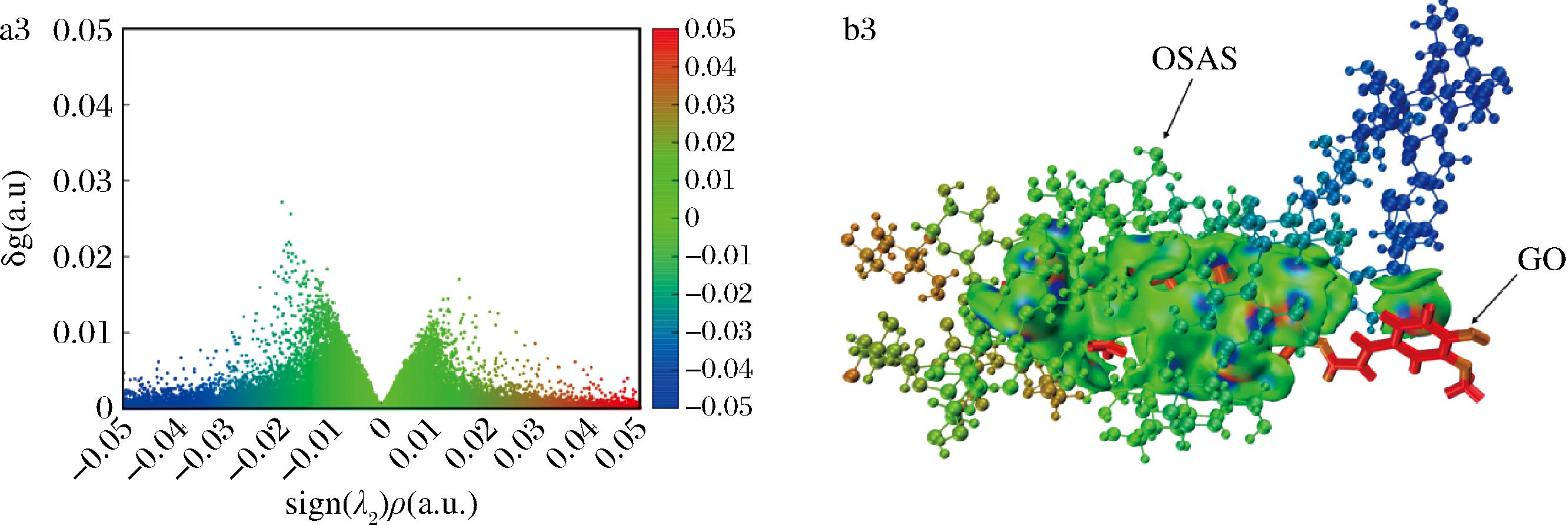
a1-PC-GO的散点图;a2-TAG-GO的散点图;a3-OSAS-GO的散点图;b1-PC-GO彩色填充等值面图;b2-TAG-GO彩色填充等值面图;b3-OSAS-GO彩色填充等值面图
图7 PC-GO、TAG-GO和OSAS-GO的δginter与sign(λ2)ρ之间的散点图以及复合物的彩色填充等值面图
Fig.7 Scatter plots between δginter vs.sign (λ2) ρ of PC-GO, TAG-GO and OSAS-GO and corresponding color filled isosurface of PC-GO,TAG-GO and OSAS-GO complexes
注:等值面为0.001 Å。
3 结论
本文研究了GO添加量对OSAS-PC纳米乳液氧化稳定性的影响机制。结果表明,GO的加入显著提高了纳米乳液的DPPH自由基清除率。在25 ℃贮藏4周后,未添加GO和含不同质量浓度GO(12.5、25.0、37.5 mg/L)的纳米乳液与对应的初始(第0周)纳米乳液相比PV分别增加了3.44、3.19、3.12、3.41 mmol/L,表明GO可以延缓纳米乳液氧化,提高其氧化稳定性。当GO质量浓度为37.5 mg/L时,纳米乳液电位绝对值最大(49.47 mV),且在贮藏4周的过程中纳米乳液能保持较高的DPPH自由基清除率,延缓PV增长速度,最大限度提高纳米乳液的物理稳定性和氧化稳定性。分子动力学模拟和IGM结果显示,静电相互作用主导了GO与PC、TAG、OSAS复合物的形成。TAG-3GO的结合能(-4.94×105 kJ/mol)最低,GO数量的增加使GO与TAG之间的静电相互作用增强,形成更加稳定的复合物从而更好的发挥抗氧化作用。总之,本结果为GO作为抗氧化剂改善纳米乳液氧化稳定性提供了理论参考。
[1] KIM D M, HYUN S S, YUN P, et al.Identification of an emulsifier and conditions for preparing stable nanoemulsions containing the antioxidant astaxanthin[J].International Journal of Cosmetic Science, 2012, 34(1):64-73.
[2] BANASAZ S, MOROZOVA K, FERRENTINO G, et al.Encapsulation of lipid-soluble bioactives by nanoemulsions[J].Molecules, 2020, 25(17):3966.
[3] GUO X, SUN X T, LIANG L, et al.Physical stability, oxidative stability, and bioactivity of nanoemulsion delivery systems incorporating lipophilic ingredients:Impact of oil saturation degree[J].Journal of Agricultural and Food Chemistry, 2021, 69(18):5405-5415.
[4] DARIO M F, OLIVEIRA C A, CORDEIRO L R G, et al.Stability and safety of quercetin-loaded cationic nanoemulsion:in vitro and in vivo assessments[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2016, 506:591-599.
[5] LERMA-GARC A M J, HERRERO-MART
A M J, HERRERO-MART NEZ J M, SIM
NEZ J M, SIM -ALFONSO E F, et al.Composition, industrial processing and applications of rice bran γ-oryzanol[J].Food Chemistry, 2009, 115(2):389-404.
-ALFONSO E F, et al.Composition, industrial processing and applications of rice bran γ-oryzanol[J].Food Chemistry, 2009, 115(2):389-404.
[6] RAMAZANI E, AKABERI M, EMAMI S A, et al.Biological and pharmacological effects of gamma-oryzanol:An updated review of the molecular mechanisms[J].Current Pharmaceutical Design, 2021, 27(19):2299-2316.
[7] KIM J S.Antioxidant activity of γ-oryzanol and synthetic phenolic compounds in an oil/water (O/W) emulsion system[J].Preventive Nutrition and Food Science, 2007, 12(3):173-176.
[8] ZHONG J F, LIU X, WANG Y H, et al.γ-Oryzanol nanoemulsions produced by a low-energy emulsification method:An evaluation of process parameters and physicochemical stability[J].Food &Function, 2017, 8(6):2202-2211.
[9] 刘敏, 罗国柳, 覃小丽, 等.果胶酯化度对酪蛋白-果胶相互作用及其复合物性能的影响[J].食品与发酵工业, 2023, 49(24):80-87.
LIU M, LUO G L, QIN X L, et al.Interaction and properties of the noncovalent of casein-pectin complexes:Effect of esterified degree of pectin[J].Food and Fermentation Industries, 2023, 49(24):80-87.
[10] JIANG Z J, LU X X, GENG S, et al.Structuring of sunflower oil by stearic acid derivatives:Experimental and molecular modelling studies[J].Food Chemistry, 2020, 324:126801.
[11] FENG J, WU S S, WANG H, et al.Improved bioavailability of curcumin in ovalbumin-dextran nanogels prepared by Maillard reaction[J].Journal of Functional Foods, 2016, 27:55-68.
[12] LOTFY S N, SAAD R, EL-MASSREY K F, et al.Effects of pH on headspace volatiles and properties of Maillard reaction products derived from enzymatically hydrolyzed quinoa protein-xylose model system[J].LWT, 2021, 145:111328.
[13] 王兴瑞, 韩玉泽, 李应霞, 等.青海亚麻籽油甘三酯指纹图谱构建及掺伪识别的研究[J].中国油脂, 2022, 47(5):117-123.
WANG X R, HAN Y Z, LI Y X, et al.Triglyceride fingerprint construction and adulteration identification of Qinghai flaxseed oil[J].China Oils and Fats, 2022, 47(5):117-123.
[14] KRIEGER E, VRIEND G.New ways to boost molecular dynamics simulations[J].Journal of Computational Chemistry, 2015, 36(13):996-1007.
[15] WANG J M, WOLF R M, CALDWELL J W, et al.Development and testing of a general amber force field[J].Journal of Computational Chemistry, 2004, 25(9):1157-1174.
[16] KIRSCHNER K N, YONGYE A B, TSCHAMPEL S M, et al.GLYCAM06:A generalizable biomolecular force field.Carbohydrates[J].Journal of Computational Chemistry, 2008, 29(4):622-655.
[17] LI J S, QIN X L, LIU X, et al.Enhanced mechanical, barrier and antioxidant properties of rice protein/sodium alginate-based films by incorporating cellulose nanocrystals and rosemary extract[J].Food Packaging and Shelf Life, 2022, 34:101000.
[18] LEFEBVRE C, RUBEZ G, KHARTABIL H, et al.Accurately extracting the signature of intermolecular interactions present in the NCI plot of the reduced density gradient versus electron density[J].Physical Chemistry Chemical Physics, 2017, 19(27):17928-17936.
[19] LU T, CHEN F W.Multiwfn:A multifunctional wavefunction analyzer[J].Journal of Computational Chemistry, 2012, 33(5):580-592.
[20] HUMPHREY W, DALKE A, SCHULTEN K.VMD:Visual molecular dynamics[J].Journal of Molecular Graphics, 1996, 14(1):33-38;27-28.
[21] YANG Y X, CUI S W, GONG J H, et al.A soy protein-polysaccharides Maillard reaction product enhanced the physical stability of oil-in-water emulsions containing citral[J].Food Hydrocolloids, 2015, 48:155-164.
[22] ISHAKA A, UMAR IMAM M, MAHAMUD R, et al.Characterization of rice bran wax policosanol and its nanoemulsion formulation[J].International Journal of Nanomedicine, 2014, 9:2261-2269.
[23] OKURO P K, MALFATTI-GASPERINI A A, VICENTE A A, et al.Lecithin and phytosterols-based mixtures as hybrid structuring agents in different organic phases[J].Food Research International, 2018, 111:168-177.
[24] TAARJI N, BOUHOUTE M, KOBAYASHI I, et al.Physicochemical stability and in-vitro bioaccessibility of concentrated γ-oryzanol nanodispersions fabricated by solvent displacement method[J].Food Chemistry, 2022, 382:132300.
[25] ZHONG J F, LI Y F, QIN X L, et al.Improving the freeze-thaw stability of emulsions via combining phosphatidylcholine and modified starch:A combined experimental and computational study[J].International Journal of Food Science &Technology, 2022, 57(2):1050-1060.
[26] MASSAROLO K C, DENARDI DE SOUZA T, COLLAZZO C C, et al.The impact of Rhizopus oryzae cultivation on rice bran:Gamma-oryzanol recovery and its antioxidant properties[J].Food Chemistry, 2017, 228:43-49.
[27] JULIANO C, COSSU M, ALAMANNI M C, et al.Antioxidant activity of gamma-oryzanol:Mechanism of action and its effect on oxidative stability of pharmaceutical oils[J].International Journal of Pharmaceutics, 2005, 299(1-2):146-154.
[28] LIU R R, XU Y, CHANG M, et al.Interactions between α-tocopherol and γ-oryzanol in oil-in-water emulsions[J].Food Chemistry, 2021, 356:129648.
[29] 龚院生, 姚惠源.米糠中γ-谷维醇抗氧化功能与分子结构的关系[J].无锡轻工大学学报(食品与生物技术), 2002(5):439-442;451.
GONG Y S, YAO H Y.The relationship between the antioxidative function of γ-oryzanol and its molecular structure[J].Journal of Wuxi University of Light Industry, 2002(5):439-442;451.
[30] HUANG B, LIU F F, DONG X Y, et al.Molecular mechanism of the affinity interactions between protein A and human immunoglobulin G1 revealed by molecular simulations[J].The Journal of Physical Chemistry.B, 2011, 115(14):4168-4176.
[31] BERTON-CARABIN C C, ROPERS M H, GENOT C.Lipid oxidation in oil-in-water emulsions:Involvement of the interfacial layer[J].Comprehensive Reviews in Food Science and Food Safety, 2014, 13(5):945-977.
[32] 郑玲, 钟金锋, 刘雄, 等.甘油二酯油凝胶和甘油三酯油凝胶物理性质的差异比较及其机制初探[J].食品与发酵工业, 2023, 49(9):142-149.
ZHENG L, ZHONG J F, LIU X, et al.Comparison of physical properties between diacylglycerol oleogels and triacylglycerol oleogels and preliminary investigation of their mechanisms[J].Food and Fermentation Industries, 2023, 49(9):142-149.
[33] ZHENG L, ZHONG J F, LIU X, et al.Physicochemical properties and intermolecular interactions of a novel diacylglycerol oil oleogel made with ethyl cellulose as affected by γ-oryzanol[J].Food Hydrocolloids, 2023, 138:108484.