生酮饮食是一种脂肪含量较高、碳水化合物含量极低和蛋白质含量适中的饮食,起源于20世纪20年代对儿童难治性癫痫的治疗[1]。在生酮状态下,机体以酮体为能量源。通过改变机体的代谢方式,生酮饮食能够起到改善肥胖、胰岛素抵抗[2]、癌症、神经系统疾病[3]、多囊卵巢综合征[4]、中风[5]等多种作用,受到越来越多的关注。
椰子油是近年来较受欢迎的健康油脂之一,其一般不经高温处理,因此能够保留油脂中的生物活性成分,如多酚、维生素等[6-7]。椰子油饱和度较高,因此具有较好的储藏稳定性和加工稳定性。此外,椰子油是中链脂肪酸的重要来源[8]。而中链脂肪酸因其能够快速供能[9],有利于促进机体生酮。因此,椰子油是生酮饮食依从人群食用的主要油脂之一。为扩大椰子油在食品中的应用,并针对目前常见的油脂微胶囊含有可消化碳水化合物的弊端,文章选择以蛋白质和亲水胶体为壁材对椰子油进行包埋。
乳清分离蛋白(whey protein isolate,WPI)是普遍使用的一种蛋白质类壁材,具有良好的乳化性和溶解性,对芯材有良好的包埋能力。阿拉伯胶(gum Arabic,GA)是亲水胶体中使用广泛的壁材,具有良好的溶解性和成膜性,在较宽的pH范围内都能保证乳液的稳定性[10]。二者常与碳水化合物类壁材(如改性淀粉、麦芽糊精等β-环糊精等)复配后使用。KARRAR等[11]和OZDEMIR等[12]均以乳清分离蛋白、阿拉伯胶和麦芽糊精(1∶1∶1,质量比)为壁材制备油脂微胶囊,微胶囊包埋率分别为93.48%和87.19%。研究发现,当不添加碳水化合物类壁材时,微胶囊包埋率较低(20%~78%),且包埋率与阿拉伯胶的分子质量有关[12-13]。前期实验发现以分子质量较小的阿拉伯胶为壁材,椰子油微胶囊的包埋率显著提高。因此,本文以成膜性和溶解度较好及分子质量较低的阿拉伯胶(470 000 Da)和乳化性较好的乳清分离蛋白为壁材,在不添加可消化碳水化合物类壁材的情况下,进行生酮椰子油微胶囊的制备,以期提高生酮椰子油微胶囊的包埋率,并对生酮椰子油微胶囊的理化性质、稳定性等进行分析,为其在食品加工中的应用提供指导。
1 材料与方法
1.1 材料与仪器
椰子油,海南文昌纯椰子食品有限公司;乳清分离蛋白(纯度>90%),Milk Specialties Global公司;阿拉伯胶(纯度>95%),泰安鼎力胶业有限公司(中国山东);吐温-80、Span-80,河南万邦化工科技有限公司;NaCl、CaCl2、MgCl2、FeCl2、石油醚(沸程30~60 ℃)、乙醇、盐酸、无水乙醚,国药集团化学试剂有限公司;尼罗红,美国sigma生物科技有限公司;尼罗蓝,上海源叶生物科技有限公司。
AH-2010高压均质机,加拿大ATS公司;MOBILE MINOR喷雾干燥机,基伊埃工程技术(中国)有限公司;TGA2热重分析仪,梅特勒-托利多仪器有限公司;Zetasizer nano ZS纳米粒度及ZETA电位仪,英国马尔文公司;LSM880激光共聚焦显微镜,德国卡尔蔡司公司;SU8010扫描电子显微镜,日本株式会日立高新技术公司;HZ-9212SB水浴振荡器,太仓市华利达实验设备有限公司。
1.2 实验方法
1.2.1 生酮椰子油微胶囊的制备
生酮椰子油微胶囊的制备方法及固定条件如下:将GA和WPI分别于60 ℃水浴溶解,之后在4 ℃下静置过夜,使壁材溶液充分水合。然后将二者分别加热至60 ℃后混合,之后加入Span-80乳化剂。将椰子油加热至60 ℃后加入吐温-80乳化剂,然后将椰子油加入GA和SPI的混合溶液中。上述加入的Span-80和吐温-80质量比为54∶46(即乳化剂的[亲水亲油平衡值(hydrophilic lipophilic balance,HLB)=10]=10),乳化剂的总添加量为总固形物含量的3%(质量分数)。将上述混合液以300 r/min搅拌乳化30 min,之后使用剪切机进行乳化(12 000 r/min,3 min)得到初乳液。将初乳液用高压均质机均质后得到终乳液(40 MPa,2次)。使用喷雾干燥机对终乳液进行干燥,收集样品于干燥密闭的环境下储藏备用。
首先从椰子油乳液的制备工艺方面对椰子油微胶囊的包埋率进行优化,然后对喷雾干燥工艺参数进行优化。
1.2.2 单因素试验
1.2.2.1 固形物含量
设定芯壁比为1∶2,GA和WPI的质量比为1∶1,制备固形物含量分别为5%、10%、15%、20%和25%(质量分数,下同)的终乳液。设定喷雾干机的进风温度180 ℃,调节进料量使得出风温度维持在(80±0.5) ℃对终乳液进行喷雾干燥,得到椰子油微胶囊,并测定椰子油微胶囊的包埋率(以下相同)。
1.2.2.2 芯壁比
设定终乳液的固形物含量为5%(质量分数,下同),GA和WPI的质量比为1∶1,制备芯壁比分别为2∶1、3∶2、1∶1、2∶3和1∶2的终乳液。喷雾干燥得到椰子油微胶囊,并测定椰子油微胶囊的包埋率。
1.2.2.3 GA和WPI的质量比
设定终乳液的固形物含量为5%,芯壁比为1∶2,制备GA和WPI的质量比分别为3∶1、2∶1、1∶1、1∶2和1∶3的终乳液。喷雾干燥得到椰子油微胶囊,并测定椰子油微胶囊的包埋率。
1.2.3 喷雾干燥条件优化
预实验发现进料温度对微胶囊包埋率没有显著影响,而进料速度与出风温度相关。因此,以下仅优化了喷雾干燥的进风温度和出风温度2个工艺参数。
1.2.3.1 进风温度
按1.2.2节得到的最优工艺条件进行椰子油乳液的制备,分别设定进风温度为170、175、180、185、190 ℃,通过调节进料量将出风温度维持在80 ℃进行微胶囊的制备,并测定椰子油微胶囊的包埋率。
1.2.3.2 出风温度
按1.2.2节得到的最优工艺条件进行椰子油乳液的制备,设定进风温度为180 ℃,通过调节进料量将出风温度分别维持在70、75、80、85、90 ℃进行微胶囊的制备,并测定椰子油微胶囊的包埋率。
1.2.4 微胶囊基本理化性质测定
参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》对椰子油微胶囊的水分含量进行测定,使用水分活度仪测定微胶囊在25 ℃下的水分活度。
参考KARRAR等[11]的方法并经过一定的修改对椰子油微胶囊的溶解度和润湿性进行测定。由于椰子油低于25 ℃会发生凝固,因此测定微胶囊在60 ℃去离子水中的溶解度和润湿性。此外,由于椰子油微胶囊的溶解度较高,通过测定溶液中固形物含量以计算微胶囊的溶解度。
首先参考黄英雄等[14]的方法对椰子油微胶囊表面油含量进行测定。将沸程为30~60 ℃的石油醚分4次对样品(m0,g)进行洗涤(样品∶石油醚=1∶20,g∶mL),收集滤液于恒重的锥形瓶(m1,g)中,挥干溶剂后将锥形瓶于105 ℃烘箱烘至恒重,并记录总重(m2,g)。表面油含量按照公式(1)计算:
表面油含量![]()
(1)
先将微胶囊进行溶解,然后参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》中酸水解法,测定微胶囊的脂肪含量,包埋率按照公式(2)计算。
包埋率![]()
(2)
称量10 mL量筒的质量为m1(g),加入样品并轻轻晃匀,使得样品体积为10 mL,称量量筒与样品的总质量为m2(g)。将量筒在海绵垫上轻轻敲击,使得样品体积无明显变化,记录此时样品的体积为V(mL)。堆积密度和实密度分别按照公式(3)和公式(4)计算。
堆积密度![]()
(3)
实密度![]()
(4)
通过卡尔指数(Carr index,CI)和豪斯指数(House index,HR)来评价微胶囊的流动性和结块性,CI和HR的计算公式分别如公式(5)和公式(6)所示。
(5)
(6)
1.2.5 微胶囊微观结构测定
将7.5 g最优工艺条件下制备的椰子油微胶囊复溶于100 mL、60 ℃的去离子水中得到复原乳,将其稀释100倍,然后取1 mL稀释后的乳液,加入10 μL罗丹明溶液(将0.5 mg罗丹明溶于1 mL二甲基亚砜溶液得到罗丹明染料溶液)对蛋白进行染色和10 μL尼罗红溶液(将0.5 mg尼罗红溶于1 mL二甲基亚砜得到尼罗红染料溶液)对油脂进行染色,用激光共聚焦显微镜对复原乳的微观形态进行观察。
将微胶囊撒在双面胶上,吹去多余的粉末,喷金后使用扫描电子显微镜(scanning electron microscope,SEM)对微胶囊的微观形态进行观察,然后使用Image J对结果进行处理,得到微胶囊的平均粒径和粒径分布。
1.2.6 热重分析
分别称取3 mg椰子油、GA、WPI和椰子油微胶囊于坩埚中,设定升温区间为20~600 ℃,升温速度10 ℃/min,N2流速50 mL/min。
1.2.7 耐金属离子稳定性分析
根据龙吉云[15]的方法进行修改,对微胶囊的耐金属离子稳定性进行测定。将微胶囊配制成固形物含量为7.5%(质量分数)的溶液得到复原乳,为避免对复原乳的过度稀释,使用不同浓度的Fe2+、Na+、Ca2+、Mg2+溶液对复原乳进行滴定,使得复原乳中金属离子的浓度分别为5、10、50、100、150、200 mmol/L。常温静置12 h后将含有金属离子的乳液稀释100倍,参照1.2.5节的方法使用激光共聚焦显微镜对乳液的微观结构进行观察,并使用Zetasizer nano ZS纳米粒度及ZETA电位仪对乳液的电位、平均粒径、粒径分布和聚合物分散性指数(polymer dispersity index, PDI)进行测定。
1.2.8 耐酸稳定性分析
根据龙吉云[15]的方法进行修改,对微胶囊的耐酸稳定性进行测定。配制微胶囊复原乳,为避免对复原乳的过度稀释,使用不同浓度的柠檬酸和盐酸溶液对复原乳进行滴定,使得复原乳的pH值分别为1.0、2.0、3.0、4.0、5.0、6.0。常温静置12 h后将复原乳稀释100倍,参照1.2.5节的方法使用激光共聚焦显微镜对乳液的微观结构进行观察,并使用Zetasizer nano ZS纳米粒度及ZETA电位仪对乳液的电位、平均粒径、粒径分布和PDI值进行测定。
1.2.9 体外消化实验
参照MINEKUS等[16]的体外消化方法制备模拟唾液(simulated salivary fluid,SSF)、模拟胃液(simulated gastric fluid,SGF)和模拟肠液(simulated intestinal fluid,SIF)。具体消化方法如下:(1)口腔消化:称取1.00 g样品(椰子油微胶囊或椰子油微胶囊的物理混合物,微胶囊的物理混合物即将阿拉伯胶、乳清分离蛋白和椰子油按2∶4∶3的质量比混合,再加入3%(质量分数)的吐温-80和Span-80的混合物(HLB=10)),加入2 mL超纯水,混匀后加入15 μL CaCl2、135 μL超纯水,2.85 mL溶解了α-淀粉酶的SSF,最终体系中α-淀粉酶活力为75 U/mL。将其在37 ℃水浴中(200 r/min)振荡消化3 min。用无水乙醚对消化液中的游离脂肪进行萃取以测定芯材释放量,并计算释放率(释放率为芯材释放量与样品所含芯材质量的比值),记为0 min。(2)胃消化:向模拟口腔消化液中加入2.49 mL SGF、3 μL CaCl2和268.8 μL超纯水,用6 mol/L的HCl溶液将消化液pH值调至3,然后加入3 mL溶解了猪胃蛋白酶的SGF,最终体系中胃蛋白酶活力为2 000 U/mL。消化液在37 ℃水浴中(200 r/min)振荡消化,每隔30 min测定芯材的释放率,共测定120 min。(3)肠消化:向模拟胃消化液中加入4.8 mL SIF、1.8 mL猪胆盐(最终体系中猪胆盐的质量浓度为5 mg/mL)、24 μL CaCl2和2.38 mL超纯水,用2 mol/L的NaOH溶液将样品溶液pH值调至7,然后加入3 mL溶解了胰蛋白酶的SIF,最终体系中胰蛋白酶活力为100 U/mL。样品在37 ℃的水浴中(200 r/min)振荡消化,每隔30 min测定芯材的释放率,共测定120 min。
1.3 统计分析
所有测量至少重复3次,通过单因素方差分析(ANOVA)和Duncan多范围检验在95%的置信水平下进行样本之间的显著性差异检验(SPSS 19)。采用Origin 2018绘图,所有结果均显示为平均值±标准差。
2 结果与分析
2.1 单因素试验
2.1.1 固形物含量对包埋率的影响
本文中的固形物含量指总固形物含量,即为溶于水的化合物的总质量。如图1所示,随着固形物含量的增加,微胶囊的包埋率呈先降低再增加的趋势。当固形物含量为5%时,微胶囊有最大包埋率(81.45%)。这是由于固形物含量较低时,乳液的流动性好,且黏度较低,易于液滴的雾化和干燥。随着固形物含量的增大,乳液的黏度增大,微胶囊成膜速度变慢,导致芯材的外溢严重,造成微胶囊包埋率降低[17]。然而随着固形物含量的进一步增大,持续增大的乳液黏度可能阻碍了液滴的运动,有利于乳液的稳定,从而再次提高了微胶囊的包埋率。当固形物含量过低时,水分蒸发量大,能耗增加。因此,以固形物含量为5%进行下一步实验。

图1 固形物含量对椰子油微胶囊包埋率的影响
Fig.1 Effects of solid content on the encapsulation efficiency of coconut oil microcapsules
注:不同字母表示处理间差异性显著(P<0.05)(下同)。
2.1.2 芯壁比对包埋率的影响
如图2所示,随着芯壁比的降低,椰子油的包埋率逐渐增大,当芯壁比为1∶2时达到最大,为82.66%。喷雾干燥制备而成的微胶囊一般具有球形结构,而球形形态的微胶囊能够容纳30%的有效载量[18],因此随着芯壁比的进一步降低,可能造成壁材的浪费。且期望得到较高载量的椰子油微胶囊,选择芯壁比为1∶2进行下一步实验。
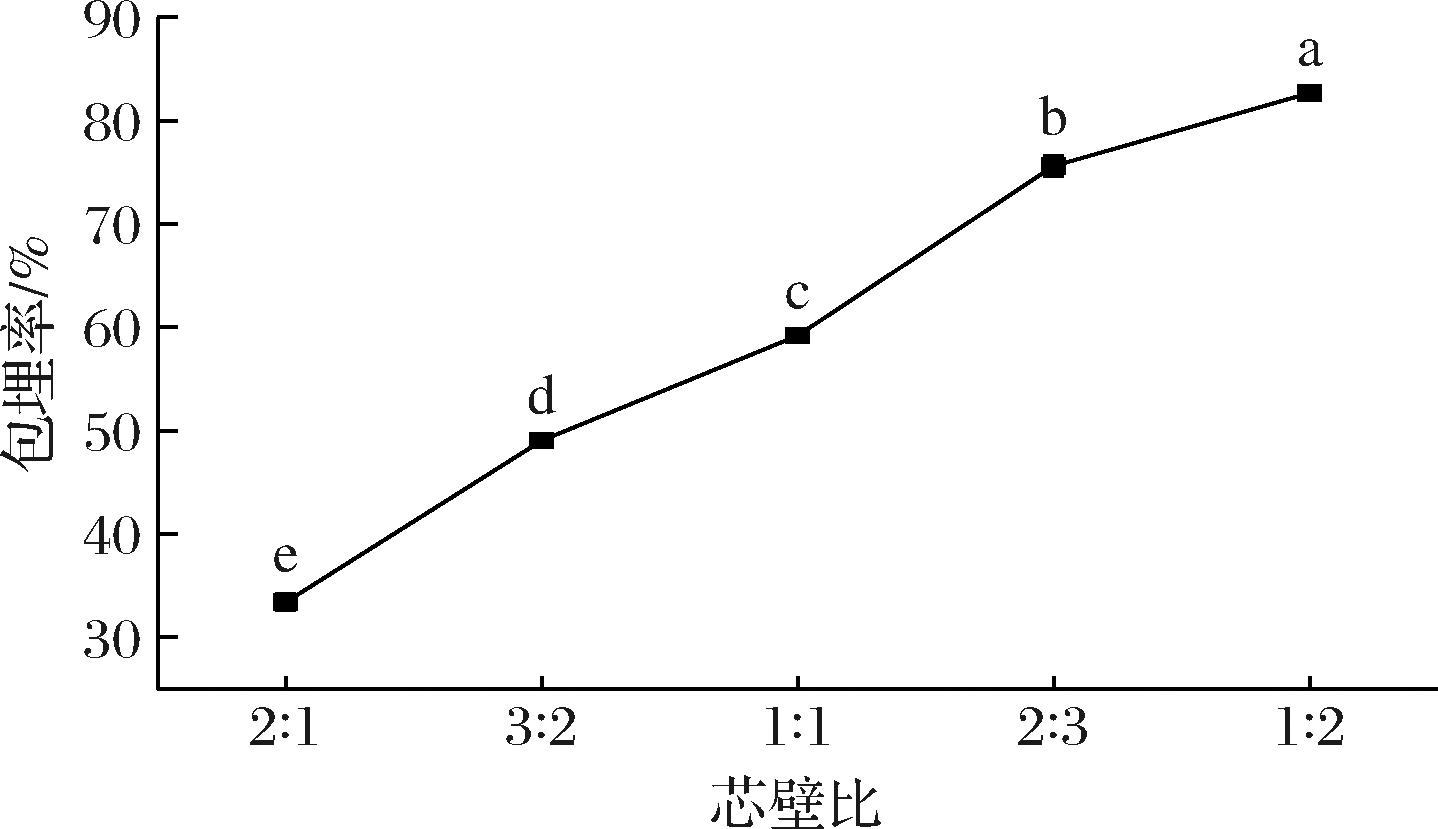
图2 芯壁比对椰子油微胶囊包埋率的影响
Fig.2 Effect of core-to-wall ratio on the encapsulation efficiency of coconut oil microcapsules
2.1.3 GA和WPI质量比对包埋率的影响
在芯壁比为1∶2,固形物含量为5%时,GA和WPI的质量比对椰子油微胶囊包埋率的影响如图3所示,随着GA和WPI的质量比的降低,包埋率呈先增大后降低的趋势。当m(GA)∶m(WPI)=1∶2时,椰子油微胶囊的包埋率达到最大,为85.57%。由于GA和WPI在微胶囊的制备中分别主要起到成膜和乳化的作用,当GA和WPI的质量比较大时,阿拉伯胶所具有的较好的成膜性可能使得干燥速度变慢,进而降低了微胶囊的包埋率[19];当乳清分离蛋白添加量过低,乳化作用不足造成乳液的不稳定,从而降低了包埋率。此外,微胶囊外壁的强度随着GA添加量的降低而降低,造成芯材的损失和微胶囊包埋率的降低[20]。因此,选择GA和WPI的质量比为1∶2进行下一步实验。
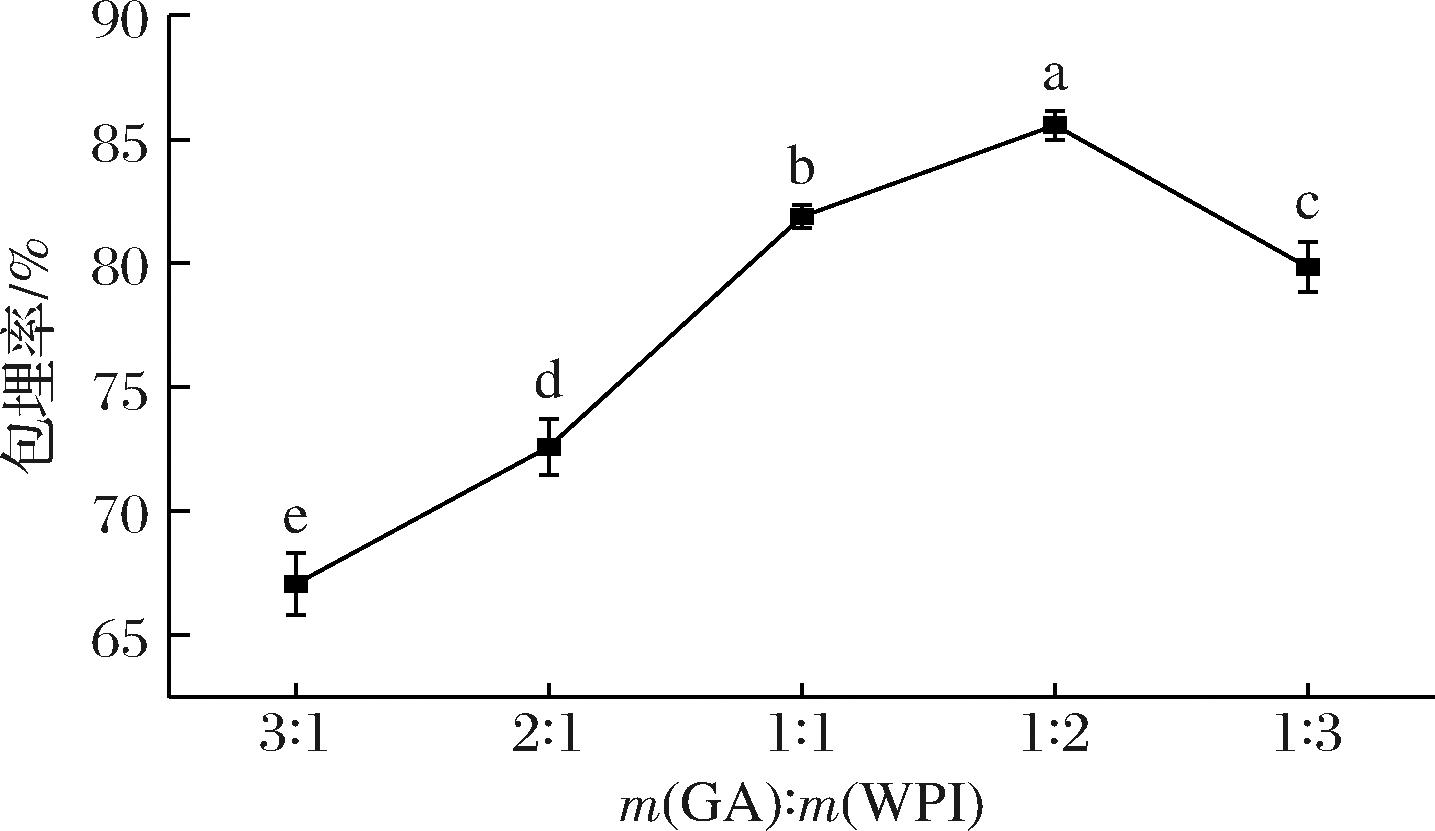
图3 GA和WPI的质量比对椰子油微胶囊包埋率的影响
Fig.3 Effect of the mass ratio of GA and WPI on the encapsulation efficiency of coconut oil microcapsules
2.2 正交试验
在单因素试验的基础上,以芯壁比(A)、GA和WPI的质量比(B)和固形物含量(C)为因素,以包埋率为判断标准,进行L9(33)正交试验(表1)。实验结果如表2所示。
表1 因素水平表
Table 1 Factor level table

水平因素A(芯壁比)B[m(GA)∶m(WPI)]C(固形物含量)/%11∶12∶3522∶31∶27.531∶21∶310
表2 正交试验结果及分析
Table 2 Results and analysis of orthogonal test
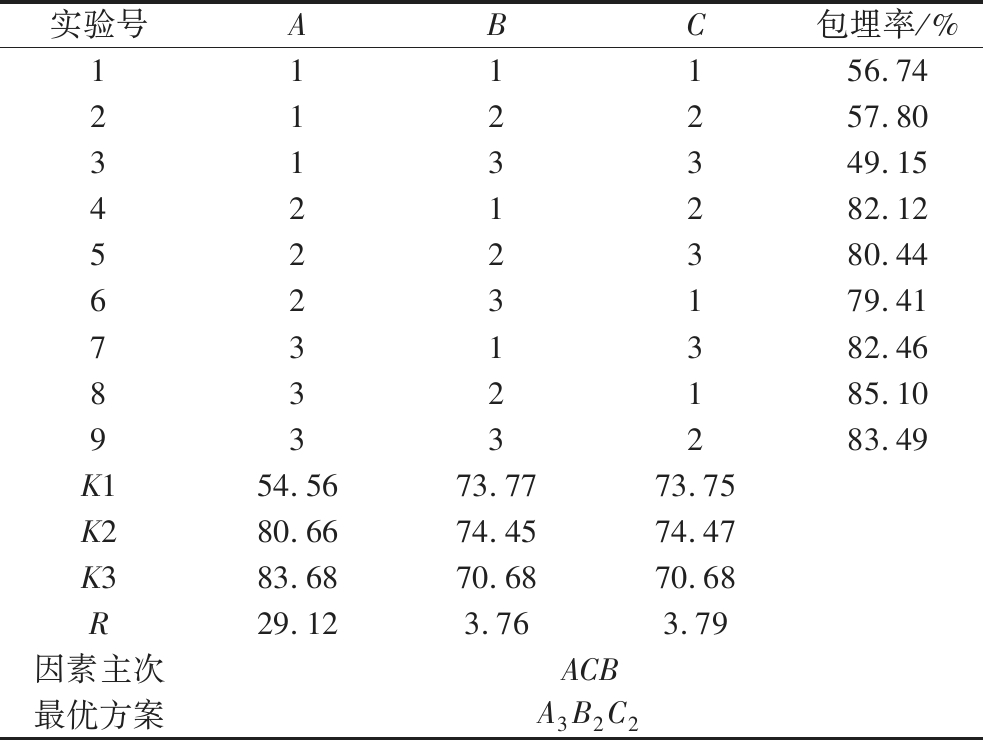
实验号ABC包埋率/%111156.74212257.80313349.15421282.12522380.44623179.41731382.46832185.10933283.49K154.5673.7773.75K280.6674.4574.47K383.6870.6870.68R29.123.763.79因素主次ACB最优方案A3B2C2
由表2可知,各因素对微胶囊包埋率影响的主次顺序为A(芯壁比)>C(固形物含量)>B(GA和WPI的质量比),最优制备工艺为A3B2C2,即芯壁比为1∶2,阿拉伯胶和乳清分离蛋白的质量比为1∶2,固形物含量为7.5%。由于由正交试验得出的最优工艺条件不包含在上述正交表中,以最优制备工艺条件对椰子油微胶囊进行制备,椰子油微胶囊的包埋率86.50%,大于正交试验表中所有实验条件下的包埋率。
2.3 喷雾干燥条件优化
预实验发现进料温度对微胶囊包埋率没有显著影响,且进料速度与出风温度相关。因此,以下仅优化了喷雾干燥的进风温度和出风温度2个工艺参数。
2.3.1 进风温度对包埋率的影响
如图4所示,当进风温度为180 ℃时,微胶囊有最大包埋率(85.58%)。当进风温度较低时,液滴干燥速度较慢,增加了芯材在液滴中向外迁移的时间,从而降低微胶囊的包埋率[21]。此外,较低的进风温度可能导致液滴干燥不完全,导致芯材的析出和微胶囊黏壁[22]。当进风温度过高时,可能会造成微胶囊外壁的破裂和孔洞的产生。因此,选择180 ℃为微胶囊喷雾干燥的进风温度。
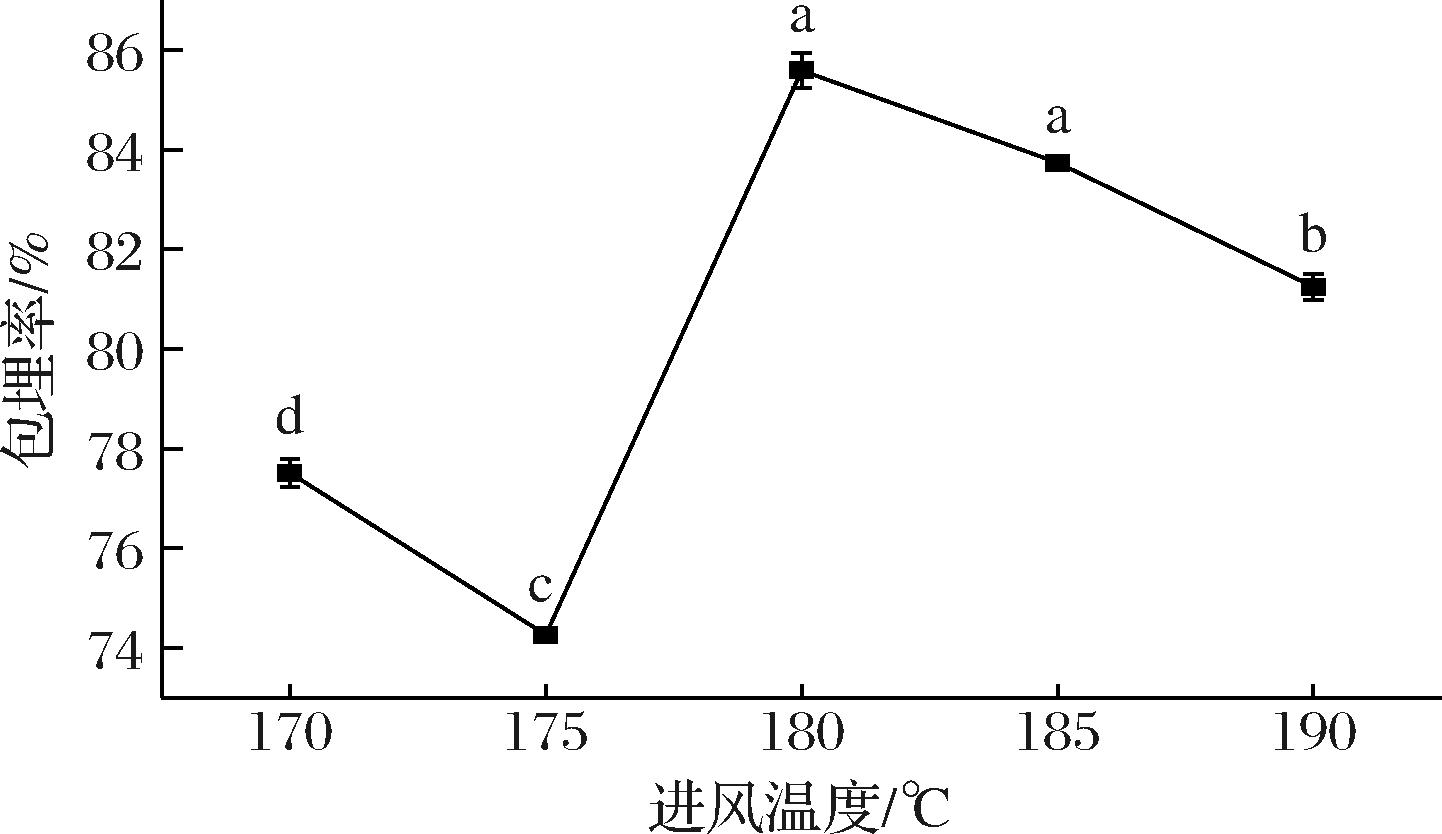
图4 进风温度对椰子油微胶囊包埋率的影响
Fig.4 Effect of inlet temperature on the encapsulation efficiency of coconut oil microcapsules
2.3.2 出风温度对包埋率的影响
如图5所示,随着进风温度的升高,微胶囊的包埋率呈先升高再降低的趋势,当出风温度为85 ℃时,椰子油微胶囊有最大包埋率,为87.61%,可达到添加可消化碳水化合物的微胶囊的包埋率水平。当进风温度不变时,出风温度由进料速度决定。当进料速度增大时,蒸发量增大,出风温度降低。而当进料速度过快时,液滴雾化困难,且干燥速度变慢,导致包埋率降低[20]。当进料速度过慢时,生产效率降低,且因水分散失过多或干燥速度过快,水分散失受阻,导致微胶囊外壁出现裂缝,引起芯材的损失[23]。因此,选择85 ℃为微胶囊喷雾干燥的出风温度。
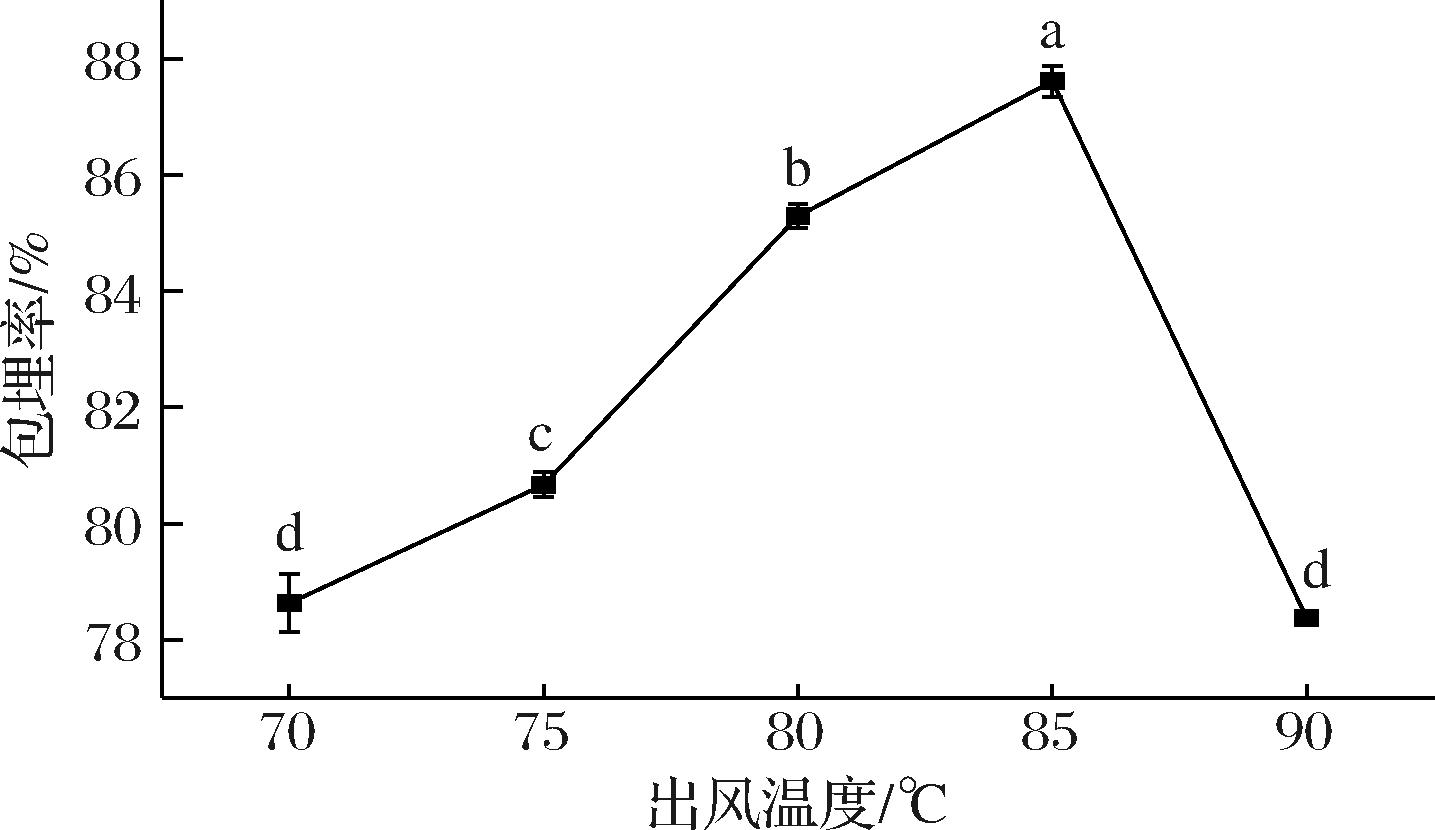
图5 出风温度对椰子油微胶囊包埋率的影响
Fig.5 Effect of outlet temperature on the encapsulation efficiency of coconut oil microcapsules
2.4 椰子油微胶囊的基本理化性质
一般认为,水分活度<0.60时,绝大多数微生物就无法生长,水分活度<0.30的粉末被认为对微生物腐败具有长期稳定性;水分含量≤4.0%是微胶囊粉末的理想特征[22]。如表3所示,微胶囊具有较低的水分含量(2.63%)和水分活度(0.252),有利于储藏。微胶囊的堆积密度会影响其零售包装和储存,实密度与其包装、运输等成本相关。较大的密度有利于减少储存空间,从而降低成本。此外,较大的实密度表明粉末内的空气含量较少,有利于减少储藏过程中的脂肪氧化。粉末的堆积密度和实密度分别为0.47 g/mL和0.54 g/mL,处于较高水平。微胶囊的CI<21%,HR<1.25,表明微胶囊具有较低的内聚性和良好的流动性。此外,微胶囊具有良好的溶解度(97.46%)、较短的润湿时间(130.00 s)和较小的平均粒径(2.10 μm),以上结果表明其具良好的食品加工特性。
表3 椰子油微胶囊的基本理化性质
Table 3 Physicochemical parameters of coconut oil microcapsules
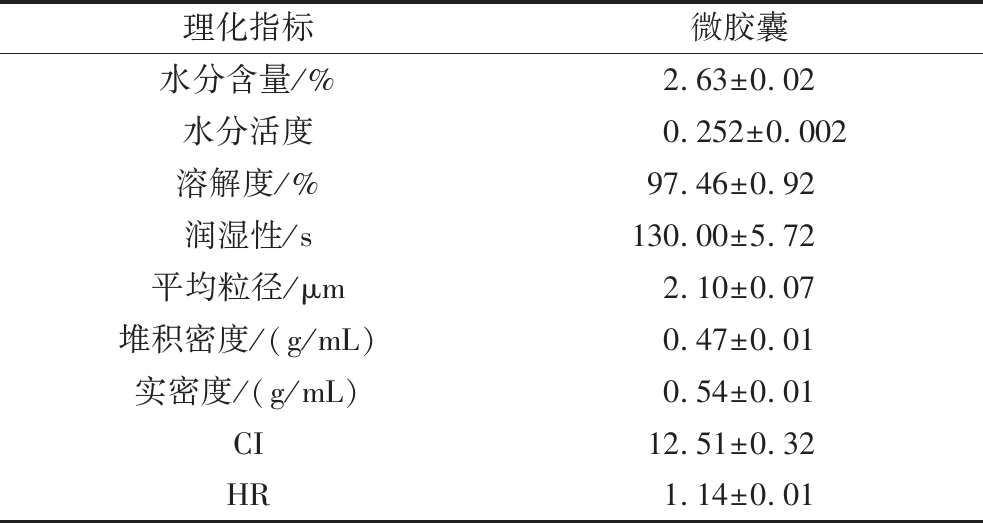
理化指标微胶囊水分含量/%2.63±0.02水分活度0.252±0.002溶解度/%97.46±0.92润湿性/s130.00±5.72平均粒径/μm2.10±0.07堆积密度/(g/mL)0.47±0.01实密度/(g/mL)0.54±0.01CI12.51±0.32HR1.14±0.01
2.5 微观结构
由图6-a可知,复溶后的微胶囊的粒径分布依然均一,芯材被很好地包埋在壁材内,且无游离脂肪酸的存在。由图6-b可知,微胶囊具有喷雾干燥粉末的特征形态。可能由于干燥过程中微胶囊收缩不均匀[12,22]或高压电子束的作用,使得微胶囊表面有不规则的褶皱存在。但微胶囊结构完整,没有裂缝或孔洞出现,从而能对芯材起到很好的保护作用。SEM图像中微胶囊表面的黑色区域表征了表面脂肪的存在[24],因此椰子油微胶囊具有较少的表面油含量,与其具有较高的包埋率一致。

a1-椰子油微胶囊的粒径分布;a2~a4-CLSM图(200×);b1-椰子油微胶囊的粒径分布;b2-SEM图(500×),b3-SEM图(5 000×)
图6 椰子油微胶囊的粒径分布及微观结构图
Fig.6 Microscopic particle size distribution and structure of coconut oil microcapsules
2.6 热重分析
通过热重分析可以了解样品的耐热性。如图7所示,可将GA、WPI和椰子油微胶囊的失重分为两个阶段。第一个阶段为低于150 ℃时,水分的蒸发和挥发性物质的损失;第二个阶段为高于150 ℃时,化学键的断裂引起的重量损失。WPI在150~500 ℃之间发生的失重源自S—S、O—N、O—O键及氨基酸残基中共价肽键的断裂[25]。由于碳水化合物环的脱水、分解和解聚,GA的一半以上的失重发生在200~400 ℃之间[26]。椰子油的热稳定性高于GA和WPI,其主要在220~440 ℃之间发生失重,且几乎损失了所有重量。最大降解速率对应的降解温度来表征样品的热稳定性,观察到椰子油微胶囊最大失重速率所对应的温度(346.00 ℃)显著高于椰子油的最大失重速率所对应的温度(379.33 ℃),即芯材的热稳定性提高,表明了壁材对芯材的保护作用[27]。且椰子油微胶囊能在低于150 ℃的条件下仅损失4.24%的重量,其中2.63%属于水分损失,因此其能够满足大多数食品的热加工需要。
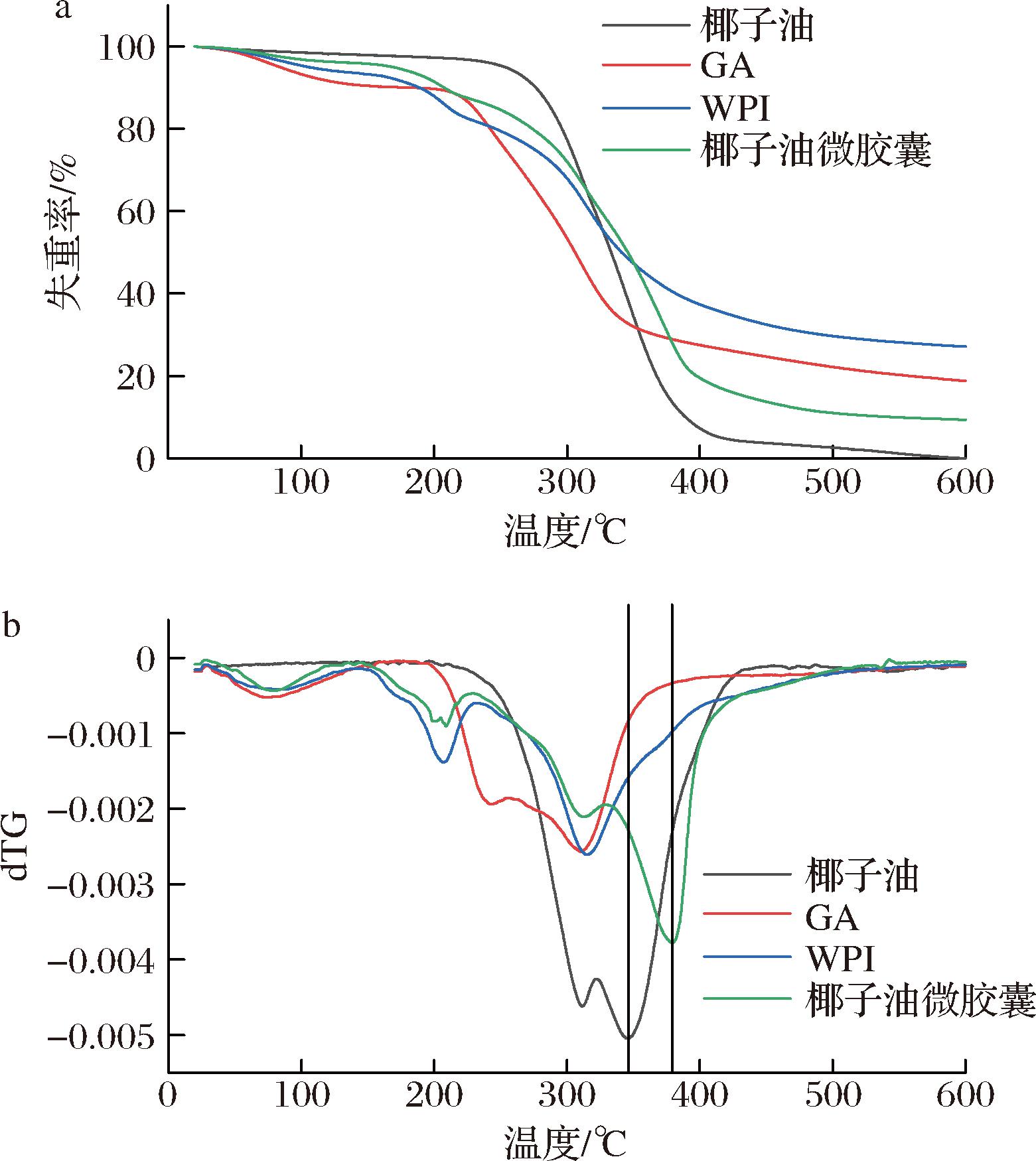
a-失重曲线;b-降解速率曲线
图7 椰子油、GA、WPI和椰子油微胶囊的热重分析曲线
Fig.7 Thermogravimetric analysis curves of coconut oil, GA, WPI and coconut oil microcapsules
2.7 耐金属离子稳定性
由于金属离子能够产生静电屏蔽效应、影响蛋白质的乳化性、造成蛋白质之间的交联,从而对微胶囊的稳定性产生影响[28]。Ca2+、Fe2+、Mg2+和Na+对乳液稳定性的影响如表4和图8所示。随着金属离子浓度的增大,乳液的电位绝对值减小。其中Na+对乳液的电位影响最小,推测这是由于其带电荷量较低。Fe2+对乳液电位的影响最大,当Fe2+的浓度为200 mmol/L时,乳液开始带正电。这可能与Fe2+易被氧化,氧化后带电量增多有关。随金属离子浓度的增大,乳液的平均粒径整体呈增大趋势,部分波动可能是由于粒径测试过程中的稀释和搅拌对液滴的破坏造成的[29]。其中添加Fe2+的乳液的平均粒径变化最大。当Fe2+浓度为50 mmol/L时,乳液粒径大幅增大(1 505.5 nm)。对其微观结构进行观察发现,乳液发生了聚集和破乳。对金属离子浓度为200 mmol/L的乳液微观结构进行观察发现,Ca2+、Mg2+、Na+没有对乳液的完整性造成影响,且乳液未发生聚集,推测此时空间位阻效应占主导作用[30]。乳液的PDI值与粒径分布变化一致,即PDI值较大时,乳液的粒径分布较宽或呈多峰分布。
表4 金属离子浓度对椰子油微胶囊稳定性的影响
Table 4 Effect of metal ion concentration on the stability of coconut oil microcapsule
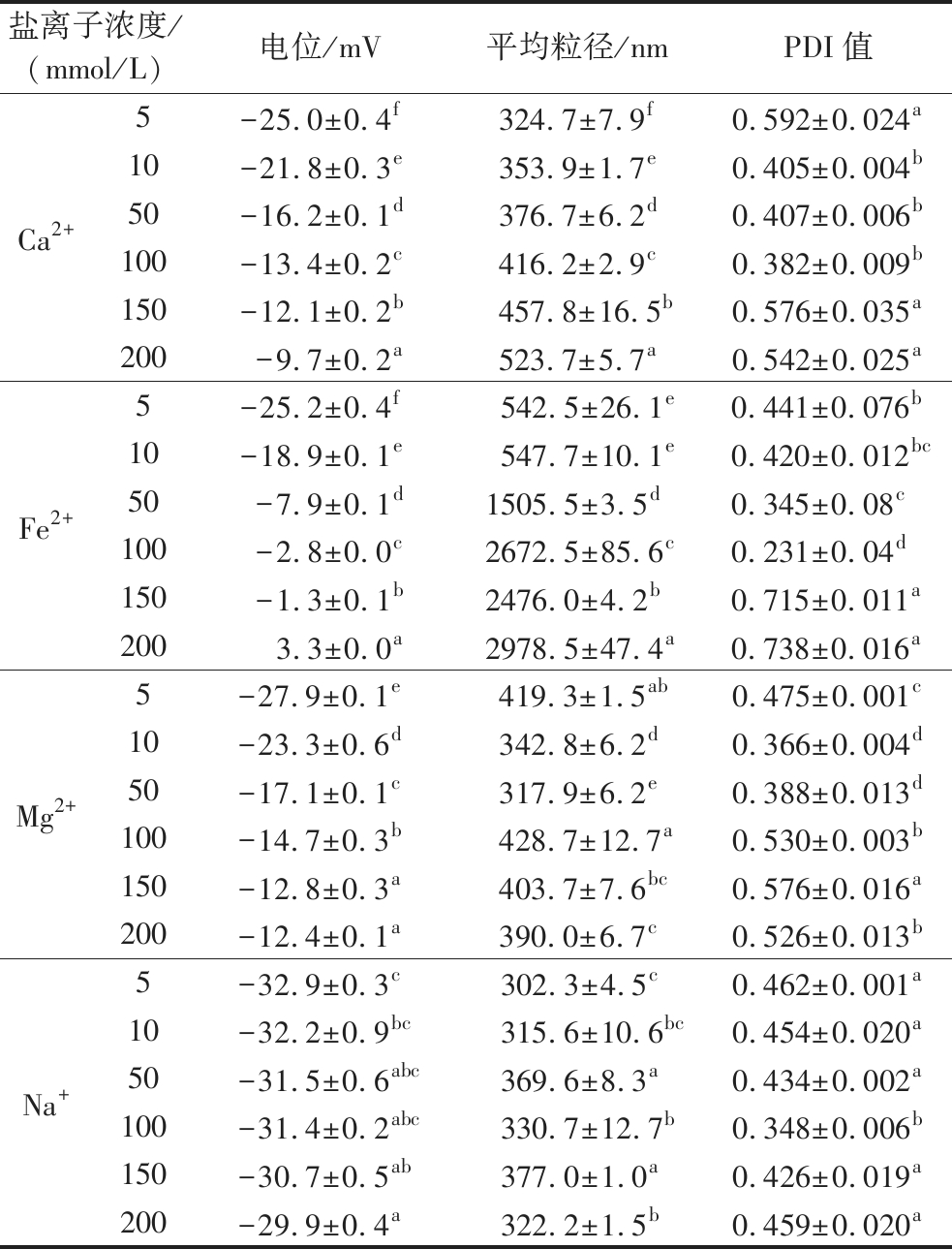
盐离子浓度/(mmol/L)电位/mV平均粒径/nmPDI值Ca2+5-25.0±0.4f324.7±7.9f0.592±0.024a10-21.8±0.3e353.9±1.7e0.405±0.004b50-16.2±0.1d376.7±6.2d0.407±0.006b100-13.4±0.2c416.2±2.9c0.382±0.009b150-12.1±0.2b457.8±16.5b0.576±0.035a200-9.7±0.2a523.7±5.7a0.542±0.025aFe2+5-25.2±0.4f542.5±26.1e0.441±0.076b10-18.9±0.1e547.7±10.1e0.420±0.012bc50-7.9±0.1d1505.5±3.5d0.345±0.08c100-2.8±0.0c2672.5±85.6c0.231±0.04d150-1.3±0.1b2476.0±4.2b0.715±0.011a2003.3±0.0a2978.5±47.4a0.738±0.016aMg2+5-27.9±0.1e419.3±1.5ab0.475±0.001c10-23.3±0.6d342.8±6.2d0.366±0.004d50-17.1±0.1c317.9±6.2e0.388±0.013d100-14.7±0.3b428.7±12.7a0.530±0.003b150-12.8±0.3a403.7±7.6bc0.576±0.016a200-12.4±0.1a390.0±6.7c0.526±0.013bNa+5-32.9±0.3c302.3±4.5c0.462±0.001a10-32.2±0.9bc315.6±10.6bc0.454±0.020a50-31.5±0.6abc369.6±8.3a0.434±0.002a100-31.4±0.2abc330.7±12.7b0.348±0.006b150-30.7±0.5ab377.0±1.0a0.426±0.019a200-29.9±0.4a322.2±1.5b0.459±0.020a
注:同一处理间同列不同字母表示差异性显著(P<0.05)(下同)。

a~d-Ca2+、Fe2+、Mg2+、Na+;1-粒径分布;2-蛋白通道;3-脂肪通道;4-双通道(200×)
图8 金属离子浓度对椰子油微胶囊粒径分布及微观形态的影响
Fig.8 Effect of metal ion concentration on particle size distribution and morphology of coconut oil microcapsule
2.8 耐酸稳定性
有机酸(柠檬酸)和无机酸(盐酸)对微胶囊稳定性的影响如表5和图9所示。WPI的等电点在5.0左右,因此当乳液pH从5.0降低到4.0时,两组乳液的电位、平均粒径和PDI值变化幅度显著提高。此外,随pH值的降低,乳液的电位绝对值逐渐降低。当添加柠檬酸的乳液pH值降低到2.0,添加盐酸的乳液pH值降低到1.0时,乳液开始带正电。随着pH值的降低,添加柠檬酸的乳液粒径呈先增大后减小的趋势,当pH=3.0时,有最大值为4 716.0 nm。可能由于随着pH的进一步降低,乳液的带电性发生改变,且电位值增大,使得添加柠檬酸的乳液粒径减小。随着pH值的降低,添加盐酸的乳液粒径逐渐增大,当pH=1.0时,乳液粒径有最大值为8 140.5 nm。对pH=3.0和pH=1.0的乳液微观结构进行观察发现,添加柠檬酸的乳液未发生聚集,且保持了良好的结构。而当pH=1.0时,添加盐酸的乳液发生了轻微破乳。总的来说,微胶囊在广泛pH下都能保持稳定。此外,可能由于柠檬酸和盐酸的电离情况不同,微胶囊对有机酸的稳定性高于无机酸。
表5 pH对椰子油微胶囊稳定性的影响
Table 5 Effect of pH on the stability of coconut oil microcapsule
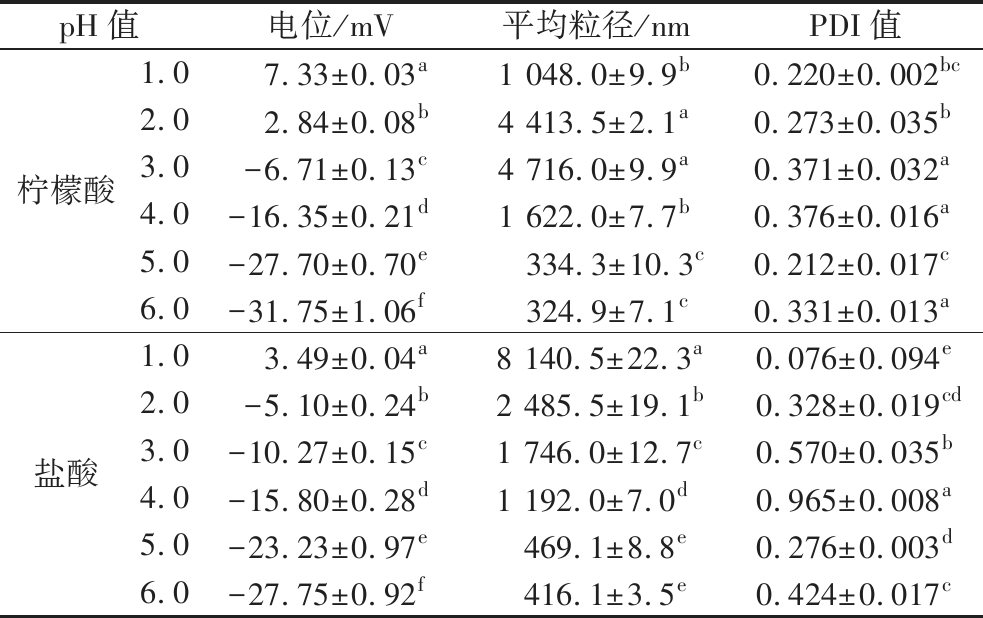
pH值电位/mV平均粒径/nmPDI值柠檬酸1.0 7.33±0.03a1 048.0±9.9b0.220±0.002bc2.02.84±0.08b4 413.5±2.1a0.273±0.035b3.0-6.71±0.13c4 716.0±9.9a0.371±0.032a4.0-16.35±0.21d1 622.0±7.7b0.376±0.016a5.0-27.70±0.70e334.3±10.3c0.212±0.017c6.0-31.75±1.06f324.9±7.1c0.331±0.013a盐酸1.0 3.49±0.04a8 140.5±22.3a0.076±0.094e2.0-5.10±0.24b2 485.5±19.1b0.328±0.019cd3.0-10.27±0.15c1 746.0±12.7c0.570±0.035b4.0-15.80±0.28d1 192.0±7.0d0.965±0.008a5.0-23.23±0.97e469.1±8.8e0.276±0.003d6.0-27.75±0.92f416.1±3.5e0.424±0.017c
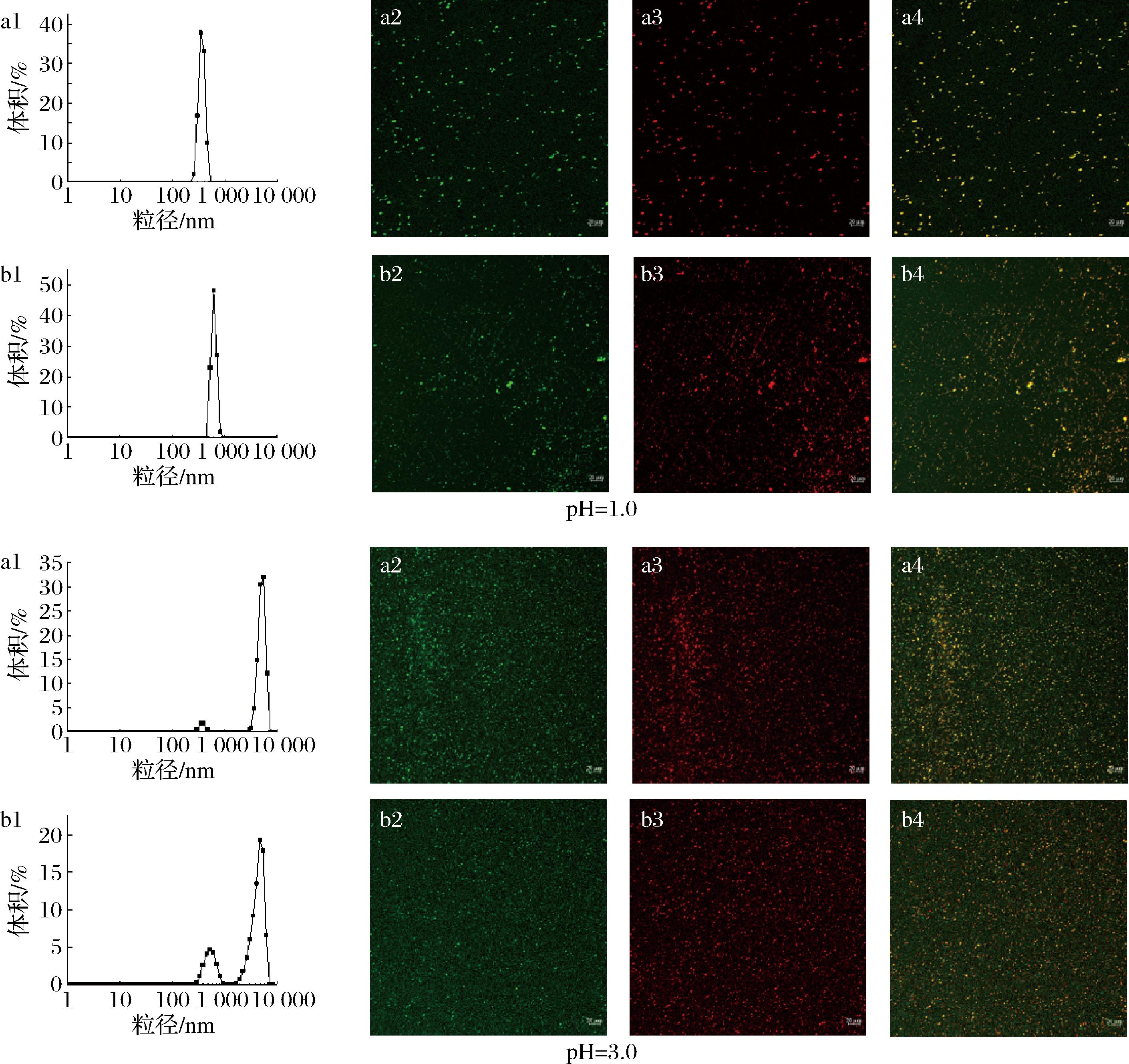
a-柠檬酸;b-盐酸;1-粒径分布;2-蛋白通道;3-脂肪通道;4-双通道(200×)
图9 pH对椰子油微胶囊的粒径分布及微观形态的影响
Fig.9 Effect of pH on particle size distribution and morphology of coconut oil microcapsule
2.9 体外模拟消化释放性能分析
2.9.1 芯材累计释放率
体外模拟消化中,椰子油微胶囊及其物理混合物中芯材释放情况如图10所示,其中0、0 ~120、120~240 min分别为口腔、胃和肠消化阶段。
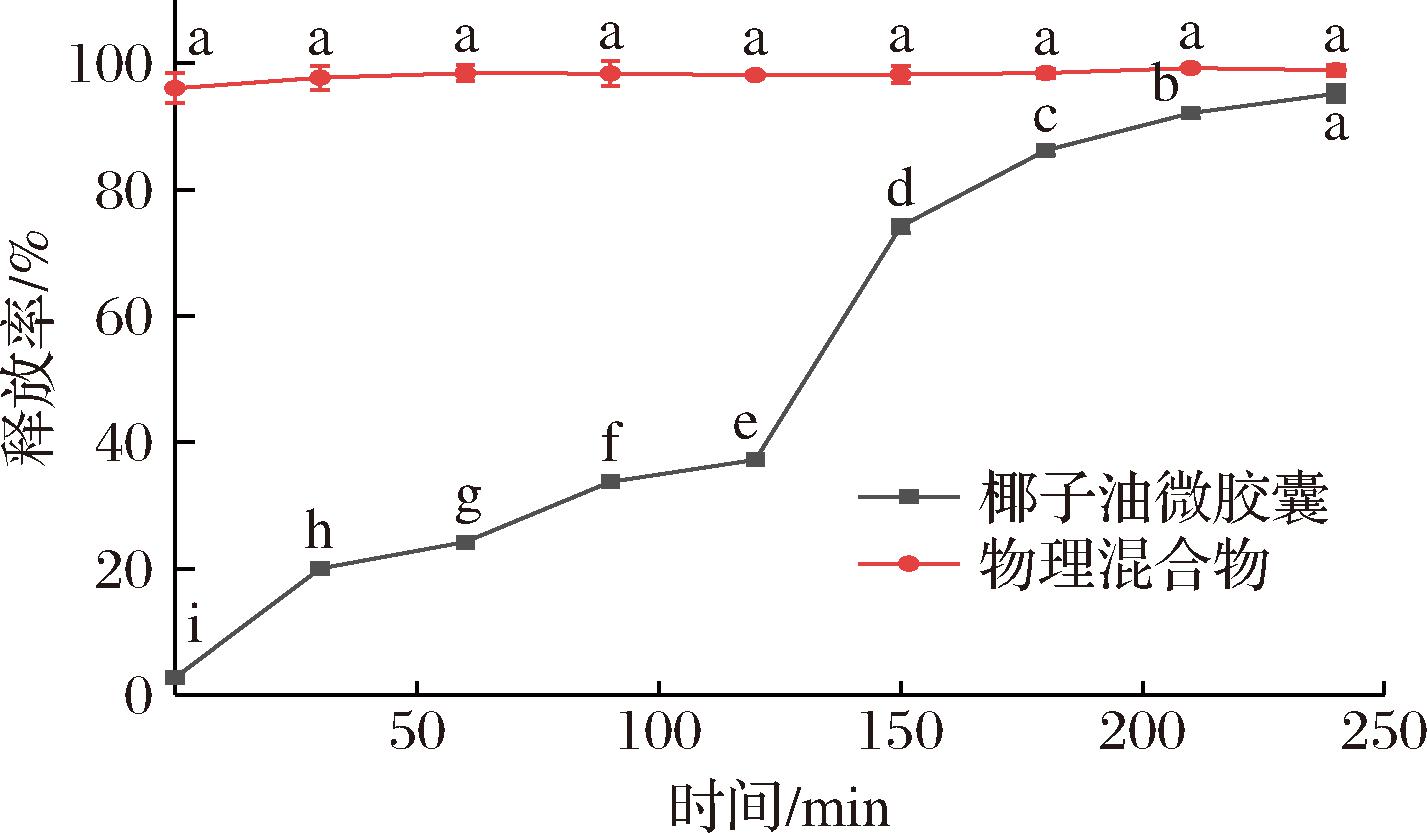
图10 椰子油微胶囊及其物理混合物体外模拟消化中芯材释放率
Fig.10 Release rate of core material during in vitro simulated digestion of coconut oil microcapsules and its physical mixture
物理混合物对芯材只有乳化作用,截留作用较差,因此椰子油在口腔中的释放率高达96.04%,当在胃液中继续消化30 min时已全部释放。由于椰子油微胶囊不含α-淀粉酶的底物,椰子油微胶囊中芯材在口腔中的释放主要为表面油脂的释放,为2.75%。在胃消化阶段,胃蛋白酶使得壁材中的乳清分离蛋白发生初步水解,芯材部分释放,其在胃中的释放率为34.48%。由于壁材中乳清分离蛋白的占比较大,椰子油微胶囊在胃消化液中的释放量相对较高[31-32]。随着消化的进行,在肠道消化液中胰蛋白酶、脂肪酶和胆盐的作用下,蛋白质及蛋白质与多糖之间的相互作用被破坏[31],芯材被大量释放。当消化2 h后,芯材几乎被完全释放,总释放率高达95.21%。
2.9.2 芯材释放动力学分析
通过对椰子油微胶囊在胃和肠中的释放情况进行释放动力学分析发现,椰子油微胶囊在胃和肠中的释放均与Ritger-Peppas释放模型有较高的相关性,拟合方程和相关指数如表6所示。当n<0.45时,为Fick扩散;当0.45<n<0.89时,为不规则扩散;当n>0.89时,为溶蚀传质扩散[33]。因此,芯材在胃液中的消化释放机制属于不规则扩散,主要由微胶囊逐渐被破坏造成。芯材在肠液中的释放机制为Fick扩散。此外,椰子油微胶囊在肠消化液中的释放速率显著高于其在胃消化液中的释放速率。
表6 椰子油微胶囊在体外模拟消化过程中芯材释放模型拟合
Table 6 Fitting results of Ritger-Peppas model for core material release of coconut oil microcapsules during in vitro simulated digestion

消化阶段拟合方程释放速率常数(k)扩散指数(n)R2胃Q=3.52t0.493.520.490.955 8肠Q=41.77t0.1841.770.180.955 2
注:其中t为时间,Q为t时间下椰子油微胶囊的芯材释放率。
3 结论
本研究以低分子质量阿拉伯胶和乳清分离蛋白为壁材,通过喷雾干燥法进行生酮椰子油微胶囊的制备。结果表明,在不添加可消化碳水化合物类壁材的情况下,生酮椰子油微胶囊的包埋率可高达87.61%。其水分含量和水分活度分别为2.63%和0.252,处于较低水平,有利于微胶囊的储藏。椰子油微胶囊具有良好的溶解度、润湿性和流动性,较小的平均粒径和完整的表面结构,且能满足一般食品热加工的需要。此外,其对有机酸、无机酸和金属离子的耐受性较强,能够满足复杂的食品体系的需要。体外模拟消化发现,椰子油微胶囊分别在口腔、胃和肠道释放了2.75%、34.48%和57.98%的芯材,具有缓释作用,且总芯材释放率高达95.21%。总的来说,加工性能良好、包埋率较高的生酮椰子油微胶囊的制备为生酮食品的开发提供了新的原料。
[1] SAMPAIO L P.Ketogenic diet for epilepsy treatment[J].Arquivos De Neuro-Psiquiatria, 2016,74(10):842-848.
[2] SUN S Y, KONG Z W, SHI Q D, et al.Carbohydrate restriction with or without exercise training improves blood pressure and insulin sensitivity in overweight women[J].Healthcare, 2021, 9(6):637.
[3] DY KA D, KOWALCZE K, PAZIEWSKA A.The role of ketogenic diet in the treatment of neurological diseases[J].Nutrients, 2022, 14(23):5003.
KA D, KOWALCZE K, PAZIEWSKA A.The role of ketogenic diet in the treatment of neurological diseases[J].Nutrients, 2022, 14(23):5003.
[4] CINCIONE I R, GRAZIADIO C, MARINO F, et al.Short-time effects of ketogenic diet or modestly hypocaloric Mediterranean diet on overweight and obese women with polycystic ovary syndrome[J].Journal of Endocrinological Investigation, 2023, 46(4):769-777.
[5] CHEN M Y, ZHAO J L, DING X M, et al.Ketogenic diet and calorie-restricted diet attenuate ischemic brain injury via UBR4 and downstream CamkⅡ/TAK1/JNK signaling[J].Journal of Functional Foods, 2023, 100:105368.
[6] SURYANI S, SARIANI S, EARNESTLY F, et al.A comparative study of virgin coconut oil, coconut oil and palm oil in terms of their active ingredients[J].Processes, 2020, 8(4):402.
[7] ZAKARIA Z A, SOMCHIT M N, MAT JAIS A M, et al.In vivo antinociceptive and anti-inflammatory activities of dried and fermented processed virgin coconut oil[J].Medical Principles and Practice:International Journal of the Kuwait University, Health Science Centre, 2011, 20(3):231-236.
[8] 黄欢, 田燕, 刘一哲, 等.椰子油纳米乳液制备工艺优化及其稳定性分析[J].食品工业科技, 2023, 44(9):10-19.
HUANG H, TIAN Y, LIU Y Z, et al.Optimization of preparation technology and stability analysis of coconut oil nanoemulsion[J].Science and Technology of Food Industry, 2023, 44(9):10-19.
[9] N P D, KONDENGADAN M S, SWEILAM S H, et al.Neuroprotective role of coconut oil for the prevention and treatment of Parkinson’s disease:Potential mechanisms of action[J].Biotechnology &Genetic Engineering Reviews, 2022:1-33.
[10] SAN S M, JATURANPINYO M, LIMWIKRANT W.Effects of wall material on medium-chain triglyceride (MCT) oil microcapsules prepared by spray drying[J].Pharmaceutics, 2022, 14(6):1281.
[11] KARRAR E, MAHDI A A, SHETH S, et al.Effect of maltodextrin combination with gum Arabic and whey protein isolate on the microencapsulation of gurum seed oil using a spray-drying method[J].International Journal of Biological Macromolecules, 2021, 171:208-216.
[12] OZDEMIR N, BAYRAK A, TAT T, et al.Microencapsulation of basil essential oil:Utilization of gum Arabic/whey protein isolate/maltodextrin combinations for encapsulation efficiency and in vitro release[J].Journal of Food Measurement and Characterization, 2021, 15(2):1865-1876.
[13] NAYANA N, MARY ABRAHAM L, PADMA ISHWARYA S, et al.Spray-dried microcapsules of red palm olein-flaxseed oil blend:Development, physicochemical characterization, and evaluation of its potential applications as a fat replacer and β-carotene fortificant in cupcakes[J].Journal of Food Processing and Preservation, 2021, 45(9):587-596.
[14] 黄英雄, 孙红明, 华聘聘.微胶囊化粉末油脂制品表面油测定方法的研究[J].中国油脂, 2002, 27(4):61-63.
HUANG Y X, SUN H M, HUA P P.Research on the methods of determining the surface oil of microencapsulated powdered oil[J].China Oils and Fats, 2002, 27(4):61-63.
[15] 龙吉云. 高含量天然维生素E油微胶囊化研究[D].南昌:南昌大学, 2011.
LONG J Y.Study on Micro-capsulation of high content natural vitamin E oil[D].Nanchang:Nanchang University, 2011.
[16] MINEKUS M, ALMINGER M, ALVITO P, et al.A standardised static in vitro digestion method suitable for food - an international consensus[J].Food &Function, 2014, 5(6):1113-1124.
[17] 陈春容, 王卉, 白燕.鱼油微胶囊喷雾干燥工艺优化及贮藏稳定性研究[J].食品工业, 2022, 43(5):96-100.
CHEN C R, WANG H, BAI Y.Optimization of spray drying process for fish oil microcapsule and study on its storage stability[J].The Food Industry, 2022, 43(5):96-100.
[18] OLIVEIRA É R, FERNANDES R V B, BOTREL D A, et al.Study of different wall matrix biopolymers on the properties of spray-dried pequi oil and on the stability of bioactive compounds[J].Food and Bioprocess Technology, 2018, 11(3):660-679.
[19] 黄芳丽, 唐婷范, 朱家庆, 等.蒜头果油微胶囊制备工艺优化及性质分析[J].中国油脂, 2021, 46(12):88-94.
HUANG F L, TANG T F, ZHU J Q, et al.Preparation process optimization and properties of Malania oleifera oil microcapsules[J].China Oils and Fats, 2021, 46(12):88-94.
[20] 林荣芳, 徐梦豪, 高丽伟, 等.响应面法优化DHA藻油微胶囊工艺[J].食品研究与开发, 2022, 43(12):114-123.
LIN R F, XU M H, GAO L W, et al.Optimization of DHA algal oil microcapsule processing using response surface methodology[J].Food Research and Development, 2022, 43(12):114-123.
[21] 戚家栋. 番荔枝子油微胶囊化工艺[J].食品工业, 2019, 40(10):45-47.
QI J D.Microencapsulation technology of Annona seed oil[J].The Food Industry, 2019, 40(10):45-47.
[22] 岳昊, 邱斌, 张文龙, 等.功能油脂微胶囊的工艺优化及稳定性研究[J].食品研究与开发, 2020, 41(15):51-57.
YUE H, QIU B, ZHANG W L, et al.Process optimization and stability study of functional oil microcapsules[J].Food Research and Development, 2020, 41(15):51-57.
[23] KORMA S A, WEI W, ALI A H, et al.Spray-dried novel structured lipids enriched with medium-and long-chain triacylglycerols encapsulated with different wall materials:Characterization and stability[J].Food Research International, 2019, 116:538-547.
[24] TABOADA M L, HEIDEN-HECHT T, BRÜCKNER-GÜHMANN M, et al.Spray drying of emulsions:Influence of the emulsifier system on changes in oil droplet size during the drying step[J].Journal of Food Processing and Preservation, 2021, 45(9):1-10.
[25] HUNDRE S Y, KARTHIK P, ANANDHARAMAKRISHNAN C.Effect of whey protein isolate and β-cyclodextrin wall systems on stability of microencapsulated vanillin by spray-freeze drying method[J].Food Chemistry, 2015, 174:16-24.
[26] BA YI
YI IT B, SA
IT B, SA LAM H, KANDEMIR
LAM H, KANDEMIR  , et al.Microencapsulation of sour cherry oil by spray drying:Evaluation of physical morphology, thermal properties, storage stability, and antimicrobial activity[J].Powder Technology, 2020, 364:654-663.
, et al.Microencapsulation of sour cherry oil by spray drying:Evaluation of physical morphology, thermal properties, storage stability, and antimicrobial activity[J].Powder Technology, 2020, 364:654-663.
[27] ZHU J Y, LI X T, LIU L, et al.Preparation of spray-dried soybean oil body microcapsules using maltodextrin:Effects of dextrose equivalence[J].LWT, 2022, 154:112874.
[28] 王磊. 基于乳清分离蛋白乳状液体系的维生素E的包埋和保护研究[D].无锡:江南大学, 2015.
WANG L.Study on the encapsulation and protection of vitamin E based on whey protein isolate stabilized emulsion system[D].Wuxi:Jiangnan University, 2015.
[29] OZTURK B, ARGIN S, OZILGEN M, et al.Formation and stabilization of nanoemulsion-based vitamin E delivery systems using natural surfactants:Quillaja saponin and lecithin[J].Journal of Food Engineering, 2014, 142:57-63.
[30] KIM Y J, KIM B K, LEE M H.Effect of small molecular surfactants on physical, turbidimetric, and rheological properties of Pickering nanoemulsions stabilized with whey protein isolate[J].Food Bioscience, 2023, 51:102214.
[31] 张程超. DHA藻油双层纳米乳液的制备及应用[D].无锡:江南大学, 2021.
ZHANG C C.Preparation and application of DHA algae oil bialayer nanoemulsion[D].Wuxi:Jiangnan University, 2021.
[32] 吴汶静, 宗爱珍, 李子松, 等.中碳链脂肪酸甘油三酯微胶囊制备优化及性质分析[J].中国粮油学报, 2023, 38(12):158-166.
WU W J, ZONG A Z, LI Z S, et al.Preparation process optimization and properties of medium carbon chain fatty acid triglyceride microcapsules[J].Journal of the Chinese Cereals and Oils Association, 2023, 38(12):158-166.
[33] 王帝, 张海娇, 冯晓梅, 等.南极磷虾油纳米复合微胶囊制备、表征及其性质研究[J].食品科技, 2022, 47(7):236-242.
WANG D, ZHANG H J, FENG X M, et al.Preparation, characterization and properties of Antarctic krill oil nanocomposite microcapsules[J].Food Science and Technology, 2022, 47(7):236-242.