五倍子是漆树科植物上因昆虫攻击和卵的沉积而生成的虫瘿,目前我国的五倍子产量和质量均居世界第一。单宁酸是五倍子中最主要的成分,又称为丹宁、鞣酸,是一种多酚类化合物,具有广泛的生理活性,如抗菌、抗炎、抗氧化、抗病毒、抗寄生虫等[1]。它在制革、食品中的应用具有非常悠久的历史,近年来,在医药、饲料、化妆品等领域中的应用也逐渐吸引了广大学者的关注。但是单宁酸本身具有强烈的涩味,使得其接受性较差,且它的稳定性容易受到光照、温度、湿度及氧气等外界环境的影响,使其在实际应用中受到一定的限制。采用适当的包埋技术将单宁酸进行包埋,以掩蔽其涩味,并且隔绝单宁酸与外界环境的接触,有利于保持单宁酸的生物活性,有助于单宁酸的加工与利用。
目前利用微胶囊技术解决物质不良气味和滋味、提高物质稳定性和定向释放等方面的研究较多[2-3]。喷雾干燥法及冷冻干燥法是制备微胶囊的常用方法[4],但喷雾干燥法并不适用于高黏度壁材以及有机溶剂体系,并且产品容易发生结块、黏壁等现象。而冷冻干燥法可抑制热敏性成分的氧化和化学变化,保留样品的物化性质,被认为是高品质干燥产品的最佳生产方法。用于制备微胶囊的壁材种类繁多,被广泛应用于多酚负载的天然大分子主要有蛋白质、糖类、脂质等,多糖因其成本低、来源广等特点被广泛用作微胶囊的壁材[5]。魔芋葡甘聚糖作为一种天然高分子多糖,具有良好的成膜性、增稠性和溶解性,可与多酚物质黏合,使具有多种生理活性的多酚类物质呈现出更好的药物包封率和生物利用度,已成功地用于苹果多酚的包埋中,而且制备得到的微胶囊产品具有良好的缓释作用[6]。目前国内对单宁酸进行微胶囊化的研究还相对较少。
本试验以魔芋葡甘聚糖作为包埋的壁材,结合冷冻干燥法制备单宁酸微胶囊,以包埋率为评价指标,通过单因素以及正交试验优化制备工艺,并对其基本性质、体外释放性能、以及抗氧化活性、抑菌性进行测定,以期达到掩蔽单宁酸的涩味、提高其稳定性的目的。同时也为单宁酸的进一步开发和利用提供理论依据及技术支持。
1 材料与方法
1.1 材料与试剂
五倍子单宁酸(纯度93%,从五倍子中提取制得),五峰赤诚生物科技股份有限公司;五倍子单宁酸微胶囊,实验室自制;魔芋葡甘聚糖,湖北强森魔芋公司;甲醇(分析纯),国药集团化学试剂有限公司;甲醇(色谱纯),美国Thermo-Fisher公司;乙酸,天津市科密欧化学试剂有限公司;单宁酸对照品、α-淀粉酶、胃蛋白酶、胰酶、DPPH、ABTS,上海源叶生物科技有限公司;LB肉汤培养基,青岛高科技工业园海博生物技术有限公司;琼脂,德国BioFroxx公司。
1.2 仪器与设备
DF-101S磁力搅拌器,武汉科尔仪器设备有限公司;LDJ-18冷冻干燥机,北京松源华兴科技发展有限公司;Tissuelyser-24多用品组织研磨仪,上海净信实业发展有限公司;CF1542R高速冷冻离心机,美国SCILOGEX公司;Thermo-U3000高效液相色谱仪、1550酶标仪,美国Thermo公司;JSM-6390LV扫描电子显微镜,美国JEOL公司;IS50傅里叶变换红外光谱仪,苏州奥普斯等离子体科技有限公司;204-F1差示扫描量热仪,美国Netzsch公司;HH-4恒温水浴锅,国华电器有限公司;LHS-24B手提式压力蒸汽灭菌锅,上海力辰邦西仪器科技有限公司;1384超净工作台,武汉贝科泰科技有限公司;HPY3000生化培养箱,武汉海声达仪器设备有限公司。
1.3 试验方法
1.3.1 五倍子单宁酸微胶囊的制备工艺
称取单宁酸溶解在水中,再根据试验条件加入壁材,通过磁力搅拌器进行搅拌,使魔芋葡甘聚糖充分溶胀,且可使壁材与芯材充分混匀。使用冷冻干燥机将混合溶液进行真空冷冻干燥。冻干结束后,经过研磨,过筛,即可得到微胶囊[6]。
1.3.2 单宁酸标准曲线的绘制
利用HPLC法进行单宁酸含量的测定。色谱条件按照常选妞等[7]的方法,并稍有改动。色谱柱:Supersil ODS2(4.6 mm×250 mm,5 μm);采用等度洗脱,流动相为V(1%乙酸水溶液)∶V(甲醇)=4∶1;检测波长为275 nm,流速1.0 mL/min,进样量10 μL,柱温25 ℃。以单宁酸的质量浓度为横坐标,峰面积为纵坐标,绘制标准曲线,得回归曲线方程:y=40.338x-0.064 9(R2=0.999 9)。
1.3.3 单宁酸微胶囊包埋率的测定
由于魔芋葡甘聚糖溶于水后具有高黏性,使用HPLC直接测定微胶囊中的单宁酸含量会比较困难。因此,微胶囊包埋率的测定采用间接测量法[8]。称取一定量的单宁酸微胶囊,加入甲醇,经过涡旋振荡,充分洗脱微胶囊表面的单宁酸,将其在5 000 r/min下离心10 min。取上清液进行氮吹至干,再用超纯水进行复溶,过0.45 μm滤膜,上机测定。根据标准曲线,即可计算出微胶囊表面的单宁酸含量,包埋率计算如公式(1)所示:
包埋率![]()
(1)
1.3.4 单宁酸微胶囊制备工艺优化
详细实验设计与结果见电子版增强附件(https://doi.org/10.13995/j.cnki.11-1802/ts.035100,下同)。
1.3.4.1 单因素试验
基于前期的预试验结果以及文献查阅,选择芯壁比、壁材浓度、反应温度以及搅拌时间作为影响因素,探究它们对单宁酸微胶囊包埋率的影响。
1.3.4.2 正交试验
根据单因素试验结果,选取芯壁比、壁材浓度、反应温度为试验变量,以单宁酸的包埋率为评价依据,采用SPSS设计L9(33)正交试验对工艺参数进行优化设计,从而确定出最佳的制备工艺。
1.4 单宁酸微胶囊理化特性分析
1.4.1 单宁酸微胶囊的微观形貌分析
取适量单宁酸微胶囊粉末平铺于样品台上,喷金,采用扫描电子显微镜观察其表面形貌。
1.4.2 单宁酸微胶囊的红外分析
将KBr与样品在干燥状态下混合均匀,充分研磨,压片后进行扫描。扫描波长范围为400~4 000 cm-1,扫描次数为32次,分为4 cm-1。
1.4.3 单宁酸微胶囊的热稳定性分析
称量5.0 mg的微胶囊粉末、魔芋葡甘聚糖、单宁酸分别置于铝坩埚中,用同样的空坩埚做参照,置于差示扫描量热仪中进行分析,温度测定范围25~250 ℃,升温速度10 ℃/min。
1.4.4 单宁酸微胶囊的缓释性能
体外模拟消化液配制参照MINEKUS等[9]的方法进行。体外模拟消化按照MINEKUS等[9]以及李东卫[10]的研究进行:1)向10 mL的模拟唾液中加入10 mg的单宁酸以及含有等量单宁酸的微胶囊,混合0.5 min;2)加入10 mL的胃模拟液,混合1 h;3)再加入20 mL的模拟肠液,混合4 h。上述混合条件:样品于50 mL锥形瓶中以150 r/min的转速在37 ℃下消化。模拟口腔阶段,0.5 min时取样,模拟胃肠消化阶段,每隔30 min取样。每次取样1 mL后,加入新鲜消化液补足体积。最后向所取样液中加入80%(体积分数)的乙醇灭酶,然后在4 ℃,12 000 r/min条件下离心10 min,收集上清液冻干处理。测定时,使用超纯水进行复溶,过0.45 μm滤膜后使用HPLC测定单宁酸的浓度。
1.4.5 单宁酸微胶囊的抗氧化性研究
称取五倍子单宁酸以及单宁酸微胶囊,溶于水中,制备成单宁酸的质量浓度为100 μg/mL的母液。之后将单宁酸及微胶囊母液稀释成25、20、15、10、5 μg/mL 5种不同质量浓度的样品溶液,备用。
1.4.5.1 样品的DPPH自由基清除能力测定
参考GENG等[11]的方法,稍作修改。配制0.2 mmol/L的DPPH溶液,避光存放。在96孔板中加入50 μL的样品液和150 μL的DPPH溶液,混匀,避光反应30 min,在517 nm处测定吸光度值A1。无水乙醇加入样品溶液做空白,测吸光度A2;无水乙醇加入DPPH作对照,测吸光度A3。以同样的方法测抗坏血酸作为阳性对照。DPPH自由基清除率的计算如公式(2)所示:
DPPH自由基清除率![]()
(2)
1.4.5.2 样品的ABTS阳离子自由基清除能力测定
参考RE等[12]的方法,稍作修改。将7 mmol/L的ABTS储存水溶液与2.45 mmol/L的K2S2O8溶液以1∶0.5的比例进行混合,在室温下避光孵育12~16 h,制备得到ABTS母液。向96孔板中加入50 μL的样液和150 μL的ABTS溶液,室温条件下避光反应8 min,在734 nm条件下测定吸光度值A1。去离子水加入样品溶液作为空白组,测吸光度值A2;去离子水中加入ABTS溶液作对照,测吸光度值为A3。以同样的方法测定抗坏血酸作为阳性对照。ABTS阳离子自由基清除率的计算如公式(3)所示:
ABTS阳离子自由基清除率![]()
(3)
1.4.6 单宁酸微胶囊的抗菌性研究
1.4.6.1 单宁酸微胶囊对肠道致病菌的抑菌效果测定
采用平板计数法[13]研究单宁酸以及单宁酸微胶囊对于大肠杆菌、金黄色葡萄球菌、鼠伤寒沙门氏菌、志贺氏菌的抑菌效果。将各个菌液和抑菌材料(0.5 mg/mL的五倍子单宁酸溶液以及含有等量的单宁酸的微胶囊溶液)按照一定的比例在样品瓶中进行混合,37 ℃培养24 h。使用无菌的PBS作为对照。分别吸取100 μL的上述悬浮液进行梯度稀释后,涂布,在37 ℃下培养24 h,然后计数菌落数。抑菌率的计算如公式(4)所示:
抑菌率![]()
(4)
1.4.6.2 单宁酸微胶囊对肠道致病菌细胞膜完整性的影响
在单宁酸微胶囊对4种肠道致病菌抑菌效果的研究基础上,分别选取金黄色葡萄球菌和大肠杆菌作为研究对象,探究单宁酸微胶囊对于其细胞膜完整性的影响。根据XIONG等[14]的方法,按照1.4.6.1节中的实验步骤将2种菌液与抑菌材料进行混合、培养。以4 000 r/min的转速离心20 min来收集菌体,加入到2.5%(体积分数)的戊二醛溶液中,在4 ℃条件下固定4 h;使用PBS漂洗3次,之后将菌体依次置于30%、50%、70%(体积分数)的乙醇溶液中。每个梯度室温放置20 min,弃去上清液,将菌体冻干后,进行观察。
1.5 数据处理与分析
采用软件Origin Pro 9.5和SPSS 26.0进行数据分析,结果用平均值±标准偏差来表示,每组试验平行3次。
2 结果与分析
2.1 五倍子单宁酸微胶囊制备工艺
在单因素试验的基础上(详细结果见电子版增强出版附件),选定芯壁比、壁材浓度和反应温度,通过正交试验和方差分析结果(详见电子版增强出版附件),发现影响单宁酸微胶囊包埋率的主次因素为芯壁比>壁材浓度>反应温度,根据各因素的最优水平确定制备单宁酸微胶囊的最佳工艺为:芯壁比1∶15、壁材质量浓度20 g/L、反应温度45 ℃,搅拌时间2.0 h。此条件下进行验证试验,包埋率为75.33%。
2.2 五倍子单宁酸微胶囊的性质分析
2.2.1 单宁酸微胶囊的形态观察
由图1可知,单宁酸微胶囊粉末呈不规则的块状,表面微有裂缝,这是由于微胶囊在预冻过程中,内部的水分形成冰晶,破坏原有结构,真空冷冻干燥时冰晶升华使微胶囊表面出现裂缝[15]。并且样品在冻干后还要经过研磨碾压才能使用,也会加剧微胶囊的形态破碎。

图1 单宁酸微胶囊的微观结构图(×400)
Fig.1 Microstructure of tannic acid microcapsules(×400)
2.2.2 单宁酸微胶囊的红外分析
傅里叶红外光谱可以用来表征微胶囊是否形成以及囊芯与壁材间的化学作用。五倍子单宁酸、魔芋葡甘聚糖、微胶囊的红外光谱如图2所示。
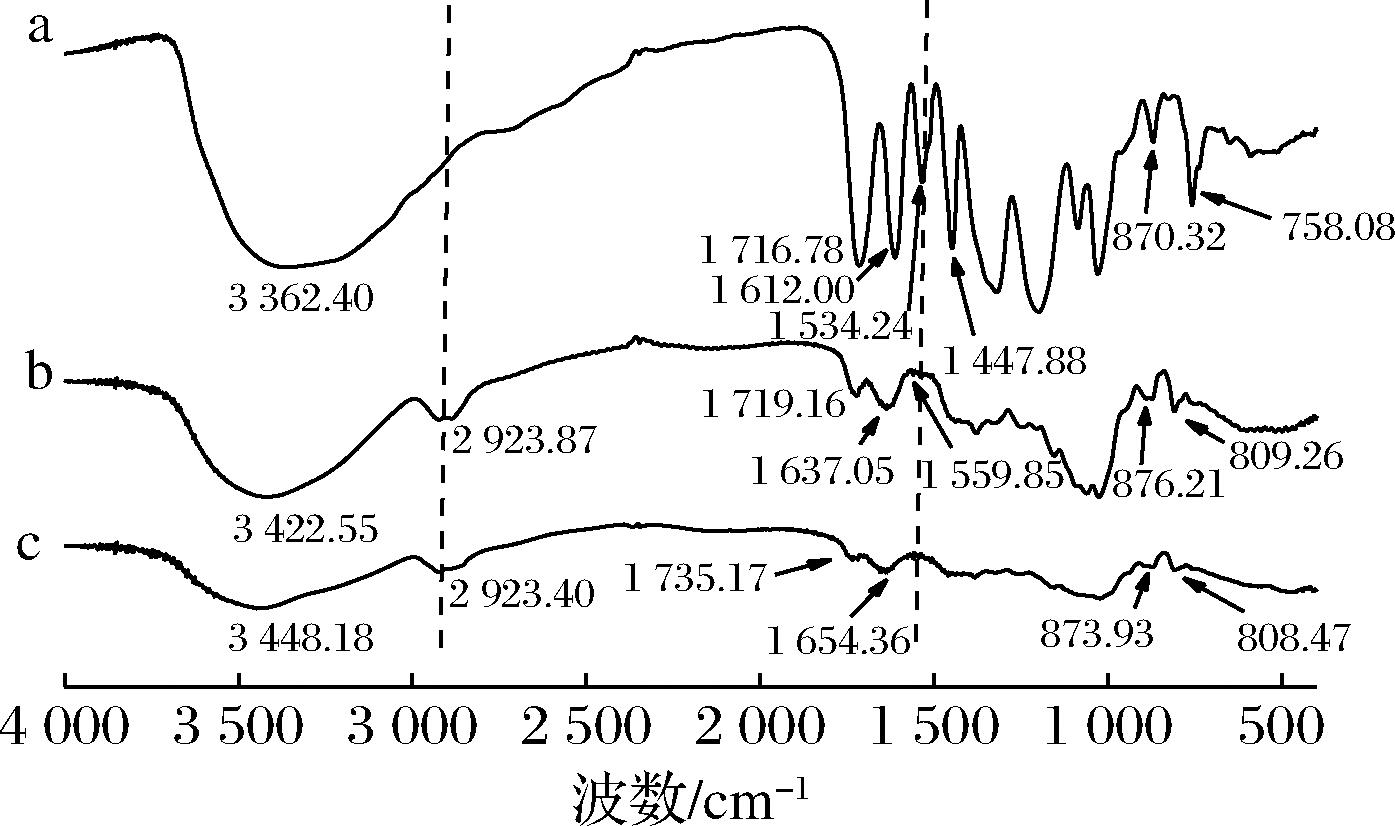
a-单宁酸;b-微胶囊;c-魔芋葡甘聚糖
图2 单宁酸、微胶囊、魔芋葡甘聚糖的红外光谱
Fig.2 Infrared spectra of tannic acid, microcapsule, and konjac glucomannan
图2-a是单宁酸的红外吸收峰,在1 716.78 cm-1处的峰表明酯键基团中的C![]() O的伸缩振动峰;1 612.00、1 534.24、1 447.88 cm-1处的峰则是由于苯环的骨架振动产生的[16]。图2-c为魔芋葡甘聚糖的红外吸收峰,2 923.40 cm-1处为甲基中C—H键的伸缩振动峰,1 735 cm-1处的弱吸收峰反映了乙酰基的存在,873.93 cm-1和808.47 cm-1处则属于甘露糖的特征吸收峰[17]。图2-b是单宁酸微胶囊的红外图谱,在1 534.24、1447.88、758.08 cm-1处五倍子单宁酸的特征吸收峰消失,其他的吸收峰有所减弱,说明单宁酸的吸收峰大多被壁材多糖的吸收峰掩盖,单宁酸良好的包埋在壁材形成的薄膜中。单宁酸微胶囊并没有新的特征峰生成,说明壁材在冷冻干燥过程中是惰性的,芯材与壁材并没有发生强化学作用。
O的伸缩振动峰;1 612.00、1 534.24、1 447.88 cm-1处的峰则是由于苯环的骨架振动产生的[16]。图2-c为魔芋葡甘聚糖的红外吸收峰,2 923.40 cm-1处为甲基中C—H键的伸缩振动峰,1 735 cm-1处的弱吸收峰反映了乙酰基的存在,873.93 cm-1和808.47 cm-1处则属于甘露糖的特征吸收峰[17]。图2-b是单宁酸微胶囊的红外图谱,在1 534.24、1447.88、758.08 cm-1处五倍子单宁酸的特征吸收峰消失,其他的吸收峰有所减弱,说明单宁酸的吸收峰大多被壁材多糖的吸收峰掩盖,单宁酸良好的包埋在壁材形成的薄膜中。单宁酸微胶囊并没有新的特征峰生成,说明壁材在冷冻干燥过程中是惰性的,芯材与壁材并没有发生强化学作用。
2.2.3 单宁酸微胶囊的热稳定性分析
如图3所示,魔芋葡甘聚糖、单宁酸和单宁酸微胶囊的热溶解起始温度分别为69.6、38.2、95.0 ℃,单宁酸微胶囊化后的热溶解的起始温度明显提高,从而使单宁酸的热稳定性提高。热焓也可以反映出样品的稳定性[18],单宁酸与单宁酸微胶囊的热焓分别为301.5、401.0 J/g,微胶囊化后热焓值提高,说明其发生相变所需要的热量更高,从而体现出微胶囊的稳定性更强。此外,单宁酸及魔芋葡甘聚糖在87.0 ℃以及107.2 ℃处均有一个较宽的吸热峰,经过包埋后这2个单峰消失,并且复合物的吸热峰往更高的方向移动,说明单宁酸和魔芋葡甘聚糖之间生成了键间新键,也能够证实单宁酸微胶囊的形成。
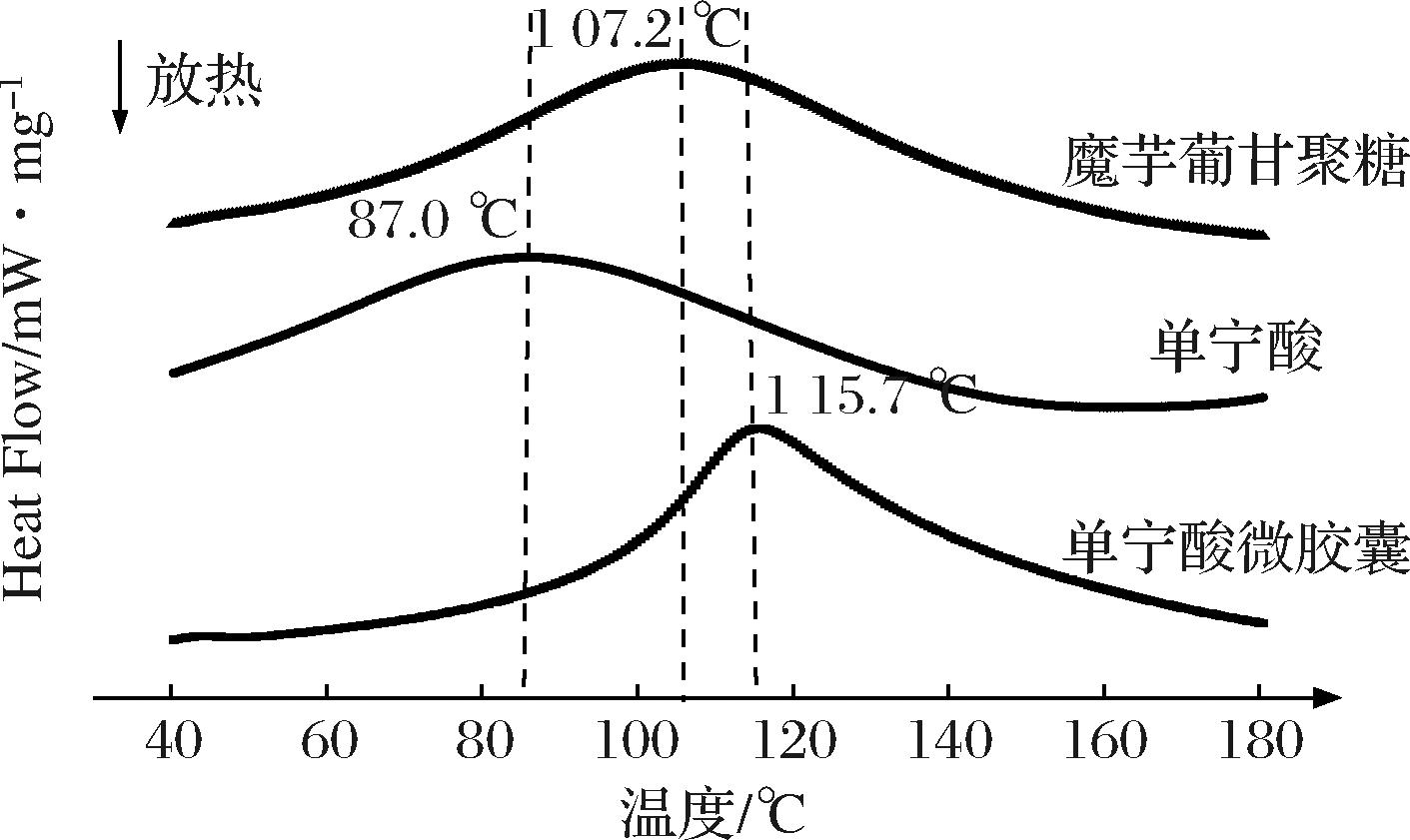
图3 魔芋葡甘聚糖、单宁酸、微胶囊的差式扫描量热分析
Fig.3 Differential scanning calorimetry analysis of Konjac glucomannan, tannic acid, and microcapsules
2.2.4 单宁酸微胶囊的缓释性分析
本实验的单宁酸质量浓度初始理论值设定为1 mg/mL。如图4所示,在口腔消化阶段,单宁酸组及单宁酸微胶囊组经测定得出单宁酸的质量浓度分别为0.98、0.57 mg/mL,说明将单宁酸进行微胶囊化后,能够阻止其在口腔的释放,有效解决单宁酸的适口性问题。单宁酸微胶囊组在胃及肠消化阶段结束时的单宁酸质量浓度分别为0.17、0.07 mg/mL,而单宁酸组在这两个时刻的质量浓度分别为0.20、0.01 mg/mL,这表明单宁酸微胶囊化后,能够有效减少单宁酸在胃部的释放,从而提高单宁酸对胃部的抵抗能力;而在肠消化过程中,微胶囊内部的单宁酸大量释放出来,使得单宁酸的含量增加。单宁酸微胶囊在体外模拟消化试验中表现出一定的缓释特性。这种释放行为与体系的pH变化密切相关,魔芋葡甘聚糖的黏度在pH 2.0的模拟胃液条件下会急剧上升,导致芯材包被其中,而当处于pH 7.0的肠液条件下,黏度会大幅度降低,导致芯材会释放出来[6]。

图4 单宁酸及单宁酸微胶囊在体外模拟消化过程中的释放行为
Fig.4 Release behavior of tannic acid and tannic acid microcapsules during simulated digestion in vitro
注:不同字母表示两组样品处于相同消化时间点时,具有显著性差异(P<0.05)。
2.2.5 单宁酸微胶囊的抗氧化性分析
如图5-a所示,3种样品对DPPH自由基的清除能力与样液浓度呈现出正相关,随着样液浓度的增加,抗氧化能力不断增强。单宁酸、单宁酸微胶囊以及抗坏血酸对DPPH自由基清除能力的IC50值分别为9.20、9.08、23.11 μg/mL,可见单宁酸经过包埋后抗氧化能力稍有增加,这表明包埋处理并没有破坏它的抗氧化活性。与阳性对照抗坏血酸相比,单宁酸对于DPPH自由基的清除能力要显著优于抗坏血酸(P<0.05)。余金橙等[19]采用喷雾干燥法制备山渣多酚微胶囊,进行DPPH抗氧化活性的测定,结果表明样品微胶囊化后具有更强的抗氧化能力,所得结果与本文相符。

a-DPPH自由基清除率;b-ABTS阳离子自由基清除率
图5 单宁酸微胶囊的抗氧化能力测定
Fig.5 Determination of antioxidant capacity of tannic acid microcapsules
注:图中不同大写字母表示同一样品在不同浓度下具有显著性(P<0.05);不同小写字母表示3种样品在相同浓度下具有显著性(P<0.05)。
如图5-b所示,单宁酸、单宁酸微胶囊以及抗坏血酸在5~25 μg/mL质量浓度范围内,对ABTS阳离子自由基清除均具有剂量依赖性,它们对ABTS阳离子自由基清除能力的IC50值分别为9.58、8.99、13.06 μg/mL。说明单宁酸经过微胶囊化后,对ABTS阳离子自由基的清除率会稍微增加,这可能是由于经过包埋后芯材的结构形态更加稳定,物理性质得到改善,可以提高单宁酸的抗氧化活性。与抗坏血酸相比,单宁酸的抗氧化能力要显著高于抗坏血酸(P<0.05)。
2.2.6 单宁酸微胶囊抗菌性能研究
2.2.6.1 单宁酸微胶囊对肠道致病菌的抑菌效果测定
在选定的单宁酸浓度下,单宁酸以及单宁酸微胶囊对于鼠伤寒沙门氏菌、志贺氏菌、大肠杆菌以及金黄色葡萄球菌均有不同程度的抑制作用。通过比较抑菌率可知(表1),单宁酸对金黄色葡萄球菌、鼠伤寒沙门氏菌、志贺氏菌、大肠杆菌的抑菌率分别为(87.06±2.28)%、(54.35±2.24)%、(66.24±5.78)%、(84.44±6.85)%。而单宁酸微胶囊在相同浓度下,对这4种致病菌的抑制率分别为(96.02±3.11)%、(50.32±2.92)%、(65.81±5.78)%、(79.34±3.97)%。
表1 单宁酸及单宁酸微胶囊的抑菌率
Table 1 Bacteriostatic rate of tannic acid and tannic acid microcapsules
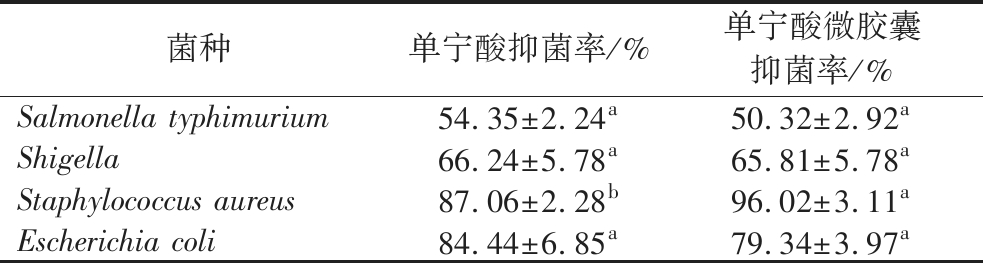
菌种单宁酸抑菌率/%单宁酸微胶囊抑菌率/%Salmonella typhimurium54.35±2.24a50.32±2.92aShigella66.24±5.78a65.81±5.78aStaphylococcus aureus87.06±2.28b96.02±3.11aEscherichia coli84.44±6.85a79.34±3.97a
注:同一行中的不同小写字母表示存在显著差异(P<0.05)。
对于3种革兰氏阴性菌来说,2个组别之间并没有呈现出显著性差异(P>0.05),而对于金黄色葡萄球菌,单宁酸经过微胶囊化后,显著提高了其抑菌性能(P<0.05),这可能是由于魔芋葡甘聚糖对金黄色葡萄球菌也起到一定的抑制作用[20],从而使微胶囊组的抑菌性显著提高。总的来说,单宁酸进行微胶囊化后,并没有破坏其抑菌性能,仍具有很好的抑菌作用,并且对革兰氏阳性菌的抑制作用要高于革兰氏阴性菌,其中对金黄色葡萄球菌的抑制作用最强,大肠杆菌次之,对鼠伤寒沙门氏菌的抑制作用最弱,抑菌效果见图6。
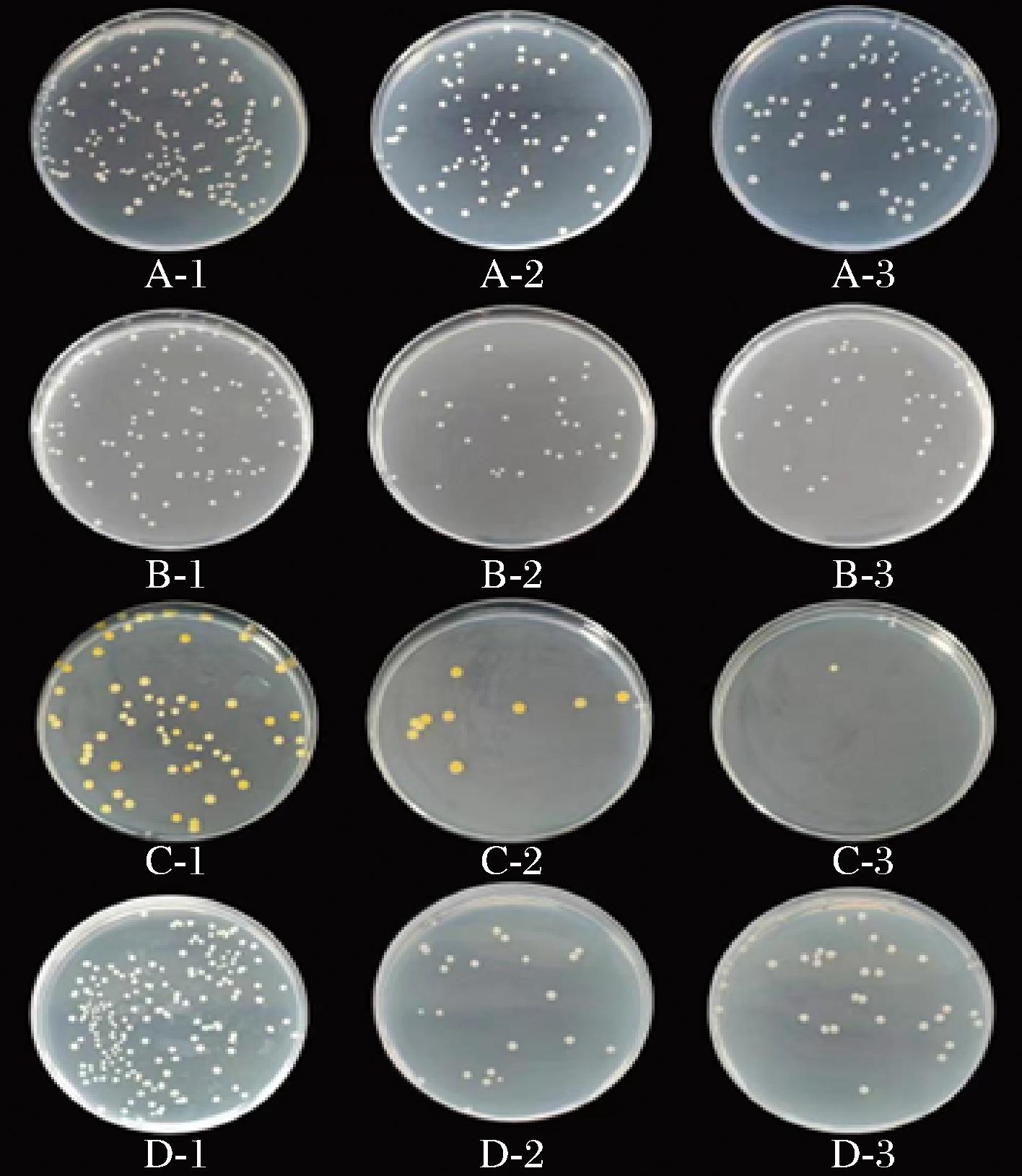
图6 单宁酸及单宁酸微胶囊对各菌种的抑菌效果
Fig.6 Inhibitory effect of tannic acid and tannic acid microcapsules on various strains
注:A、B、C、D分别表示鼠伤寒沙门氏菌、志贺氏菌、金黄色葡萄球菌以及大肠杆菌;1、2、3分别表示PBS对照组、单宁酸样品组以及单宁酸微胶囊样品组。
2.2.6.2 单宁酸微胶囊对细菌细胞膜完整性的影响
如图7所示,空白组(a-1、b-1)的大肠杆菌和金黄色葡萄球菌的细胞形态完整,细胞边界较为清晰,菌体饱满,无明显破损。

a-大肠杆菌;b-金黄色葡萄球菌
图7 大肠杆菌及金黄色葡萄球菌的扫描电镜图
Fig.7 Scanning electron microscopy of E.coli and S. aureus
注:1、2、3分别表示PBS对照组、单宁酸样品组以及单宁酸微胶囊样品组。
大肠杆菌经过单宁酸以及单宁酸微胶囊处理后(a-2、a-3),细胞仍呈短杆状,但整个菌体不再饱满,表面的皱褶结构变的模糊,细胞出现了凹陷,这表明大肠杆菌的菌体结构受到破坏。金黄色葡萄球菌经过单宁酸及单宁酸微胶囊处理后(b-2、b-3),可以明显的看到菌体细胞破裂,菌体表面由原本的光滑状变为粗糙状,无饱满感,并且自溶现象严重,内容物渗出到细胞外,附着在表面上。由此可见,单宁酸及单宁酸微胶囊对于大肠杆菌和金黄色葡萄球菌的菌体会有损伤作用,并使细胞膜破损。
3 结论
本研究以魔芋葡甘聚糖为壁材,通过单因素试验以及正交试验进行单宁酸微胶囊的工艺优化,最佳的制备参数为芯壁比1∶15(质量比),壁材质量浓度为20 g/L,反应温度45 ℃,搅拌时间2 h。此条件下微胶囊包埋率为75.33%;该产品的微观形态呈现出不规则的块状。通过对微胶囊进行红外光谱分析、热稳定性分析,均有效证明了单宁酸微胶囊的形成,且微胶囊的热稳定性提高。
体外模拟消化试验表明,单宁酸微胶囊能够有效阻止单宁酸在口腔以及胃中的释放,在模拟肠液中的单宁酸释放率最大,具有良好的缓释性。而且经过微胶囊包埋处理后,产品对DPPH自由基、ABTS阳离子自由基的清除能力均有所增加;此外,单宁酸微胶囊还具有良好的抑制致病菌的能力,其中对金黄色葡萄球菌的抑制作用最强,大肠杆菌次之,对鼠伤寒沙门氏菌的抑制作用较弱。这些研究结果表明,将单宁酸进行微胶囊化,能够有效改善涩味、达到定向释放且保持其活性稳定,为拓宽单宁酸的应用范围提供了理论依据及实验基础。
[1] HUANG Q Q, LIU X L, ZHAO G Q, et al.Potential and challenges of tannins as an alternative to in-feed antibiotics for farm animal production[J].Animal Nutrition, 2018, 4(2):137-150.
[2] 张亚杰, 徐金帅, 邹波, 等.柚皮苷/柠檬苦素微胶囊的制备、结构分析及特性研究[J].食品工业科技, 2021, 42(18):209-217.
ZHANG Y J, XU J S, ZOU B, et al.Preparation, structural analysis and properties of naringin/limonin microcapsules[J].Science and Technology of Food Industry, 2021, 42(18):209-217.
[3] 陈程莉, 李丰泉, 刁倩, 等.不同壁材对黑枸杞花青素微胶囊稳定性和缓释特性的影响[J].食品与发酵工业, 2020, 46(16):78-85.
CHEN C L, LI F Q, DIAO Q, et al.Effects of different wall materials on the stability and sustained-release characteristics of anthocyanin microcapsules of Lycium ruthenicum Murr[J].Food and Fermentation Industries, 2020, 46(16):78-85.
[4] 孙闫晨昊, 王维, 李一喆, 等.橘皮油微胶囊制备及其产品质量评价[J].化工进展, 2023, 42(5):2626-2637.
SUN Y C H, WANG W, LI Y Z, et al.Preparation of mandarin oil microcapsules and its product quality evaluation[J].Chemical Industry and Engineering Progress, 2023, 42(5):2626-2637.
[5] 郑杰, 杨敏, 王楠, 等.天然大分子对花色苷的负载研究进展[J].食品与发酵工业, 2022, 48(10):290-298.
ZHENG J, YANG M, WANG N, et al.The progress of anthocyanin loading by natural macromolecule[J].Food and Fermentation Industries, 2022, 48(10):290-298.
[6] 郑健姿, 岳田利.魔芋葡甘聚糖为壁材的苹果多酚微胶囊制备及缓释[J].食品研究与开发, 2017, 38(24):48-52.
ZHENG J Z, YUE T L.Preparation of apple polyphenol microcapsules using KGM as wall material and its sustained release[J].Food Research and Development, 2017, 38(24):48-52.
[7] 常选妞, 杨新玲, 杨建平.高效液相色谱法测定饲料中的单宁酸[J].畜禽业, 2021, 32(10):10;12.
CHANG X N, YANG X L, YANG J P.Determination of tannic acid in feed by HPLC[J].Livestock and Poultry Industry, 2021, 32(10):10;12.
[8] 孟祥. 茶多酚的微胶囊化研究[D].上海:上海理工大学, 2006.
MENG X.Study on microencapsulation of tea polyphenols[D].Shanghai:University of Shanghai for Science &Technology, 2006.
[9] MINEKUS M, ALMINGER M, ALVITO P, et al.A standardised static in vitro digestion method suitable for food-an international consensus[J].Food &Function, 2014, 5(6):1113-1124.
[10] 李东卫. 仿生法评定生长猪常用植物性饲料有效磷酶促反应条件研究[D].北京:中国农业科学院, 2012.
LI D W.Study of enzymatic reaction conditions of evaluating the available phosphorus of plant-origin feedstuffs for growing pig with bionic digestion[D].Beijing:Chinese Academy of Agricultural Sciences, 2012.
[11] GENG S, SHAN S R, MA H J, et al.Antioxidant activity and α-glucosidase inhibitory activities of the polycondensate of catechin with glyoxylic acid[J].PLoS One, 2016, 11(3):e0150412.
[12] RE R, PELLEGRINI N, PROTEGGENTE A, et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay[J].Free Radical Biology &Medicine, 1999, 26(9-10):1231-1237.
[13] 欧阳旭, 徐新良, 徐江洋, 等.载银香茅油微胶囊的合成及其抑菌性能[J].浙江理工大学学报(自然科学版), 2021, 45(2):227-233.
OUYANG X, XU X L, XU J Y, et al.Synthesis of citronella oil microcapsules containing nano-Ag and its antibacterial property[J].Journal of Zhejiang Sci-Tech University (Natural Sciences Edition), 2021, 45(2):227-233.
[14] XIONG L G, CHEN Y J, TONG J W, et al.Tea polyphenol epigallocatechin gallate inhibits Escherichia coli by increasing endogenous oxidative stress[J].Food Chemistry, 2017, 217:196-204.
[15] 张丽红, 黄梦, 王桂瑛, 等.木姜子精油微胶囊制备工艺优化及其品质分析[J].食品工业科技, 2022, 43(2):157-165.
ZHANG L H, HUANG M, WANG G Y, et al.Preparation process optimization and quality analysis of Litsea pungens Hemsl essential oil microcapsules[J].Science and Technology of Food Industry, 2022, 43(2):157-165.
[16] 王晓婷, 康明丽, 宋丽君, 等.单宁酸改性明胶脂肪替代物结构及功能性质的研究[J].食品工业科技, 2022, 43(11):104-111.
WANG X T, KANG M L, SONG L J, et al.Study on structure and functional properties of tannic acid modified gelatin fat substitute[J].Science and Technology of Food Industry, 2022, 43(11):104-111.
[17] 焦晓佳, 邓坤鑫, 魏慧婷, 等.精制对魔芋葡甘聚糖及其与κ-卡拉胶复配凝胶性质的影响[J].食品工业科技, 2022, 43(16):81-89.
JIAO X J, DENG K X, WEI H T, et al.Effects of refining on konjac glucomannan and gel properties of its blend with κ-carrageenan[J].Science and Technology of Food Industry, 2022, 43(16):81-89.
[18] 陈程莉, 李丰泉, 刁倩, 等.黑枸杞花青素微胶囊优化及理化特性分析[J].食品与发酵工业, 2020, 46(5):208-214.
CHEN C L, LI F Q, DIAO Q, et al.Optimization and analysis of physical and chemical properties of black Lycium ruthenicum Murr anthocyanin microcapsules[J].Food and Fermentation Industries, 2020, 46(5):208-214.
[19] 余金橙, 王淑玉, 崔楠, 等.山楂多酚微胶囊制备及理化性质分析[J].食品工业科技, 2023, 44(2):222-231.
YU J C, WANG S Y, CUI N, et al.Preparation and physicochemical properties of hawthorn polyphenol microcapsules[J].Science and Technology of Food Industry, 2023, 44(2):222-231.
[20] 熊武国, 李太兵, 李加兴, 等.KGM的乙醇沉淀法提取及体外抑菌活性[J].吉首大学学报(自然科学版), 2017, 38(3):60-63.
XIONG W G, LI T B, LI J X, et al.Extraction conditions and determination of antibacterial activity in vitro of konjac glucomannan[J].Journal of Jishou University (Natural Sciences Edition), 2017, 38(3):60-63.