桑黄(Phellinus igniarius),又称桑臣、桑耳、胡孙眼等,多为扁半球形或马蹄形,隶属锈革孔菌科桑黄属[1]。作为一种名贵的食药用真菌,许多研究表明,桑黄富含多糖类、黄酮类、多酚类、甾醇类和萜类等天然活性成分[2],具有抗氧化、抗肿瘤、降血糖血脂、抗炎抗病毒等多种生理功能,在医药领域、保健品行业具有巨大的开发价值和应用前景。
黄酮类化合物作为桑黄发挥生理功能的重要物质基础之一,受到了广泛的关注。目前,许多学者对其提取制备方法进行了大量研究。朱姝枚等[3]优化了超声波辅助提取忍冬桑黄菌丝体的总黄酮工艺;郎明紫等[4]研究发现料液比1∶40(g∶mL),100 ℃提取5 h是超声波辅助提取桑黄黄酮的最优工艺,得率为4.41%,并具有较强的清除DPPH自由基和羟自由基(·OH)的能力;于翠翠[5]优化了微波辅助提取桑黄的工艺,其总黄酮提取含量为28.66 mg/g;张倩等[6]采用了超临界CO2萃取桑黄菌丝体中黄酮,其提取率为4.67%。传统的桑黄黄酮提取主要是以有机溶剂为提取剂,而采用深共熔溶剂(deep eutectic solvent,DES)提取桑黄黄酮的研究未见报道。
DES是由氢受体(如氯化胆碱)和氢供体(如糖、醇或羧酸)按适合比例混合形成的液态混合溶剂,具有经济、无毒、可回收、可降解、环境友好的优点,并表现出对有机化合物良好的溶解性和萃取性,作为环境友好的“绿色”溶剂,有替代有机溶剂作为提取剂的潜力[7-10]。国内外学者构建了不同体系的DES对天然产物进行了制备,WANG等[11]研究表明超声波辅助DES(乙二醇∶氯化胆碱=1∶1,物质的量比)结合大孔吸附树脂(NKA-2、S-8)能很好地提取和富集红花中的黄酮类化合物;ALI等[12]研究表明由氯化胆碱和对甲苯磺酸(1∶2,物质的量比)构建的DES能实现枸杞果实中黄酮类化合物的有效提取;王帆等[13]研究表明采用微波辅助DES(氯化胆碱∶乙酰丙酸=1∶2,物质的量比)提取厚朴渣中木脂素类化合物,较相同条件下甲醇法的提取率高出了395.03%。汪涛等[14]构建草酸∶氯化胆碱(1∶1,物质的量比)的DES可提取核桃青皮多酚,PAN等[9]利用DES(氯化胆碱∶草酸=2∶1)高效提取了羊肚菌的多糖物质,其提取率是传统水提法的4.5倍。总之,DES在多糖、多酚和黄酮等活性物质的提取中都取得了良好的效果。
本文构建了适合桑黄黄酮提取的DES体系,并通过响应面优化提取条件,比较不同大孔树脂从DES中富集回收黄酮的效果,并通过测定其对α-淀粉酶、α-酶葡萄糖苷酶的抑制能力和结合胆酸盐能力来评价其降血糖和降血脂的活性。
1 材料与方法
1.1 材料与试剂
桑黄超细粉,宁波御菌生物技术有限公司提供;氯化胆碱、乳酸、乙二醇、二缩三乙二醇、丙二醇、乙酰丙酸、芦丁、大孔吸附树脂(NKA-9、D101、HPD600、XDA-2、X-5、LSA-10、NKI-9、SP-825、AB-8)α-淀粉、α-酶葡萄糖苷酶、阿卡波糖,上海源叶生物科技有限公司;甘油、葡萄糖、柠檬酸、Al(NO3)3,国药集团化学试剂有限公司;总胆汁酸测试盒,南京建成生物工程研究所;所有试剂均为分析纯。
1.2 仪器与设备
KQ3200E型超声波清洗器,昆山市超声仪器有限公司;L550离心机,湖南湘仪实验室仪器开发有限公司;HL-2S恒流泵,上海沪西分析仪器厂有限公司;ALPHA1-4 LD plus真空冷冻干燥机,德国CHRIST公司;TU-1810紫外分光光度计,北京普析通用有限公司。
1.3 实验方法
1.3.1 黄酮含量的测定
以芦丁为标准品,参考黄文睿等[15]的方法,稍作修改,分别取0、0.5、1.0、1.5、2.0、2.5 mL质量浓度为1 mg/mL的芦丁标准液于10 mL的容量瓶中,加入0.05%(质量分数)NaNO2溶液0.3 mL,摇匀后放置6 min,再加入0.1%(质量分数)的Al(NO3)3溶液0.3 mL,摇匀,放置6 min后加入1 mol/L NaOH溶液5 mL,用体积分数为30%甲醇定容至刻度,摇匀后放置15 min,于510 nm处测定吸光值。所得标准曲线的回归方程为y=1.062 1x+0.019 1,R2=0.998 5;样品测定时,将样品稀释到一定倍数后,取1 mL样品液按上述步骤进行测定,按公式(1)计算得率。
黄酮得率![]()
(1)
式中:ρ,测定时样品中黄酮的质量浓度,mg/mL;n,样品的稀释倍数,V,上清液总体积,mL;m,样品质量,g。
1.3.2 DES的制备与筛选
按表1所示,分别称取适量的氢供体和氢受体,于80 ℃加热至无色透明液体,冷却至室温,即得不同的DES。准确称取0.100 0 g桑黄超细粉,置于5 mL离心管中,分别加入表1所示的7种DES和体积分数为60%乙醇1 mL,涡旋混匀后,置于超声波清洗器中,在50 ℃下提取30 min,然后于5 000 r/min离心15 min,测定上清液中的黄酮含量,比较不同溶剂体系对黄酮的提取效果。
表1 DES组成
Table 1 Composition of the DESs
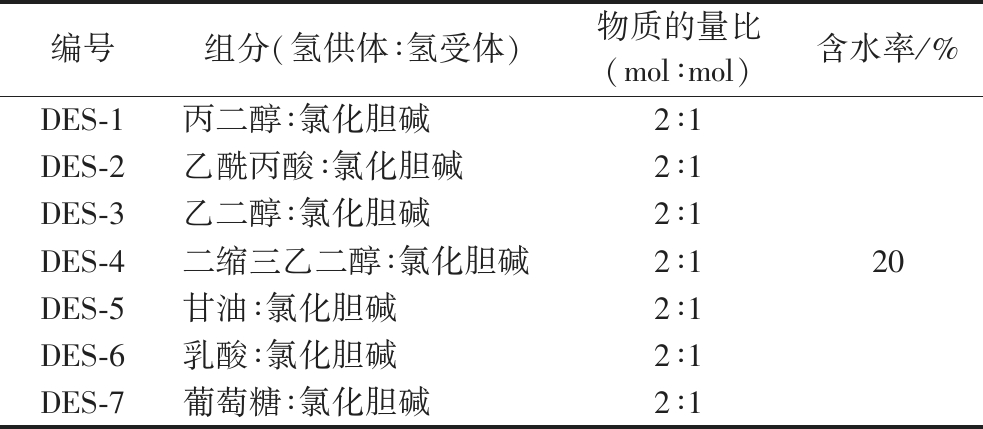
编号组分(氢供体∶氢受体)物质的量比(mol∶mol)含水率/%DES-1丙二醇∶氯化胆碱2∶1DES-2乙酰丙酸∶氯化胆碱 2∶1DES-3乙二醇∶氯化胆碱2∶1DES-4二缩三乙二醇∶氯化胆碱 2∶1DES-5甘油∶氯化胆碱 2∶1DES-6乳酸∶氯化胆碱 2∶1DES-7葡萄糖∶氯化胆碱 2∶120
1.3.3 超声波辅助DES提取桑黄黄酮的工艺优化
1.3.3.1 单因素试验
以1.3.2节所得最佳的DES为提取剂,分别考查不同含水率(0%、10%、20%、30%、40%和50%)、氢供体与氢受体的物质的量比(2∶1、4∶1、6∶1、8∶1、10∶1、12∶1、14∶1,mol∶mol)、料液比(25∶1、50∶1、75∶1、100∶1和125∶1,mg∶mL)、提取温度(30、40、50、60、70、80 ℃)和提取时间(10、20、30、40、50、60 min)对桑黄黄酮得率的影响。
1.3.3.2 响应面优化试验设计
在单因素试验结果的基础上,以黄酮得率为响应值,采用Box-Behnken设计响应面法(BBD-RSM)对物质的量比(A)、温度(B)和时间(C)3个因素进行优化,因素与水平设计见表2。
表2 响应面分析因素与水平
Table 2 Response surface analysis factors and levels

因素水平-101A物质的量比(mol∶mol)1∶61∶81∶10B温度/℃607080C时间/min304050
1.3.4 桑黄黄酮的富集回收试验
参考WANG等[11]的方法,考查NKA-9、D101、HPD600、XDA-2、X-5、LSA-10、NKI-9、SP-825和AB-8等9种大孔树脂对桑黄黄酮进行富集回收。参考巫永华等[16]的方法对树脂进行处理,各取2 g滤干的树脂于100 mL具塞锥形瓶中,加入一定初始质量浓度的桑黄黄酮DES粗提取液10 mL,在30 ℃下,120 r/min振荡24 h以达到吸附平衡,然后过滤,并用适量去离子水冲洗后,置于100 mL具塞锥形瓶中,加入10 mL体积分数为60%的甲醇在上述条件下振荡解析24 h以达到解析平衡,测定上清液中的黄酮质量浓度,并按公式(2)计算黄酮的回收率。
回收率![]()
(2)
1.3.5 α-淀粉酶抑制率的测定
参考李萌萌等[17]的方法,稍作修改。取10 U/L α-淀粉酶1 mL于试管中,于37 ℃水浴5 min,加入1%(质量分数)可溶性淀粉和样品液各1 mL,37 ℃水浴10 min后加入1%(质量分数)3,5-二硝基水杨酸溶液0.5 mL中止反应,沸水浴5 min后冷却至室温,3 500 r/min离心10 min,上清液转入25 mL容量瓶中,加蒸馏水定容,测定510 nm处的吸光值。以阿卡波糖作为阳性对照,按公式(3)计算α-淀粉酶抑制率:
抑制率![]()
(3)
式中:A0,空白对照组吸光值;A1,样品反应组吸光值;A2,样品背景对照组吸光值;A3,空白组吸光值。
1.3.6 α-葡萄糖苷酶抑制率的测定
参考於雨碟等[18]的方法,略作修改。取样品液和0.5 mg/mL酶液各100 μL,37 ℃水浴保温5 min,加入5 mmol/L 4-硝基苯-α-D-吡喃葡萄糖苷溶液200 μL混匀,于37 ℃反应30 min后加入2 mL的0.2 mol/L Na2CO3溶液终止反应,测定405 nm处的吸光值。以阿卡波糖作为阳性对照,按公式(4)计算α-葡萄糖苷酶抑制率。
抑制率/%=[1-(A2-A1)/A0]×100
(4)
式中:A0,空白组吸光值;A1,磷酸缓冲液替代PNPG溶液的吸光值;A2,样品组吸光值。
1.3.7 胆酸盐结合能力的测定
参考赵有伟等[19]的方法,并加以修改。取1 mL样液于试管中,加入1 mL的0.01 mol/L HCl溶液和1 mL 10 mg/mL胃蛋白酶,37 ℃下振荡消化1 h,模拟胃消化,空白组加盐酸溶液,样品用去离子水代替;调pH值至6.3;加入2 mL 10 mg/mL猪胰酶液,37 ℃下振荡消化1 h,模拟肠道消化,再加入1.5 mL 0.3 mmol/L的胆酸盐消化1 h,5 000 r/min离心10 min后取上清液,然后按试剂盒的方法进行操作,按公式(5)计算胆酸钠的结合率。
结合率![]()
(5)
式中:c0和c1分别为空白溶液和样品溶液中胆酸盐浓度,μmol/L。
1.4 数据处理与分析
试验重复3次,数据进行差异性分析采用SPSS 18.0软件,数据处理和绘图采用Excel 2010软件;IC50值为曲线增长阶段拟合线性方程后计算获得。
2 结果与分析
2.1 DES的筛选
不同组成的DES具有不同的极性、黏度和表面张力等理化性质,会影响目标化合物的提取,选择一种合适的DES是有效提取目标物的重要前提。传统溶剂提取中,李善姬等[20]研究表明体积分数60%的乙醇对桑黄黄酮的提取效果最佳,故实验选择体积分数为60%乙醇的提取效果与DES的进行比较。由图1可知,体积分数60%乙醇为溶剂提取时,得率为4.38%,显著低于各DES的桑黄黄酮得率(P<0.05),可能是由于DES能使原料表面的形貌特征发生改变,更易于细胞的破壁,使黄酮类化合物更易溶出。此外,黄酮类化合物与DES形成强的分子间氢键和静电作用也能增加提取效果[15]。而DES-3的得率为8.31%,显著高于其他DES体系(P<0.05)。WANG等[11]研究认为由乙二醇∶氯化胆碱=1∶1(物质的量比)组成DES能很好地提取红花中的黄酮类化合物,与本结果相似,但CUI等[21]研究表明1,4丁二醇∶氯化胆碱=3∶1(物质的量比)的DES最适合沙棘叶黄酮类化合物的提取,这可能与DES的性质和黄酮的组成及结构相关。故选择乙二醇与氯化胆碱组成的DES-3进行后续试验。
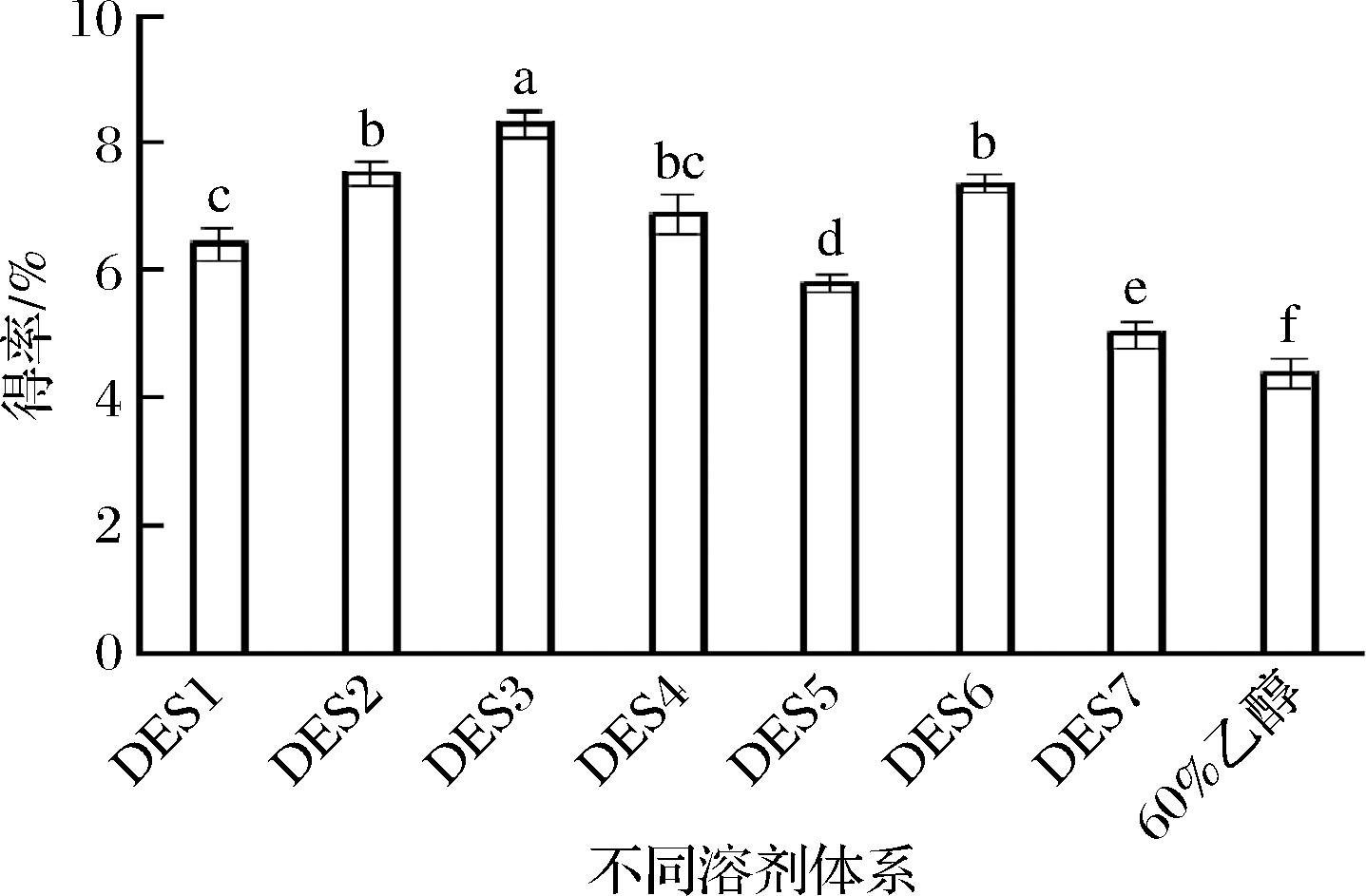
图1 不同溶剂体系对桑黄黄酮得率的影响
Fig.1 Effects of different DESs on the yield of PIFs
注:不同字母代表差异显著(下同)。
2.2 超声波辅助DES提取桑黄黄酮工艺优化
2.2.1 DES含水率的确定
DES在氢供体和氢受体之间存在氢键网络,使其黏度远高于其他分子溶剂和离子溶剂,导致溶剂中自由基团的移动受到限制,而通过加入适量的水,不仅可以降低其黏度,也能调节其极性和表面张力,从而改善提取效果[22]。由图2可知,随着含水率的提高,黄酮得率先上升后下降,含水率为30%时得率最高,与MENG等[23]的研究结果相似。这可能是由于含水率从0增加到30%时,扩大了样品与溶剂间的接触面积,增加了DES对黄酮类化合物的溶解效率,一定程度上提高了得率。但含水率>30%后,反而降低了提取效果,是因为过多的水分会导致DES的氢键被破坏、其特殊结构消失,DES与目标化合物的相互作用减弱和破坏[15],降低了黄酮在DES中的溶解度。因此,选取含水率30%的DES进行后续试验。
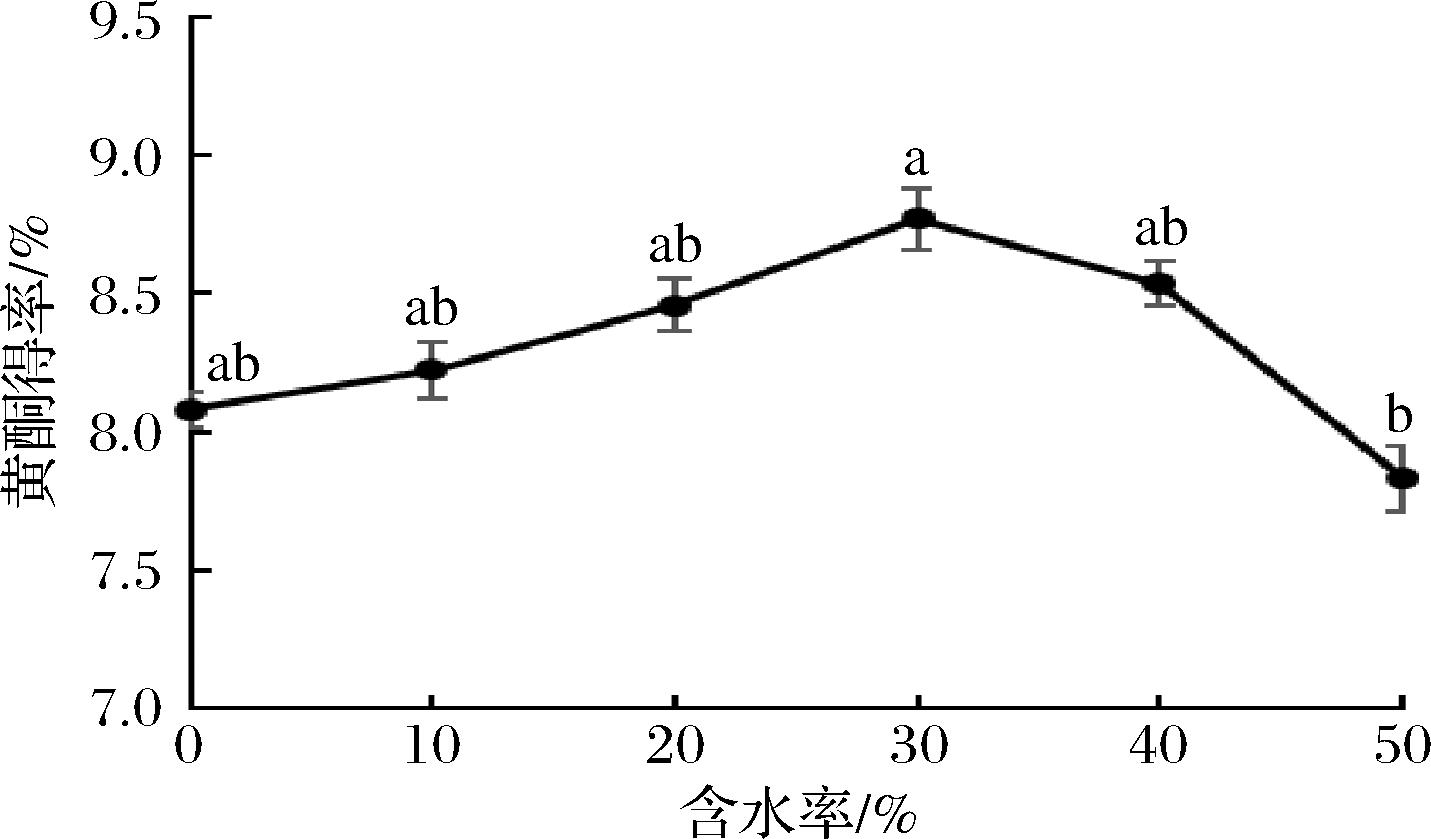
图2 DES含水率对黄酮得率的影响
Fig.2 Effects of water content of DESs on the yield of PIFs
2.2.2 物质的量比的确定
氢供体和氢受体的物质的量比会影响DES的黏度和极性,进而影响提取能力。由图3可知,随着物质的量比从2∶1(mol∶mol)增加到8∶1(mol∶mol)时,桑黄黄酮得率呈上升趋势,这是由于适当增加乙二醇的比例,使得DES的黏度和表面张力下降,有利于目标化合物的传质;而物质的量比大于8∶1(mol∶mol)后,桑黄黄酮得率呈现下降趋势,可能是因为过量的乙二醇导致黄酮化合物与DES的相互作用减弱,降低其提取效果。因此,选取乙二醇与氯化胆碱的物质的量比为8∶1(mol∶mol)用于响应面优化试验。
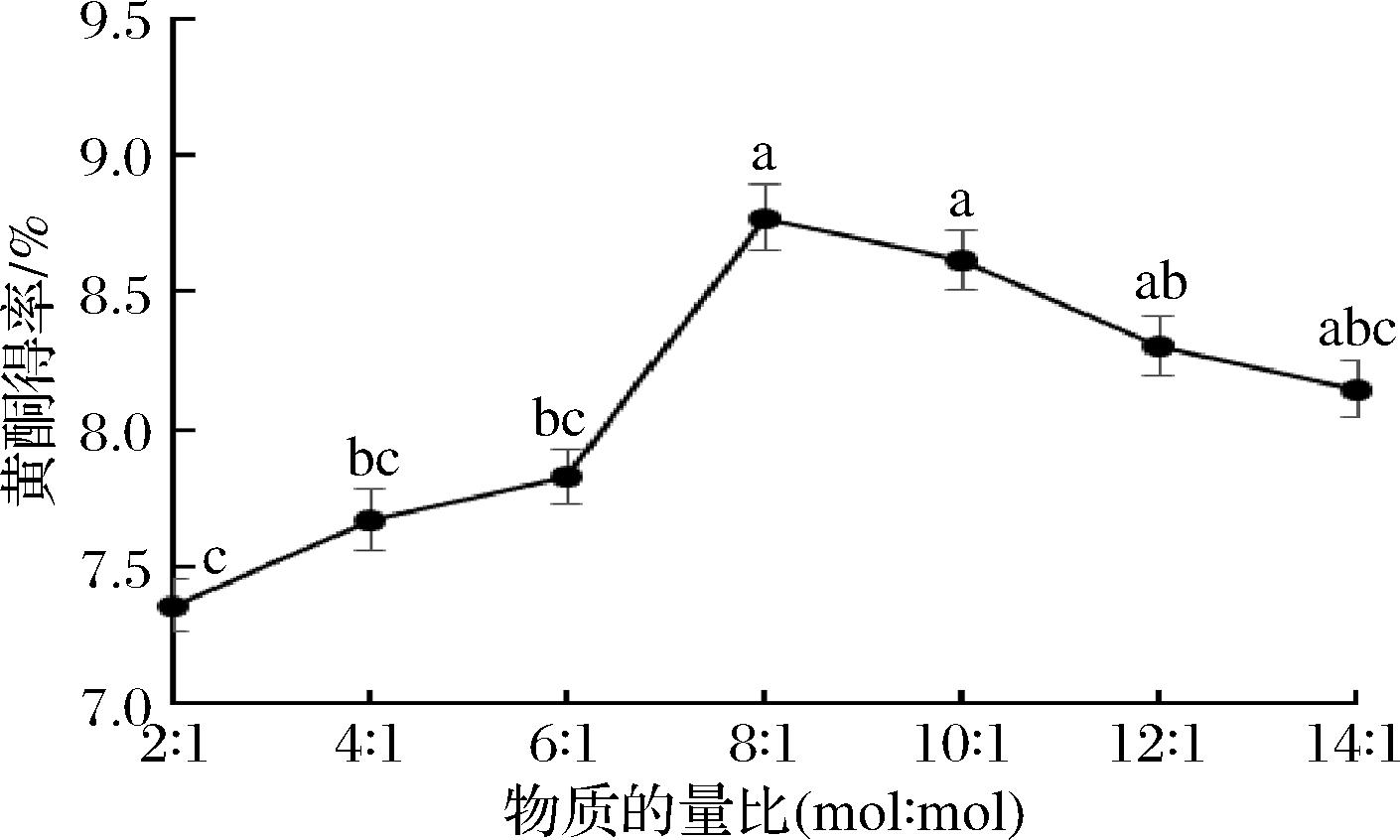
图3 物质的量比对黄酮得率的影响
Fig.3 Effects of DESs ratio on the yield of PIFs
2.2.3 料液比的确定
料液比会影响目标化合物的传质效率,由图4可知,料液比小于50∶1(mg∶mL)时,随着原料的增加,得率提高,大于50∶1(mg∶mL)后,黄酮得率下降明显,表明适当的增加原料可以提高提取效率,但是过多的原料会导致DES对黄酮的溶解达到饱和,反而降低提取效率。故选择料液比50∶1(mg∶mL)进行后续试验。
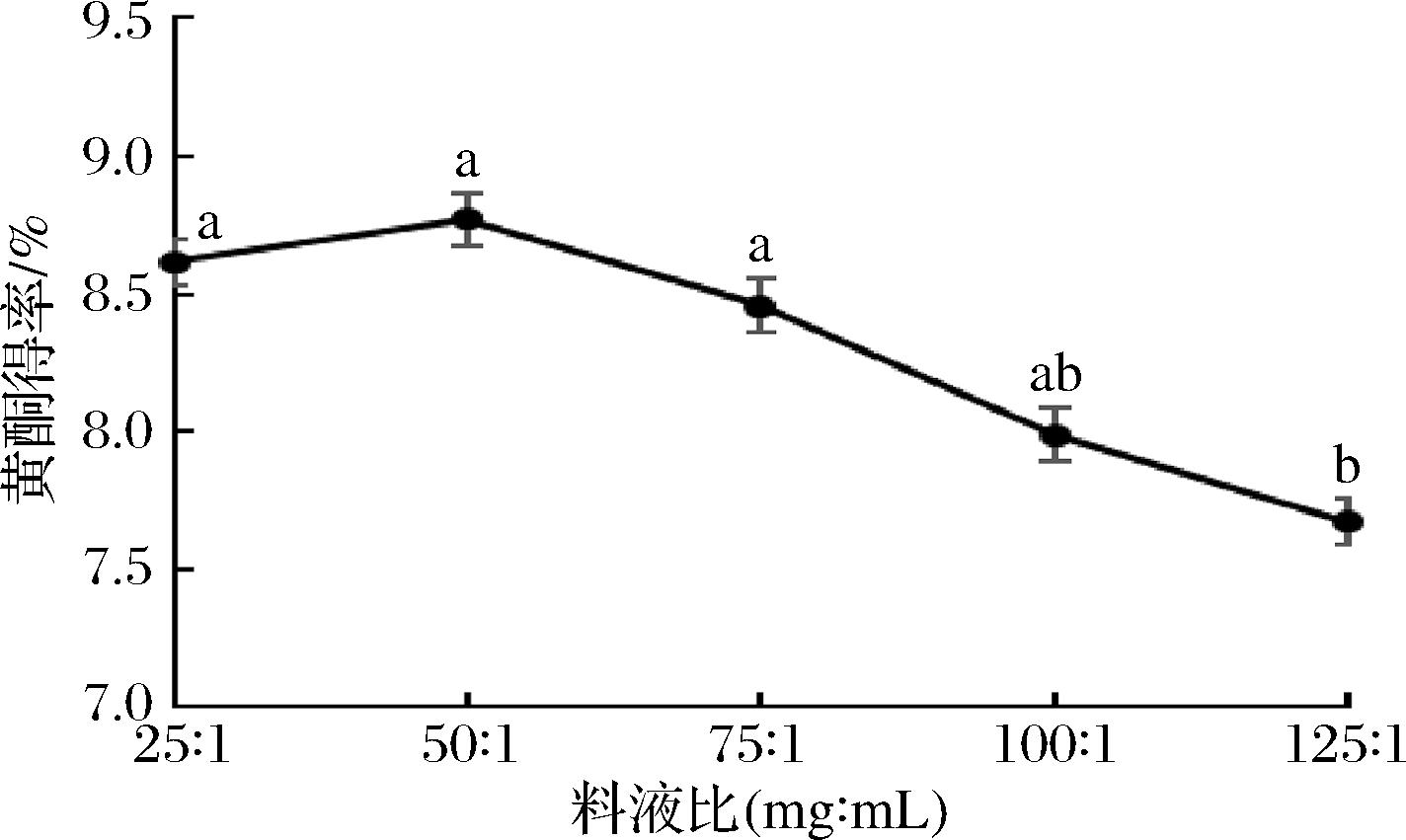
图4 料液比对黄酮得率的影响
Fig.4 Effects of ratio of material to liquid on the yield of PIFs
2.2.4 提取温度的确定
温度能影响DES的黏度和表面张力,从而影响其提取效果,由图5可知,提取温度70 ℃时,黄酮得率达到8.75%,WANG等[11]发现适当地升高温度,能降低DES的黏度,提高目标物的传质效率,但过高的温度会导致目标化合物发生降解而导致提取率下降。故选择提取温度70 ℃进行响应面优化试验。
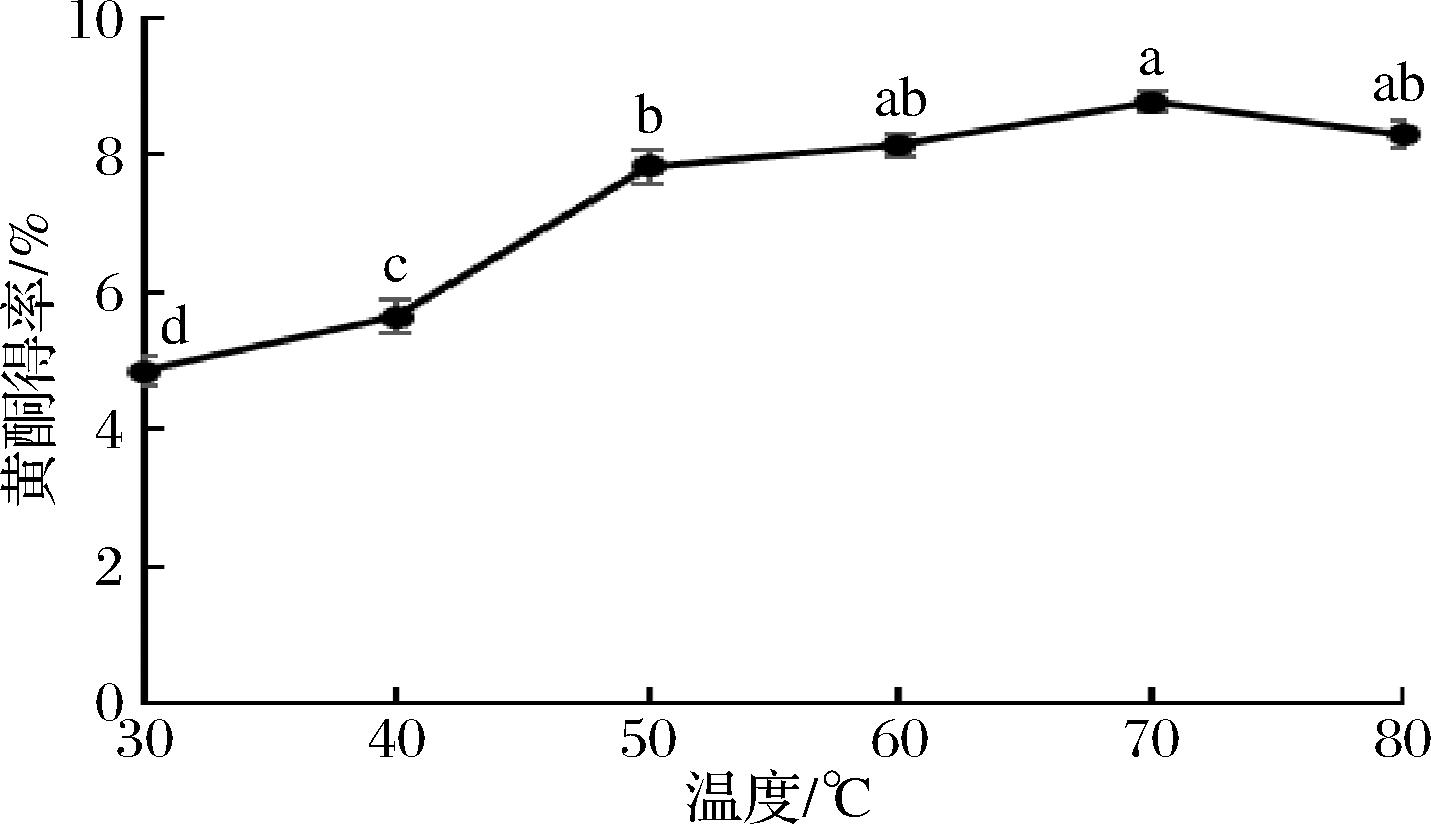
图5 提取温度对桑黄黄酮得率的影响
Fig.5 Effects of temperature on the yield of PIFs
2.2.5 提取时间的确定
由图6可知,提取时间为10~40 min时,桑黄黄酮得率显著增加,这是由于充分的提取时间,使得原料与DES充分接触,提高了黄酮物质向溶剂中扩散;但提取时间>40 min后,桑黄黄酮提取率呈现下降趋势,这是由于长时间的超声振动,可能使溶剂中的黄酮物质遭到破坏,同时DES的稳定性也会遭到破坏。因此,选取提取时间40 min进行响应面优化试验。
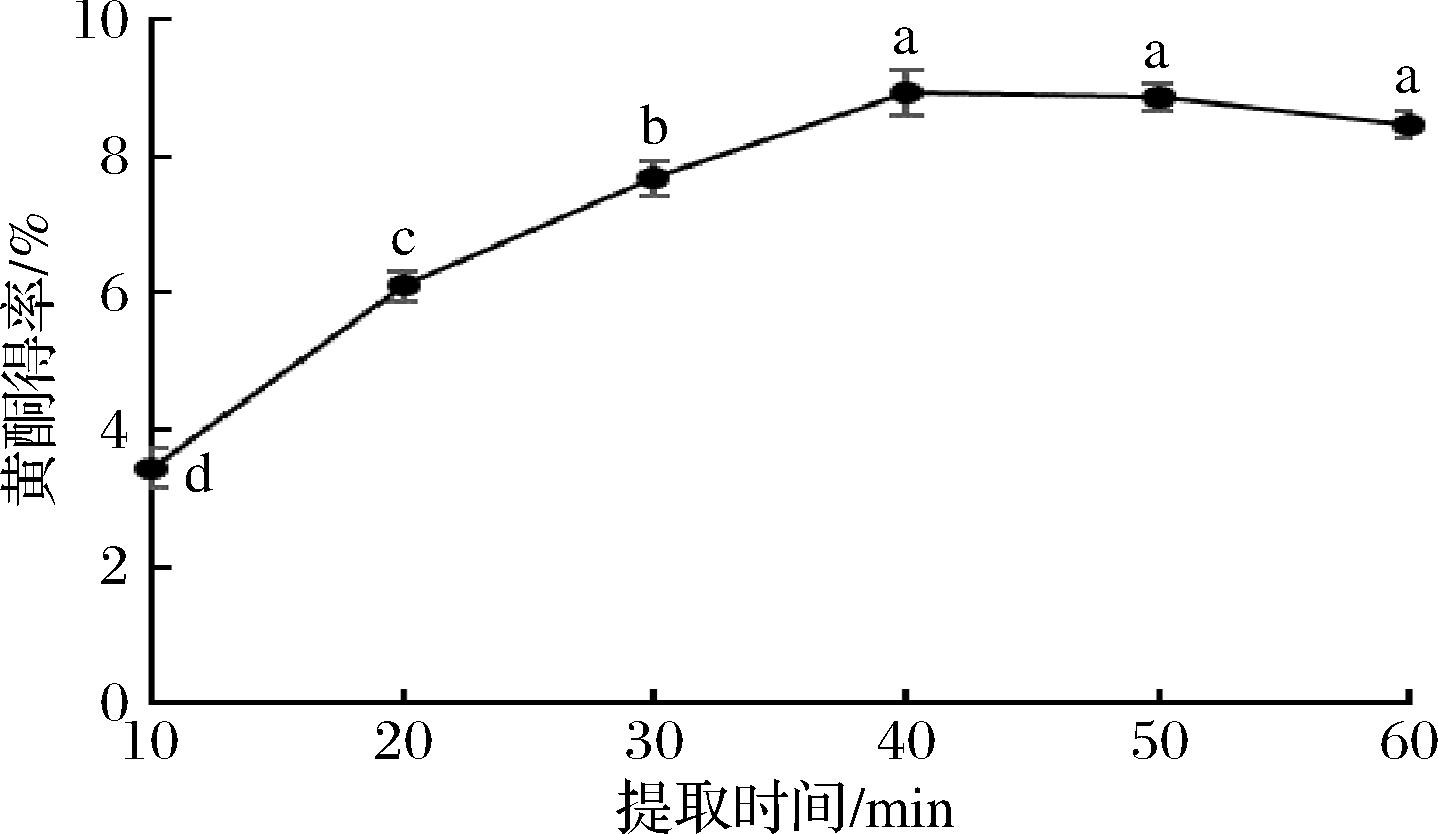
图6 提取时间对桑黄黄酮得率的影响
Fig.6 Effects of extraction time on the yield of PIFs
2.2.6 响应面优化提取工艺试验结果
2.2.6.1 响应面回归模型与交互作用分析
在单因素试验结果的基础上,固定DES含水率为30%,料液比50∶1(mg∶mL),采用BBD-RSM对黄酮得率影响较大的物质的量比、提取温度和时间3个变量进行优化,试验结果见表3,软件拟合出的二次多项回归方程为Y=-72.82-37.75A-1.02B+0.30C-0.20AB+0.05AC-0.034BC- 4.36A2-0.075B2-0.095C2
表3 响应面试验设计及结果
Table 3 Response surface test design and results
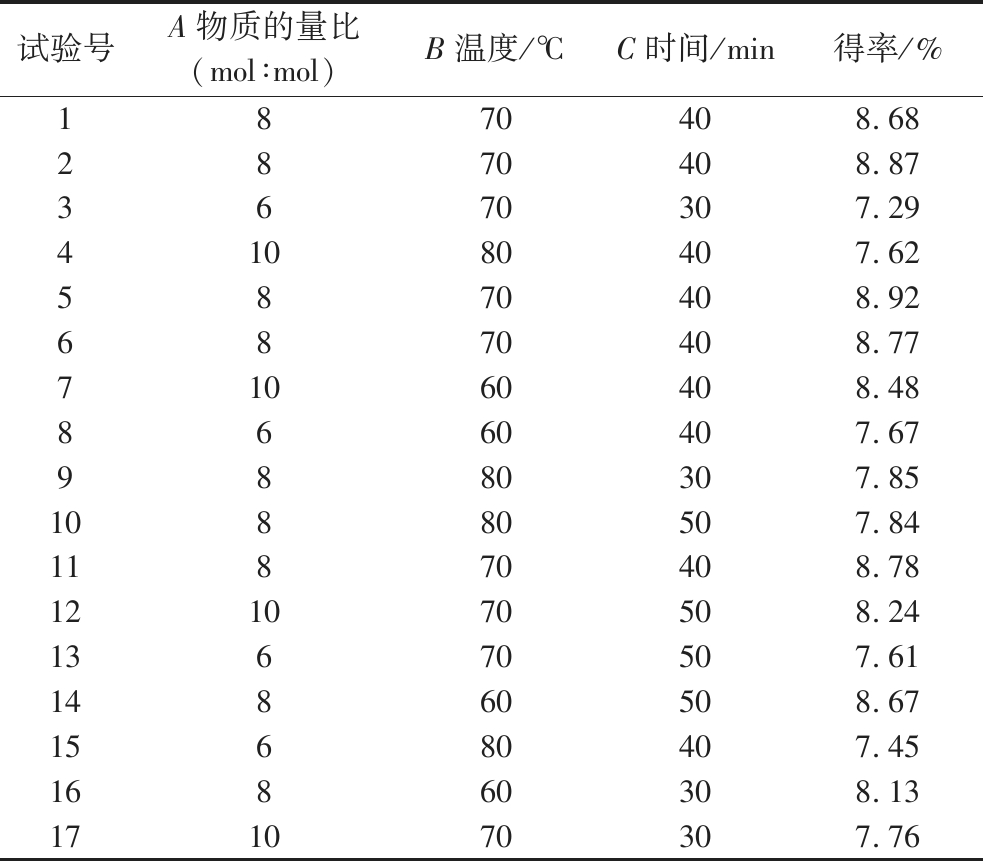
试验号A物质的量比(mol∶mol)B温度/℃C时间/min得率/%1870408.682870408.873670307.2941080407.625870408.926870408.7771060408.488660407.679880307.8510880507.8411870408.78121070508.2413670507.6114860508.6715680407.4516860308.13171070307.76
依据响应面试验对模型方差分析结果见表4,模型的P<0.000 1,表明此模型对实验结果的拟合较好;方程失拟项P=0.748 4>0.05,说明该模型合理,适合对试验进行拟合。一次项中A、B和二次项A2、B2、C2的P<0.01,表明其对结果的影响极显著;交互项AB的P<0.01、交互项BC的P<0.05,结合图7、图8的响应面和等高线图的陡峭程度和形状可知,AB的交互作用对结果的影响极显著,而BC的交互作用对结果的影响显著。模型的确定系数R2=0.990 7,调整确定系数为![]() 说明此模型结果与实际的试验结果具有良好的拟合度。综合分析,此模型适用于桑黄黄酮提取最佳工艺的理论预测和分析。
说明此模型结果与实际的试验结果具有良好的拟合度。综合分析,此模型适用于桑黄黄酮提取最佳工艺的理论预测和分析。
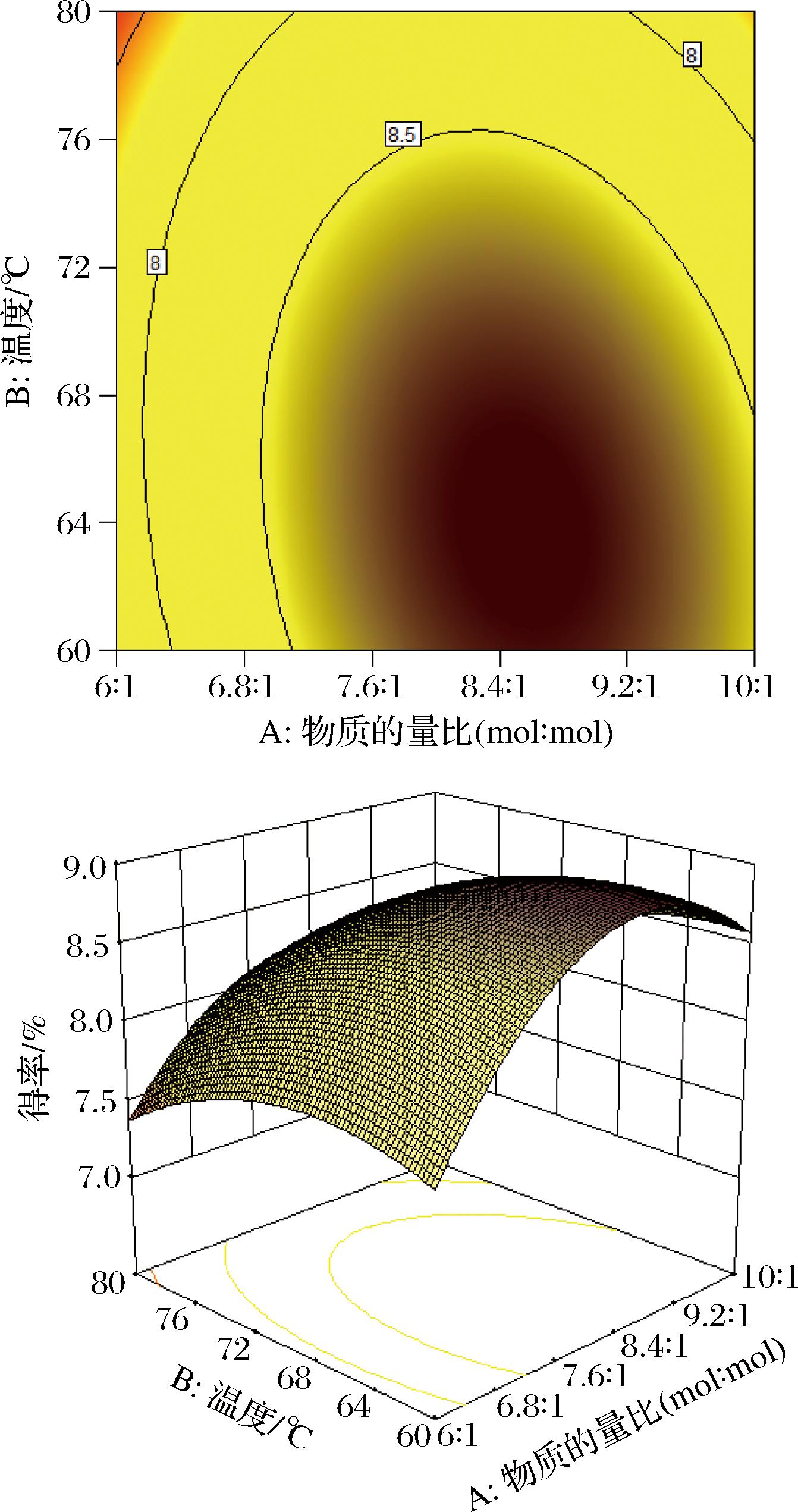
图7 物质的量比和提取温度的响应面和等高线图
Fig.7 Response surface and contour plot of DESs ratio and extraction temperature
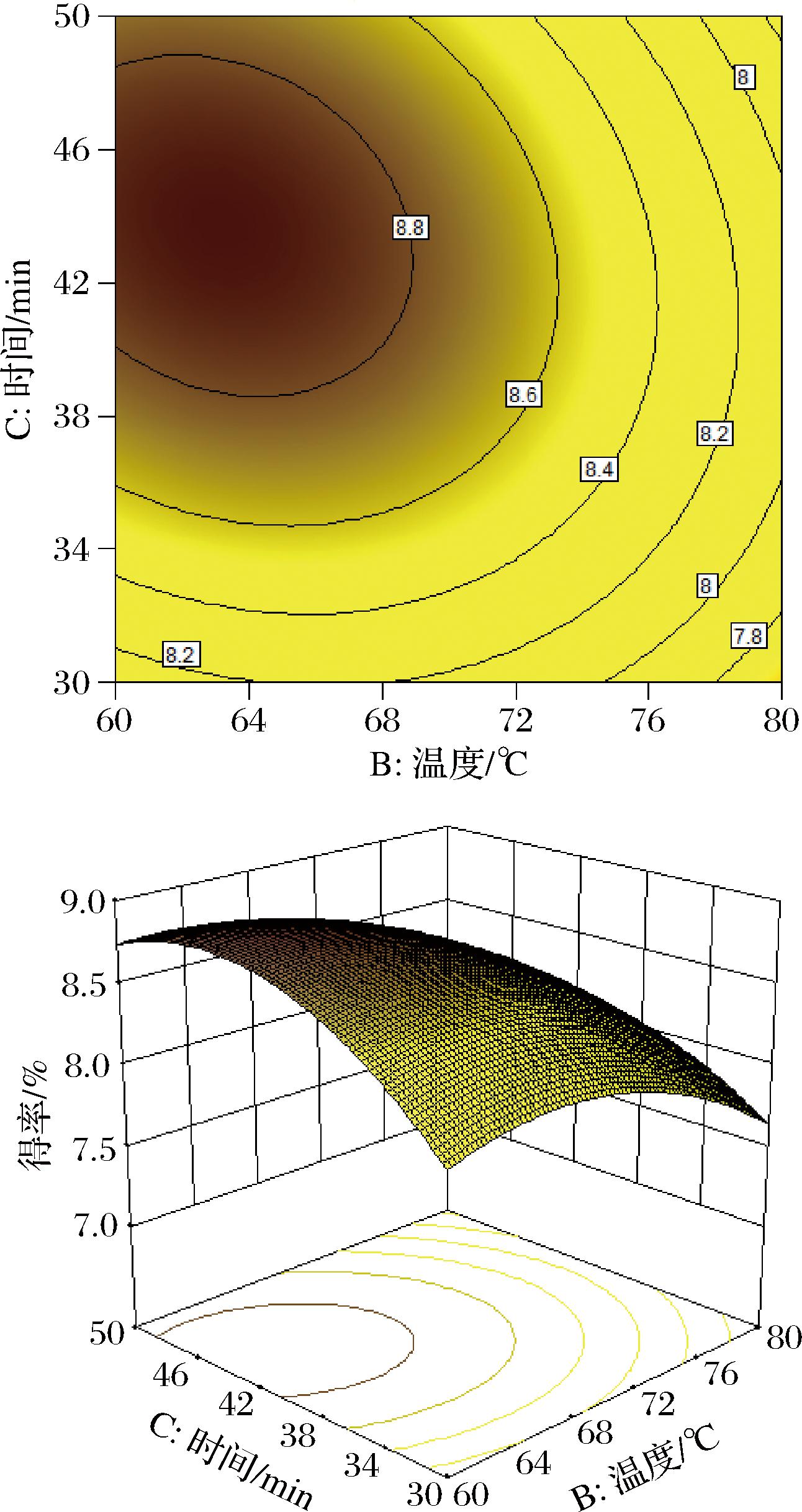
图8 提取温度和时间的响应面和等高线图
Fig.8 Response surface and contour plot of extraction temperature and time
表4 二次响应面回归模型方差分析
Table 4 Analysis of variance of quadratic response surface regression model
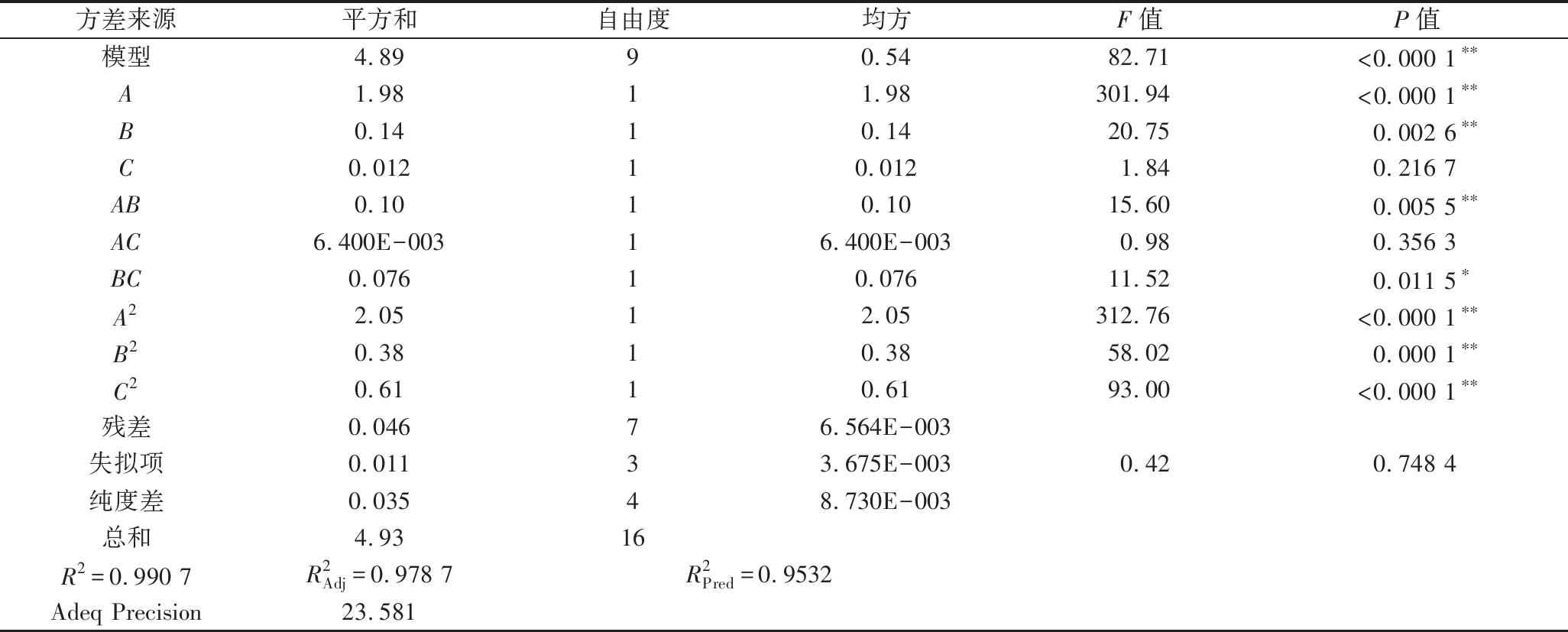
方差来源平方和自由度均方F值P值模型4.8990.5482.71<0.000 1∗∗A1.9811.98301.94<0.000 1∗∗B0.1410.1420.750.002 6∗∗C0.01210.0121.840.216 7AB0.1010.1015.600.005 5∗∗AC6.400E-00316.400E-0030.980.356 3BC0.07610.07611.520.011 5∗A22.0512.05312.76<0.000 1∗∗B20.3810.3858.020.000 1∗∗C20.6110.6193.00<0.000 1∗∗残差0.04676.564E-003失拟项0.01133.675E-0030.420.748 4纯度差0.03548.730E-003总和4.9316R2=0.990 7R2Adj=0.978 7R2Pred=0.9532Adeq Precision23.581
注:*为差异显著(P<0.05);**为差异高度的显著(P<0.01)。
2.2.6.2 最佳工艺条件验证
通过响应面软件预测获得的最佳工艺条件为,DES含水率30%,料液比50∶1(mg∶mL),乙二醇∶氯化胆碱=8.21∶1 (mol∶mol),提取温度64.42 ℃,提取时间43.32 min,此时桑黄黄酮得率为8.93%。为便于实际操作,将上述温度调整为64 ℃,提取时间调整为43 min,其他条件不变的情况下进行3次重复实验,获得的桑黄黄酮得率为(8.85±0.34)%,与模型预测值接近,表明此模型适用于本试验条件下桑黄黄酮提取情况的预测。
2.3 大孔树脂对桑黄黄酮富集回收试验结果
试验评价了9种不同类型的大孔树脂从DES中富集回收桑黄黄酮的效果,由图9可知,各种树脂对DES提取液中黄酮的回收率都大于60%,其中AB-8树脂的回收率最优,为85.25%,表明其能实现黄酮较好的富集回收。试验结果与CUI等[21]研究大孔树脂从DES提取液中回收沙棘叶中类黄酮的结果一致,但WANG等[11]研究认为NKA-2树脂最适合于红花中黄酮的富集回收,这可能与黄酮的组成、结构和树脂的极性、表面性质及物理性质有关。经AB-8树脂纯化后,桑黄黄酮的纯度由12.36%提高到75.68%,提高了6.12倍,表明该树脂能很好地去除糖、色素等杂质。此外,将用纯水洗脱的DES提取液,经去杂后,采用真空干燥后可重复用于目标化合物的提取,从而实现DES的回收利用,节约试剂。
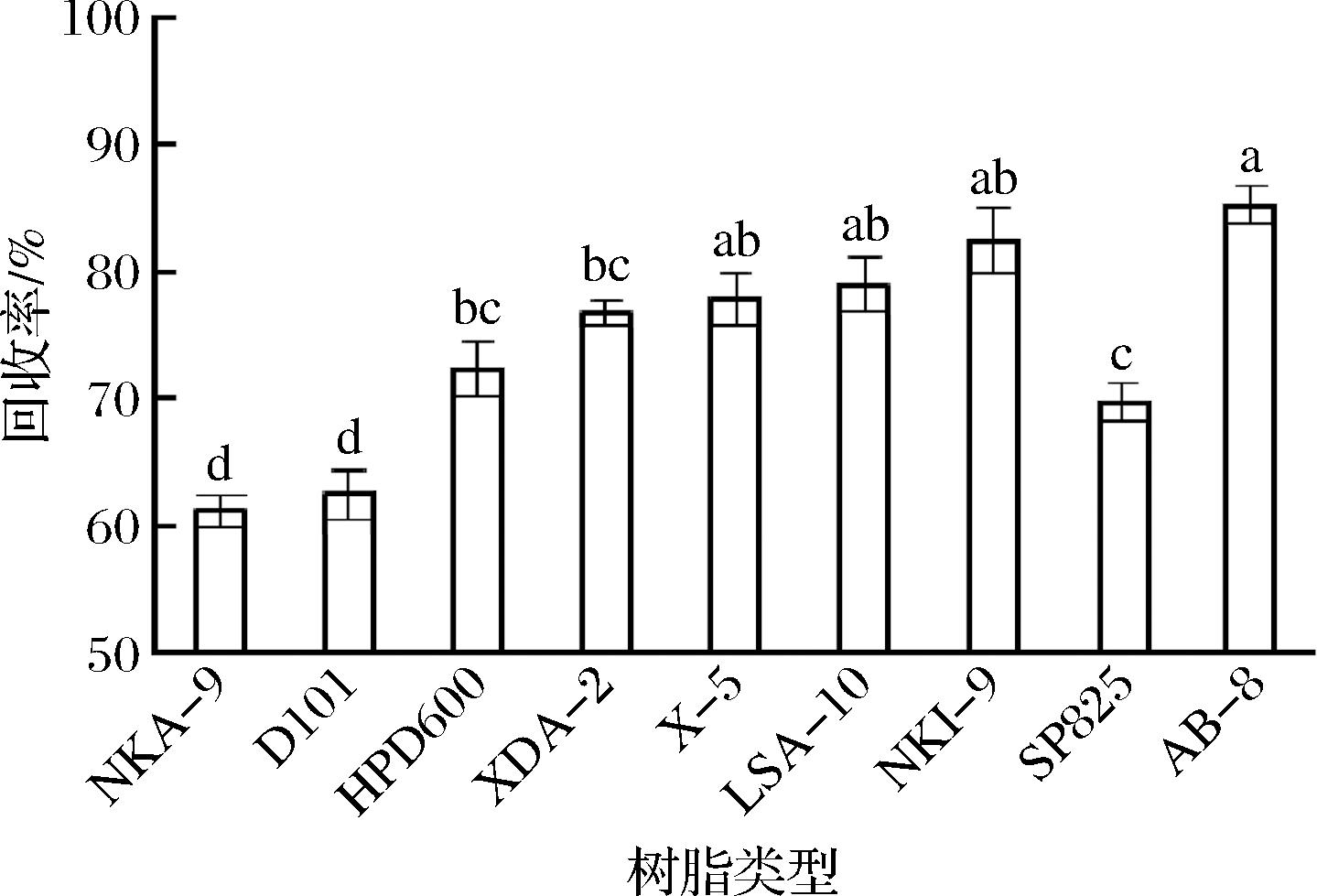
图9 不同树脂对桑黄黄酮的回收率
Fig.9 The recovery rate of PIFs of macroporous resin
2.4 桑黄黄酮体外降血糖试验结果
α-淀粉酶是体内将碳水化合物水解成葡萄糖以便于在细胞内运输的关键酶,而α-葡萄糖苷酶是碳水化合物消化和葡萄糖释放的关键催化酶,通过抑制α-淀粉酶和α-葡萄糖苷酶可以延缓碳水化合物的消化,实现葡萄糖摄取延迟,从而降低餐后血糖水平[24]。黄酮类化合物被认为具有潜在的替代商品降糖药物(如阿卡波糖和伏格列波糖)的天然化合物,因为它具有抑制α-淀粉酶和α-葡萄糖苷酶活性的作用[25]。从图10-a可知,随着样品质量浓度的增加,对α-淀粉酶抑制率也随之增加,并具有很好的量剂关系;质量浓度为2.5 mg/mL的桑黄黄酮对α-淀粉酶的抑制率达到了75.5%,其对α-淀粉酶的抑制率的IC50值为1.19 mg/mL,显著大于阿卡波糖(IC50 0.27 mg/mL)(P<0.01)。由图10-b可知,随着浓度的升高,桑黄黄酮和阿卡波糖对α-葡萄糖苷酶的抑制活性也增强,质量浓度为2.5 mg/mL的桑黄黄酮对α-葡萄糖苷酶活性的抑制率达83.57%,稍高于阿卡波糖对α-葡萄糖苷酶的抑制作用。但桑黄黄酮抑制α-葡萄糖苷酶活性的IC50值为1.28 mg/mL,显著大于阿卡波糖(IC50 0.16 mg/mL)(P<0.01),表明桑黄黄酮虽然表现出良好的降血糖活性,但低于阿卡波糖。李雨鸿等[26]研究表明桑黄醇提取物抑制α-淀粉酶活性低于阿卡波糖,但其对α-葡萄糖苷酶的抑制作用较阿卡波糖强。许多研究表明黄酮类化合物对α-淀粉酶和α-葡萄糖苷酶的抑制作用与其结构有很大关系,LIM等[27]研究表明,黄酮类化合物的C2和C3之间的双键以及A5和B3处的—OH—对于抑制α-淀粉酶非常关键,而B3和C3处的—OH对于α-葡糖苷酶抑制非常重要。PIPARO等[28]研究表明类黄酮中环C的C2和C3之间的双键增加了环C中电子云的强度,从而稳定了环A(或B)与α-淀粉酶中色氨酸芳香环之间的π-π共轭,进而增加了α-淀粉酶抑制活性。XIAO等[29]研究发现黄酮的3’位羟基会增强其对α-淀粉酶的抑制作用。LIU等[30]研究表明蓝果忍冬果实的花色苷成分能通过氢键和范德华力与糖苷酶相互作用,起到延缓淀粉消化速度的作用。但桑黄黄酮对α-淀粉酶和α-葡萄糖苷酶活性抑制作用的集中有待进一步研究。
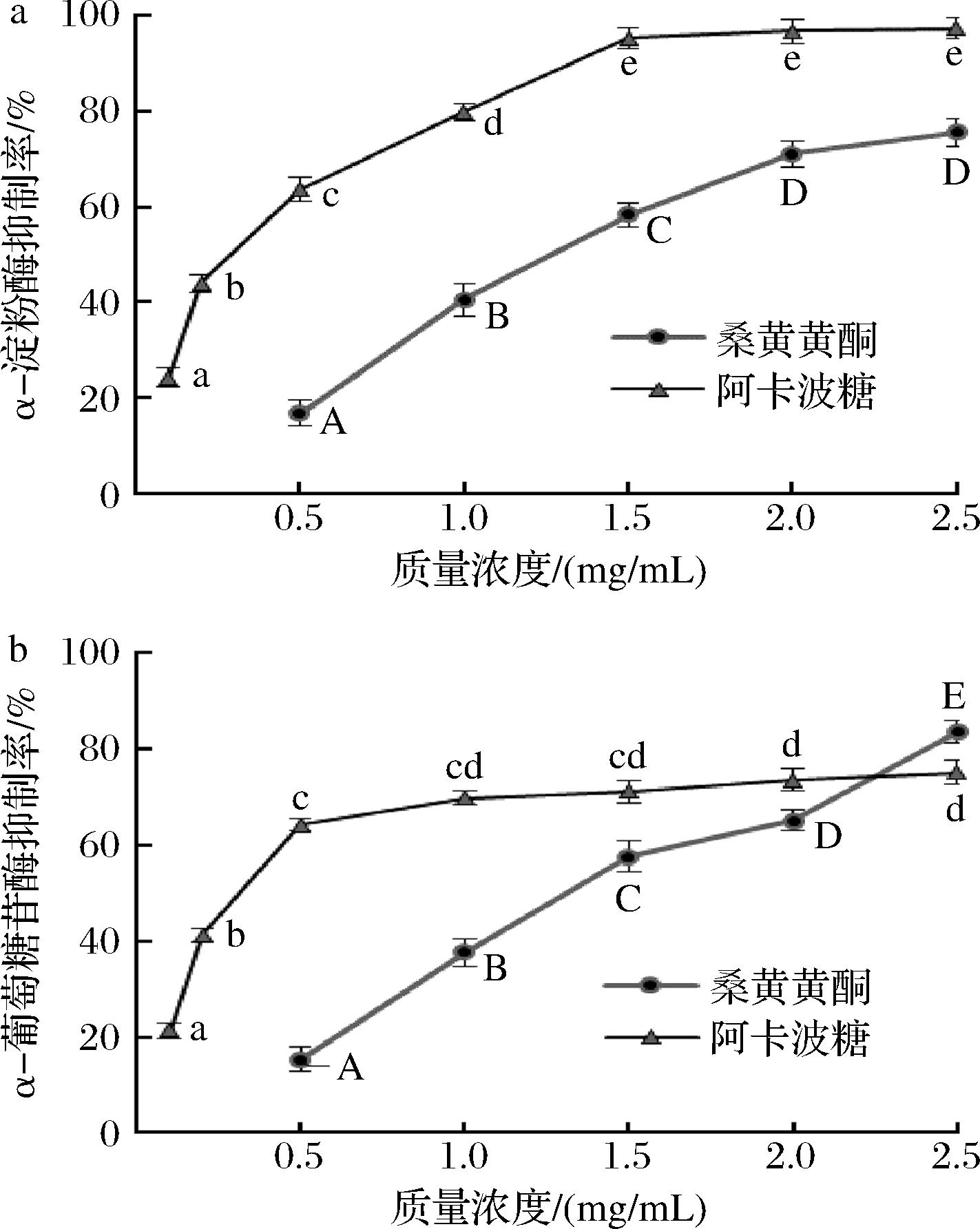
a-α-淀粉酶活性抑制能力;b-α-葡萄糖苷酶活性抑制能力
图10 桑黄黄酮的降血糖试验结果
Fig.10 Hypoglycemic of PIFs
注:大写字母表示桑黄黄酮差异显著性,小写字母表示阿卡波糖差异显著性(P<0.05)。
2.5 对胆酸盐结合能力试验结果
黄酮类化合物能通过与胆酸盐结合和降低胆汁酸的重吸收率,从而降低胆固醇的含量,到达降血脂的功能[31]。如图11所示,在实验浓度范围内,随着黄酮浓度的增大,与胆酸钠结合率越高,质量浓度为3 mg/mL时,对牛磺胆酸钠和甘氨胆酸钠的结合率分别为最82.50%和76.23%,其IC50值分别为0.62 mg/mL和1.19 mg/mL,表明桑黄黄酮具有较强的胆酸钠结合能力,具有一定的调节血脂功能。姚旭等[32]研究甜橙皮黄酮类化合物和芦宇等[33]研究红树莓籽黄酮的结果与本研究结果一致。说明桑黄黄酮具有开发成天然降血脂药物的潜质。
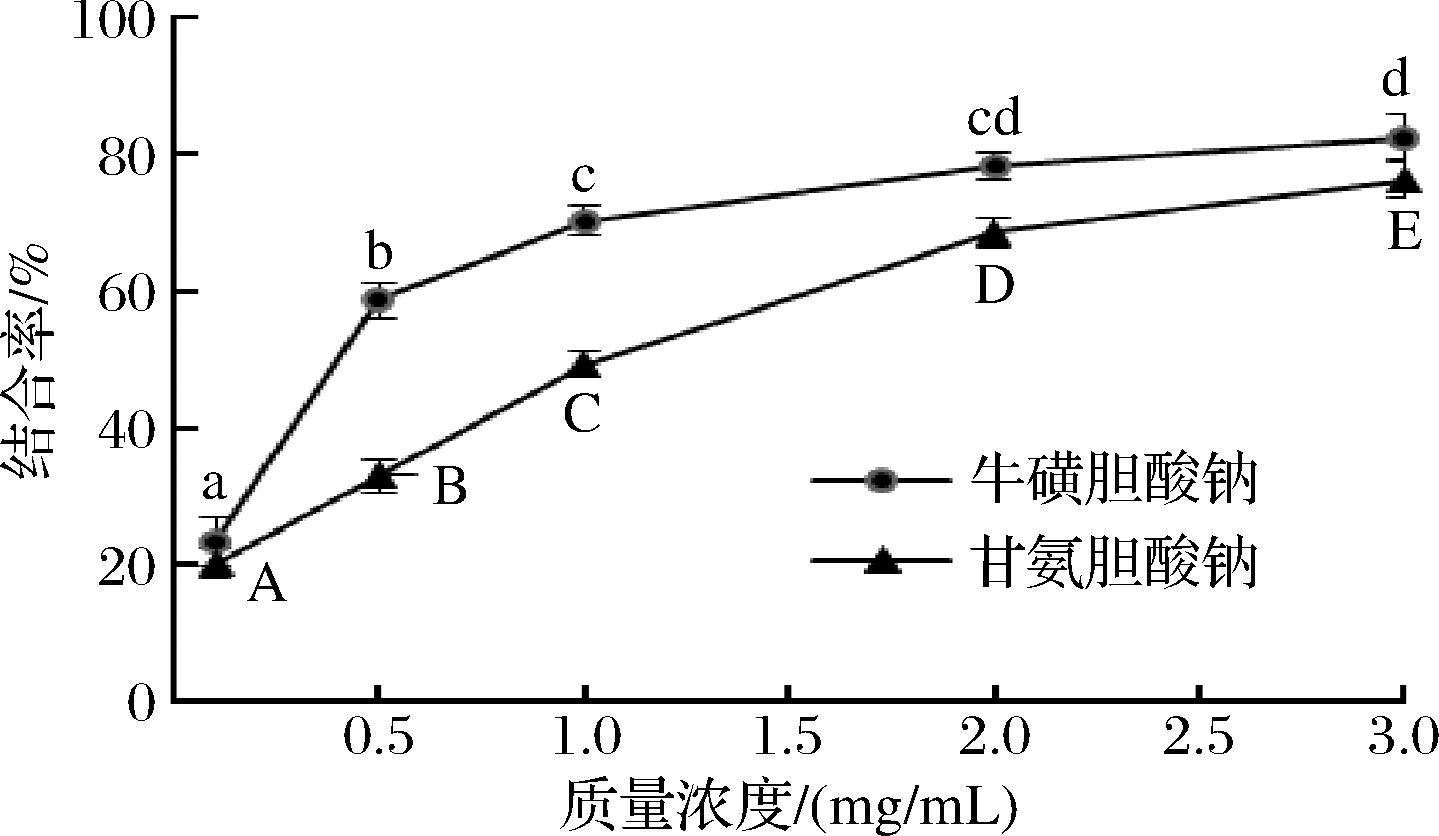
图11 对胆酸钠的结合能力
Fig.11 Binding ability of cholate
注:大写字母表示甘氨胆酸钠差异显著性,小写字母表示牛磺胆酸钠差异显著性(P<0.05)。
3 结论
本文筛选出对桑黄黄酮提取最佳的DES为以氯化胆碱为氢受体和乙二醇为氢供体组成的体系,DES提取桑黄黄酮的最佳条件为含水率30%,氯化胆碱∶乙二醇物质的量比8.21∶1(mol∶mol),料液比50∶1(mg∶mL),提取温度64 ℃,提取时间43 min,在此条件下黄酮得率为(8.85±0.34)%,是体积分数为60%乙醇提取得率的2.02倍。9种不同类型的大孔树脂中AB-8对桑黄黄酮的富集回收效果最好,纯化后其纯度提高了6.12倍。桑黄黄酮具有较好的抑制α-淀粉酶和α-葡萄糖苷酶活性及结合胆酸钠的能力,表明桑黄黄酮具有较强降低血糖和血脂的能力,试验结果为绿色制备、富集桑黄黄酮及其作为降血糖和降血脂的功能成分的开发利用提供了一定的依据。
不同的DES具有不同的理化性质,对不同种类的黄酮化合物的提取效果也有差异,本文仅以总黄酮的得率为指标,下一步可探讨DES对不同种类黄酮化合物的提取效果,获得特定化合物的提取条件,并可对其提取机制进行分析。
[1] 荣丹, 唐梦瑜, 么越, 等.桑黄活性物质提取分离及药理作用研究进展[J].中国食用菌, 2022, 41(6):1-6.
RONG D, TANG M Y, YAO Y, et al.Research progress on extraction, separation and pharmacological action of the active substances from Sanghuang[J].Edible Fungi of China, 2022, 41(6):1-6.
[2] 郎明紫. 桑黄黄酮类化合物的免疫药理学研究[D].杭州:浙江大学, 2019.
LANG M Z.Immunopharmacological study on flavonoids from Phellinus igniarius[D].Hangzhou:Zhejiang University, 2019.
[3] 朱姝枚, 郭璐, 张少冰, 等.超声波辅助乙醇提取忍冬桑黄菌丝体中黄酮的研究[J].食品科技, 2022, 47(2):239-244.
ZHU S M, GUO L, ZHANG S B, et al.Study on ultrasonic-assisted ethanol extraction conditions of flavonoids from Sanghuangporus lonicericola mycelium[J].Food Science and Technology, 2022, 47(2):239-244.
[4] 郎明紫, 刘明明, 解鸿青, 等.桑黄黄酮的超声波辅助醇提工艺优化及其体外抗氧化活性测定[J].蚕业科学, 2019, 45(2):262-268.
LANG M Z, LIU M M, XIE H Q, et al.Optimizing ultrasonic-assisted ethanol extracting conditions of total flavonoids from Phellinus baumii and its antioxidant effect in vitro[J].Science of Sericulture, 2019, 45(2):262-268.
[5] 于翠翠. 桑黄总黄酮提取及抗氧化功效研究[D].长春:吉林农业大学, 2014.
YU C C.Study on the extraction of phellinus total flavonoids and its antioxidant function[D].Changchun:Jilin Agricultural University, 2014.
[6] 张倩, 孙瑞祥, 王妍, 等.桑黄、蛹虫草超临界CO2萃取物的抗氧化活性及其黄酮和三萜含量[J].食用菌, 2020, 42(5):65-67.
ZHANG Q, SUN R X, WANG Y, et al.Antioxidant activity and content of flavonoids and triterpene of supercritical CO2 extract from Cordyceps militaris and Sanghuangporus sanghuang[J].Edible Fungi, 2020, 42(5):65-67.
[7] 张平静. 低共熔溶剂在黄酮类化合物苷元制备与分析中的应用[D].杭州:浙江工商大学, 2019.
ZHANG P J.The application of natural deep eutectic solvents in preparation and analysing of flavonoid aglycones[D].Hangzhou:Zhejiang Gongshang University, 2019.
[8] LI Z H, LIU D, MEN Z W, et al.Insight into effective denitrification and desulfurization of liquid fuel with deep eutectic solvents:An innovative evaluation criterion to filtrate extractants using the compatibility index[J].Green Chemistry, 2018, 20(13):3112-3120.
[9] PAN X, XU L J, MENG J L, et al.Ultrasound-assisted deep eutectic solvents extraction of polysaccharides from Morchella importuna:Optimization, physicochemical properties, and bioactivities[J].Frontiers in Nutrition, 2022, 9:912014.
[10] YOO D E, JEONG K M, HAN S Y, et al.Deep eutectic solvent-based valorization of spent coffee grounds[J].Food Chemistry, 2018, 255:357-364.
[11] WANG X H, WANG J P.Effective extraction with deep eutectic solvents and enrichment by macroporous adsorption resin of flavonoids from Carthamus tinctorius L[J].Journal of Pharmaceutical and Biomedical Analysis, 2019, 176:112804.
[12] ALI M C, CHEN J, ZHANG H J, et al.Effective extraction of flavonoids from Lycium barbarum L.fruits by deep eutectic solvents-based ultrasound-assisted extraction[J].Talanta, 2019, 203:16-22.
[13] 王帆, 简雅婷, 张宇, 等.低共熔溶剂提取厚朴渣中木脂素类化合物[J].农业工程学报, 2022, 38(3):304-310.
WANG F, JIAN Y T, ZHANG Y, et al.Extracting the lignanoids from magnolia bark residues by deep eutectic solvent[J].Transactions of the Chinese Society of Agricultural Engineering, 2022, 38(3):304-310.
[14] 汪涛, 梁亮, 李旭锐, 等.低共熔溶剂提取核桃青皮多酚工艺优化及其抑菌活性[J].农业工程学报, 2021, 37(5):317-323.
WANG T, LIANG L, LI X R, et al.Optimization of the technology for deep eutectic solvents extraction and antibacterial activity of walnut green husk polyphenols[J].Transactions of the Chinese Society of Agricultural Engineering, 2021, 37(5):317-323.
[15] 黄文睿, 唐超凡, 陶雨峰, 等.绿色低共熔溶剂提取野菊花中黄酮类化合物[J].精细化工, 2022, 39(3):569-576.
HUANG W R, TANG C F, TAO Y F, et al.Extraction of flavonoids from Chrysanthemum indicum L.by green deep eutectic solvents[J].Fine Chemicals, 2022, 39(3):569-576.
[16] 巫永华, 张建萍, 赵节昌, 等.大孔树脂纯化黄精多酚及其抗氧化性与组成分析[J].农业工程学报, 2020, 36(1):318-326.
WU Y H, ZHANG J P, ZHAO J C, et al.Antioxidantion and composition analysis of purified Polygonatum sibiricum polyphenols using macroporous resin[J].Transactions of the Chinese Society of Agricultural Engineering, 2020, 36(1):318-326.
[17] 李萌萌, 吕长鑫, 芦宇, 等.纤维素酶辅助提取红树莓籽黄酮及其对α-葡萄糖苷酶和α-淀粉酶的抑制作用[J].中国食品学报, 2017, 17(11):99-107.
LI M M, LYU C X, LU Y, et al.Inhibitory activities on α-glucosidase and α-amylase of flavonoids cellulase-assisted extracts from red raspberry seed[J].Journal of Chinese Institute of Food Science and Technology, 2017, 17(11):99-107.
[18] 於雨碟, 张佳妍, 张酥, 等.桦褐孔菌子实体多糖的提取及体外降血糖活性[J].菌物学报, 2021, 40(1):189-202.
YU Y D, ZHANG J Y, ZHANG S, et al.Molecular screening of medicinal fungus Inonotus obliquus and anti-breast cancer activity of its submerged fermentation broth[J].Mycosystema, 2021, 40(1):189-202.
[19] 赵有伟, 李德海.超声微波协同制备粗毛纤孔菌多糖及体外降脂作用的研究[J].食品工业科技, 2021, 42(20):191-198.
ZHAO Y W, LI D H.Ultrasonic and microwave synergistic preparation of polysaccharide from Inonotus hispidus and its effect on lowering lipid in vitro[J].Science and Technology of Food Industry, 2021, 42(20):191-198.
[20] 李善姬, 梁承武, 崔承弼, 等.野生桑黄总黄酮提取工艺及其抗氧化作用的研究[J].食品研究与开发, 2015, 36(20):32-35.
LI S J, LIANG C W, CUI C B, et al.Study on extraction technology and antioxidant activity of total flavonoid from wild Phellinus vanini[J].Food Research and Development, 2015, 36(20):32-35.
[21] CUI Q, LIU J Z, WANG L T, et al.Sustainable deep eutectic solvents preparation and their efficiency in extraction and enrichment of main bioactive flavonoids from sea buckthorn leaves[J].Journal of Cleaner Production, 2018, 184:826-835.
[22] 刘丹宁. 枳实黄酮的超声低共熔溶剂提取及其对化疗腹泻小鼠的影响[D].重庆:西南大学, 2020.
LIU D N.Flavonoids in fructus aurantii immaturus:Ultrasound-assisted deep eutectic solvent extraction and effects on 5-FU induce diarrhea mice[D].Chongqing:Southwest University, 2020.
[23] MENG Z R, ZHAO J, DUAN H X, et al.Green and efficient extraction of four bioactive flavonoids from Pollen typhae by ultrasound-assisted deep eutectic solvents extraction[J].Journal of Pharmaceutical and Biomedical Analysis, 2018, 161:246-253.
[24] TIAN J L, SI X, WANG Y H, et al.Bioactive flavonoids from Rubus corchorifolius inhibit α-glucosidase and α-amylase to improve postprandial hyperglycemia[J].Food Chemistry, 2021, 341(Pt 1):128149.
[25] 杨继晨. 黄酮类化合物对α-淀粉酶/α-葡萄糖苷酶的抑制机制及其构效关系研究[D].天津:天津大学, 2021.
YANG J C.Inhibitory mechanism and structure-activity relationship of flavonoids on α-amylase/α-glucosidase[D].Tianjin:Tianjin University, 2021.
[26] 李雨鸿, 殷朝敏, 范秀芝, 等.桑黄提取物的体外抗氧化、降血糖及降尿酸活性[J].现代食品科技, 2022, 38(5):71-80.
LI Y H, YIN C M, FAN X Z, et al.In vitro anti-oxidant, hypoglycemic, and hypouricemic activities of Sanghuangporus vaninii extracts[J].Modern Food Science and Technology, 2022, 38(5):71-80.
[27] LIM J, FERRUZZI M G, HAMAKER B R.Structural requirements of flavonoids for the selective inhibition of α-amylase versus α-glucosidase[J].Food Chemistry, 2022, 370:130981.
[28] PIPARO E L, SCHEIB H, FREI N, et al.Flavonoids for controlling starch digestion:Structural requirements for inhibiting human alpha-amylase[J].Journal of Medicinal Chemistry, 2008, 51(12):3555-3561.
[29] XIAO Z C, HOU X H, ZHANG T, et al.Starch-digesting product analysis based on the hydrophilic interaction liquid chromatography coupled mass spectrometry method to evaluate the inhibition of flavonoids on pancreatic α-amylase[J].Food Chemistry, 2022, 372:131175.
[30] LIU S W, YU J C, GUO S, et al.Inhibition of pancreatic α-amylase by Lonicera caerulea berry polyphenols in vitro and their potential as hyperglycemic agents[J].LWT, 2020, 126:109288.
[31] 何旭华, 石志娇, 王安娜, 等.黑果腺肋花楸叶黄酮的提取工艺优化及抗氧化、结合胆酸盐能力分析[J].食品工业科技, 2023, 44(2):253-260.
HE X H, SHI Z J, WANG A N, et al.Optimization of extraction process of flavonoids from Aronia melanocarpas’ leaves and analysis of their antioxidant and bile salt binding capacity[J].Science and Technology of Food Industry, 2023, 44(2):253-260.
[32] 姚旭, 郦萍, 顾青.4种甜橙皮黄酮类化合物体外抗氧化活性及降糖降脂功能研究[J].中国食品学报, 2022, 22(1):49-57.
YAO X, LI P, GU Q.Studies on antioxidant activity, hypoglycemic and lipid-lowering capacity of flavonoids in sweet orange peels in vitro[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(1):49-57.
[33] 芦宇, 吕长鑫, 焦天慧, 等.聚酰胺纯化红树莓籽黄酮及其结合胆酸盐能力评价[J].中国食品学报, 2019, 19(10):172-178.
LU Y, LYU C X, JIAO T H, et al.Ability of bile salt-binding of red raspberry seed flavonoids purifuication by polyamide[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(10):172-178.