叶黄素是一种广泛存在于水果与花卉之中的类胡萝卜素,在人体中无法合成,有研究表明叶黄素在预防视网膜病变和心血管疾病等方面有积极作用[1-3]。叶黄素作为一种脂溶性色素具有高度疏水的特点,此外由于其对光、热敏感,易造成氧化降解影响其生物活性从而极大程度上限制其在食品中的应用[4-5]。
目前,针对亲脂性功能成分开发出了许多类型的递送载体,基于乳液的递送体系具有明显的优势[6]。将功能成分包裹在油相内核之中,通过控制液滴的大小、分散相与连续相组成等因素又可以得到不同形式的乳液,从而更好地改善功能成分的理化稳定性及生物可及性[7]。蛋白和多糖是制备乳液时常用的乳化剂,采用高压均质法构建以酪蛋白酸钠为乳化剂的叶黄素纳米乳液在4 ℃下保存30 d后仍有较高的物理稳定性,且能有效降低叶黄素的降解速率[8]。通过静电层层组装技术,利用乳清分离蛋白、壳聚糖和亚麻籽胶形成不同界面层的叶黄素乳状液,发现多层乳液中的叶黄素理化稳定性都明显优于单层乳液[9]。随着人们对绿色、安全食品的追求,使用天然乳化剂也逐渐成为发展趋势。
米糠油体(rice bran oil body)是一种天然复合乳状液,其内部为甘油三酯,表面被磷脂和蛋白膜覆盖,富含多不饱和脂肪酸、油体蛋白、磷脂、生育酚和植物甾醇等功能性成分[10]。全球米糠产量丰富,但是存在深加工严重不足的问题,米糠是稻谷加工过程中最重要的一类副产物,因此其获取来源广泛,在食品中有广阔的应用前景[11]。由于油体特殊的结构,其具备作为天然乳化剂的潜力。有研究使用大豆油体作为乳化剂通过超声波处理成功制备负载姜黄素乳液[12],但尚未见到关于米糠油体相关研究。
因此,本研究以米糠为原料,采用NaHCO3提取法从中分离得到油体作为乳化剂,制备负载叶黄素的米糠油体乳液,并探究体系中不同油相浓度米糠油体叶黄素乳液的理化稳定性,旨在为利用油体开发叶黄素递送载体提供研究基础。
1 材料与方法
1.1 实验材料
米糠,市售;稻米油,益海嘉里有限公司;叶黄素(纯度≥90%),河北晨光生物科技有限公司;尼罗红,上海麦克林生化科技有限公司;尼罗蓝,美国Sigma试剂公司;其他试剂均为国产分析纯。
1.2 仪器与设备
DF-101S集热式恒温加热磁力搅拌器,河南省予华仪器有限公司;Allegra X-15R超高速离心机,美国贝克曼库尔特有限公司;Mastersizer 2000激光粒度分布仪,英国马尔文仪器有限公司;LUMiSizer稳定性分析仪,德国L.U.M.GmbH公司;Microfluids高压微射流纳米均质机,美国MFIC公司;FV3000激光共聚焦显微镜,美国Olympus公司;紫外可见分光光度计,日本岛津公司;iS10 FTIR光谱仪,美国Nicolet公司;D8 Advance X射线衍射仪,德国Bruker公司。
1.3 实验方法
1.3.1 米糠油体叶黄素乳液的制备
将米糠浸泡在NaHCO3溶液(2 mol/L,pH 6.5),料液比为1∶7(g∶mL),在50 ℃下水浴加热搅拌3 h,使用双层纱布过滤混合物中的米糠,将滤液在10 000 r/min,4 ℃下离心20 min后取上层漂浮物即为米糠油体。取适量米糠油体充分溶解在磷酸盐缓冲溶液(1 mmol/L,pH 6.5)中制备油体质量分数为45%的水相,添加0.1%(质量分数)叶黄素于稻米油中,120 ℃避光加热搅拌2 min使之完全溶解,将不同比例的水相与油相混合,在15 000 r/min剪切3 min后,再经过微射流高压均质机在50 MPa下均质3个循环,最终制备得到油相体积分数为5%、10%、15%、20%、25%的米糠油体叶黄素乳液。
1.3.2 粒径和电位的测定
将新鲜制备的乳液稀释400倍避免多重散射,利用激光粒度及zeta电位仪测定不同油相浓度乳液的粒径和电位,样品平衡120 s后进行测定,每个样品测定3次。
1.3.3 物理稳定性分析
使用LUMiSizer稳定性分析仪测定米糠油体叶黄素乳液的稳定性。取0.4 mL样品,在转速4 000 r/min,测试温度25 ℃,扫描间隔60 s/次,扫描次数255次条件下,测定样品的不稳定系数,每个样品测定3次。
1.3.4 叶黄素包埋率的测定
参考HAO等[13]的方法进行测定,取不同水相油相比例米糠油体叶黄素乳液1 mL,加入适量无水乙醇,漩涡振荡30 s后,在4 000 r/min下离心5 min,取离心后得到的上清液,以同样处理的米糠油体为空白,在445 nm处测定吸光度。包埋率根据叶黄素浓度标准曲线(y=0.153 5x-0.015 8,R2=0.998)及公式(1)可得.
包埋率![]()
(1)
式中:C0,制备时的叶黄素含量,g/100 g;C1,上清液中叶黄素含量,g/100 g。
1.3.5 剪切流变特性分析
使用MARS40旋转流变仪及其附带的同心圆筒夹具(直径30 mm,间隙4 000 μm)在25 ℃下测定米糠油体叶黄素乳液的表观黏度。使用17 mL乳液以0.1~100 s-1的剪切速率测量样品的表观黏度,在测定开始前样品需要平衡5 min。
1.3.6 微观结构分析
1.3.6.1 激光共聚焦显微镜分析
使用尼罗蓝和尼罗红分别对乳液中的蛋白相和油相进行染色,取少量染色好的样品置于载玻片上,在共聚焦激光显微镜下进行观察,采用10倍目镜和60倍物镜(油镜)观察来自尼罗红(激发波长488 nm)和尼罗蓝A(激发波长635 nm)染料的荧光信号。
1.3.6.2 冷冻扫描电镜
样品先在液氮中预冷冻,然后转移到冷冻制备室,在真空状态下冷冻断裂、升华除冰和溅射镀铂,最后转移到扫描电子显微镜(scanning electron microscope,SEM)样品台进行观察。
1.3.7 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)测定
冷冻干燥后的样品与100 mg KBr粉末混合,将其研磨成细粉末压制成颗粒。扫描区间为4 000~600 cm-1,分辨率为4 cm-1,光谱在32次扫描后获得。
1.3.8 X射线衍射(X-ray diffraction,XRD)测定
扫描范围为5 °~50 °(2θ),扫描速度为2°/min。管电流和加速电压分别设置为40 mA和40 kV。
1.3.9 叶黄素降解测定
将样品置于37 ℃黑暗中保存22 d,以加速叶黄素降解。用无水乙醇提取叶黄素,在445 nm处测定吸光度。根据叶黄素标准曲线计算乳液中叶黄素的含量,如公式(2)所示:
叶黄素保留率![]()
(2)
式中:Ct,贮藏时间t d后的叶黄素含量,g/100 g。
1.3.10 数据统计与分析
用SPSS 17、Microsoft Excel 2019软件对数据进行单因素方差分析(ANOVA),P<0.05表示差异显著,所有实验平行3次,数据以平均值±标准偏差表示,结果用Origin 2022软件作图表示。
2 结果与分析
2.1 油相浓度对乳液粒径和zeta电位的影响
图1显示了不同油相浓度米糠油体叶黄素乳液的粒径以及zeta电位变化趋势,随着体系中油相浓度的增大,乳液的平均粒径随之先减小后增大,当油相体积分数为10%时乳液呈现最小的粒径为(481.03±34.39) nm。油体在乳液中充当乳化剂时其所能稳定的油相浓度是有限的,因而当体系中油相占比逐渐增大,且没有足够的油体蛋白和磷脂在乳液液滴界面上起到乳化作用,就造成了液滴的聚集从而使其粒径增加。乳液的zeta电位显示出负值,这归因于其在水中电离出的羟基[14],其值主要分布在(-36.5±0.5)~(-42.67±0.42) mV,绝对值随着油相浓度的增大而增大,这主要是因为较大的乳液粒径使其表面能够吸附更多的负离子,从而使乳液整体的zeta电位增大[15]。
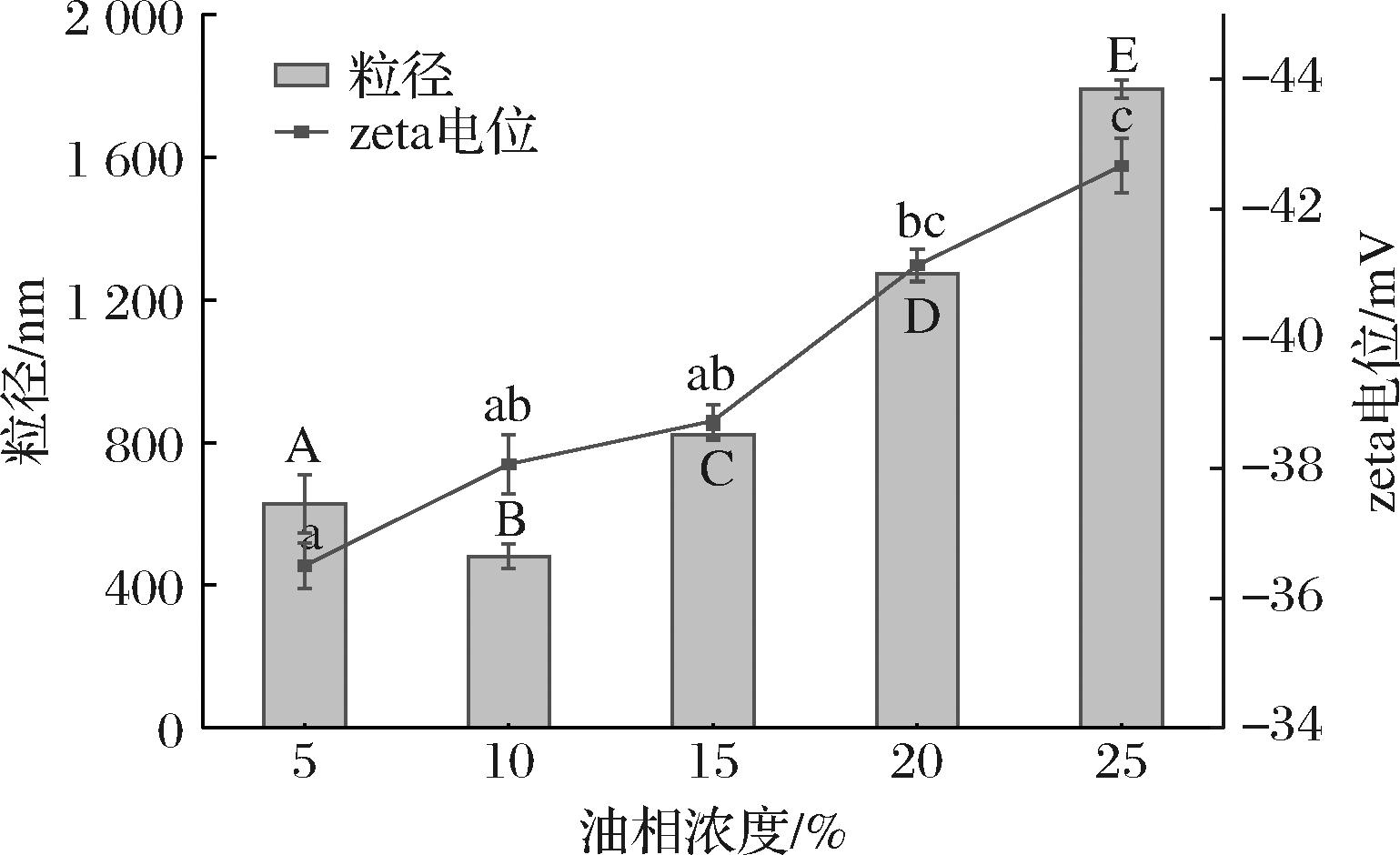
图1 油相浓度对米糠油体叶黄素乳液粒径和zeta电位的影响
Fig.1 Effect of oil phase concentration on particle size and zeta potential of lutein-loaded rice bran oil body emulsion
2.2 油相浓度对乳液物理稳定性的影响
对于不同油相浓度制备的米糠油体叶黄素乳液在LUMiSizer中测得的图像分析,终止谱线如果高于起始谱线,即谱线向上变宽, 则表明顶部的透光率增加, 溶液变得澄清, 溶液组分在离心力的作用下向底部发生迁移[16]。谱线变化的范围越大说明乳液的稳定性越差[17]。因此,当乳液中的油相含量逐渐增大时,乳液的稳定性也随之降低。由图2可知,当体系中的油相含量为10%时,可以观察到其谱线变化程度最低,结合粒径测定结果可知,该油相浓度下的乳液具有最小的乳液液滴尺寸,其具有更大的可吸附蛋白质的表面积,这能稳定并加强液滴界面膜,乳液具有更高的稳定性,从而减少在离心过程中的沉淀分散,而乳液中油相占比大于20%时,由于乳液液滴间的聚集其更易在离心过程中失稳。

a-5%;b-10%;c-15%;d-20%;e-25%
图2 油相浓度对米糠油体叶黄素乳液物理稳定性的影响
Fig.2 Effect of oil phase concentration on physical stability of lutein-loaded rice bran oil body emulsion
2.3 叶黄素包埋效果的测定
图3-a中显示了不同油相浓度米糠油体叶黄素乳液中的叶黄素包埋率,对于所有乳液中叶黄素的包埋效果,其总体趋势随着油相浓度的增大先上升后减小。最大包埋率在乳液中油相体积分数为10%时,其值在37%左右。由于油相占比增大,乳液的稳定性变差,油体蛋白与磷脂无法较好地包覆住溶解了叶黄素的油相,因而其包埋效果也随之变差。如图3-b所示,通过对油相体积分数为10%的米糠油体叶黄素乳液进行XRD测定,米糠油体显示出了一个宽峰,表明其无定型状态,叶黄素的图谱中具有尖锐、强烈的特征峰,这表明了叶黄素内部存在的晶体结构,而在米糠油体叶黄素乳液中显示出的平滑曲线以及叶黄素特征峰消失,则表明在乳液的内部叶黄素由结晶态转为非晶态,能够被包覆在乳液的油相核心中[18]。

a-不同油相浓度米糠油体叶黄素乳液包埋率;b-米糠油体叶黄素乳液XRD图
图3 米糠油体叶黄素乳液中叶黄素包埋效果分析
Fig.3 Analysis of encapsulation efficiency of lutein in lutein-loaded rice bran oil body emulsion
2.4 油相浓度对乳液表观黏度的影响
图4显示出不同油相浓度稳定的米糠油体叶黄素乳液的表观黏度,在0.1~100 s-1的剪切速率下,乳液的表观黏度均保持在0.1 Pa·s以下,这表明乳液间具有较低的黏度以及良好的流动性。对于所有的乳液样品,乳液的表观黏度随着剪切速率的增加逐渐降低,表现出乳液中常见的剪切变稀行为,这种现象产生的原因在于乳液液滴的聚集和密集堆积[19]。随着剪切速率的增加,絮凝的液滴被破坏,导致黏度降低。对于油相体积分数在20%以下的乳液,当剪切速率高于40 s-1时,乳液黏度保持相对稳定,并显示出牛顿流体的特征。此外,随着油相浓度的增加,乳液的表观黏度也随之增加。一般来说,乳液具有较小的粒径会有更高的黏度,但是在米糠油体叶黄素乳液中并不完全适用这种模式,这可能是因为乳液中的磷脂与蛋白质相互作用形成了具有高黏度的稳定网络,不仅如此,乳液黏度还会受到带电液滴的存在以及液滴之间的排斥相互作用的影响[20]。也可能是因为乳液中更高的油相核心使得乳液具有更高的黏度[21]。

图4 不同油相浓度米糠油体叶黄素乳状液表观黏度
Fig.4 Apparent viscosity of lutein-loaded rice bran oil body emulsion with different oil phase concentrations
2.5 乳液微观结构
激光共聚焦可以观察乳液液滴的分布情况以及界面结构。由图5-a可知,随着体系中油相浓度的增大,液滴的平均粒径逐渐增大,这与平均粒径的测量结构一致。通过对乳液液滴中的蛋白以及油相进行染色观察可以看出,当油相含量升高时,乳液中油滴的聚集现象发生明显,且液滴界面上的蛋白分布情况很难维持乳液稳定,而油相体积分数为10%的乳液中液滴分布均匀,其稳定性也相对较好。如图5-b所示,通过冷冻扫描电镜的图像,可以更好地观察乳液液滴的形态特征以及分布情况,从不同的放大倍数下观察,乳液液滴形态呈球状,在液滴表面吸附的片状物质推测是稳定乳液界面结构的蛋白,同时,在乳液中的小液滴彼此靠近聚拢,其形成的网络结构能更好地包裹油脂核心,支撑着乳液的稳定性[12]。

a- 不同油相浓度米糠油体叶黄素乳液激光共聚焦图像
(A-油相;B-蛋白;C-复合图);b- 油相体积分数10%米糠油体叶黄素乳液冷冻扫描电镜图
图5 米糠油体叶黄素乳液微观结构图
Fig.5 Microstructure graph of lutein-loaded rice bran oil body emulsion
2.6 乳液红外光谱分析
叶黄素、米糠油体及油相体积分数10%乳液的红外光谱如图6所示,米糠油体的酰胺A带在3 292 cm-1出峰,对应—NH和—OH的振动,2 925 cm-1的吸收峰是由酰胺B带C—N伸缩振动产生,而酰胺Ⅰ带在1 656 cm-1出峰,是C![]() O和C
O和C![]() N的拉伸振动的特征谱带,酰胺Ⅱ带位于1 547 cm-1,为蛋白C—N伸缩振动与N—H弯曲振动。在形成米糠油体叶黄素乳液之后,其酰胺Ⅰ带以及酰胺III带的吸收峰值并未发生明显偏移,而在酰胺Ⅱ带以及酰胺A带之中,可以看出其吸收带发生“蓝移”,这些都表明了氢键的生成[22-23]。与米糠油体相比,没有新的吸收峰产生,说明叶黄素与米糠油体之间以非共价键结合,二者之间的相互作用虽然会改变吸收峰的位置与强度,但是不会出现新的官能团[24]。
N的拉伸振动的特征谱带,酰胺Ⅱ带位于1 547 cm-1,为蛋白C—N伸缩振动与N—H弯曲振动。在形成米糠油体叶黄素乳液之后,其酰胺Ⅰ带以及酰胺III带的吸收峰值并未发生明显偏移,而在酰胺Ⅱ带以及酰胺A带之中,可以看出其吸收带发生“蓝移”,这些都表明了氢键的生成[22-23]。与米糠油体相比,没有新的吸收峰产生,说明叶黄素与米糠油体之间以非共价键结合,二者之间的相互作用虽然会改变吸收峰的位置与强度,但是不会出现新的官能团[24]。
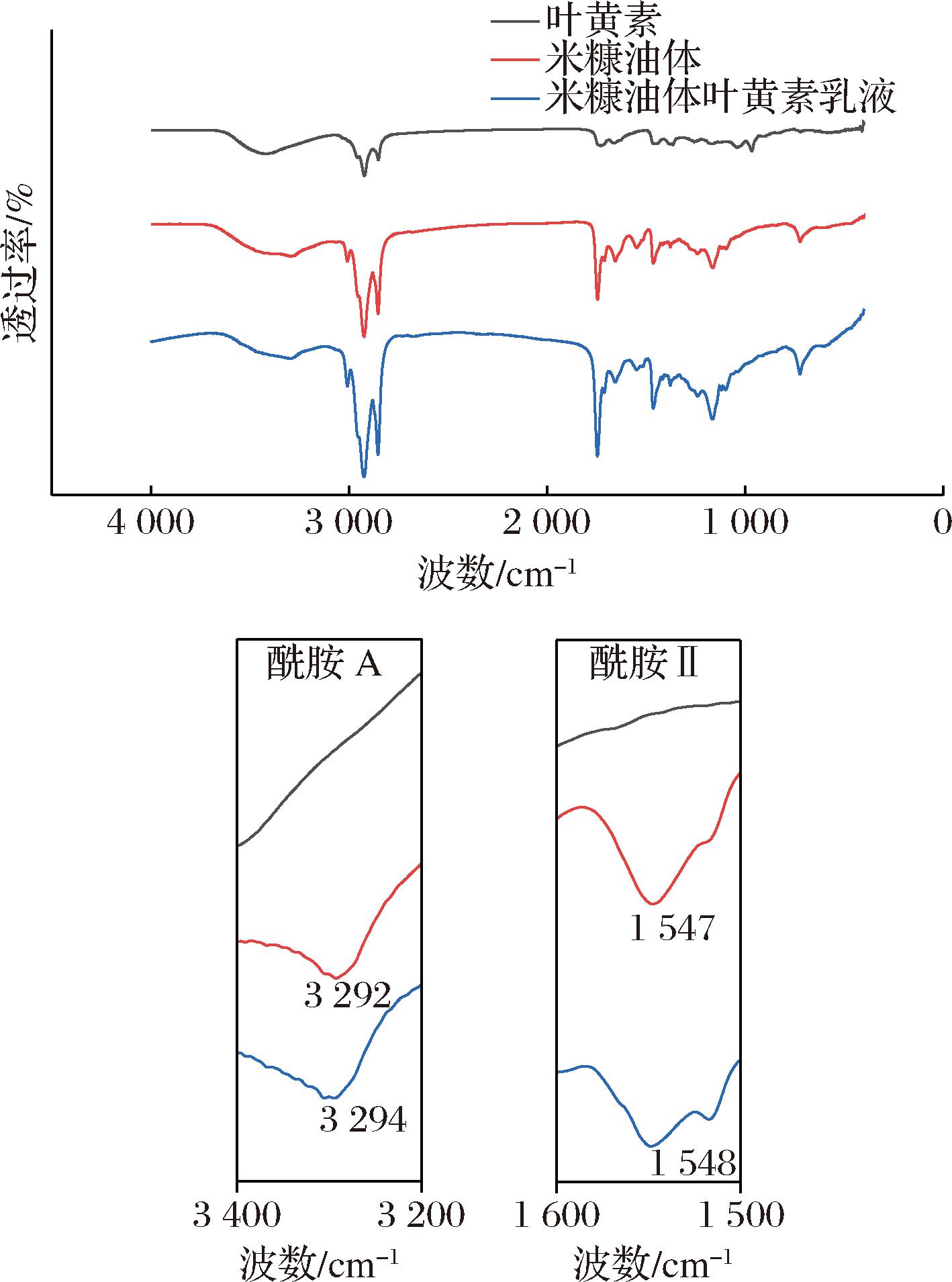
图6 米糠油体叶黄素乳液FTIR图
Fig.6 FTIR spectra of lutein-loaded rice bran oil body emulsion
2.7 叶黄素降解率的测定
图7展示了不同油相浓度的米糠油体叶黄素乳液中叶黄素的降解率,所有乳液中的叶黄素在前7 d都显示出了较快的降解速度,而在之后的氧化过程中,其降解速度稍有减缓。油相体积分数10%的乳液对比高浓度油相乳液中的叶黄素降解程度更低,具有最好的叶黄素保护效果,在储藏22 d后,所含的叶黄素含量接近65%。此外,在不同油相浓度的米糠油体叶黄素乳液中叶黄素的最终降解程度与其物理稳定性的特征有一定相似性,油相浓度高导致乳液对叶黄素的包封效果较差,在加速氧化储存的过程中,乳液中的油相和蛋白更易发生氧化,液滴界面结构更易被破坏,从而导致叶黄素保护效果较差[25]。
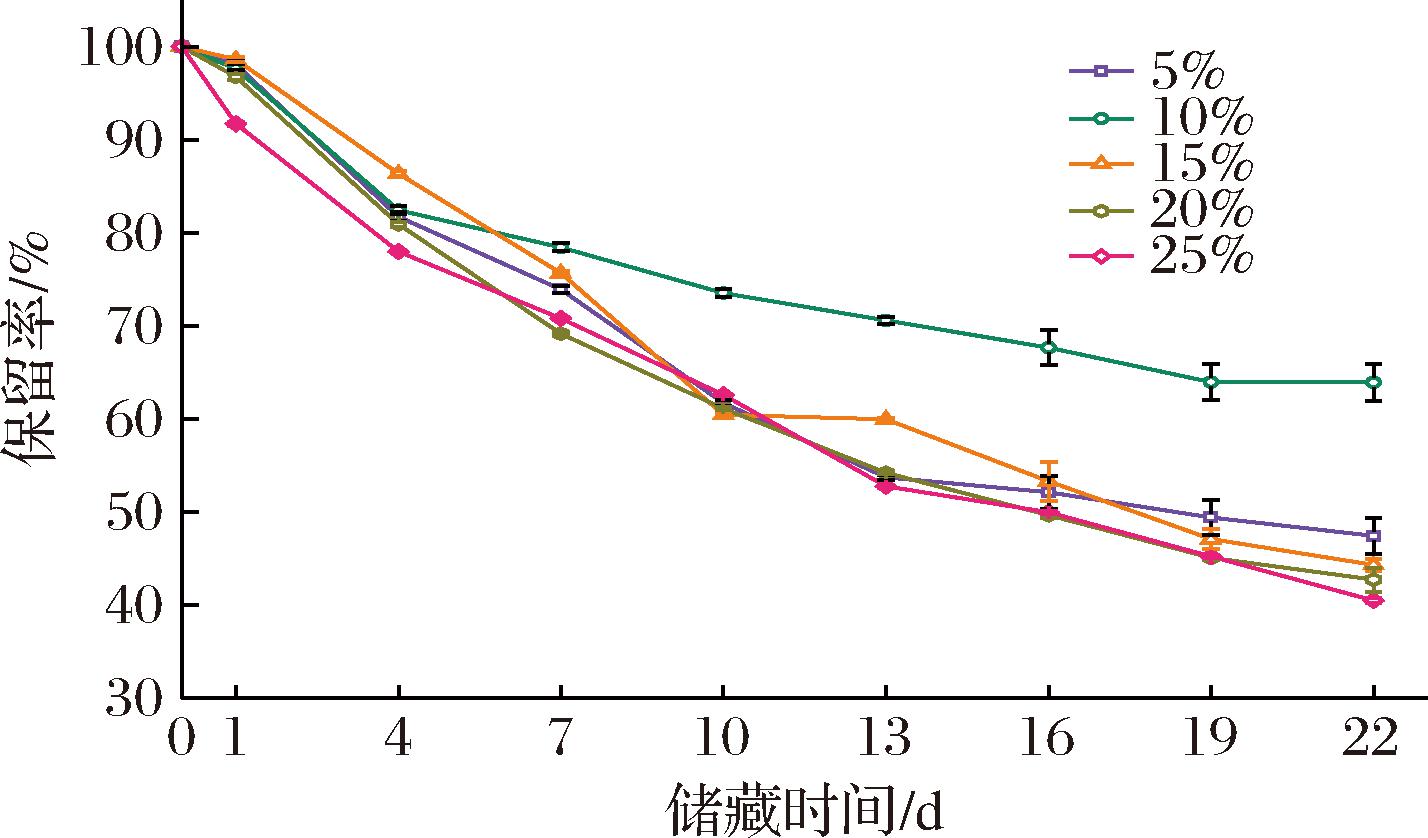
图7 油相浓度对米糠油体叶黄素乳液中叶黄素降解率的影响
Fig.7 Effect of oil phase concentration on the degradation rate of lutein in lutein-loaded rice bran oil body emulsion
3 结论与讨论
以米糠油体作为乳化剂,叶黄素可以成功负载在乳液中,且当乳液中的油相体积分数为10%时,乳液的包埋效果最佳,其剪切流变特性显示乳液具有较好的流动性,此外微观结构的结果表明乳液液滴分布均匀,形态呈球状,较小的粒径提高了乳液的理化稳定性,傅里叶红外光谱证明了氢键是乳液形成的主要驱动力。乳液中的叶黄素在经过22 d的加速氧化储藏后保留接近65%。综上,本实验结果为设计叶黄素递送载体和开发米糠油体递送功能因子体系提供了理论依据。
[1] GOMBA Z,
Z,  RNIVEC I G O, SKRT M, et al.Stabilisation of lutein and lutein esters with polyoxyethylene sorbitan monooleate, medium-chain triglyceride oil and lecithin[J].Foods, 2021, 10(3):500.
RNIVEC I G O, SKRT M, et al.Stabilisation of lutein and lutein esters with polyoxyethylene sorbitan monooleate, medium-chain triglyceride oil and lecithin[J].Foods, 2021, 10(3):500.
[2] SAINI R K, KEUM Y S.Carotenoid extraction methods:A review of recent developments[J].Food Chemistry, 2018, 240:90-103.
[3] BUSCEMI S, CORLEO D, DI PACE F, et al.The effect of lutein on eye and extra-eye health[J].Nutrients, 2018, 10(9):1321.
[4] 陈艾霖, 洪鹏志, 宋春勇, 等.热处理对负载叶黄素的罗非鱼分离蛋白乳液稳定性和体外消化的影响[J].食品与发酵工业, 2021, 47(16):173-180.
CHEN A L, HONG P Z, SONG C Y, et al.Effect of heat treatment on stability and in vitro digestion of lutein loaded tilapia protein isolate[J].Food and Fermentation Industries, 2021, 47(16):173-180.
[5] WEIGEL F, WEISS J, DECKER E A, et al.Lutein-enriched emulsion-based delivery systems:Influence of emulsifiers and antioxidants on physical and chemical stability[J].Food Chemistry, 2018, 242:395-403.
[6] STEINER B M, MCCLEMENTS D J, DAVIDOV-PARDO G.Encapsulation systems for lutein:A review[J].Trends in Food Science &Technology, 2018, 82:71-81.
[7] 郭静, 胡坦, 潘思轶.食品运载体系包埋叶黄素的研究进展[J].食品科学, 2022, 43(1):313-320.
GUO J, HU T, PAN S Y.Progress in research on food delivery systems for lutein encapsulation[J].Food Science, 2022, 43(1):313-320.
[8] LI J N, GUO R, HU H, et al.Preparation optimisation and storage stability of nanoemulsion-based lutein delivery systems[J].Journal of Microencapsulation, 2018, 35(6):570-583.
[9] XU D X, AIHEMAITI Z, CAO Y P, et al.Physicochemical stability, microrheological properties and microstructure of lutein emulsions stabilized by multilayer membranes consisting of whey protein isolate, flaxseed gum and chitosan[J].Food Chemistry, 2016, 202:156-164.
[10] ABDULLAH, WEISS J, ZHANG H.Recent advances in the composition, extraction and food applications of plant-derived oleosomes[J].Trends in Food Science &Technology, 2020, 106:322-332.
[11] NANTIYAKUL N, FURSE S, FISK I, et al.Phytochemical composition of Oryza sativa (rice) bran oil bodies in crude and purified isolates[J].Journal of the American Oil Chemists’ Society, 2012, 89(10):1867-1872.
[12] SUN Y F, ZHONG M M, WU L C, et al.Loading natural emulsions with nutraceuticals by ultrasonication:Formation and digestion properties of curcumin-loaded soybean oil bodies[J].Food Hydrocolloids, 2022, 124:107292.
[13] HAO J, XU J Z, ZHANG W G, et al.The improvement of the physicochemical properties and bioaccessibility of lutein microparticles by electrostatic complexation[J].Food Hydrocolloids, 2022,125:107381.
[14] LI J L, SHIN G H, LEE I W, et al.Soluble starch formulated nanocomposite increases water solubility and stability of curcumin[J].Food Hydrocolloids, 2016, 56:41-49.
[15] 曾庆晗, 马培华, 邰克东, 等.油相浓度对姜黄素纳米乳液稳定性的影响[J].食品工业科技, 2017, 38(22):17-21.
ZENG Q H, MA P H, TAI K D, et al.Effect of oil phase concentration on the stability of curcumin nanoemulsion[J].Science and Technology of Food Industry, 2017, 38(22):17-21.
[16] 王成祥, 刘辉, 段胜林, 等.应用快速稳定性分析方法研究增稠剂对燕麦饮料稳定性的影响[J].食品与发酵工业, 2018, 44(3):253-259.
WANG C X, LIU H, DUAN S L, et al.Research on the effect of thickening on the stability of oat beverage using rapid stability analysis instrument[J].Food and Fermentation Industries, 2018, 44(3):253-259.
[17] NAKAUMA M, FUNAMI T, NODA S, et al.Comparison of sugar beet pectin, soybean soluble polysaccharide, and gum Arabic as food emulsifiers.1.Effect of concentration, pH, and salts on the emulsifying properties[J].Food Hydrocolloids, 2008, 22(7):1254-1267.
[18] 瓦文强, 秦娟娟, 杨敏, 等.酪蛋白胶束乳液凝胶性质及其在大黄素负载中的应用[J].食品与发酵工业, 2023, 49(1):132-139.
WA W Q, QIN J J, YANG M, et al.Properties of emulsion gel based on casein micelles and its application in emodin loading[J].Food and Fermentation Industries, 2023, 49(1):132-139.
[19] L PEZ-MONTERRUBIO D I, LOBATO-CALLEROS C, VERNON-CARTER E J, et al.Influence of β-carotene concentration on the physicochemical properties, degradation and antioxidant activity of nanoemulsions stabilized by whey protein hydrolyzate-pectin soluble complexes[J].LWT, 2021, 143:111148.
PEZ-MONTERRUBIO D I, LOBATO-CALLEROS C, VERNON-CARTER E J, et al.Influence of β-carotene concentration on the physicochemical properties, degradation and antioxidant activity of nanoemulsions stabilized by whey protein hydrolyzate-pectin soluble complexes[J].LWT, 2021, 143:111148.
[20] CHEVALIER R C, GOMES A, CUNHA R L.Role of aqueous phase composition and hydrophilic emulsifier type on the stability of W/O/W emulsions[J].Food Research International, 2022, 156:111123.
[21] YU X X, ZHAO Y J, SUN M, et al.Effects of egg yolk lecithin/milk fat globule membrane material ratio on the structure and stability of oil-in-water emulsions[J].LWT, 2022,168:113891.
[22] 刘杰, 邓利玲, 曾云军, 等.糖基化改性对明胶乳化性和抗氧化活性的影响[J].食品与发酵工业, 2023, 49(19):175-182.
LIU J, DENG L L, ZENG Y J, et al.Effects of glycosylation modification on emulsifying property and antioxidant activity of gelatin[J].Food and Fermentation Industries, 2023, 49(19):175-182.
[23] LIU G, WANG Q, HU Z Z, et al.Maillard-reacted whey protein isolates and epigallocatechin gallate complex enhance the thermal stability of the Pickering emulsion delivery of curcumin[J].Journal of Agricultural and Food Chemistry, 2019, 67(18):5212-5220.
[24] 李文婧. 醇溶蛋白/原花青素/果胶复合纳米颗粒稳定Pickering乳液的制备及其负载姜黄素的研究[D].泰安:山东农业大学, 2022.
LI W J.Pickering emulsions stabilized by zein-proanthocyanidins-pectin composites and its application for curcumin loading[D].Tai’an:Shandong Agricultural University, 2022.
[25] GONG T, CHEN B, HU C Y, et al.Resveratrol inhibits lipid and protein co-oxidation in sodium caseinate-walnut oil emulsions by reinforcing oil-water interface[J].Food Research International, 2022, 158:111541.